-
植物病原真菌炭疽菌属(Colletotrichum spp.)宿主种类广,分布范围大,属于一种全球性分布的病原真菌[1]。橡胶树胶孢炭疽菌(C. gloeosporioides)能够侵染我国重要热带经济作物橡胶树,是橡胶树主要经济病害之一,严重病害会导致橡胶产量减少和品质降低[2, 3]。鉴定并挖掘与胶胞炭疽菌致病性相关的基因、研究其功能并在分子层面阐明其调控机制与靶点,可以为靶向杀菌研究措施提供新的理论基础。
羧肽酶(Carboxypeptidase,CPs)是一种具有特定性与专一性的蛋白外切酶,能够从多肽链C端逐个将氨基酸水解并分离。羧肽酶在动、植物中分布广泛,发挥着非常重要的生理调控作用[4]。羧肽酶根据其来源可分为动物羧肽酶、植物羧肽酶以及微生物羧肽酶三种[5]。动物体内羧肽酶种类较多,通常包含羧肽酶A(Carboxypeptidase A,CPA)与羧肽酶B(Carboxypeptidase B,CPB),作为消化酶起到消化食物的作用[6]。植物与真菌中均存在活性中心为丝氨酸残基的丝氨酸羧肽酶(Serine Carboxypeptidase,SCP),据报道,水稻(Oryza sativa L.)中植物源丝氨酸羧肽酶SCP46是籽粒灌浆与种子萌发的关键调节因子[7]。羧肽酶Y(Carboxypeptidase Y,CPY)是一种微生物源丝氨酸羧肽酶,主要来源于酿酒酵母(Saccharomyces cerevisiae)。在酵母菌株内CPY参与外源蛋白水解调控,为酵母细胞代谢提供氮源[8, 9]。此外,CPY也被广泛应用于多肽氨基酸序列的测定[10]。在酿酒酵母中,羧肽酶Y抑制子(Carboxypeptidase Y Inhibitor,CPI)可以特异性地抑制酵母体内的羧肽酶Y的生理活性,保护蛋白质免受CPY的水解作用[11]。羧肽酶Y抑制子属于磷脂酰乙醇胺结合蛋白(Phosphatidylethanolamine-binding protein,PEBP)家族[12]。通过蛋白质序列比对,本研究团队发现在橡胶树胶孢炭疽菌中存在一个编码PEB蛋白的基因,将其命名为CgPEB。至今为止,尚未见到有关CgPEB在胶孢炭疽菌中功能研究的相关报道。本研究通过构建CgPEB基因缺失突变株并对其生理表型以及致病能力进行了分析,初步阐明了CgPEB在橡胶树胶孢炭疽菌中的功能。
-
本研究所用的橡胶树胶孢炭疽菌野生型菌株(C. gloeosporioides Wild Type,CgWT)由本实验室分离、鉴定与保存。该菌株的基因组测序数据与数据的总结和建库已由本实验室完成。
实验中所用到的PCR引物由擎科生物公司和睿博兴科公司共同完成(表1)。DNA测序工作由擎科生物公司和铂尚生物公司共同完成。大肠杆菌感受态细胞TOP10购于上海吐露港生物科技有限公司。pEASY-blunt载体购于山东思科捷公司。pBS-SUR由本实验室改造。其他化学试剂采用国产分析纯。
表 1 本实验所用引物
Table 1. Primers used in the present experiment
引物名称Primer 序列(5′-3′)Sequence 用途Usage CgPEB-5F AAGGCAGGGTGGGACAT 同源臂扩增Homologous arm amplification CgPEB-5R TTTGATGCTGTTTCGACG 同源臂扩增Homologous arm amplification CgPEB-MF1 CGTCGAAACAGCATCAAAGTGCCAACGCCACAGTG 同源臂扩增Homologous arm amplification CgPEB-MR1 CACTGTGGCGTTGGCACTTTGATGCTGTTTCGACG 同源臂扩增Homologous arm amplification CgPEB-MF2 GAATTGCATGCTCTCACTTGTCGACCATTCATATT 同源臂扩增Homologous arm amplification CgPEB-MR2 AATATGAATGGTCGACAAGTGAGAGCATGCAATTC 同源臂扩增Homologous arm amplification CgPEB-3F TTGTCGACCATTCATATT 同源臂扩增Homologous arm amplification CgPEB-3R GATCGTGATTCGCTGTT 同源臂扩增Homologous arm amplification Sur-SLR ATGTTGGCATAAGCCGAACCGT 同源臂扩增Homologous arm amplification Sur-SLF CCTCTGATATTGGAAGCGACGC 同源臂扩增Homologous arm amplification CgPEB-JC5F AATGTTCTTTGCCCGACTTGT 突变株鉴定 Mutant Strain Identification CgPEB-JC3R TCGGCTTCATTCCATATTCATT 突变株鉴定 Mutant Strain Identification CgPEB-JCOF ATGGCGGGCCGAATTGTAG 突变株鉴定 Mutant Strain Identification CgPEB-JCOR CTGCTTTTCGTTCTGGGCA 突变株鉴定 Mutant Strain Identification SUR-JC5R GCGTTTGTAACTCTGCCTGTTTG 突变株鉴定 Mutant Strain Identification SUR-JC3F ACGAGGACCGCTACTCACATAC 突变株鉴定 Mutant Strain Identification CgPEB-OF(XbaⅠ) TCTAGAATTCTACTGCTTGTGCCTTGA 同源臂扩增Homologous arm amplification CgPEB-OR(BamHⅠ) GGATCCCTACTGCTTTTCGTTCTGG 同源臂扩增Homologous arm amplification CgActin-qF GATTGGTATGGGCCAGAAGG 相对表达量检测
Relative expression level detectionCgActin-qR GGAGCTCGTTGTAGAAGGTG 相对表达量检测
Relative expression level detectionCRY-QF CGTCCTCATCTACGCTGGTG 相对表达量检测
Relative expression level detectionCRY-QR TTGACCTTGCCGTATTCCTC 相对表达量检测
Relative expression level detection -
本研究使用以同源重组原理为基础的Split-Marker基因敲除技术进行胶胞炭疽菌CgPEB基因敲除突变体的构建:首先以野生型基因组为模板,对CgPEB基因上、下游同源臂进行扩增。其次,将氯嘧磺隆抗性基因(Sulfonylurea resistance gene,SUR)分为上下两部分扩增,利用融合引物将同源臂与抗性基因片段进行融合以得到敲除转化片段。橡胶树胶孢炭疽菌原生质体的制备与转化方法参照郭云峰等[13]的实验体系。将通过1%ME液体培养基(Malt extract,ME)培养的胶胞炭疽菌野生型菌丝放入融壁酶与R10融壁酶的混合溶液中,28 ℃,110 r·min−1酶解4 h后得到原生质体,随后通过PEG4000介导法将片段转入原生质体。此后,将原生质体转化溶液均匀分布于培养皿底部,再倒入不含筛选抗性的由酵母提取物(Yeast extract)、酸水解酪蛋白(Casamino acid)以及蔗糖(Sucrose)混合配制的固体培养基YCS。吹干倒置培育12 h后,倒入含有100 μg·mL−1氯嘧磺隆(Chlorsulfuron)的YCS固体培养基进行筛选培养。待筛选培养基表面生长出单菌落转化子时,将转化子接入马铃薯葡萄糖琼脂培养基(Potato dextrose agar,PDA)进行培养检测。互补株的构建以基因敲除突变体为受体菌株,将具有自身启动子以及完整阅读框的线性化互补载体pGPDA-CgPEB通过原生质体转化转入基因缺失突变体中,使用浓度为250 μg·mL−1的潮霉素(Hygromycin B)进行互补转化子的筛选。
-
首先,提取转化子基因组进行鉴定,以野生型基因组模板为阴性对照,利用上、下游同源臂外侧以及抗性基因片段内部的检测引物CgPEB-JC5F/Sur-JC5R与Sur-JC3F/CgPEB-JC3R进行检测。将检测结果为阳性的转化子进行单孢纯合。通过上下游检测引物与基因检测引物CgPEB-JCOF/CgPEB-JCOR进行鉴定。互补菌株则以野生型基因组为阳性对照,通过基因检测引物CgPEB-JCOF/CgPEB-JCOR验证CgPEB的回补情况(表1)。
-
将CgWT、ΔCgpeb以及Res-ΔCgpeb切取相同大小的圆形菌块接种于PDA固体培养基中心,在28 ℃培养箱中倒置培养5 d后进行菌落直径的测量与拍照记录,统计比较各菌株的生长速率差异。同样将相同大小的菌块接种于含有不同药剂的基本固体培养基(Minimal medium,MM),药剂种类与处理分析参照梁琳悦等[14]的实验方法。28 ℃培养箱倒置培养5 d后使用十字交叉法测量菌落直径,拍照记录,并计算不同药剂对各菌株生长的抑制率。
-
将培养5 d的CgWT、ΔCgpeb以及Res-ΔCgpeb菌株沿边缘切碎置于30 mL液体完全培养基(Complete medium,CM)中培养2 d,将培养好的菌液通过神奇滤膜过滤得到孢子液。利用血球计数板统计孢子数量并计算孢子浓度,用无菌水将孢子液稀释至1×104 个·mL−1,然后吸取100 μL孢子液置于含有千分之一卡那霉素(Kanamycin,Kana)以及羧苄青霉素(Carbenicillin,Car)的30 mL CM液体培养基中,28 ℃培养3 d后过滤并计算孢子浓度。
-
制备致病力分析所用菌株孢子样品参考1.4.2的方法。得到孢子后,用0.5%ME液体培养基稀释孢子浓度至5×105 个·mL−1。选择淡绿叶期的橡胶树叶片以及成熟的苹果作为接种材料,每次接种5 μL菌液于预刺伤处理的橡胶树叶片以及打孔器打孔的苹果中,28 ℃保湿条件下培养。随后,测量统计接种2 d后的橡胶树叶片病斑和5 d后的苹果病斑大小。
-
用YCS液体培养基将培养2 d的CgWT、ΔCgpeb以及Res-ΔCgpeb的孢子液稀释至5×105 个·mL−1。将稀释好的孢子悬浮液用移液枪滴至干净的玻璃载玻片上进行培养,每滴悬浮液体积为15 μL。28 ℃培养2 h与3 h,用显微镜观察并拍照记录。
-
野生型、突变体以及互补株孢子样品的制备参考1.4.2。将孢子液移入1.5 mL离心管中,
5000 r·min−1离心1.5 min,弃上清液。再使用无菌水将孢子洗涤并离心收集,重复2 次,充分洗净孢子表面培养基,减少孢子营养生长。将洗涤后的孢子用无菌水稀释至4×105个·mL−1并接种于疏水表面,每滴菌液的体积为5 μL。接种完成后保湿培养12 h与24 h,用显微镜对不同菌株附着胞的形成情况进行观察与拍照记录。 -
无菌水孢子稀释液的制备同1.6.2。接种载体选取新鲜的洋葱,用手术刀切取洋葱内表皮,将洋葱内表皮疏水面向上贴于含有0.05 g·mL−1 NaCl的1.5%固体水琼脂表面。将25 μL稀释好的孢子液分5滴均匀分散接种于洋葱内表皮疏水面。将样品置于28 ℃恒温培养箱,保湿培养12 h与24 h,观察并记录统计入侵菌丝形成情况。
-
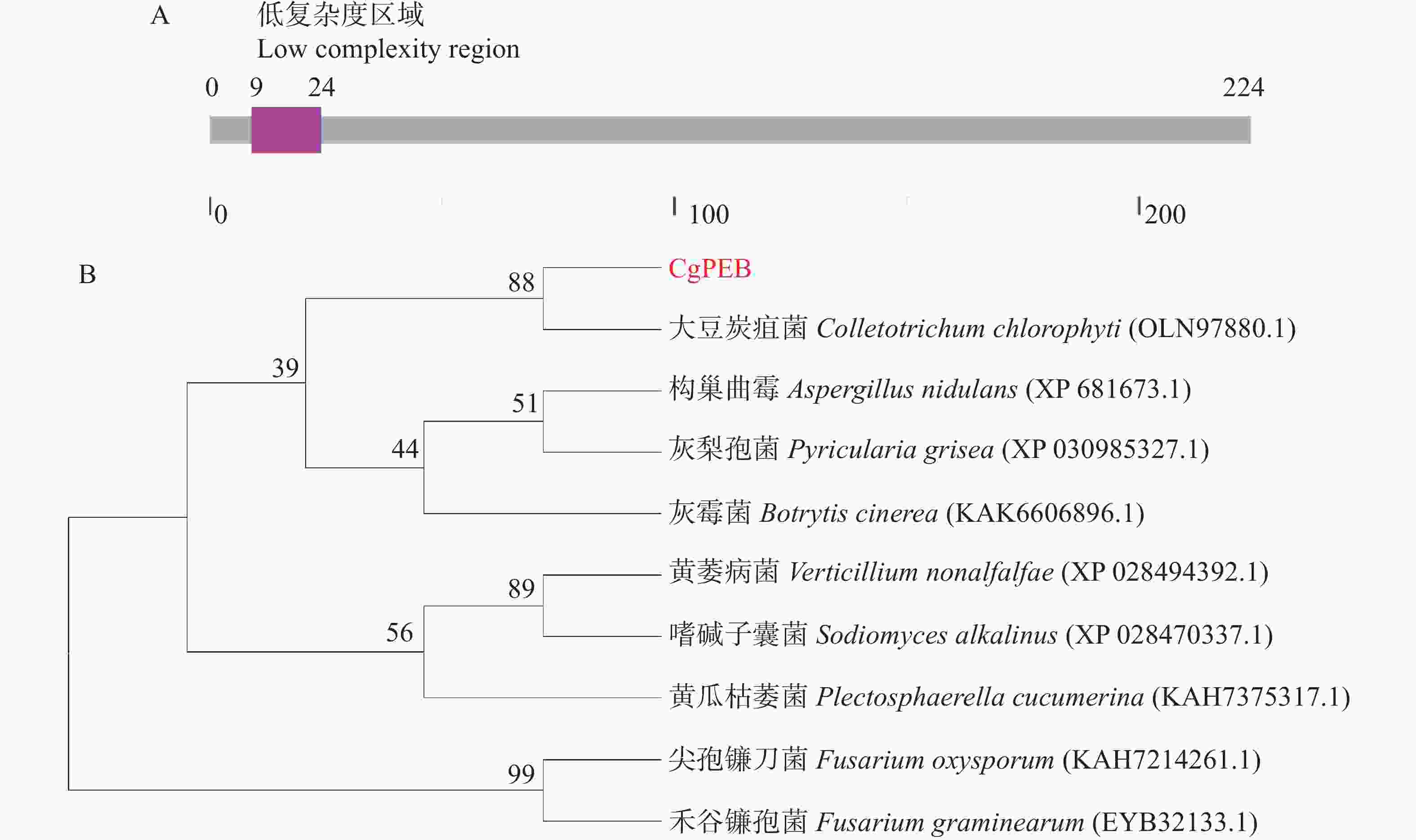
胶胞炭疽菌CgPEB的基因序列包含一个长度为788bp的开放阅读框(Open reading frame,ORF)。其中包含两个内含子,编码区(Coding sequence,CDS)总长为675 bp,编码一个具有224个氨基酸,分子量为23.89 kDa的羧肽酶Y抑制蛋白。通过SMART结构域预测分析发现,CgPEB蛋白并无已知的保守结构域(图1−A)。但是通过NCBI进行进一步序列比对分析,发现在大豆炭疽菌(C. chlorophyte)、构巢曲霉(Aspergillus nidulans)、灰梨孢菌(Pyricularia grisea)、黄瓜枯萎菌(Plectosphaerella cucumerina)、尖孢镰刀菌(Fusarium oxysporum)和禾谷镰孢菌(F. graminearum)等真菌中均存在CgPEB的同源蛋白(图1−B),且同源性较高,说明CgPEB在植物病原真菌中保守。
-
本研究通过同源重组的原理利用Split-Marker基因敲除技术对胶孢炭疽菌CgPEB基因进行敲除(图2−A)。将通过上、下游检测得到的阳性转化子进行单孢分离后,提取转化子基因组进行进一步的检测。通过上、下游同源臂检测,单胞分离后的转化子检测条带与目标条带大小一致(上游
1641 bp;下游1416 bp)。再通过基因检测进行进一步的鉴定,转化子均未检测出基因条带(图2−B),检测结果表明CgPEB基因敲除突变体构建成功,并将成功构建的突变体命名为ΔCgpeb。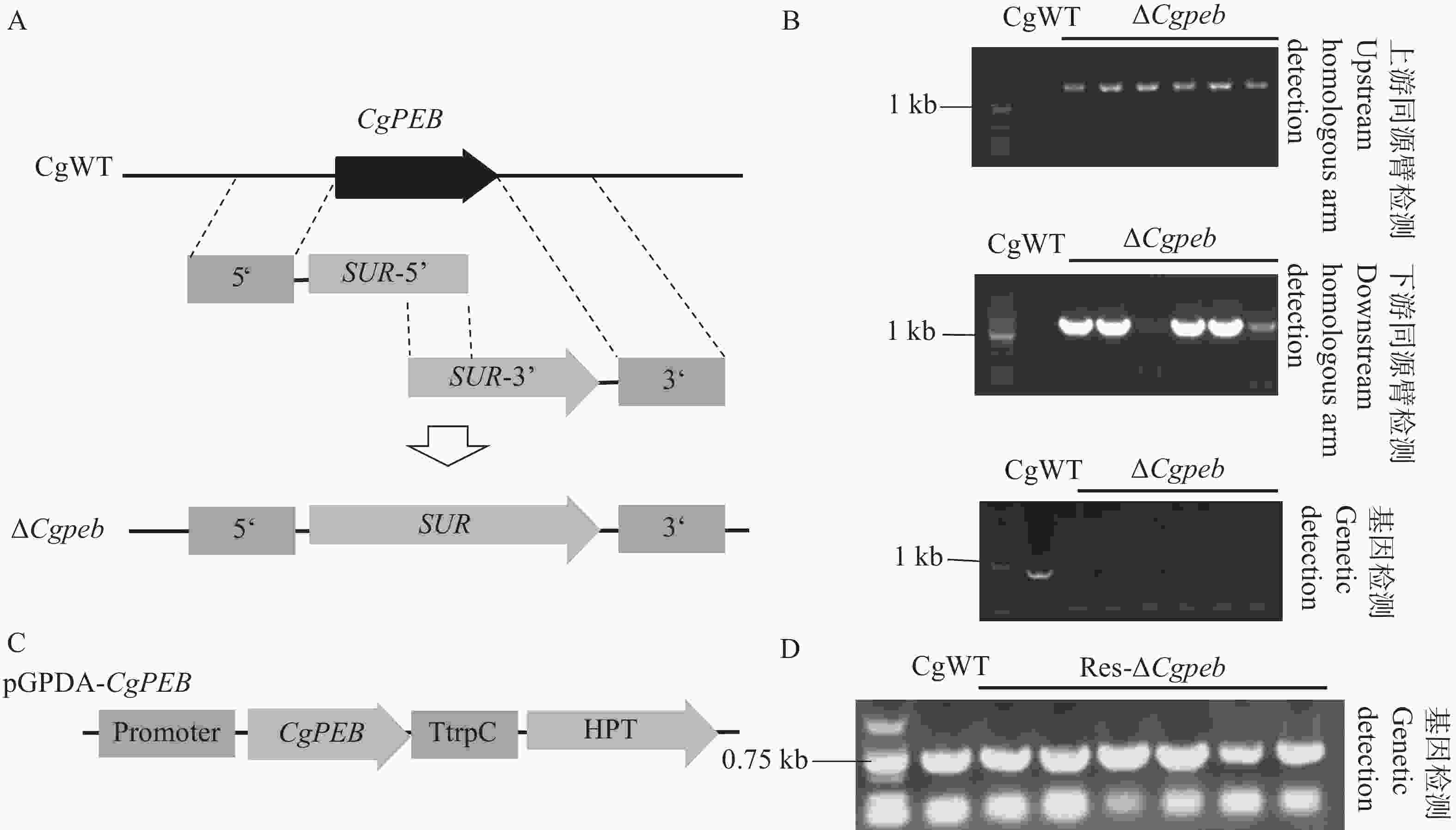
图 2 Split-Marker基因敲除原理以及基因敲除突变体与互补株的鉴定
Figure 2. Principle of Split-Marker gene knockout and identification of knockout mutants and complemented strains
接着,通过构建具有包含一段自身启动子和CgPEB完整表达框的载体pGPDA-CgPEB,将线性化的载体通过原生质体转化的方式对基因敲除突变体ΔCgpeb进行基因回补(图2−C)。使用基因检测引物CgPEB-OF/PEB-OR对互补转化子进行鉴定,以野生型基因组模板为阳性对照,凝胶电泳结果表明(图2−D),互补转化子基因组检测出目标基因CgPEB条带(781 bp),表明互补株构建成功,并将其命名为Res-ΔCgpeb。
-
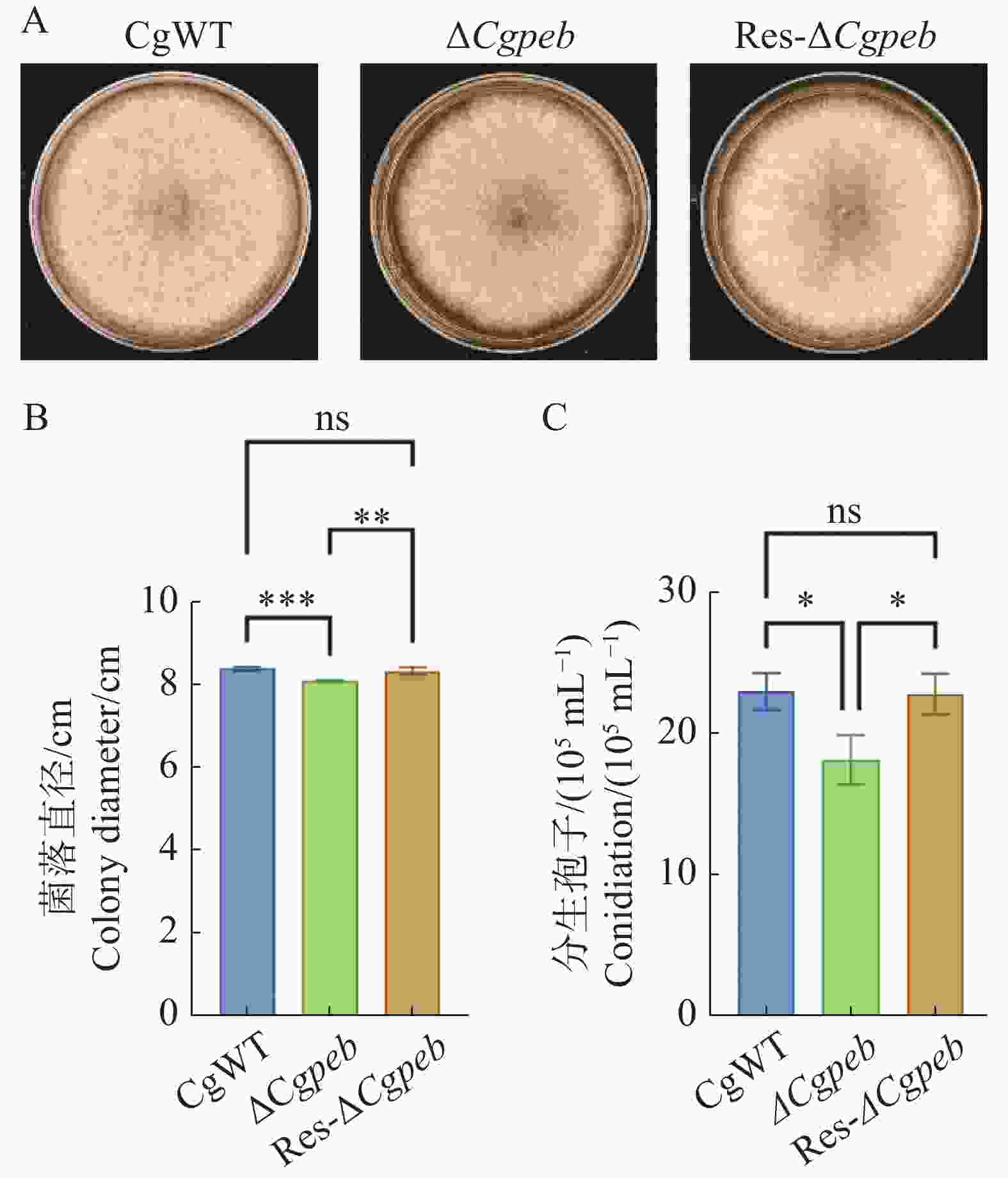
为了探究CgPEB在胶孢炭疽菌生长表型方面的作用,对ΔCgpeb生长表型进行了观察。在生长至5 d时CgWT和Res-ΔCgpeb的菌株平均直径均为8.4 cm,而ΔCgpeb菌株直径为8.0 cm(图3−A、B),结果表明突变株菌落生长速率显著低于野生型与互补株。此外,通过统计产孢量发现(图3−C),在转入相同数量的孢子后28 ℃培养3 d,CgWT的孢子产量为22.5×105 个·mL−1,Res-ΔCgpeb的孢子产量为21×105 个·mL−1。而与野生型相比,ΔCgpeb的孢子产量下降了18%,为18.5×105 个·mL−1。以上结果表明CgPEB基因参与对橡胶树胶孢炭疽菌的营养生长以及产孢的调控。
-
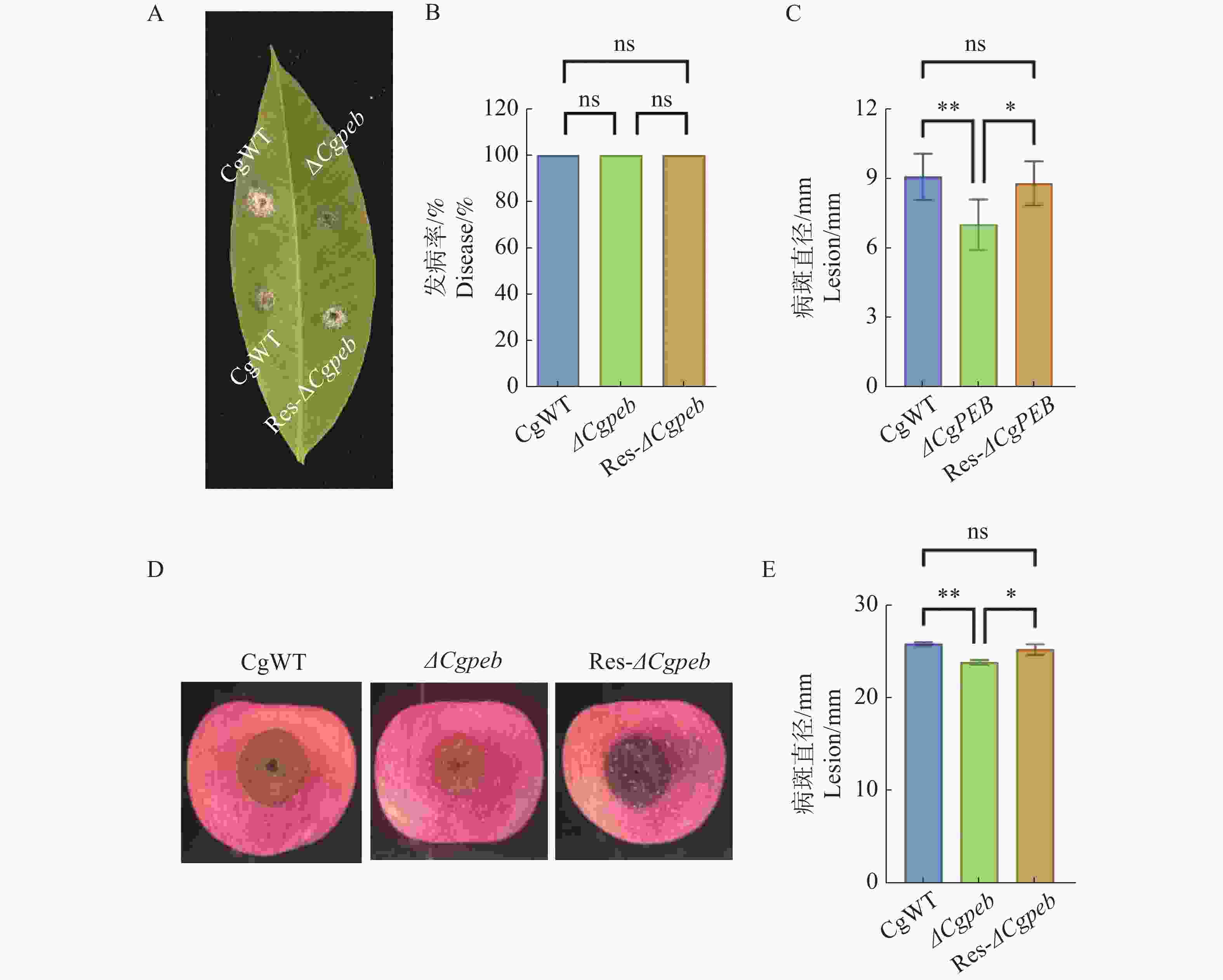
橡胶树胶孢炭疽菌可以侵染橡胶树叶片以及各种果类植物,因此本研究团队对不同菌株对橡胶树叶片和苹果进行了致病力的分析。结果表明将CgWT、ΔCgpeb和Res-ΔCgpeb接种于预刺伤处理淡绿期橡胶树叶片2 d后,3种菌株的发病率一致。但从叶片病斑大小来看,CgWT病斑大小平均为9 mm,Res-ΔCgpeb平均病斑大小为8.7 mm,而ΔCgpeb平均病斑大小为7.7 mm(图4−A、B、C)。而接种苹果5 d后,CgWT和Res-ΔCgpeb病斑大小平均为25.8 mm和25.2 mm,而ΔCgpeb平均病斑大小为23.7 mm(图4−D、E),这说明CgPEB基因的缺失导致胶胞炭疽菌对橡胶树叶片和苹果的致病力显著降低。以上结果说明CgPEB参与了橡胶树胶孢炭疽菌对寄主植物致病力的调控。
-
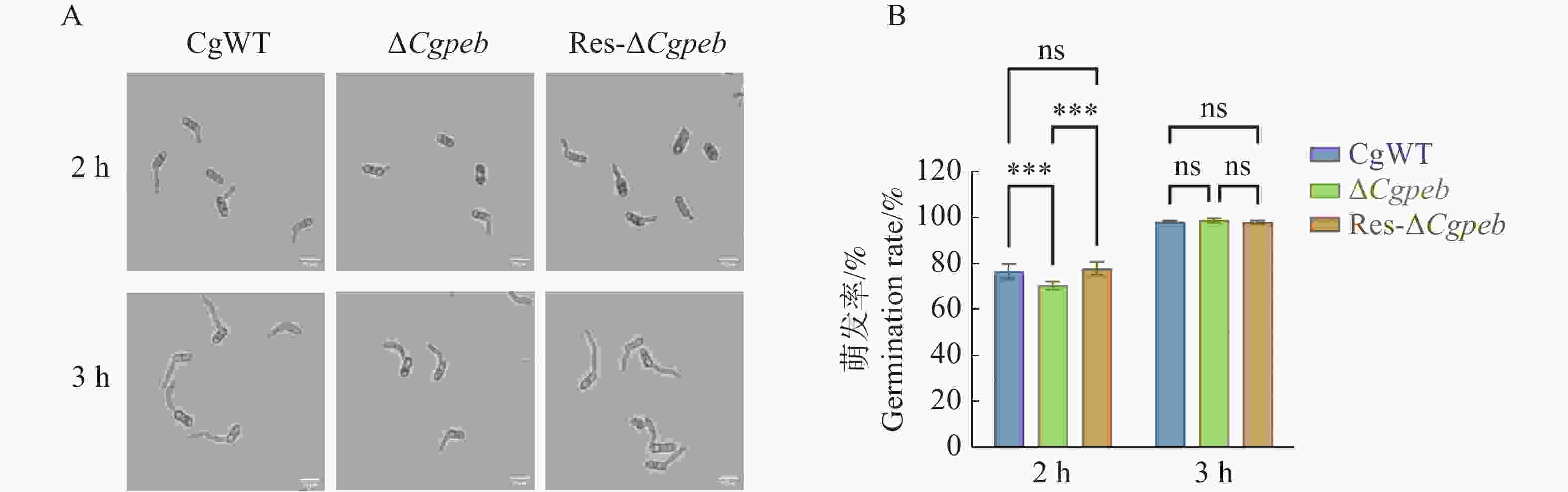
通过2%YCS培养基培养菌株孢子。2 h后CgWT和Res-ΔCgpeb的孢子萌发率分别为76.8%和77.9%,而ΔCgpeb的孢子萌发率为70.5%。在培育3 h后CgWT、ΔCgpeb和Res-ΔCgpeb的孢子萌发率均约为98%(图5−A、B)。以上结果表明,Cgpeb基因的缺失对胶胞炭疽菌孢子的萌发有一定的延缓作用。
-
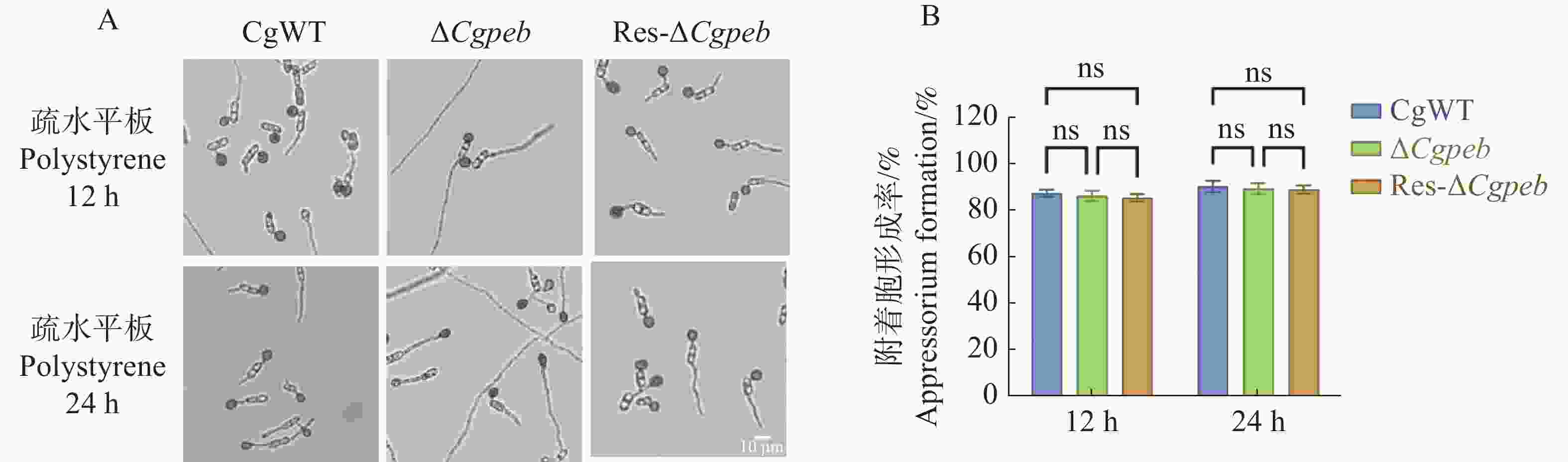
将孢子液滴接种于疏水表面进行诱导培养。在培养12 h后,CgWT和ΔCgpeb附着胞形成率为87%,Res-ΔCgpeb附着胞形成率为85%,而在培养24 h后CgWT、ΔCgpeb和Res-ΔCgpeb附着胞形成率均约为90%。说明CgPEB不参与调控胶胞炭疽菌附着胞的形成(图6−A、B)。
-
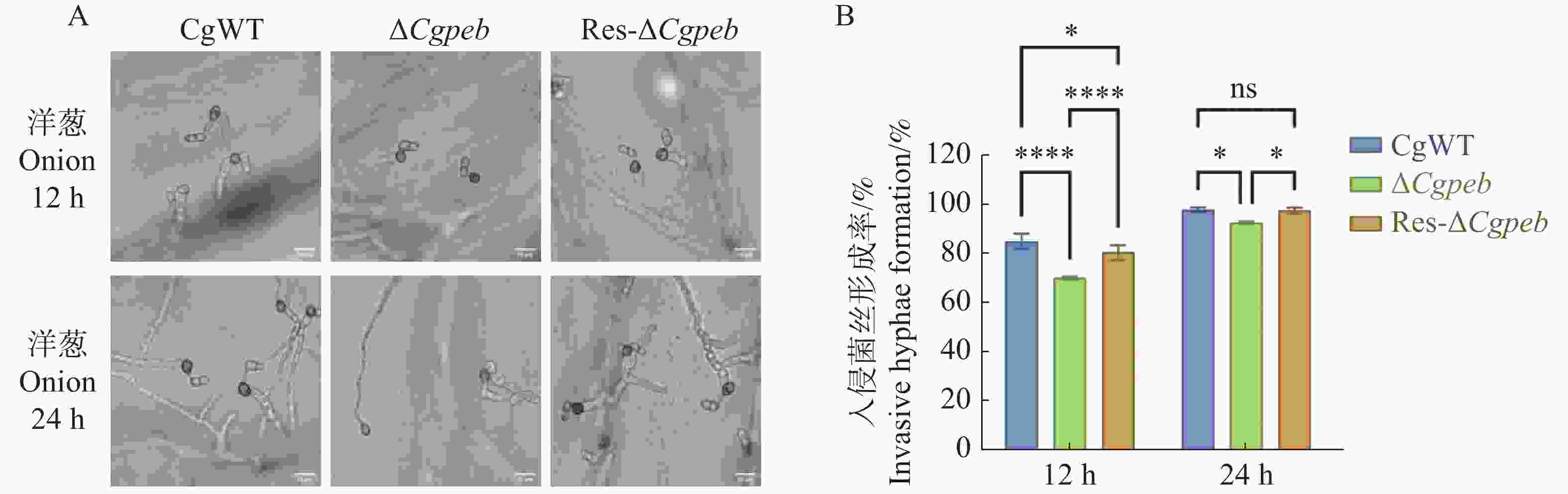
将4×105个/mL的CgWT、ΔCgpeb和Res-ΔCgpeb的孢子悬浮液滴于洋葱内表皮疏水表面进行保湿恒温28 ℃培养。12 h后通过显微镜观察统计,CgWT和Res-ΔCgpeb入侵菌丝形成率分别为85%和80%,而ΔCgpeb入侵菌丝形成率为70%,显著降低。在培养24 h后CgWT入侵菌丝形成率为97%,Res-ΔCgpeb入侵菌丝形成率为95%,而ΔCgpeb入侵菌丝形成率为93%,ΔCgpeb入侵菌丝形成率仍然低于CgWT和Res-ΔCgpeb(图7−A、B)。以上结果表明,CgPEB参与调控胶胞炭疽菌对寄主细胞的入侵。
-
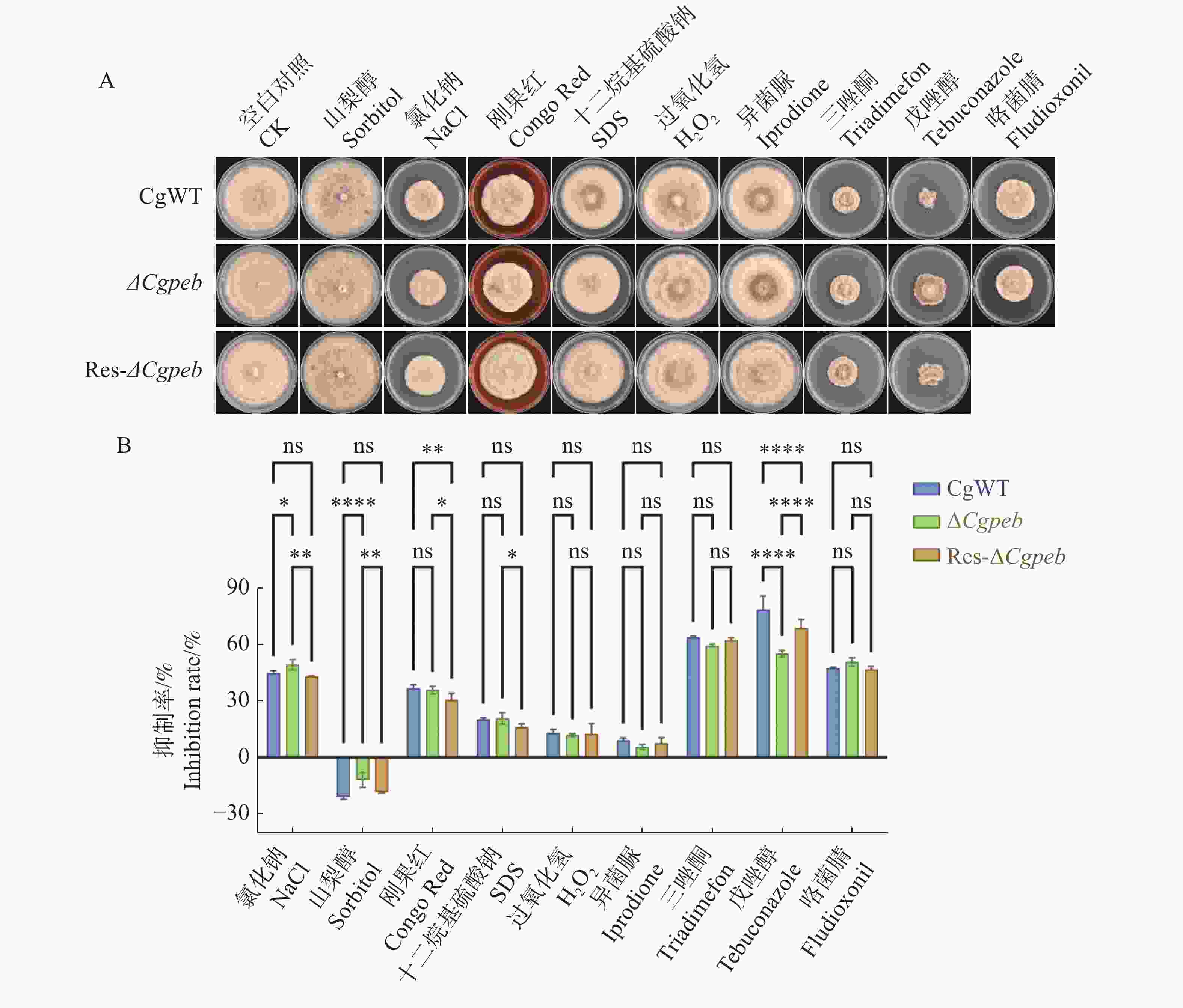
将CgWT、ΔCgpeb和Res-ΔCgpeb接种于含有氯化钠(0.7 mol/L)、异菌脲(10 mg/L)、三唑酮(20 mg/L)、山梨醇(1 mol/L)、刚果红(0.25 mg/L)、戊唑醇(0.2 mg/L)、十二烷基硫酸钠(0.1 mg/L)、咯菌腈(0.05 mg/L)和过氧化氢(30 mmol/L)的MM基础固体培养基中(图8−A)。28 ℃恒温培养10 d后,ΔCgpeb在含有氯化钠的MM培养基上的抑制率显著高于CgWT和Res-ΔCgpeb。而在三唑酮以及戊唑醇对于ΔCgpeb的抑制率则显著低于CgWT和Res-ΔCgpeb(图8−B)。以上结果表明,CgPEB参与调控胶胞炭疽菌对逆境胁迫的响应。
-
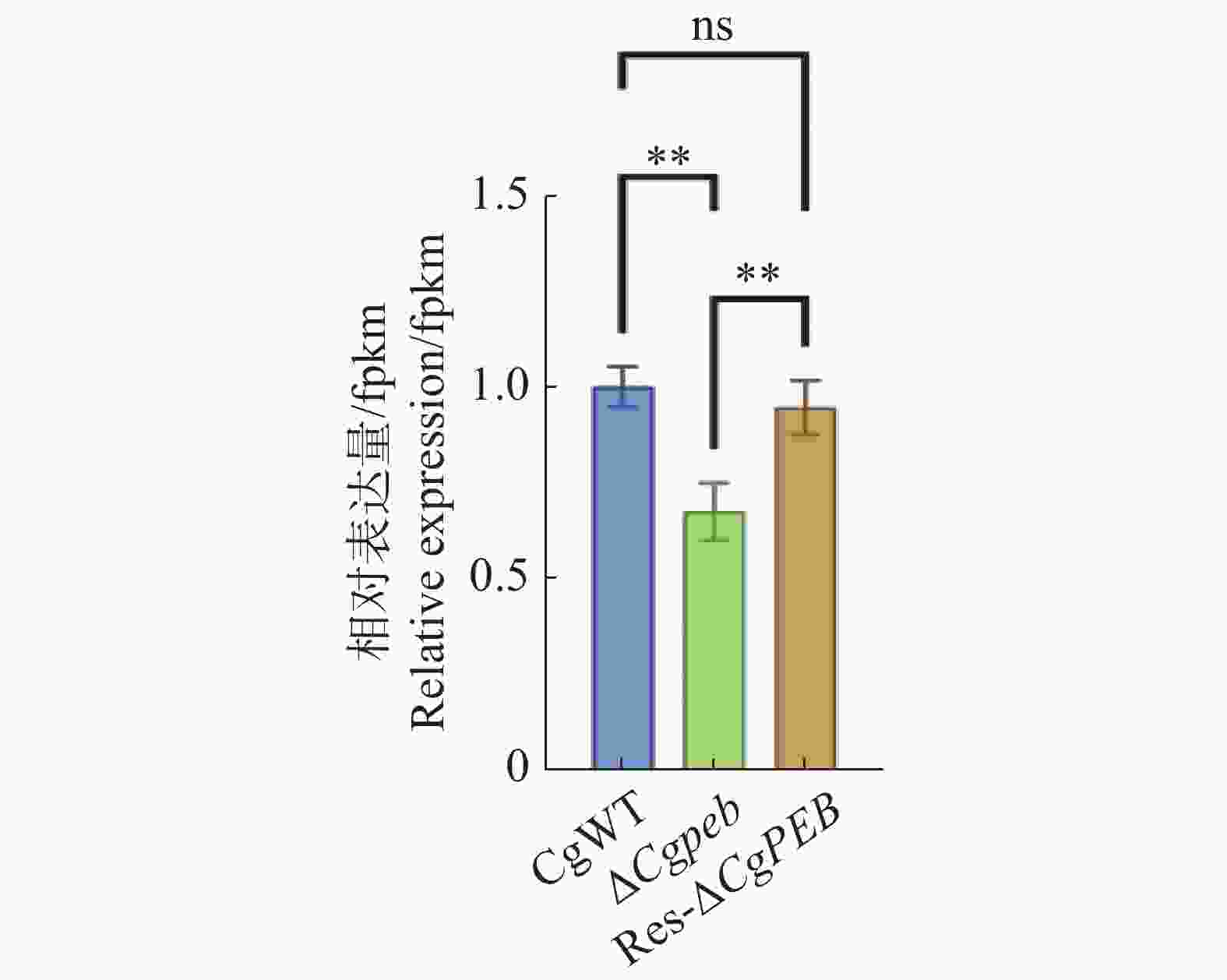
为了初步验证CgPEB的缺失是否影响羧肽酶Y相关基因的表达,通过实时荧光定量PCR(Quantitative Real-time polymerase chain reaction,qRT-PCR)检测并计算胶孢炭疽菌羧肽酶Y的关键合成基因CgCRY在不同菌株中相对表达量的差异。实验结果表明,在敲除CgPEB后,CgCRY的表达量显著降低,CgPEB的回补有效恢复了CgCRY的表达(图9)。
-
蛋白酶(Protease)是一类广泛存在于动、植物以及微生物体内的水解酶,能够参与蛋白质的分解与加工,维持生物体蛋白质的稳态[15]。蛋白酶抑制剂(Protease inhibitor)则是一类能够特异性或非特异性抑制蛋白酶活性的物质[16]。蛋白酶与蛋白酶抑制剂的相互作用普遍存在于生物体中,参与调控病原菌生长、繁殖以及致病力等生理表型[17]。番茄叶酶病菌(Cladosporium fulvum)在侵染寄主植物时能够分泌毒力因子蛋白酶抑制剂Avr2,Avr2能够特异性地抑制植物基础免疫系统关键蛋白酶Cys[18]。在金黄色葡萄球菌(Staphylococcus aureus)中,内源性半胱氨酸蛋白酶抑制剂可以调节细胞毒力相关蛋白酶的活性,防止蛋白酶活性过高而导致蛋白质过度水解[19]。胶孢炭疽菌CgPEB能够编码一种羧肽酶Y抑制蛋白,但未见其生物学功能的研究报道。在米曲酶(A. oryzae)中,丝氨酸羧肽酶KexA是菌株正常生长所必需的关键因素,KexA的异常会导致菌株分生孢子形成的延迟[20]。为了探究羧肽酶Y抑制剂CgPEB在胶孢炭疽菌生理表型中的调控作用机制,本实验通过构建CgPEB基因敲除突变株和互补株分析其表型差异。实验结果表明CgPEB的缺失导致胶孢炭疽菌菌株生长速率变缓,分生孢子产量降低,说明CgPEB参与橡胶树胶孢炭疽菌的生长表型调控。因此本研究团队推测,CgPEB可能通过调控胶孢内羧肽酶Y的活性,防止羧肽酶Y的过度活化而间接调控菌株孢子的形成。在禾谷镰孢菌(F. graminearum)中,丝氨酸羧肽酶FgSCP基因的缺失会导致禾谷镰刀菌的致病力降低。且FgSCP作为一种重要的效应蛋白在禾谷镰刀菌的生长、毒力、次生代谢以及宿主入侵中起到了关键的作用[21]。在棕榈疫霉菌(Phytophthora palmivora)中,半胱氨酸蛋白酶抑制剂PpalEPICs通过抑制木瓜蛋白酶(Papain)活性以侵染木瓜的茎、叶以及果实[22]。为了进一步探究CgPEB对于橡胶树胶孢炭疽菌致病力的调控作用,本研究团队通过接种预刺伤处理的淡绿期橡胶树叶片以及苹果发现,CgPEB的缺失会导致胶胞炭疽菌的致病力减弱,说明羧肽酶Y抑制子CgPEB确实参与调控橡胶树胶孢炭疽菌的致病力。孢子在寄主表面的顺利萌发、附着胞结构的形成和入侵菌丝的成功侵入对于胶胞炭疽菌对植物寄主的致病过程都至关重要[23],为了进一步探究CgPEB对于橡胶树胶孢炭疽菌的致病力调控机制,本研究以橡胶树胶孢炭疽菌侵染发展的不同阶段为依据,进行了突变体萌发率、附着胞形成率以及入侵菌丝形成率的观察研究,发现CgPEB基因缺失突变体在萌发早期萌发率降低,不影响附着胞的形成但会造成入侵菌丝的形成率降低,说明CgPEB主要参与橡胶树胶孢炭疽菌入侵菌丝的形成调控。因此本研究团队推测,CgPEB通过抑制寄主植物基础防御系统分泌的蛋白酶活性来调控胶孢炭疽菌的致病力,但其靶标蛋白以及调控机制有待进一步深入验证。
羧肽酶是一类能够从多肽链羧基端逐个水解并分离氨基酸的蛋白酶。羧肽酶Y是一种具有丝氨酸残基活性中心的微生物源丝氨酸羧肽酶,广泛存在于真菌等微生物中。目前,有关羧肽酶抑制剂的研究多集中于植物中,且其功能多与植物应对逆境胁迫相关。研究表明马铃薯羧肽酶抑制子(Potato carboxypeptidase inhibitor,PCI)作为异源蛋白在水稻中表达时,能够参与水稻对真菌病原菌的抗病过程[24]。据报道,在枸杞(Lycium barbarum)中鉴定出了一种有效的羧肽酶抑制子β-lybatide,β-lybatide有助于维持枸杞的生物活性[25]。在茄科(Solanaceae)植物中,羧肽酶抑制子具有较强的抗菌活性[26]。在真菌酿酒酵母(S. cerevisiae)中,羧肽酶Y抑制子可以特异性的抑制酵母体内的羧肽酶Y的生理活性,达到保护蛋白质免受羧肽酶Y水解的作用。此外,羧肽酶Y抑制子通过调控羧肽酶的活性参与酵母体内蛋白质的修饰调控,从而影响酵母的生长发育[27]。据上述研究表明,羧肽酶抑制子通过与羧肽酶进行特异性竞争结合来调节生物体内羧肽酶活性,通过控制羧肽酶Y水解蛋白质效率维持细胞内蛋白质平衡,进而维持细胞稳态。本研究通过序列比对分析鉴定到了胶孢炭疽菌中与酿酒酵母羧肽酶Y关键合成基因PRC1的同源基因CgCRY,并且通过qRT-PCR检测CgPEB的缺失对于CgCRY表达量的影响。结果表明,ΔCgpeb中CgCRY的相对表达量显著下调,基因的回补可以有效恢复CgCRY的表达。因此本研究团队推测,CgPEB作为羧肽酶Y抑制子通过特异性结合胶孢炭疽菌内羧肽酶Y来维持细胞内蛋白质稳态并进行一系列的生理调控;进而推测,在敲除CgPEB后,胞内与羧肽酶Y特异性结合的羧肽酶抑制子减少,具有生理活性的羧肽酶Y浓度升高,胞内对羧肽酶Y的需求减少,因此ΔCgpeb中CgCRY表达量降低。但其具体调控机制有待进一步的实验验证。
-
本研究通过构建橡胶树胶孢炭疽菌CgPEB的基因敲除突变体,针对基因敲除突变株的生理表型与致病能力进行分析。研究发现,CgPEB参与橡胶树胶孢炭疽菌的营养生长、分生孢子产量以及抗渗透胁迫的生理生长的调控。并且通过影响橡胶树胶孢炭疽的入侵能力调控胶胞炭疽菌的致病能力。此外,CgPEB参与调控羧肽酶Y合成关键基因CgCRY的表达,但其参与调控羧肽酶Y活性进而影响胶孢炭疽菌生理表型的分子机制有待深入研究。
Functional analysis of carboxypeptidase Y inhibitor CgPEB of Colletotrichum gloeosporioides from Hevea brasiliensis
-
摘要: 橡胶是中国重要的战略资源,由胶胞炭疽菌(Colletotrichum gloeosporioides)引起的炭疽病会大大影响橡胶产业的发展。开展橡胶树胶孢炭疽菌致病力相关基因的功能研究可以为病害防治提供理论基础。本研究在橡胶树胶孢炭疽菌中鉴定到一个编码羧肽酶Y抑制蛋白的基因Cgpeb。首先,通过原生质体转化体系构建了该基因的敲除突变株ΔCgpeb和互补菌株Res-ΔCgpeb,并对敲除突变株ΔCgpeb和互补菌株Res-ΔCgpeb营养生长以及致病能力相关表型进行了分析。研究发现Cgpeb基因敲除突变体ΔCgpeb菌落生长速率降低,分生孢子产量下降,且ΔCgpeb对橡胶树叶片和苹果的致病力明显下降。进一步分析发现,ΔCgpeb在洋葱表皮细胞中的入侵菌丝形成率显著降低。以上结果表明,Cgpeb在调控胶孢炭疽菌菌落生长、分生孢子产量以及致病能力中发挥重要作用。Abstract: Natural rubber is an important strategic resource in China. The infection of Colletotrichum gloeosporides in rubber tree would greatly affect the development of rubber industry. The functional study of the pathogenicity-related genes of C. gloeosporioides can provide a theoretical basis for disease prevention and control. A gene CgPEB encoding carboxypeptidase Y inhibitor protein was identified in C. gloeosporioides. The gene knockout mutant strain was constructed according to the principle of homologous recombination, and the phenotype and pathogenicity analysis were performed. The results showed that the growth rate and conidial production of ΔCgpeb, Cgpeb gene knockout mutant were reduced. Besides, both the appressorium and invasive hyphae formation rate of ΔCgpeb were significantly reduced. These findings suggested that CgPEB plays an important role in regulating the colony growth, conidial production and pathogenicity of C. gloeosporioides.
-
Key words:
- Colletotrichum gloeosporioides /
- CgPEB /
- pathogenicity /
- Carboxypeptidase Y inhibitor
-
图 2 Split-Marker基因敲除原理以及基因敲除突变体与互补株的鉴定
注:A. Split-Marker基因敲除原理示意图;B. CgPEB基因敲除突变体上、下游同源臂和基因检测(顺序由上到下);C. 互补株载体构建示意图;D. 互补株基因检测。
Fig. 2 Principle of Split-Marker gene knockout and identification of knockout mutants and complemented strains
Notes: A. Schematic diagram of the Split-Marker gene knockout principle; B. Detection of upstream/downstream homologous arms and the target gene in CgPEB knockout mutants(from top to bottom); C. Schematic diagram of complementation vector construction; D. Gene detection in complemented strains.
图 3 ΔCgpeb突变体生长速率与产胞量分析
注:A. 各菌株在PDA培养基上生长 5 d 后的菌落形态;B. 各菌株培养5 d 后菌落直径统计;C. 各菌株产孢量统计;误差线表示样品平均值±标准差SD;ns: P>0.05; *: P<0.05; **: P<0.01; ***: P<0.001。
Fig. 3 Analysis of growth rate and sporulation capacity in ΔCgpeb strains
Notes: A. Colony morphology of strains cultured on PDA medium for 5 d; B. Statistical analysis of colony diameter after 5 days of cultivation; C. Sporulation quantity of strains. Error bars represent the mean ± SD; ns: P>0.05; *: P<0.05; **: P<0.01; ***: P<0.001.
图 4 ΔCgpeb突变体致病力分析
注: A. 接种预刺伤处理橡胶树叶片2 d发病情况; B. 接种橡胶树叶片2 d发病率; C. 接种橡胶树叶片2 d 病斑大小差异分析; D. 接种苹果5 d发病情况; E. 接种苹果5 d病斑大小差异分析; 误差线表示样品平均值±标准差SD; ns; P>0.05; *: P<0.05; **: P<0.01。
Fig. 4 Pathogenicity analysis of ΔCgpeb strains
Note :A. Disease symptoms on pre-wounded rubber tree leaves 2 days after inoculation; B. Statistical analysis of disease incidence on rubber tree leaves for 2 d; C. Comparative analysis of lesion size on rubber tree leaves for 2 d; D. Disease symptoms on apple fruits for 5 d; E. Comparative analysis of lesion size on apple fruits for 5 d. Error bars represent the mean ± SD; ns: P>0.05; *: P<0.05; **: P<0.01.
图 5 ΔCgpeb突变体孢子萌发率分析
注: A. ΔCgpeb萌发2 h与3 h情况观察; B. ΔCgpeb培养2 h与3 h的萌发率统计; 误差线表示样品平均值±标准差SD; ns: P>0.05; ***: P<0.001; Bar=10 μm。
Fig. 5 Analysis of spore germination rate in ΔCgpeb strains
Notes: A. Observation of spore germination status in ΔCgpeb strains at 2 h and 3 h; B. Statistical analysis of germination rates after 2 h and 3 h of incubation in ΔCgpeb strains. Error bars represent the mean ± SD; ns: P>0.05; ***: P<0.001; Bar=10 μm.
图 6 ΔCgpeb突变体附着胞形成率分析
注: A. 疏水平板ΔCgpeb附着胞形成情况; B. 附着胞形成率统计; 误差线表示样品平均值±标准差SD; ns: P>0.05; Bar=10 μm。
Fig. 6 Analysis of appressorium formation rate in ΔCgpeb strains
Notes: A. Appressorium formation of ΔCgpeb on a hydrophobic plate; B. Statistical analysis of appressorium formation rate. Error bars represent the mean ± SD; ns: P>0.05; Bar= 10 μm.
图 7 ΔCgpeb突变体入侵菌丝形成率分析
注: A. ΔCgpeb接种洋葱内表皮入侵菌丝形成情况;B; 入侵菌丝形成率统计; 误差线表示样品平均值±标准差SD; ns: P>0.05; *: P<0.05; ****: P<0.0001; Bar=10 μm。
Fig. 7 Analysis of invasive hyphae formation rate in ΔCgpeb strains
Notes: A. Formation of invasive hyphae in ΔCgpeb strains inoculated on onion epidermal cells; B. Statistical analysis of invasive hyphae formation rate. Error bars represent the mean ± SD; ns: P>0.05; *: P<0.05; ****: P<0.0001; Bar= 10 μm.
图 8 ΔCgpeb突变体试剂抗逆能力分析
注: A. CgWT、ΔCgpeb和Res-ΔCgpeb接种含有不同试剂MM培养基菌落生长情况; B. 不同逆境胁迫对CgWT、ΔCgpeb和Res-ΔCgpeb菌落生长抑制率分析; 误差线表示样品平均值±标准差SD; ns: P>0.05; *: P<0.05; **: P<0.01; ****: P<0.0001; Bar=10 μm。
Fig. 8 Analysis of stress resistance in ΔCgpeb strains
Note: A. Colony growth of CgWT, ΔCgpeb, and Res-ΔCgpeb strains on MM medium containing different chemical agents; B. Analysis of growth inhibition rates under different stress conditions for CgWT, ΔCgpeb, and Res-ΔCgpeb strains;. Error bars represent the mean ± SD; ns: P>0.05; *: P<0.05; **: P<0.01; ****: P<0.0001; Bar = 10 μm.
表 1 本实验所用引物
Table 1 Primers used in the present experiment
引物名称Primer 序列(5′-3′)Sequence 用途Usage CgPEB-5F AAGGCAGGGTGGGACAT 同源臂扩增Homologous arm amplification CgPEB-5R TTTGATGCTGTTTCGACG 同源臂扩增Homologous arm amplification CgPEB-MF1 CGTCGAAACAGCATCAAAGTGCCAACGCCACAGTG 同源臂扩增Homologous arm amplification CgPEB-MR1 CACTGTGGCGTTGGCACTTTGATGCTGTTTCGACG 同源臂扩增Homologous arm amplification CgPEB-MF2 GAATTGCATGCTCTCACTTGTCGACCATTCATATT 同源臂扩增Homologous arm amplification CgPEB-MR2 AATATGAATGGTCGACAAGTGAGAGCATGCAATTC 同源臂扩增Homologous arm amplification CgPEB-3F TTGTCGACCATTCATATT 同源臂扩增Homologous arm amplification CgPEB-3R GATCGTGATTCGCTGTT 同源臂扩增Homologous arm amplification Sur-SLR ATGTTGGCATAAGCCGAACCGT 同源臂扩增Homologous arm amplification Sur-SLF CCTCTGATATTGGAAGCGACGC 同源臂扩增Homologous arm amplification CgPEB-JC5F AATGTTCTTTGCCCGACTTGT 突变株鉴定 Mutant Strain Identification CgPEB-JC3R TCGGCTTCATTCCATATTCATT 突变株鉴定 Mutant Strain Identification CgPEB-JCOF ATGGCGGGCCGAATTGTAG 突变株鉴定 Mutant Strain Identification CgPEB-JCOR CTGCTTTTCGTTCTGGGCA 突变株鉴定 Mutant Strain Identification SUR-JC5R GCGTTTGTAACTCTGCCTGTTTG 突变株鉴定 Mutant Strain Identification SUR-JC3F ACGAGGACCGCTACTCACATAC 突变株鉴定 Mutant Strain Identification CgPEB-OF(XbaⅠ) TCTAGAATTCTACTGCTTGTGCCTTGA 同源臂扩增Homologous arm amplification CgPEB-OR(BamHⅠ) GGATCCCTACTGCTTTTCGTTCTGG 同源臂扩增Homologous arm amplification CgActin-qF GATTGGTATGGGCCAGAAGG 相对表达量检测
Relative expression level detectionCgActin-qR GGAGCTCGTTGTAGAAGGTG 相对表达量检测
Relative expression level detectionCRY-QF CGTCCTCATCTACGCTGGTG 相对表达量检测
Relative expression level detectionCRY-QR TTGACCTTGCCGTATTCCTC 相对表达量检测
Relative expression level detection -
[1] CANNON P F, DAMM U, JOHNSTON P R, et al. Colletotrichum–current status and future directions[J]. Studies in Mycology, 2012, 73(1): 181 − 213. [2] 冯淑芬, 刘秀娟, 郑服丛, 等. 橡胶树炭疽菌生物学和侵染特征研究[J]. 热带作物学报, 1998(2): 7 − 14. [3] LIU L, ZHANG L, QIU P, et al. Leaf spot of Polygonatum odoratum caused by colletotrichum spaethianum[J]. Journal of General Plant Pathology, 2020, 86(2): 157 − 161. doi: 10.1007/s10327-019-00903-4 [4] KURIKI Y, SOGAWA M, KOMATSU T, et al. Modular design platform for activatable fluorescence probes targeting carboxypeptidases based on ProTide chemistry[J]. Journal of the American Chemical Society, 2024, 146(1): 521 − 531. doi: 10.1021/jacs.3c10086 [5] SAPIO M R, FRICKER L D. Carboxypeptidases in disease: insights from peptidomic studies[J]. Proteomics Clinical Applications, 2014, 8(5-6): 327 − 337. doi: 10.1002/prca.201300090 [6] 王德解, 方宏清, 陈宏, 等. 羧肽酶a/b亚家族[J]. 中国生化药物杂志, 2005, 26(1): 55 − 58. doi: 10.3969/j.issn.1005-1678.2005.01.022 [7] LI Z Y, TANG L Q, QIU J H, et al. Serine carboxypeptidase 46 regulates grain filling and seed germination in rice (oryza sativa l.)[J]. PLoS One, 2016, 11(7): e0159737. [8] 单雨瑶. 羧肽酶y的酵母异源表达及其在固相酶法肽合成中的应用[D]. 天津大学, 2018. [9] 纪海兵, 刘中美, 郭军玲, 等. 雅致放射毛霉羧肽酶y的基因克隆、表达与酶学性质研究[J]. 现代食品科技, 2017, 33(1): 81 − 86. [10] DUAN W, ZHANG Y, XU G Q. Optimization and application of protein c-terminal labeling by carboxypeptidase Y[J]. Chinese Journal of Biotechnology, 2016, 32(1): 135 − 148. [11] NAGAYAMA M, KURODA K, UEDA M. Identification of interaction site of propeptide toward mature carboxypeptidase y (mCPY) based on the similarity between propeptide and CPY inhibitor (IC)[J]. Bioscience Biotechnology Biochemistry, 2012, 76(1): 153 − 156. doi: 10.1271/bbb.110668 [12] MIMA J, NARITA Y, CHIBA H, et al. The multiple site binding of carboxypeptidase Y inhibitor (IC) to the cognate proteinase. Implications for the biological roles of the phosphatidylethanolamine-binding protein[J]. The Journal of Biological Chemistry, 2003, 278(32): 29792 − 29798. doi: 10.1074/jbc.M301859200 [13] 郭云峰, 安邦. 橡胶树胶孢炭疽菌nadph氧化酶功能研究[J]. 生物技术通报, 2018, 34(10): 165 − 171. [14] 梁琳悦, 王倩男. 胶孢炭疽菌微管末端结合蛋白cg EB1的功能初步分析[J]. 分子植物育种, 2024, 22(17): 5569 − 5577. [15] 张杰, 杨玺, 李游山. 蛋白酶及其抑制剂关键活性位点研究进展[J]. 生物工程学报, 2021, 37(2): 561 − 579. [16] 熊科, 邓蕾, 柳佳芸, 等. 蛋白酶水解底物特异性机制研究进展[J]. 食品与发酵工业, 2019, 45(19): 292 − 298. [17] KĘDZIOR M, SEREDYŃSKI R, GUTOWICZ J. Microbial inhibitors of cysteine proteases[J]. Medical Microbiology and Immunology, 2016, 205(4): 275 − 296. doi: 10.1007/s00430-016-0454-1 [18] VAN ESSE H P, VAN'T KLOOSTER J W, BOLTON M D, et al. The Cladosporium fulvum virulence protein avr2 inhibits host proteases required for basal defense[J]. The Plant Cell, 2008, 20(7): 1948 − 1963. doi: 10.1105/tpc.108.059394 [19] KANTYKA T, SHAW L N, POTEMPA J. Papain-like proteases of Staphylococcus aureus[J]. Advances in Experimental Medicine and Biology, 2011, 712: 1 − 14. [20] MORITA H, TOMITA S, MAEDA H, et al. Serine-type carboxypeptidase KexA of Aspergillus oryzae has broader substrate specificity than saccharomyces cerevisiae kex1 and is required for normal hyphal growth and conidiation[J]. Applied and Environmental Microbiology, 2012, 78(22): 8154 − 8157. doi: 10.1128/AEM.01601-12 [21] LIU K H, WANG X T, QI Y Z, et al. Effector protein serine carboxypeptidase FgSCP is essential for full virulence in F. graminearum and is involved in modulating plant immune responses[J]. Phytopathology, 2024, 114(9): 2131 − 2142. doi: 10.1094/PHYTO-02-24-0068-R [22] GUMTOW R, WU D, UCHIDA J, et al. A phytophthora palmivora extracellular cystatin-like protease inhibitor targets papain to contribute to virulence on Papaya[J]. Molecular Plant-Microbe Interactions, 2018, 31(3): 363 − 373. doi: 10.1094/MPMI-06-17-0131-FI [23] 韩长志. 胶孢炭疽病菌的研究进展[J]. 华北农学报, 2012, 27(S1): 386 − 389. doi: 10.3969/j.issn.1000-7091.2012.z1.075 [24] QUILIS J, MEYNARD D, VILA L, et al. A potato carboxypeptidase inhibitor gene provides pathogen resistance in transgenic rice[J]. Plant Biotechnology Journal, 2007, 5(4): 537 − 553. doi: 10.1111/j.1467-7652.2007.00264.x [25] HUANG J Y, WONG K H, TAN W L, et al. Identification and characterization of a wolfberry carboxypeptidase inhibitor from Lycium barbarum[J]. Food Chemistry, 2021, 351: 129338. doi: 10.1016/j.foodchem.2021.129338 [26] GOMES G D S, ESPÓSITO P C, BARACAT P M C. Carboxypeptidase inhibitors from solanaceae as a new subclass of pathogenesis related peptide aiming biotechnological targets for plant defense[J]. Frontiers in Molecular Biosciences, 2023, 10(1): 20. [27] BARTH R, WOLF D H, HOLZER H. Studies on the carboxypeptidase y-inhibitor complex of yeast[J]. Biochimica Et Biophysica Acta, 1978, 527(1): 63 − 69. doi: 10.1016/0005-2744(78)90256-5 -

 点击查看大图
点击查看大图
计量
- 文章访问数: 632
- HTML全文浏览量: 386
- 被引次数: 0



 下载:
下载: