-
炭疽菌是具有重要经济价值的植物病原体,危害包括林木、蔬菜和花卉等多种植物。炭疽菌种类繁多,遗传多态性丰富,其中胶孢炭疽菌是最为常见的致病种之一。暹罗炭疽菌是胶胞炭疽菌复合群下的一个种,是中国多种作物炭疽病的田间优势病原种[1]。目前,化学防治是控制该类病害最常用的方法,常用药剂主要是由代森类杀菌剂、麦角甾醇生物合成抑制剂(DMI 类)、甲氧基丙烯酸酯类杀菌剂(QoI 类)组成的单剂或混剂产品[2 − 4]。但长期单一药剂的使用导致抗性问题愈加突出,寻找新途径防治炭疽病势在必行。
酰胺类杀菌剂是一类古老的杀菌剂,已有近半个世纪的使用历史,数量约占杀菌剂总数的四分之一,且不断有新产品上市。酰胺类杀菌剂包含苯基酰胺、羧酸酰胺、吡啶酰胺和吡唑酰胺等多种类型的化合物,其作用靶标涵盖了RNA聚合酶、纤维素合成酶、琥珀酸脱氢酶和麦角甾醇合成酶等关键催化酶,是杀菌剂研发的焦点。2000年后上市的酰胺类杀菌剂结构新颖、活性高,已被广泛用于大田作物和经济作物病害的防治[5]。其中,以吡唑酰胺类杀菌剂最多,主要包括苯并烯氟菌唑、吡噻菌胺、吡唑萘菌胺、联苯吡菌胺和氟唑菌酰胺等;其次是吡啶酰胺类杀菌剂,主要包括啶酰菌胺和氟吡菌酰胺等[6]。这些酰胺类杀菌剂的作用机制是抑制病原菌的琥珀酸脱氢酶(succinate dehydrogenase, SDH),因此它们也被称为琥珀酸脱氢酶抑制剂(succinate dehydrogenase inhibitor, SDHI)[7]。
SDHI类杀菌剂具有高效、广谱、选择性强等优势,兼具预防和治疗作用。对多种病原菌孢子萌发、芽管伸长、菌丝体生长等各阶段抑制作用显著。该类杀菌剂常用于谷物、蔬菜、果树等多种作物及草坪,防治由灰葡萄孢菌、镰刀菌、白粉菌、链格孢菌、丝核菌、尾孢菌等病原菌引起的病害[8 − 9]。但大部分的SDHI类杀菌剂不能用于防治炭疽病,对炭疽菌属(Colletotrichum)的抑制效果很差[10 − 11]。Ishii 等[12]首次研究发现 SDHI 类杀菌剂对炭疽菌抑菌活性差异较大,啶酰菌胺、氟唑菌酰胺和氟吡菌酰胺对炭疽菌无离体抑菌活性,活体防效较差。吡噻菌胺对于大多数炭疽菌离体抑菌活性较好,但活体防效一般。苯并烯氟菌唑由先正达公司于2003年开发,2012年上市,是一种广谱杀菌剂,具有优异的抑菌活性,在防治多种作物炭疽病方面表现出卓越效果[12]。多数SDHI类杀菌剂对炭疽菌的EC50值均大于100 μg·mL−1,苯并烯氟菌唑对所有炭疽菌测试菌株的EC50值不大于0.2 μg·mL−1;多数SDHI类杀菌剂无法抑制炭疽菌分生孢子的萌发和芽管伸长,苯并烯氟菌唑抑制孢子萌发的EC50值均小于8.2 μg·mL−1,0.1 μg·mL−1即可显著抑制菌体分生孢子的芽管伸长[13]。因此,除SDH酶靶标结合机制外[14],苯并烯氟菌唑等SDHI类杀菌剂对炭疽菌毒力差异的产生可能还其他作用机制。本研究前期发现,苯并烯氟菌唑可以显著破坏暹罗炭疽菌的细胞膜,导致菌体电解质外泄[15]。这种药剂的作用方式得到了其他研究数据的支持,如Hou等[16]的透射电镜和细胞膜电导率实验结果表明,苯并烯氟菌唑可以破坏玉米小斑病菌的细胞膜。高杨杨[17]研究发现,苯并烯氟菌唑具有优异的膜渗透性能,对胶孢炭疽菌和灰霉菌的膜渗透率均显著大于其他SDHI类杀菌剂,这可能是该药剂易破坏细胞膜从而顺利进入菌体内部所致。麦角甾醇是真菌生物膜的特异性组分,对保持细胞膜完整性和流动性具有重要作用。麦角甾醇合成途径复杂,催化酶种类众多,合成中间产物多样,研究麦角甾醇合成通路有利于探明真菌麦角甾醇生物合成的分子调控机制,为改善现有杀菌剂的化学结构奠定理论基础。
本研究以橡胶树暹罗炭疽菌为研究对象,开展苯并烯氟菌唑处理下的转录调控分析,重点聚焦其对麦角甾醇合成通路的抑制作用;通过气相色谱-质谱联用(GC-MS/MS)分析,明确了苯并烯氟菌唑对麦角甾醇合成前体种类及其含量的影响;通过基因过表达技术验证了关键合成酶的功能,初步揭示了苯并烯氟菌唑抑制暹罗炭疽菌麦角甾醇合成的分子机制。该研究为炭疽病防治新药剂的筛选提供了理论依据。
-
橡胶树暹罗炭疽菌(Colletotrichum siamense)CS23菌株由本实验室分离鉴定并保存。
-
99.99% (m/m)苯并烯氟菌唑原药由德国Dr. Ehrenstorfer公司提供,丙酮溶解并配制成
10000 μg·mL−1的储备液,于4 ℃保存。96.4%(m/m)麦角甾醇标准品和99.7%(m/m)角鲨烯标准品由坛墨质检科技股份有限公司提供。90%(m/m)羊毛甾醇、99%(m/m)胆固醇由上海源叶生物科技有限公司提供。 -
PDB培养基由马铃薯200 g煮沸滤取的浸出液和葡萄糖20 g组成;PDA培养基在PDB基础上加入琼脂粉20 g以用于平板培养。YCS培养基包括上层、下层及液体培养基:上层培养基含酵母提取物1 g、酸水解酪蛋白1 g、葡萄糖10 g和琼脂粉10 g;下层培养基含酸水解酪蛋白1 g、酵母提取物1 g、蔗糖342 g和琼脂粉12 g;YCS液体培养基由蔗糖342 g和酸水解酪蛋白1 g组成;三者均定容至
1000 mL。所有培养基均在121 ℃高压灭菌20 min后使用。 -
药剂处理:将CS23菌株于PDA平板上28 ℃活化培养3 d后,取直径5 mm的菌饼置于100 mL PDB液体培养基中,以28 ℃和180 r·min−1条件下摇床培养36 h。根据前期研究,选择 5 μg·mL−1 苯并烯氟菌唑作为处理质量浓度,加入后继续培养 36 h[15]。使用无菌水作为空白对照。滤干菌丝多余水分,称取等量菌丝置真空冷冻干燥器干燥备用。
皂化法提取甾类化合物:参考黄慧等[18]醇碱皂化法提取米曲霉麦角甾醇,并在此基础上改进。称取300 mg冻干菌丝,加入皂化剂氢氧化钾-甲醇溶液(60 g·L−1),在70 ℃皂化2 h。用3倍的正己烷萃取3次,合并提取液,旋转蒸发正己烷浓缩得到不可皂化脂质,加入二氯甲烷使溶液体积为1 mL,−20 ℃保存。
-
定性方法:采用美国国家标准与技术研究院(National institute of standards and technology, NIST)谱库检索并结合甾醇类化合物的质谱裂解规律进行定性分析。
定量方法:采用胆固醇内标法进行定量。将与麦角甾醇具有相似结构的外源物质胆固醇溶解于二氯甲烷中,配制成12.5、25、50、100、200 μg·mL−1的胆固醇标准液。然后,将胆固醇标准液加入提取液中,作为内标物质。通过GC-MS/MS对样品进行检测,建立标准曲线为y=461.95x−
7856.1 ,R2=0.9916 ,最低检出限为0.01 μg·mL−1,用于其他甾醇类化合物的定量分析。 -
色谱条件:TG−5ILMS型气相色谱柱(30 m × 0. 25 mm × 0. 25 μm);进样口温度230 ℃;恒流模式;不分流进样;进样体积1 μL。程序升温:初始温度为80 ℃(保持2 min),以30 ℃/min升至250 ℃(保持5 min),以35 ℃/min升至300 ℃(保持2 min)。载气为高纯氦气(99.999%)。
质谱条件:电子轰击离子源(EI);离子源温度300 ℃;传输线温度250 ℃;溶剂延迟时间3 min;Full Scan 模式扫描,质子数/电荷数(m/z)比值监测范围50~500。
-
将活化好的CS23菌株挑取5个菌饼转入终浓度为1 μg·mL−1苯并烯氟菌唑PDB培养基中,恒温摇床28 ℃、140 r·min−1培养3 d,以无添加药剂为空白对照。用滤纸过滤菌丝并用无菌水清洗,将吸干水分的菌丝体转移至研钵中加入液氮速冷,并迅速研磨至粉末状,取500 mg磨碎后的菌丝样品至2.0 mL无酶离心管中采用Trizol法提取RNA,方法参考天根总RNA提取试剂盒说明书。核酸浓度分析仪检测RNA合格后寄样送转录组测序。RNA-seq数据已上传至NCBI数据库,登录号为PRJNA744009[15]。使用倍数变化 ≥ 2 且P值 < 0.05 作为筛选标准,以识别不同组别之间的差异表达基因。
-
采取同源重组的策略,将目的基因 cDNA 序列引入pCAMBIA1303过表达载体中。从CS23菌株中提取总RNA,经反转录合成cDNA文库,以cDNA为模板使用表1中特异性引物分别PCR扩增ERG1、ERG7、cyp51a 和 cyp51b基因。采用ClonExpres无缝克隆技术,将纯化得到的目的基因片段连入酶切线性pCAMBIA1303载体质粒。连接体系为:线性化载体4.5 μL,目的基因片段0.5 μL,2 × ClonExpress Mix 5 μL,ddH2O补足 10 μL PCR仪50 ℃反应15 min。重组转化步骤参考ClonExpress® Ultra One Step Cloning Kit试剂盒说明书(诺唯赞)。菌落PCR扩增并测序以验证阳性单克隆,阳性转化子加入甘油后置于−80 ℃保存。
表 1 本研究使用的引物
Table 1. Primer used in this study
引物名称
Primer name引物序列
Primer sequencesKL-CDS-cyp51b-F1 ATGGGTCTCCTGCAGGAGGT KL-CDS-cyp51b-R1 TTACGCCTCACGCTTCTCCC KL-CDS-cyp51a-F1 ATGAGCCCTCTCGTTGTCTATGG KL-CDS-cyp51a-R1 TCAATCACGTCGGGTCCACC KL-CDS-ERG1-F1 ATGATTGAGAGTCCGACAGCAGC KL-CDS- ERG1-R1 CTAGTTCAATTCGCGCCACAT KL-CDS-ERG7-F1 ATGGTCGTCGAGAAGAAAGCG KL-CDS-ERG7-R1 TTACTCCTTGCCGCTGATGC qp-cyp51a-F ACGTCGCAAGAACGGTGATA qp-cyp51a-R CTGACCTCCCATGAGAAGCG qp-cyp51b-F TGGAACAAGAAGCGCGATCA qp-cyp51b-R GTGCCGTTCTTGTAGGTGGA qp-ERG1-F GGCAAGACGAAGGACGACTA qp-ERG1-R GGAGGTACTCCTTGCGGAAC qp-ERG7-F TGCAAGGACTCGGACAAGTG qp-ERG7-R TGAGCGCCTCCGAAATACAG qp-β2-tubulin-F AGCCCTACAACGCCACTCTCT qp-β2-tubulin-R GTGGTTCAGGTCGCCGTAAG qp-ERG5-3F TCACGCCGAACTACACTGTCC qp-ERG5-3R ACATATCTTCGCGCAAGGCAA qp-ERG5-2F AATTCGTCGTTCTTGCATCCG qp-ERG5-2R CTTCGATACTCTGCGTGGTC qp-ERG6-2-F ATCAGACAGGCTCGTACAGCA qp -ERG6-2-R TGCCACCCTTGAGTCCCAT 1303 -FTTTGAACCTTTCAGTTCGAGCTTT 1303 -RCTGAATGCCCACAGGCC cz-cyp51b-F agacatcaccatggtagatct
ATGGGTCTCCTGCAGGAGGTcz-cyp51b-R ttctacaggacgtaaactagt
TTACGCCTCACGCTTCTCCCcz-cyp51a-F agacatcaccatggtagatct
ATGAGCCCTCTCGTTGTCTATGGcz-cyp51a-R ttctacaggacgtaaactagt
TCAATCACGTCGGGTCCACCcz-ERG1-F agacatcaccatggtagatct
ATGATTGAGAGTCCGACAGCAGCcz-ERG1-R ttctacaggacgtaaactagt
CTAGTTCAATTCGCGCCACATcz-ERG7-F agacatcaccatggtagatct
ATGGTCGTCGAGAAGAAAGCGcz-ERG7-R ttctacaggacgtaaactagt
TTACTCCTTGCCGCTGATGC注:小写字母代表线性化载体重叠序列。 Note:The lowercase letters represent an overlapping sequence of linearized vector. -
将CS23菌株和过表达菌株ERG1-OE1、ERG7-OE1、cyp51a-OE1、cyp51b-OE1在PDA平板上于28 ℃活化培养3 d后取直径5 mm菌饼置于含有100 mL PDB液体培养基锥形瓶中28 ℃和180 r·min−1下振荡培养。每个菌株设置3个生物学重复。药剂处理:摇培36 h后向培养基中加入苯并烯氟菌唑使其终质量浓度为5 μg·mL−1,继续摇培36 h。滤干菌丝多余水分,采用Trizol法提取RNA以β2-tubulin基因为内参基因比较不同条件下的基因表达式,使2−ΔΔCt方法计算每个基因的相对表达水平。基因表达量的相对标准偏差(RSD)均小于15%,数据以均值±SD形式呈现。
-
采用菌丝生长速率法测定菌株的药敏性[19]。向灭菌后的PDA培养基中加入苯并烯氟菌唑储备液,使其终质量浓度为0.1 μg·mL−1和0.05 μg·mL−1。将暹罗炭疽菌基因过表达菌株ERG1-OE1、ERG7-OE1、cyp51a-OE1、cyp51b-OE1在PDA平板上于28 ℃活化培养3 d后,从菌落边缘打取直径5 mm的菌饼,分别接种于含不同质量浓度苯并烯氟菌唑的PDA平板中央,每质量浓度设3个重复,于28 ℃培养5 d后,采用十字交叉法测量各处理的菌落直径,计算菌丝生长抑制率并使用SPSS 22.0进行统计分析,确保结果可靠性。每个处理3次重复。
-
方法参考Cao 等[20]稍作修改,PDA培养基中加入苯并烯氟菌唑储备液,使其终质量浓度为0.1 μg·mL−1。同时,加入适量麦角甾醇和角鲨烯母液形成不同浓度的药剂外源物质组合。将CS23菌株及过表达菌株分别接种于PDA平板正中央28 ℃培养5 d后,采用十字交叉法测量各处理的菌落直径,同1.2.5计算不同外源组合物质对过表达菌株的菌丝生长抑制率。每个处理3次重复。
-
为了探究苯并烯氟菌唑对破坏暹罗炭疽菌的细胞膜完整性的分子作用机制,本研究对苯并烯氟菌唑处理条件下的CS23菌株进行转录组分析。以药剂未处理的CS23菌株转录组为对照,使用倍数变化≥ 2 且 P值 < 0.05 为显著差异分析GO途径和KEGG富集通路(表2),发现在苯并烯氟菌唑处理组的差异基因显著富集在细胞膜相关途径(0031224; 0044425; 0016020)和甾类化合物合成通路(ko00100)中。尤其是在麦角甾醇合成通路中,有6个关键基因表达显著下调,相对表达量在0.11~0.43之间。另外,通过荧光定量PCR技术分析了这些基因的表达量,发现表达趋势与转录组数据一致,相对表达量在0.16~0.48之间(表3)。上述结果表明,苯并烯氟菌唑可能通过抑制麦角甾醇的生物合成来破坏暹罗炭疽菌的细胞膜完整性。
表 2 苯并烯氟菌唑处理条件下的CS23菌株转录组GO和KEGG分析
Table 2. GO and KEGG analysis of differential genes of CS23 treated with benzovindiflupyr
ID 描述
Descriptionq 值
q-valueGO terms GO:0031224 膜内在成分
intrinsic component of membrane0.000089 GO:0044425 膜部分
membrane part0.009700 GO:0016020 膜
Membrane0.010000 GO:0071944 胞外
cell periphery0.049000 GO:0036387 Pre-RC 复合体
pre-replicative complex0.049000 GO:0003824 催化活性
catalytic activity0.013000 KEGG pathway ko00100 甾类化合物合成
steroid biosynthesis0.000560 ko00360 苯丙氨酸代谢
phenylalanine metabolism0.001100 ko01110 次级生物合成代谢
biosynthesis of secondary
metabolites0.002200 ko00380 色氨酸代谢
tryptophan metabolism0.002200 ko00500 淀粉和蔗糖代谢
starch and sucrose metabolism0.004000 ko00040 戊糖和葡萄糖醛酸酯途径
pentose and glucuronate
interconversions0.022000 ko02010 ABC 转运
ABC transporters0.022000 ko00052 半乳糖代谢
galactose metabolism0.045000 注:q值小于0.05代表显著富集。 Note: The q-value < 0.05 indicates significant enrichment. 表 3 苯并烯氟菌唑处理条件下的CS23菌株麦角甾醇生物合成基因相对表达量
Table 3. Relative expression of ergosterol biosynthesis gene in CS23 strain treated with benzovindiflupyr
基因ID
Gene ID基因名称
Gene name转录组结果
Transcriptome result荧光定量PCR结果
qRT-PCR resultncbi_
59275084ERG5 0.11 0.22±0.11 ncbi_
59276216cyp51a 0.17 0.17±0.06 ncbi_
59275085ERG5 0.18 0.16±0.06 ncbi_
59266665ERG6 0.22 0.19±0.03 ncbi_
59271246ERG1 0.43 0.48±0.02 ncbi_
59267068cyp51b 0.36 0.36±0.02 -
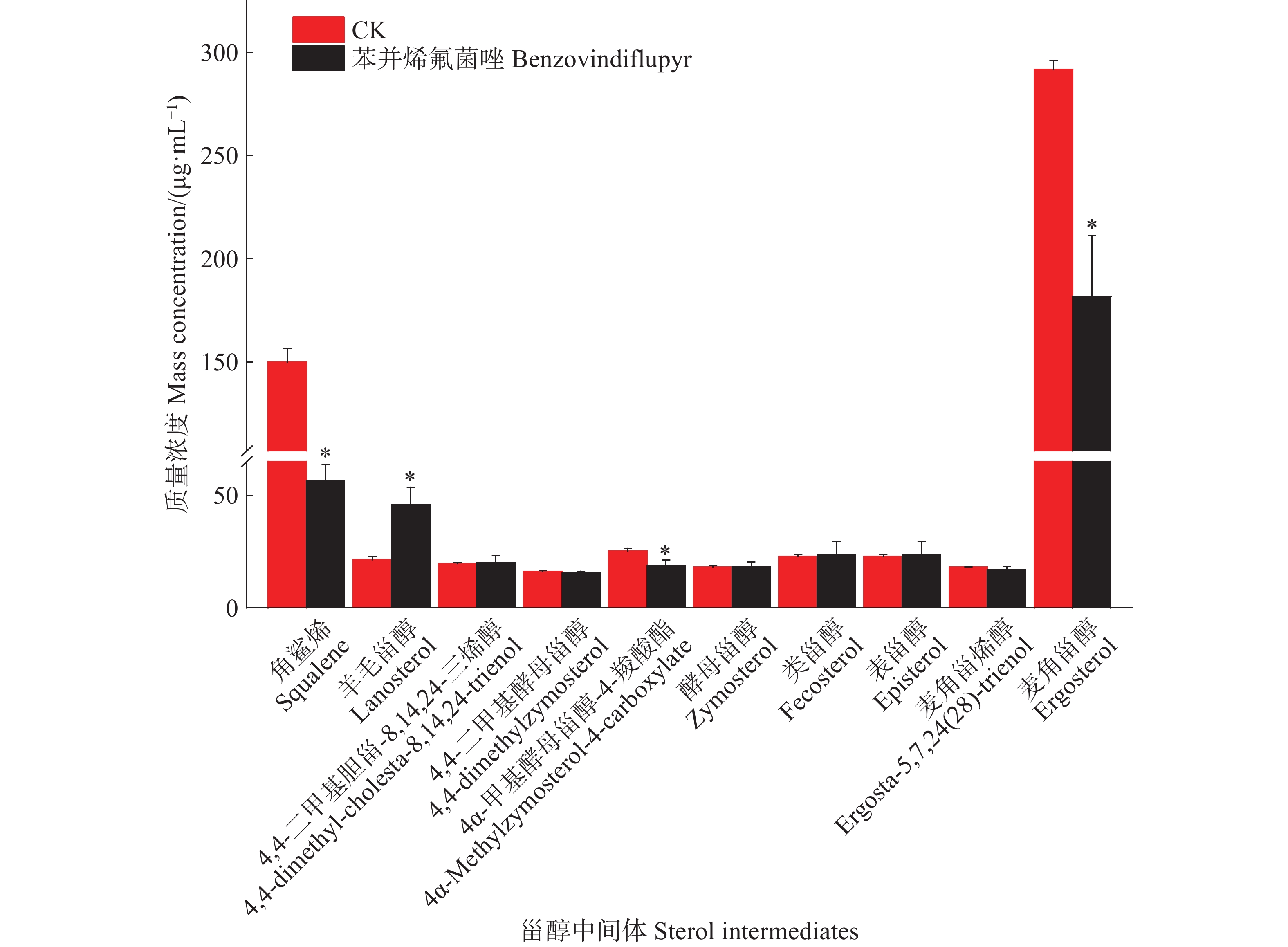
为了进一步明确苯并烯氟菌唑对麦角甾醇生物合成通路的作用机制,本研究利用GC-MS/MS技术分析了暹罗炭疽菌的麦角甾醇生物合成途径中的中间体组成,根据甾醇类化合物的代谢规律及NIST质谱库检索分析,鉴定出10种甾醇类化合物,按照麦角甾醇合成路线顺序依次是角鲨烯、羊毛甾醇、4,4-二甲基胆甾-8, 14,24-三烯醇、4,4-二甲基酵母甾醇、酵母甾醇、4α-甲基酵母甾醇-4-羧酸酯、粪甾醇、表甾醇、麦角甾烯醇、麦角甾醇(表4)。以未处理组为对照,本研究分析了苯并烯氟菌唑对暹罗炭疽菌中10种甾醇类化合物质量浓度的影响。定量结果显示,在2组处理的菌丝中均检测到10种甾醇类化合物,其中角鲨烯、羊毛甾醇、4α-甲基酵母甾醇-4-羧酸酯和麦角甾醇的质量浓度在2组之间存在显著差异。苯并烯氟菌唑处理后,4α-甲基酵母甾醇-4-羧酸酯和麦角甾醇的质量浓度显著降低,而羊毛甾醇的质量浓度则显著升高(图1)。结果表明,苯并烯氟菌唑可影响暹罗炭疽菌体内麦角甾醇生物合成中间体的质量浓度,最终影响麦角甾醇的生物合成
表 4 CS23菌株的10种甾醇类化合物GC-MS/MS鉴定结果
Table 4. Identification results of 10 sterol compounds by GC-MS/MS
序号
No.中文名称
Chinese name英文名称
English name保留时间/min
Retention time/min相对分子质量
Molecular weight分子式
Molecular formula1 角鲨烯 Squalene 17.04 410.7180 C30H50 2 羊毛甾醇 Lanosterol 24.23 426.7174 C30H50O 3 4,4-二甲基胆甾-8,14,
24-三烯醇4,4-dimethyl-cholesta-8,
14,24-trienol25.21 410.6749 C29H46O 4 4,4-二甲基酵母甾醇 4,4-dimethylzymosterol 22.74 412.6908 C29H48O 5 4α-甲基酵母甾醇-
4-羧酸酯4α-Methylzymosterol-4-
carboxylate24.95 442.6737 C29H46O3 6 酵母甾醇 Zymosterol 23.72 384.6377 C27H44O 7 粪甾醇 Fecosterol 23.20 398.6642 C28H46O 8 表甾醇 Episterol 23.40 398.6642 C28H46O 9 麦角甾烯醇 Ergosta-5,7,24(28)-trienol 21.99 396.6484 C28H44O 10 麦角甾醇 Ergosterol 22.60 396.6484 C28H44O 注:甾醇类化合物的排序依据麦角甾醇生物合成通路的先后顺序,从1至10依次排列。 Note: The sterol compounds are listed in the order of the ergosterol biosynthesis pathway, from 1 to 10. -
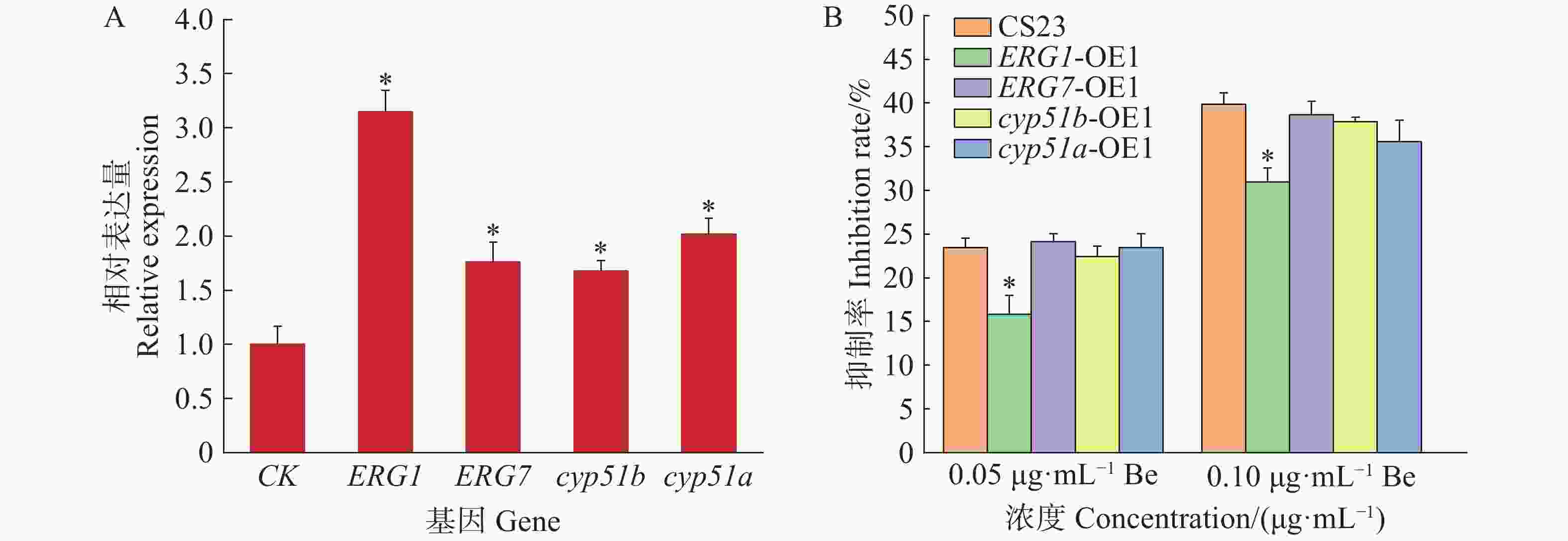
参考真菌麦角甾醇合成途径[21],结合苯并烯氟菌唑对麦角甾醇合成中间体及编码基因的抑制作用,筛选出可能受药剂作用的4个催化酶基因,分别为ERG1、ERG7、cyp51a和cyp51b。本研究成功构建了这4个基因的暹罗炭疽菌过表达菌株,并与野生型菌株CS23进行了荧光定量分析。结果表明,过表达菌株的基因相对表达量均显著高于CS23菌株,表达水平提高了1.7~3.1倍(图2−A)。此外,进一步测定了这些过表达菌株对苯并烯氟菌唑的药敏性。结果显示,与CS23菌株相比,ERG1基因的过表达菌株ERG1-OE1对苯并烯氟菌唑的敏感性降低了7.6%~8.9%,而其他过表达菌株与CS23菌株无显著差异(图2−B)。这表明,苯并烯氟菌唑可能通过抑制CS23菌株中ERG1基因的表达,从而影响麦角甾醇的生物合成。
-
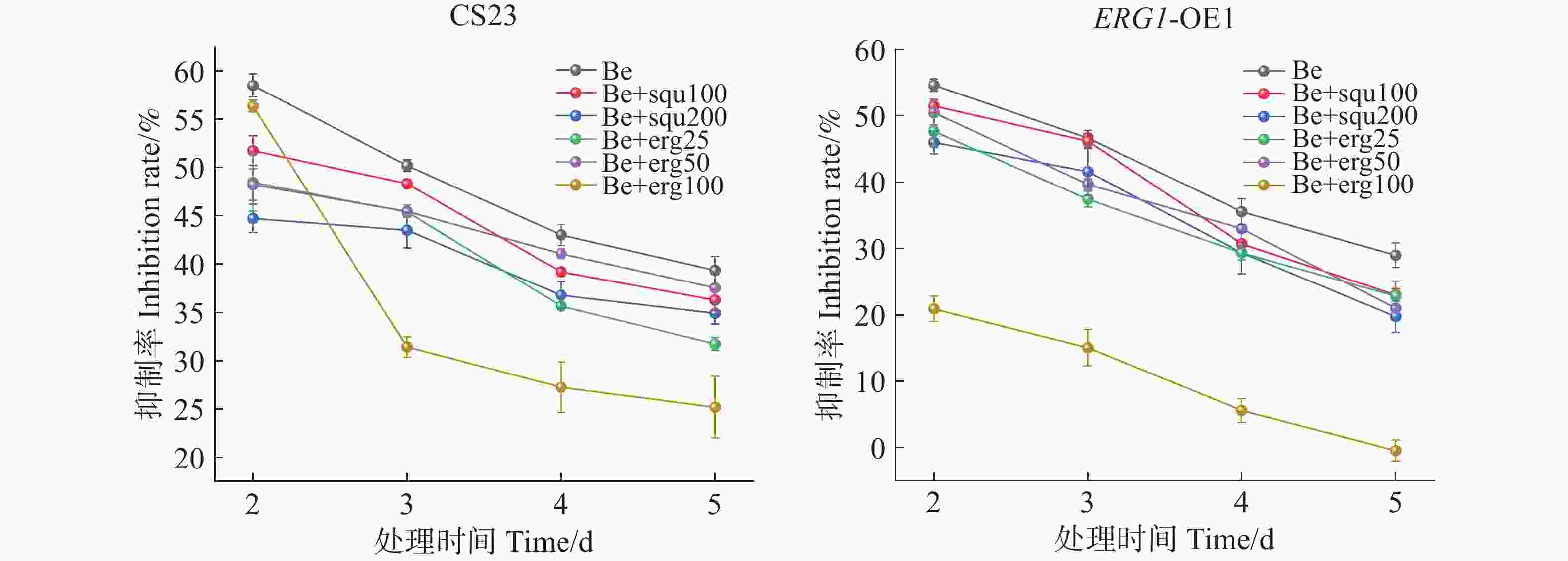
以未添加组为对照,研究外源添加角鲨烯和麦角甾醇条件下,苯并烯氟菌唑对CS23菌株及ERG1-OE1菌株菌丝生长抑制率的影响。结果表明,0.1 μg·mL−1苯并烯氟菌唑处理后2~5 d内,菌丝生长抑制率逐渐降低,外源添加不同质量浓度角鲨烯和麦角甾醇显著降低了药剂对2个菌株的抑制率,尤其在第5天时,100 μg·mL−1麦角甾醇处理下,苯并烯氟菌唑对CS23菌株的抑制率仅为25.18%,对ERG1-OE1则无抑制效果(图3)。由此可见,外源添加角鲨烯和麦角甾醇能显著降低苯并烯氟菌唑对暹罗炭疽菌的生长抑制作用。
-
酰胺类杀菌剂苯并烯氟菌唑在防治多种作物炭疽病方面展现出独特优势,能够有效抑制炭疽菌的菌丝生长、孢子萌发和芽管伸长[11 − 13]。因此,Ishii等[12]人提出,除了SDH酶靶标结合机制外,可能还存在其他作用机制,导致苯并烯氟菌唑等SDHI类杀菌剂对炭疽菌的毒力差异。然而,该现象背后的具体作用机制尚未完全阐明。本研究对苯并烯氟菌唑处理下的暹罗炭疽菌进行转录组分析,发现差异基因显著富集细胞膜相关途径和甾类化合物合成通路。尤其是在麦角甾醇合成通路中,有6个关键基因表达差异显著,相对表达量在0.11~0.43。经荧光定量PCR技术验证,这些基因表达趋势与转录组数据一致。
麦角甾醇又称麦角固醇,是一种类异戊二烯的准平面分子,是真菌细胞膜上特有的甾醇类组分。麦角甾醇是真菌细胞膜的关键成分,参与质膜融合、胞间运输等多种生物过程[22 − 24]。此外,麦角甾醇还存在于线粒体、液泡、内质网等多种内膜结构中,对胞内信号传递、物质运输、遗传等生物学过程意义重大[25 − 27]。本研究建立了GC-MS/MS技术,用于分析麦角甾醇生物合成途径中的甾醇组分及其含量,并推测苯并烯氟菌唑可能作用的关键合成酶。在真菌甾醇组分的分析中,尽管已有多项研究采用GC-MS进行定性和定量分析并取得了良好效果,但该方法仍需进行衍生化处理[28 − 30]。本研究中提取的不可皂化脂质无须衍生化处理,可直接通过GC-MS/MS进行分离,获得更精确的母离子分子量,对甾醇组分进行定性和定量分析。在检测的10种甾醇组分中,角鲨烯、羊毛甾醇、4α-甲基酵母甾醇-4-羧酸酯和麦角甾醇的含量在不同处理间显著变化。结果表明,苯并烯氟菌唑显著作用于暹罗炭疽菌的麦角甾醇生物合成通路,这与转录组分析及GO和KEGG富集分析的结果一致。
多项研究表明,阻断或破坏麦角甾醇合成途径中的任意一步,都会导致中间代谢产物增加或最终麦角甾醇合成量减少[31 − 33]。苯并烯氟菌唑可能抑制炭疽菌中的角鲨烯环氧化酶,且其作用靶标有别于麦角甾醇类杀菌剂[34 − 35]。为进一步验证角鲨烯环氧化酶的作用,本研究通过基因过表达技术构建了过表达菌株。结果显示,与CS23菌株相比,编码角鲨烯环氧化酶的ERG1基因过表达菌株ERG1-OE1对苯并烯氟菌唑的敏感性显著降低,说明苯并烯氟菌唑可能会抑制角鲨烯环氧化酶的活性。此外,外源添加角鲨烯和麦角甾醇后,暹罗炭疽菌对苯并烯氟菌唑的药敏性显著降低,表明外源角鲨烯和麦角甾醇的添加增加了菌体内麦角甾醇的含量,可能通过减弱药剂对细胞膜完整性的破坏作用,降低了其抑制效果[36]。
综上所述,苯并烯氟菌唑不仅通过靶向SDH酶发挥作用,还能够抑制麦角甾醇合成酶相关基因的表达,从而阻断麦角甾醇合成途径,展现出多重作用机制。其中,ERG1基因的显著变化与中间代谢产物的积累及药敏性的改变密切相关,可能是苯并烯氟菌唑的关键作用靶标之一。本项研究的意义在于初步揭示了苯并烯氟菌唑抑制暹罗炭疽菌的分子机制,为炭疽病防治新药剂的筛选与应用提供了重要的理论依据。然而,本研究虽然利用基因过表达技术验证了关键合成酶的功能,但仍存在一定的实验局限性,尤其是药剂与靶标酶的直接结合尚需进一步实验证据。为克服上述局限,后续研究将通过酶活性测定、分子对接和基因敲除等实验方法,进一步验证和完善本研究的预测结果。这将有助于进一步揭示苯并烯氟菌唑抑制暹罗炭疽菌麦角甾醇合成的分子机制,为新型酰胺类杀菌剂的研发提供理论依据。
苯并烯氟菌唑抑制暹罗炭疽菌麦角甾醇生物合成机制初探
DOI: 10.15886/j.cnki.rdswxb.20250052
 CSTR: 32425.14.j.cnki.rdswxb.20250052
CSTR: 32425.14.j.cnki.rdswxb.20250052
Molecular mechanism of benzovindiflupyr inhibiting ergosterol biosynthesis in Colletotrichum siamense
-
摘要: 酰胺类杀菌剂凭借多样的化学结构和广泛的靶点,已成为农药研发的关键领域。然而,不同酰胺类杀菌剂在同一病原菌上的毒力差异尚未充分阐明,限制了其优化和应用。其中,苯并烯氟菌唑作为一种新型琥珀酸脱氢酶抑制剂(succinate dehydrogenase inhibitor,SDHI),表现出对炭疽菌的显著抑制效果,尤其是通过显著破坏细胞膜完整性展现了不同于传统SDHI类杀菌剂的机制。本研究旨在进一步探讨苯并烯氟菌唑的分子机制,揭示其对暹罗炭疽菌的多重抑制途径。通过转录组KEGG富集分析,发现苯并烯氟菌唑显著抑制了暹罗炭疽菌(Colletotrichum siamense)的甾类化合物合成途径。荧光定量PCR进一步验证了麦角甾醇合成途径中ERG1、cyp51a等关键基因表达显著下降。气相色谱−串联质谱(GC-MS/MS)分析显示,苯并烯氟菌唑处理后,暹罗炭疽菌的角鲨烯和麦角甾醇含量显著降低,羊毛甾醇含量增加。构建ERG1等5个麦角甾醇合成基因过表达菌株后,发现ERG1过表达菌株对苯并烯氟菌唑的敏感性显著降低,其他过表达菌株与野生型CS23菌株的药敏性一致。此外,外源添加角鲨烯和麦角甾醇显著降低了苯并烯氟菌唑的抑菌效果,尤其是在添加100 μg·mL−1麦角甾醇时,苯并烯氟菌唑对CS23菌株的抑制率降至25.18%,对ERG1-OE1菌株则无抑制作用。综上所述,苯并烯氟菌唑可能通过抑制ERG1基因的表达,阻碍麦角甾醇的合成,从而破坏暹罗炭疽菌的细胞膜,最终抑制其菌丝生长。本研究初步揭示了苯并烯氟菌唑对炭疽菌的分子作用机制,为新型酰胺类杀菌剂的研发提供了理论依据。Abstract: Amidine fungicides, with their diverse chemical structures and broad targets, have become a key area in pesticide development. However, the differences in toxicity among various amidine fungicides against the same pathogen have not been fully elucidated, limiting their optimization and widespread application. Among them, benzovindiflupyr, as a novel succinate dehydrogenase inhibitor (SDHI), showed significant inhibitory effects against Colletotrichum spp, especially by significantly disrupting the cell membrane integrity demonstrating a mechanism different from that of traditional SDHI fungicides. The aim of the present study was to further investigate the molecular mechanism of benzovindiflupyr and to reveal its multiple inhibitory pathways against C. siamense. The transcriptome KEGG enrichment analysis revealed that benzovindiflupyr, significantly inhibited the steroid synthesis pathway in C. siamense. Fluorescence quantitative PCR further verified that the expression of key genes in the ergosterol synthesis pathway, such as ERG1 and cyp51a, was significantly decreased. Gas chromatography-tandem mass spectrometry (GC-MS/MS) analysis showed that squalene and ergosterol contents of C. siamense were significantly decreased and lanosterol content was increased by benzovindiflupyr treatment. After constructing five ergosterol synthesis gene overexpression strains, including ERG1, it was found that ERG1 overexpression strains were significantly less susceptible to benzovindiflupyr, and the other overexpression strains were consistent with the drug sensitivity of wild-type CS23 strain. In addition, exogenous addition of squalene and ergosterol significantly reduced the inhibitory effect of benzoflumizole, especially at the addition of 100 μg·mL−1 ergosterol, the inhibitory effect of benzovindiflupyr was reduced to 25.18% against CS23 strain, while no inhibitory effect was observed against ERG1-OE1 strain. In summary, benzovindiflupyr may inhibit ergosterol synthesis by suppressing the expression of the ERG1 gene, thereby disrupting the cell membrane of C. siamense, and ultimately inhibiting mycelial growth. This study provides preliminary insights into the molecular mechanism of benzovindiflupyr against anthracnose fungi and offers theoretical support for the development of novel amide fungicides.
-
Key words:
- Colletotrichum siamense /
- Benzovindiflupyr /
- Ergosterol synthesis /
- Molecular mechanism
-
图 3 外源添加角鲨烯和麦角甾醇条件下苯并烯氟菌唑的抑菌效果
Be代表0.1 μg·mL−1苯并烯氟菌唑,squ100、200分别代表100、200 μg·mL−1角鲨烯,erg25、50、100分别代表25、50、100 μg·mL−1麦角甾醇。
Fig. 3 The inhibitory effect of benzovindiflupyr under the conditions of exogenous addition of squalene and ergosterol
Be represents 0.1 μg·mL−1 of benzovindiflupyr, squ100 and squ200 represent 100 μg·mL−1 and 200 μμg·mL−1 of squalene, respectively, while erg25, erg50, and erg100 represent 25 μg·mL−1, 50 μg·mL−1, and 100 μg·mL−1 of ergosterol, respectively.
表 1 本研究使用的引物
Table 1 Primer used in this study
引物名称
Primer name引物序列
Primer sequencesKL-CDS-cyp51b-F1 ATGGGTCTCCTGCAGGAGGT KL-CDS-cyp51b-R1 TTACGCCTCACGCTTCTCCC KL-CDS-cyp51a-F1 ATGAGCCCTCTCGTTGTCTATGG KL-CDS-cyp51a-R1 TCAATCACGTCGGGTCCACC KL-CDS-ERG1-F1 ATGATTGAGAGTCCGACAGCAGC KL-CDS- ERG1-R1 CTAGTTCAATTCGCGCCACAT KL-CDS-ERG7-F1 ATGGTCGTCGAGAAGAAAGCG KL-CDS-ERG7-R1 TTACTCCTTGCCGCTGATGC qp-cyp51a-F ACGTCGCAAGAACGGTGATA qp-cyp51a-R CTGACCTCCCATGAGAAGCG qp-cyp51b-F TGGAACAAGAAGCGCGATCA qp-cyp51b-R GTGCCGTTCTTGTAGGTGGA qp-ERG1-F GGCAAGACGAAGGACGACTA qp-ERG1-R GGAGGTACTCCTTGCGGAAC qp-ERG7-F TGCAAGGACTCGGACAAGTG qp-ERG7-R TGAGCGCCTCCGAAATACAG qp-β2-tubulin-F AGCCCTACAACGCCACTCTCT qp-β2-tubulin-R GTGGTTCAGGTCGCCGTAAG qp-ERG5-3F TCACGCCGAACTACACTGTCC qp-ERG5-3R ACATATCTTCGCGCAAGGCAA qp-ERG5-2F AATTCGTCGTTCTTGCATCCG qp-ERG5-2R CTTCGATACTCTGCGTGGTC qp-ERG6-2-F ATCAGACAGGCTCGTACAGCA qp -ERG6-2-R TGCCACCCTTGAGTCCCAT 1303 -FTTTGAACCTTTCAGTTCGAGCTTT 1303 -RCTGAATGCCCACAGGCC cz-cyp51b-F agacatcaccatggtagatct
ATGGGTCTCCTGCAGGAGGTcz-cyp51b-R ttctacaggacgtaaactagt
TTACGCCTCACGCTTCTCCCcz-cyp51a-F agacatcaccatggtagatct
ATGAGCCCTCTCGTTGTCTATGGcz-cyp51a-R ttctacaggacgtaaactagt
TCAATCACGTCGGGTCCACCcz-ERG1-F agacatcaccatggtagatct
ATGATTGAGAGTCCGACAGCAGCcz-ERG1-R ttctacaggacgtaaactagt
CTAGTTCAATTCGCGCCACATcz-ERG7-F agacatcaccatggtagatct
ATGGTCGTCGAGAAGAAAGCGcz-ERG7-R ttctacaggacgtaaactagt
TTACTCCTTGCCGCTGATGC注:小写字母代表线性化载体重叠序列。 Note:The lowercase letters represent an overlapping sequence of linearized vector. 表 2 苯并烯氟菌唑处理条件下的CS23菌株转录组GO和KEGG分析
Table 2 GO and KEGG analysis of differential genes of CS23 treated with benzovindiflupyr
ID 描述
Descriptionq 值
q-valueGO terms GO:0031224 膜内在成分
intrinsic component of membrane0.000089 GO:0044425 膜部分
membrane part0.009700 GO:0016020 膜
Membrane0.010000 GO:0071944 胞外
cell periphery0.049000 GO:0036387 Pre-RC 复合体
pre-replicative complex0.049000 GO:0003824 催化活性
catalytic activity0.013000 KEGG pathway ko00100 甾类化合物合成
steroid biosynthesis0.000560 ko00360 苯丙氨酸代谢
phenylalanine metabolism0.001100 ko01110 次级生物合成代谢
biosynthesis of secondary
metabolites0.002200 ko00380 色氨酸代谢
tryptophan metabolism0.002200 ko00500 淀粉和蔗糖代谢
starch and sucrose metabolism0.004000 ko00040 戊糖和葡萄糖醛酸酯途径
pentose and glucuronate
interconversions0.022000 ko02010 ABC 转运
ABC transporters0.022000 ko00052 半乳糖代谢
galactose metabolism0.045000 注:q值小于0.05代表显著富集。 Note: The q-value < 0.05 indicates significant enrichment. 表 3 苯并烯氟菌唑处理条件下的CS23菌株麦角甾醇生物合成基因相对表达量
Table 3 Relative expression of ergosterol biosynthesis gene in CS23 strain treated with benzovindiflupyr
基因ID
Gene ID基因名称
Gene name转录组结果
Transcriptome result荧光定量PCR结果
qRT-PCR resultncbi_
59275084ERG5 0.11 0.22±0.11 ncbi_
59276216cyp51a 0.17 0.17±0.06 ncbi_
59275085ERG5 0.18 0.16±0.06 ncbi_
59266665ERG6 0.22 0.19±0.03 ncbi_
59271246ERG1 0.43 0.48±0.02 ncbi_
59267068cyp51b 0.36 0.36±0.02 表 4 CS23菌株的10种甾醇类化合物GC-MS/MS鉴定结果
Table 4 Identification results of 10 sterol compounds by GC-MS/MS
序号
No.中文名称
Chinese name英文名称
English name保留时间/min
Retention time/min相对分子质量
Molecular weight分子式
Molecular formula1 角鲨烯 Squalene 17.04 410.7180 C30H50 2 羊毛甾醇 Lanosterol 24.23 426.7174 C30H50O 3 4,4-二甲基胆甾-8,14,
24-三烯醇4,4-dimethyl-cholesta-8,
14,24-trienol25.21 410.6749 C29H46O 4 4,4-二甲基酵母甾醇 4,4-dimethylzymosterol 22.74 412.6908 C29H48O 5 4α-甲基酵母甾醇-
4-羧酸酯4α-Methylzymosterol-4-
carboxylate24.95 442.6737 C29H46O3 6 酵母甾醇 Zymosterol 23.72 384.6377 C27H44O 7 粪甾醇 Fecosterol 23.20 398.6642 C28H46O 8 表甾醇 Episterol 23.40 398.6642 C28H46O 9 麦角甾烯醇 Ergosta-5,7,24(28)-trienol 21.99 396.6484 C28H44O 10 麦角甾醇 Ergosterol 22.60 396.6484 C28H44O 注:甾醇类化合物的排序依据麦角甾醇生物合成通路的先后顺序,从1至10依次排列。 Note: The sterol compounds are listed in the order of the ergosterol biosynthesis pathway, from 1 to 10. -
[1] 刘欢庆, 周双针, 高菁, 等. 暹罗炭疽菌同源异型盒转录因子CsHtf1的生物学功能[J]. 微生物学通报, 2023, 50(12): 5350 − 5362. doi: 10.13344/j.microbiol.china.230323 [2] 芦志成, 张鹏飞, 李慧超, 等. 中国农药创制概述与展望[J]. 农药学学报, 2019, 21(5/6): 551 − 579. doi: 10.16801/j.issn.1008-7303.2019.0086 [3] 路粉, 王文桥. 我国蔬菜杀菌剂及其应用状况[J]. 中国蔬菜, 2017(10): 6 − 13. doi: 10.19928/j.cnki.1000-6346.2017.10.002 [4] 马云云, 吴灿, 王兰芬, 等. 滇黄精炭疽病菌的初步鉴定及其对3种杀菌剂的敏感性[J]. 农药学学报, 2020, 22(5): 742 − 751. doi: 10.16801/j.issn.1008-7303.2020.0102 [5] 毛玉帅, 段亚冰, 周明国. 琥珀酸脱氢酶抑制剂类杀菌剂抗性研究进展[J]. 农药学学报, 2022, 24(5): 937 − 948. doi: 10.16801/j.issn.1008-7303.2022.0062 [6] 魏阁, 高梦琪, 朱晓磊, 等. 靶向琥珀酸脱氢酶的酰胺类杀菌剂的研究进展[J]. 农药学学报, 2019, 21(5/6): 673 − 680. doi: 10.16801/j.issn.1008-7303.2019.0095 [7] WANG Q, MAO Y S, LI S X, et al. Molecular mechanism of Sclerotinia sclerotiorum resistance to succinate dehydrogenase inhibitor fungicides[J]. Journal of Agricultural and Food Chemistry, 2022, 70(23): 7039 − 7048. doi: 10.1021/acs.jafc.2c02056 [8] 仇是胜, 柏亚罗. 琥珀酸脱氢酶抑制剂类杀菌剂的研发进展(Ⅰ)[J]. 现代农药, 2014, 13(6): 1 − 7. doi: 10.3969/j.issn.1671-5284.2014.06.001 [9] 柏亚罗. 琥珀酸脱氢酶抑制剂(SDHI)类杀菌剂研发进展及其重点产品评析[J]. 世界农药, 2022, 44(12): 6 − 25. doi: 10.16201/j.cnki.cn10-1660/tq.2022.12.02 [10] REBELLO C S, BAGGIO J S, FORCELINI B B, et al. Sensitivity of Colletotrichum acutatum species complex from strawberry to fungicide alternatives to quinone-outside inhibitors[J]. Plant Disease, 2022, 106(8): 2053 − 2059. doi: 10.1094/PDIS-09-21-1934-RE [11] OLIVEIRA M S, CORDOVA L G, PERES N A. Efficacy and baseline sensitivity of succinate-dehydrogenase-inhibitor fungicides for management of Colletotrichum crown rot of strawberry[J]. Plant Disease, 2020, 104(11): 2860 − 2865. doi: 10.1094/PDIS-01-20-0083-RE [12] ISHII H, ZHEN F, HU M J, et al. Efficacy of SDHI fungicides, including benzovindiflupyr, against Colletotrichum species[J]. Pest Management Science, 2016, 72(10): 1844 − 1853. doi: 10.1002/ps.4216 [13] ISHII H, WATANABE H, YAMAOKA Y, et al. Sensitivity to fungicides in isolates of Colletotrichum gloeosporioides and C. acutatum species complexes and efficacy against anthracnose diseases[J]. Pesticide Biochemistry and Physiology, 2022, 182: 105049. doi: 10.1016/j.pestbp.2022.105049 [14] FRAAIJE B A, BAYON C, ATKINS S, et al. Risk assessment studies on succinate dehydrogenase inhibitors, the new weapons in the battle to control Septoria leaf blotch in wheat[J]. Molecular Plant Pathology, 2012, 13(3): 263 − 275. doi: 10.1111/j.1364-3703.2011.00746.x [15] LIANG X Y, ZOU L J, LIAN W X, et al. Comparative transcriptome analyses reveal conserved and distinct mechanisms of the SDHI fungicide benzovindiflupyr inhibiting Colletotrichum[J]. Phytopathology® , 2022, 112(6): 1255 − 1263. doi: 10.1094/PHYTO-10-21-0420-R [16] HOU Y P, CHEN Y L, WU L Y, et al. Baseline sensitivity of Bipolaris maydis to the novel succinate dehydrogenase inhibitor benzovindiflupyr and its efficacy[J]. Pesticide Biochemistry and Physiology, 2018, 149: 81 − 88. doi: 10.1016/j.pestbp.2018.06.002 [17] 高杨杨. 琥珀酸脱氢酶抑制剂类杀菌剂对炭疽病菌的毒力差异机制[D]. 泰安: 山东农业大学, 2021. doi: 10.27277/d.cnki.gsdnu.2021.000053 [18] 黄慧, 王立, 胡志宏, 等. 培养基组分及培养条件对米曲霉麦角甾醇含量的影响[J]. 江西科技师范大学学报, 2021(6): 87 − 92. doi: 10.3969/j.issn.1007-3558.2021.06.017 [19] 陈雨, 张文芝, 周明国. 氰烯菌酯对禾谷镰孢菌分生孢子萌发及菌丝生长的影响[J]. 农药学学报, 2007, 9(3): 235 − 239. doi: 10.3321/j.issn:1008-7303.2007.03.006 [20] CAO Y X, SONG X N, XU G Y, et al. Study on the antifungal activity and potential mechanism of Natamycin against Colletotrichum fructicola[J]. Journal of Agricultural and Food Chemistry, 2023, 71(46): 17713 − 17722. doi: 10.1021/acs.jafc.3c05154 [21] JORDÁ T, PUIG S. Regulation of ergosterol biosynthesis in Saccharomyces cerevisiae[J]. Genes, 2020, 11(7): 795. doi: 10.3390/genes11070795 [22] UMEBAYASHI K, NAKANO A. Ergosterol is required for targeting of tryptophan permease to the yeast plasma membrane[J]. The Journal of Cell Biology, 2003, 161(6): 1117 − 1131. doi: 10.1083/jcb.200303088 [23] MOURITSEN O G, JØRGENSEN K. Small-scale lipid-membrane structure: simulation versus experiment[J]. Current Opinion in Structural Biology, 1997, 7(4): 518 − 527. doi: 10.1016/S0959-440X(97)80116-9 [24] HEESE-PECK A, PICHLER H, ZANOLARI B, et al. Multiple functions of sterols in yeast endocytosis[J]. Molecular Biology of the Cell, 2002, 13(8): 2664 − 2680. doi: 10.1091/mbc.e02-04-0186 [25] SCHNEITER R, BRÜGGER B, SANDHOFF R, et al. Electrospray ionization tandem mass spectrometry (Esi-MS/MS) analysis of the lipid molecular species composition of yeast subcellular membranes reveals acyl chain-based sorting/remodeling of distinct molecular species En route to the plasma membrane[J]. The Journal of Cell Biology, 1999, 146(4): 741 − 754. doi: 10.1083/jcb.146.4.741 [26] NÜRNBERGER T, BRUNNER F, KEMMERLING B, et al. Innate immunity in plants and animals: striking similarities and obvious differences[J]. Immunological Reviews, 2004, 198(1): 249 − 266. doi: 10.1111/j.0105-2896.2004.0119.x [27] LAQUITAINE L, GOMÈS E, FRANÇOIS J, et al. Molecular basis of ergosterol-induced protection of grape against Botrytis cinerea: induction of type I LTP promoter activity, WRKY, and stilbene synthase gene expression[J]. Molecular Plant-Microbe Interactions® , 2006, 19(10): 1103 − 1112. doi: 10.1094/MPMI-19-1103 [28] 刘洪涛, 高平挥, 曹永兵, 等. 气-质联用研究氟康唑对白念珠菌甾醇生物合成的抑制作用[J]. 中国药理学与毒理学杂志, 2002, 16(5): 368 − 371. doi: 10.3321/j.issn:1000-3002.2002.05.011 [29] 王添琦, 李祥, 李玲, 等. 气质联用法定量分析白念珠菌中甾醇含量[J]. 药学实践杂志, 2013, 31(4): 277 − 279. doi: 10.3969/j.issn.1006-0111.2013.04.010 [30] OUYANG Q L, TAO N G, JING G X. Transcriptional profiling analysis of Penicillium digitatum, the causal agent of citrus green mold, unravels an inhibited ergosterol biosynthesis pathway in response to citral[J]. BMC Genomics, 2016, 17(1): 599. doi: 10.1186/s12864-016-2943-4 [31] 刘雪, 关丽杰. 苯丙烯菌酮对水稻稻瘟病病原真菌细胞壁膜的作用[J]. 江苏农业科学, 2019, 47(22): 117 − 121. doi: 10.15889/j.issn.1002-1302.2019.22.026 [32] HU Z H, HE B, MA L, et al. Recent advances in ergosterol biosynthesis and regulation mechanisms in Saccharomyces cerevisiae[J]. Indian Journal of Microbiology, 2017, 57(3): 270 − 277. doi: 10.1007/s12088-017-0657-1 [33] HAYAKAWA H, SOBUE F, MOTOYAMA K, et al. Identification of enzymes involved in the mevalonate pathway of Flavobacterium johnsoniae[J]. Biochemical and Biophysical Research Communications, 2017, 487(3): 702 − 708. doi: 10.1016/j.bbrc.2017.04.120 [34] 刘凤华, 马迪成, 张晓敏, 等. 植物病原真菌对甾醇脱甲基抑制剂类杀菌剂抗性分子机制研究进展[J]. 农药学学报, 2022, 24(3): 452 − 464. doi: 10.16801/j.issn.1008-7303.2022.0008 [35] HOFFMEISTER M, ZITO R, BÖHM J, et al. Mutations in Cyp51 of Venturia inaequalis and their effects on DMI sensitivity[J]. Journal of Plant Diseases and Protection, 2021, 128(6): 1467 − 1478. doi: 10.1007/s41348-021-00516-0 [36] TURK M, PLEMENITAŠ A, GUNDE-CIMERMAN N. Extremophilic yeasts: plasma-membrane fluidity as determinant of stress tolerance[J]. Fungal Biology, 2011, 115(10): 950 − 958. doi: 10.1016/j.funbio.2011.04.006 -




 下载:
下载: