-
木薯渣(Manihot esculenta Crantz)是木薯淀粉生产的主要固体废弃物,中国年木薯渣产量超过100万吨[1]。目前木薯渣的处理方式主要包括填埋、生物质燃烧、动物饲料和化学处理等处理方式[2]。但木薯渣体积大且水分含量高,填埋处理需要大量空间,不利于土地的有效利用[3]。木薯渣燃烧虽可回收热能,但会释放颗粒物(Particulate Matter)、硫氧化物(Sulfur Oxides)、氮氧化物(Nitrogen Oxides)、一氧化碳(Carbon Monoxide)及挥发性有机物(Volatile Organic Compounds)等污染物,会产生潜在污染排放问题。值得注意的是,木薯渣中含有大量的纤维素、半纤维素以及部分未利用的淀粉残留,契合厌氧发酵技术的要点[4]。与传统处理方法相比,木薯渣废弃物通过厌氧发酵不仅能将有机物转化为清洁能源甲烷,降低能源消耗和碳排放,还能生成高价值的有机肥料,实现废弃物的资源化利用[5]。厌氧发酵过程受多种因素影响,如底物类型、浓度、温度、盐分、pH、氨氮、接种物等,其中发酵温度直接影响微生物的群体组成及底物转化特性[6]。其次,发酵浓度(即发酵液中总固体含量,total solid,TS)直接影响厌氧发酵效率及其经济性,过低的TS可能导致产气效率降低,而过高的TS则可能导致体系传质受阻,挥发性脂肪酸(VFAs)积累,甚至引发酸化失稳[3]。Cao[7]等研究了不同温度对微生物群落和代谢物的影响,在不同的发酵温度下(22 °C、30 °C、38 °C和45 °C),38 °C被认为是早期发酵阶段乳酸和乙醇积累的最佳温度,强调了温度对发酵过程的重要性。Mutezo[8]等对厌氧发酵接种量进行研究发现,接种量过低可能导致发酵启动时间延长甚至失败,而过高的接种量则可能造成基质利用率下降,增加发酵成本。
本文以木薯加工产生的木薯渣有机固废为研究对象,探究其在中温(37±1)℃、高温(60±1)℃下,不同发酵TS浓度(w/10%、w/20%、w/30%)及接种量(w/30%,w/50%)的序批式发酵特性,探讨不同因素对木薯渣产甲烷特性、潜力及物质转化过程的影响,明确发酵过程的主导功能性微生物及其代谢特性,以期为木薯渣废弃物厌氧发酵工艺的启动和运行提供关键参数支撑,为其他纤维素类生物质厌氧发酵系统的优化设计提供参考。
-
实验所用木薯渣购自广西武鸣县骅瑞木薯淀粉厂,木薯渣收集到密闭的容器中,放置在4 °C的冰箱中储存备用。实验所用的接种物(沼液)取自黑龙江省哈尔滨市双城现代牧业养牛场粪污处理工艺的出料。木薯渣和接种物的主要理化指标如表1所示。
表 1 木薯渣及接种物的特性
Table 1. Characteristics of cassava residues and inoculum
参数
Parameter木薯渣
Cassava residues沼液
Biogas slurrypH 6.05 7.82 ORP(mv) −269 −362 TS(%) 35.77 3.15 TN 29.95(g·kg−1) 12.56(mg·L−1 ) TP 10.20(g·kg−1) 75.64(mg·L−1 ) SCOD(mg·L−1 ) 21 248 3 022 -
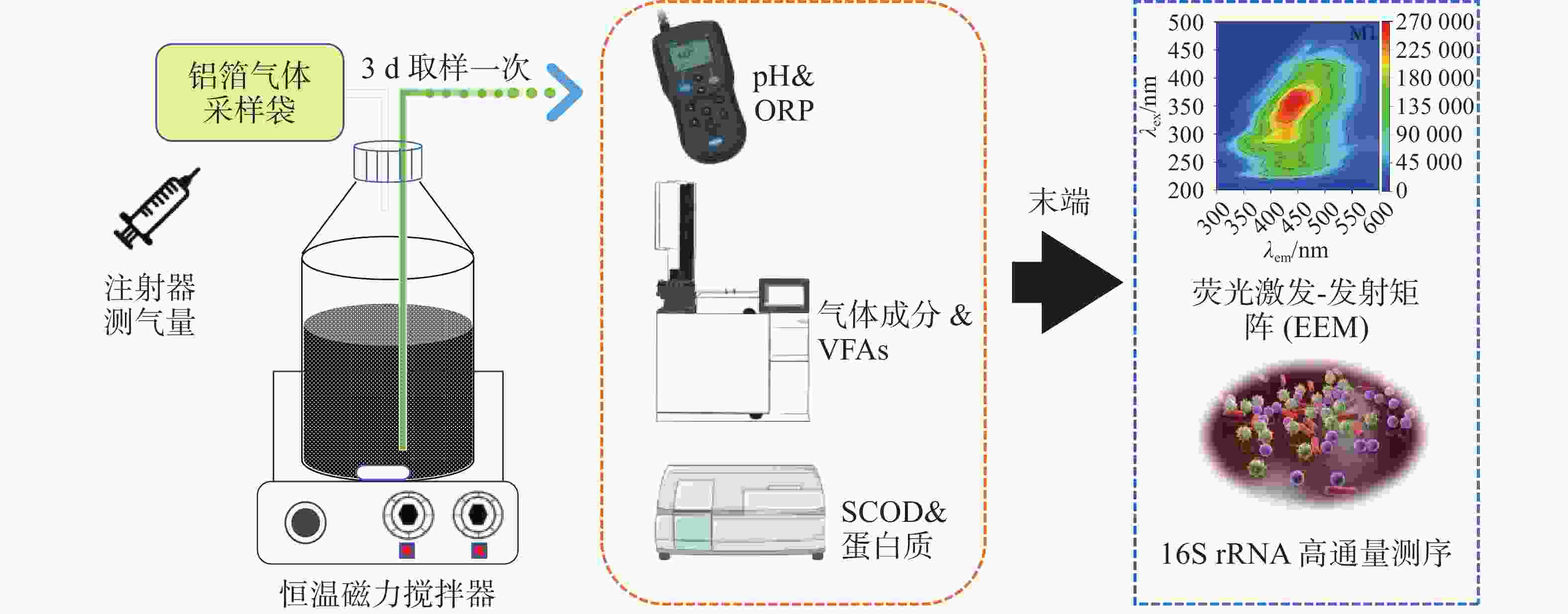
实验采用全混合序批式厌氧发酵系统,具体采用6个体积为1 L的厌氧瓶进行厌氧发酵,有效发酵体积为800 mL,发酵及指标测试示意如图1所示。当前厌氧发酵温度一般为中温发酵和高温发酵,因此温度选择了37℃与60℃、底物投加量即底物浓度,实验室规模通常会选择1% TS~10% TS不等,工程运行中试试发酵的TS通常为5%左右,因此本研究中分别选择(150.3 g、100.2 g和50.1 g),接种量通常设置为总发酵体积的10%~30%,而我们课题组之前的实验中发现对于难降解的有机物厌氧发酵产甲烷,启动阶段加大接种量能够缩短启动时间,因此本研究中接种物设置为w/30%和w/50%,即150 mL和250 mL。在保持总发酵液体积恒定(500 mL)的前提下,这些组合旨在:1)比较中温与高温条件下的产甲烷性能(如M2与M3对比);2)评估不同有机负荷即不同浓度下(即不同TS)对体系稳定性及产甲烷产率的影响(本研究中M1、M3、M4的梯度对比);3)考察提高接种量是否能缓解酸化并提升产甲烷(如分析M1和 M5;M2和 M6)。启动所用接种物(沼液)在接种之前进行驯化7 d,目的是使微生物适应目标底物,提升其生存和代谢能力。实验设计如表2所示,具体操作过程如下:木薯渣按照10%,20%,30%的TS浓度进行稀释,控制底物总体积为500 mL,再分别投加底物体积30%和50%驯化后的沼液混匀,在恒温磁力搅拌器上以37℃和60℃条件下进行厌氧发酵。实验运行至39 d结束,为了监测不同实验组的发酵过程,发酵液和气体每3 d收集一次,对液相代谢产物及各项指标进行分析测试。厌氧发酵装置开始启动前进行了气密性检查,确保启动实验的厌氧环境和集取沼气产量的准确性。
表 2 实验设计参数
Table 2. Experimental design parameters
组
Group温度/℃
Temperature/℃木薯渣/g
Cassava Bagasse/g发酵浓度
Fermentation
concentration接种物/mL
Inoculum/
mL接种比
Vaccination ratio总发酵液量/mL
Total fermentation
broth volume/mLM1 37 150.3 30% 150 30% 500 M2 60 100.2 20% 150 30% 500 M3 37 100.2 20% 150 30% 500 M4 37 50.1 10% 150 30% 500 M5 37 150.3 30% 250 50% 500 M6 60 50.1 10% 250 50% 500 -
产气量采用集气袋收集,并用注射器在气袋取样口抽取计量气量。采用气相色谱仪测定(GC9790plus, Fuli, China)、热导检测器和填充柱分析沼气成分。载气采用氩气(纯度 > 99.999%)。VFAs浓度的测定,液体样品以9 000 r/min离心20 min,通过0.22 μm膜过滤。采用配备火焰电离检测器(FID)和毛细管柱的气相色谱仪测定,进样器、色谱柱和检测器的温度分别设置为80、180和250℃。pH用Kedida CT-6023pH计测定。溶解性化学需氧量(Soluble Chemical Oxygen Demand,SCOD)使用HACH-DR2800用分光光度计法测定。氧化还原电位(ORP)用上海精密仪器公司生产的C220-ORP测定仪测定。蛋白质浓度采用BCA考马斯亮蓝方法测定。总固体(TS)采用(105±5)℃烘干恒重法测定。
$$ 总固体({\mathrm{TS}}): \text{TS}(\mathrm{\% })=\frac{W1}{W0}\times 100\mathrm{\% } $$ (1) 式中:W0为样品质量,g;W1 为样品干燥至恒重后的质量,g。
原料的产气率,产甲烷计算公式:
$$ {\mathrm{TS}}产气率: V_{TS}=\frac{H}{W0\times TS} \text{,} $$ (2) $$ 原料产气率: V\text{r}=\frac{H }{W0} \text{,} $$ (3) $$ {\mathrm{TS}}产甲烷率: {V}^{\prime}_{TS}=\frac{H0}{W0\times TS} $$ (4) 式中:H为累积产气量,mL;H0 为累积产甲烷量,mL;TS为总固体含量。
-
采用修正的Gompertz模型对厌氧消化累积产气量进行动力学拟合分析,公式如下:以R2用于评价模型拟合优度,R2越高模型拟合度越好。
$$ H=H{_\text{max}} {\mathrm{exp}}\left\{-\text{exp}\left[\frac{R_{{\mathrm{max}}} e}{H_{{\mathrm{max}}} }\left(\lambda \text-t\right)+1\right]\right\} $$ (5) 式中:H为累积产甲烷量,mL;Hmax为最大累积产甲烷量,mL;Rmax为最大产甲烷速率,mL·d−1;e为自然常数,2.718 281 828;λ为延迟时间,h;t为发酵时间,h。
-
为了明确不同发酵条件下微生物的分布特征,委托上海美吉生物医药科技有限公司对厌氧反应器进行微生物群落分析。在反应运行稳定后分别从反应瓶中取3~10 mL样品于离心管中放置在−80 °C的冰箱中作为微生物高通量测序分析样品。细菌V3-V4区用引物338F/806R扩增,古菌V4-V5区用引物524F扩增。扩增程序如下:95℃预变性3 min,27个循环(95℃变性30 s,55℃退火30 s,72℃延伸30 s),然后72℃稳定延伸10 min,最后在4℃进行保存(PCR仪:ABI GeneAmp®
9700 型)。使用2%琼脂糖凝胶回收PCR产物,利用DNA凝胶回收纯化试剂盒(PCR Clean-Up Kit,中国逾华)进行回收产物纯化,并用Qubit 4.0 (Thermo Fisher Scientific, USA)对回收产物进行检测定量。使用NEXTFLEX Rapid DNA-Seq Kit对纯化后的PCR产物进行建库:(1)接头链接;(2)使用磁珠筛选去除接头自连片段;(3)利用PCR扩增进行文库模板的富集;(4)磁珠回收PCR产物得到最终的文库。利用Illumina PE300/PE250平台进行测序(上海美吉生物医药科技有限公司)。数据在美吉云平台上进行分析。 -
为解析溶液中溶解性有机物的组分特征,本研究采用三维荧光光谱技术(EEM)进行综合表征。基于HITACHI F-
4600 型荧光分光光度计,首先将水样通过0.45 μm滤膜过滤,以去除悬浮颗粒物干扰。测试参数经系统优化:激发光谱(Ex)覆盖200~450 nm波段,间隔为5 nm;发射光谱(Em)采集280~550 nm区间,间隔为2 nm;扫描速率设为2 400 nm·min−1,响应时间配置为0.002 s。获取的原始光谱数据经MATLAB 2022a平台处理,通过内置算法校正拉曼散射与瑞利散射效应,确保荧光信号的精确解析。 -
产气量是评价厌氧发酵效果最直观的参数。如图2-a,2-b,2-d所示:反应过程持续了39 d,不同参数配伍对产甲烷发酵过程产生显著的影响,整体呈波动状态,符合复杂有机物批式发酵实验规律,实验组M1,M3,M4,M5,M6均在第3 d达到产气峰值,分别为2 750 mL,1 970 mL,1 035 mL,650 mL,2 650 mL。随后产气量迅速下降,这可能归因于底物中易降解的有机物如淀粉、糖类等迅速消耗,然而随着纤维素,半纤维素的持续性的水解,M2组分别在第12 d和第15 d出现大幅度上升,达到产气的第二个峰值。发酵进行15 d,产气量回收率占比84.25%。当发酵累计到39 d时,M6实验组获得了最大的产气量8 331 mL,较M1组提高153.7%。值得注意的是M3组,在30 d到达了产气的第二次峰值,这可能是由于TS为20%的条件下,底物浓度较高,意味着底物的降解和转化需要更多的时间。较高的TS可能导致底物降解不完全,增加了系统中的传质阻力,只有较低的接种量会导致微生物这会影响微生物的活性和数目并延长产气的延滞期。
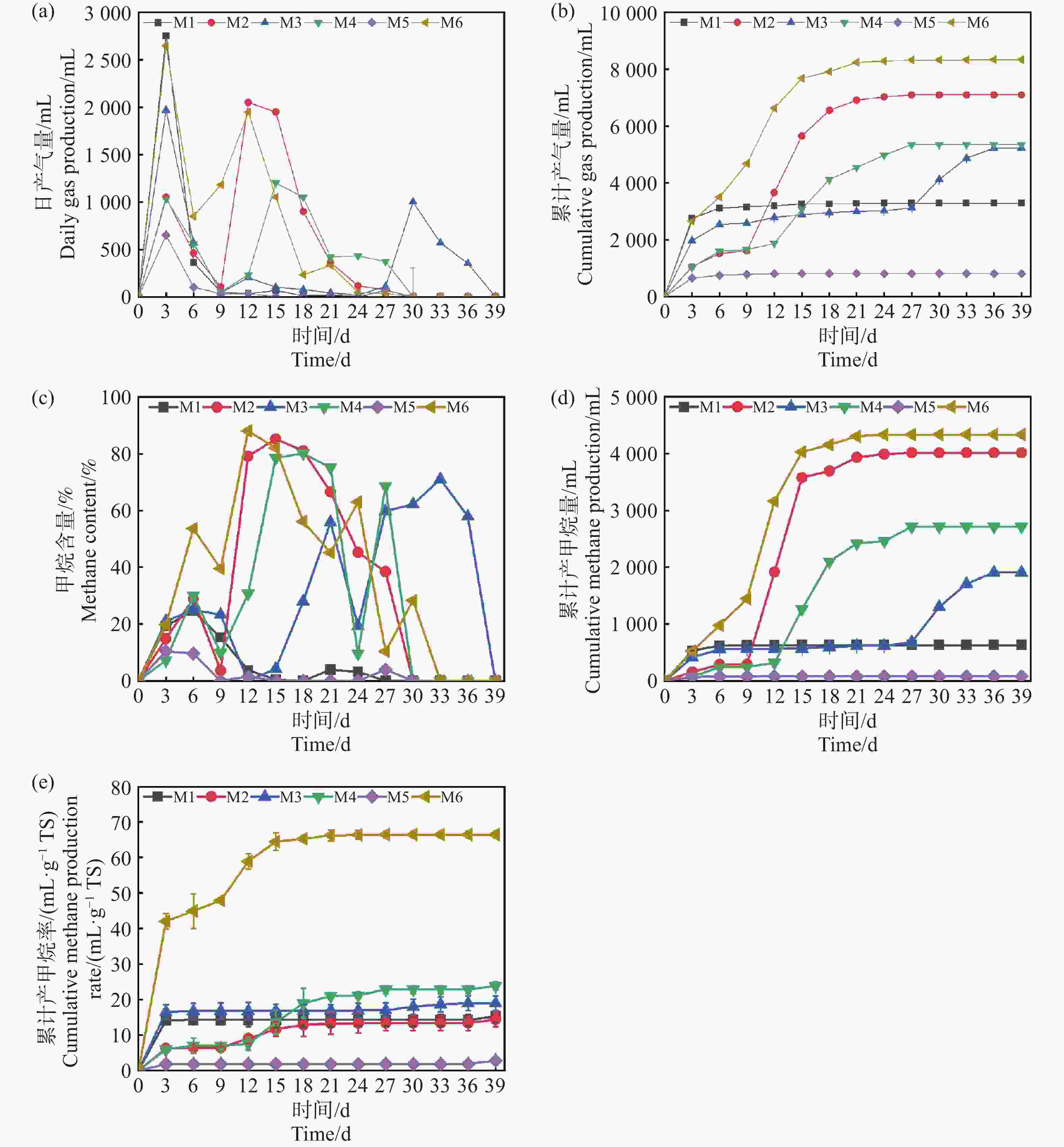
图 2 日产气量(a),累计产气量(b),甲烷含量(c),累计产甲烷量(d)和累计产甲烷效率(e)随厌氧发酵时间的变化
Figure 2. Changes in daily gas production (a), cumulative gas production (b), methane content (c), cumulative methane production (d), and cumulative methane production efficiency (e) with anaerobic fermentation time
根据图2-c可知,除M6组在第9 d时,甲烷的含量达到了39.86%,基本上符合厌氧发酵产甲烷的正常水平。M1-M5组的甲烷体积分数处在1.25%~22.43%,反应了这些发酵系统中微生物还在适应发酵环境,消耗的营养物质主要用于自身繁殖,因此沼气中甲烷含量较低,而二氧化碳的含量较高[9]。自第9 d开始,产甲烷量开始逐步提升。在15 d前后,各组的产甲烷含量都能达到>50%,代表实验组都实现了正常的厌氧消化产沼气的过程。需要指出的是,虽然部分实验组(如M5)在第9 d以后产气量几乎降为零,但其甲烷体积分数仍然能够提升至50%以上,这表明气体成分的变化与累计产气量并非完全同步,其原因可能在于系统中残余有机物降解速率下降、产气动力不足,但甲烷菌群体已逐渐稳定,因而气体质量改善而产量下降。同时,M6组在产气量与甲烷含量方面均表现最优,但与M4、M1、M2等组的比较并非单一因素控制,而是不同条件叠加效应的结果。例如,M6与M4虽然木薯渣添加量一致,但接种量和发酵温度均存在差异,这种跨条件对比的意义在于突出木薯渣与其他参数的协同效应,而非单因素作用的直接体现。类似地,M6与M1和M2的对比,旨在说明在不同TS和接种量配合下,木薯渣添加比例对体系产气潜力的放大作用。
如图2-e所示,M6经过前期产甲烷效率波动之后在第12 d达到最高产率139.2 mL·g-1 TS。相比于相同接种量50%的M5组,底物产甲烷率提高了94.6%,这说明高温条件下,发酵反应速率比中温快,产气率更高,底物降解更彻底。M6与M4平行对比,M6在更高接种量的情况下,产甲烷效率要比M4更好,原因在于更高的接种量,在反应初期可以拥有更多有效微生物,使反应启动更加迅速,这可以作为沼气工程上有效的启动手段之一。M6与M1,M2对比,不同的TS情况下,虽然TS高在理论上具有更多的原料,但实验得出结果刚好相反,反之较低TS浓度,10%的情况下产甲烷效率更高,这说明了过高的TS虽然在理论上有更多的底物,更高的发酵潜力,但也有更高的产生底物抑制的风险,这也与Pastor等[10]的研究结果一致。从反应动力学的结果可以得出(表3),M6组表现出最优的产甲烷能力,其最大产甲烷量(Pm)和最大产甲烷速率(Rm)均为最高,且延滞期适中,表明其底物降解效率高,微生物活性强,甲烷生成条件得到充分优化。M5组的产气最差,其最终产气量和产甲烷速率极低,仅有810 mL和3.45 mL·g−1 TS,可能与底物难降解性和微生物活性不足有关,这可能是由于过高的TS,导致了过高的氨氮水平致使氨氮抑制。
表 3 不同组木薯渣厌氧发酵产甲烷动力学分析
Table 3. Kinetic analysis of methane production from anaerobic fermentation of cassava residues in different groups
组 Group Pm(mL·g−1 TS) Rmax(mL·g−1 TS·h) λ(h) R2 M1 16.79±0.01 0.31±0.016 15.66± 2.89 0.99±0.02 M2 185.39±1.41 1.18±0.07 219.82± 5.41 0.99±0.04 M3 193.02±1.65 1.05±0.047 714.83± 56.92 0.99±0.06 M4 216.64±3.68 1.08±0.12 265.47± 11.52 0.99±0.03 M5 2.12±0.01 0.03±0.01 14.54± 14.02 0.99±0.02 M6 351.68±5.69 1.38±0.14 94.32± 13.51 0.99±0.01 -
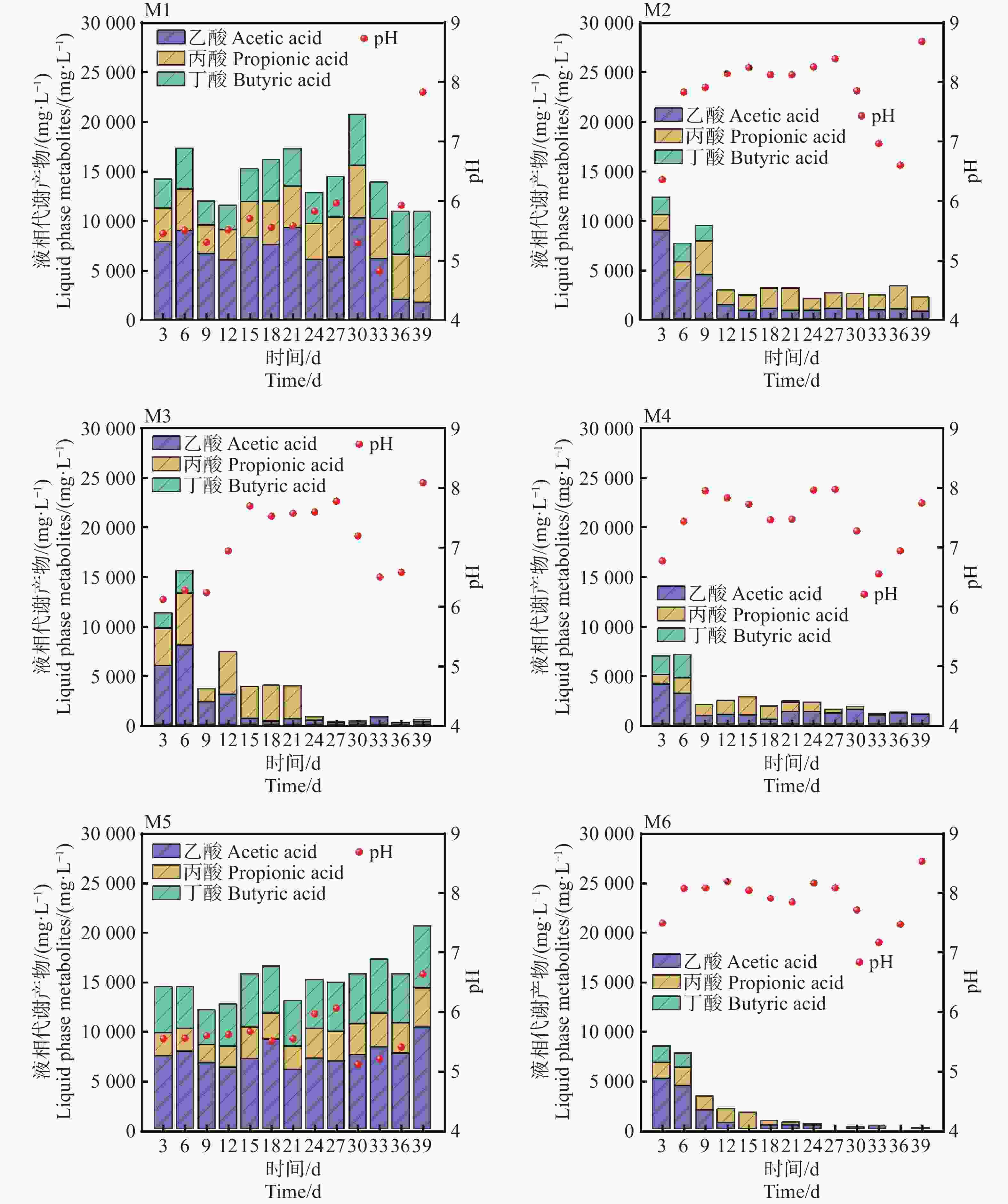
pH是影响发酵细菌生长的重要参数,通常甲烷菌的适宜生长的pH范围为6.5~7.8之间[11]。如图3所示,M6在发酵初期(0~6 d)从7.8降低至7.2,主要是溶解性有机物迅速降解,生成挥发性脂肪酸(VFAs)的积累导致体系pH下降。随着甲烷的生成,发酵体系的pH逐渐回升,在6~18 d,pH基本维持在7.8~8.2之间,相比较于其他实验组,M6组pH波动最小,这表明较低的TS和较高的接种量具有一定程度的pH缓冲能力,这也与Yi等[12]以厨余垃圾为底物中温厌氧发酵的结论一致。在发酵后期(27~39 d)M2,M3,M4,M6组,pH回升后趋于稳定,而M1,M5在30 d,pH降低到了4.95和5.33,该环境对产甲烷菌已经产生了严重的抑制作用,这也是M1,M5产甲烷效果不佳的原因。进一步对发酵液进行分析可知,乙酸、丙酸、丁酸是厌氧发酵过程中最重要的中间代谢产物。M4和M6组在6 d达到峰值8 946 mg·L−1和7 994 mg·L−1,随着甲烷的大量生成,VFAs浓度迅速降低,尤其是乙酸浓度,在39 d,乙酸的浓度降低到57 mg·L−1。对于M6实验组,乙酸去除率几乎达到100%,可能是因为在较低TS条件下(且)具有更高接种量的情况下能够获得更高的底物转化效率,这也是M6组pH和产气更加稳定的原因[13]。然而,M1和M5组从起始至反应结束,VFAs一致呈现较高浓度的积累,最高的浓度达到21 652 mg·L−1和
21349 mg·L−1,其中乙酸占比51.42%。随着乙酸浓度增加,产气速率逐渐变慢,可以看到几乎所有组均在第6~9 d达到峰值,过高的VFA积累推测是引起pH下降和产气停止的主要原因。 -
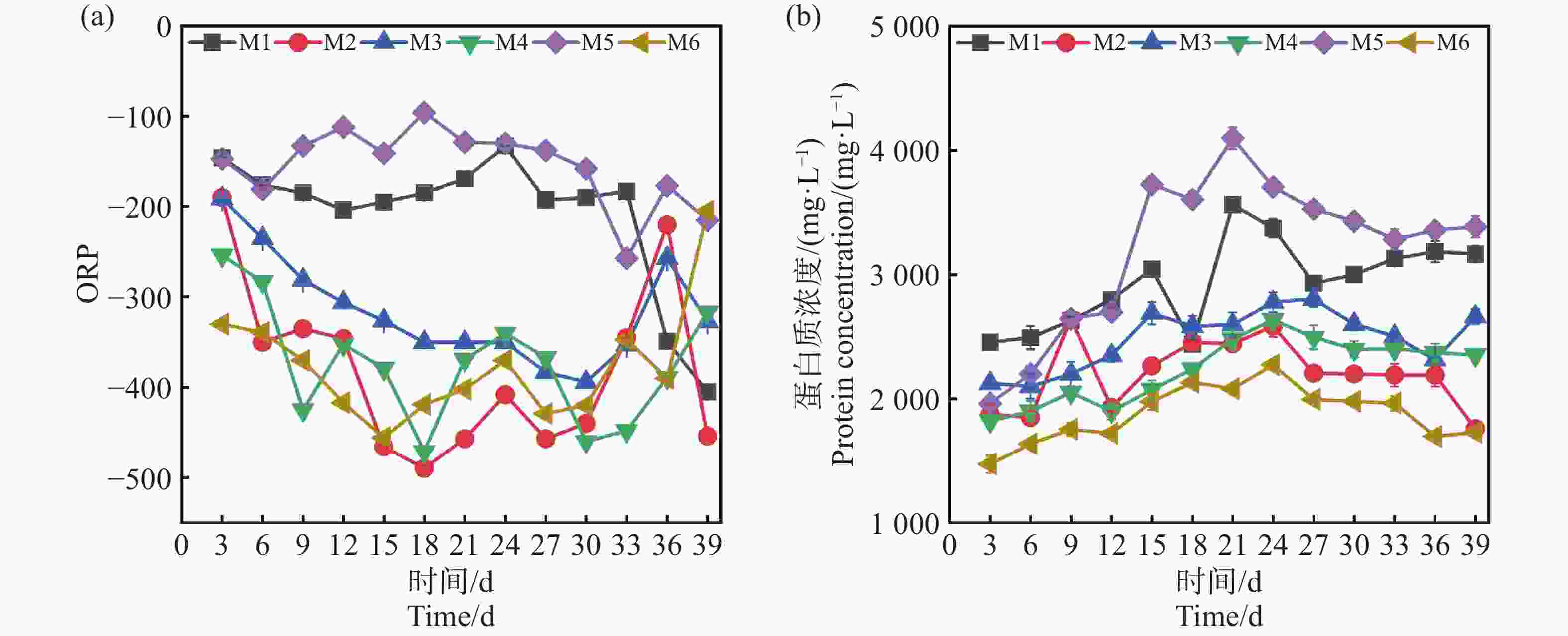
ORP是衡量厌氧发酵环境稳定性的重要指标。一般ORP低于−300 mV表明体系处于良好的厌氧状态,有利于产甲烷菌的活性和甲烷的生成[14]。如图5-a,M6从启动初期至反应结束一直稳定在<−300 mV,而M1,M5一直>−200 mV,不利于产甲烷菌的正常代谢过程,这也是M1,M5产气不佳的原因,可能归因于过高的TS导致体系内部的传质阻力增大,影响微生物的活性,致使有机物分解速率较慢,产生的还原性物质不足,从而导致ORP一直处于较高的指标[12],其次是在中温的条件下,微生物的代谢速率和反应速率变慢,体系达到稳定厌氧环境所需的时间更长,因此长期维持在−200 mV至−300 mV[15]。
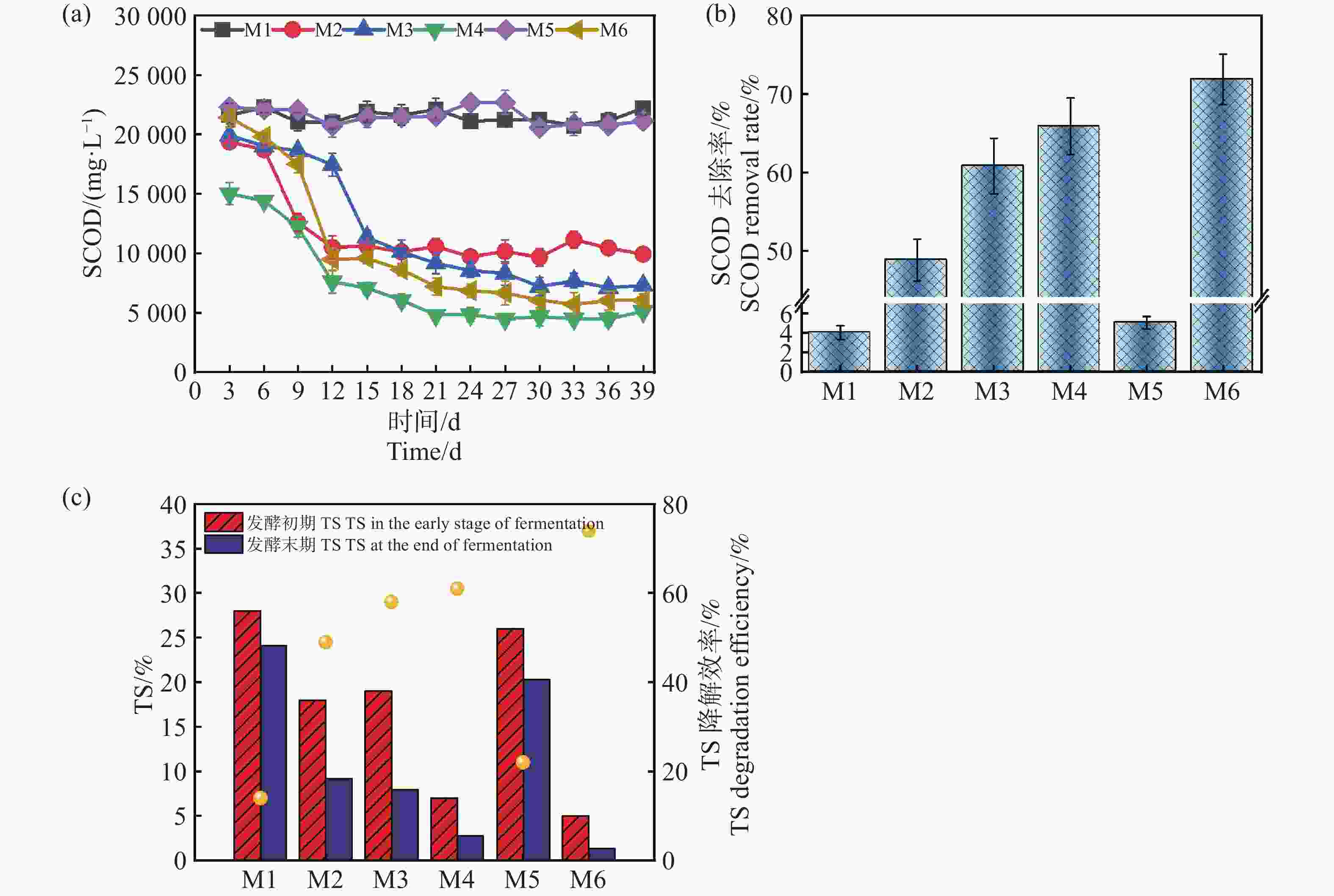
图 5 SCOD去除率随厌氧发酵时间的变化和TS降解率
Figure 5. Changes in SCOD removal rate with anaerobic fermentation time and TS degradation rate
蛋白质在厌氧发酵中能提供微生物生长所需要的氮源、维持碳氮平衡和提供产甲烷过程的底物[16]。如图5-b所示,0~9 d所有组的蛋白含量均呈现上升的趋势,表明在发酵初期微生物活性逐渐增强,群体增长导致蛋白质初始累计。在12 d后,相较于其他组缓慢增加,M1和M5的蛋白浓度进一步快速累积,M5在18 d达到了峰值4 329.2 mg·L−1,M1在21 d达到了3 566.3 mg·L−1,这表明较高浓度的蛋白含量下游离氨的浓度可能会升高[17]。而蛋白的分解释放出的氨基酸进一步分解生成游离氨和铵根离子,对微生物的毒性随着浓度增加和增强进而影响M2和M5的产气,其次,蛋白的分解还会释放VFAs,可以看到M1和M5在后期均出现了不同程度的酸化,这也是由于蛋白的含量高VFAs积累快未能及时转化,导致了体系酸化pH降低,也是造成产气量不佳的一个诱因[17]。而产气量最优的M6组,从开始到39 d反应结束一直保持在1 800 mg·L−1左右,并没有受到氨氮堆积的抑制,这可能是由于较低的TS基质稀释程度较高,传质效果更好致使微生物的活性更高[12]。因此,在厌氧系统实际运行中,较高的接种量在反应初期就有利于快速启动,并且使底物得到快速降解,在保证产气率与系统稳定性时,可以需要根据实际情况作出合理的选择。
-
如图5-a所示,发酵组的TS(总固体含量)降解率表现出显著差异,与实验设计条件、微生物活性、底物利用效率和产甲烷性能等密切相关。在发酵初期测出的TS含量不同,可能是由于加入了不同接种量的沼液导致了初始值的变化。M6组的TS初始值最低(5.02%),降解后仅剩1.3%左右,降解效率达到约74%,可能源于底物的有效降解和微生物代谢效率的显著提升,也表明该组的配伍条件利于厌氧发酵达到较优的状态,底物水解酸化和甲烷化阶段均得到了有效协调[18]。然而M1组的初始TS浓度为28%,TS降解效率最低,仅为约14%,这可能与其微生物活性不高有关。M2、M3和M4组的TS降解效率分别为49%、58%和61%,表现出中等的降解效果。尽管M2组具有较高的蛋白含量,却未能显著高TS的降解率,这可能是由于较高的蛋白质含量可能导致氨氮的积累,特别是在高温条件下,氨氮浓度可能升高,进而抑制产甲烷菌和其他有机物降解微生物的活性,造成降解效率的降低,这与Sunar[19]等的结论相似。值得注意的是,M5组的初始TS浓度为26%,降解效率为22%,对比M1组,同时结合前面的分析,M5组的厌氧发酵过程可能存在微生物活性受抑制或厌氧条件不稳定等问题,但降低发酵浓度,厌氧体系呈现恢复的趋势[3]。这些结果进一步说明,较低的TS配合较高的接种量,在高温条件下具有更好的发酵前景,这也与Yin[20]等人的研究成果相似。
可溶性化学需氧量(SCOD)也是衡量厌氧发酵过程中有机物浓度的重要指标,反映了体系中可被微生物利用的溶解性有机物含量。SCOD的含量和降解率直接影响甲烷的产量及厌氧发酵的效率[21]。由图5-b和5-c可知,除M1,M5发酵组外,M2,M3,M4,M6整体趋势是先降低再趋于平稳,其中M6组从起始的22 325 mg·L-1到发酵39 d,降低到了6 072 mg·L−1,降解率达到71.25%。结合发酵数据,可知在处理难降解的复杂物质时,高温耦合较高的接种量能够加速有机物的水解和酸化过程,本研究促进了木薯渣中的复杂有机物快速转化为SCOD的过程,提高了底物的可利用性。同时,较高的接种量保证了系统中有足够的微生物数量和活性,有助于进一步高效地将SCOD转化为甲烷。此外,高温条件下的微生物群落结构趋于优化,甲烷菌活性增强,系统稳定性更高,从而实现了SCOD的高降解率和甲烷产量的提升。然而M1,M5组降解率分别仅为4.7%,5.6%,表明底物只发生了水解过程,并未完成产甲烷过程,这与M1,M5组产气产甲烷规律相吻合。进一步分析,M1组表现SCOD降解率低的原因可能来源于接种量较低,致使体系内微生物数量不足以抵抗底物中重金属、抗生素、盐度等的抑制环境,这与苗荪[22]等的研究结果一致,微生物数量不足无法高效的降解高TS的发酵物。较高的TS浓度增加了底物的传质阻力,抑制了微生物的降解效率,同时高浓度的氨氮可能抑制了产甲烷菌的活性。过高的接种量加剧了氮源的竞争,导致氨氮积累,进一步影响了微生物的代谢平衡和发酵效率。因此,过高的TS和接种量导致了M5组发酵效率和SCOD降解率较低。
-
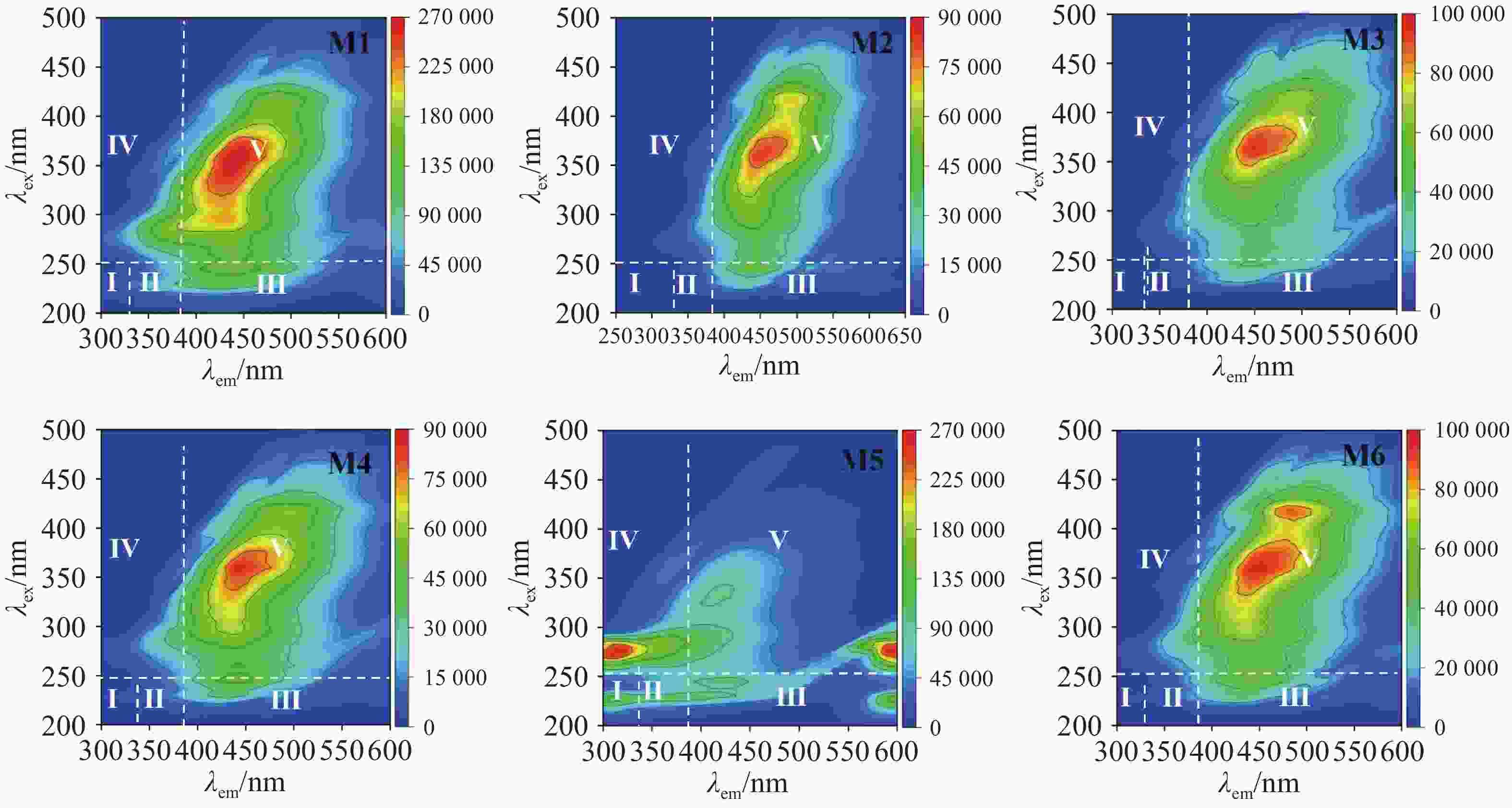
通过荧光的强弱对厌氧发酵后沼液中的溶解性有机物(Dissolved Organic Matter)进行分析,可以根据激发-发射波长(Ex/Em)将光谱图划分为5个区域:Ⅰ(220~250 nm/280~330 nm),Ⅱ(220~250 nm/330~380 nm),Ⅲ(220~250 nm/380~550 nm),Ⅳ(250~400 nm/280~80 nm),Ⅴ(250~400 nm/380~550 nm),这些区域分别对应酪氨酸类蛋白质(Tyrosine-like Proteins)、色氨酸类蛋白质(Tryptophan-like Proteins)、富里酸类物质(Fulvic Acid-like Substances)、溶解性微生物代谢产物(Soluble Microbial By-produc)和腐殖酸类物质(Humic Acid-like Substances)[23]。由图6可以看出,除M5组外,各实验组荧光物质区域大致相似,仅在荧光强度上有所不同。所有实验组在Ⅳ和Ⅴ区域显示出荧光峰,这表明由于微生物的活跃,大量代谢产物进入沼液,导致SMP含量较高,随着腐殖化过程的进行,HA也逐渐积累。由于木薯渣中蛋白质含量较低,且厌氧发酵微生物群落主要优先降解糖类和纤维素类物质。此外,厌氧环境下,微生物代谢更倾向于能量释放和甲烷生成,氨基酸类物质的降解较为缓慢。高TS浓度和高温等发酵条件也可能抑制了TR和TP的降解,因此导致TR、TP代谢产量较少。而FA在腐殖化过程中会逐渐转化为HA,因此累积较少。而M5组在Ⅰ、Ⅲ、Ⅳ、Ⅴ中均有荧光峰出现,多个荧光峰表明其体系中存在较多未降解的大分子有机物,蛋白类物质荧光峰强度较高,对应有机物降解速率较低,SCOD降解率和产甲烷量也较低,蛋白类物质没有被快速分解利用,这与蛋白质数据相吻合,并且类腐殖质物质的荧光强度未明显降低,说明复杂大分子物质降解不充分,这也是M5产气产甲烷效果不好的原因之一,这也与石玉飞等人的研究结果相似[24]。相反,M6蛋白质类荧光峰最低,类腐殖质物质的荧光强度显著下降,这表明该组的蛋白质类和类腐殖质物质的分解与转化彻底,积累量少[25]。
-
通过高通量测序对不同发酵组的微生物群落进行分析,有助于了解不同配伍参数对种群分布及它们之间的相互作用关系以及分析在优化的发酵系统中和木质纤维素降解的功能菌分布情况,为优化、强化和调控厌氧发酵系统的运行状态提供了参考依据。表4为不同发酵组的细菌和古菌测序获得的Alpha多样性指数统计结果。从表中可看出,各个样品文库覆盖度均大于92%,表明本次测序获得的数据能准确地代表各样本的真实情况。表征丰富度的ACE指数和Chao1指数结果显示M6略高于其他组,表征多样性的Shannon指数结果显示,M6也是多样性多于其他组。而与之相反的是M5,产甲烷相古菌的比较可以看出,表征多样性的Shannon指数结果显示1.59,代表M5群落中的多样性水平较低。以上结果可以说明在较低TS条件下,负责底物水解酸化的细菌的丰富度和多样性指数得到了提升,相反负责产甲烷的古菌丰富度和多样性出现降低的现象。高接种量会促进体系内菌群结构调整,尤其是有助于水解酸化菌群的优化。而产甲烷菌则可能是高效产甲烷菌占绝对优势,促使某一类型的菌群结构得到了进一步聚集。
表 4 不同发酵组中微生物序列的统计分析结果
Table 4. Statistical analysis results of microbial sequences in different fermentation groups
样品 Sample 文库覆盖率/%
Library coverage rate/%Shannon Chao1 ACE 细菌 M1 94 1.79 135.19 136.02 M2 94 1.65 139.29 144.89 M3 92 1.76 123.16 124.96 M4 94 1.71 116.53 117.02 M5 96 1.59 116.00 122.00 M6 94 1.84 155.29 157.35 古菌 M1 95 0.59 149.62 202.54 M2 97 0.66 144.57 211.75 M3 97 0.61 147.22 194.57 M4 99 0.53 139.69 169.43 M5 96 0.53 138.71 177.58 M6 92 0.66 174.11 219.39 -
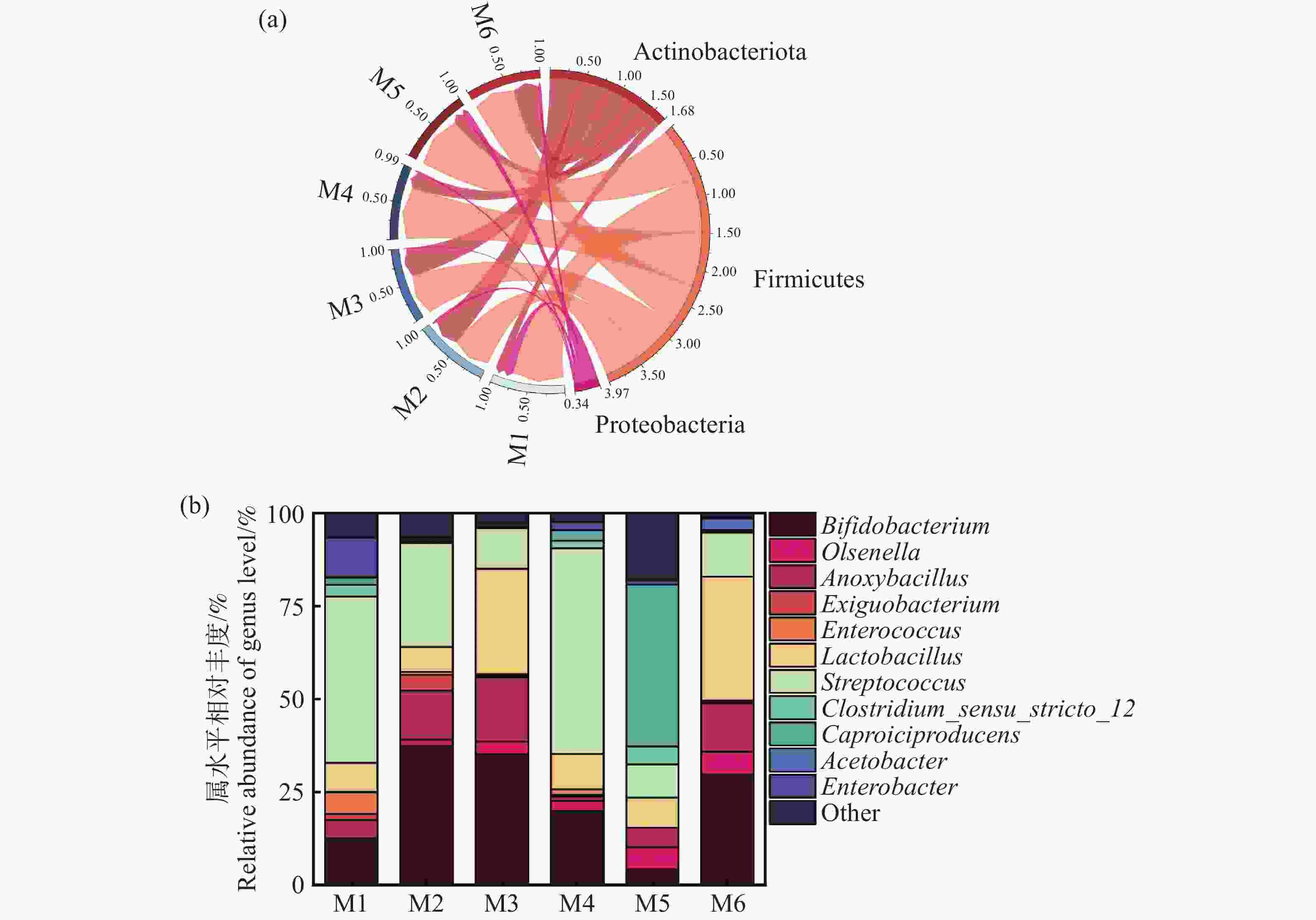
基于α-多样性结果,进一步解析细菌群落结构组成。从图7-a,图7-b可以看出,厚壁菌门(Firmicutes)和放线菌门(Actinobacteriota)占比最高,总比例超过90%,其次是变形菌门(Proteobacteria),占比9.69%。多项研究显示,厚壁菌门(Firmicutes)和放线菌门(Actinobacteriota)是厌氧消化体系中常见的优势细菌门,主要负责厌氧发酵中的水解酸化等过程[26]。结合图7-b细菌属水平组成的分析,发现相对丰度>50%的菌属中,厚壁菌门的链球菌属(Streptococcus)、产乳酸菌属(Lactobacillus)在M6组中的占比高于其他试验组。乳酸菌属被认为是能够快速利用木薯渣中的可发酵性碳源,分解复杂有机物并产生乳酸等短链脂肪酸,为产氢菌和产甲烷菌提供关键底物[27]。在实验组中还有丰度相当的双歧杆菌属(Bifidobacterium)、欧陆森氏菌属(Olsenella)、无氧芽胞杆菌(Anoxybacillus)、肠球菌属(Enterococcus)、肠杆菌属(Enterobacter)、己酸产物属(Caproiciproducens)和醋酸杆菌属(Acetobacter),这些细菌同样在参与底物从大分子降解成小分子过程中起到重要的作用[26, 28-29]。Wirth[30]证明Olsenella属可以分解复杂的有机物如纤维素和半纤维素,产生乳酸、乙酸等短链脂肪酸,为后续产氢菌和产甲烷菌提供优质的代谢底物。此外,M4组发现有最高丰度的链球菌属(Streptococcus)水平,Lee[28]等发现过高的链球菌水平会快速将糖类代谢生成大量乳酸,容易导致体系酸化,显著抑制产甲烷菌的活性,进而降低甲烷产量。而对于产气效果最差的M5组,发现大量Caproiciproducens属,该菌属可能导致乳酸等酸性代谢产物的积累,导致发酵体系pH下降,抑制产甲烷菌的活性,进而降低甲烷产量。金巍[31]等也发现了Caproiciproducens属的高活性可能与产甲烷菌竞争底物,导致甲烷生成效率降低,这一结论同本研究中M5组的情况相同。
-
图8显示了古菌属的分类组成。各实验组中,广古菌门(Euryarchaeota)是绝对优势菌门,相对丰度为51~58%不等,其次是Halobacterota(盐杆菌门),相对丰度为27~38%(图8-a)。Euryarchaeota门内的微生物被发现是普遍存在多种厌氧发酵过程中主要的产甲烷菌。而Halobacterota门的成员在产甲烷过程中也起到重要的作用[32]。从图8-b古菌属的分布可以得出,Euryarchaeota门内的Methanobacterium属,Methanothermobacter属,Halobacterota门内的Methanoculleus属,Methanolinea属,Methanosarcina属及Methanospirillum属均出现在各发酵组中。其中Methanobacterium属、Methanothermobacter属和Methanoculleus属占比最高,丰度达到90%。此类菌属主要利用氢气和二氧化碳作为底物,通过氢营养型产甲烷途径生成甲烷,同时减少体系中的氢气浓度,优化其他厌氧菌的代谢环境[30]。值得注意的是,M6组含有较高丰度的Methanobacterium属,丰度达到51.5%,杨清等[33]指出甲烷杆菌对于维持厌氧发酵体系的平衡、提高甲烷产量以及促进底物的降解具有重要作用。此外,Methanobacterium属对环境条件如pH和氨氮浓度具有一定耐受性,这也解释了M6组具有较高的缓冲能力,维持了发酵体系的稳定,获得较高的甲烷产率[34]。然而,具有过高水平的Methanobacterium属过度富集可能抑制其他产甲烷菌的活性,从而影响整体的产甲烷效果,这与李旭等[35]的研究结果相似,这也是M5组产期产甲烷效率不佳的原因。Methanothermobacter属在M2组具有较高丰度,Kotsyurbenko[36]等指出该菌属对氢气消耗速率较快,容易造成发酵体系中氢气竞争激烈,从而抑制其他利用氢气或产生氢气的微生物的活性,影响整体有机物的降解效率,这可能也是M2组产气产甲烷效率不佳的原因之一。此外,甲烷八叠球菌属(Methanosarcina)在厌氧发酵过程中主要通过乙酸营养型途径产生甲烷,但其对乙酸和氨氮的耐受性相对较低,正因为此M3中乙酸浓度过高反而抑制其发酵产甲烷效果不佳,而M6中乙酸浓度适中,并没有产生抑制,这也是M6产气产甲烷效率较高的原因之一[37]。本研究中 M6 组产气效果最佳,可能归因于温度与接种比的双重作用。一方面,60℃的热环境提高了产酸菌的纤维素水解与酸化效率,同时筛选出以氢为底物的耐热产甲烷菌群体,如Methanothermobacter 属,提升了氢的转化效率。另一方面,较高的接种比保证了微生物群落的丰富度和稳定性,加快了发酵体系的启动,降低了酸化积累与氨氮抑制风险。这表明,温度和接种浓度的合理组合能够促进产酸菌与产甲烷菌的代谢耦合,从而提升产气性能。
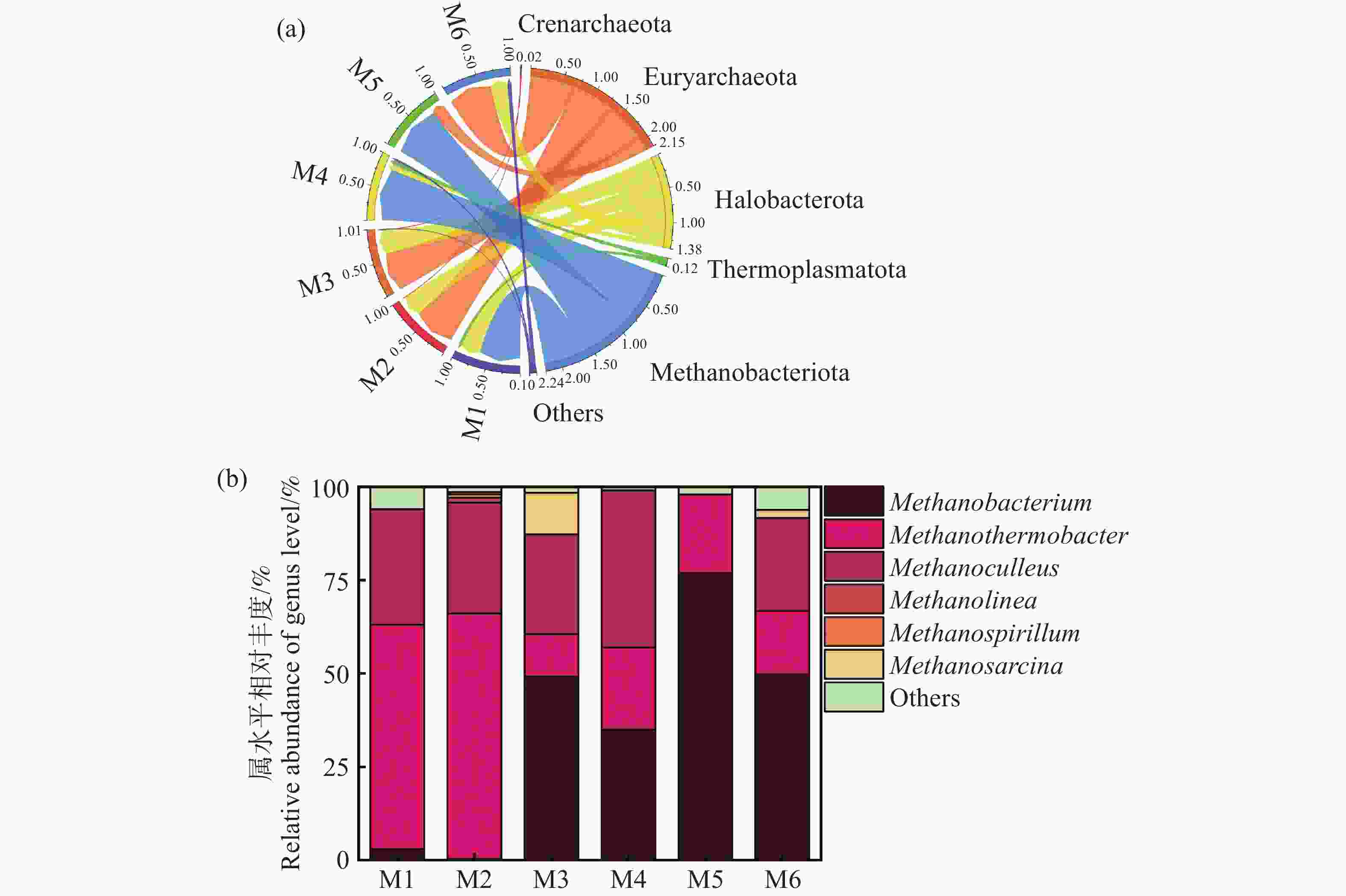
图 8 末端古菌门水平相对丰度(a)末端古菌属水平相对丰度(b)
Figure 8. Horizontal relative abundance of terminal archaea phylum (a) and horizontal relative abundance of terminal archaea genus (b)
以上研究结果表明在以难降解的木质纤维素为主的底物进行厌氧发酵时,发酵细菌和产甲烷古菌之间的互作作用更为重要,通过不同实验组分析可知,Streptococcus属与Caproiciproducens属的大量富集可以导致体系内乙酸和丁酸过度积累,出现过酸化,抑制甲烷菌的活性。利用氢气和二氧化碳产甲烷Methanobacterium属对环境条件如pH和氨氮浓度具有一定耐受性。然而众所周知的甲烷八叠球菌属(Methanosarcina)能够高效产甲烷,但在本研究中,其受乙酸的抑制显著,导致相应的M3发酵组产甲烷效果较差。结合产气及微观指标变化数据可以得出,较低的TS和较高的接种量在高温条件下发酵能为难降解有机物厌氧发酵产甲烷良性运行提供基础保证。
-
本研究系统分析了木薯渣作为唯一碳源的厌氧发酵关键的影响因子,总固体浓度(TS)、接种量和温度对甲烷产量、底物降解及微生物群落的影响,实验结果显示:1)较低TS结合较高接种量显著促进了产甲烷过程,最高甲烷产率达到139.2 mL·g−1,SCOD降解率超过70%。基于此,本研究推荐在工程应用中采用低至中等 TS 水平配合适度增大接种量,以兼顾高产率和体系稳定性。2)高TS(>10%)条件下,由于传质阻力增大和底物抑制效应,微生物活性显著降低,甲烷产量仅为19.8mL·g−1,较效率高发酵组降低6.03倍。因此在高负荷运行条件下,应通过优化接种量或控制进料策略来避免酸化抑制和产甲烷效率下降。3)微生物分布特征分析表明,厚壁菌门(Firmicutes)和放线菌门(Actinobacteriota)作为主导菌门,其中乳酸菌属(Lactobacillus)在低TS条件下丰度较高。而在高TS条件下,链球菌属(Streptococcus)水平较高,导致乳酸过量积累、体系酸化,从而抑制甲烷菌活性。甲烷杆菌属(Methanobacterium)和甲烷八叠球菌属(Methanosarcina)作为主要产甲烷菌,对维持体系平衡和提高甲烷产量发挥了关键作用。结合以上结果,可见通过调控 10%TS、50%接种量及60℃发酵温度,可以优化微生物群落结构,实现高效、稳定的甲烷产出,为木薯渣厌氧发酵在实际工程应用中提供参考依据。
Methane production potential and characteristics of anaerobic digestion of cassava residues under mesophilic and thermophilic conditions
-
摘要: 本文以木薯(Manihot esculenta Crantz)加工产生的木薯渣有机固废为研究对象,探究其在中温(37±1)℃、高温(60±1)℃下,不同发酵TS (Total Solids)浓度(w/10%、w/20%、w/30%)及接种量(w/30%,w/50%)的序批式发酵特性,明确了木薯渣厌氧消化的产气潜力,产气规律及微生物群落分布特征,并通过修正的Gompertz模型对累积产甲烷量进行了相关性拟合。结果表明,高温组产气效率显著高于中温组,且高温发酵仅需3~6 d即达到产气峰值,相较中温缩短6~9 d。以TS浓度10%、接种量50%的实验组的产气量、甲烷含量最好,平均甲烷含量为54%,原料产气率为666.48 mL·g−1 TS,产甲烷率为346.96 mL·g−1 TS,SCOD (Soluble Chemical Oxygen Demand)降解率达到71.25%。在探究微生物群落生物群落分布特征中,不同试验组在细菌/古细菌门水平和属水平的差异中优势菌群受温度和TS影响较大,高温条件能够促进氢营养型甲烷代谢的优势菌群如Methanobacterium (49.84%)和Methanoculleus (24.92%)显著富集,使反应系统获得更好的甲烷收率。从结果可以得出,以木薯渣单独作为沼气发酵原料,控制适宜的TS浓度,提升接种量和发酵温度,能够在短时间内获得理想的沼气回收率。该研究结果可为木薯渣厌氧发酵的工艺优化提供参考。Abstract: Cassava residues, an organic solid waste generated from cassava processing, were digested in an anaerobic way under mesophilic (37±1)℃ and thermophilic (60±1)℃ conditions, and were batch fermentated at varying total solid (TS) concentrations (w/10%, w/20%, w/0%) and inoculum concentrations (w/30%, w/50%) to evaluate the biogas production potential, gas production patterns, and microbial community distribution characteristics during the anaerobic digestion process. The cumulative methane production was fitted using a modified Gompertz model. The results demonstrated that the thermophilic group exhibited significantly higher total gas production efficiency compared to the mesophilic group. Moreover, the thermophilic fermentation reached peak gas production within 3-6 days, which was 6-9 days shorter than the mesophilic fermentation. The optimal conditions, achieved at 10% TS and 50% inoculum dosage, yielded the highest biogas and methane production, with an average methane content of 54%, biogas yield of 666.48 mL·g−1 TS, methane yield of 346.96 mL·g−1 TS, and SCOD degradation rate of 71.25%. Analysis of microbial community distribution revealed that temperature and TS concentration significantly influenced the dominant bacterial and archaeal populations at both phylum and genus levels. Thermophilic conditions promoted the enrichment of hydrogenotrophic methanogens, such as Methanobacterium (49.84%) and Methanoculleus (24.92%), leading to improved methane recovery. The findings suggest that cassava residues alone could serve as a viable feedstock for biogas production, and that desirable biogas recovery could be achieved in a shorter time frame through controlling an appropriate TS concentration, increasing inoculum dosage, and optimizing fermentation temperature. All these findings provide valuable insights for optimizing the anaerobic fermentation process of cassava residues.
-
图 3 不同发酵组生成的VFAs及pH随厌氧发酵时间的变化
注:图中紫色柱状图代表乙酸浓度,黄色代表丙酸浓度,青色代表丁酸浓度
Fig. 3 Changes in VFAs and pH generated by different fermentation groups with anaerobic fermentation time
Note: The purple bar chart in the figure represents the concentration of acetic acid; yellow represents the concentration of propionic acid; blue represents the concentration of butyric acid
表 1 木薯渣及接种物的特性
Table 1 Characteristics of cassava residues and inoculum
参数
Parameter木薯渣
Cassava residues沼液
Biogas slurrypH 6.05 7.82 ORP(mv) −269 −362 TS(%) 35.77 3.15 TN 29.95(g·kg−1) 12.56(mg·L−1 ) TP 10.20(g·kg−1) 75.64(mg·L−1 ) SCOD(mg·L−1 ) 21 248 3 022 表 2 实验设计参数
Table 2 Experimental design parameters
组
Group温度/℃
Temperature/℃木薯渣/g
Cassava Bagasse/g发酵浓度
Fermentation
concentration接种物/mL
Inoculum/
mL接种比
Vaccination ratio总发酵液量/mL
Total fermentation
broth volume/mLM1 37 150.3 30% 150 30% 500 M2 60 100.2 20% 150 30% 500 M3 37 100.2 20% 150 30% 500 M4 37 50.1 10% 150 30% 500 M5 37 150.3 30% 250 50% 500 M6 60 50.1 10% 250 50% 500 表 3 不同组木薯渣厌氧发酵产甲烷动力学分析
Table 3 Kinetic analysis of methane production from anaerobic fermentation of cassava residues in different groups
组 Group Pm(mL·g−1 TS) Rmax(mL·g−1 TS·h) λ(h) R2 M1 16.79±0.01 0.31±0.016 15.66± 2.89 0.99±0.02 M2 185.39±1.41 1.18±0.07 219.82± 5.41 0.99±0.04 M3 193.02±1.65 1.05±0.047 714.83± 56.92 0.99±0.06 M4 216.64±3.68 1.08±0.12 265.47± 11.52 0.99±0.03 M5 2.12±0.01 0.03±0.01 14.54± 14.02 0.99±0.02 M6 351.68±5.69 1.38±0.14 94.32± 13.51 0.99±0.01 表 4 不同发酵组中微生物序列的统计分析结果
Table 4 Statistical analysis results of microbial sequences in different fermentation groups
样品 Sample 文库覆盖率/%
Library coverage rate/%Shannon Chao1 ACE 细菌 M1 94 1.79 135.19 136.02 M2 94 1.65 139.29 144.89 M3 92 1.76 123.16 124.96 M4 94 1.71 116.53 117.02 M5 96 1.59 116.00 122.00 M6 94 1.84 155.29 157.35 古菌 M1 95 0.59 149.62 202.54 M2 97 0.66 144.57 211.75 M3 97 0.61 147.22 194.57 M4 99 0.53 139.69 169.43 M5 96 0.53 138.71 177.58 M6 92 0.66 174.11 219.39 -
[1] 邵鹏程, 赵峰, 张男吉, 等. 木薯渣饲料的营养特性及其在畜禽养殖中的应用研究进展[J]. 中国畜牧杂志, 2023, 59(10): 36−41. https://doi.org/10.19556/j.0258-7033.20220812-03 doi: 10.19556/j.0258-7033.20220812-03 [2] 黄慧德, 刘恩平, 刘海清, 等. 木薯产业可持续发展的途径与存在问题[J]. 热带农业科学, 2012, 32(2): 84−87. https://doi.org/10.3969/j.issn.1009-2196.2012.02.019 doi: 10.3969/j.issn.1009-2196.2012.02.019 [3] 陈若曦, 何会班, 赵业华, 等. 小麦秸秆高浓度厌氧梯度预发酵的中试研究[J]. 中国沼气, 2024, 42(5): 13−22. https://doi.org/10.20022/j.cnki.1000-1166.20240828 doi: 10.20022/j.cnki.1000-1166.20240828 [4] Zhang J Q, Wang Q F, Yu H M, et al. Metagenomic insights into protein degradation mechanisms in natural fermentation of cassava leaves [J]. Bioresource Technology, 2024, 396: 130433. https://doi.org/10.1016/j.biortech.2024.130433 doi: 10.1016/j.biortech.2024.130433 [5] Chantawan N, Moungprayoon A, Lunprom S, et al. High-solid dark fermentation of cassava pulp and cassava processing wastewater for hydrogen production [J]. International Journal of Hydrogen Energy, 2022, 47(96): 40672−40682. https://doi.org/10.1016/j.ijhydene.2022.09.106 doi: 10.1016/j.ijhydene.2022.09.106 [6] 柳金虎, 张箭, 张云杰, 等. 中温条件下驴粪厌氧消化产甲烷潜力及特性分析[J]. 中国沼气, 2024, 42(6): 34−40. https://doi.org/10.20022/j.cnki.1000-1166.2024060034 doi: 10.20022/j.cnki.1000-1166.2024060034 [7] Cao Y, Zhang H X, Du H, et al. Microorganisms and metabolic characteristics of temperature-dependent fermentation during sauce-flavor Baijiu production [J]. Food Bioscience, 2025, 63: 105787. https://doi.org/10.1016/j.fbio.2024.105787 doi: 10.1016/j.fbio.2024.105787 [8] Mutezo G, Mulopo J. A review of Africa’s transition from fossil fuels to renewable energy using circular economy principles [J]. Renewable and Sustainable Energy Reviews, 2021, 137: 110609. https://doi.org/10.1016/j.rser.2020.110609 doi: 10.1016/j.rser.2020.110609 [9] 黄开明, 赵立欣, 冯晶, 等. 复合微生物预处理玉米秸秆提高其厌氧消化产甲烷性能[J]. 农业工程学报, 2018, 34(16): 184−189. https://doi.org/10.11975/j.issn.1002-6819.2018.16.024 doi: 10.11975/j.issn.1002-6819.2018.16.024 [10] Pastor-Poquet V, Papirio S, Trably E, et al. High-solids anaerobic digestion requires a trade-off between total solids, inoculum-to-substrate ratio and ammonia inhibition [J]. International Journal of Environmental Science and Technology, 2019, 16(11): 7011−7024. https://doi.org/10.1007/s13762-019-02264-z doi: 10.1007/s13762-019-02264-z [11] Cheng L, Qiu T L, Li X, et al. Isolation and characterization of Methanoculleus receptaculi sp. nov. from Shengli oil field, China [J]. FEMS Microbiology Letters, 2008, 285(1): 65−71. https://doi.org/10.1111/j.1574-6968.2008.01212.x doi: 10.1111/j.1574-6968.2008.01212.x [12] Yi J, Dong B, Jin J W, et al. Effect of increasing total solids contents on anaerobic digestion of food waste under mesophilic conditions: performance and microbial characteristics analysis [J]. PLoS One, 2014, 9(7): e102548. https://doi.org/10.1371/journal.pone.0102548 doi: 10.1371/journal.pone.0102548 [13] Lukitawesa, Patinvoh R J, Millati R, et al. Factors influencing volatile Fatty Acids production from Food Wastes via anaerobic digestion [J]. Bioengineered, 2020, 11(1): 39−52. https://doi.org/10.1080/21655979.2019.1703544 doi: 10.1080/21655979.2019.1703544 [14] Conrad R. Methane production in soil environments-anaerobic biogeochemistry and microbial life between flooding and desiccation [J]. Microorganisms, 2020, 8(6): 881. https://doi.org/10.3390/microorganisms8060881 doi: 10.3390/microorganisms8060881 [15] 袁京群, 康达, 毛伟华, 等. 温度和储存基质对储存后厌氧颗粒污泥特性的影响[J]. 环境科学学报, 2018, 38(7): 2622−2631. https://doi.org/10.13671/j.hjkxxb.2018.0041 doi: 10.13671/j.hjkxxb.2018.0041 [16] Ur Rehman M L, Iqbal A, Chang C C, et al. Anaerobic digestion [J]. Water Environment Research, 2019, 91(10): 1253−1271. https://doi.org/10.1002/wer.1219 doi: 10.1002/wer.1219 [17] Yang J, Zhang J, Du X, et al. Ammonia inhibition in anaerobic digestion of organic waste: a review [J]. International Journal of Environmental Science and Technology, 2025, 22(5): 3927−3942. https://doi.org/10.1007/s13762-024-06029-1 doi: 10.1007/s13762-024-06029-1 [18] 王晓鑫, 王建, 马峰, 等. 中高温鸡粪厌氧消化微生物调节机制对比及耐热机理研究[J]. 环境保护科学, 2023, 49(4): 74−84. https://doi.org/10.16803/j.cnki.issn.1004−6216.202303048 doi: 10.16803/j.cnki.issn.1004−6216.202303048 [19] Sunar N M, Stentiford E L, Stewart D I, et al. The process and pathogen behavior in composting: a review [J]. arXiv: Quantitative Methods. , 2014, doi:10.48550/arXiv.1404.5210 (查阅网上资料,不确定本条文献类型与格式,请确认) [20] Yin F B, Li Z F, Hou S, et al. The influence of total solid and inoculum ratio on thermophilic anaerobic digestion of waste activated sludge [J]. Advanced Materials Research, 2014, 878: 670−678. https://doi.org/10.4028/www.scientific.net/AMR.878.670 doi: 10.4028/www.scientific.net/AMR.878.670 [21] Wang Q H, Liang Y, Zhao P, et al. Potential and optimization of two-phase anaerobic digestion of oil refinery waste activated sludge and microbial community study [J]. Scientific Reports, 2016, 6: 38245. https://doi.org/10.1038/srep38245 doi: 10.1038/srep38245 [22] 苗荪, 陈磊, 左剑恶. 环境中抗生素抗性基因丰度与抗生素和重金属含量的相关性分析: 基于Web of Science数据库检索[J]. 环境科学, 2021, 42(10): 4925−4932. https://doi.org/10.13227/j.hjkx.202101043 doi: 10.13227/j.hjkx.202101043 [23] 朱金杰, 邹楠, 钟寰, 等. 富营养化巢湖沉积物溶解性有机质光谱时空分布特征及其环境意义[J]. 环境科学学报, 2020, 40(7): 2528−2538. https://doi.org/10.13671/j.hjkxxb.2020.0051 doi: 10.13671/j.hjkxxb.2020.0051 [24] 石玉飞, 李胜楠, 耿金菊, 等. 发酵制药废水二级出水中溶解性有机物特性分析[J]. 环境科学学报, 2021, 41(5): 1901−1909. https://doi.org/10.13671/j.hjkxxb.2020.0364 doi: 10.13671/j.hjkxxb.2020.0364 [25] 邵一奇, 王电站, 颜成, 等. 厌氧消化对猪场废水中溶解性和颗粒态有机物的组成与性质的影响[J]. 南京农业大学学报, 2019, 42(4): 713−720. https://doi.org/10.7685/jnau.201810031 doi: 10.7685/jnau.201810031 [26] Loughrin J H, Parekh R R, Agga G E, et al. Microbiome diversity of anaerobic digesters is enhanced by microaeration and low frequency sound [J]. Microorganisms, 2023, 11(9): 2349. https://doi.org/10.3390/microorganisms11092349 doi: 10.3390/microorganisms11092349 [27] 张鑫, 高爱武, 黄雅娟, 等. 酵母菌与乳酸菌共培养发酵马铃薯渣的研究[J]. 食品工业科技, 2012, 33(1): 194−197. https://doi.org/10.13386/j.issn1002-0306.2012.01.061 doi: 10.13386/j.issn1002-0306.2012.01.061 [28] Lee S S, Hsu J T, Mantovani H C, et al. The effect of bovicin HC5, a bacteriocin from Streptococcus bovis HC5, on ruminal methane production in vitro [J]. FEMS Microbiology Letters, 2002, 217(1): 51−55. https://doi.org/10.1111/j.1574-6968.2002.tb11455.x doi: 10.1111/j.1574-6968.2002.tb11455.x [29] Dong L L, Cao G L, Guo X Z, et al. Efficient biogas production from cattle manure in a plug flow reactor: a large scale long term study [J]. Bioresource Technology, 2019, 278: 450−455. https://doi.org/10.1016/j.biortech.2019.01.100 doi: 10.1016/j.biortech.2019.01.100 [30] Wirth R, Kádár G, Kakuk B, et al. The planktonic core microbiome and core functions in the cattle rumen by next generation sequencing [J]. Frontiers in Microbiology, 2018, 9: 2285. https://doi.org/10.3389/fmicb.2018.02285 doi: 10.3389/fmicb.2018.02285 [31] 金巍, 刘军花, 李袁飞, 等. 甲烷菌对厌氧真菌不同碳源代谢的影响[J]. 微生物学报, 2017, 57(7): 1106−1111. https://doi.org/10.13343/j.cnki.wsxb.20160453 doi: 10.13343/j.cnki.wsxb.20160453 [32] Bräuer S L, Basiliko N, Siljanen H M P, et al. Methanogenic Archaea in peatlands [J]. FEMS Microbiology Letters, 2020, 367(20): fnaa172. https://doi.org/10.1093/femsle/fnaa172 doi: 10.1093/femsle/fnaa172 [33] 杨清, 白丽萍. 产甲烷古菌甲基转移酶研究进展[J]. 中国沼气, 2024, 42(2): 3−12. https://doi.org/10.20022/j.cnki.1000-1166.20240325 doi: 10.20022/j.cnki.1000-1166.20240325 [34] Vítězová M, Kohoutová A, Vítěz T, et al. Methanogenic microorganisms in industrial wastewater anaerobic treatment [J]. Processes, 2020, 8(12): 1546. https://doi.org/10.3390/pr8121546 doi: 10.3390/pr8121546 [35] 李旭, 冯磊, 甄箫斐, 等. 基于CSTR反应器鸡粪秸秆共消化产甲烷特性及菌群变化研究[J]. 环境科学学报, 2021, 41(8): 3312−3323. https://doi.org/10.13671/j.hjkxxb.2021.0036 doi: 10.13671/j.hjkxxb.2021.0036 [36] Kotsyurbenko O R. Trophic interactions in the methanogenic microbial community of low-temperature terrestrial ecosystems [J]. FEMS Microbiology Ecology, 2005, 53(1): 3−13. https://doi.org/10.1016/j.femsec.2004.12.009 doi: 10.1016/j.femsec.2004.12.009 [37] 孔德望, 张克强, 房芳, 等. 猪粪厌氧发酵消化液回流体系微生物群落结构特征与产气关系研究[J]. 农业环境科学学报, 2018, 37(3): 559−566. https://doi.org/10.11654/jaes.2017-1241 doi: 10.11654/jaes.2017-1241 -

 点击查看大图
点击查看大图
计量
- 文章访问数: 74
- HTML全文浏览量: 44
- 被引次数: 0



 下载:
下载: