-
木棉(Bombax ceiba)系木棉科落叶乔木,原产于中国,别名攀枝花、英雄树、红棉等,主要分布于海南、广东、广西和云南等地[1],广泛用于园林绿化和造林。木棉树形优美、花大色艳,常用于庭院、公园及行道树景观建设,且具有深厚的文化象征意义,被誉为“英雄树”[2]。木棉全身皆可利用,其花、根、叶、树皮具有药用价值,可清热利湿、凉血解毒,用于治疗多种病症[3]。木棉果实纤维可作填充材料,种子榨油可作润滑油、肥皂,木材轻软适用于造纸和木制品加工,具有极高的生态和经济价值[4]。木棉存在播种繁殖成株周期冗长、表型遗传不稳定性等固有缺陷,且难以保障栽培品种的性状同一性。因此,良种的无性繁殖成为繁育过程中不可或缺的步骤。木棉扦插繁殖的苗木因根系发育不良、抗病虫害能力较弱,在育苗阶段容易受到病害侵袭。在湿度、温度和基质条件不理想的情况下,插穗容易干枯或腐烂,导致木棉成活率极低。组织培养存在较高污染风险,成本高昂,且对技术要求严格,难以实现大规模、高效生产,经济性不如传统繁殖方法[5]。而木棉嫁接繁育能保持优良品种特性,提前开花结果,提高抗性与品质,并加速优良品种的繁育进程。木棉嫁接愈合是嫁接苗培育的关键,国内外研究表明,嫁接愈合与砧穗的生理生化物质含量密切相关,内源激素对愈合过程有重要影响[6 − 9]。目前对木棉嫁接愈合详细的愈合机制和生理生化变化过程尚未见报道,本研究一方面通过硬组织切磨片法观察木棉嫁接口愈合过程的组织形态特征,了解砧穗愈合过程中的细胞学变化,判断嫁接愈合关键期,并将木棉嫁接愈合过程划分阶段,分析木棉嫁接愈合组织学机制。另一方面通过测定砧穗愈合过程的各项生理生化指标,包括内源激素浓度、抗氧化酶活性及营养物质的含量变化,明确其在嫁接体发育过程中的作用。因此,研究木棉嫁接愈合过程中的组织解剖与生理生化特性,并对生理生化指标相关性进行讨论,有助于加快木棉优良无性系的繁育速度,从而促进海南省木棉产业良种化进程。
-
实验地位于海南大学儋州校区农科实验基地(19°51′N,109°49′E),属于典型热带季风气候区,年均气温23.5 ℃,年降水量约2 000 mm,光照充足,土壤为红壤土,地势平坦且通风排水良好。
-
砧木选取海南大学儋州校区农科基地木棉试实验田5年生健康美丽异木棉(Ceiba speciosa)(胸径12.0 cm±1.6 cm)。接穗选取当年生、长约8~12 cm、叶芽饱满的健壮半木质化木棉枝条。以木棉为接穗,以美丽异木棉为砧木,进行劈接,共240株。具体操作方式为:首先用嫁接刀在接穗的底端两边各削一刀,形成长度为 1.5~2.0 cm的2个削面,削面平滑,接穗保留顶芽;用枝剪在砧木上合适位置剪断,使用嫁接刀将砧木切口修整平滑,从砧木剪断面中央垂直劈开,劈口长度约为3~4 cm;将准备好的接穗插入,确保砧木与接穗的形成层对接,然后用塑料保鲜膜包扎固定,完成嫁接。
-
每个嫁接组合嫁接处理后按1、3、5、7、10、14、17、21、25、30、35、40 d共采样12次,采用完全随机法,每次取15株嫁接成活苗的结合部茎段(生物学重复),其中剪取3株约1.5 cm长的结合部茎段,立即浸入体积分数为70%的FAA固定液,存放于4 ℃冷藏环境备用,取样完成后统一进行切片。剩余12株将嫁接口茎段经液氮冷冻后,放入−80 ℃冰箱保存,取样完成后统一进行生理生化分析,分为3次技术重复进行指标测定。
-
硬组织树脂包埋切磨片实验步骤,样品从固定液中取出,新鲜组织确定取材部位,将植物组织用70%FAA固定48 h,依次通过体积分数60% → 70% → 80% → 90% →95%乙醇脱水,每梯度处理24~72 h,再用T7200树脂浸润20 d。之后将组织放入包埋模具,调整包埋面,加入T7200树脂,光固化12 h,接着进行平行切片。平行粘片后,进行切片磨片,最后将切磨片进行甲苯胺蓝染色,透明封片。染色结果显示,木质化细胞壁呈蓝绿色,纤维素细胞壁呈紫蓝色。将切片置于日本产的Nikon Eclipse E100正置光学显微镜下观察并拍照。
-
采用蒽酮比色法[10]对可溶性糖含量进行测定;采用考马斯亮蓝[11]测定可溶性蛋白含量;过氧化物酶(POD)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)的活性均通过分光光度法测定。实验所需的试剂盒全部由苏州科铭生物技术有限公司提供。生长素(IAA)、细胞分裂素(CTK)、赤霉素(GA)及脱落酸(ABA)的含量均通过酶联免疫吸附法测定。
-
数据处理及绘图使用Excel 2023和Origin 2022,照片处理使用Photoshop 2023,数据统计分析采用SPSS 27.0进行单因素方差分析,误差线表示均值±标准差(n=3)。
-
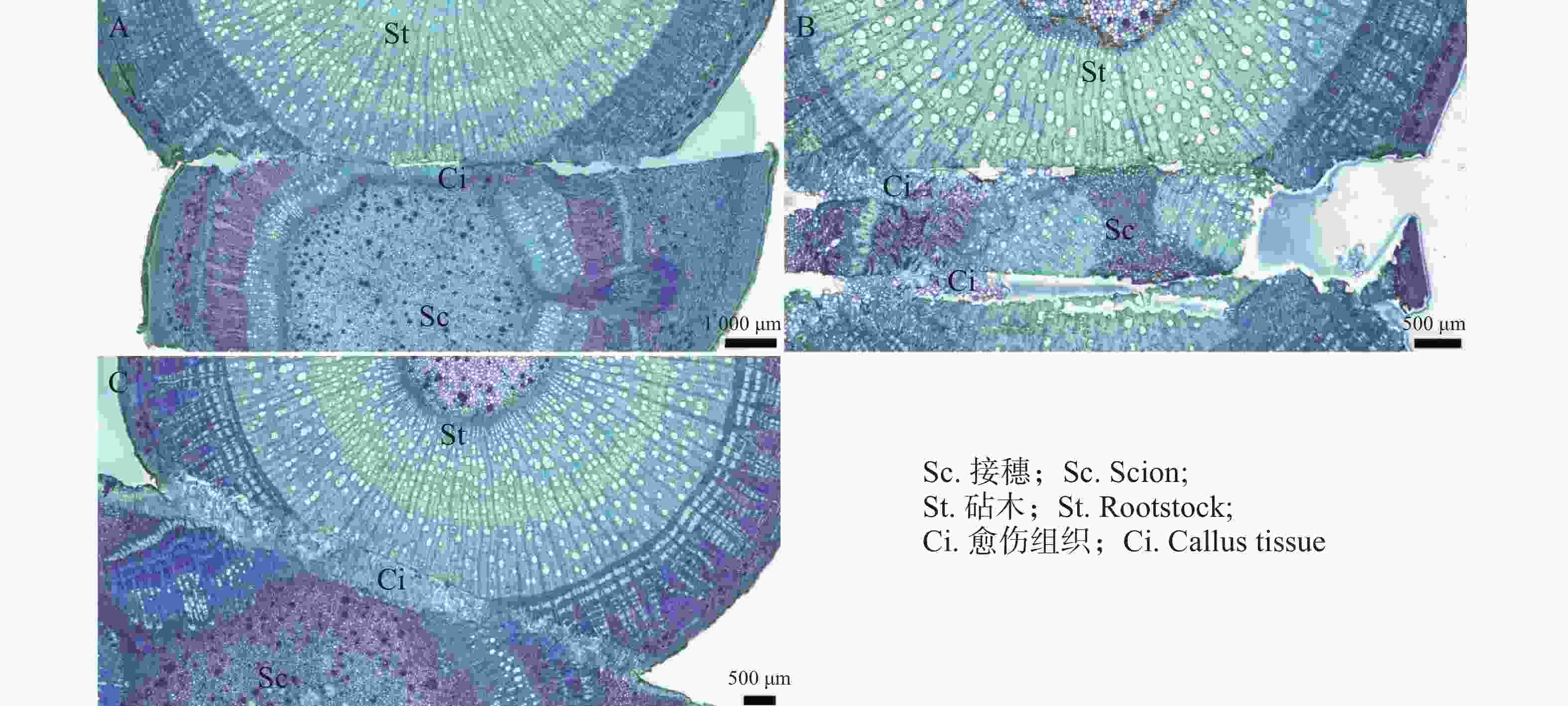
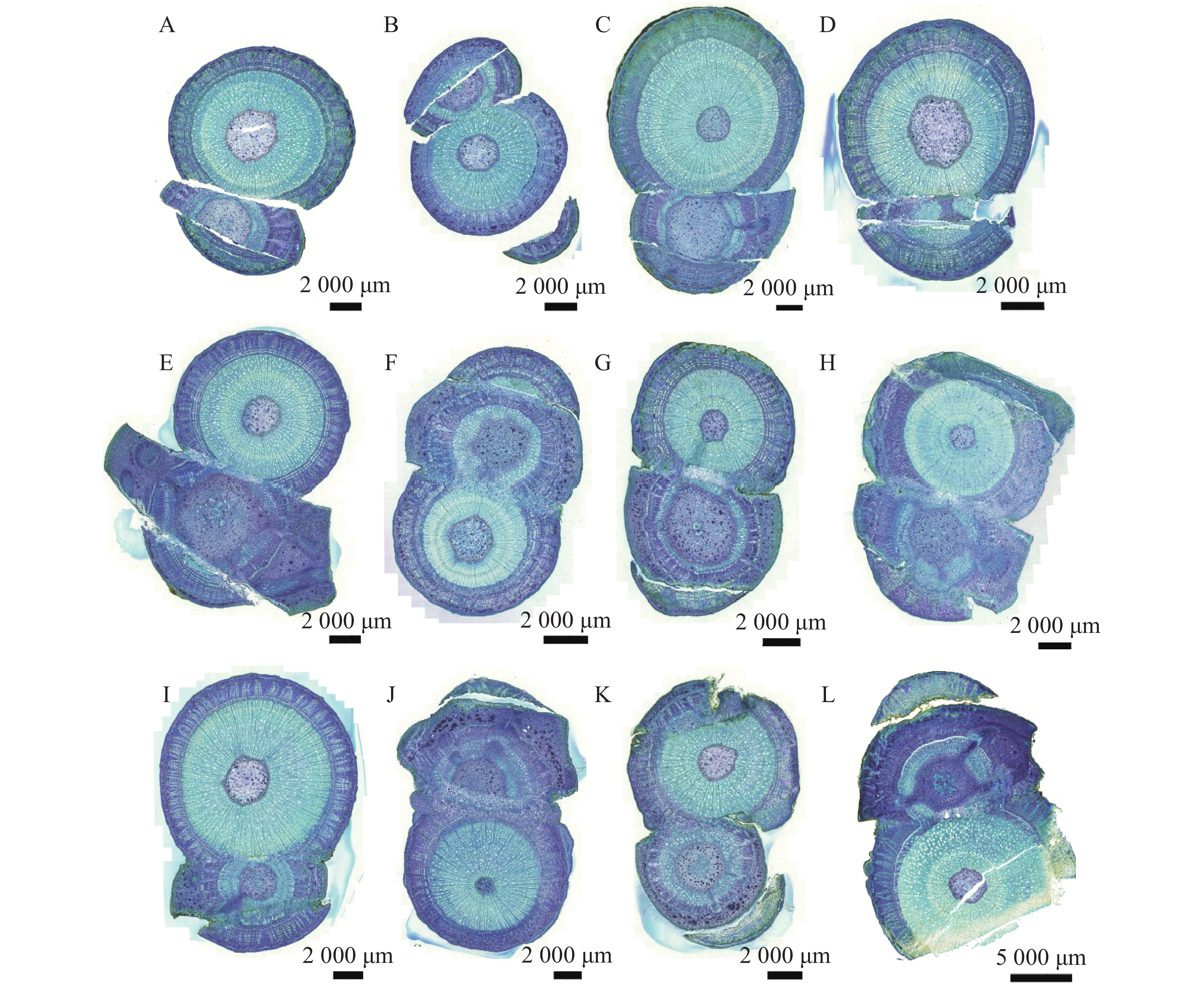
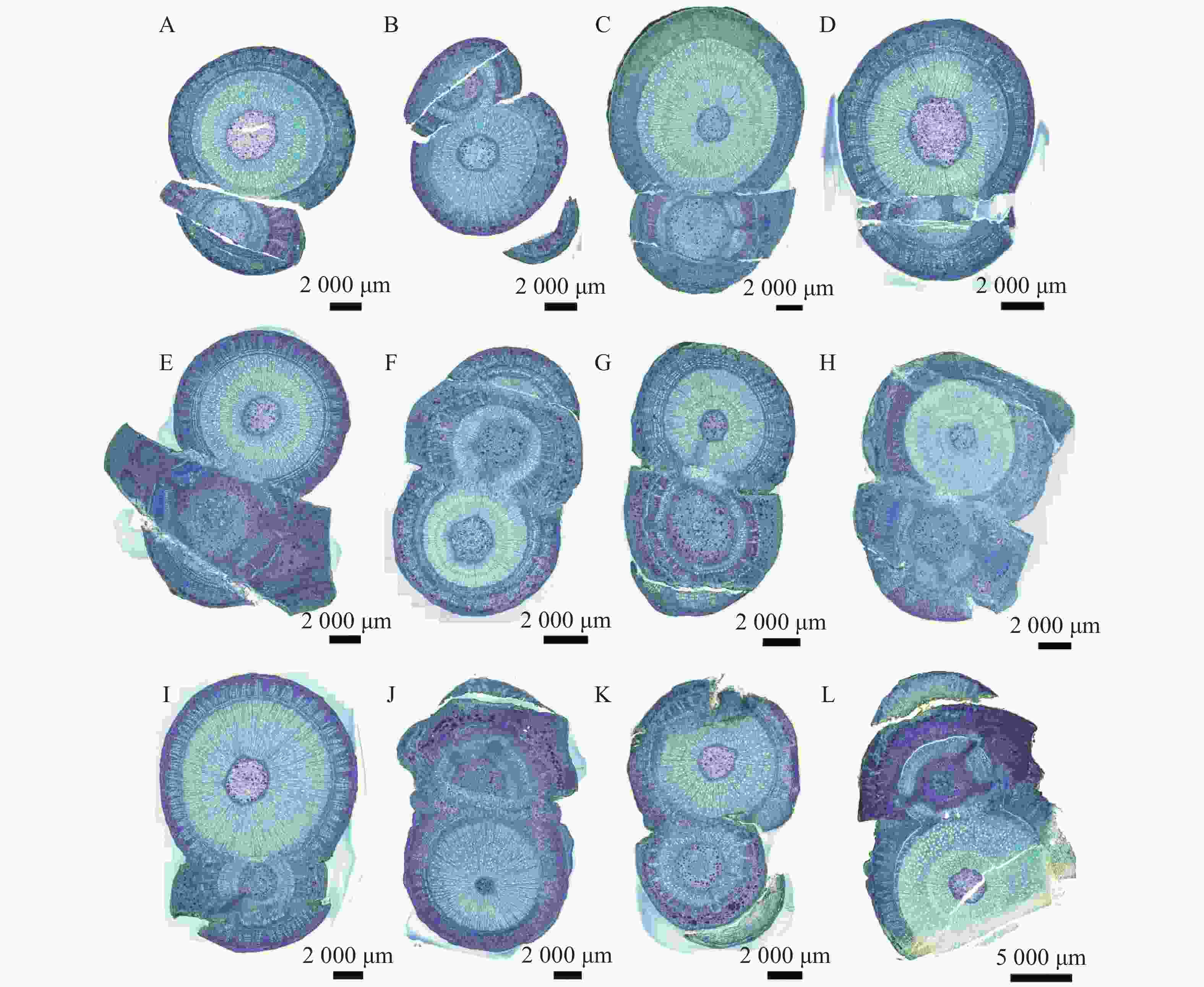
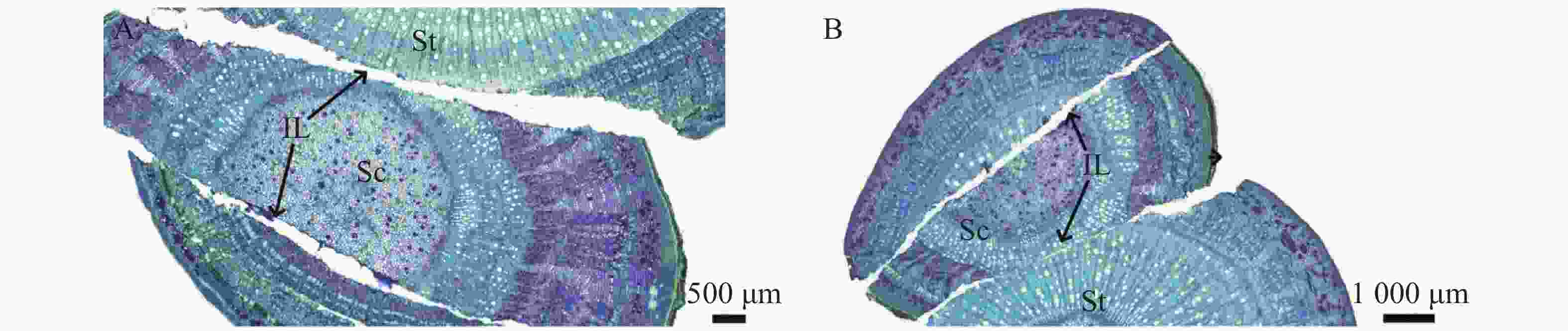
观察发现(图1),隔离层和愈伤组织分别在嫁接后第1天(图1−A)和第3天(图1−B)开始形成;到第10天(图1−E),愈伤组织填充了砧木和接穗之间的空隙,二者紧密结合,形成愈伤组织桥,隔离层消失。嫁接后第22天(图1−H)时,连成完整的形成层带。砧穗结合部的形成层环表明嫁接体已愈合。到嫁接后第40天(图1−L),新形成的维管束进一步分化,分布从规整变为不规整,形成维管束混合群体,标志着嫁接体成活。木棉嫁接愈合过程可分为4个阶段,分别是隔离层形成期(第0~3天)、愈伤组织形成期(第3~10天)、愈伤组织分化和连接期(第10~22天)和形成层连接和维管组织分化期(第22~40天)。
-
隔离层由坏死的细胞组织构成,主要起到保护伤口的作用。在嫁接后的第1天(图2−A)和第3天(图2−B),在砧木与接穗切口处的形成层位置,观察到褐色坏死组织(隔离层)形成,它在嫁接初期有助于减少水分蒸发,保护伤口。
-
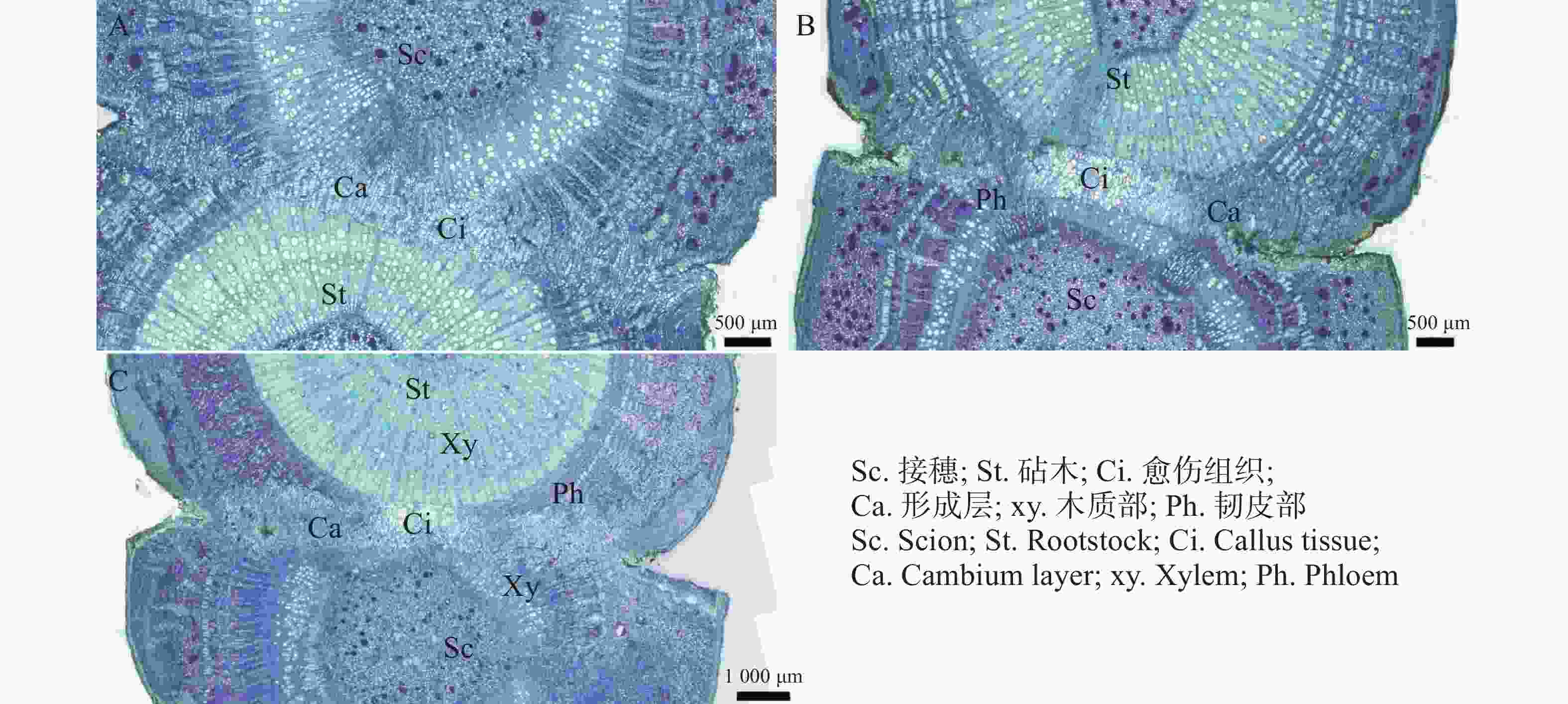
在嫁接后的第5天(图3−A),砧木伤口附近出现不规则的薄壁细胞,即愈伤组织形成。在嫁接后的第7天(图3−B),愈伤组织大量增殖,形成无序排列的愈伤组织细胞团。在嫁接后的第10天(图3−C),砧木与接穗的愈伤组织继续增生,径向薄壁细胞层数增加,并出现细胞融合现象。
-
在嫁接后的第14天(图4−A),愈伤组织抱合连接,填满了砧木与接穗之间的空隙,形成愈伤组织桥,隔离层消失,愈伤组织桥成为细胞流通的关键途径,在维管束形成前的嫁接初期,愈伤组织桥是砧木向接穗提供水分和营养的主要通道。嫁接后第22天(图4−C),薄壁细胞持续分化形成新的形成层,并向接穗生长,最终形成完整的形成层带,带状结构扭曲。砧穗结合部形成层环表明嫁接体已愈合。
-
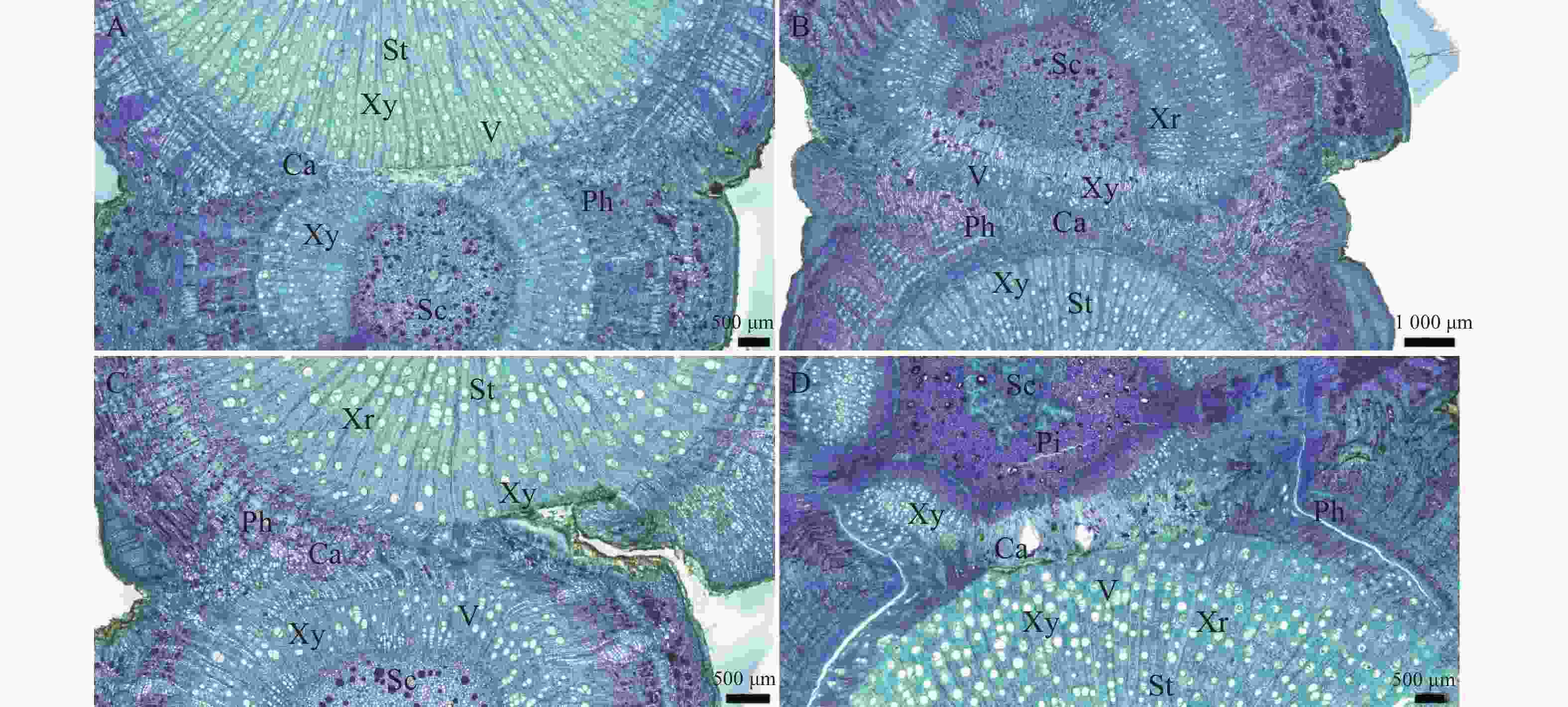
在嫁接后的第26天(图5−A):完整的形成层带开始活跃分化,向内生成木质部,同时新生导管开始形成。嫁接后第30天(图5−B),形成大量规则的木质部和韧皮部结构,导管清晰可见。嫁接后的第35天(图5−C),新分化出的维管束扩大分化,分布从规整变为不规整,形成维管束混合群体。嫁接后的第40天(图5−D),砧穗已完整地连为一体,嫁接愈合过程基本结束。
-
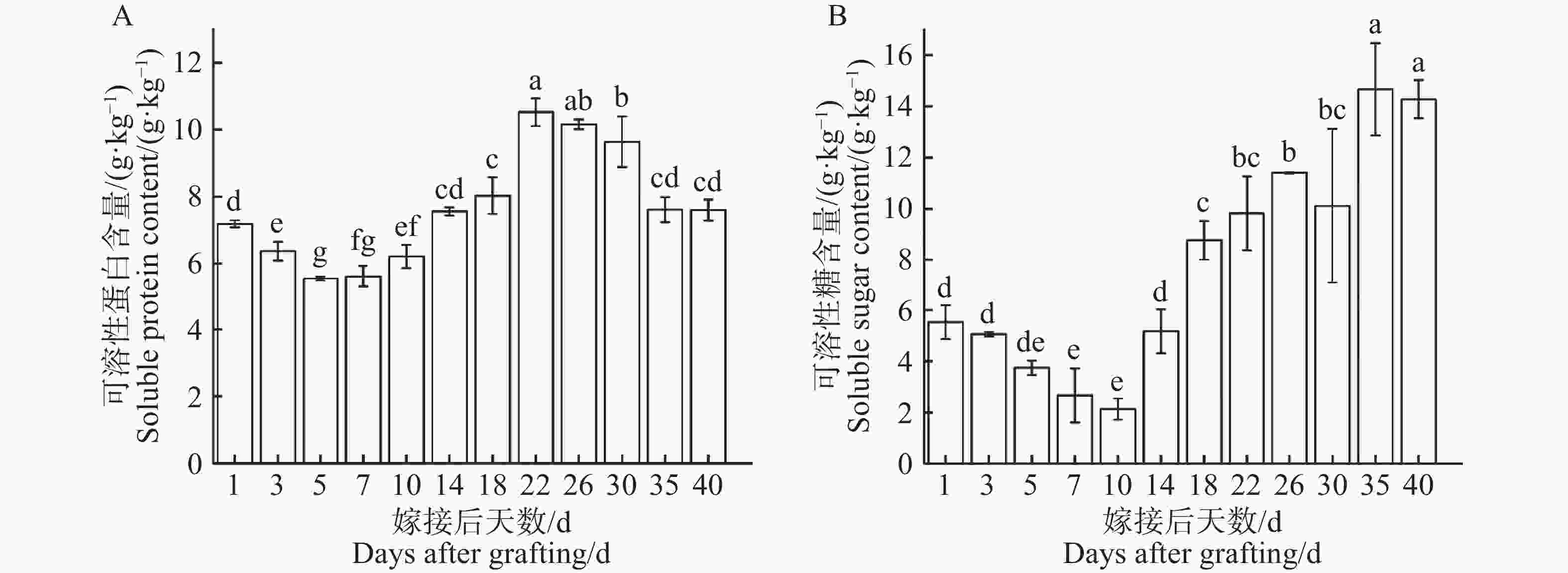
从图6−A可知,在1~5 d可溶性蛋白含量持续下降,在第5天下降至最低点(5.55 g·kg−1),随即在第5~22天可溶性蛋白含量逐步上升,在第22天显著上升至最高点(10.53 g·kg−1),最高点是最低点的1.90倍。在第22天出现峰值后,可溶性蛋白含量22~40 d逐步下降,在第40天趋于稳定(7.60 g·kg−1)。可溶性蛋白含量在嫁接愈合过程中呈现出先下降后上升再下降的变化趋势。从图6−B可知,在1~10 d可溶性糖含量持续下降,在第10天显著下降至最低点(2.13 g·kg−1),随即在第10~40天逐步上升至峰值,在第35天显著上升至最高点(14.66 g·kg−1),最高点是最低点的6.88倍,且在形成层连接和维管组织分化阶段(22~40 d)可溶性糖含量与可溶性蛋白含量呈相反变化趋势,可溶性糖在整个嫁接愈合过程中呈现出先下降后上升的变化趋势。
-
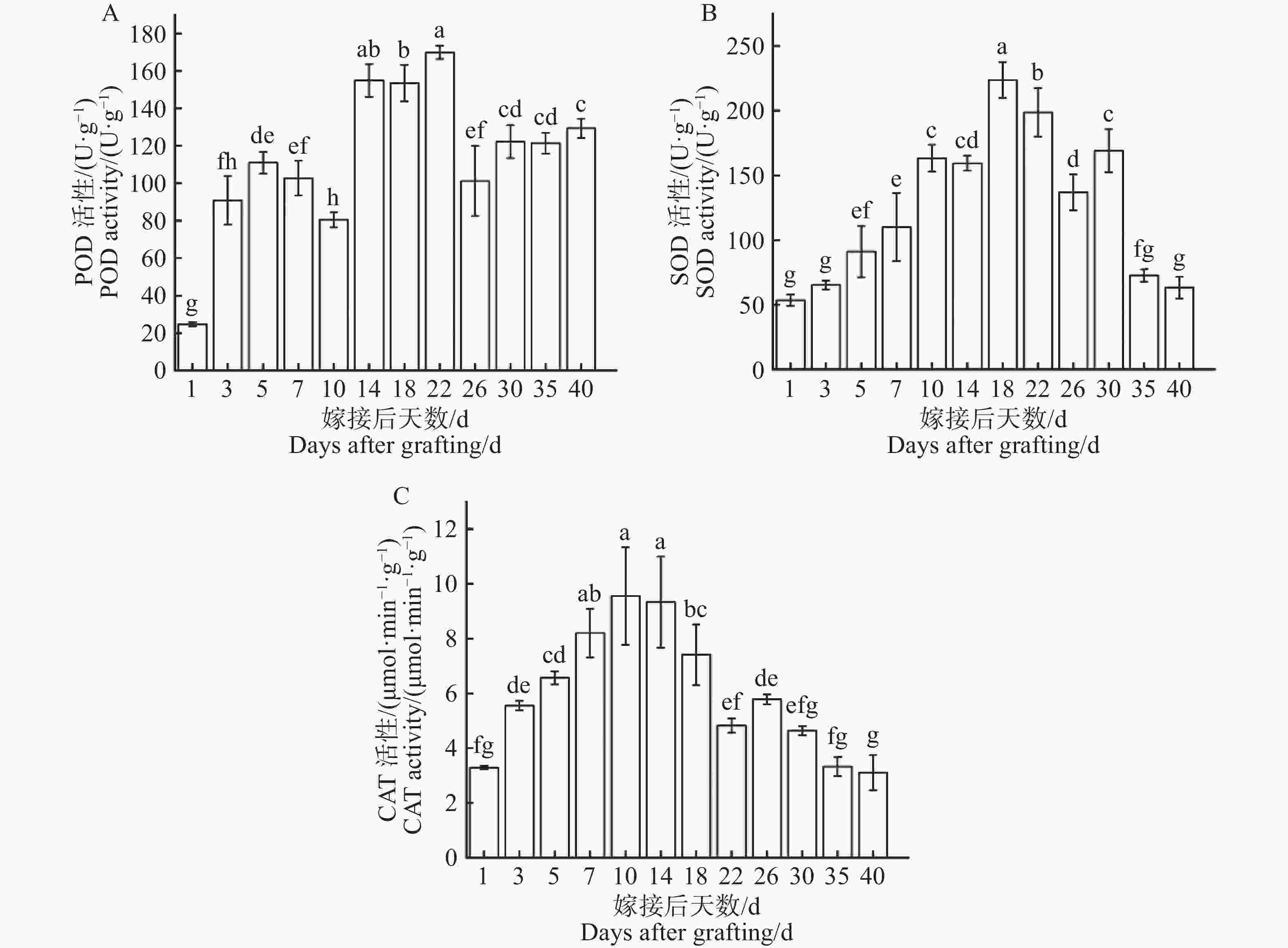
从图7−A可知,过氧化物酶(POD)活性第1天为最低点(24.74 U·g−1),在1~5 d过氧化物酶活性持续上升,在第5天上升至第1个峰值(80.48 U·g−1),随即在第5~10天过氧化物酶活性略微下降,过氧化物酶活性在第10~22天显著上升至最高点(169.87 U·g−1),最高点是最低点的6.87倍,在第22天出现峰值后,过氧化物酶活性在第22~40天显著下降后平稳波动。过氧化物酶活性在整个嫁接愈合过程中呈现先上升后下降,再上升再下降的变化趋势。从图7−B可知,在嫁接后1~18天超氧化物歧化酶(SOD)活性持续上升,在第18天上升至最高点(223.64 U·g−1),随即在第18~40天超氧化物歧化酶活性逐步下降,在第40天显著下降至最低点(63.16 U·g−1),最高点是最低点的3.54倍。超氧化物歧化酶活性在整个嫁接愈合过程中呈现出先上升后下降明显变化趋势。从图7−C可知,在1~10 d过氧化氢酶(CAT)活性持续上升,在第10天上升至最高点(9.55 μmol·min−1·g−1),随即在第10~40天过氧化氢酶活性波动性下降,在第40天显著下降至最低点(3.11 μmol·min−1·g−1),最高点是最低点的3.07倍。过氧化氢酶活性在整个嫁接愈合过程中呈现出先上升后下降的明显变化趋势。
-
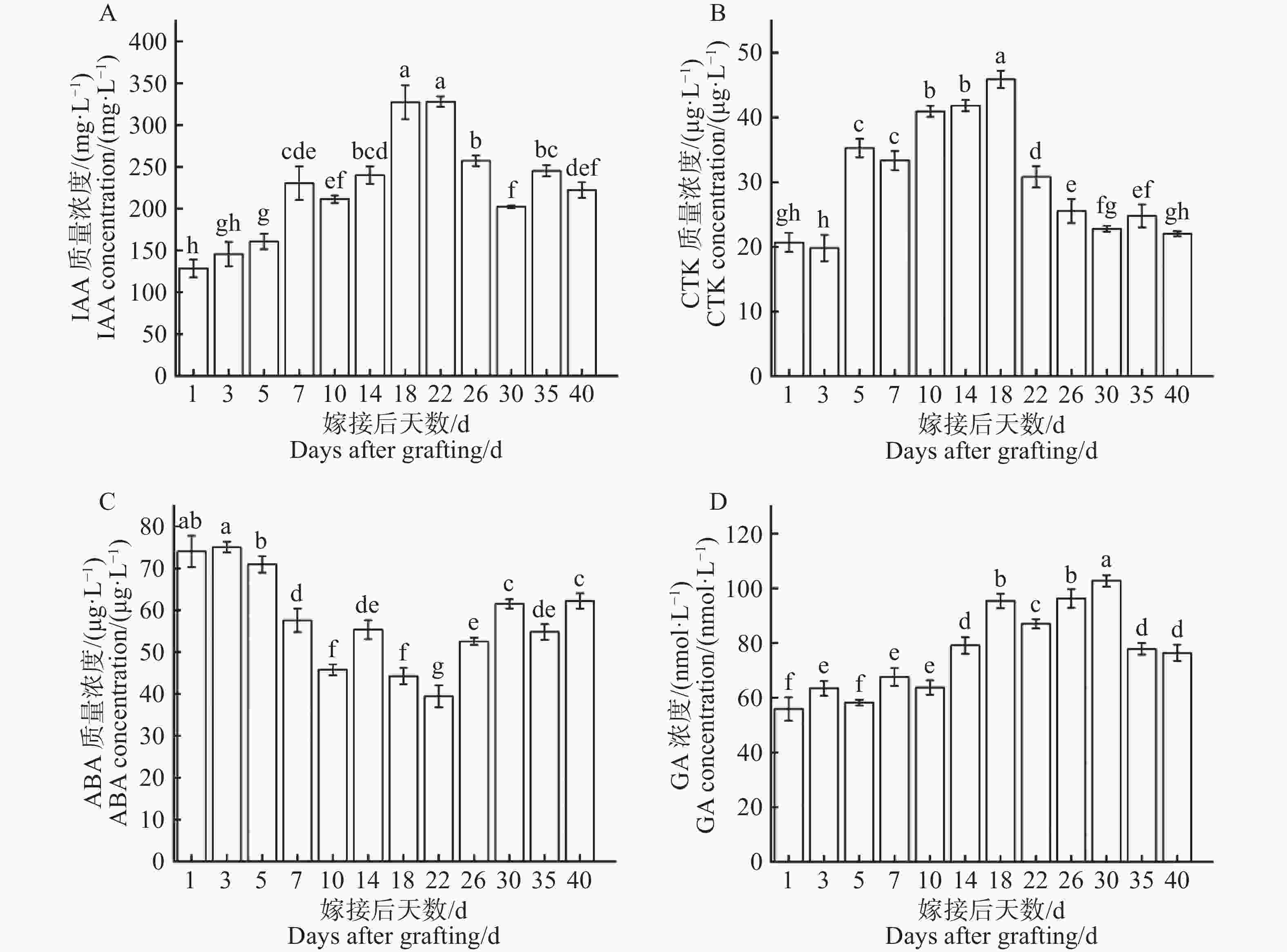
从图8−A可知,在嫁接后1~22 d激素IAA浓度波动上升,在第22天上升至最高点(328.2 mg·L−1),随即在第22~30天激素IAA浓度逐步下降,在第30~40天激素IAA浓度波动起伏逐渐平稳。第1天为最低点(128.7 mg·L−1),最高点是最低点的2.55倍。激素IAA浓度在整个嫁接愈合过程中总体呈现出先上升后下降的变化趋势。如图8−B所示,在1~18 d激素CTK浓度持续上升,在第18天上升至最高点(45.89 μg·L−1),随即在第18~22 d激素CTK浓度急剧下降,在第22~40 d激素CTK浓度波动起伏逐渐平稳,第3 d为最低点(19.79 μg·L−1)最高点是最低点的2.32倍。激素CTK浓度在整个嫁接愈合过程中总体呈现出先上升后下降的变化趋势。从图8−C可知,在1~22 d激素ABA浓度持续下降,在第22天下降至最低点(39.41 μg·L−1),随即在第22~40天激素ABA浓度波动性上升,第3天为最高点(75.08 μg·L−1),最高点是最低点的1.91倍。激素ABA浓度在整个嫁接愈合过程中呈现出先下降后上升的明显变化趋势。如图8−D所示,在1~30 d激素GA浓度波动性上升,在第30天上升至最高点(102.7 nmol·L−1),随即在第30~40 d激素GA浓度急剧下降,第1天为最低点(55.87 nmol·L−1),最高点是最低点的1.84倍。激素GA浓度在整个嫁接愈合过程中呈现出先上升后下降的变化趋势。
-
对嫁接愈合整个过程中各生理生化指标数值进行相关性分析,从表1可知,除CAT与可溶性蛋白、POD及SOD与可溶性糖无显著相关性之外,其余各指标之间均呈显著相关(P<0.05)趋势,特别是可溶性糖与可溶性蛋白、SOD与可溶性蛋白、SOD与POD及SOD与CAT之间均存在极为显著的正相关(P<0.01)关系,CAT与可溶性糖呈现极为显著负相关(P<0.01)趋势。通过相关性分析,嫁接愈合过程中多种生理生化指标之间呈现出显著的相关性,特别是一些抗氧化酶与可溶性糖、可溶性蛋白之间的关系。SOD、CAT和POD作为抗氧化酶,可能通过减轻氧化应激,促进愈合过程中的细胞修复和代谢。与此同时,可溶性糖与可溶性蛋白的显著正相关也提示它们在植物愈合过程中可能相互支持,维持愈合所需的能量和物质合成。
表 1 嫁接体接口愈合过程中生理生化指标的相关分析
Table 1. Correlation Analysis of Physiological and Biochemical Indicators During the Grafting Interface Healing Process
指标
Indicators可溶性蛋白
Soluble Protein Content可溶性糖
Soluble Sugar ContentPOD SOD CAT 可溶性蛋白
Soluble Protein Content1.000 — — — — 可溶性糖
Soluble Sugar Content0.612** 1.000 — — — POD 0.412* 0.358* 1.000 — — SOD 0.471** −0.051 0.598** 1.000 — CAT −0.324 −0.652** 0.155 0.484** 1.000 注:*和**分别表示性状间的相关性达到显著(P<0.05)或极显著(P<0.01)水平,下同。 Note: * denotes a significant correlation (P<0.05), while ** indicates an extremely significant correlation (P<0.01), similarly hereinafter. 对嫁接愈合整个过程中IAA、CTK、GA、ABA的含量进行相关性分析,由表2可知,除CTK与GA无显著相关性之外,其余各指标之间均呈显著相关(P<0.05)趋势。其中,IAA与CTK、IAA与GA呈现极为显著正相关(P<0.01)趋势,ABA与CTK、GA、IAA呈现极为显著负相关(P<0.01)趋势。IAA与CTK、GA之间呈现显著的正相关关系,表明它们在嫁接愈合过程中通过协同作用共同促进愈伤组织的生成和植物的生长。ABA与IAA、CTK、GA之间存在显著的负相关,作为植物应激反应的关键激素,ABA通过抑制细胞过度分裂与生长,协助植物应对逆境。它通过与IAA、CTK、GA的负相关作用,调控植物的生长,以减少不必要的能量消耗,从而增强植物在不良环境条件下的生存能力。
表 2 嫁接体接口愈合过程中内源激素指标的相关分析
Table 2. Correlation Analysis of Endogenous Hormone Indicators During the Grafting Interface Healing Process
指标
IndicatorsCTK IAA GA ABA CTK 1.000 — — — IAA 0.384* 1.000 — — GA 0.006 0.667** 1.000 — ABA −0.470** −0.895** −0.546** 1.000 -
嫁接愈合是一个复杂的生物学过程,通常包括多个阶段,尽管不同研究者对愈合阶段的划分有所不同,但愈合过程一般包括隔离层形成、愈伤组织形成、愈伤组织分化、形成层分化及维管组织形成等关键阶段,最终促使砧木与接穗在细胞和组织层面实现连接,从而结合成1个新个体。美国山核桃(Carya illinoinensis)嫁接愈合过程分为4个阶段[12],梨树嫁接愈合过程可分为愈伤组织形成期和维管形成层形成及活动期2个阶段[13];圆齿野鸦椿(Euscaphis konishii)嫁接愈合过程可分为3个阶段[14],将山苍子(Litsea cubeba)嫁接愈合过程可分为4个阶段[15]。尽管嫁接体愈合过程展示相似的解剖特征,但嫁接成活时间受植物种类、年龄、嫁接方法和部位等多种因素的影响,各类植物的愈合时间表现出明显差异。例如,美国山核桃在嫁接后第30天即可实现砧穗的结合[12],油茶(Camellia oleifera)在第35天形成维管束桥[6],而黄瓜(Cucumis sativus)则在第12天愈合部位形成新维管束 [16],马铃薯与枸杞嫁接后第17天愈合完成[17]。这些时间差异反映了植物种类、年龄、嫁接方式和部位等因素对植物愈合能力和速度的显著影响。本实验中,木棉的嫁接愈合在第40天完成愈合,根据嫁接口在愈合过程中的动态变化,本研究结果表明,木棉嫁接愈合过程可分为4个阶段,分别是隔离层形成期(第0~3天);愈伤组织形成期(第3~10天);愈伤组织分化和连接期(第10~22天);形成层连接和维管组织分化期(第22~40天),前22天是决定嫁接成活的关键期,而前40天,则对嫁接苗的存活至关重要。
-
在木棉嫁接愈合过程中,可溶性糖和可溶性蛋白的含量动态变化在不同愈合阶段发挥着至关重要的作用。可溶性糖主要提供了嫁接过程中的能量支持,并帮助调节嫁接部位的渗透压,确保水分和养分的有效运输[18 − 20]。本研究结果表明,可溶性糖在嫁接愈合中整体趋势为先下降后升高,可溶性糖在愈伤组织形成阶段含量最低,是由于隔离层阻隔了砧穗间养分运输通道,可溶性糖下降,而愈伤组织的形成也需要大量消耗可溶性糖来提供能量。这与潘淑民[21]的研究结果基本一致。可溶性蛋白通过调节植物激素的合成和信号传递,促进细胞分裂、扩展和愈伤组织的形成,通过参与细胞壁的重构和愈伤组织的合成,调节嫁接部位的组织修复,加速嫁接愈合过程并提高嫁接成功率,在嫁接愈合过程中起到关键作用[22 − 23]。本研究结果表明,可溶性蛋白质在嫁接愈合中整体趋势为先下降后升高先下降后上升再下降,蛋白质含量在形成层连接和维管组织分化阶段达到高峰,是由于在维管组织形成阶段,细胞壁重构和维管组织的分化需要大量可溶性蛋白的支持,因此蛋白质含量达到高峰,这与王习政等[15]的研究结果基本一致。
-
植物细胞抗氧化系统清除酶主要包括CAT、SOD、POD,可作为嫁接亲和性的判定指标[24 − 25]。在木棉嫁接愈合过程中,POD、SOD和CAT通过协同作用,有效地清除活性氧,减轻氧化损伤,促进伤口愈合。POD主要通过有效保护膜结构,促进木质素合成,增强伤口结构稳定性;SOD通过转化超氧化物为过氧化氢,清除氧化损伤,维持细胞内的氧化还原平衡;CAT则通过分解过氧化氢,保护细胞免受氧化毒害,促进伤口愈合[26−27]。本研究结果表明,POD、SOD和CAT 3类抗氧化酶活性在嫁接初期上升,是由于嫁接口受机械损伤后激活了抗氧化系统,增强了自由基清除能力,有效防止了氧化损伤,随着细胞的快速增殖和分化产生大量活性氧(ROS),3类抗氧化酶在愈伤组织分化和连接阶段均达到最高峰,随后随着形成层和维管组织的稳定,3类抗氧化酶活性下降后平稳波动。杨冬冬等[28]的研究结果表明,西瓜嫁接体中POD活性的增加与木质素合成相关,本实验中POD活性的上升趋势可能与细胞木质化反应的增加有关,表明POD活性的提升有助于接合部的愈合。张旭阳等[29] 的研究结果也表明,嫁接后愈合过程中,POD活性先上升后下降,这与本实验的结果基本一致。胡艳青等[16]的研究结果表明,嫁接初期,SOD活性升高,有利于转化超氧化物阴离子(O2−)为过氧化氢(H2O2)来减轻氧化损伤;嫁接体成活后,SOD活性随之下降,SOD呈现先上升后下降的趋势,嫁接初期,CAT活性增强,有助于清除氧自由基、减轻氧化损伤并去除多余的H2O2;嫁接稳定后,CAT活性下降。上述研究均与本实验结果一致,本研究结果表明,POD、SOD、CAT活性的增强对嫁接体愈伤组织的形成具有促进作用,在嫁接体逐渐稳定后,3类酶活性随之下降,通过3类酶的活性变化初步判定在木棉嫁接愈合过程中愈伤组织分化和连接期是关键阶段。
-
植物内源激素是嫁接体发育的关键因子之一[30−31],在本研究中,探讨了IAA、CTK、GA和ABA等植物激素含量在木棉嫁接愈合过程中的动态变化。在本研究中,3种激素均呈现先上升后下降的趋势,在相关性分析中呈现显著正相关,在嫁接愈合过程,IAA、GA和CTK协同作用,刺激细胞分裂分化,促进维管束形成及木质部与韧皮部的连接,Zhang等[31]也得出了类似的结果。本研究结果表明,IAA和CTK在愈伤组织分化和连接阶段质量浓度达到最高峰,支持愈伤组织的增生与初步连接,并协同调节愈伤组织向功能性维管组织的转化,确保接穗与砧木间形成高效的运输通道。GA在形成层连接和维管组织分化阶段质量浓度达到最高峰,以促进细胞的伸长,推动导管和筛管的形成,帮助形成新的维管组织,与Melnyk 等[32]的研究结果一致。ABA与上述3种激素均呈现显著负相关,在本实验中呈现先下降后上升的趋势,ABA作为一种抗逆境的激素,在嫁接过程中主要通过提高植物的抗逆性、减缓胁迫下的不必要的生长以及平衡植物激素来促进愈合过程。本研究结果表明,ABA在隔离层阶段质量浓度最高,ABA通过抑制伤口区域细胞的过度分裂,促进伤口的愈合环境稳定,避免了伤口部位的过度反应,在细胞增殖分化阶段浓度降低,这与IKEUCHI等[33] 的研究结果一致。
-
本研究发现,可溶性糖与可溶性蛋白之间呈现极为显著的正相关(P<0.01)。在嫁接愈合过程中,植物可能通过增加可溶性糖的含量来促进可溶性蛋白的合成。这是因为可溶性糖不仅为植物提供能量,而且参与了许多代谢过程,包括蛋白质合成。可溶性糖作为能量来源,为蛋白质合成提供必要的能量支持。特别是在愈伤组织的形成和愈合过程中,细胞分裂和蛋白质的合成是关键活动,糖类提供能量,维持细胞的代谢活动,进而促进愈伤组织的生长与修复。也有研究表明,插穗在逆境响应中通过激活蛋白酶系统加速大分子物质水解代谢,促使可溶性蛋白含量显著提升;并使淀粉酶介导的碳源分解代谢与叶片光合产物共同驱动可溶性糖的积累,二者呈协同作用[34]。本研究结果表明,SOD与POD之间呈现极为显著正相关(P<0.01)。这2种抗氧化酶在植物的氧化应激反应中共同作用,SOD通过减少超氧阴离子自由基的积累,降低细胞氧化损伤,而POD则进一步分解过氧化氢,减少由过氧化氢引起的细胞损伤。在愈合过程中,SOD和POD协同作用,共同清除植物体内的过氧化物和自由基。SOD与CAT之间呈现极为显著正相关(P<0.01)。SOD主要负责清除超氧阴离子自由基,而CAT则进一步清除过氧化氢,防止其积累并对细胞造成损害。SOD和CAT共同工作,减少氧化损伤,促进细胞的修复和代谢。朱丽丽等[35]的研究结果也表明,柑橘在胁迫条件下 主要通过POD、SOD和CAT三者协同作用,使自由基维持在一个低水平,从而防止自由基伤害。本研究结果表明,IAA与CTK之间呈现出极为显著的正相关(P<0.01)。IAA与CTK协同作用,共同调控植物的生长。在愈伤组织形成及植物发育过程中,两者通过互相调节共同促进细胞的分裂与扩展,进而加速愈伤组织的形成,推动植物组织的生长与愈合过程。IAA与GA之间也呈现出极为显著的正相关(P<0.01)。IAA和GA之间存在协同作用,尤其在植物生长和发育过程中,二者共同促进细胞的分裂和伸长。GA主要负责调节细胞的伸长与愈伤组织的扩展,而IAA则主要调节细胞分裂,二者的协同作用有效促进了植物的正常生长及愈合过程。上述结果与Schaller等[36]的研究结果一致:CTK,GA的作用通常通过与IAA信号通路相互作用而发生,激素互作调控细胞。本研究结果表明,ABA与IAA之间呈现极为显著的负相关(P<0.01)。IAA通常促进植物的生长和细胞的伸长,而ABA则在植物面对不良环境(如干旱、盐分等)时发挥抑制作用,减少过度的细胞扩展。ABA通过减少IAA的作用,帮助植物应对逆境,抑制不必要的生长。张佳兴等[37]的研究结果也表明,IAA的降低和ABA的升高体现了拮抗作用,显著影响着无患子(Sapindus mukorossi)的嫁接愈合的过程。
-
本实验通过对木棉嫁接结合部进行解剖学显微观察,木棉嫁接愈合过程可分为隔离层形成期(第0~3天);愈伤组织形成期(第3~10天);愈伤组织分化和连接期(第10~22天);形成层连接和维管组织分化阶段(第22~40天)这4个阶段,前22 d是决定嫁接成活的关键期,而前40 d则对嫁接苗的存活至关重要。在生理生化分析中,多数生理生化指标在愈伤组织的分化和连接期会达到最高峰,这进一步证实了该时期是嫁接愈合过程中的关键环节,本研究未直接测定ROS含量,但嫁接早期抗氧化酶活性动态提示氧化应激的存在。未来将整合ROS原位检测与转录组分析,精准解析木棉嫁接中氧化还原调控网络,从多方面深入探讨木棉嫁接愈合的形成机制,推动木棉优良无性系的繁育与应用。
木棉嫁接愈合过程组织解剖与生理生化特性研究
DOI: 10.15886/j.cnki.rdswxb.20240192
 CSTR: 32425.14.j.cnki.rdswxb.20240192
CSTR: 32425.14.j.cnki.rdswxb.20240192
Tissue anatomy, physiological and biochemical changes of Bombax ceiba during graft healing
-
摘要: 为了深入研究木棉(Bombax ceiba)嫁接及其愈合机制,以美丽异木棉(Ceiba speciosa)为砧木,以木棉1年生枝为接穗,采用劈接嫁接技术,于嫁接后不同时期取嫁接结合部位组织采用硬组织切片技术,观察嫁接愈合过程中组织结构的变化;测定可溶性糖、可溶性蛋白、过氧化物酶(POD)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)等生理指标;并采用酶联免疫吸附法测定嫁接结合部相关内源激素含量。木棉嫁接愈合过程可分为4个阶段,分别是隔离层形成期(第0~3天);愈伤组织形成期(第3~10天);愈伤组织分化和连接期(第10~22天);形成层连接和维管组织分化阶段(第22~40天);前22 d是决定嫁接成活的关键期,40 d内则是嫁接苗成活的重要阶段。可溶性蛋白含量在嫁接愈合过程中呈现出先下降后上升再下降的变化趋势,可溶性糖在整个嫁接愈合过程中呈现出先下降后上升的变化趋势,两者均在形成层连接和维管组织分化阶段含量达到最高峰。POD、SOD和CAT活性在嫁接愈合过程中先上升后下降,三者协同作用均在愈伤组织分化和连接期活性达到高峰。生长素(IAA)、赤霉素(GA)和细胞分裂素(CTK) 3种激素促进细胞分裂与维管组织形成;IAA与CTK在愈伤组织分化和连接阶段质量浓度达到最高峰,GA在形成层连接和维管组织分化阶段质量浓度达到最高峰,脱落酸(ABA)质量浓度则呈下降后上升趋势,ABA会抑制愈伤组织细胞的增殖。Abstract: To investigate the grafting compatibility and healing mechanisms of Bombax ceiba, one-year-old branches of Bombax ceiba were grafted onto Ceiba speciosaby using the cleft grafting method, and graft union tissues were collected at various post-grafting stages for histological observation via hard tissue sectioning to analyze structural changes during the healing of graft union. Physiological activities of soluble sugars, soluble proteins, peroxidase (POD), catalase (CAT), and superoxide dismutase (SOD) were quantitatively assessed, while endogenous hormone levels at the graft union were determined using enzyme-linked immunosorbent assay (ELISA).The healing process of the graft is divided into four distinct stages: isolation layer formation stage (Day 0–3), callus formation stage (Day 3–10), callus differentiation and connection stage (Day 10–22), and cambial connection and vascular tissue differentiation stage (Day 22–40). The first 22 days after grafting are critical for determining whether a viable graft union can form, and the first 40 days are crucial for graft survival. The activities of POD, SOD, and CAT initially increased and then decreased during the healing process, with their peak activities observed during the callus differentiation and connection stage. The hormones IAA, GA, and CTK promoted cell division and vascular tissue formation. The concentrations of IAA and CTK peaked during the callus differentiation and connection stage, while GA reached its highest concentration during the cambial connection and vascular tissue differentiation stage. ABA levels showed a decreasing trend followed by an increase, with ABA inhibiting the proliferation of callus cells.
-
图 2 隔离层形成期横切图
A.嫁接后1 d横切详图;B.嫁接后3 d横切详图;Sc.接穗;St.砧木;IL.隔离层。下同。
Fig. 2 Transverse section at the formation stage of the isolation layer
A. Cross-sectional detail of grafting after 1 day; B.Cross-sectional detail of grafting after 3 days Sc. Scion; St. Rootstock; IL. Isolation layer. similarly hereinafter.
图 4 愈伤组织分化和连接横切图
A.嫁接后14 d横切详图;B.嫁接后18 d横切详图;C.嫁接后22 d横切详图。
Fig. 4 Transverse section showing callus differentiation and vascular connection
A.Cross-sectional detail of grafting 14 days post-grafting; B. Cross-sectional detail of grafting 18 days post-grafting; C. Cross-sectional detail of grafting 22 days post-grafting.
图 5 形成层连接和维管组织分化横切图
A.嫁接后26 d横切详图;B.嫁接后30 d横切详图;C.嫁接后35 d横切详图;D.嫁接后40 d横切详图;Sc.接穗;St.砧木;Ca.形成层;V.导管;Xy.木质部;Ph.韧皮部;Xr.木射线;Pi.髓。
Fig. 5 Transverse section of cambium layer connection and vascular tissue differentiation
A.Cross-sectional detail of grafting 26 days post-grafting; B.Cross-sectional detail of grafting 30 days post-grafting; C.Cross-sectional detail of grafting 35 days post-grafting; D. Cross-sectional detail of grafting 40 days post-grafting; Sc.Scion; St. Rootstock; Ca. Cambium layer; V. Vessel; Xy. Xylem; Ph. Phloem; Xr. Xylem ray; Pi.Pith.
图 6 嫁接结合部愈合过程中营养物质含量动态变化
A.嫁接愈合中可溶性蛋白的变化趋势;B. 嫁接愈合中可溶性糖的变化趋势;图中的误差线上方用不同小写字母表示各指标在不同时间点差异达显著水平(P<0.05)。下同。
Fig. 6 Dynamic changes in nutrient content during the graft union healing process
A. Changes in Soluble Proteins during Graft Healing; B. Changes in Soluble Sugars during Graft Healing; Different lowercase letters above the error bars indicate significant differences (P < 0.05) in the values of each parameter at different time points. similarly hereinafter.
图 7 嫁接结合部愈合过程中酶活性动态变化
A. 嫁接愈合中过氧化物酶的变化趋势;B.嫁接愈合中超氧化物歧化酶的变化趋势;C.嫁接愈合中过氧化氢酶的变化趋势。
Fig. 7 Dynamic changes in enzyme activity during the graft union healing process
A. Changes in Peroxidase during Graft Healing; B. Changes in Superoxide Dismutase during Graft Healing; C. Changes in Catalase during Graft Healing.
图 8 嫁接结合部愈合过程中内源激素含量动态变化
A.嫁接愈合中生长素的变化趋势;B. 嫁接愈合中细胞分裂素的变化趋势;C. 嫁接愈合中脱落酸的变化趋势;D. 嫁接愈合中赤霉素的变化趋势。
Fig. 8 Dynamic changes in endogenous hormone levels during the graft union healing process
A. Changes in Auxin during Graft Healing; B. Changes in Cytokinin during Graft Healing; C.Changes in Abscisic Acid during Graft Healing; D. Changes in Gibberellin during Graft Healing.
表 1 嫁接体接口愈合过程中生理生化指标的相关分析
Table 1 Correlation Analysis of Physiological and Biochemical Indicators During the Grafting Interface Healing Process
指标
Indicators可溶性蛋白
Soluble Protein Content可溶性糖
Soluble Sugar ContentPOD SOD CAT 可溶性蛋白
Soluble Protein Content1.000 — — — — 可溶性糖
Soluble Sugar Content0.612** 1.000 — — — POD 0.412* 0.358* 1.000 — — SOD 0.471** −0.051 0.598** 1.000 — CAT −0.324 −0.652** 0.155 0.484** 1.000 注:*和**分别表示性状间的相关性达到显著(P<0.05)或极显著(P<0.01)水平,下同。 Note: * denotes a significant correlation (P<0.05), while ** indicates an extremely significant correlation (P<0.01), similarly hereinafter. 表 2 嫁接体接口愈合过程中内源激素指标的相关分析
Table 2 Correlation Analysis of Endogenous Hormone Indicators During the Grafting Interface Healing Process
指标
IndicatorsCTK IAA GA ABA CTK 1.000 — — — IAA 0.384* 1.000 — — GA 0.006 0.667** 1.000 — ABA −0.470** −0.895** −0.546** 1.000 -
[1] 王健, 水庆艳, 宋希强. 木棉(Bombax ceiba)名称辨析与栽培应用[J]. 热带作物学报, 2009, 30(12): 1764 − 1769. doi: 10.3969/j.issn.1000-2561.2009.12.010 [2] 王秋萍, 黄晖星. 岭南文学中木棉意象的内涵及价值[J]. 唐山学院学报, 2020, 33(2): 84 − 88. doi: 10.16160/j.cnki.tsxyxb.2020.02.010 [3] 唐微艳, 苏瑞权, 杨斌. 木棉花药理成分及作用的研究进展[J]. 广西医学, 2020, 42(18): 2433 − 2436. doi: 10.11675/j.issn.0253-4304.2020.18.25 [4] 陈雷, 孙冰, 廖绍波, 等. 木棉资源培育及园林应用研究进展[J]. 浙江农林大学学报, 2014, 31(5): 798 − 804. doi: 10.11833/j.issn.2095-0756.2014.05.022 [5] 田向楠, 伍建榕, 郑艳玲, 等. 木棉植物相关研究进展[J]. 林业调查规划, 2014, 39(4): 36 − 41. doi: 10.3969/j.issn.1671-3168.2014.04.008 [6] 冯金玲, 陈辉, 陈世品, 等. 油茶芽苗砧嫁接口愈合与内源激素的关系[J]. 森林与环境学报, 2018, 38(1): 27 − 32. doi: 10.13324/j.cnki.jfcf.2018.01.005 [7] 苏文川. 薄壳山核桃嫁接愈合的解剖学和生理生化特性研究 [D]. 南京: 南京林业大学, 2016. [8] ALONI B, COHEN R, KARNI L, et al. Hormonal signaling in rootstock-scion interactions[J]. Scientia Horticulturae, 2010, 127(2): 119 − 126. doi: 10.1016/j.scienta.2010.09.003 [9] 卢善发, 宋艳茹. 激素水平与试管苗离体茎段嫁接体维管束桥分化的关系[J]. 科学通报, 1999, 44(13): 1422 − 14241425. doi: 10.3321/j.issn:0023-074X.1999.13.014 [10] 杨梅, 吴昊, 王晓玲. 硫酸–蒽酮法测定糯米藤中多糖的含量[J]. 西南民族大学学报(自然科学版), 2011, 37(5): 776 − 778. doi: 10.3969/j.issn.1003-2483.2011.09.22 [11] 余平福, 蓝学, 覃林海. 不同供磷水平对油茶幼苗生长生理指标和养分含量的影响[J]. 安徽农业科学, 2018, 46(24): 114 − 116. doi: 10.3969/j.issn.0517-6611.2018.24.036 [12] 兖攀, 彭方仁, 张瑞, 等. 美国山核桃嫁接愈合过程的组织细胞学观察[J]. 南京林业大学学报(自然科学版), 2018, 42(2): 202 − 206. doi: 10.3969/j.issn.1000-2006.201703067 [13] 初庆刚, 张长胜. 梨树嫁接愈合的解剖观察[J]. 莱阳农学院学报, 1992, 9(4): 256 − 259. [14] 黄航, 刘聪, 万瑞琪, 等. 圆齿野鸦椿嫁接愈合过程的显微观察及嫁接体酶活性的变化分析[J]. 经济林研究, 2022, 40(3): 55 − 64. doi: 10.14067/j.cnki.1003-8981.2022.03.006 [15] 王习政, 陈霞, 苏文娟, 等. 山苍子嫁接愈合过程的组织解剖和生理特性[J]. 中南林业科技大学学报, 2024, 44(3): 56 − 64. doi: 10.14067/j.cnki.1673-923x.2024.03.006 [16] 胡艳青, 苏媛, 韩风叶, 等. 嫁接黄瓜在愈合过程中的解剖观察和抗氧化酶活性的变化研究[J]. 内蒙古农业大学学报(自然科学版), 2007, 28(3): 224 − 230. doi: 10.3969/j.issn.1009-3575.2007.03.051 [17] 李越. 马铃薯与枸杞嫁接愈合过程解剖学观察及属间有性杂交初探 [D]. 张家口: 河北北方学院, 2020. doi: 10.27767/d.cnki.ghbbf.2020.000234 [18] WANG T, DENG L J, HUANG S J, et al. Genetic relationship, SPAD reading, and soluble sugar content as indices for evaluating the graft compatibility of citrus interstocks[J]. Biology, 2022, 11(11): 1639. doi: 10.3390/biology11111639 [19] WANG L, RUAN Y L. Regulation of cell division and expansion by sugar and auxin signaling[J]. Frontiers in Plant Science, 2013, 4: 163. doi: 10.3389/fpls.2013.00163 [20] MIAO L, LI Q, SUN T S, et al. Sugars promote graft union development in the heterograft of cucumber onto pumpkin[J]. Horticulture Research, 2021, 8(1): 146. doi: 10.1038/s41438-021-00580-5 [21] 潘淑民. 江南油杉嫁接愈合的解剖学与生理变化研究 [D]. 南宁: 广西大学, 2024. doi: 10.27034/d.cnki.ggxiu.2024.001980 [22] 侯毅兴, 阿克居里德孜·努尔改里得, 薛靖, 等. 鲜食葡萄砧穗组合生理指标及亲和力分析[J]. 中外葡萄与葡萄酒, 2022(2): 33 − 37. doi: 10.13414/j.cnki.zwpp.2022.02.005 [23] 马攀. 不同砧木嫁接甜柿亲和性生理机制研究 [D]. 北京: 中国林业科学研究院, 2015. [24] 严毅, 张南新, 何承忠, 等. 葡萄柚不同砧木嫁接亲和性与保护酶活性相关性分析[J]. 北方园艺, 2012(11): 8 − 11. [25] 朱太富, 王赟, 苏效兰, 等. 葡萄柚嫁接愈合过程中砧穗生理物质特性及其与嫁接亲和性的关系[J]. 江苏农业科学, 2022, 50(13): 141 − 147. doi: 10.15889/j.issn.1002-1302.2022.13.023 [26] 郝建军, 刘延吉. 植物生理学实验技术 [M]. 2版. 沈阳: 辽宁科学技术出版社, 2001. [27] 杨瑞. 葡萄砧穗组合筛选及嫁接早期亲和力研究[D]. 兰州: 甘肃农业大学, 2007. [28] 杨冬冬, 黄丹枫. 西瓜嫁接体发育中木质素合成及代谢相关酶活性的变化[J]. 西北植物学报, 2006, 26(2): 290 − 294. doi: 10.3321/j.issn:1000-4025.2006.02.011 [29] 张旭阳, 王铃钰, 于俊川, 等. 不同砧穗苗龄对斜插法黄瓜嫁接苗愈合及生理性状的影响[J]. 南方农业学报, 2024, 55(9): 2734 − 2743. [30] 卢善发, 宋艳茹. 嫁接接合部维管组织分化的激素调节[J]. 云南植物研究, 1999, 21(4): 483 − 490. doi: 10.3969/j.issn.2095-0845.1999.04.013 [31] ZHANG J, AI D, MENG J X, et al. Research progress on interactive mechanism between rootstock and scion after plant grafting[J]. Journal of Northwest A&F University (Natural Science Edition)J. Northwest Sci. Tech. Univ. , 2022, 50(5): 139−145. doi: 10.13207/j.cnki.jnwafu.2022.05.015 [32] MELNYK C W, SCHUSTER C, LEYSER O, et al. A developmental framework for graft formation and vascular reconnection in Arabidopsis thaliana[J]. Current Biology, 2015, 25(10): 1306 − 1318. doi: 10.1016/j.cub.2015.03.032 [33] IKEUCHI M, IWASE A, RYMEN B, et al. Wounding triggers callus formation via dynamic hormonal and transcriptional changes[J]. Plant Physiology, 2017, 175(3): 1158 − 1174. doi: 10.1104/pp.17.01035 [34] 张于卉, 吴文, 沈永宝, 等. 外源吲哚丁酸促进对榉树硬枝扦插[J]. 农业与技术, 2018, 38(21): 81 − 83. doi: 10.11974/nyyjs.20181131031 [35] 朱丽丽. 柑橘应答低温胁迫的生理生化变化[D]. 武汉: 华中农业大学, 2008. [36] SCHALLER G E, BISHOPP A, KLEBER KIEBER J J. The Yin-Yang of hormones: cytokinin and auxin interactions in plant development[J]. The Plant Cell, 2015, 27(1): 44 − 63. doi: 10.1105/tpc.114.133595 [37] 张佳兴, 卢俊杰, 杨琪, 等. 无患子嫁接口愈合与内源激素的关系[J]. 特种经济动植物, 2023, 26(3): 43 − 48. doi: 10.3969/j.issn.1001-4713.2023.03.015 -




 下载:
下载: