-
木棉(Bombax ceiba)为木棉科木棉属多年生落叶乔木,又名斑芝树、英雄花和攀枝花等。它的花期处于冬春之际,花朵大多呈现红色,观赏价值颇高,在中国广东、广西、海南和云南等地广泛种植[1]。在中国南方民间,木棉花常被当作健康食材,人们会将它与肉类一同炖汤,或与米共煮成粥食用[2]。这种花也是一种传统中药材,与其他4种药用植物的花混合,制成名为 “五花茶” 的保健茶[3]。木棉花味甘、性凉,具清热凉血止血、利湿解毒之效,可用于治疗腹泻、慢性炎症、发热、肝炎、痢疾和痔疮出血等症[4]。现代药理研究显示,木棉花具有多种生物活性,如抗氧化[5]、抗炎[6]、抗癌[7]、抗菌[8]、降血糖[9]、以及保肝[10]和心血管系统[11]。同时,木棉花的化学成分丰富,主要包含挥发油类、黄酮类、苯丙素类、甾体类、脂肪酸类、微量元素,以及三萜类化合物、酚酸类化合物等。黄酮类化合物多具有较强的清除自由基(抗氧化)能力,并兼具降压、降脂、延缓衰老、增强免疫力、泻下、镇咳、祛痰、解痉及抗变态等多种生物活性[12 − 14]。木棉花作为药食同源的传统中药材,蕴含丰富生物活性成分,在医药保健领域极具开发潜力。木棉花发挥抗氧化作用主要包括甲醇提取物、水提物、乙醇提取物、丙酮提取物及乙醚提取物等类型。VIEIRA等[15]发现,木棉花的甲醇提取物不仅对 DPPH 自由基具有显著的清除作用,还能有效抑制微粒体及大豆卵磷脂脂质的过氧化过程。有研究表明,木棉花石油醚提取物对DPPH自由基的清除活性最强,乙醚提取物则在β−胡萝卜素漂白试验中表现出更优的清除效果[16]。尽管木棉花体外抗氧化活性已有众多报道,但针对其水提取物抗氧化活性的系统性探索仍有待深入。本研究通过考察不同料液比与煎煮时间对木棉花水提取物(BWE)总黄酮含量的影响,结合 DPPH 自由基清除率、ABTS 自由基清除率及铁离子还原能力等抗氧化指标,筛选出 BWE的最优制备参数。同时,运用液相色谱-质谱联用(LC-MS)技术解析其化学成分,旨在为 BWE 在抗氧化功能性饮品、天然化妆品等领域的产业化应用提供科学依据与数据支撑。
-
木棉花采集于海南省昌江黎族自治县(N 18°53′—19°30′, E108°38′—109°17′);芦丁(北京索莱宝科技有限公司);1,1−二苯基−2−三硝基苯肼(1,1-diphenyl-2-picryl-hydrazyl radical,DPPH,CAS:1898-66-4)、2,4,6三吡啶基三嗪(2,4,6 Tri(2-pyridyl)-s-triazine,TPTZ,CAS:
3682 -35-7)(上海阿拉丁生化科技股份有限公司);2,2−联氮−二(3−乙基−苯并噻唑−6−磺酸)二铵盐(2,2'-Azinobis-(3-ethylbenzthiazoline-6-sulphonate), ABTS,CAS:30931 -67-0)、盐酸、过硫酸钾、乙酸钠、磷酸氢二钾、三氯化铁(上海麦克林生化科技有限公司);其余化学试剂均为分析纯。 -
电热鼓风干燥箱(DHG-9070A,上海一恒科学仪器有限公司);中草药粉碎机(FW177,天津市泰斯特仪器有限公司);电热恒温水浴锅(HH−S4,北京科伟永兴仪器有限公司);旋转蒸发器(RE−2000A,上海亚荣生化仪器厂);电子分析天平(AX124ZH,常州奥豪斯仪器有限公司);紫外可见分光光度计(V−T3,上海屹谱仪器制造有限公司)。隔膜真空泵(SCJ−10,绍兴市苏珀仪器有限公司);普力菲尔超纯水机(FST−I−05,上海富诗特仪器设备有限公司);pH计(FE28−Standard,上海梅特勒−托利多仪器有限公司);真空冷冻干燥机(Lab4085,南京金实仪器设备有限公司)。
-
木棉花水提物Bombax ceiba water extract(简称BWE)的提取参考文献[17]的方法并做修改。称取木棉花粉末80 g,以蒸馏水为溶剂,料液比(m/v)分别为 1∶10、1∶12.5、1∶15,浸泡30 min,每10 min搅拌1次,然后煎煮 1 h和1. 5 h( 温度 100 ℃ ),滤出药液,残渣用蒸馏水煎煮提取3次。合并3次滤液,旋转蒸发浓缩至 100 mL,制成每毫升 0. 8 g 生药的木棉花水提物,4 ℃ 保存备用。
-
使用亚硝酸钠-硝酸铝比色法测定样品中的总黄酮含量[18 − 19],并结合课题组经验做了修改。提前制备成芦丁浓度为 0.2 g·L−1 的标准液。分别取不同浓度芦丁标准液,以φ=75%的乙醇做空白对照,加入w=5%亚硝酸钠 1.5 mL,混匀,静置6 min;立即加入 w=10%硝酸铝 1.5 mL,混匀,静置6 min;最后加入w=4%氢氧化钠4 mL和φ=75%乙醇2 mL混匀后室温静置30 min,于510 nm 波长下测定各浓度标样的吸光值,以吸光度值为纵坐标,芦丁对照品溶液浓度为横坐标,绘制标准曲线。
-
按照1.3.2的方法,吸取木棉花水提取液1mL置于10 mL容量瓶中,将相应的吸光值带入芦丁的标准工作曲线,根据下式(1)计算总黄酮含量(Y)。
$$ \mathit{Y} \mathrm{=(} \mathit{C} _{ \mathrm{1}} \mathrm{\times } \mathit{V} _{ \mathrm{2}} \mathrm{)\times 100{\text{%}}/} \mathit{V} _{ \mathrm{1}} \mathrm{\times } \mathit{m} \mathrm{\times 1\;000\text{,}} $$ (1) 式中,Y为原料中可提取的总黄酮的百分率(%);C1为代入标准曲线计算得到的提取液总黄酮质量浓度;V1为测定用提取液体积(mL);V2为样品提取液总体积(mL);m为样品重量(g)。
-
参考文献[20]的方法,并稍作调整。提前制成0.2 mmol·L−1的DPPH储备液(保存在黑暗中,3.5 h内用完)。分别取2 mL浓度为50、100、200、300、400、500 mg·L−1的BWE溶液,再加入2 mL DPPH(0.2 mmol·L−1)混匀后,室温下避光静置反应30 min,将维生素 C(Vitamin C, VC)设为阳性对照,在517 nm波长测其吸光度,所有待测液平行操作3次,根据公式(2)计算DPPH清除率,并测其及VC的IC50。
$$ \mathrm{清除率=[1-(} \mathit{A} - \mathit{A} _{ \mathrm{1}} \mathrm{)/} \mathit{A} _{ \mathrm{0}} \mathrm{]\times 100\% \text{,}} $$ (2) 式中,A为样品液和DPPH混合液的吸光度;A1为无水乙醇和样品液溶液混合后得到的吸光度;A0为DPPH溶液和蒸馏水混合液的吸光度。
-
根据文献 [21]的方法并稍作调整。制备ABTS二铵盐储备液和过硫酸钾,将二者1∶1混合反应13 h过夜,用pH7.4磷酸盐缓冲液将混合液稀释40倍直至吸光度为0.70 ± 0.02,此溶液即为ABTS+自由基工作液。分别取0.5 mL浓度为50、80、100、200、300、400、500 mg·L−1的BWE溶液,然后加入2.5 mL的ABTS+工作液,将混合后的溶液避光反应20 min。用蒸馏水作为对照,并以VC为阳性参照,在734 nm波长下测量吸光值,所有待测液设置3组平行,根据公式(3)计算ABTS清除率,并测其及VC的IC50。
$$ \mathrm{清除率=[1-(} \mathit{P} _{ \mathrm{1}}- \mathit{P} _{ \mathrm{2}} {)/} \mathit{P} _{ \mathrm{0}} \mathrm{]\times 100{\text{%}}\text{,}} $$ (3) 式中,P1为样品液与ABTS溶液反应后的吸光度;P2为蒸馏水和样品液混合后得到的吸光度;P0为蒸馏水与ABTS溶液反应后的吸光度。
-
采用文献 [22]的方法测定并稍作修改。配制300 mmol·L−1醋酸钠缓冲液(pH3.6)、10 mmol ·L−1TPTZ溶液和20 mmol·L−1 FeC13水溶液,以10∶1∶1比例(体积比)混合,得到FRAP工作溶液(现用现配,用之前预热至37 ℃)。吸取 400 μL浓度为50、80、100、200、300、400、500 mg·L−1 的BWE样品溶液,再分别加入3 mL FRAP工作液(37 ℃)。37 ℃水浴条件下反应10 min,在593 nm下测定吸光度,做3次平行实验。以VC作为对照。反应液的吸光度值越大,说明样品的Fe3+的还原能力越强。
-
参考文献[23]的方法并作部分修改。称取10 mg冻干粉于2 mL 离心管,加 1 mL 预冷的甲醇−乙腈混合液(1∶1, v/v),涡旋 30 s后于−20 ℃冷冻 30 min;12 000 r·min−1、4 ℃离心10 min,取 850 μL上清液真空浓缩至干;用 150 μL含 5 mg·L−1 2 -氯苯丙氨酸的50% 甲醇复溶,涡旋 30 s 后,同条件离心 10 min,取上清液过 0.22 μm 滤膜,滤液入检测瓶待上机检测。
-
色谱条件与质谱条件依据文献[24]的方法并做部分修改。使用ACQUITY UPLC HSS T3 色谱柱(100Å, 1.8 µm, 2.1 mm × 100 mm),流速0.4 mL·min−1,柱温40 ℃,自动进样器8 ℃,进样量2 μL。一级全扫描选择的分辨率为60 000,二级分辨率选择15 000。
-
数据处理及绘图使用Excel 2023和Origin 2022,照片处理使用Photoshop 2023,数据统计分析采用SPSS 27.0进行单因素方差分析,所有数据均基于平均±标准差(平均±SEM)。P<0.05表示差异显著,P<0.01表示差异极显著。
-
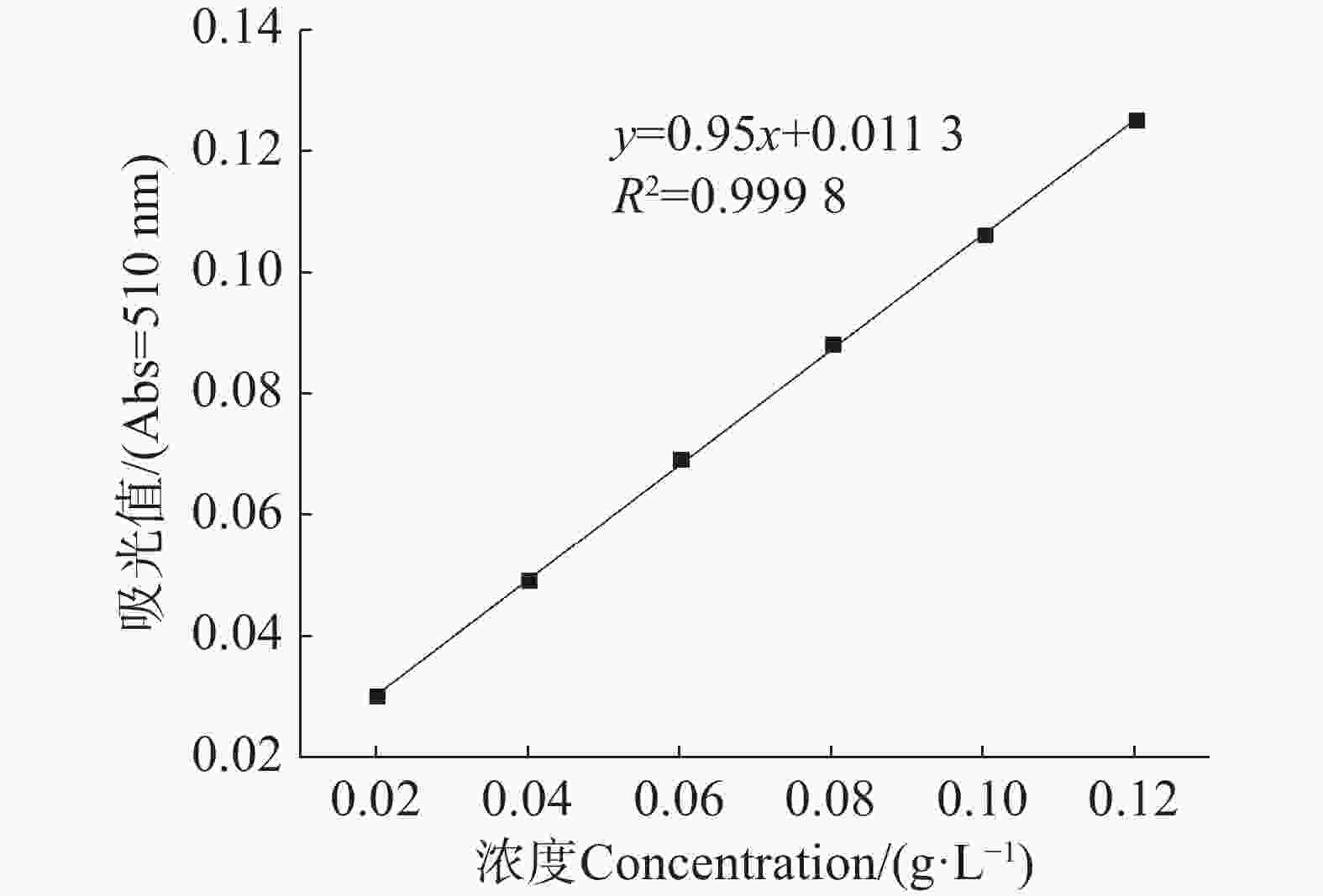
芦丁标准曲线如图1所示,以芦丁为标准品,以测得的吸光度值为纵坐标,对应的芦丁质量浓度为横坐标绘制标准曲线,得到标准曲线回归方程为y=0.95x + 0.011 33,R2=0.999 8,表明芦丁质量浓度在0.02 ~ 0.12 g·L−1范围内,吸光度与取其质量浓度具有良好的线性关系。
-
从表1可知,在料液比1∶12.5,煎煮时间1.5 h,此时总黄酮含量最高,为1.21%,优于其他试验组合的结果,可作为木棉花提取总黄酮的最佳工艺条件。
表 1 木棉花水提物总黄酮含量测定
Table 1. Determination of total flavonoids content of aqueous extract of Kapok flower
处理
Treatment总黄酮含量/%
Total flavonoids content/%1∶10 1 h 0.92 1∶10 1.5 h 0.64 1∶12.5 1 h 1.20 1∶12.5 1.5 h 1.21 1∶15 1 h 1.00 1∶15 1.5 h 0.87 注:1∶10 1 h为料液比1∶10煎煮时间1 h;1∶10 1.5 h为料液比1∶10煎煮时间1.5 h;1∶12.5 1 h为料液比1∶12.5煎煮时间1 h;1∶12.5 1.5 h为料液比1∶12.5煎煮时间1.5 h;1∶15 1 h为料液比1∶15煎煮时间1 h;1∶15 1.5 h为料液比1∶15煎煮时间1.5 h。下同。
Note: "1:10 1 h" refers to a material-to-liquid ratio of 1:10 with a decoction time of 1 h; "1:10 1.5 h" refers to a material-to-liquid ratio of 1:10 with a decoction time of 1.5 h; "1:12.5 1 h" refers to a material-to-liquid ratio of 1:12.5 with a decoction time of 1 h; "1:12.5 1.5 h" refers to a material-to-liquid ratio of 1:12.5 with a decoction time of 1.5 h; "1:15 1 h" refers to a material-to-liquid ratio of 1:15 with a decoction time of 1 h; "1:15 1.5 h" refers to a material-to-liquid ratio of 1:15 with a decoction time of 1.5 h. Similarly hereinafter. -
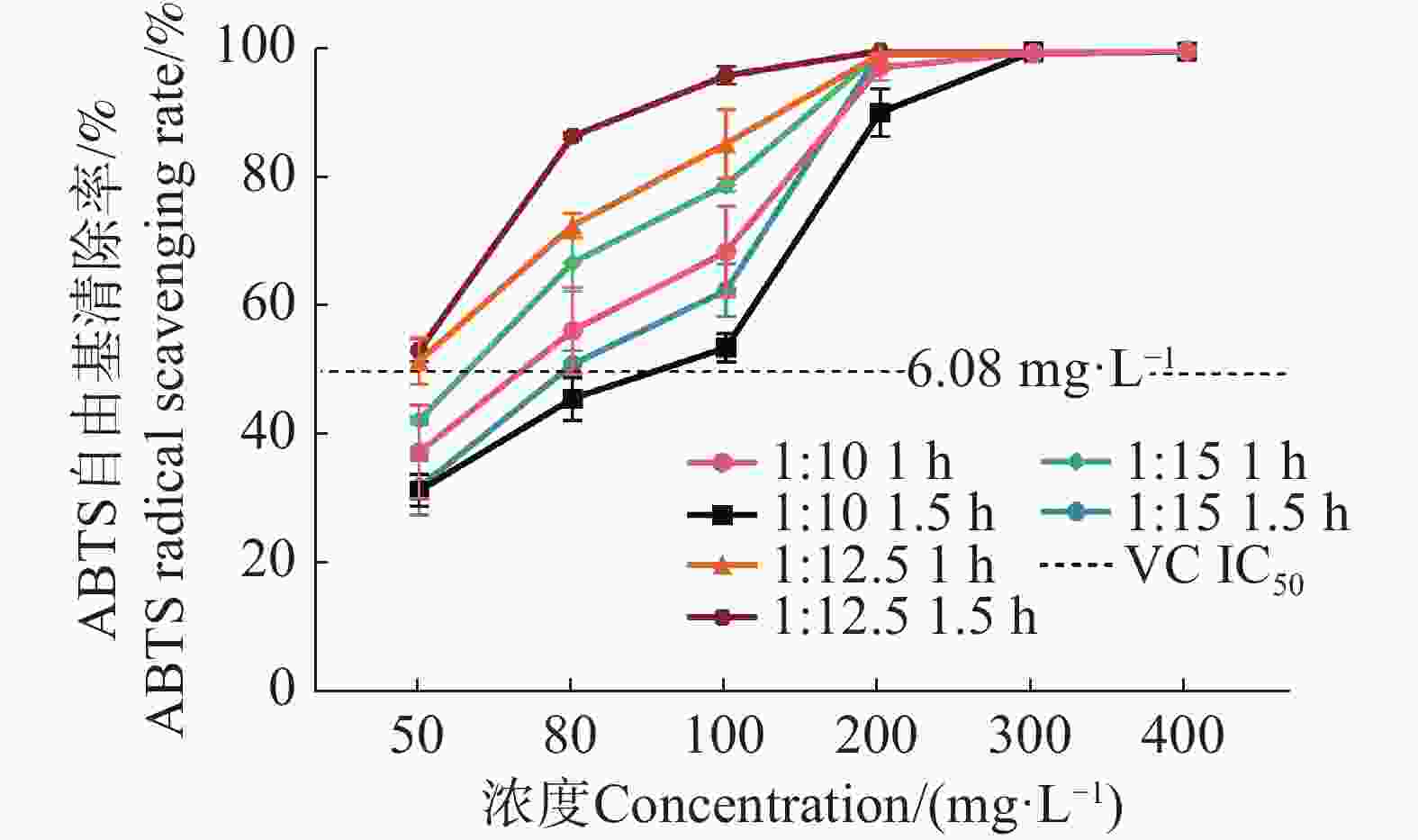
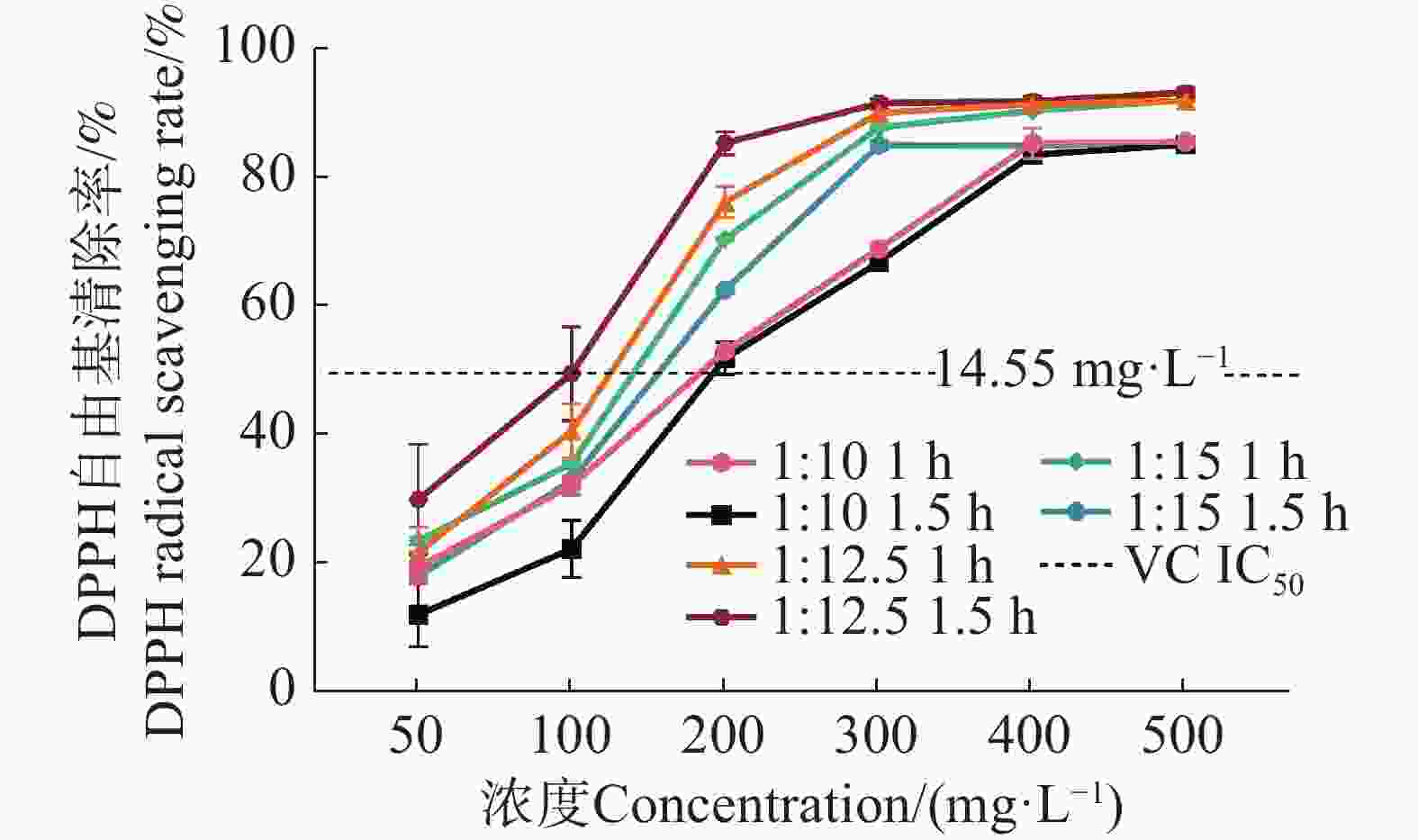
由图2可知,BWE随着质量浓度的增加,DPPH自由基清除率整体呈上升趋势,说明在此质量浓度范围内,质量浓度越高,抗氧化能力越强。质量浓度在50 ~ 200 mg·L−1时,随着质量浓度的上升,BWE对DPPH的清除能力呈上升趋势,且在此质量浓度范围内两者表现出明显的量效关系。当浓度升至200 ~ 500 mg·L−1,其清除率趋近饱和,接近90%甚至更高。说明质量浓度增加有利于提高DPPH自由基清除能力,高质量浓度时清除效果趋于平稳。在相同质量浓度和料液比下,1∶10 1 h的自由清除率高于1.5 h; 1∶15 1 h的自由清除率高于1.5 h;1∶12.5 1.5 h和 1∶12.5 1h清除率均高于其他组合,同时1∶12.5 1.5 h的BWE质量浓度在200 mg·L−1 时,清除率效果最好,且最先达到90%以上,为92.04%,同时其1.5 h的清除率略高于1 h,说明适当延长作用时间,可能有助于提高抗氧化效果。VC的 IC50 为14.55 mg·L−1;BWE 1∶10 1 h的IC50 为157.92 mg·L−1;1∶10 1.5 h的IC50为186.26 mg·L−1;1∶12.5 1 h的IC50为111.51 mg·L−1;1∶12.5 1.5 h的IC50为87.44 mg· L−1;1∶15 1 h的IC50为117.24 mg· L−1;1∶15 1.5h的IC50为137.83 mg·L−1,它们之间差异极显著(P<0.01)。实验结果表明,BWE对DPPH自由基的清除能力弱于VC,其中,BWE的1∶12.5 1.5 h对 DPPH 自由基的清除能力最好。
-
由图3可知,BWE随着质量浓度升高,ABTS 自由基清除率整体呈上升趋势的趋势。这表明在实验设定的质量浓度范围内,质量浓度越高,BWE对 ABTS 自由基的清除能力越强,即抗氧化能力越强。当BWE质量浓度在50~200 mg·L−1 范围内,BWE与ABTS自由基清除率呈正相关,随着其质量浓度的上升,BWE对ABTS自由基的清除率呈上升趋势,且在此质量浓度范围内,两者表现出明显的量效关系。当BWE质量浓度在200 mg·L−1 时,其对ABTS自由基的清除率可达91.73%,而后进一步增加质量浓度清除率变化趋于平稳近100%。在相同质量浓度和料液比下,1∶10 1h的自由清除率高于1.5 h; 1∶15 1 h的自由清除率高于1.5 h;1∶12.5 1.5 h和 1∶12.5 1 h清除率均高于其他组合,同时1∶12.5 1.5 h的BWE质量浓度在100 mg·L−1 时清除率效果最好最先达到90%以上,为94.41%,同时其1.5 h的清除率略高于1 h,说明适当延长作用时间,可能有助于提高抗氧化效果。VC 的 IC50 为6.08 mg·L−1;BWE 1∶10 1 h的IC50 为67.71 mg·L−1;1∶10 1.5 h的IC50为81.21 mg·L−1;1∶12.5 1 h的IC50为51.25 mg·L−1;1∶12.5 1.5 h的IC50为46.77 mg·L−1;1∶15 1 h的IC50为59.24 mg·L−1;1∶15 1.5 h的IC50为73.86 mg·L−1,它们之间差异极显著(P<0.01)。上述结果表明,BWE对ABTS自由基的清除能力弱于VC,其中,BWE 1∶12.5 1.5 h对 ABTS 自由基的清除能力最好。
-
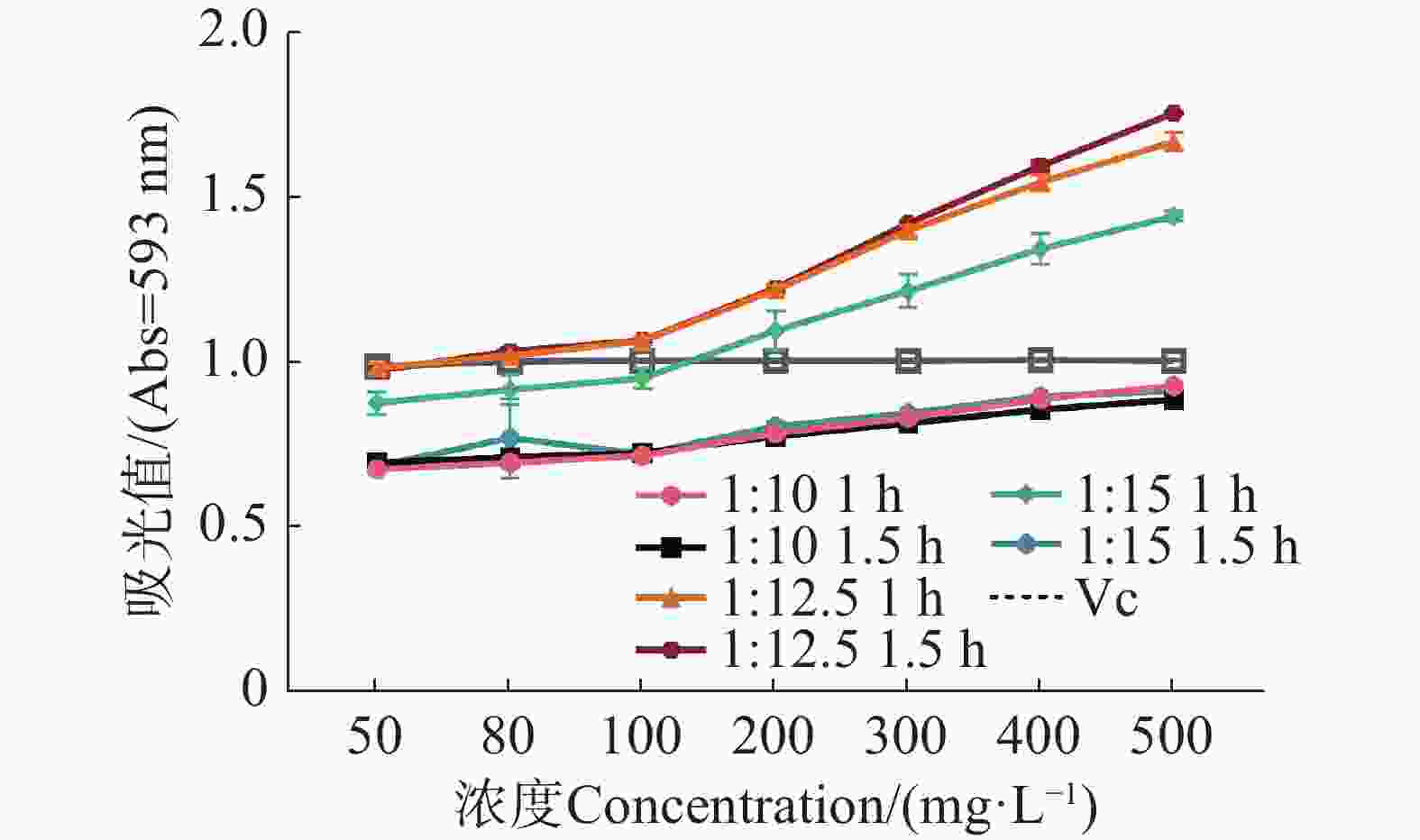
从图4可知,BWE对Fe3+ 的还原能力随着BWE浓度(50~500 mg·L−1 )的升高而增强,吸光值也逐渐增大,二者的还原能力逐渐增强,表现出明显的量效关系。在相同质量浓度条件下,1∶12.5 1.5 h和 1∶12.5 1 h的铁还原能力均强于VC,而1∶10 1 h、 1∶10 1.5 h和1∶15 1.5 h的Fe3+的还原能力均低于VC,但1∶15 1 h 的BWE在浓度高于200 mg·L−1时,其Fe3+的还原能力高于VC。结果表明,BWE 1∶12.5 1.5 h对Fe3+的还原能力最强。
-
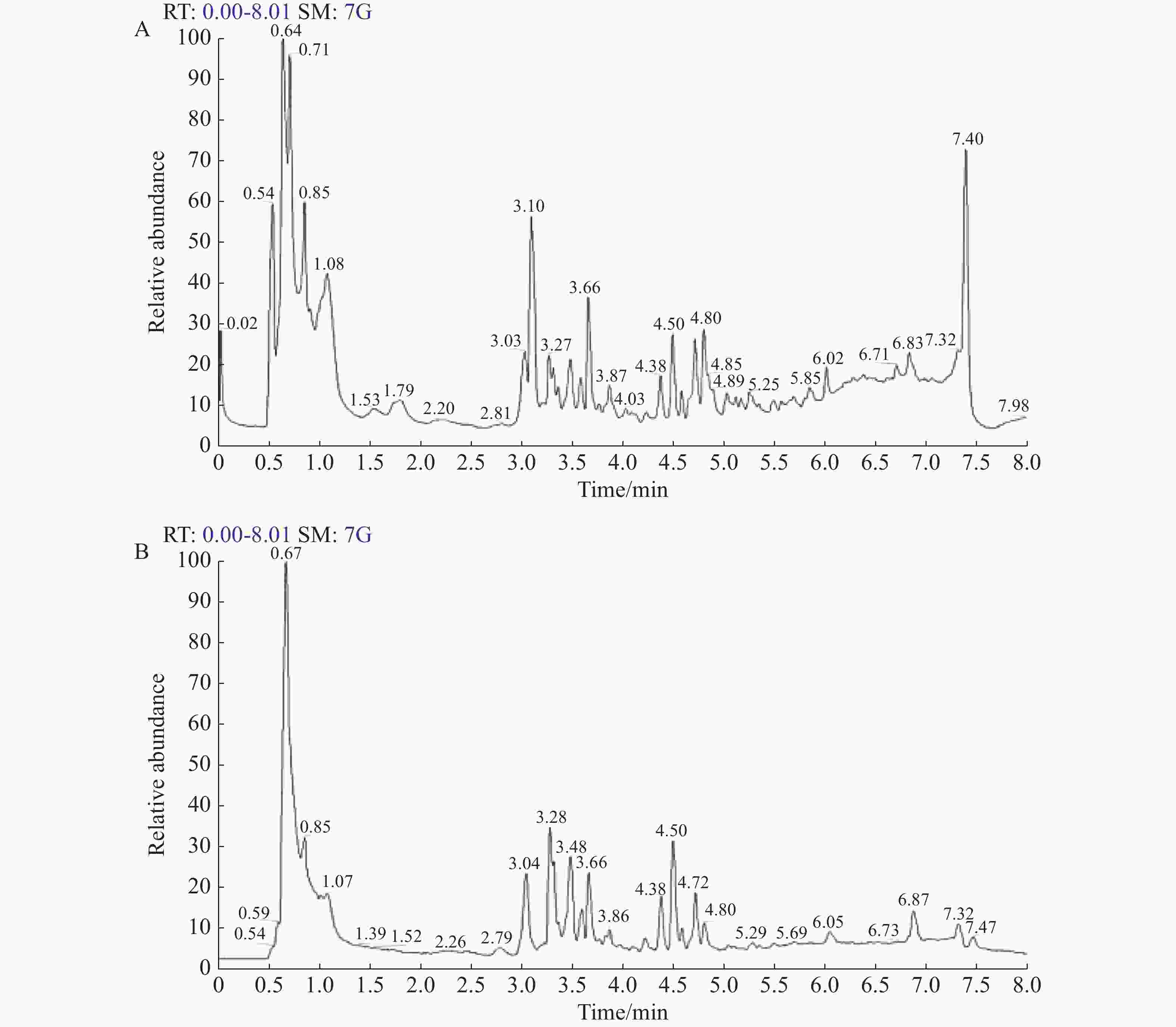
LC-MS能够准确测定物质的分子量及其他结构信息,对研究BWE提取物组成成分的分析具有重要意义。本研究测定结果用 Xcalibur 4.2 软件进行处理和分析。下图所示为BWE提取物混样质控 QC 样本的正负离子模式色谱图,横坐标为代谢物检测的保留时间,纵坐标为离子检测的离子流强度。结果如图5。
利用液相色谱−质谱联用技术测定出了BWE提取物中的有效成分,对于BWE中的成分,主要有黄酮类、苯丙素类、脂肪酸类等物质,其中,黄酮类物质含量高达73种(表2)。进一步对检测出的黄酮类化合物进行分类,分为黄烷类、黄酮、黄酮苷、羟基黄酮、O−甲基黄酮和吡喃洛酮类、双黄酮和多聚黄酮7类。其中,样本中以黄酮苷和黄烷类化合物占主导,分别有 37个和16个。本研究中相对含量最高的4种化学成分依次为槲皮素−3−O−葡萄糖醛酸苷(49.99%)、飞燕草素−3−O−(6''−O−α−鼠李吡喃糖基−β−吡喃葡萄糖苷(8.24%)、芦丁(7.45%)、表儿茶素(5.65%)。其余的为9种O−甲基化黄酮类化合物、4种黄酮类化合物、4种双黄酮和多聚黄酮类化合物、2 种吡喃类黄酮化合物及1种羟基黄酮类化合物。杨梅素−3−葡萄糖醛酸苷、异鼠李素−3−芸香糖苷、山奈酚−3−O−芸香糖苷、槲皮素−3−O−葡萄糖醛酸苷、木犀草素−7−O−葡萄糖苷等属于黄酮苷类,该类物质的苷元主要包括槲皮素、山奈酚和异鼠李素,其具备抗氧化、延缓衰老以及清除自由基的功效;儿茶素、没食子儿茶素、表儿茶素表没食子儿茶素、柚皮素等属于黄烷类;其具有抗炎免疫、调节血脂、保护心血管等功效。
表 2 BWE提取物中黄酮类化合物及其衍生物的初步鉴定
Table 2. Preliminary identification of flavonoids and their derivatives extracted from BWE
No.
编号Ion mode
离子模式Reference ion
参考离子Formula
分子式Substance
物质Classification
分类CAS
登记号Relative content
相对含量1 Positive [M+H]+ C15H14O7 (+)−没食子儿茶素 黄烷类 970-73-0 2.68% 2 Positive [M+H]+ C21H20O4 2−(4−甲氧基苯基)−8,8−二甲基−2,3−
二氢吡喃[2,3−]铬−4−酮吡喃类黄酮 — 0.08% 3 Positive [M+NH4]+ C15H14O7 (−)−表没食子儿茶素 黄烷类 970-74-1 0.25% 4 Positive [M+H]+ C21H24O11 表儿茶素−8−C−β−D−吡喃葡萄糖苷 黄酮苷类 — 0.05% 5 Positive [M+H]+ C27H30O15 芹菜素−6,8−二半乳糖苷 黄酮苷类 — 0.58% 6 Positive [M+H-H2O]+ C16H14O6 高圣草酚 O−甲基黄酮 446-71-9 0.11% 7 Positive [M+H]+ C15H12O6 (2R,3R)−3,5,7−三羟基−2−(3−羟基苯基)−2,3−二氢铬−4−酮 黄烷类 — 1.02% 8 Positive [M+H]+ C27H28O18 槲皮素−3−葡萄糖苷−7−葡萄糖醛酸 黄酮苷类 0.28% 9 Positive [M+H]+ C28H32O17 3−(2S,3R,4S,5S,6R)−4,5−二羟基−6−(羟甲基)−3−(2S,3R,4S,5S,6R)−3,4,5−三羟基−6−(羟甲基)氧嘧−2−基]氧氧嘧−2−(3,4−二羟基苯基)−5−羟基−7−甲氧基铬−4−酮 黄酮苷类 — 0.09% 10 Positive [M+H]+ C34H42O21 异鼠李素−3−O−槐糖苷−7−O−鼠李糖苷 黄酮苷类 41328 -75-00.04% 11 Positive [M+H]+ C27H30O16 芦丁 黄酮苷类 153-18-4 7.45% 12 Positive [M+H]+ C15H14O6 儿茶素 黄烷类 154-23-4 0.21% 13 Positive [2M+Na]+ C21H20O10 牡荆素 黄酮苷类 3681 -93-40.05% 14 Positive [M+H]+ C15H12O5 柚皮素 黄烷类 480-41-1 0.30% 15 Positive [2M+NH4]+ C15H10O7 槲皮素 黄酮类 117-39-5 2.79% 16 Positive [M+H]+ C27H30O15 山奈酚−3−O−芸香糖苷 黄酮苷类 17650 -84-90.41% 17 Positive [2M+Na]+ C20H18O11 2−(3,4−二羟基苯基)−5,7−二羟基−3−{[(2S,3R,4S,5S)−3,4,5−三羟基氧嘧−2−基]氧}−4H−铬−4−酮 黄酮苷类 — 0.06% 18 Positive [M+Na]+ C21H24O10 根皮苷 黄酮苷类 60-81-1 0.06% 19 Positive [M+CH3OH+H]+ C21H20O11 紫云英苷 黄酮苷类 480-10-4 0.31% 20 Positive [M+H]+ C15H10O6 山奈酚 黄酮类 520-18-3 0.17% 21 Positive [M+CH3OH+H]+ C34H42O20 3−[−6−[[3,5−二羟基−6−甲基−4−[3,4,5−三羟基−6−甲基氧嘧−2−基]氧氧嘧−2−基]氧甲基]−3,4,5−三羟基氧嘧−2−基]氧基−2−(3,4−二羟基苯基)−5−羟基−7−甲氧基铬基−4−酮 黄酮苷类 1324 -63-60.10% 22 Positive [M+H]+ C15H10O7 5,7,3',4',5'−五羟基黄酮 黄酮类 520-31-0 0.18% 23 Positive [M+H]+ C30H26O14 [(2R,3S,4S,5R,6R)−3,4,5−三羟基−6−[2−羟基−5−(3,5,7−三羟基−4−氧铬基−2−基)苯氧基]氧嘧−2−基]甲基3−(4−羟基苯基)丙−2−烯酸酯 黄酮苷类 — 0.07% 24 Positive [2M+Na]+ C21H22O10 5,7−二羟基−2−(4−羟基苯基)−6−[3,4,5−三羟基−6−(羟甲基)氧嘧−2−基]−3,4−二氢−2H−1−苯并吡喃−4−酮 黄酮苷类 — 0.04% 25 Positive [M+H]+ C15H10O6 漆黄素 黄酮类 528-48-3 0.16% 26 Positive [M+H]+ C18H18O6 5,7−二羟基−2−(4−羟基苯基)−3,4−二氢−2H−1−苯并吡喃−8−羧酸乙酯 羟基黄酮类化合物 — 0.10% 27 Positive [M+H]+ C15H12O5 5,7−二羟基−2−(3−羟基苯基)−3,4−二氢−2H−1−苯并吡喃−4−酮 黄烷类 — 0.47% 28 Positive [M+H]+ C16H14O5 5,7,4'−三羟基−8−甲基二氢黄酮 黄烷类 916917 -28-70.04% 29 Positive [M+NH4]+ C27H30O16 2−[3,4−双[[(2S,3R,4S,5S,6R)−3,4,5−三羟基−6−(羟甲基)氧杂−2−基]氧基]苯基]−5,7−二羟基铬−4−酮 黄酮苷类 — 1.17% 30 Negative [M-H]- C20H18O7
6−(5,7−二羟基−4−氧代−3,4−二氢−2H−1−苯并吡喃−2−基)−8−羟基−2,2−二甲基−3,4−二氢−2H−1−苯并吡喃−4−酮黄烷类 — 0.70% 31 Negative [M-H]- C18H14O6 2−(2H−1,3−苯并二氧醇−5−基)−5,7−二甲氧基−4H−铬−4−酮 O-甲基黄酮 — 0.63% 32 Negative [M-H]- C33H40O21 山柰酚−3−O−槐二糖−7−O−葡萄糖苷 黄酮苷类 55136 -76-00.11% 33 Negative [M-H]- C21H24O11 儿茶素−4'−O−β−D−吡喃葡萄糖苷 黄酮苷类 — 0.16% 34 Negative [M-2H]2- C27H30O17 槲皮素−3,4'−O−二−β−吡喃葡萄糖苷 双黄酮和多聚黄酮类 — 0.01% 35 Negative [M-H]- C21H20O11 木犀草素−7−O−葡萄糖苷 黄酮苷类 5373 -11-50.06% 36 Negative [M-H]- C27H31O15 矢车菊素−3−O−芸香糖苷 黄酮苷类 28338 -59-20.32% 37 Negative [M-H]- C30H26O12 原花青素二聚体 双黄酮和多聚黄酮类 — 0.01% 38 Negative [M-H]- C17H14O9 5,7−二羟基−3,6−二甲氧基−2−(3,4,5− 三羟基苯基)−4H−色原酮−4−酮 O-甲基黄酮 — 0.78% 39 Negative [M-H]- C21H22O13 二氢杨梅−7−葡萄糖苷 黄酮苷类 — 0.11% 40 Negative [M-H]- C24H24O7 2−(3,4−二甲氧基苯基)−5,10−二甲氧基−8,8−二甲基吡喃[3,2−g]铬−4−酮 吡喃洛酮类 — 0.08% 41 Negative [M-H]- C45H38O18 原花青素 C1 双黄酮和多聚黄酮类 37064 -30-51.38% 42 Negative [M-H]- C21H22O11 2,4,6,4'−四羟基−2−苄基香豆荆酮4−O−葡萄糖苷 黄酮苷类 — 0.71% 43 Negative [M-H]- C15H14O6 表儿茶素 黄烷类 490-46-0 5.65% 44 Negative [M-H]- C15H14O6 L−(−)−儿茶素 黄烷类 — 0.35% 45 Negative [M-H]- C30H26O11 (2r,3r,4s)−2−(4−羟基苯基)−4−{[(2r,3r,4s)−4,7,8−三羟基-2-(4-羟基苯基)−3,4−二氢−2h−1−苯并吡喃−3−基]氧}−3,4−二氢−2h−1−苯并吡喃−3,7,8−三醇 黄烷类 — 0.09% 46 Negative [M-H]- C21H18O14 杨梅素−3−葡萄糖醛酸苷 黄酮苷类 77363 -65-60.13% 47 Negative [M-H]- C32H24O10 5−羟基−2−(4−{[5−羟基−2−(4−羟基苯基)−7−甲氧基−4−氧代−3,4−二氢−2H−1−苯并吡喃−6−基]氧基}苯基)−7−甲氧基−4H−铬−4−酮 O-甲基黄酮 — 0.10% 48 Negative [M-H]- C21H20O12 槲皮素−4'−O−葡萄糖苷 黄酮苷类 — 0.14% 49 Negative [M+Cl]- C27H30O16 3−[(2S,3R,4S,5R,6S)−3,4-二羟基−6−甲基−5−[(2S,3R,4S,5S,6R)−3,4,5−三羟基−6−(羟甲基)氧嘧−2−基]氧氧嘧−2−(3,4−二羟基苯基)−5,7−二羟基铬−4−酮 黄酮苷类 — 0.68% 50 Negative [M-2H]- C27H31O16 飞燕草素−3−O−(6''−O−α−鼠李吡喃糖基−β−吡喃葡萄糖苷) 黄酮苷类 — 8.24% 51 Negative [M-H]- C30H26O12 (+)−原花青素 B2 双黄酮和多聚黄酮类 29106 -49-80.32% 52 Negative [M-H]- C21H18O13 槲皮素−3−O−葡萄糖醛酸苷 黄酮苷类 22688 -79-549.99% 53 Negative [M-H]- C28H24O16 2''−O−没食子酰基金丝桃苷 黄酮苷类 53209 -27-10.34% 54 Negative [M-H]- C21H20O12 异槲皮素 黄酮苷类 21637 -25-23.89% 55 Negative [M-H]- C21H20O12 金丝桃苷 黄酮苷类 482-36-0 0.08% 56 Negative [M-H]- C16H16O7 (2r,3r,4r)−2−(3−羟基−4−甲氧基苯基)−3,4−二氢−2h−1−苯并吡喃−3,4,7,8−四醇 黄烷类 — 0.26% 57 Negative [M-H]- C28H32O16 异鼠李素−3−芸香糖苷 黄酮苷类 604-80-8 0.16% 58 Negative [M-2H]2- C21H18O12 木犀草素−7−O−葡萄糖醛酸苷 黄酮苷类 29741 -10-42.47% 59 Negative [M-H]- C15H12O7 二氢槲皮素 黄烷类 480-18-2 0.51% 60 Negative [M-H]- C22H24O11 高圣草素−7−O−β−D−葡萄糖苷 黄酮苷类 14982 -11-70.17% 61 Negative [M-H]- C23H24O12 白桦油醇−3−半乳糖苷 黄酮苷类 — 0.08% 62 Negative [M-H]- C23H24O11 5−羟基−2−(4−羟基−3,5−二甲氧基苯基)−7−[(2S,3S,5S)−3,4,5−三羟基−6−(羟甲基)氧嘧−2−基]铬−4−酮 黄酮苷类 — 0.13% 63 Negative [M-H]- C21H24O8 2,3,3,5,6,7−六甲氧基−2−苯基−1−苯并吡喃−4−酮 O−甲基黄酮 — 0.08% 64 Negative [M-H]- C15H12O6 二氢山奈酚 黄烷类 480-20-6 0.58% 65 Negative [M-H]- C24H20O8 9,10−二氢−10−(4−羟基苯基)−吡喃基[2,3−h]表儿茶素−8−酮 黄烷类 — 0.15% 66 Negative [M-H]- C21H20O11 木犀草素−7−O−葡萄糖苷 黄酮苷类 5373 -11-50.06% 67 Negative [M-H]- C20H18O9 5−羟基−3,6,7,8−四甲氧基−3',4'−亚甲二氧基黄酮 O-甲基黄酮 — 0.09% 68 Negative [M-H]- C21H22O10 (2S,3R,4S,5S,6R)−2−[[(6aS,11aS)−6a,9−二羟基−6,11a−二氢−[1]苯并呋喃[3,2−c]铬−3−基]氧基]−6−(羟甲基)氧代−3,4,5−三醇 黄酮苷类 — 0.09% 69 Negative [M-H]- C21H20O12 (2S)−二氧化二酰−7−O−β−D−吡喃葡萄糖醛酸 黄酮苷类 — 0.13% 70 Negative [M-H]- C22H22O10 4,7,9−三甲氧基−6−(3,4,5−三甲氧基苯基)-2h-[1,3]二氧氧基[4,5−g]铬−8−酮 O−甲基黄酮 — 0.06% 71 Negative [M-H]- C16H14O6 橙皮素 O−甲基黄酮 520-33-2 0.29% 72 Negative [M-H]- C16H14O5 二氢木蝴蝶素A O−甲基黄酮 18956 -18-80.05% 73 Negative [M-H]- C23H24O7 (2S)−5,7−二甲氧基−8−(2S−羟基−3−甲基−3−丁烯基)−3',4'−亚甲二氧基黄烷酮 黄烷类 — 0.04% -
黄酮类化合物的提取方式包括有机溶剂提取法、索氏提取法、微波提取法、超声波提取法、酶解提取法、超临界流体萃取法、大孔树脂吸附法[25]。目前,林庆景等[26]通过研究得出超声波辅助乙醇提取木棉花总黄酮的最优工艺条件为乙醇浓度为 41%,料液比为 31∶1,超声波功率为 470 W,在此条件下,木棉花总黄酮的提取率为 4.35%。何秋彤等[27]系统比较了蒸馏水、质量浓度为500 g·L−1 的乙醇溶液、质量浓度为 800 g·L−1 的丙酮溶液对木棉花黄酮含量的提取率,结果显示,木棉花水提取在黄酮提取率指标上有一定优势,黄酮含量为(39.62±2.68)mg·g−1(CE)。不过,该实验采用三氯化铝法测定黄酮含量,以(+)−儿茶素为对照品;而本实验采用亚硝酸钠−硝酸铝比色法测定,以芦丁为对照品,且两者在提取方法(溶剂、温度、时间)及计算公式上也略有差异,因此得到的总黄酮提取率有所不同。而在广西民间,人们常将采摘的新鲜木棉花晾晒干燥,制成木棉花茶。本研究采用无毒无害的水提法处理木棉花,以规避甲醇、乙醇、丙酮等工业有机溶剂的毒性与残留风险。在此基础上,本研究重点优化了料液比和煎煮时间的参数。该方法绿色温和,操作简便,更符合食品安全与药品监管要求,具备良好的日常应用潜力。实验结果最终筛选出 BWE 的最优制备参数:料液比 1∶12.5,煎煮时间 1.5 h,在此条件下,木棉花黄酮含量最高,为 1.21%。
-
木棉花的水提取物(BWE)展现出较强的抗氧化能力。何秋彤等[27]对木棉花水提物、乙醇提取物、丙酮提取物进行了抗氧化研究,发现3种提取物的 DPPH 自由基清除率在不同程度上与总黄酮含量呈正相关,其中水提物对DPPH 有较强的自由基清除能力,IC50 为 (
2554.67 ±3.83)mg·L−1,表明木棉花具有突出的抗氧化性。WANJARI等[28]通过检测木棉花水提取物DPPH自由基清除活性来确定其抗氧化活性,结果显示,木棉花水提取物的 DPPH 自由基清除活性较强,IC50为50.21 mg· L−1。Yu等[29]采用DPPH清除实验、氧自由基吸收能力法、正三价铁离子还原能力实验、脂质过氧化抑制实验,对木棉花3种提取物(水提取物、50% 乙醇提取物、80% 丙酮提取物)的体外抗氧化活性进行了检测。结果显示,水提物对DPPH有较强的自由基清除能力,IC50 为(554.67±3.83 )mg·L−1。与阳性对照抗坏血酸或没食子酸相比,所有木棉花提取物均展现出良好的抗氧化性能,各提取物中总黄酮含量越高,其抗氧化作用越强。本研究借助分析不同料液比和煎煮时间对木棉花水提取物(BWE)的总黄酮含量带来的影响,连同 DPPH 自由基清除率、ABTS 自由基清除率及铁离子还原能力等抗氧化指标,最终挑选出 BWE的最优制备参数料液比1∶12.5,煎煮时间1.5 h,此条件下的木棉花黄酮含量最高,为1.21%。从抗氧化实验结果来看,黄酮含量最高的料液比1∶12.5,煎煮时间1.5 h的BWE对DPPH和ABTS两种自由基能力均高于其料液比与煎煮时间,其半抑制浓度IC50分别为87.44 mg·L−1,46.77 mg·L−1;且在Fe3+的还原能力方面,具有同样的效果,说明木棉花水提物具有良好的体外抗氧化活性。实验结果与前人的研究结果趋势一致,甚至本研究中水提物的制备方法其自由基清除能力优于部分前人的研究,均证实了木棉具有良好的抗氧化活性以及黄酮含量与抗氧化能力呈正相关。 -
根据现有文献报道[30 − 39],从木棉花甲醇及乙醇提取物中已分离鉴定出以下黄酮类化合物包括儿茶素、芹菜素、槲皮素−3−O−β−D−吡喃葡萄糖苷、槲皮素−3−O−芸香糖苷(芦丁)、槲皮素−3−O−β−D−吡喃半乳糖醛酸苷、槲皮素−3−O−β−D−吡喃葡萄糖醛酸苷、山奈酚−3−O−芸香糖苷、山奈酚−3−O−β−D−吡喃葡萄糖醛酸苷、金合欢素−7−O−芸香糖苷(蒙花苷)、芹菜素−7−O−β−D−吡喃葡萄糖苷(大波斯菊苷)、芹菜素−7−O−β−新橘皮糖苷、矢车菊素−3−O−葡萄糖苷、天竺葵色素−5−O−β−D−吡喃葡萄糖苷(翠菊色苷)、矢车菊素−7−甲醚−3−β−D−吡喃葡萄糖苷、芹菜素−8−C−葡萄糖苷(牡荆素)、芹菜素−6−C−葡萄糖苷(异牡荆素)、芹菜素−6,8−二−C−β−吡喃葡糖苷(新西兰牡荆苷−2)、芹菜素−6−C−葡萄糖−7−O−葡萄糖苷(皂草苷)、木犀草素−6−C−葡萄糖苷、山奈酚−3−O−(6"−O−E−p−酰基)−β−D−吡喃葡萄糖苷、栎草亭−3−O−β−D−呋喃葡萄糖苷、异鼠李素−3−O−β−D−葡萄糖苷、六羟黄酮(栎草亭)、Sexangularetin-3-O-sophoroside、黄姜味草醇(5,4'−二羟基−6,7,8−三甲氧基黄酮)、芒果苷、异芒果苷、7−O−甲基芒果苷、知母宁、Muraxanthone等。而山奈酚 3−槐糖苷 7−葡萄糖苷、异鼠李素−3−O−槐糖苷−7−O−鼠李糖苷、5,7−二羟基−2−(4−羟基苯基)−3,4 −二氢−2H−1−苯并吡喃−8−羧酸乙酯、2,4,6,4'−四羟基−2−苄基香豆荆酮 4−O−葡萄糖苷、(2r,3r,4s)−2−(4−羟基苯基)−4−{[(2r,3r,4s)−4,7,8−三羟基−2−(4−羟基苯基)−3,4−二氢−2h−1−苯并吡喃−3−基]氧}−3,4−二氢−2h−1−苯并吡喃−3,7,8−三醇、5−羟基−2−(4−{[5−羟基−2−(4−羟基苯基−7−甲氧基−4−氧代−3,4−二氢−2H−1−苯并吡喃−6−基]氧基}苯基−7−甲氧基−4H−铬−4−酮、3−[−6−[[3,5−二羟基−6−甲基−4−[3,4,5−三羟基−6−甲基氧嘧−2−基]氧氧嘧−2−基]氧甲基]−3,4,5−三羟基氧嘧−2−基]氧基−2−(3,4−二羟基苯基)−5−羟基−7−甲氧基铬基−4−酮是首次从该植物中水提物中分离得到。现阶段针对木棉花水提物(BWE)的黄酮类成分研究相对较少。本研究在已有基础上进行了系统性补充,通过LC-MS等技术共鉴定出73种黄酮类化合物,丰富了木棉花水提物的成分数据库。木棉花水提物比甲醇及乙醇提取物鉴定出更多化合物,可能归因于以下机制:①极性适配性:水溶剂(高极性)更有利于黄酮糖苷(如芦丁、槲皮素苷)的溶出,而甲醇/乙醇提取物以苷元为主;②提取条件优势:水提法(常压、低温)可减少热敏性黄酮(如某些酚羟基衍生物)的降解;③基质干扰少:水提物中脂溶性杂质较少,有利于LC-MS对黄酮苷类化合物的精准鉴定。不同溶剂因极性、溶解特性及提取动力学差异,导致其化学成分谱存在显著区别。水提物因更适配黄酮糖苷的提取需求,在黄酮类化合物的鉴定数量和多样性上展现出独特优势。这一发现为木棉花水提物的深度开发和标准化研究提供了重要依据。
木棉花水提取物经LC-MS分析,鉴定到73种黄酮类化合物,其中含量最多的4个成分槲皮素−3−O−葡萄糖醛酸苷、飞燕草素−3−O−(6''−O−α−鼠李吡喃糖基−β−吡喃葡萄糖苷、芦丁、表儿茶素。有相关研究显示,黄酮类化合物具备优良的生物活性,比如在改善心血管疾病、增强人体免疫系统功能以及提升动物生产性能等方面均有表现;除此之外,其还具有易溶解且储存周期较长的特性[40 − 41]。其中,槲皮素3−O−葡萄糖醛酸苷这种天然类黄酮化合物不仅具有抗氧化性,还能抑制动脉粥样硬化形成,并可作为CBR1抑制剂[42 − 44]。芦丁具有多重生理活性,能清除自由基、促进成骨细胞增殖、降低血糖,并抑制结直肠癌与前列腺癌细胞生长,从而对人体多器官系统发挥保护作用[45]。飞燕草素−3−O−(6''−O−α−鼠李吡喃糖基−β−吡喃葡萄糖苷通过其强大的抗增殖活性,展现出巨大的抗癌潜力[46 − 47]。表儿茶素是一种黄烷醇化合物,广泛分布于多种中药材中。它具有抗氧化、降血糖和预防心血管疾病等功效[48 − 49]。研究表明,它还能改善小鼠心肌缺血缺氧的状况[50]。
-
本研究借助分析不同料液比和煎煮时间对木棉花水提取物(BWE)的总黄酮含量带来的影响,连同 DPPH 自由基清除率、ABTS 自由基清除率及铁离子还原能力等抗氧化指标,最终挑选出 BWE 的最优制备参数料液比1∶12.5,煎煮时间1.5 h,此条件下的木棉花黄酮含量最高,为1.21%。通过试验证实BWE具有良好的抗氧化活性,且对DPPH自由基、ABTS自由基的清除能力、Fe3+的还原能力与其质量浓度存在明显的量效对应关系,表现为一定的浓度范围内,BWE的浓度越高,其抗氧化活性越强。BWE具有良好的体外抗氧化活性,可能与其含有丰富黄酮类物质有关。
本研究基于LC-MS分析,从BWE中共初步鉴定出73种主要的黄酮类活性化合物,这些化合物可归为七大类:黄烷类、黄酮类及其黄酮苷、羟基黄酮、O−甲基黄酮及吡喃洛酮类、双黄酮类和多聚黄酮类。样品化学成分分析显示,黄酮苷和黄烷类化合物占据主导地位,其数量分别为37个和16个。其中,相对含量槲皮素−3−O−葡萄糖醛酸苷(49.99%)、飞燕草素−3−O−(6''−O−α−鼠李吡喃糖基−β−吡喃葡萄糖苷(8.24%)、芦丁(7.45%)、表儿茶素(5.65%)位居前四。因此,BWE 展现出的良好体外抗氧化活性,可能与其富含多种结构多样的黄酮类化合物密切相关。 作为一种潜在的天然抗氧化剂来源,BWE 在食品、抗衰老化妆品开发以及医药保健等领域展现出广阔的应用前景。未来研究应着重加强木棉花清热、利湿、解毒、止血功效的物质基础研究,探究其有效部位或单体化合物的药理活性与作用机制,并建立以有效成分为指标的质量控制方法,从而为木棉花的临床应用及产品开发提供坚实的科学依据和理论支撑。
Antioxidant activity and LC-MS component analysis of water extracts from the flowers of Bombax ceiba
-
摘要: 为挖掘木棉(Bombax ceiba)花水提取物(BWE)在抗氧化领域的应用潜能,通过研究BWE的不同料液比和煎煮时间对提取液中总黄酮含量及DPPH 自由基清除率、ABTS 阳离子自由基清除率、Fe3+的还原能力等体外抗氧化指标的影响,筛选出最佳料液比和煎煮时间的工艺参数,继而借助液相色谱-质谱联用(LC-MS)分析技术对其化学成分进行深度鉴定分析。结果表明:在一定范围内, BWE对DPPH、ABTS自由基的清除能力以及对Fe3+还原能力随浓度的升高而升高,最佳参数为料液比1∶12.5,煎煮时间1.5 h,其IC50分别为87.44和46.77 mg·L−1,但其Fe3+还原能力强于VC。BWE具有良好的抗氧化活性,在BWE中共识别出73个黄酮类化合物,其中,相对含量较高的4种化学成分依次为槲皮素−3−O−葡萄糖醛酸苷(49.99%)、飞燕草素−3−O−(6''−O−α−鼠李吡喃糖基−β−吡喃葡萄糖苷(8.24%)、芦丁(7.45%)和表儿茶素(5.65%)。
-
关键词:
- 木棉 /
- 水提物 /
- 抗氧化活性 /
- 化学成分 /
- 液相色谱-质谱联用(LC-MS)
Abstract: To explore the potential of the aqueous extract of Bombax ceiba flower (BWE) in the field of antioxidation, the effects of different solid-liquid ratios and decoction times on the total flavonoid content and in vitro antioxidant indices such as DPPH radical scavenging rate, ABTS cation radical scavenging rate, and Fe3+ reducing ability of the extract were investigated. The optimal process parameters of solid-liquid ratio and decoction time were screened out. Subsequently, the chemical components of BWE were identified and analyzed by using liquid chromatography-mass spectrometry (LC-MS) to provide key scientific basis for the development and application of BWE in the field of antioxidation. The results showed that within a certain range, the scavenging ability of BWE on DPPH and ABTS radicals and the reducing ability of Fe3+ increased with the concentration. The optimal parameters were a solid-liquid ratio of 1∶12.5 and a decoction time of 1.5 h, with IC50 values being 87.44 mg·L−1 and 46.77 mg·L−1, respectively. However, the Fe3+ reducing ability of BWE was higher than that of vitamin C. These results indicated that BWE had high antioxidant activity. A total of 73 flavonoids were identified in BWE, among which four chemical components in BWE, i.e. quercetin 3-O-glucuronide (49.99%), Delphinidin-3-O-(6''-O-alpha-rhamnopyranosyl-beta-glucopyranoside) (8.24%), rutin (7.45%), and gallocatechin (5.65%), were the highest in relative content and are important pharmacologically active substances. This provides a theoretical basis for further in-depth exploration and utilization of the medicinal potential of flavonoids in BWE. -
图 2 不同质量浓度的BWE对DPPH自由基清除能力
注:1∶10 1 h为料液比1∶10煎煮时间1 h;1∶10 1.5 h为料液比1∶10煎煮时间1.5 h;1∶12.5 1 h为料液比1∶12.5煎煮时间1 h;1∶12.5 1.5 h为料液比1∶12.5煎煮时间1.5 h;1∶15 1 h为料液比1∶15煎煮时间1 h;1∶15 1.5 h为料液比1∶15煎煮时间1.5 h。下同。
Fig. 2 DPPH radical scavenging ability of BWE at different concentrations
Note: "1:10 1 h" refers to a material-to-liquid ratio of 1:10 with a decoction time of 1 h; "1:10 1.5 h" refers to a material-to-liquid ratio of 1:10 with a decoction time of 1.5 h; "1:12.5 1 h" refers to a material-to-liquid ratio of 1:12.5 with a decoction time of 1 h; "1:12.5 1.5 h" refers to a material-to-liquid ratio of 1:12.5 with a decoction time of 1.5 h; "1:15 1 h" refers to a material-to-liquid ratio of 1:15 with a decoction time of 1 h; "1:15 1.5 h" refers to a material-to-liquid ratio of 1:15 with a decoction time of 1.5 h. Similarly hereinafter.
表 1 木棉花水提物总黄酮含量测定
Table 1 Determination of total flavonoids content of aqueous extract of Kapok flower
处理
Treatment总黄酮含量/%
Total flavonoids content/%1∶10 1 h 0.92 1∶10 1.5 h 0.64 1∶12.5 1 h 1.20 1∶12.5 1.5 h 1.21 1∶15 1 h 1.00 1∶15 1.5 h 0.87 注:1∶10 1 h为料液比1∶10煎煮时间1 h;1∶10 1.5 h为料液比1∶10煎煮时间1.5 h;1∶12.5 1 h为料液比1∶12.5煎煮时间1 h;1∶12.5 1.5 h为料液比1∶12.5煎煮时间1.5 h;1∶15 1 h为料液比1∶15煎煮时间1 h;1∶15 1.5 h为料液比1∶15煎煮时间1.5 h。下同。
Note: "1:10 1 h" refers to a material-to-liquid ratio of 1:10 with a decoction time of 1 h; "1:10 1.5 h" refers to a material-to-liquid ratio of 1:10 with a decoction time of 1.5 h; "1:12.5 1 h" refers to a material-to-liquid ratio of 1:12.5 with a decoction time of 1 h; "1:12.5 1.5 h" refers to a material-to-liquid ratio of 1:12.5 with a decoction time of 1.5 h; "1:15 1 h" refers to a material-to-liquid ratio of 1:15 with a decoction time of 1 h; "1:15 1.5 h" refers to a material-to-liquid ratio of 1:15 with a decoction time of 1.5 h. Similarly hereinafter.表 2 BWE提取物中黄酮类化合物及其衍生物的初步鉴定
Table 2 Preliminary identification of flavonoids and their derivatives extracted from BWE
No.
编号Ion mode
离子模式Reference ion
参考离子Formula
分子式Substance
物质Classification
分类CAS
登记号Relative content
相对含量1 Positive [M+H]+ C15H14O7 (+)−没食子儿茶素 黄烷类 970-73-0 2.68% 2 Positive [M+H]+ C21H20O4 2−(4−甲氧基苯基)−8,8−二甲基−2,3−
二氢吡喃[2,3−]铬−4−酮吡喃类黄酮 — 0.08% 3 Positive [M+NH4]+ C15H14O7 (−)−表没食子儿茶素 黄烷类 970-74-1 0.25% 4 Positive [M+H]+ C21H24O11 表儿茶素−8−C−β−D−吡喃葡萄糖苷 黄酮苷类 — 0.05% 5 Positive [M+H]+ C27H30O15 芹菜素−6,8−二半乳糖苷 黄酮苷类 — 0.58% 6 Positive [M+H-H2O]+ C16H14O6 高圣草酚 O−甲基黄酮 446-71-9 0.11% 7 Positive [M+H]+ C15H12O6 (2R,3R)−3,5,7−三羟基−2−(3−羟基苯基)−2,3−二氢铬−4−酮 黄烷类 — 1.02% 8 Positive [M+H]+ C27H28O18 槲皮素−3−葡萄糖苷−7−葡萄糖醛酸 黄酮苷类 0.28% 9 Positive [M+H]+ C28H32O17 3−(2S,3R,4S,5S,6R)−4,5−二羟基−6−(羟甲基)−3−(2S,3R,4S,5S,6R)−3,4,5−三羟基−6−(羟甲基)氧嘧−2−基]氧氧嘧−2−(3,4−二羟基苯基)−5−羟基−7−甲氧基铬−4−酮 黄酮苷类 — 0.09% 10 Positive [M+H]+ C34H42O21 异鼠李素−3−O−槐糖苷−7−O−鼠李糖苷 黄酮苷类 41328 -75-00.04% 11 Positive [M+H]+ C27H30O16 芦丁 黄酮苷类 153-18-4 7.45% 12 Positive [M+H]+ C15H14O6 儿茶素 黄烷类 154-23-4 0.21% 13 Positive [2M+Na]+ C21H20O10 牡荆素 黄酮苷类 3681 -93-40.05% 14 Positive [M+H]+ C15H12O5 柚皮素 黄烷类 480-41-1 0.30% 15 Positive [2M+NH4]+ C15H10O7 槲皮素 黄酮类 117-39-5 2.79% 16 Positive [M+H]+ C27H30O15 山奈酚−3−O−芸香糖苷 黄酮苷类 17650 -84-90.41% 17 Positive [2M+Na]+ C20H18O11 2−(3,4−二羟基苯基)−5,7−二羟基−3−{[(2S,3R,4S,5S)−3,4,5−三羟基氧嘧−2−基]氧}−4H−铬−4−酮 黄酮苷类 — 0.06% 18 Positive [M+Na]+ C21H24O10 根皮苷 黄酮苷类 60-81-1 0.06% 19 Positive [M+CH3OH+H]+ C21H20O11 紫云英苷 黄酮苷类 480-10-4 0.31% 20 Positive [M+H]+ C15H10O6 山奈酚 黄酮类 520-18-3 0.17% 21 Positive [M+CH3OH+H]+ C34H42O20 3−[−6−[[3,5−二羟基−6−甲基−4−[3,4,5−三羟基−6−甲基氧嘧−2−基]氧氧嘧−2−基]氧甲基]−3,4,5−三羟基氧嘧−2−基]氧基−2−(3,4−二羟基苯基)−5−羟基−7−甲氧基铬基−4−酮 黄酮苷类 1324 -63-60.10% 22 Positive [M+H]+ C15H10O7 5,7,3',4',5'−五羟基黄酮 黄酮类 520-31-0 0.18% 23 Positive [M+H]+ C30H26O14 [(2R,3S,4S,5R,6R)−3,4,5−三羟基−6−[2−羟基−5−(3,5,7−三羟基−4−氧铬基−2−基)苯氧基]氧嘧−2−基]甲基3−(4−羟基苯基)丙−2−烯酸酯 黄酮苷类 — 0.07% 24 Positive [2M+Na]+ C21H22O10 5,7−二羟基−2−(4−羟基苯基)−6−[3,4,5−三羟基−6−(羟甲基)氧嘧−2−基]−3,4−二氢−2H−1−苯并吡喃−4−酮 黄酮苷类 — 0.04% 25 Positive [M+H]+ C15H10O6 漆黄素 黄酮类 528-48-3 0.16% 26 Positive [M+H]+ C18H18O6 5,7−二羟基−2−(4−羟基苯基)−3,4−二氢−2H−1−苯并吡喃−8−羧酸乙酯 羟基黄酮类化合物 — 0.10% 27 Positive [M+H]+ C15H12O5 5,7−二羟基−2−(3−羟基苯基)−3,4−二氢−2H−1−苯并吡喃−4−酮 黄烷类 — 0.47% 28 Positive [M+H]+ C16H14O5 5,7,4'−三羟基−8−甲基二氢黄酮 黄烷类 916917 -28-70.04% 29 Positive [M+NH4]+ C27H30O16 2−[3,4−双[[(2S,3R,4S,5S,6R)−3,4,5−三羟基−6−(羟甲基)氧杂−2−基]氧基]苯基]−5,7−二羟基铬−4−酮 黄酮苷类 — 1.17% 30 Negative [M-H]- C20H18O7
6−(5,7−二羟基−4−氧代−3,4−二氢−2H−1−苯并吡喃−2−基)−8−羟基−2,2−二甲基−3,4−二氢−2H−1−苯并吡喃−4−酮黄烷类 — 0.70% 31 Negative [M-H]- C18H14O6 2−(2H−1,3−苯并二氧醇−5−基)−5,7−二甲氧基−4H−铬−4−酮 O-甲基黄酮 — 0.63% 32 Negative [M-H]- C33H40O21 山柰酚−3−O−槐二糖−7−O−葡萄糖苷 黄酮苷类 55136 -76-00.11% 33 Negative [M-H]- C21H24O11 儿茶素−4'−O−β−D−吡喃葡萄糖苷 黄酮苷类 — 0.16% 34 Negative [M-2H]2- C27H30O17 槲皮素−3,4'−O−二−β−吡喃葡萄糖苷 双黄酮和多聚黄酮类 — 0.01% 35 Negative [M-H]- C21H20O11 木犀草素−7−O−葡萄糖苷 黄酮苷类 5373 -11-50.06% 36 Negative [M-H]- C27H31O15 矢车菊素−3−O−芸香糖苷 黄酮苷类 28338 -59-20.32% 37 Negative [M-H]- C30H26O12 原花青素二聚体 双黄酮和多聚黄酮类 — 0.01% 38 Negative [M-H]- C17H14O9 5,7−二羟基−3,6−二甲氧基−2−(3,4,5− 三羟基苯基)−4H−色原酮−4−酮 O-甲基黄酮 — 0.78% 39 Negative [M-H]- C21H22O13 二氢杨梅−7−葡萄糖苷 黄酮苷类 — 0.11% 40 Negative [M-H]- C24H24O7 2−(3,4−二甲氧基苯基)−5,10−二甲氧基−8,8−二甲基吡喃[3,2−g]铬−4−酮 吡喃洛酮类 — 0.08% 41 Negative [M-H]- C45H38O18 原花青素 C1 双黄酮和多聚黄酮类 37064 -30-51.38% 42 Negative [M-H]- C21H22O11 2,4,6,4'−四羟基−2−苄基香豆荆酮4−O−葡萄糖苷 黄酮苷类 — 0.71% 43 Negative [M-H]- C15H14O6 表儿茶素 黄烷类 490-46-0 5.65% 44 Negative [M-H]- C15H14O6 L−(−)−儿茶素 黄烷类 — 0.35% 45 Negative [M-H]- C30H26O11 (2r,3r,4s)−2−(4−羟基苯基)−4−{[(2r,3r,4s)−4,7,8−三羟基-2-(4-羟基苯基)−3,4−二氢−2h−1−苯并吡喃−3−基]氧}−3,4−二氢−2h−1−苯并吡喃−3,7,8−三醇 黄烷类 — 0.09% 46 Negative [M-H]- C21H18O14 杨梅素−3−葡萄糖醛酸苷 黄酮苷类 77363 -65-60.13% 47 Negative [M-H]- C32H24O10 5−羟基−2−(4−{[5−羟基−2−(4−羟基苯基)−7−甲氧基−4−氧代−3,4−二氢−2H−1−苯并吡喃−6−基]氧基}苯基)−7−甲氧基−4H−铬−4−酮 O-甲基黄酮 — 0.10% 48 Negative [M-H]- C21H20O12 槲皮素−4'−O−葡萄糖苷 黄酮苷类 — 0.14% 49 Negative [M+Cl]- C27H30O16 3−[(2S,3R,4S,5R,6S)−3,4-二羟基−6−甲基−5−[(2S,3R,4S,5S,6R)−3,4,5−三羟基−6−(羟甲基)氧嘧−2−基]氧氧嘧−2−(3,4−二羟基苯基)−5,7−二羟基铬−4−酮 黄酮苷类 — 0.68% 50 Negative [M-2H]- C27H31O16 飞燕草素−3−O−(6''−O−α−鼠李吡喃糖基−β−吡喃葡萄糖苷) 黄酮苷类 — 8.24% 51 Negative [M-H]- C30H26O12 (+)−原花青素 B2 双黄酮和多聚黄酮类 29106 -49-80.32% 52 Negative [M-H]- C21H18O13 槲皮素−3−O−葡萄糖醛酸苷 黄酮苷类 22688 -79-549.99% 53 Negative [M-H]- C28H24O16 2''−O−没食子酰基金丝桃苷 黄酮苷类 53209 -27-10.34% 54 Negative [M-H]- C21H20O12 异槲皮素 黄酮苷类 21637 -25-23.89% 55 Negative [M-H]- C21H20O12 金丝桃苷 黄酮苷类 482-36-0 0.08% 56 Negative [M-H]- C16H16O7 (2r,3r,4r)−2−(3−羟基−4−甲氧基苯基)−3,4−二氢−2h−1−苯并吡喃−3,4,7,8−四醇 黄烷类 — 0.26% 57 Negative [M-H]- C28H32O16 异鼠李素−3−芸香糖苷 黄酮苷类 604-80-8 0.16% 58 Negative [M-2H]2- C21H18O12 木犀草素−7−O−葡萄糖醛酸苷 黄酮苷类 29741 -10-42.47% 59 Negative [M-H]- C15H12O7 二氢槲皮素 黄烷类 480-18-2 0.51% 60 Negative [M-H]- C22H24O11 高圣草素−7−O−β−D−葡萄糖苷 黄酮苷类 14982 -11-70.17% 61 Negative [M-H]- C23H24O12 白桦油醇−3−半乳糖苷 黄酮苷类 — 0.08% 62 Negative [M-H]- C23H24O11 5−羟基−2−(4−羟基−3,5−二甲氧基苯基)−7−[(2S,3S,5S)−3,4,5−三羟基−6−(羟甲基)氧嘧−2−基]铬−4−酮 黄酮苷类 — 0.13% 63 Negative [M-H]- C21H24O8 2,3,3,5,6,7−六甲氧基−2−苯基−1−苯并吡喃−4−酮 O−甲基黄酮 — 0.08% 64 Negative [M-H]- C15H12O6 二氢山奈酚 黄烷类 480-20-6 0.58% 65 Negative [M-H]- C24H20O8 9,10−二氢−10−(4−羟基苯基)−吡喃基[2,3−h]表儿茶素−8−酮 黄烷类 — 0.15% 66 Negative [M-H]- C21H20O11 木犀草素−7−O−葡萄糖苷 黄酮苷类 5373 -11-50.06% 67 Negative [M-H]- C20H18O9 5−羟基−3,6,7,8−四甲氧基−3',4'−亚甲二氧基黄酮 O-甲基黄酮 — 0.09% 68 Negative [M-H]- C21H22O10 (2S,3R,4S,5S,6R)−2−[[(6aS,11aS)−6a,9−二羟基−6,11a−二氢−[1]苯并呋喃[3,2−c]铬−3−基]氧基]−6−(羟甲基)氧代−3,4,5−三醇 黄酮苷类 — 0.09% 69 Negative [M-H]- C21H20O12 (2S)−二氧化二酰−7−O−β−D−吡喃葡萄糖醛酸 黄酮苷类 — 0.13% 70 Negative [M-H]- C22H22O10 4,7,9−三甲氧基−6−(3,4,5−三甲氧基苯基)-2h-[1,3]二氧氧基[4,5−g]铬−8−酮 O−甲基黄酮 — 0.06% 71 Negative [M-H]- C16H14O6 橙皮素 O−甲基黄酮 520-33-2 0.29% 72 Negative [M-H]- C16H14O5 二氢木蝴蝶素A O−甲基黄酮 18956 -18-80.05% 73 Negative [M-H]- C23H24O7 (2S)−5,7−二甲氧基−8−(2S−羟基−3−甲基−3−丁烯基)−3',4'−亚甲二氧基黄烷酮 黄烷类 — 0.04% -
[1] 王健, 水庆艳, 宋希强. 木棉(Bombax ceiba)名称辨析与栽培应用[J]. 热带作物学报, 2009, 30(12): 1764 − 1769. doi: 10.3969/j.issn.1000-2561.2009.12.010 [2] 中国科学院中国植物志编辑委员会. 中国植物志 第四十九卷 第二分册[M]. 北京: 科学出版社, 1984: 106. [3] 包文龙,冯俊华,劳成景,等. 木棉花提取物对酪氨酸 酶抑制作用的研究[J].广东化工,2020,48(14):100−102. [4] 国家药典委员会. 中华人民共和国药典(一部)[M]. 北京: 中国医药科技出版社, 2020. [5] DONIPATI R S, SUBHASINI P. Determining the Antioxidant Activity of Bombax ceiba Flower Extracts[J]. International Journal for Pharmaceutical Research Scholars, 2016, 5: 146 − 150. [6] 刘金泳, 邱素君, 陈芳超, 等. 木棉花水提取物抗炎镇痛作用的实验研究[J]. 广州医药, 2018, 49(1): 5 − 8. doi: 10.3969/j.issn.1000-8535.2018.01.002 [7] YOSHIMI N, MATSUNAGA K, KATAYAMA M, et al. The inhibitory effects of mangiferin, a naturally occurring glucosylxanthone, in bowel carcinogenesis of male F344 rats[J]. Cancer Letters, 2001, 163(2): 163 − 170. doi: 10.1016/S0304-3835(00)00678-9 [8] MASOOD-UR-REHMAN, AKHTAR N, MUSTAFA R. Antibacterial and antioxidant potential of stem bark extract of Bombax ceiba collected locally from south Punjab area of Pakistan[J]. African Journal of Traditional, Complementary and Alternative Medicines, 2017, 14(2): 9 − 15. doi: 10.21010/ajtcam.v14i2.2 [9] SALEEM R, AHMAD M, HUSSAIN S A, et al. Hypotensive, hypoglycaemic and toxicological studies on the flavonol C-glycoside shamimin from Bombax ceiba[J]. Planta Medica, 1999, 65(4): 331 − 334. doi: 10.1055/s-1999-14060 [10] ARAFA A F, FODA D S, MAHMOUD A H, et al. Bombax ceiba flowers extract ameliorates hepatosteatosis induced by ethanol and relatively moderate fat diet in rats[J]. Toxicology Reports, 2019, 6: 401 − 408. doi: 10.1016/j.toxrep.2019.04.008 [11] PATEL S S, VERMA N K, RATHORE B, et al. Cardioprotective effect of Bombax ceiba flowers against acute adriamycin-induced myocardial infarction in rats[J]. Revista Brasileira De Farmacognosia, 2011, 21(4): 704 − 709. doi: 10.1590/S0102-695X2011005000090 [12] HODGSON J M. Effects of tea and tea flavonoids on endothelial function and blood pressure: a brief review[J]. Clinical and Experimental Pharmacology and Physiology, 2006, 33(9): 838 − 841. doi: 10.1111/j.1440-1681.2006.04450.x [13] RATHEE P, CHAUDHARY H, RATHEE S, et al. Mechanism of action of flavonoids as anti-inflammatory agents: a review[J]. Inflammation & Allergy-Drug Targets (Discontinued), 2009, 8(3): 229 − 235. doi: 10.2174/187152809788681029 [14] 高中洪, 黄开勋, 徐辉碧. 黄芩中黄酮类生物活性的研究进展[J]. 中国药学杂志, 1998, 33(12): 705 − 707. doi: 10.3321/j.issn:1001-2494.1998.12.001 [15] VIEIRA T O, SAID A, ABOUTABL E, et al. Antioxidant activity of methanolic extract of Bombax ceiba[J]. Redox Report, 2009, 14(1): 41 − 46. doi: 10.1179/135100009X392485 [16] TUNDIS R, RASHED K, SAID A, et al. In vitro cancer cell growth inhibition and antioxidant activity of Bombax ceiba (Bombacaceae)flower extracts[J]. Natural Product Communications, 2014, 9(5): 69 − 694. doi: 10.1177/1934578X1400900527 [17] 唐微艳. 木棉花水提物对人肺癌NCI-H460细胞体内外抑制作用及机制研究[D]. 南宁: 广西医科大学, 2019. [18] 徐源, 杨立军, 李冰洁, 等. 超声辅助双水相提取紫苏叶总黄酮工艺优化及其抗氧化活性分析[J]. 粮食与油脂, 2025, 38(2): 158 − 162. doi: 10.3969/j.issn.1008-9578.2025.02.026 [19] 魏瑞敬. 木棉花黄酮的提取分离及祛痘功效研究[D]. 广州: 华南理工大学, 2022. doi: 10.27151/d.cnki.ghnlu.2022.004380 [20] 王斌, 王凤君, 梁颖琪, 等. 玫瑰纯露提取工艺优化及其抑菌和抗氧化活性研究[J]. 北方园艺, 2020(18): 106 − 113. doi: 10.11937/bfyy.20194233 [21] 黎楚楚, 徐霖, 林长松. 响应面优化黄姜花根多糖提取工艺及其抗氧化活性分析[J]. 饲料研究, 2024, 47(11): 109 − 113. doi: 10.13557/j.cnki.issn1002-2813.2024.11.020 [22] 任曼妮, 王存堂, 唐旭华, 等. 黑豆皮多酚提取物抗氧化活性研究[J]. 食品与机械, 2019, 35(10): 189 − 192. doi: 10.13652/j.issn.1003-5788.2019.10.038 [23] WANT E J, MASSON P, MICHOPOULOS F, et al. Global metabolic profiling of animal and human tissues via UPLC-MS[J]. Nature Protocols, 2013, 8(1): 17 − 32. doi: 10.1038/nprot.2012.135 [24] ZELENA E, DUNN W B, BROADHURST D, et al. Development of a robust and repeatable UPLC-MS method for the long-term metabolomic study of human serum[J]. Analytical Chemistry, 2009, 81(4): 1357 − 1364. doi: 10.1021/ac8019366 [25] HE G Q, XIONG H P, CHEN Q E, et al. Optimization of conditions for supercritical fluid extraction of flavonoids from hops(Humulus lupulus L. )[J]. Journal of Zhejiang University Science B, 2005, 6(10): 999 − 1004. doi: 10.1007/BF02888491 [26] 林庆景, 王志江, 杨旭, 等. 超声波辅助提取木棉花黄酮工艺[J]. 亚热带农业研究, 2016, 12(3): 192 − 198. doi: 10.13321/j.cnki.subtrop.agric.res.2016.03.010 [27] 何秋彤. 凉茶抗氧化性能的研究[D]. 广州: 华南理工大学, 2011. [28] WANJARI M M, GANGORIA R, DEY Y N, et al. Hepatoprotective and antioxidant activity of Bombax ceiba flowers against carbon tetrachloride-induced hepatotoxicity in rats[J]. Hepatoma Research, 2016, 2: 144 − 150. doi: 10.20517/2394-5079.2015.55 [29] YU Y G, HE Q T, YUAN K, et al. In vitro antioxidant activity of Bombax malabaricum flower extracts[J]. Pharmaceutical Biology, 2011, 49(6): 569 − 576. doi: 10.3109/13880209.2010.529614 [30] 马琼. 木棉花化学成分研究及活性部位的抗糖尿病作用[D]. 呼和浩特: 内蒙古大学, 2016. doi: 10.7666/d.Y3026877 [31] ZHANG Y B, WU P, ZHANG X L, et al. Phenolic compounds from the flowers of Bombax malabaricum and their antioxidant and antiviral activities[J]. Molecules, 2015, 20(11): 19947 − 19957. doi: 10.3390/molecules201119660 [32] HAIT M, GOSWAMI J. Physicochemical and phytochemical status on flower of Bombax ceiba[J]. Journal of Medicinal Plants Studies, 2017, 5(3): 189 − 192. [33] JOSHI K R, DEVKOTA H P, YAHARA S. Chemical analysis of flowers of Bombax ceiba from Nepal[J]. Natural Product Communications, 2013, 8(5): 583 − 584. doi: 10.1177/1934578X1300800508 [34] EL-HAGRASSI A M, ALI M M, OSMAN A F, et al. Phytochemical investigation and biological studies of Bombax malabaricum flowers[J]. Natural Product Research, 2011, 25(2): 141 − 151. doi: 10.1080/14786419.2010.518146 [35] SAID A, ABOUTABL E A, NOFAL S M, et al. Phytoconstituents and bioctivity evaluation of Bombax ceiba L. flowers[J]. Journal of Traditional Medicines, 2011, 28(2): 55 − 62. doi: 10.11339/jtm.28.55 [36] WU J, ZHANG X H, ZHANG S W, et al. Three novel compounds from the flowers of Bombax malabaricum[J]. Helvetica Chimica Acta, 2008, 91(1): 136 − 143. doi: 10.1002/hlca.200890004 [37] KUMAR S M, MADHURAMBAL G. Quercetagetin glycoside from the flowers of Bombax ceiba[J]. Asian Journal of Research in Chemistry, 2010, 3(1): 78 − 80. [38] LI A N, LI S, LI H B, et al. Total phenolic contents and antioxidant capacities of 51 edible and wild flowers[J]. Journal of Functional Foods, 2014, 6: 319 − 330. doi: 10.1016/j.jff.2013.10.022 [39] NIRANJAN G S, GUPTA P C. Anthocyanins from the flowers of Bombax malabaricum[J]. Planta Medica, 1973, 24(6): 196 − 199. doi: 10.1055/s-0028-1099488 [40] SAMPIEV A M, NIKIFOROVA E B, SHEVCHENKO A I. Flavonoids from leaves of Ziziphus jujuba[J]. Pharmaceutical Chemistry Journal, 2020, 54(8): 800 − 803. doi: 10.1007/s11094-020-02277-w [41] GUNESCH S, SORIANO-CASTELL D, LAMER S, et al. Development and application of a chemical probe based on a neuroprotective flavonoid hybrid for target identification using activity-based protein profiling[J]. ACS Chemical Neuroscience, 2020, 11(22): 3823 − 3837. doi: 10.1021/acschemneuro.0c00589 [42] WU Y B, ZHENG L J, WU J G, et al. Antioxidant activities of extract and fractions from receptaculum nelumbinis and related flavonol glycosides[J]. International Journal of Molecular Sciences, 2012, 13(6): 7163 − 7173. doi: 10.3390/ijms13067163 [43] HO L, FERRUZZI M G, JANLE E M, et al. Identification of brain-targeted bioactive dietary quercetin-3-O-glucuronide as a novel intervention for Alzheimer's disease[J]. The FASEB Journal, 2013, 27(2): 769 − 781. doi: 10.1096/fj.12-212118 [44] DERLINDATI E, DALL'ASTA M, ARDIGÒ D, et al. Quercetin-3-O-glucuronide affects the gene expression profile of M1 and M2a human macrophages exhibiting anti-inflammatory effects[J]. Food & Function, 2012, 3(11): 1144 − 1152. doi: 10.1039/C2FO30127J [45] 李玉山. 芦丁的资源、药理及主要剂型研究进展[J]. 氨基酸和生物资源, 2013, 35(3): 13 − 16. doi: 10.14188/j.ajsh.2013.03.011 [46] BABY B, ANTONY P, VIJAYAN R. Antioxidant and anticancer properties of berries[J]. Critical Reviews in Food Science and Nutrition, 2018, 58(15): 2491 − 2507. doi: 10.1080/10408398.2017.1329198 [47] JIA N, XIONG Y L, KONG B H, et al. Radical scavenging activity of black currant (Ribes nigrum L. ) extract and its inhibitory effect on gastric cancer cell proliferation via induction of apoptosis[J]. Journal of Functional Foods, 2012, 4(1): 382 − 390. doi: 10.1016/j.jff.2012.01.009 [48] 童观珍, 付晓萍, 杨艳, 等. 表儿茶素的分布及药理活性研究进展[J]. 云南农业大学学报(自然科学), 2018, 33(2): 343 − 349. doi: 10.12101/j.issn.1004-390X(n).201705044 [49] SHARIATI S, KALANTAR H, PASHMFOROOSH M, et al. Epicatechin protective effects on bleomycin-induced pulmonary oxidative stress and fibrosis in mice[J]. Biomedicine & Pharmacotherapy, 2019, 114: 108776. doi: 10.1016/j.biopha.2019.108776 [50] LI J W, WANG X Y, ZHANG X, et al. (-)-Epicatechin protects against myocardial ischemia-induced cardiac injury via activation of the PTEN/PI3K/AKT pathway[J]. Molecular Medicine Reports, 2018, 17(6): 8300 − 8308. doi: 10.3892/mmr.2018.8870 -

 点击查看大图
点击查看大图
计量
- 文章访问数: 278
- HTML全文浏览量: 175
- 被引次数: 0



 下载:
下载: