-
肠致病菌感染发生时,释放大量的脂多糖,从而促进致病菌在肠道定植,阻断吞噬作用,并干扰白细胞的迁移和黏附[1]。感染结束后致病菌数量减少,但是脂多糖仍然大量存在。致病菌脂多糖是革兰氏阴性细菌的主要细胞壁成分,在肠腔中含量丰富[2]。研究发现,脂多糖通过分泌细胞因子和炎症介质,直接或间接地破坏紧密连接蛋白的结构,使黏膜通透性增加[3],从而诱发肠道炎症。目前,治疗炎症性肠病的有效方法仍然很少[4 − 5]。临床上常用的药物包括5-氨基水杨酸、洛哌丁胺、奥曲肽、5-HT3受体阻断剂等[6],对肠炎具有一定的治疗效果,但在临床应用过程中极易出现不良反应。英夫利昔单抗和阿达木单抗对肠炎的控制具有一定的效果,但费用昂贵,且长期使用易产生抗药性[7]。此外,益生菌、膳食补充剂等可以改善炎症性肠病的症状,但这些药物在临床应用中的效果仍然有限[5]。因此,亟需开发新的治疗制剂缓解炎症。
丁酸钠(sodium butyrate,SB)是一种短链脂肪酸,具有抗炎和改善肠道屏障的功能[8 − 10]。例如,有研究发现SB可以抑制活性氧的表达和NLRP3炎症小体的激活,并通过影响核NF-κB的信号通路,从而抑制炎症因子的表达,保护黏膜屏障的完整性[11]。然而,口服补充的SB在胃肠道上部被快速吸收,大部分药物无法到达炎症部位发挥作用[12]。此外,口服SB也因其令人不愉快的味道而在使用中受到限制。研究表明,药物递送系统能够有效地提高药物递送的效率及治疗效果,因此,构建合适的药物递送系统用于丁酸钠的递送成为当前研究的热点。
壳聚糖(chitosan,CS)及其衍生物由于具有良好的黏膜黏附性[13]、生物相容性、生物可降解性[14]、低毒性、低免疫原性,以及抗病毒、抗癌和抗炎等多种生物活性而受到广泛关注[15]。最重要的是,许多基于CS的药物递送系统显示,CS在治疗炎症性肠病中具有巨大的优势。首先,CS对pH具有敏感性,其在低pH环境(例如胃液、小肠液)中能够使包封的药物不被释放出来,但是在较高pH环境(如结肠)中溶解或膨胀,从而允许药物释放[16]。其次,研究发现,结肠中有400多种不同种类的需氧和厌氧微生物,它们能产生水解和还原代谢酶,催化异生物质和其他生物分子的代谢。而CS只能在结肠中被厌氧菌代谢,在胃和小肠中稳定,这些特性使其对胃肠道环境具有良好的耐受性,同时使结肠靶向给药成为可能。透明质酸(hyaluronic acid,HA)是一种可生物降解、生物相容性好且无毒的天然多糖,广泛应用于纳米颗粒制剂中[17]。HA作为细胞外基质的物质基础,在药物输送方面也具有巨大的应用潜力。除了在肠道炎症性疾病中具有抗炎作用外,HA还能够降低肠道通透性[18]。研究报道,HA可用于制备灌肠剂,涂覆在发炎的结肠上皮表面,从而提供一种隔离外部细菌的保护屏障,促进受损黏膜的修复,降低肠道通透性[19]。
壳聚糖-透明质酸纳米颗粒是由壳聚糖和透明质酸配体组成的纳米颗粒,两者都是天然多糖[20]。两种聚合物具有相反的电荷,因此与其他需要大量化学修饰的纳米颗粒配体系统(例如叶酸、曲妥珠单抗、雌激素等)相比,其制备方式更简单[21]。因此,利用壳聚糖和透明质酸在三聚磷酸钠(sodium tripolyphosphate,TPP)存在下交联的性质,将丁酸钠包裹在颗粒中,形成CS-SB纳米颗粒。通过透射电镜和激光粒度分析对CS-SB进行表征,利用高效液相色谱测定CS-SB对SB的负载量,并探究SB在PBS溶液中的缓释情况。通过RT-qPCR检测经CS-SB处理后的炎性细胞中IL-1β、TNF-α、IL-10和TGF-β基因的相对表达情况,分析CS-SB的抗炎活性。
-
本实验使用的Caco-2细胞为实验室保藏细胞株,所用培养基为DMEM培养基,在37 ℃的二氧化碳培养箱中培养。
-
丁酸钠(C4H7NaO2)购于安耐吉化学技术有限公司;壳聚糖季铵盐(C6H13NO4)、透明质酸((C14H21NO11)n)购于麦克林生化科技有限公司;三聚磷酸钠(Na5P3O10)购于西亚化学有限公司;DMEM培养基、胎牛血清、青霉素−链霉素溶液、胰酶、CCK-8和Total RNA Extractor试剂盒购于生工生物有限公司;脂多糖购于碧云天生物技术有限公司。
-
超净工作台(SW−CJ−2D)购于苏州净化设备有限公司;荧光定量PCR仪(LightCycler 96)购于美国罗氏集团;高速台式离心机(Centrifuge 5418)购于德国艾本德股份公司;振荡仪(VM−500S)购于群安实验仪器有限公司;高效液相色谱仪(Waters 2695)购于美国Waters公司;透射电子显微镜(JEM−2100)购于日本电子有限公司;激光粒度分析仪(BT−9300 H)购于东康有限公司。
-
按参考文献[22]制备CS-SB,并稍作修改。具体步骤:1)分别配制SB溶液(8 mg·mL−1)、CS溶液(0.6 mg·mL−1)、HA溶液(1.25 mg·mL−1)及TPP溶液(0.5 mg·mL−1),其中CS溶液用1%(v/v)的乙酸溶液配制,其余均用去离子水配制;2)在搅拌下,向2 mL HA溶液中加入100 μL TPP溶液,备用;3)向1 mL CS溶液中加入0.2 mL SB溶液,搅拌30 min,备用;4)将0.5 mL 2)滴加到 3)中,搅拌10 min形成CS-SB溶液。
-
取10 μL CS-SB溶液滴加到铜网上(74 μm),待自然干燥后,于透射电子显微镜下观察。
-
使用激光粒度分析仪对CS-SB的水合粒径和Zeta电位进行测定。
-
本实验通过高效液相色谱仪测定SB的含量,测定条件参考文献[23]:使用C18色谱柱,流动相A为乙腈,流动相B为0.1%(v/v)的磷酸溶液,其中,乙腈与磷酸溶液的体积比为20∶80,流速为1 mL·min−1,使用紫外检测器,在206 nm波长下检测,柱温为30 ℃,进样量为20 μL。
-
CS-SB制备好后,12 000 r·min−1离心10 min后收集上清液,过0.22 μm滤膜,通过高效液相色谱仪测定其中丁酸钠的质量,此为未被CS包裹的SB,与初始SB相减,即为包裹在CS中SB的质量。
$$ \begin{split} \text{负载量}=& \text{包裹在}CS\text{中的}SB\text{质量}(\rm{ng})/ \\ & CS\text{ 的质量}(\rm{ng})\end{split} $$ -
CS-SB制备好后,12 000 r·min−1离心10 min收集沉淀,弃上清液,用1 mL PBS溶液将沉淀重悬起来,放入37 ℃、150 r·min−1恒温摇床中,于0.5、1、2、4、8、24 h将EP管取出,12 000 r·min−1离心10 min后取约0.5 mL上清液(并向其中补充等量PBS溶液),过0.22 μm滤膜后装入液相瓶中,通过高效液相色谱仪测定其中释放的SB质量。测定前将液相瓶放于4 ℃冰箱暂存。以时间(h)为横坐标,丁酸钠累积释放量(ng)为纵坐标绘制SB在PBS溶液中随时间的释放曲线图。
-
本研究采用CCK-8法探究药物对细胞的毒性作用,结果以细胞存活率表示。将细胞接种在96孔板中(每孔中10万个细胞),然后放在37 ℃ CO2培养箱中培养12 h。随后用不同浓度的CS、SB及CS-SB处理细胞,24 h后吸出培养液,加入CCK-8显色1 h后,用酶标仪测定其在450 nm下的吸光度并计算细胞存活率。每组重复3次。
$$ \begin{split} & \mathrm{细}\mathrm{胞}\mathrm{存}\mathrm{活}\mathrm{率} (\text{%}) = [\mathrm{O}\mathrm{D}_{\mathrm{实}\mathrm{验}\mathrm{组}} - \mathrm{O}\mathrm{D}_{\mathrm{空}\mathrm{白}\mathrm{组}} ]/ \\& \qquad [\mathrm{O}\mathrm{D}_{\mathrm{对}\mathrm{照}\mathrm{组}}-\mathrm{O}\mathrm{D}_{\mathrm{空}\mathrm{白}\mathrm{组}}]\times 100, \end{split} $$ 式中,OD实验组为用CS、SB及CS-SB处理的组,即具有细胞、药物溶液、培养基溶液、CCK-8溶液的孔的OD;OD对照组为未做任何处理的组,即具有细胞、培养基溶液、CCK-8溶液的孔的OD;OD空白组为具有培养基溶液、CCK-8溶液的孔的OD。
-
实验共分为5组,分别是Control组、PBS组、CS组、SB组及CS-SB组,每组进行3次重复。将消化后的细胞接种在12孔板中(每孔中100万个细胞),然后放在37 ℃ CO2培养箱中培养12 h。随后分别用含LPS(10 μg·mL−1)的PBS、CS、SB及CS-SB溶液处理细胞(其中CS、SB及CS-SB的质量浓度均为30 μg·mL−1)。24 h后吸出培养液,然后用Trizol试剂盒提取细胞RNA,将其反转录成cDNA后,进行RT-qPCR,以β-Actin作为内参,使用2−△△ct法计算IL-1β、TNF-α、IL-10和TGF-β基因的相对表达量。
-
按照Total RNA Extractor(Trizol)试剂盒说明书步骤提取细胞RNA并测定其中RNA的浓度。
-
采用HiScript Ⅱ Q RT SuperMix for qPCR试剂盒将RNA反转录成cDNA,反转录总体系为10 μL(表1和表2)。
表 1 反转录体系
Table 1. Reverse transcription system
成分 Ingredient 体积 Volumes/μL RNA x(${x}=\dfrac{500}{{c} }$,500为cDNA质量,
ng;c为RNA浓度,ng·μL−1)5×HiScript Ⅱ qRT
super Mix2 RNase-free ddH2O 8-x 表 2 反转录程序
Table 2. Reverse transcription procedure
反应温度
Reaction temperature/℃反应时间
Reaction time/min50 15.0 85 0.5 -
将cDNA稀释一定的倍数,配制RT-qPCR体系,引物序列见表3。将样品加入到96孔板中,用膜封住反应孔,瞬离20 s后放置于实时荧光定量PCR仪中(反应体系和反应程序见表4和表5)。
表 3 引物序列
Table 3. Primer sequences
基因名称
Gene name引物序列(5′-3′)
Primer sequence(5′-3′)IL-10(F) TTTGAATTCCCTGGGTGAGAA IL-10(R) CTCCACTGCCTTGCTCTTATTTTC iNOS(F) CAACCAGTATTATGGCTCCT iNOS(R) GTGACAGCCCGGTCTTTCCA TGF-β(F) TGGTGGACCGCAACAACGCC TGF-β(R) GGGGGTTCGGGCACTGCTTC IL-1β(F) AAATACCTGTGGCCTTGGGC IL-1β(R) CTTGGGATCCACACTCTCCAG 表 4 RT-qPCR反应体系
Table 4. RT-qPCR reaction system
成分
Ingredient体积/µL
Volumes/µLcDNA 1.08 2×ChamQ SYBR Color qPCR
Master Mix5 Forward primer 0.4 Reverse primer 0.4 ddH2O 3.12 表 5 RT-qPCR反应程序
Table 5. RT-qPCR reaction procedures
步骤
Step温度/°C
Temperature/°C时间/s
Time/s1 95 30 2 95 5 3 55 15 4 72 15 注:步骤2~4重复40个循环。
Note: Repeat steps 2-4 for 40 cycles. -
数据以“平均值±标准差”表示。使用Graphpad Prism软件进行绘图,使用SPSS软件对实验数据进行统计分析,对2组样本进行独立样本t检验,对3组及以上样本进行单因素方差分析,并计算显著性。显著性水平设置为*P<0.05,**P<0.01和***P<0.001。
-
药物递送载体在调控肠上皮功能障碍过程中具有重要意义,基于CS的纳米材料因具有黏附性、环境响应性等优势,成为肠道药物递送的重要载体。故本研究选用具有黏附作用的CS和缓解炎症作用的HA形成药物载体,并装载SB进行药物递送。CS-SB经TPP的交联作用形成,图1是制备好的CS-SB的照片,可以看出CS-SB溶液呈乳白色,略黏稠。此外,在制备过程中观察到,滴入交联剂TPP的瞬间,溶液由透明变浑浊,表明纳米颗粒的形成,与文献报道的一致[22]。同时,高效液相色谱测得CS-SB对SB的负载量为(119.95 ± 8.95)ng SB/600 ng CS。
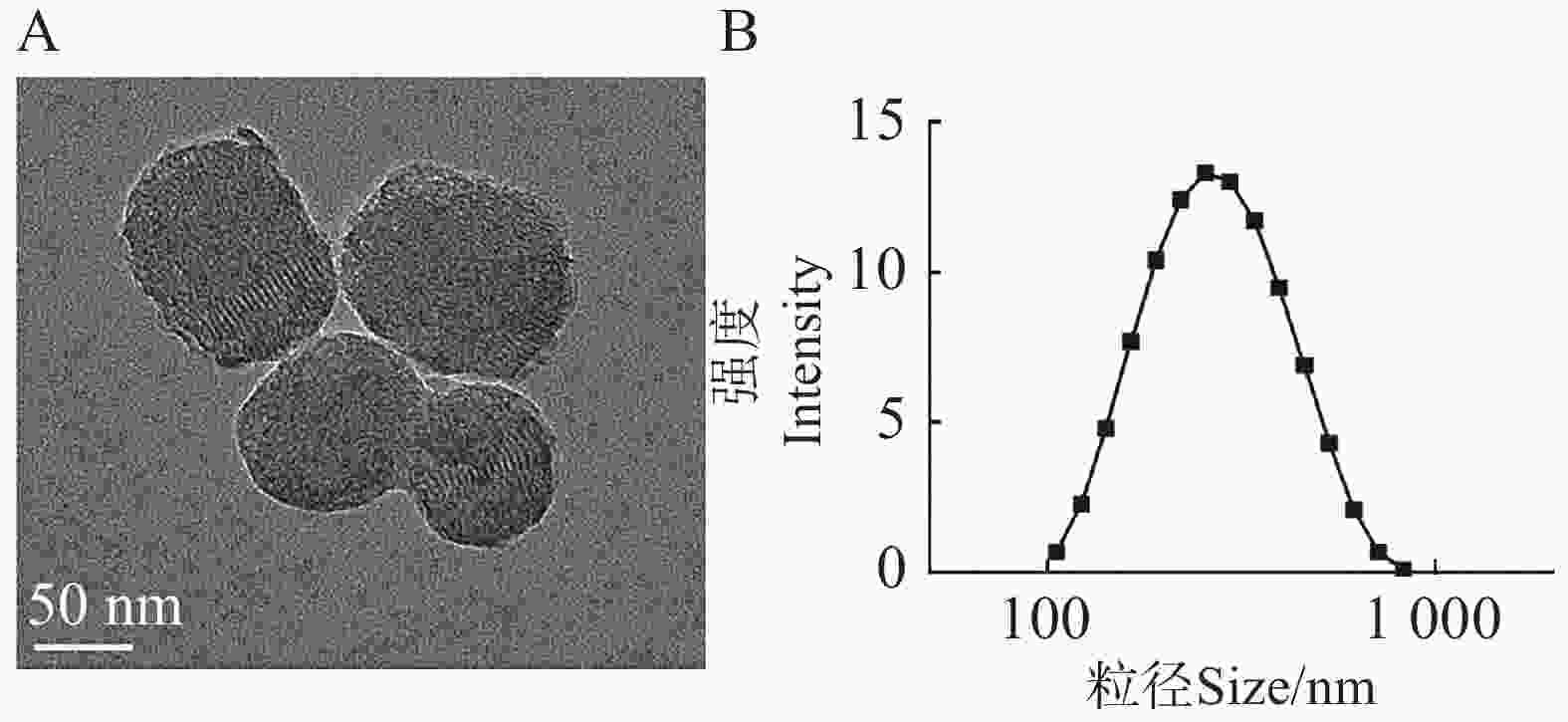
为了研究CS-SB的形貌与表面性质等特征,通过透射电子显微镜、马尔文激光粒度仪等仪器对CS-SB的形貌、电位和水合粒径等特征进行测定。图2−A为CS-SB的透射电子显微镜图像,CS-SB呈不规则的球状,粒径为(97.30±4.20)nm。通过激光粒度仪测定CS-SB的水合粒径和Zeta电位,图2−B表明,CS-SB的水合粒径约为(358.35±218.60) nm,略高于透射电镜所测得的粒径,可归因于纳米颗粒表面游离的分子团簇。CS-SB的ζ电位为(1.62±0.04) mV,表明其表面携带正电荷。
-
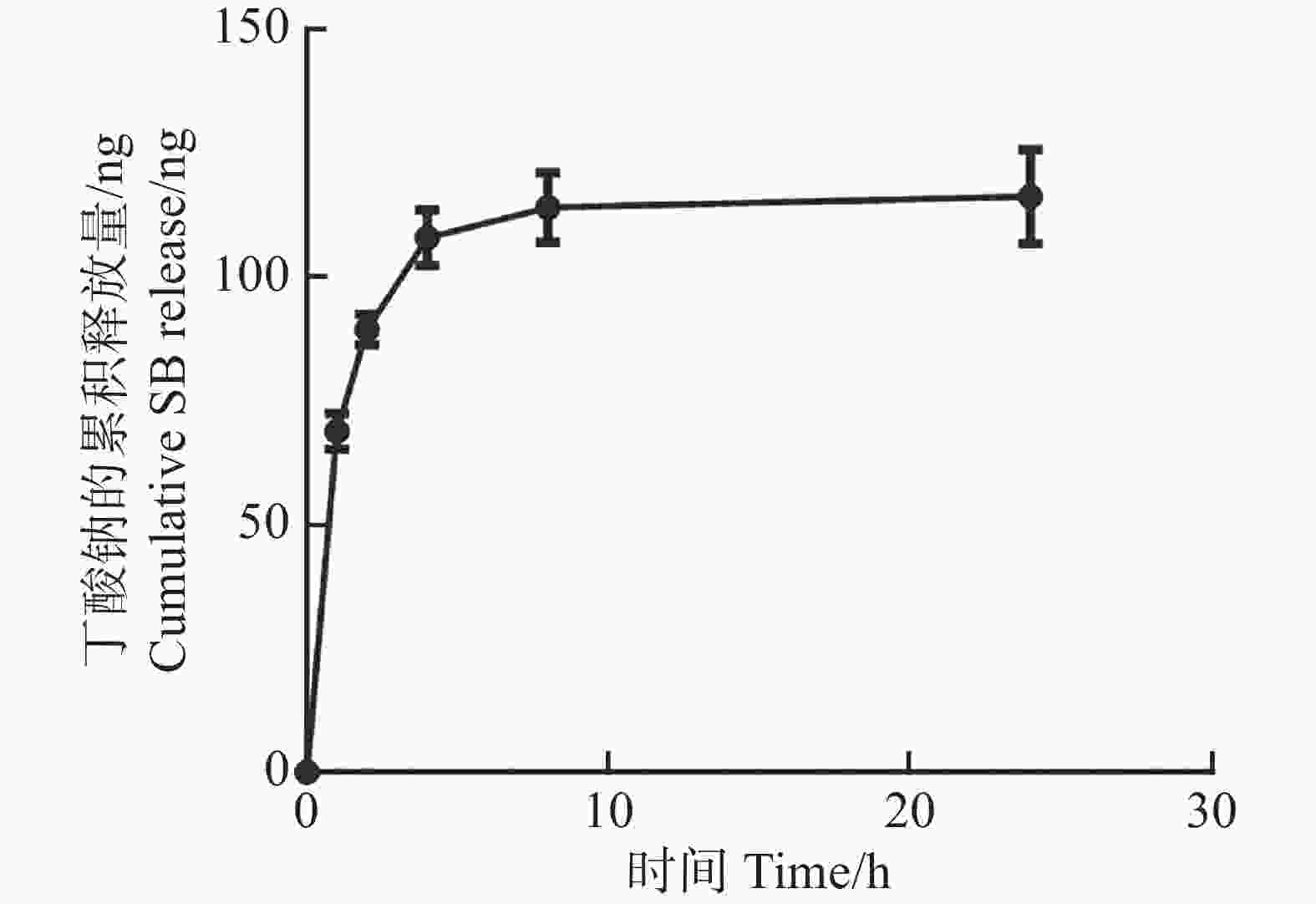
CS-SB中SB的体外释放在PBS缓冲液(pH=7.4)中进行。通过高效液相色谱仪连续检测了其在PBS溶液中24 h的释放情况。结果表明,SB的释放主要集中在前8 h,8~24 h的释放量逐渐趋于稳定,24 h的累积释放量达到(116.27±7.75)ng(图3)。该结果表明,当CS-SB处于中性环境中时,负载SB的CS因其对pH的响应特性,可将负载的药物释放出来。此外,本研究还用同样的方法研究了CS-SB在低pH环境中(pH=1.5)的药物释放行为,高效液相结果显示,SB在低pH环境中2 h内累积释放量几乎为0。CS的这一特性已被其他文章报道,即CS对pH具有敏感性,其在酸性环境中稳定,负载的药物不被释放出来,但其在较高pH环境(如结肠)中溶解或膨胀,药物被缓慢释放[24]。
-
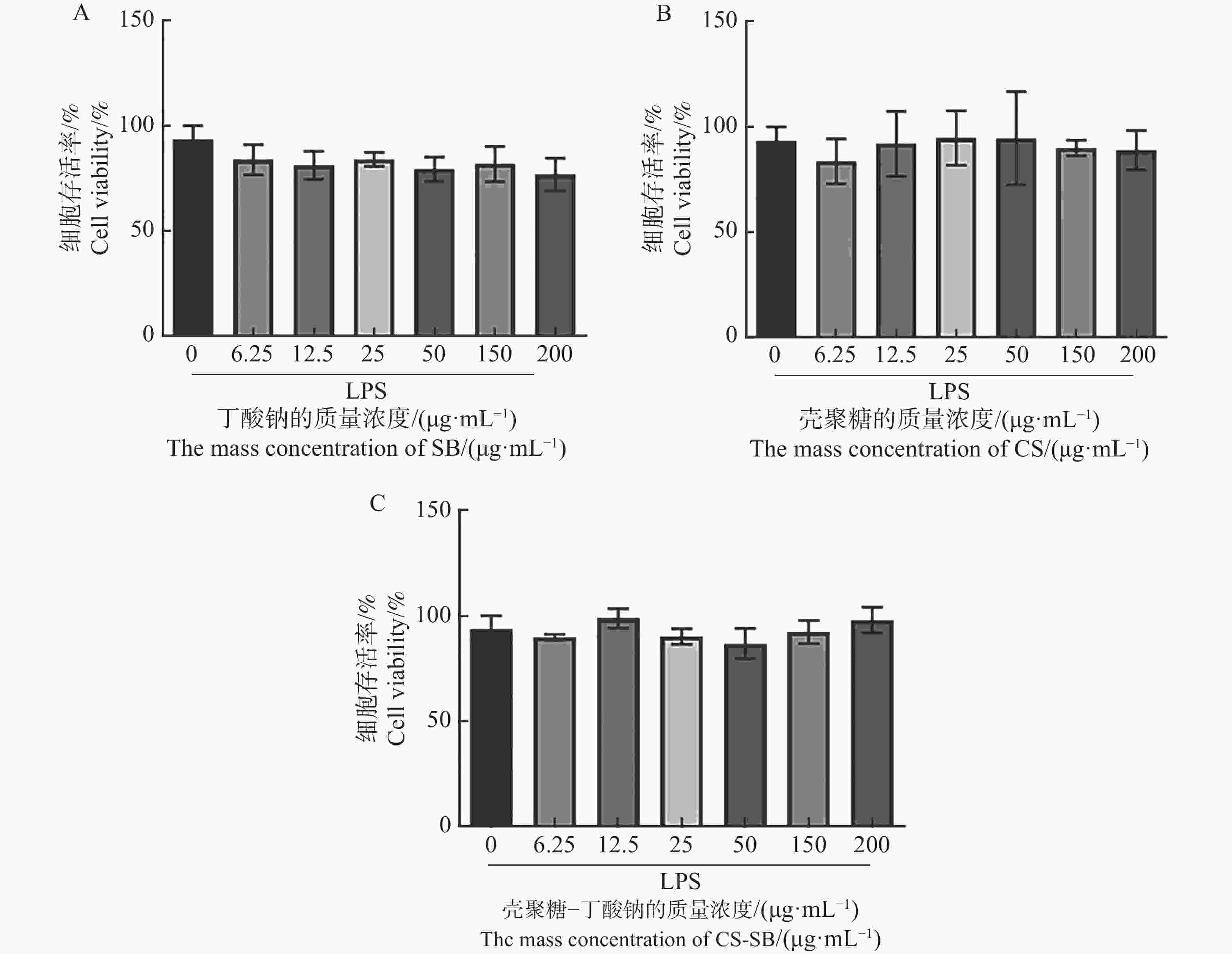
为评估CS-SB对Caco-2细胞的毒性作用,将不同质量浓度的CS、SB和CS-SB与细胞共孵育24 h后,用CCK-8法来检测细胞的存活率。图4表明,在本实验设定的质量浓度范围内(6.25~200 μg·mL−1),CS、SB和CS-SB处理细胞24 h后,细胞的存活率均大于80%,即认为药物对细胞的毒性可忽略不计。
-
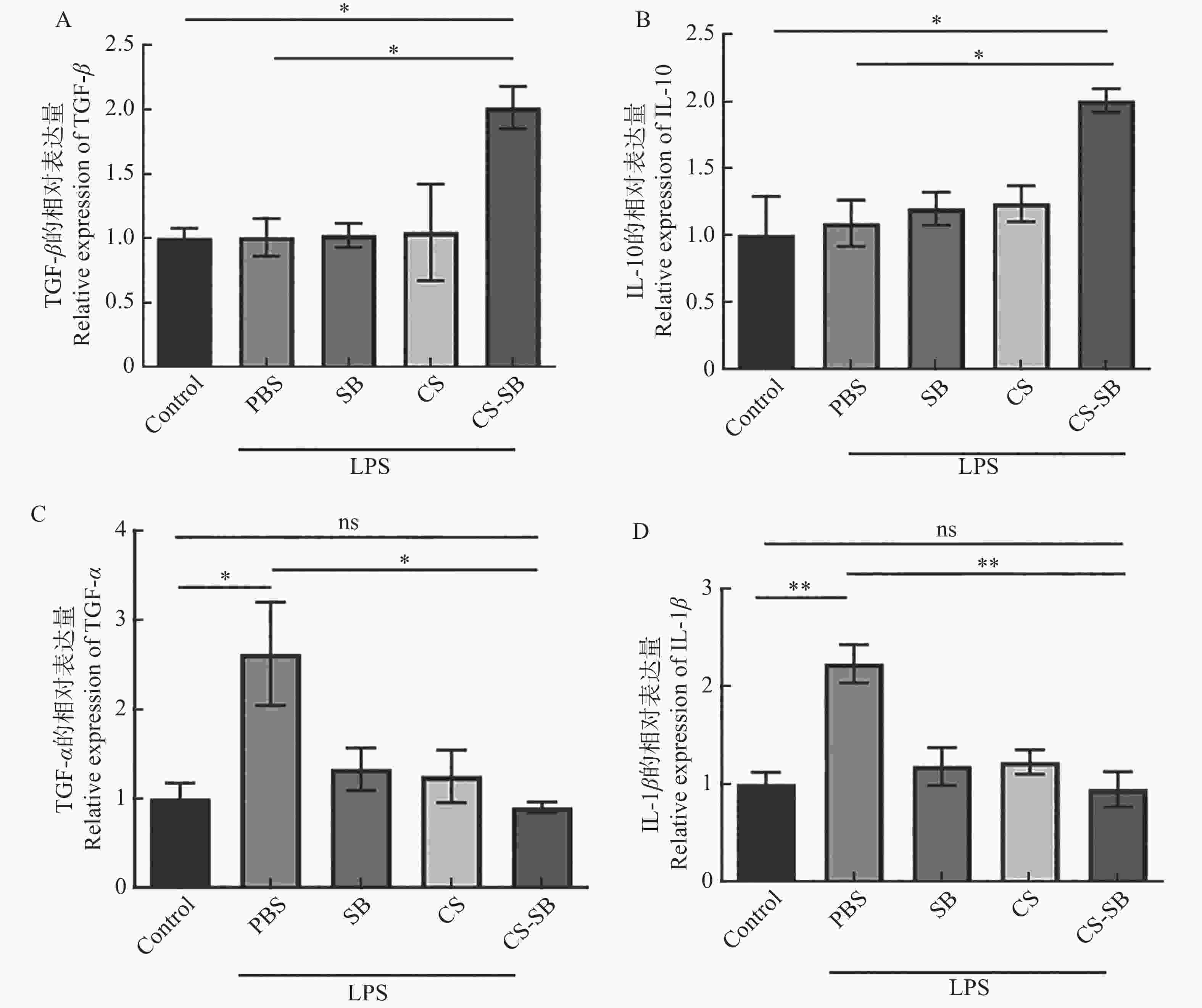
为了探究CS-SB对炎症的缓解作用,用LPS刺激Caco-2细胞24 h,建立细胞炎症模型,再分别用PBS、SB、CS及CS-SB与细胞共孵育,24 h后收集细胞并提取RNA,进行RT-qPCR,检测IL-1β、TNF-α、IL-10和TGF-β基因的相对表达情况。图5表明,与未处理的细胞(Control组)相比,LPS刺激后(PBS组),Caco-2细胞的促炎因子IL-1β和TNF-α的相对表达量显著增加,说明LPS刺激24 h后成功构建了肠道细胞炎症模型。而SB、CS及CS-SB逆转了IL-1β和TNF-α的上调,其中,CS-SB的效果最显著。此外,CS-SB处理后细胞的抗炎基因IL-10和TGF-β的相对表达量较PBS组上调约2倍。综上所述,CS-SB激活了细胞抗炎反应,能够有效缓解LPS刺激诱发的细胞炎症。
-
肠上皮屏障功能障碍,可能使肠黏膜通透性增加,肠道病原菌或毒素易位,进而加重肠道屏障完整性的破坏,导致肠道局部或全身疾病,如炎症性肠病、多器官功能障碍等[25]。因此,维持肠上皮屏障功能在临床治疗各种急慢性疾病中非常重要。载药纳米颗粒因具有黏附性、环境响应性等优势,逐渐取代了传统药物。
载药纳米颗粒的制备方法有很多,例如通过乳液液滴的凝胶化获得纳米颗粒,该方法可应用于具有胶凝特性的聚合物。聚合物的胶凝特性决定了从乳液中获得纳米颗粒的程序。对于像琼脂糖这样的聚合物,通过将高温(100 ℃)下的该溶液冷却便可以形成纳米颗粒。而对于藻酸盐和果胶等其他聚合物,则需要通过添加第二种成分或通过改变聚合物溶液的pH值来形成凝胶[26]。再比如基于自组装大分子的方法来形成纳米颗粒,有报道称[27]将海藻酸盐(一种带负电的多糖)与聚赖氨酸(一种带正电的肽)混合后,会形成纳米级聚集体。而本研究利用CS和HA在TPP存在下交联的性质,将SB包裹在其中,形成CS-SB纳米颗粒。该方法简单易行,可操作性强。
作为短链脂肪酸的一种,SB优良的抗炎活性和肠道屏障修复功能被广泛报道[28]。然而其气味难闻、易挥发和利用率低等缺点限制了SB口服应用[29]。本研究制备的CS-SB纳米颗粒有效克服了这一缺陷。CS-SB处理后细胞的抗炎因子IL-10和TGF-β较PBS组上调约2倍,表明CS-SB具有良好的抗炎活性。
CS-SB细胞水平抗炎活性实验还表明,CS-SB降低了促炎因子IL-1β和TNF-α在炎性细胞中的相对表达量。IL-1β是肠道炎症和组织损伤的重要因素,在促进炎症发生发展中具有关键作用[30]。变性白蛋白包裹氯喹纳米粒子(BSA-chl NPs)能够使促炎因子IL-1β的表达下调约1.75倍[31]。本研究中,CS-SB处理后炎性细胞的IL-1β基因相对表达量下调225%,说明其抗炎活性可能优于BSA-chl NPs。此外,CS和游离的SB均能有效降低炎性细胞中IL-1β基因的相对表达量,其联合使用对于NF-κB的调控具有更好的效果。其次,CS的黏附性和pH响应性,可以帮助药物黏附在特定部分,延长药物在体内的停留时间的同时实现药物可控释放[32]。
-
将CS和HA作为药物递送载体,开发了一种新型肠道炎症治疗策略。简而言之,就是利用CS和HA在TPP存在下交联的性质,将SB包裹在颗粒中,形成CS-SB纳米颗粒。实验结果表明,CS-SB组装成功,并且负载的SB能够在PBS溶液中缓慢释放。此外,CS-SB生物安全性高,能有效地抑制炎性细胞促炎因子的表达,具有良好的抗炎活性。鉴于其生物安全性及良好的抗炎活性,CS-SB有望用于治疗肠炎性疾病。本研究为新型生物活性口服药物递送系统的构建提供了新思路,为进一步实现肠道炎症的有效治疗奠定了理论基础。
丁酸钠负载壳聚糖纳米颗粒的制备及其抗炎活性研究
DOI: 10.15886/j.cnki.rdswxb.20240069
 CSTR: 32425.14.j.cnki.rdswxb.20240069
CSTR: 32425.14.j.cnki.rdswxb.20240069
Preparation of sodium butyrate-loaded chitosan nanoparticles and their anti-inflammatory activities
-
摘要: 致病菌感染会释放大量脂多糖,破坏肠道紧密连接蛋白的结构,导致肠道通透性增加,造成肠上皮屏障功能失调,诱发严重的肠道炎症。丁酸钠,作为短链脂肪酸的一种,对于缓解肠道炎症具有重要作用;然而,其易挥发、利用率低等特性严重影响其应用。因此,设计开发丁酸钠药物递送系统对于提高丁酸钠利用率和作用效果具有重要意义。基于此,利用壳聚糖(chitosan,CS)和透明质酸(hyaluronic acid,HA)在三聚磷酸钠(sodium tripolyphosphate,TPP)存在下交联的性质,将丁酸钠(sodium butyrate,SB)包裹在颗粒中,形成CS-SB纳米颗粒。通过透射电子显微镜和激光粒度分析对CS-SB进行表征,发现CS-SB呈不规则的球状,粒径约为(97.30±4.20) nm。SB能够在PBS缓冲液中释放,24 h的累积释放量达到(116.27±7.75) ng。构建脂多糖诱导肠道细胞炎症模型,发现CS-SB能有效地抑制细胞促炎因子的表达,起到缓解炎症的作用。运用壳聚糖等天然产物开发的药物递送系统,能有效克服丁酸钠易挥发的缺点,为设计新型生物活性口服药物递送体系提供了一种新的思路。Abstract: Pathogenic bacterial infections release large amounts of lipopolysaccharides that disrupt the structure of intestinal tight junction proteins, leading to increased intestinal permeability, causing dysfunction of the intestinal epithelial barrier, and inducing severe intestinal inflammation. Sodium butyrate (SB), as a type of short-chain fatty acid, has an important role in relieving intestinal inflammation. However, its properties such as volatility and low utilization rate seriously affect its application. Therefore, the design and development of sodium butyrate drug delivery system is important to improve the utilization and effect of sodium butyrate. In this context the nature of cross-linking of chitosan (CS) and hyaluronic acid in the presence of sodium tripolyphosphate was made full use of to form CS-SB nanoparticles by encapsulating SB in the particles. CS-SB was characterized by transmission electron microscopy and laser particle size analysis, and was found to be irregularly spherical with a particle size of approximately (97.30 ± 4.20) nm. SB was able to release in PBS buffer, reaching a cumulative release of (116.27 ± 7.75) ng over 24 h. A lipopolysaccharide-induced intestinal cellular inflammation model was constructed, and it was found that CS-SB could effectively inhibit the expression of cellular pro-inflammatory factors and play a role in alleviating inflammation. The drug delivery system developed using natural products such as chitosan can effectively overcome the shortcomings of sodium butyrate, which is volatile, and provides a new idea for designing new bioactive oral drug delivery systems.
-
Key words:
- sodium butyrate /
- chitosan /
- lipopolysaccharide /
- nanoparticles /
- anti-inflammatory
-
表 1 反转录体系
Table 1 Reverse transcription system
成分 Ingredient 体积 Volumes/μL RNA x( ${x}=\dfrac{500}{{c} }$ ,500为cDNA质量,
ng;c为RNA浓度,ng·μL−1)5×HiScript Ⅱ qRT
super Mix2 RNase-free ddH2O 8-x 表 2 反转录程序
Table 2 Reverse transcription procedure
反应温度
Reaction temperature/℃反应时间
Reaction time/min50 15.0 85 0.5 表 3 引物序列
Table 3 Primer sequences
基因名称
Gene name引物序列(5′-3′)
Primer sequence(5′-3′)IL-10(F) TTTGAATTCCCTGGGTGAGAA IL-10(R) CTCCACTGCCTTGCTCTTATTTTC iNOS(F) CAACCAGTATTATGGCTCCT iNOS(R) GTGACAGCCCGGTCTTTCCA TGF-β(F) TGGTGGACCGCAACAACGCC TGF-β(R) GGGGGTTCGGGCACTGCTTC IL-1β(F) AAATACCTGTGGCCTTGGGC IL-1β(R) CTTGGGATCCACACTCTCCAG 表 4 RT-qPCR反应体系
Table 4 RT-qPCR reaction system
成分
Ingredient体积/µL
Volumes/µLcDNA 1.08 2×ChamQ SYBR Color qPCR
Master Mix5 Forward primer 0.4 Reverse primer 0.4 ddH2O 3.12 表 5 RT-qPCR反应程序
Table 5 RT-qPCR reaction procedures
步骤
Step温度/°C
Temperature/°C时间/s
Time/s1 95 30 2 95 5 3 55 15 4 72 15 注:步骤2~4重复40个循环。
Note: Repeat steps 2-4 for 40 cycles. -
[1] 蔡军涛. 两种肠道致病菌表面糖类抗原的全合成研究[D]. 无锡: 江南大学, 2020. doi: 10.27169/d.cnki.gwqgu.2020.001142 [2] MOHR A E, CRAWFORD M, JASBI P, et al. Lipopolysaccharide and the gut microbiota: considering structural variation[J]. FEBS Letters, 2022, 596(7): 849 − 875. doi: 10.1002/1873-3468.14328 [3] KUO W T, ZUO L, ODENWALD M A, et al. The tight junction protein ZO-1 is dispensable for barrier function but critical for effective mucosal repair[J]. Gastroenterology, 2021, 161(6): 1924 − 1939. doi: 10.1053/j.gastro.2021.08.047 [4] WANG Y Y, WEI B, WANG D P, et al. DNA damage repair promotion in colonic epithelial cells by andrographolide downregulated cGAS‒STING pathway activation and contributed to the relief of CPT-11-induced intestinal mucositis[J]. Acta Pharmaceutica Sinica B, 2022, 12(1): 262 − 273. doi: 10.1016/j.apsb.2021.03.043 [5] 向道春. 穿心莲内酯缓解5-氟尿嘧啶所致肠道损伤的作用和机制研究[D]. 武汉: 华中科技大学, 2020. doi: 10.27157/d.cnki.ghzku.2020.002123 [6] LONG D P. Crohn's disease and ulcerative colitis: from pathophysiology to novel therapeutic approaches[J]. Biomedicines, 2024, 12(3): 689. doi: 10.3390/biomedicines12030689 [7] YANG K L, WANG X C, HUANG R K, et al. Prebiotics and postbiotics synergistic delivery microcapsules from microfluidics for treating colitis[J]. Advanced Science, 2022, 9(16): 2104089. doi: 10.1002/advs.202104089 [8] REKHA K, VENKIDASAMY B, SAMYNATHAN R, et al. Short-chain fatty acid: An updated review on signaling, metabolism, and therapeutic effects[J]. Critical Reviews in Food Science and Nutrition, 2024, 64(9): 2461 − 2489. doi: 10.1080/10408398.2022.2124231 [9] NEY L M, WIPPLINGER M, GROSSMANN M, et al. Short chain fatty acids: key regulators of the local and systemic immune response in inflammatory diseases and infections[J]. Open Biology, 2023, 13(3): 230014. doi: 10.1098/rsob.230014 [10] 鲁春灵, 黄建奎, 冯斌, 等. 丁酸盐在仔猪肠道健康调节中的应用研究进展[J]. 中国畜牧杂志, 2023, 59(8): 41 − 45. doi: 10.19556/j.0258-7033.20230117-03 [11] PENG K X, XIA S H, XIAO S Q, et al. Short-chain fatty acids affect the development of inflammatory bowel disease through intestinal barrier, immunology, and microbiota: a promising therapy?[J]. Journal of Gastroenterology and Hepatology, 2022, 37(9): 1710 − 1718. doi: 10.1111/jgh.15970 [12] MU Y M, KINASHI Y, LI J T, et al. Polyvinyl butyrate nanoparticles as butyrate donors for colitis treatment[J]. ACS Applied Bio Materials, 2021, 4(3): 2335 − 2341. doi: 10.1021/acsabm.0c01105 [13] WATHONI N, MEYLINA L, RUSDIN A, et al. The potential cytotoxic activity enhancement of α-mangostin in chitosan-kappa carrageenan-loaded nanoparticle against MCF-7 cell line[J]. Polymers, 2021, 13(11): 1681. doi: 10.3390/polym13111681 [14] 姚平, 杨伟渊, 祝震, 等. 新型透明质酸/壳聚糖交联膜制备及性能研究[J]. 浙江工业大学学报, 2024, 52(2): 217 − 221. doi: 10.3969/j.issn.1006-4303.2024.02.013 [15] ANIL S. Potential medical applications of chitooligosaccharides[J]. Polymers, 2022, 14(17): 3558. doi: 10.3390/polym14173558 [16] SHINN J, KWON N, LEE S A, et al. Smart pH-responsive nanomedicines for disease therapy[J]. Journal of Pharmaceutical Investigation, 2022, 52(4): 427 − 441. doi: 10.1007/s40005-022-00573-z [17] PULUHULAWA L E, JONI I M, ELAMIN K M, et al. Chitosan-hyaluronic acid nanoparticles for active targeting in cancer therapy[J]. Polymers, 2022, 14(16): 3410. doi: 10.3390/polym14163410 [18] LEE Y, SUGIHARA K, GILLILLAND III M G, et al. Hyaluronic acid-bilirubin nanomedicine for targeted modulation of dysregulated intestinal barrier, microbiome and immune responses in colitis[J]. Nature Materials, 2020, 19(1): 118 − 126. doi: 10.1038/s41563-019-0462-9 [19] KOTLA N G, ISA I L M, RASALA S, et al. Modulation of gut barrier functions in ulcerative colitis by hyaluronic acid system[J]. Advanced Science, 2022, 9(4): 2103189. doi: 10.1002/advs.202103189 [20] POUDEL K, BANSTOLA A, GAUTAM M, et al. Redox/photo dual-responsive, self-targeted, and photosensitizer-laden bismuth sulfide nanourchins for combination therapy in cancer[J]. Nanoscale, 2021, 13(2): 1231 − 1247. doi: 10.1039/D0NR07736D [21] DI MOLA A, LANDI M R, MASSA A, et al. Hyaluronic acid in biomedical fields: new trends from chemistry to biomaterial applications[J]. International Journal of Molecular Sciences, 2022, 23(22): 14372. doi: 10.3390/ijms232214372 [22] SACCO P, DECLEVA E, TENTOR F, et al. Butyrate-loaded chitosan/hyaluronan nanoparticles: a suitable tool for sustained inhibition of ROS release by activated neutrophils[J]. Macromolecular Bioscience, 2017, 17(11): 1700214. doi: 10.1002/mabi.201700214 [23] 李浙烽, 余荣, 安文敏, 等. 使用HPLC法测定丁酸和丁酸钠的方法: 中国, 103728389[P]. 2016-04-27. https://pss-system.cponline.cnipa.gov.cn/documents/detail?prevPageTit=changgui. [24] ZHUO S J, ZHANG F, YU J Y, et al. pH-sensitive biomaterials for drug delivery[J]. Molecules, 2020, 25(23): 5649. doi: 10.3390/molecules25235649 [25] FARRÉ R, FIORANI M, ABDU RAHIMAN S, et al. Intestinal permeability, inflammation and the role of nutrients[J]. Nutrients, 2020, 12(4): 1185. doi: 10.3390/nu12041185 [26] ZIELIŃSKA A, CARREIRÓ F, OLIVEIRA A M, et al. Polymeric nanoparticles: production, characterization, toxicology and ecotoxicology[J]. Molecules, 2020, 25(16): 3731. doi: 10.3390/molecules25163731 [27] DROGOZ A, DAVID L, ROCHAS C, et al. Polyelectrolyte complexes from polysaccharides: formation and stoichiometry monitoring[J]. Langmuir, 2007, 23(22): 10950 − 10958. doi: 10.1021/la7008545 [28] 周超, 唐含林, 徐鹏, 等. 丁酸盐在小鼠结肠炎损伤中的缓解作用及机制研究[J]. 免疫学杂志, 2020, 36(1): 28 − 33. doi: 10.13431/j.cnki.immunol.j.20200006 [29] VERNERO M, DE BLASIO F, RIBALDONE D G, et al. The usefulness of microencapsulated sodium butyrate add-on therapy in maintaining remission in patients with ulcerative colitis: a prospective observational study[J]. Journal of Clinical Medicine, 2020, 9(12): 3941. doi: 10.3390/jcm9123941 [30] LI Y, TAN S, SHEN Y, et al. MiR-146a-5p negatively regulates the IL-1β-stimulated inflammatory response via downregulation of the IRAK1/TRAF6 signaling pathway in human intestinal epithelial cells[J]. Experimental and Therapeutic Medicine, 2022, 24(4): 615. doi: 10.3892/etm.2022.11552 [31] 马玉佩. 变性白蛋白包裹氯喹纳米粒子用于治疗炎症性肠病的研究[D]. 合肥: 合肥工业大学, 2022. doi: 10.27101/d.cnki.ghf [32] ABDELLA S, ABID F, YOUSSEF S H, et al. pH and its applications in targeted drug delivery[J]. Drug Discovery Today, 2023, 28(1): 103414. doi: 10.1016/j.drudis.2022.103414 -




 下载:
下载: