-
随着人们生活水平的提升,宠物猫犬在家庭中的普及程度日益增加。然而,猫犬携带的变应原可诱发人体过敏反应,猫犬过敏原被认为是哮喘和过敏性鼻炎发展的主要危险因素[1 − 2]。在世界范围内,猫犬过敏的发生率较高。在欧美等发达国家,由于宠物饲养率高,猫犬过敏人群占比较大,部分地区可达20%~30%。在亚洲国家,随着生活水平的提高和宠物饲养观念的变化,猫犬过敏的人数也在逐渐增加。世界各国中,以美国养宠物者最多,儿童达到了68%(猫)和86%(犬),其中约有10%的被调查者对宠物过敏[3]。国内目前尚无精确的普通人群流行病学调查数据,北京协和医院对2 413例门诊患者血清sIgE检测结果分析显示约5.4%的患者血清对猫或者犬的变应原提取物呈阳性反应。对猫过敏患者而言,在自然条件下接触一定的猫过敏原会导致严重的外周气道阻塞,不仅影响患者的生活质量,严重时甚至危及生命[4]。
已经鉴定的猫的致敏蛋白组分有8种,分别为Fel d 1~4、5、6、7和8[5],其中Fel d 1为主要致敏蛋白组分[6],最早由Ohman等[7]在1974年发现并鉴定,主要存在于猫唾液和皮脂腺中[8],80%~95%对猫过敏的患者血清中可检测到针对Fel d 1的特异性IgE抗体[9 − 10]。已鉴定的犬的致敏蛋白组分有7种,分别为Can f 1~7,Can f 1是犬的主要致敏蛋白组分[11],由舌上皮组织产生[12]。在治疗中,抗IgE单克隆抗体治疗猫犬变应原导致的一些严重过敏患者的疗效较好[13]。彭美琪等[14]研究了同时针对猫犬过敏的预防效果。目前缺乏同时针对猫和犬诱发的过敏反应的治疗方法,猫过敏患者对犬的变应原也呈现敏感症状,这表明猫主要变应原Fel d 1和犬主要变应原Can f 1可能存在交叉反应[15]。
层状双氢氧化物(Layered double hydroxides,LDH)是指某一类特殊的层状物质,这种层状材料是由数层带正电荷的层与存在其间平衡电荷的阴离子组成,中间的阴离子和层与层间作用力弱[16],且通常是可以被交换的。LDH有良好的层状结构,可以作为药物载体,能够将药物分子插入层间,实现药物的负载和保护。而且这种结构可以控制药物的释放速度,让药物在特定的部位或者时间释放[17],提高药物的有效性。在生物相容性上,LDH表现较好,其降解产物意味着它对生物体的毒性较低,在进入人体后不会引发严重的免疫反应等不良影响,比较安全[18]。
猫犬融合变应原相较于单一的猫或犬变应原,可能具有更全面的免疫原性特征,能够激发机体产生更为广泛和有效的免疫应答。基于此,本研究旨在利用LDH负载猫犬融合蛋白疫苗,构建一种创新型的可同时针对猫和犬过敏的免疫治疗策略,并通过建立猫犬融合变应原诱导的小鼠过敏模型,深入探究该疫苗在治疗过敏反应中的效果。本研究成果有望为开发针对猫犬变应原诱导过敏症的新型治疗方法提供理论依据和实验基础,推动宠物过敏治疗领域的进一步发展。
-
雌性BALB/c小鼠,4~6周龄,购自斯贝福(北京)生物技术有限公司。所有实验动物均给予无病原污染的饲料及水饲养。所有动物试验均严格按照海南大学实验动物福利与伦理要求,并经海南大学动物伦理委员会批准。
-
原核表达载体pQE-80L为海南大学生物技术制药与分子药理学实验室保存;大肠杆菌(E. coli)BL21(DE3)感受态细胞、ELISA酶标板、EL-TMB显色试剂盒、HRP-conjugated Rabbit Anti-Goat IgG均购自生工生物工程(上海)股份有限公司;Goat pAb to Mouse IgE购自Abcam公司;实验涉及其他试剂均购自国药集团化学试剂有限公司。
-
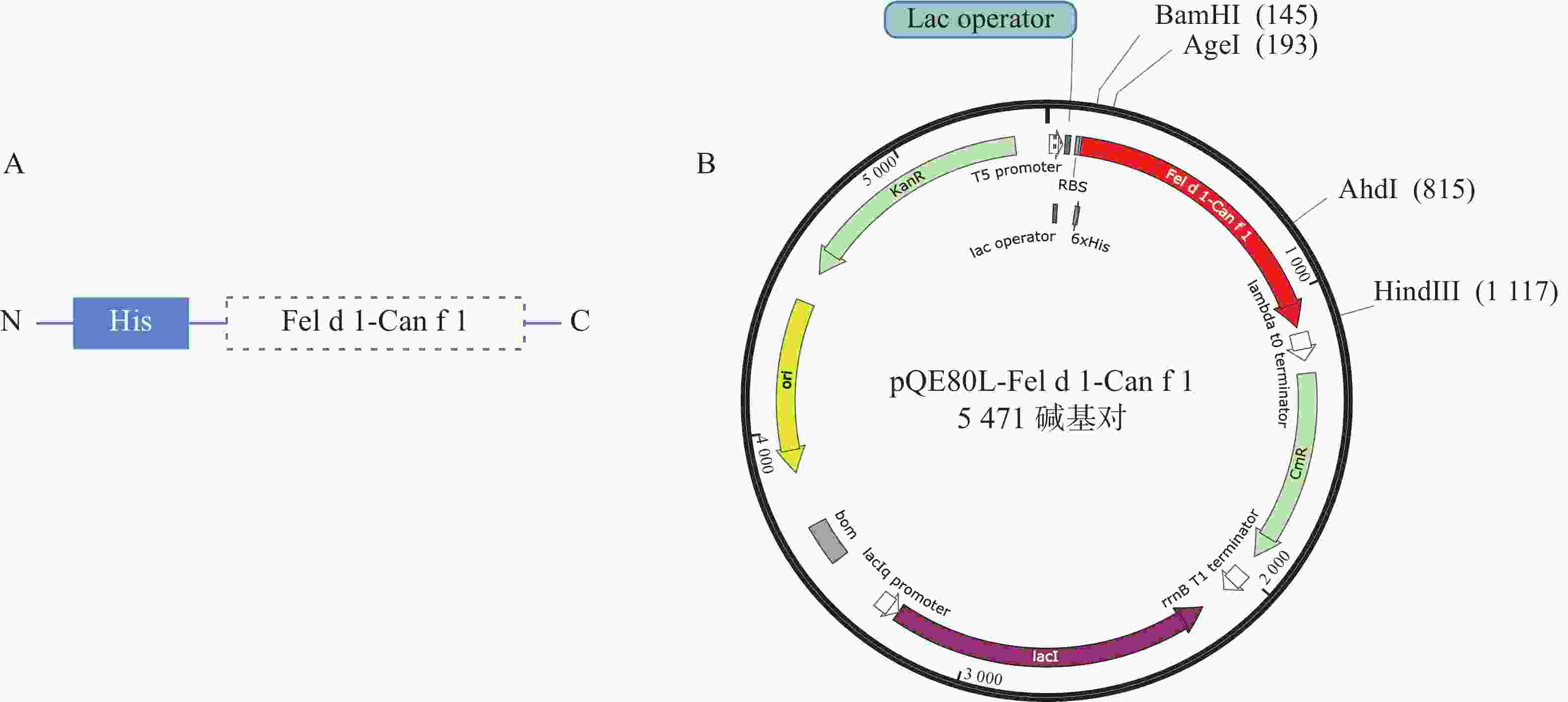
猫主要变应原Fel d 1链1(P30438)、链2(P30440)及犬的主要变应原Can f 1(O18873)基因序列均来自NCBI Genbank,进行密码子优化后将Fel d 1和Can f 1通过柔性氨基酸链AAY连接,利用BamHⅠ和Hand Ⅲ两个酶切位点将Fel d 1-Can f 1插入到原核表达载体pQE-80L中,由上海生工进行合成。
-
将pQE-80L-Fel d 1-Can f 1质粒转化E. coli BL21(DE3)感受态后,挑取阳性单菌落于卡那抗性LB培养基中,37 ℃预培养。在250 mL含卡那霉素的LB培养基中加入5 mL预培养的菌液,37 ℃恒温摇床,200 r·min−1,培养至OD600为0.6~0.8时加入终浓度为1 mmol·L−1的IPTG,160 r·min−1诱导6 h。培养结束后收集菌体在冰上进行破碎,4 ℃,8 000 g,30 min离心收集上清进行镍柱纯化,用3个柱体积的10 mmol·L−1咪唑、6个柱体积的30 mmol·L−1和4个柱体积的40 mmol·L−1依次洗脱杂蛋白,250 mmol·L−1咪唑洗脱目的蛋白,收集流出液进行SDS-PAGE。将流出液进行超滤离心以去除咪唑,浓缩至1 mL并利用BCA法测定蛋白浓度。
-
采用共沉淀法制备层状双氢氧化物LDH,A液为0.6 mol·L−1 MgCl2、0.6 mol·L−1 AlCl3和ddH2O的混合液,B液为0.15 mol·L−1 NaOH,将A液逐滴加入B液且不断搅拌制得混悬液,离心后再用ddH2O洗2次沉淀,最后用ddH2O重悬,100 ℃水热处理16 h成功制备LDH。分别采用激光粒度分析仪、X射线衍射、傅里叶红外光谱仪和扫描电镜来检测LDH的粒径大小、电位、化学组成、晶体结构和形态特征。
-
设置LDH与Fel d 1-Can f 1的不同质量比分别为5∶1、6∶1、7∶1、8∶1、9∶15∶1~9∶1混合,4 ℃下1 000 r·min−1摇床充分摇晃30 min,离心收集上清进行SDS-PAGE分析LDH与Fel d 1-Can f 1的最佳吸附比例,以最佳质量吸附比制备LDH纳米融合蛋白疫苗。
-
利用Fel d 1-Can f 1蛋白诱导小鼠过敏模型,正常组不做任何处理,建模方案参照魏春洁[19]。腹腔致敏实验:将1 mg Fel d 1-Can f 1蛋白(1 mg·mL−1溶于PBS)作为变应原与50 mg氢氧化铝佐剂混合,室温震荡2 h。在第0、7 天小鼠腹腔注射上述Fel d 1-Can f 1/氢氧化铝复合物致敏,100 µL·只−1,正常组不做任何处理。气管注入实验:第14、16、18天将Fel d 1-Can f 1蛋白(1 mg·mL−1溶于PBS)经气管注入小鼠肺部组织致敏,100 µL·只−1,共3次,进行过敏模型的诱导,正常组不做任何处理。
气管注入方法参照Mateus Casaro等[20],具体操作如下:麻醉后小鼠用橡皮筋挂住门牙,使其身体与实验台面呈90°自然垂下,保持气管不受挤压。用镊子将小鼠舌头移开暴露气管区域,将20 µL毛细管平行于气管缓缓插入,使用注射器将变应原溶液经毛细管注入,此时小鼠呼吸急促,说明气管内滴注成功。
造模完成后第3天分别对正常组和过敏模型小鼠采血检测血清中特异性IgE以及肺呼吸阻力。IgE水平若显著高于正常小鼠,说明模型建立成功可能性大;使用肺功能检测系统,给小鼠吸入乙酰甲胆碱或组胺等气道收缩剂,观察气道阻力的变化。过敏模型成功建立时,气道因炎症和高反应性对这些刺激更敏感,与正常小鼠相比,气道阻力会显著增加。
-
将小鼠过敏模型随机分为过敏模型组、LDH组和疫苗组,并对各组进行相应的治疗,正常组不做任何处理,其中,过敏模型组为猫犬融合蛋白Fel d 1-Can f 诱导的过敏模型,正常组作为对照即Naïve组,4个组别每组6只。第25、39、53天对致敏组、LDH组和疫苗组的小鼠过敏模型进行颈部皮下和腿部肌肉多点注射,其中,致敏组注射PBS,100 µL/只;、LDH组注射LDH悬液,100 µL/只;疫苗组注射LDH+Fel d 1-Can f 1,100 µL/只(1 mg·mL−1溶于PBS),颈部皮下和腿部肌肉各注射50 µL,共三次。第60天开始检测疫苗的治疗效果,采用采眼眶血检测IgE水平、检测肺呼吸阻力、Anaphyxis应激过敏检测体温、耳朵点刺统计染料渗漏面积以及组织学检测等方法检测。
-
用包被缓冲液稀释Fel d 1-Can f 1蛋白到10 μg/mL作为变应原包被96孔高吸附酶标板,100 μL/孔做3个重复,并设置空白对照用等量包被液代替变应原,于4 ℃孵育过夜。除去包被液用PBST清洗5-8次,每次都将板拍干,加入5%脱脂奶粉以封闭板上未结合位点,于37 ℃封闭1 h。除去封闭液并用PBST清洗5-8次,每次都将板拍干,加入适当稀释的小鼠血清作为一抗,37 ℃孵育2 h。除去一抗用PBST清洗5-8次,每次都将板拍干,加入1∶
3000 稀释的Goat anti-mouse IgE二抗,37 ℃孵育2 h。除去二抗并用PBST清洗5-8次,每次都将板拍干,加入1:3000 稀释的HRP-conjugated Rabbit anti-goat IgG,37 ℃孵育2 h。同样去除板上的液体,拍干,用TMB试剂盒进行显色,室温避光15-30 min,出现蓝色后加入终止液终止显色反应,酶标仪测量450 nm光密度值。 -
治疗前后小鼠通过FinePointe WBP全身体积描记检测系统检测其气道反应性。程序创建为:适应时间30 min,雾化2 min,反应时间3 min,恢复2 min。将腔体与体描机连接后把小鼠放到腔体内,依次雾化PBS以及1.56、3.125、6.25、12.5、25、50 mg·mL−1氯化乙酰胆碱(Mch),以PBS为基线,观察雾化后小鼠气道阻力变化。
-
蛋白激发后的过敏性反应,分别检测并纪录0 min的小鼠体温,尾静脉注射50 μL Fel d 1-Can f 1(1 g·L−1溶于PBS),每隔5 min记录小鼠体温检测其体温变化。
-
向小鼠尾静脉注射200 μL 0.5%Evans blue,30 min后将小鼠麻醉,使用23 G刺血针刺穿小鼠耳朵并在刺穿处滴加20 μL融合蛋白(500 μg·mL−1)。1 h后麻醉处死小鼠,用密度检测法检测小鼠耳部染料渗漏面积。
-
小鼠被麻醉处死后,取小鼠的肺组织进行固定、包埋和切片。进行H&E、PAS和Massion染色,评分标准[21- 22]见表1。
表 1 肺部组织切片评分标准
Table 1. Scoring criteria for lung tissue sections
评分项
Scoring item各分值标准(Criteria for each score) 0分 1分 2分 3分 H&E染色的炎症打分标准
Inflammation scoring criteria for H&E staining没有炎症细胞的浸润
No infiltration of inflammatory cells支气管周围偶尔出现炎症细胞
Occasional inflammatory cells around the bronchi大多数支气管周围环绕着1~5层炎症细胞薄层
Most bronchi are surrounded by a thin layer of 1 ~ 5 inflammatory cells大多数支气管周围环绕超过5层的
炎症细胞
Most bronchi are surrounded by more
than 5 layers of inflammatory cellsPAS染色杯状细胞数量的评分标准
Scoring criteria for the number of PAS stained cup cells没有杯状细胞
No goblet cell1~5个杯状细胞
1~5 goblet cells6~20个杯状细胞
6~20 goblet cells超过20个杯状细胞
More than goblet cellsMassion染色胶原沉积和纤维化评分标准
Massion Staining Collagen Deposition and Fibrosis Scoring Criteria肺泡间隔和薄壁肺泡胶原含量正常
Normal alveolar septal and thin-walled alveolar collagen content肺泡间隔轻度胶原沉积和厚纤维化
Mild collagen deposition and thick fibrosis of alveolar septa中度胶原沉积、肺泡间隔持续纤维化
Moderate collagen deposition, persistent
fibrosis of alveolar septa过度胶原沉积导致肺泡间隔增厚、肺泡压缩、融合性纤维团块和纤维增生Excessive collagen deposition leads to
alveolar septal thickening, alveolar
compression, fused fibrous masses and
fibrous hyperplasia注:H&E染色的炎症打分标准:以0~3分标准来评价支气管周围炎症的程度。PAS染色杯状细胞数量的评分标准:以0~3分标准来评价杯状细胞数目。Massion染色胶原沉积和纤维化的评分标准:以0~3分标准来评价胶原沉积和纤维化程度。
Note: Inflammation scoring criteria for H&E staining: The degree of peribronchial inflammation was evaluated on a scale of 0~3. Scoring criteria for PAS staining of the number of cuprocytes: The number of cuprocytes was evaluated on a scale of 0~3. Scoring criteria for Massion staining of collagen deposition and fibrosis: The degree of collagen deposition and fibrosis was evaluated on a scale of 0~3. -
采用Graphpad 9.0.0软件的t检验法比较各组之间的差异。Anaphyxis应激过敏试验的体温变化曲线所围成面积统计采用one-way ANOVA,Bonferroni’s multiple comparison post test。
-
构建原核表达质粒pQE-80L-Fel d 1-Can f 1,完整质粒图谱如图1所示。
-
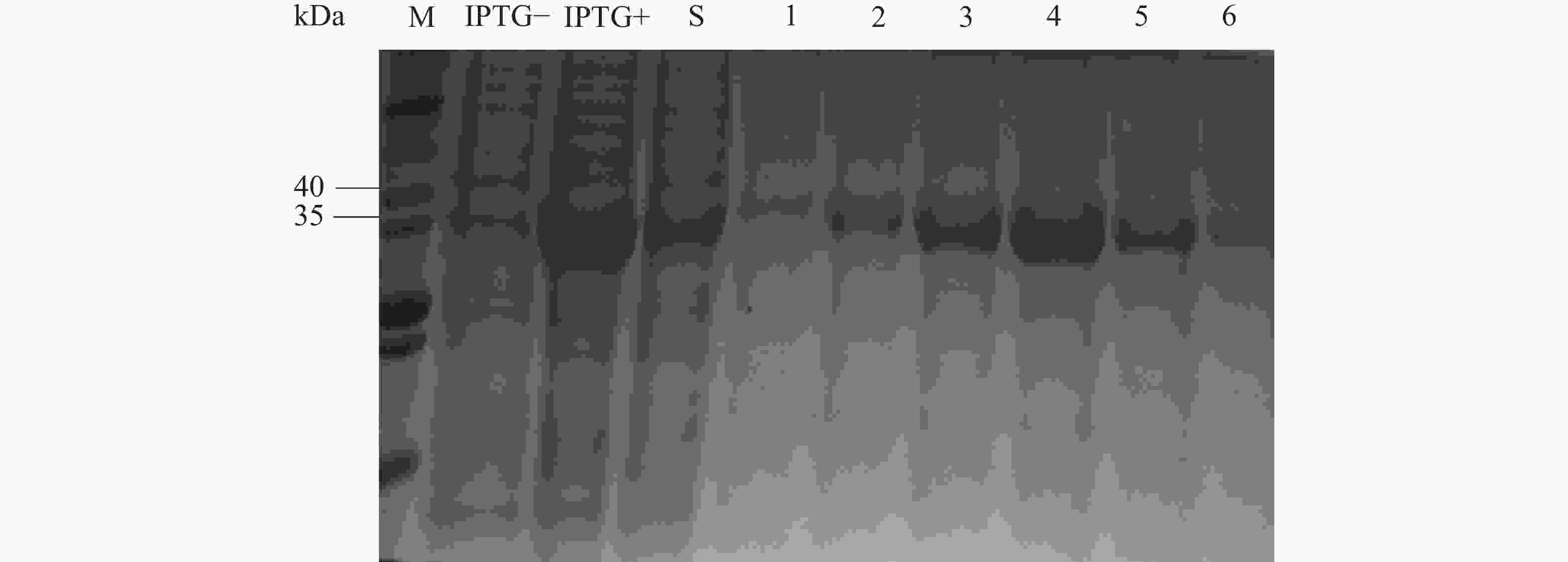
经镍柱纯化后的不同时间流出液SDS-PAGE分析,IPTG诱导后表达出融合蛋白Fel d 1-Can f 1,条带出现在36 kDa左右(图2),纯化后条带较为单一,大小与纯度符合预期。
-
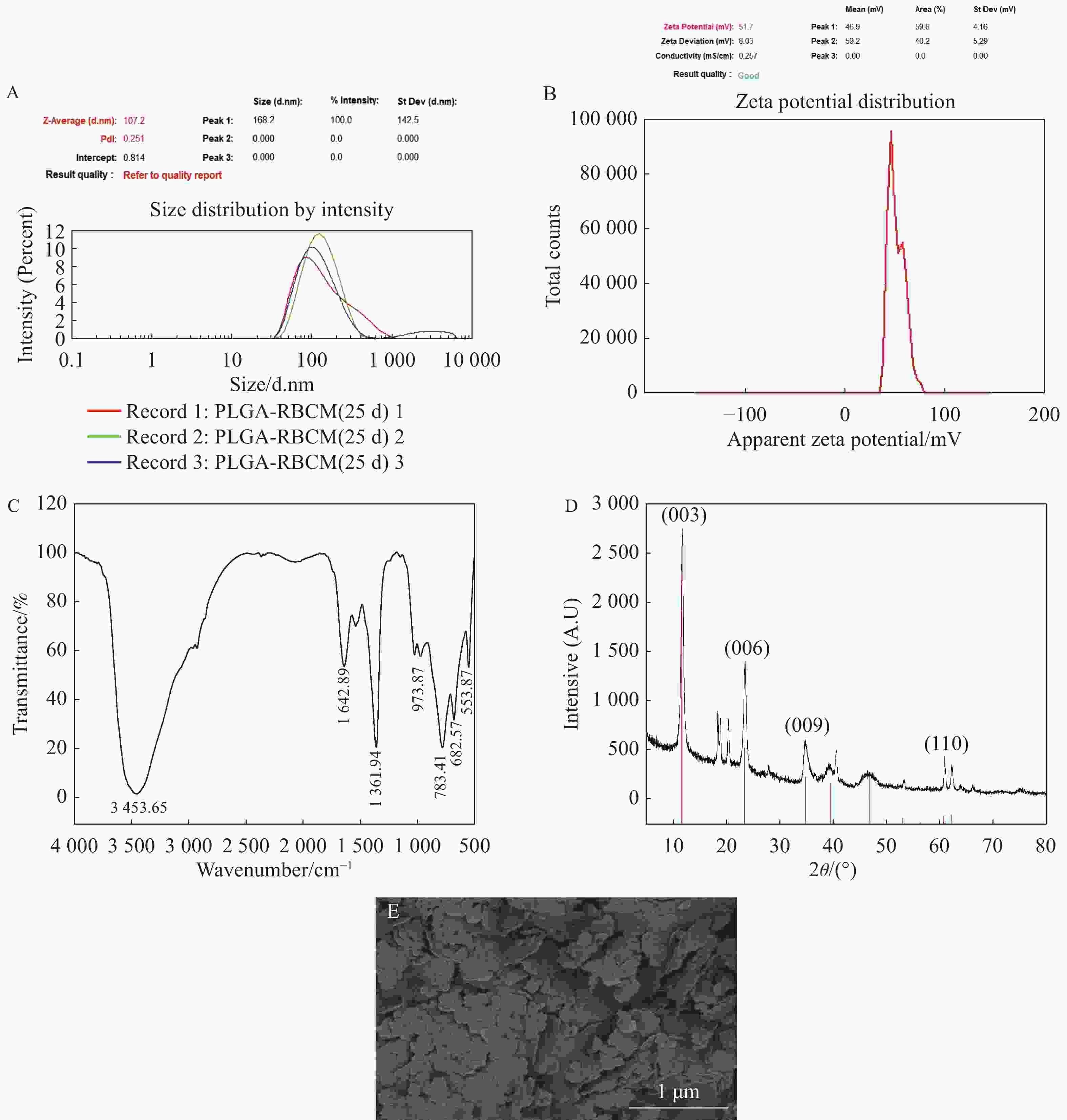
根据动态光散射原理,通过激光粒度分析仪检测LDH的粒子表面电荷、流体动力学直径和分散情况。结果如图3-A、B所示,采用共沉淀法制备的LDH平均直径为107.2 nm,Zeta电位为51.7 mV,带正电荷,多分散性指数PDI为0.251,表明颗粒分布均匀,有较好的均一性。
-
为研究LDH晶体的内部结构及晶胞参数,利用X射线衍射技术探究LDH纳米颗粒的微观结构、层间距等。LDH的X射线衍射结果如图3-C显示了LDH的几个特征峰,分别为对应(003)、(006)、(009)、(110)等晶面的基本衍射峰,这些衍射峰为LDH的典型峰,表明所得产物与天然水滑石具有相似结构。其中d(003)体现的是层状双金属氢氧化镁铝中间层的层间距,它与中间层的阴离子半径及其与层板上的阳离子之间的相互作用有关。d(110)反映了层板原子排列密度的大小,它与该晶面中镁铝的物质的量比有关。
-
使用傅里叶红外光谱仪来测定LDH的红外特征吸收峰,单体羟基在
3500 ~3650 cm−1范围有吸收峰,若化合物产生缔合现象,羟基伸缩振动吸收峰会向低波数方向位移,通常会在3460 cm−1左右出现强的吸收峰。从图3-D可以看出,样品在3400 cm−1附近有强吸收峰,峰形尖锐且无其他吸收峰干扰,该峰值比单个金属氢氧化物的吸收峰值低,说明混合金属离子溶液中生成的是非独立的氢氧化物沉淀。LDH在波长3453.65 cm−1出现吸收峰,可归于层板上O-H键及层间水分子中O-H键的伸缩振动;波长在1642.89 cm−1出现的特征峰可归于水分子中氢键的弯曲振动;在1361.94 cm−1和973.87 cm−1附近的较强吸收峰可归于层间CO32-的伸缩振动和弯曲振动;其他低于800 cm−1的吸收峰可认为是Mg-O、Al-O的伸缩及弯曲振动。 -
扫描电镜结果图3-E显示所制备LDH为片状结构,有利于层间离子交换和分子吸附,可提供更多的活性位点。颗粒尺寸较小且均匀,有助于提高材料的反应活性和均匀性。
-
为了探究LDH与融合蛋白的最佳质量吸附比,设置LDH与融合蛋白的不同质量比,通过SDS-PAGE结果图4得出LDH与融合蛋白的最佳质量比为9∶1,以此质量比制备纳米融合蛋白疫苗进行后续的动物实验。
-
为了建立猫犬融合变应原诱导小鼠过敏模型,使用猫犬融合变应原通过腹腔注射和气管注入等方式诱导小鼠过敏模型(图5-A)。
-
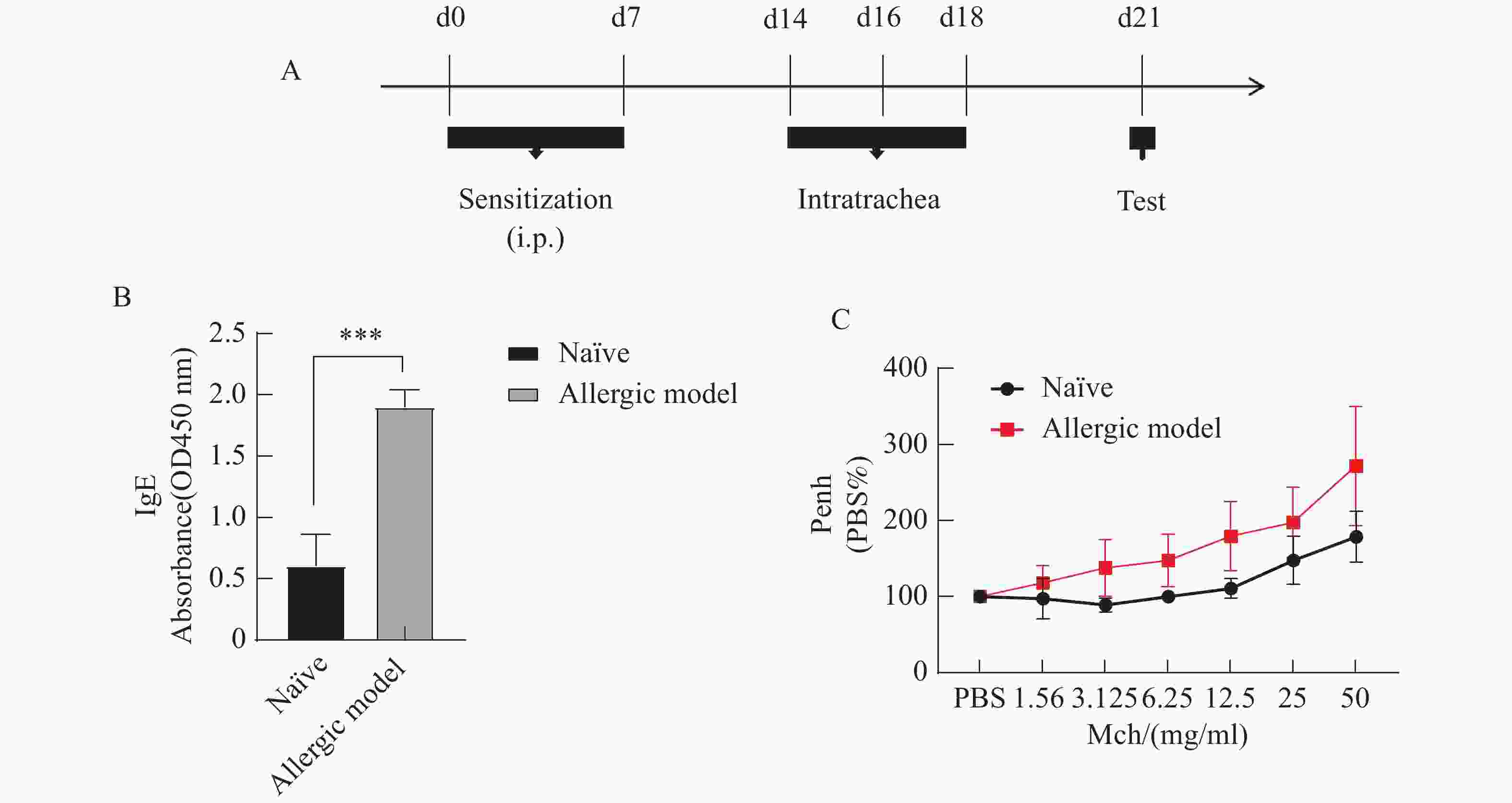
IgE升高是过敏症的一大重要特征,对小鼠最后一次灌肺3 d后采眼眶血,检测小鼠血清总IgE水平,以评估小鼠过敏症状。实验结果(图5-B)显示,与Naïve组相比,过敏模型组血清IgE的水平极显著上升。说明猫犬融合变应原诱导后的小鼠可能是发生了过敏反应。
-
用浓度倍增梯度的Mch激发小鼠测定其气道反应程度。结果显示,过敏模型组小鼠呼吸阻力显著上升,且随着Mch浓度增高,呼吸受阻越明显(图5-C)。
-
为了评估LDH纳米融合蛋白疫苗对猫犬过敏原致敏小鼠的治疗效果,先用猫犬融合过敏原致敏小鼠后,再对小鼠颈部皮下和腿部肌肉多点注射LDH纳米融合蛋白疫苗进行治疗,流程图如图6A所示。
-
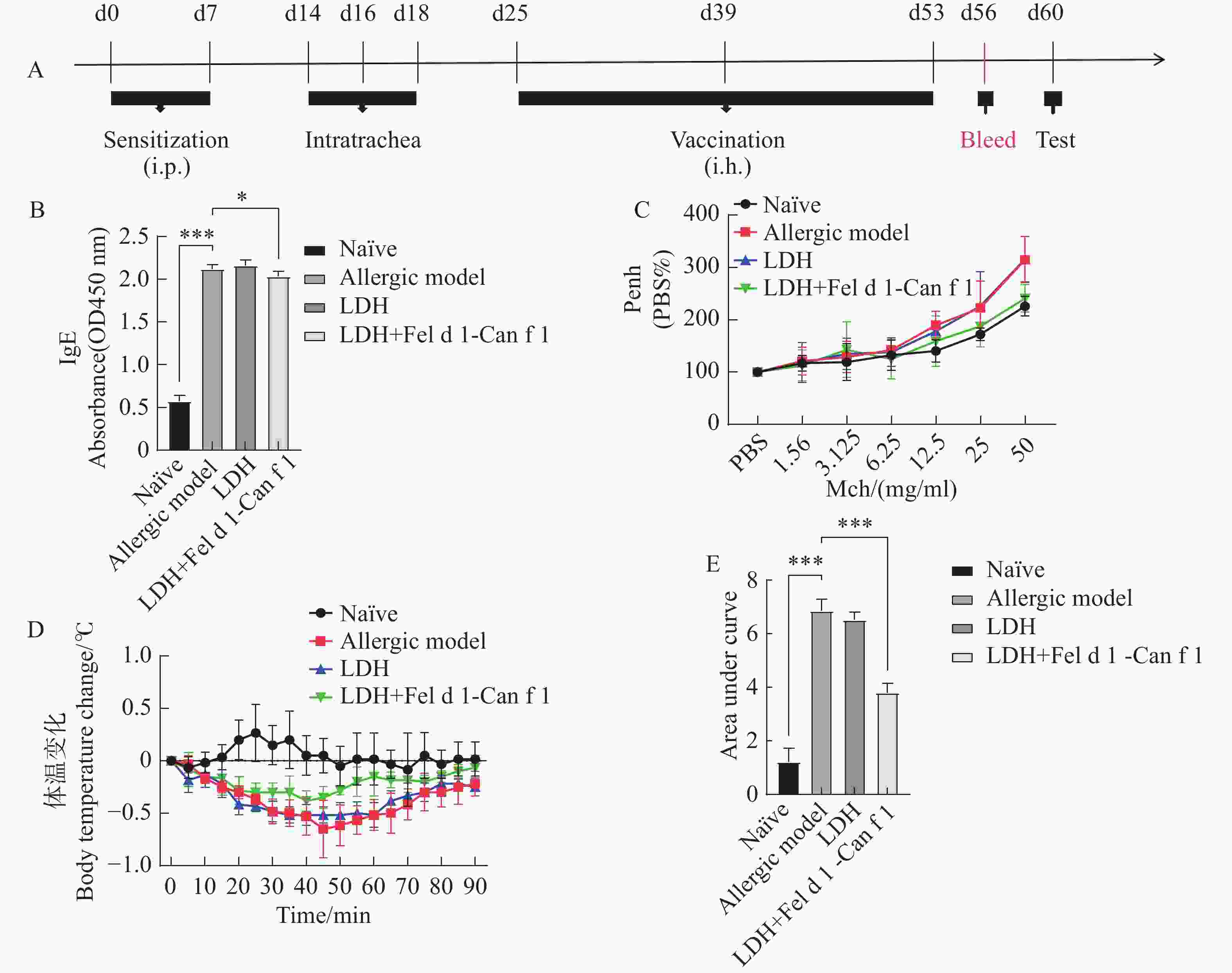
经纳米融合蛋白疫苗治疗后采眼眶血进行血清中特异性IgE检测,结果(图6-B)显示,1) 与Naïve相比,过敏模型组的血清特异性IgE极显著增高;2) 与过敏模型组相比,疫苗组血清中特异性IgE显著降低,LDH组没有显著性差异。
-
纳米蛋白疫苗治疗小鼠模型后气道反应性结果(图6-C)显示:1) 与Naïve组相比,过敏模型组的气道高反应性随Mch浓度的增加而增加,明显高于Naïve组;2) 与过敏模型组相比,小鼠经LDH纳米融合蛋白疫苗治疗后,气道高反应性降低。这说明LDH组与过敏模型组趋势基本一致,过敏反应没有得到缓解。
-
Anaphyxis应激过敏试验结果(图6-D)所示:1)正常组小鼠体温一直保持平稳轻微变化,无明显的体温变化趋势;2)过敏模型组在注射变应原后,小鼠体温在45 min时下降0.65 ℃,计时结束时仍较正常温度降低约0.2 ℃,未恢复至正常温度;3)LDH组小鼠在40~60 min体温没有变化,下降温度达0.5 ℃,最后体温仍低于正常温度约0.25 ℃;4)疫苗组小鼠最低下降温度为0.38 ℃,计时结束时接近恢复正常体温。对小鼠体温变化曲线与Y轴0刻度水平线围成的面积进行统计,结果(图6-E)所示,LDH组与过敏模型组无显著性差异,疫苗组的应激性过敏反应严重程度较过敏模型组极显著减轻。
-
对小鼠进行耳朵点刺实验,通过耳朵点刺的染料渗漏面积评估LDH纳米融合蛋白疫苗对猫犬融合变应原诱发的小鼠过敏反应的治疗效果。结果(图7)表明,过敏模型组和LDH组仍然发生强烈的过敏反应,耳朵点刺染料渗漏面积实验中疫苗组比过敏模型组极显著降低,说明经疫苗治疗后小鼠体内过敏反应有所缓解。
-
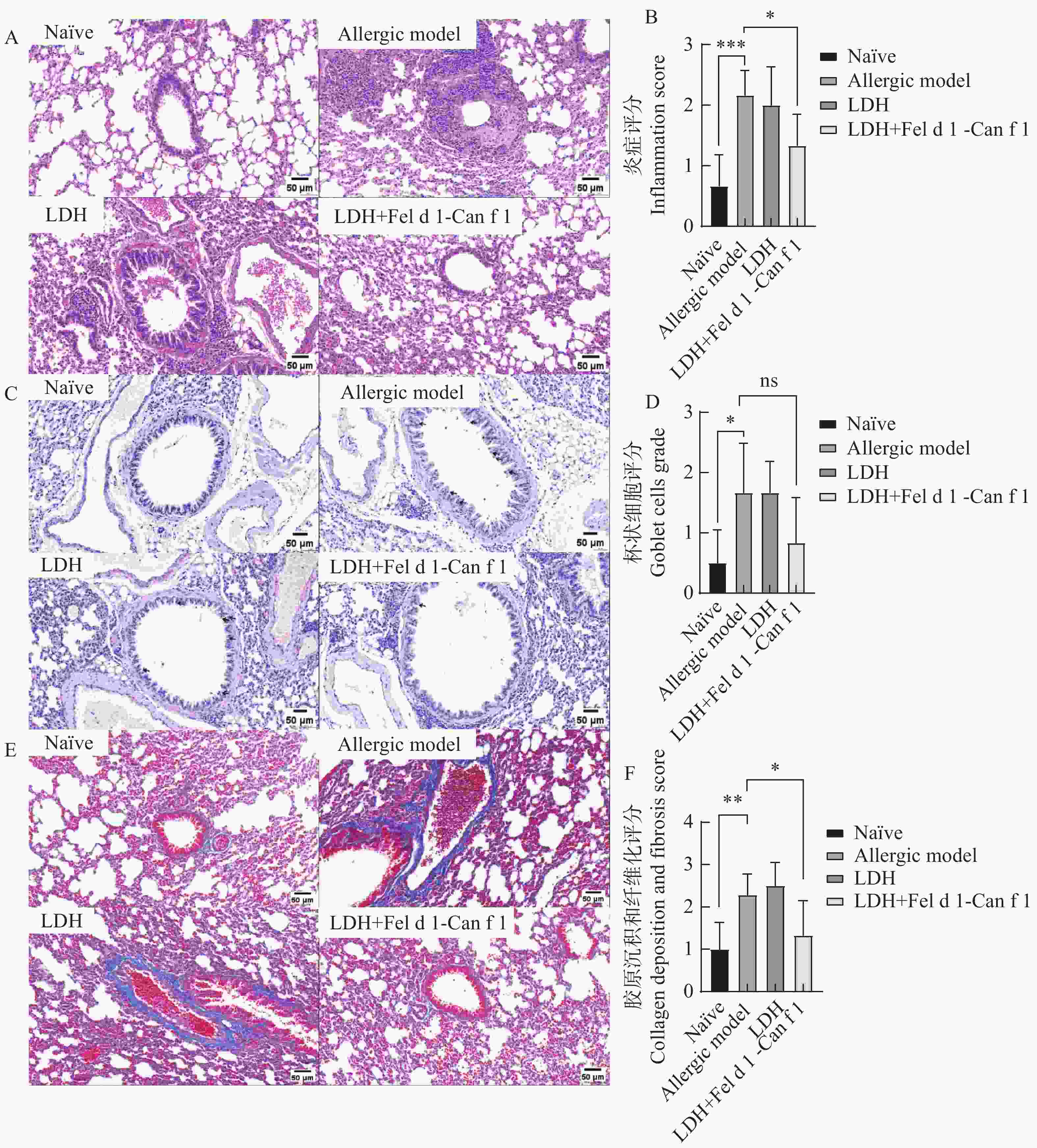
H&E染色结果(图8-A、B)表明,过敏模型组较Naïve组出现较为严重的炎症反应,LDH组与过敏模型组相比无显著差异。经LDH纳米融合蛋白疫苗治疗后,小鼠肺部组织的炎性细胞浸润情况相较于过敏模型组极显著减轻,这说明该疫苗对猫犬融合变应原诱发的过敏症有较好的治疗效果。PAS染色的结果(图8-C、D)表明,与过敏模型组相比,经LDH纳米融合蛋白疫苗治疗后小鼠肺部支气管上皮的杯状细胞数量有所减少,但没有显著性差异。马松染色结果(图8-E、F)表明,与过敏模型组相比,经LDH纳米融合蛋白疫苗治疗后小鼠肺部组织的胶原沉积和纤维化显著减轻,与H&E结果一致。
-
猫犬过敏主要会引起一系列的呼吸道问题。比如过敏性鼻炎,患者会出现鼻痒、打喷嚏、流鼻涕等症状;还有过敏性哮喘,会导致喘息、咳嗽、呼吸困难等[23],严重的哮喘发作可能会危及生命。段雪课题组将手性氨基酸插入LDH片层中,使LDH成为一种储存、转运不稳定手性生物分子,其课题组成功完成了虫草素/LDH纳米药物载体的制备[24 − 25]。因其独特的层状结构、良好的生物相容性以及高效的药物负载与控释性能,在生物医药领域展现出巨大的应用潜力。其能够有效地负载和保护生物活性物质,实现靶向递送与可控释放[26],从而提高药物的稳定性和生物利用度,为新型疫苗的研发提供了一种极具前景的载体平台。LDH与Toll样受体9(Toll-like receptor 9,TLR9)配体含胞嘧啶-鸟嘌呤二核苷酸的寡脱氧核苷酸(CpG oligonucleotide,CpG ODN)联合还能促进免疫反应从Th2向Th1极化[27]。且LDH诱导的强效佐剂效应能在小鼠模型中持续数月,显著抑制肿瘤细胞生长[28],还不会引起动物器官的组织学病变。变应原特异性免疫治疗(Allergen Specific Immunotherapy,AIT)被认为是一种治疗及预防性疫苗,可建立机体对特定变应原的耐受性,诱导调节性T细胞(regulatory T cells,Treg)的产生以及诱导Th2细胞向Th1细胞转变。AIT还会通过诱导IgG的产生,通过直接中和变应原、抑制性IgG受体(inhibitory Fcgamma receptor,FcγRIIb)参与、肥大细胞对IgE的内化等途径阻断肥大细胞和嗜碱性粒细胞的激活[29],从而达到治疗过敏的作用。因此,本研究将猫的主要变应原和犬的主要变应原融合,利用LDH作为蛋白疫苗的佐剂和递送系统,制备抑制猫犬过敏的治疗性疫苗,并对疫苗的治疗效果进行评估。
IgE在过敏性疾病的发展中发挥了重要作用,尤其是在过敏性哮喘、过敏性皮炎和系统性过敏反应等病症中。本研究中猫狗融合变应原诱发的过敏模型组,与Naïve组比,IgE极显著升高,肺呼吸阻力增大;LDH组作为对照,并未表现出缓解过敏反应的作用;疫苗组血清特异性IgE水平较过敏模型组显著下降,肺呼吸阻力在治疗后也得到了明显的缓解,表明LDH纳米融合蛋白疫苗在抑制特异性IgE产生方面有较好的效果,同时对呼吸系统的功能有一定的改善作用。小鼠的应激性过敏反应表现往往为体温下降[30],过敏模型组与Naïve组比,体温变化曲线面积极显著增加,即体温严重下降,LDH组的体温变化趋势一致;我们观察到疫苗治疗后蛋白诱发的体温降低幅度与过敏模型组相比有所减缓。猫犬融合蛋白诱发小鼠过敏后分泌大量IgE,IgE通过与效应细胞表面的特异性受体结合激活效应细胞。当处于致敏状态的小鼠再次受到过敏原激发时,激活状态的肥大细胞会释放过敏介质,导致血管通透性增加[31]。R Bhowmik[32]模拟急性过敏反应和肥大细胞脱颗粒发现HK和MMK显著减少了组胺和化合物48/80诱导的EB染料渗漏,表明它们能够降低血管通透性。本实验中,过敏模型组较Naïve组小鼠染料渗漏面积增加,经疫苗治疗后耳朵染料渗漏面积显著减小,凸显了LDH纳米融合蛋白对局部过敏炎症反应的有效抑制。本研究还表明,过敏模型组较Naïve组比,肺部炎症浸润细胞数量、胶原沉积、纤维化及杯状细胞显著增加,LDH组也呈现相同的趋势,而疫苗治疗后肺部炎症浸润细胞数量、胶原沉积、纤维化显著缓解,杯状细胞减少但与过敏模型组无显著差异。
综上,本研究构建LDH纳米融合蛋白疫苗,研究表明其可以有效缓解猫犬诱发的过敏反应,但依旧存在过敏反应。LDH具有较大的比表面积和阳离子交换特性,能够高效地负载融合蛋白抗原。融合蛋白可以被很好地保护在LDH的层状结构内,避免被体内的酶快速降解[33],确保抗原能够完整地到达免疫细胞,抑制了过敏症状。纳米融合蛋白可针对多种过敏原或过敏原的多个表位进行设计,对于多种过敏原诱发的复杂过敏情况,纳米融合蛋白可能更具应用前景。尽管纳米融合蛋白疫苗有一定优势,但融合蛋白本身免疫原性不足,需要进一步优化,如设计多表位等方式来增强免疫反应。
Therapeutic effect of nanofusion protein vaccine on a mouse model of sensitization to fusion of cat and dog allergens
-
摘要: 探讨层状双氢氧化物(Layered double hydroxides,LDH)纳米融合蛋白疫苗对猫犬融合变应原诱导小鼠模型的治疗效果,为猫犬过敏疾病的治疗提供了一种潜在的新型疫苗策略。实验步骤:1)制备猫犬融合变应原,并将其加载于层状双氢氧化物纳米材料上构建疫苗。2)选取BALB/c小鼠,通过腹腔注射和气管注入等方式进行猫犬融合变应原致敏,建立小鼠过敏模型。3)随后将过敏模型小鼠随机分为过敏模型组(Allergic model)、LDH组和疫苗组,每组6只。过敏模型组、LDH疫苗组小鼠分别给予磷酸盐缓冲液(Phosphate Buffered Saline,PBS)、LDH悬液、LDH纳米融合蛋白疫苗注射,正常组(Naïve)作为对照组不做任何处理。4)检测血清中IgE、肺呼吸阻力、体温变化、耳朵点刺以及病理切片等结果综合评价疫苗治疗效果。实验结果表明,与过敏模型组相比,经LDH纳米融合蛋白疫苗治疗后的疫苗组小鼠的反应:1)血清特异性IgE水平显著下降;2)肺呼吸阻力有所缓解;3)变应原诱发的体温极显著降低;4)耳朵染料渗漏面积极显著减小;5)肺部炎症浸润显著降低,杯状细胞数量减少但没有显著性差异,胶原沉积和纤维化程度减轻。综合上述结果,LDH纳米猫犬融合蛋白疫苗对猫犬融合变应原诱导的小鼠过敏模型具有较好的治疗效果,能够有效改善小鼠过敏症状,减轻过敏相关组织炎症反应。Abstract: An attempt was made to investigate the therapeutic efficacy of layered double hydroxides (LDH) nanofusion protein vaccines in cat and dog fusion allergens-induced mouse model, which provides a potential novel vaccine strategy for the treatment of canine and feline allergic diseases. A cat and dog fusion allergen was prepared and loaded onto layered double hydroxide nanomate vials to construct a vaccine. BALB/c mice were selected and sensitized to the cat and dog fusion allergen by intraperitoneal injection and lung perfusion to establish a mouse allergy model. Subsequently, the allergy model mice were randomly divided into four groups: normal (naïve) group, allergy model group (allergic model), LDH group and vaccine group, with six mice in each group. Among them, the normal group was not treated, and the mice in the allergic model group, LDH group and vaccine group were given phosphate buffered saline (PBS), LDH nanosuspension, and LDH nanofusion protein vaccine injections, respectively, and the results of serum IgE, pulmonary respiratory resistance, temperature change, ear prick, and pathological section were detected to comprehensively evaluate the vaccine treatment effect. The results showed that compared with the Allergic model group, the vaccine group treated with LDH nanofusion protein vaccine significantly decreased the serum-specific IgE levels of mice, alleviated lung respiratory resistance, highly significantly reduced allergen-induced body temperature and the area of ear dye leakage, significantly reduced inflammatory infiltration in the lungs, reduced the number of cuprocytes although not significantly, and reduced the degree of collagen deposition and fibrosis. Taken together, these results indicate that the laminar double hydroxide nanocat-dog fusion protein vaccine has a good therapeutic effect on the cat-dog fusion allergen-induced mouse allergy model, and is able to effectively improve the allergy symptoms and reduce the inflammatory reaction of allergy-associated tissues in mice.
-
Key words:
- pet /
- allergy /
- layered double hydroxides /
- vaccine /
- therapy
-
图 2 融合蛋白Fel d 1-Can f 1的表达纯化
M:三色预染蛋白质分子质量标准;IPTG-:未加IPTG的全菌;IPTG+:加入终浓度为1 mmol·L−1 IPTG诱导6 h后的全菌;S:诱导表达的菌体破碎离心后上清;1~6:依次收集镍柱纯化后的目的蛋白。
Fig. 2 Expression and purification of fusion protein Fel d 1-Can f 1
M: Three-color prestained protein molecular quality standard; IPTG-: Whole bacteria without IPTG; IPTG+: The whole bacteria were induced by adding a final concentration of 1 mmol/L IPTG for 6 h; S: Induced expression of the cell after centrifugation and supernatant; 1~6: Collect the target protein after nickel column purification in turn.
图 3 LDH的表征
A. 激光粒度分析仪检测LDH的粒子流体动力学直径和分散情况;B. 激光粒度分析仪检测LDH的粒子表面电荷;C. X射线衍射技术探究LDH的微观结构、层间距等;D. 傅里叶红外光谱仪来测定LDH的红外特征吸收峰;E. 扫描电镜观察LDH整体形貌、尺寸等。
Fig. 3 Characterization of LDH
A: Laser particle size analyzer used to detect the hydrodynamic diameter and dispersion of LDH particles; B: Laser particle size analyzer used to detect the surface charge of LDH particles; C: X-ray diffraction technology used to explore the microstructure and layer spacing of LDH; D: Fourier transform infrared spectroscopy used to determine the infrared characteristic absorption peak of LDH; E: Scanning electron microscope used to observe the overall morphology and size of LDH.
图 4 LDH与融合蛋白的吸附实验
M:三色预染蛋白质分子质量标准;LDH:层状双氢氧化物;P:Fel d 1-Can f 1蛋白;1~5:LDH与Fel d 1-Can f 1质量加载比例5:1、6:1、7:1、8:1、9:1。
Fig. 4 Adsorption experiments of LDH with the fusion protein
M: Three-color prestained protein molecular mass standard; LDH: Layered double hydroxides; P: Fel d 1-Can f 1 protein; 1~5: Mass loading ratios of LDH to Fel d 1-Can f1:5:1, 6:1, 7:1, 8:1, 9:1.
图 5 小鼠过敏模型的建立
A. 猫犬融合变应原Fel d 1-Can f 1诱导小鼠过敏模型的流程图;B. 过敏模型小鼠血清中特异性IgE( ***:P<0.001);C. 过敏模型小鼠气道反应性变化曲线图。
Fig. 5 Establishment of a mouse allergy model
A: Flow chart of allergy model in mice induced with a cat and dog fusion allergen Fel d 1-Can f 1; B: Specific IgE in serum of allergy model mice( ***: P<0.001); C: Change curve of airway reactivity in allergy model mice.
图 6 LDH纳米蛋白疫苗的治疗效果
A. LDH纳米融合蛋白疫苗治疗猫犬融合变应原Fel d 1-Can f 1小鼠过敏模型的流程图;B. 治疗小鼠模型后血清特异性IgE(*:P<0.05;**:P<0.01;***:P<0.001);C. 治疗小鼠模型后气道反应性;D. 变应原激发小鼠体温变化曲线;E. 体温变化面积统计。体温变化曲线所围成面积统计采用one-way ANOVA,Bonferroni’s multiple comparison post test(*:P<0.05;**:P<0.01;***:P<0.001)。
Fig. 6 Therapeutic effect of LDH nanoprotein vaccine
A: Flow chart of LDH nanofusion protein vaccine for the treatment of a cat and dog fusion allergen Fel d 1-Can f 1-induced mouse allergy model; B: Serum-specific IgE after treatment of mouse model(*:P<0.05; **:P<0.01; ***:P<0.001); C: Airway responsiveness after treatment of mouse models; D: Body temperature curve of allergen-excited mice; E: Area statistics of body temperature change. The area formed from the body temperature curve was computed by using One-way ANOVA and Bonferroni's multiple comparison post test(*:P<0.05;**:P<0.01;***:P<0.001).
图 8 组织切片分析
A. 经治疗后各组肺部组织切片H&E染色;B. 对H&E染色结果进行肺部炎症评分(ns:P>0.05;*:P<0.05;**:P<0.01;***:P<0.001);C. 经治疗后各组肺部组织切片PAS染色;D. 对PAS染色结果对杯状细胞数量进行评分(ns:P>0.05;*:P<0.05;**:P<0.01;***:P<0.001);E. 经治疗后各组肺部组织切片Masson染色;F. 对Masson 染色结果进行胶原沉积和纤维化评分(ns:P>0.05;*:P<0.05;**:P<0.01;***:P<0.001)。
Fig. 8 Tissue section analysis
A: H&E staining of lung tissue sections in each group after treatment; B: The lung inflammation score was performed on the H&E staining results(ns: P>0.05; *: P<0.05; **: P<0.01; ***: P<0.001); C: The PAS staining of lung tissue sections in each group after treatment; D: The number of goblet cells was scored on the PAS staining results(ns: P>0.05; *: P<0.05; **: P<0.01; ***: P<0.001); E: The Masson staining of lung tissue sections in each group was carried out after treatment; F: Collagen deposition and fibrosis scores were performed on the Masson staining results(ns: P>0.05; *: P<0.05; **: P<0.01; ***: P<0.001).
表 1 肺部组织切片评分标准
Table 1 Scoring criteria for lung tissue sections
评分项
Scoring item各分值标准(Criteria for each score) 0分 1分 2分 3分 H&E染色的炎症打分标准
Inflammation scoring criteria for H&E staining没有炎症细胞的浸润
No infiltration of inflammatory cells支气管周围偶尔出现炎症细胞
Occasional inflammatory cells around the bronchi大多数支气管周围环绕着1~5层炎症细胞薄层
Most bronchi are surrounded by a thin layer of 1 ~ 5 inflammatory cells大多数支气管周围环绕超过5层的
炎症细胞
Most bronchi are surrounded by more
than 5 layers of inflammatory cellsPAS染色杯状细胞数量的评分标准
Scoring criteria for the number of PAS stained cup cells没有杯状细胞
No goblet cell1~5个杯状细胞
1~5 goblet cells6~20个杯状细胞
6~20 goblet cells超过20个杯状细胞
More than goblet cellsMassion染色胶原沉积和纤维化评分标准
Massion Staining Collagen Deposition and Fibrosis Scoring Criteria肺泡间隔和薄壁肺泡胶原含量正常
Normal alveolar septal and thin-walled alveolar collagen content肺泡间隔轻度胶原沉积和厚纤维化
Mild collagen deposition and thick fibrosis of alveolar septa中度胶原沉积、肺泡间隔持续纤维化
Moderate collagen deposition, persistent
fibrosis of alveolar septa过度胶原沉积导致肺泡间隔增厚、肺泡压缩、融合性纤维团块和纤维增生Excessive collagen deposition leads to
alveolar septal thickening, alveolar
compression, fused fibrous masses and
fibrous hyperplasia注:H&E染色的炎症打分标准:以0~3分标准来评价支气管周围炎症的程度。PAS染色杯状细胞数量的评分标准:以0~3分标准来评价杯状细胞数目。Massion染色胶原沉积和纤维化的评分标准:以0~3分标准来评价胶原沉积和纤维化程度。
Note: Inflammation scoring criteria for H&E staining: The degree of peribronchial inflammation was evaluated on a scale of 0~3. Scoring criteria for PAS staining of the number of cuprocytes: The number of cuprocytes was evaluated on a scale of 0~3. Scoring criteria for Massion staining of collagen deposition and fibrosis: The degree of collagen deposition and fibrosis was evaluated on a scale of 0~3. -
[1] KONRADSEN J R, FUJISAWA T, VAN HAGE M, et al. Allergy to furry animals: new insights, diagnostic approaches, and challenges-ScienceDirect[J]. Journal of Allergy and Clinical Immunology, 2015, 135(3): 616 − 625. doi: 10.1016/j.jaci.2014.08.026 [2] NEAL J S, ARLIAN L G, MORGAN M S. Relationship among house-dust mites, Der 1, Fel d 1, and Can f 1 on clothing and automobile seats with respect to densities in houses[J]. Annals of Allergy, Asthma & Immunology, 2002, 88(4): 410-415. doi: 10.1016/S1081-1206(10)62373-3 [3] FREIDHOFF L R, MEYERS D A, MARSH D G. A genetic-epidemiologic study of human immune responsiveness to allergens in an industrial population: III. Environmental influences on skin sensitivity and total serum IgE in a stratified random sample[J]. International Archives of Allergy and Applied Immunology, 1986, 79(2): 188 − 195. doi: 10.1159/000233969 [4] ANDERSON M C, BAER H. Allergenically active components of cat allergen extracts[J]. The Journal of Immunology, 1981, 127(3): 972 − 975. doi: 10.4049/jimmunol.127.3.972 [5] SPARKES A H. Human allergy to cats: a review for veterinarians on prevalence, causes, symptoms and control[J]. Journal of Feline Medicine and Surgery, 2022, 24(1): 31 − 42. doi: 10.1177/1098612X211036793 [6] LICCARDI G, D'AMATO G, RUSSO M, et al. Focus on cat allergen (Fel d 1): immunological and aerodynamic characteristics, modality of airway sensitization and avoidance strategies[J]. International Archives of Allergy and Immunology, 2003, 132(1): 1 − 12. doi: 10.1159/000073259 [7] OHMAN J L, JR, LOWELL F C J, BLOCH K J. Allergens of mammalian origin. III. Properties of a major feline allergen[J]. The Journal of Immunology, 1974, 113(6): 1668 − 1677. doi: 10.4049/jimmunol.113.6.1668 [8] BONNET B, MESSAOUDI K, JACOMET F, et al. An update on molecular cat allergens: Fel d 1 and what else? Chapter 1: Fel d 1, the major cat allergen[J]. Allergy, Asthma & Clinical Immunology, 2018, 14: 14. doi: 10.1186/s13223-018-0239-8 [9] VAN REE R, VAN LEEUWEN W A, BULDER I, et al. Purified natural and recombinant Fel d 1 and cat albumin in in vitro diagnostics for cat allergy[J]. Journal of Allergy and Clinical Immunology, 1999, 104(6): 1223 − 1230. doi: 10.1016/S0091-6749(99)70017-5 [10] GRÖNLUND H, ADÉDOYIN J, REININGER R, et al. Higher immunoglobulin E antibody levels to recombinant Fel d 1 in cat-allergic children with asthma compared with rhinoconjunctivitis[J]. Clinical & Experimental Allergy, 2008, 38(8): 1275 − 1281. doi: 10.1111/j.1365-2222.2008.03003.x [11] SMALLWOOD J, OWNBY D. Exposure to dog allergens and subsequent allergic sensitization: an updated review[J]. Current Allergy and Asthma Reports, 2012, 12(5): 424 − 428. doi: 10.1007/s11882-012-0277-0 [12] KONIECZNY A, MORGENSTERN J P, BIZINKAUSKAS C B, et al. The major dog allergens, Can f 1 and Can f 2, are salivary lipocalin proteins: cloning and immunological characterization of the recombinant forms[J]. Immunology, 1997, 92(4): 577 − 586. doi: 10.1046/j.1365-2567.1997.00386.x [13] BANDBON BALENGA N A, THALHAMER J, WEISS R. Bicistronic expression plasmid encoding allergen and anti-IgE single chain variable fragment antibody as a novel DNA vaccine for allergy therapy and prevention[J]. Medical Hypotheses, 2006, 67(1): 71 − 74. doi: 10.1016/j.mehy.2005.12.044 [14] 彭美琪, 魏春洁, 郑安琪, 等. 层状双氢氧化物-rFel d 1-Can f 1融合变应原对小鼠模型过敏反应的预防效果分析[J]. 畜牧兽医学报, 2024, 55(7): 3143 − 3154. doi: 10.11843/j.issn.0366-6964.2024.07.032 [15] YANG M S, LEE S P, KWON Y J K, et al. Dog and cat allergies and allergen avoidance measures in Korean adult pet owners who participated in a pet exhibition[J]. Allergy, Asthma & Immunology Research, 2018, 10(2): 155-164. doi: 10.4168/aair.2018.10.2.155 [16] ZHOU D J, LI P S, LIN X, et al. Layered double hydroxide-based electrocatalysts for the oxygen evolution reaction: identification and tailoring of active sites, and superaerophobic nanoarray electrode assembly[J]. Chemical Society Reviews, 2021, 50(15): 8790 − 8817. doi: 10.1039/D1CS00186H [17] PAN D K, ZHANG H. Synthesis and drug release behavior of magnetic nanoparicles based on layered double hydroxide for magnetic drug targeting[J]. Acta Chimica Sinica, 2011, 69(13): 1545 − 1552. [18] 彭威, 徐旸, 王文锐. 层状双氢氧化物作为基因药物递送载体的研究进展[J]. 中国医药工业杂志, 2020, 51(10): 1243 − 1253. doi: 10.16522/j.cnki.cjph.2020.10.003 [19] 魏春洁, 徐琳皓, 高江瑞, 等. 猫、犬融合变应原Fel d 1-Can f 1过敏性哮喘小鼠模型的建立[J]. 热带生物学报, 2024, 15(5): 558 − 566. doi: 10.15886/j.cnki.rdswxb.20240036 [20] CASARO M, SOUZA V R, OLIVEIRA F A, et al. OVA-induced allergic airway inflammation mouse model[M]//GUEST P C. Pre-clinical models: techniques and protocols. New York: Humana Press, 2019: 297-301. doi: 10.1007/978-1-4939-8994-2_28 [21] 肖正泮, 刘金莹, 韦双双, 等. 重组热带螨Blo t 21变应原诱导小鼠变态反应气道炎症模型的建立[J]. 热带生物学报, 2017, 8(3): 371 − 376. doi: 10.15886/j.cnki.rdswxb.2017.03.020 [22] PRANGTAWORN P, MAHASONGKRAM K, SAEUNG A, et al. A component-resolved therapeutic vaccine for cockroach allergy made of per a 9 and transforming growth factor-β homologue, an immunosuppressive protein of Brugia malayi[J]. Frontiers in Immunology, 2021, 12: 676558. doi: 10.3389/fimmu.2021.676558 [23] AN W, LI T, TIAN X Y, et al. Allergies to allergens from cats and dogs: a review and update on sources, pathogenesis, and strategies[J]. International Journal of Molecular Sciences, 2024, 25(19): 10520. doi: 10.3390/ijms251910520 [24] YANG Q Z, YANG J, ZHANG C K. Layered double hydroxide as cordycepin delivery nanocarrier[J]. Chinese Chemical Letters, 2006, 17(7): 985 − 987. [25] YANG Q Z, YANG J, ZHANG C K. Synthesis and properties of cordycepin intercalates of Mg-Al-nitrate layered double hydroxides[J]. International Journal of Pharmaceutics, 2006, 326(1/2): 148 − 152. doi: 10.1016/j.ijpharm.2006.06.037 [26] ZHANG H, ZHANG L, CAO Z B, et al. Two-dimensional ultra-thin nanosheets with extraordinarily high drug loading and long blood circulation for cancer therapy[J]. Small, 2022, 18(22): e2200299. doi: 10.1002/smll.202200299 [27] SHEN W C, HU T T, LIU X Y, et al. Defect engineering of layered double hydroxide nanosheets as inorganic photosensitizers for NIR-III photodynamic cancer therapy[J]. Nature Communications, 2022, 13(1): 3384. doi: 10.1038/s41467-022-31106-9 [28] ZHANG L X, LIU D Q, WANG S W, et al. MgAl-layered double hydroxide nanoparticles co-delivering siIDO and Trp2 peptide effectively reduce IDO expression and induce cytotoxic T-lymphocyte responses against melanoma tumor in mice[J]. Journal of Materials Chemistry B, 2017, 5(31): 6266 − 6276. doi: 10.1039/C7TB00819H [29] BACHMANN M F, MOHSEN M O, KRAMER M F, et al. Vaccination against allergy: a paradigm shift?[J]. Trends in Molecular Medicine, 2020, 26(4): 357 − 368. doi: 10.1016/j.molmed.2020.01.007 [30] PEI Y C, GENG S, LIU L, et al. Fel d 1-airway inflammation prevention and treatment by co-immunization vaccine via induction Of CD4+CD25−Foxp3+ Treg cells[J]. Human Vaccines & Immunotherapeutics, 2013, 9(5): 1019 − 1031. doi: 10.4161/hv.23518 [31] LIU Y, LIN S Y, LIU K X, et al. Insights into sensitizing and eliciting capacity of gastric and gastrointestinal digestion products of shrimp (Penaeus vannamei) proteins in BALB/c mice[J]. Food Science and Human Wellness, 2024, 13(1): 339 − 348. doi: 10.26599/FSHW.2022.9250028 [32] BHOWMIK R, SHAHARYAR A, KANAKAL M M, et al. Ayurvedic herbal formulations Haridra Khanda and Manjisthadi Kwath (brihat) in the management of allergic rhinitis: a pharmacological study[J]. Heliyon, 2024, 10(11): e31937. doi: 10.1016/j.heliyon.2024.e31937 [33] MASARUDIN M J, YUSOFF K, RAHIM R A, et al. Successful transfer of plasmid DNA into in vitro cells transfected with an inorganic plasmid-Mg/Al-LDH nanobiocomposite material as a vector for gene expression[J]. Nanotechnology, 2009, 20(4): 045602. doi: 10.1088/0957-4484/20/4/045602 -

 点击查看大图
点击查看大图
计量
- 文章访问数: 428
- HTML全文浏览量: 456
- 被引次数: 0



 下载:
下载: