-
随着社会发展,大量的含氮废水被排放在环境中,致使水体富营养化从而对生态环境造成极大的危害[1]。厌氧氨氧化是一种新型的脱氮技术,是厌氧氨氧化菌以NO
$ {}_{2}^{-} $ -N作为电子受体,在缺氧条件下氧化NH$ {}_{4}^{+} $ -N生成氮气(N2)和少量的NO$ {}_{3}^{-} $ -N[2 − 3]。与传统的硝化–反硝化工艺相比,厌氧氨氧化工艺具有降低能耗,减少污泥产生,脱氮率高等优点[4]。然而,厌氧氨氧化细菌(anaerobic ammonia oxidising bacteria,AnAOB)生长缓慢,菌体易流失[5],同时对环境条件非常敏感,如溶解氧(DO)[6]、温度[7]、底物质量浓度[8]、pH[9]、水力停留时间(hydraulic retention time ,HRT)[10]等环境因素都会直接影响厌氧氨氧化菌的活性,进而导致工艺性能下降等问题。投加载体是截留AnAOB、提高厌氧氨氧化脱氮性能的有效方法之一[11]。载体可以为微生物的生长和增殖提供良好的生存环境,降低剪切力的风险[12],为AnAOB提供厌氧环境,且有助于富集优势菌群[13 − 14]。安雪迪等[15]利用聚氨酯海绵填料富集厌氧氨氧化生物膜,经过120 d的运行后,容积氮去除负荷从0.08提升至3.39 kg·N·m−3·d−1,系统表现出良好的适应性和氮去除率。水力停留时间(HRT)是厌氧氨氧化工艺中的一个重要参数[16],会影响反应器的运行效能及微生物群落的构建。在大多数典型的厌氧氨氧化工艺系统中,HRT均为16~24 h,但是较长的HRT会阻碍进水氮负荷(Influent nitrogen loading rate,NLR)的提升[17]。同时,HRT还会直接影响微生物生存的环境和脱氮效率,Karasuta等[18]的研究表明HRT的降低使得NLR增加,从而影响脱氮效率。Li等[19]研究显示在氮负荷为3.6 kg·N·m−3·d−1、水力停留时间为2 h的条件下,膜生物反应器的脱氮效率最高,根据测序结果表明这主要得益于菌群之间的相互协作。厌氧氨氧化系统中微生物群落的相互作用也是影响代谢活性的关键问题。代谢交换和交叉喂养在微生物群落中无处不在,但是目前针对NLR提升对厌氧氨氧化工艺的运行的整体效能及微生物群落中功能微生物的生理、生态特征之间的平衡很少被报道。因此,了解厌氧氨氧化细菌与其他细菌的交叉喂养机制也很重要。笔者选取了聚氨酯海绵作为生物膜载体,旨在研究以下几个方面:(1)阐明NLR的提高在长期运行过程中对反应器运行效能的影响;(2)讨论在NLR变化下生物膜的形态变化;(3)根据微生物多样性变化分析菌群的动态演化。
-
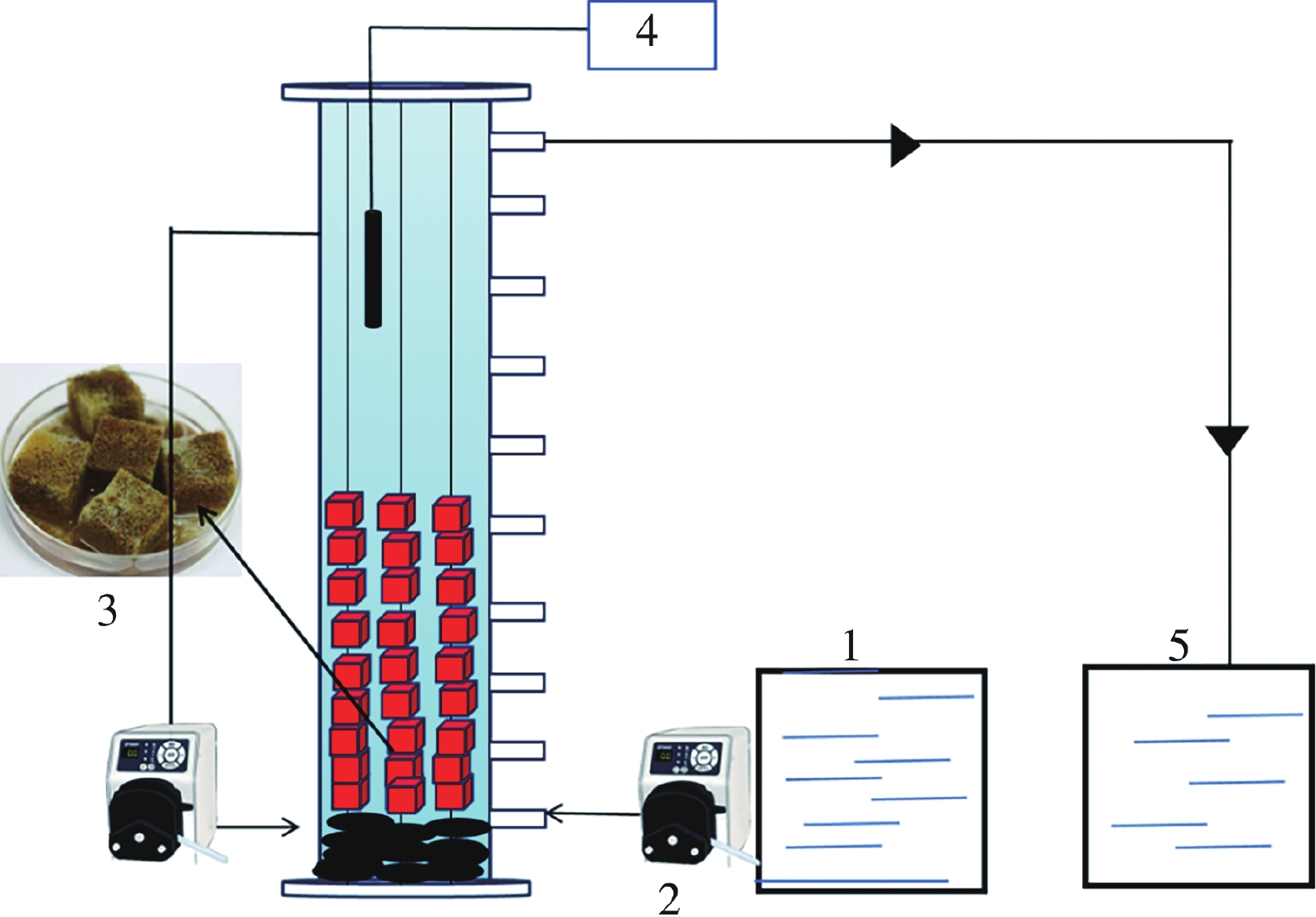
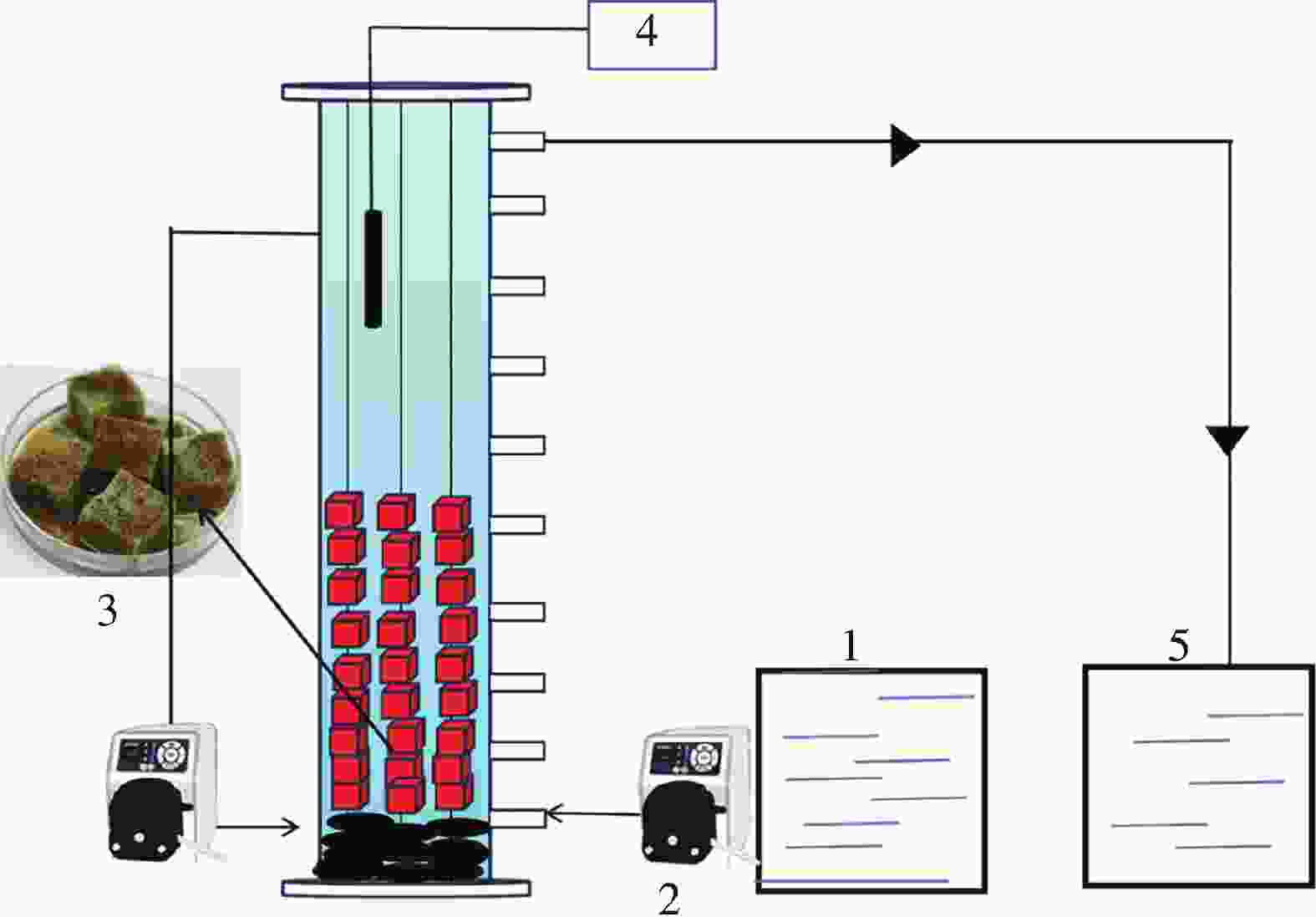
反应器结构如图1所示,反应器为改进UASB反应器,直径8.5 cm,高90 cm,有效容积5.10 L,底部用鹅卵石铺垫防止菌种掉落形成死区对厌氧氨氧化微生物群落造成影响,外接回流装置加速生物膜的形成,填料为聚氨酯海绵,由于其为轻质填料易漂浮,故使用铁丝串联后投入反应器中,填充率为30%,反应器内装有加热器控制温度为(30 ± 2)℃,反应器外壁使用锡箔纸进行包裹避免光源的干扰。
-
试验用水的合成废水分别含有NH
$ {}_{4}^{+} $ -N和NO$ {}_{2}^{-} $ -N,由NH4Cl和NaNO2提供并按1∶1.32进行配制;矿质元素为MgSO4·7H2O(1.8 mg·L−1)、KH2PO4(36 mg·L−1)、CaCl2(2.8 mg·L−1);微量元素Ⅰ:EDTA(5 000 mg·L−1)、FeSO4·7H2O(5 000 mg·L−1);微量元素Ⅱ:EDTA(15 000 mg·L−1)、MnCl2·4H2O(990 mg·L−1)、CuSO4·5H2O(250 mg·L−1)、ZnSO4·7H2O(430 mg·L−1)、NiCl2·6H2O(190 mg·L−1)、Na2MoO4·2H2O(210 mg·L−1)、H3BO4(14 mg·L−1);pH由NaHCO3调节至7.5 ± 0.4;模拟城市生活污水,进水流量为6 L·h−1。合成废水在使用前持续通入N2约30 min,以确保系统中溶解氧质量浓度低于0.2 mg·L−1。接种污泥为实验室驯化良好的厌氧氨氧化颗粒污泥,厌氧氨氧化细菌主要包含Candidatus_Kuenenia、Candidatus_Jettenia及Candidatus_Brocadia3种。 -
试验所需的填料为聚氨酯海绵,如图2所示,由于其多孔性、高比表面积和潜在的阳离子交换能力,具有高效的生物质截留能力和基质吸附能力,可以延长厌氧氨氧化菌的停留时间,使厌氧氨氧化污泥能够形成生物膜。这些生物膜具有更稳定的结构,可以进一步提高厌氧氨氧化菌在反应器中的停留时间。
-
系统总运行时间为150 d:反应器启动阶段,HRT设定为8 h,设置进水NH
$ {}_{4}^{+} $ -N和NO$ {}_{2}^{-} $ -N质量浓度为20和26 mg·L−1;第50天开始,进水NH$ {}_{4}^{+} $ -N和NO$ {}_{2}^{-} $ -N质量浓度保持不变,改变HRT。试验阶段分为启动阶段,与水力负荷增加段。保持进水NH
$ {}_{4}^{+} $ -N和NO$ {}_{2}^{-} $ -N质量浓度不变,通过调缩短HRT逐渐增加氮负荷率(NLR)。以氮负荷增加段与水利负荷增加段的氮损为分析视角,可客观反映厌氧氨氧化体系的抗负荷水平与稳定性特征,其详细的操作条件示于表1中。表 1 反应器的运行条件
Table 1. Operating conditions for the reactor
运行时间
Time/d进水NH$ {}_{4}^{+} $-N/
(mg·L−1)进水NO$ {}_{2}^{-} $-N/
(mg·L−1)HRT/h 进水NLR/
(kg·m−3·d−1)1~50 20 ± 3.21 25.98 ± 3.02 8 0.15 ± 0.01 51~100 20 ± 5.02 28.72 ± 2.76 6 0.20 ± 0.07 101~150 20 ± 3.11 28.37 ± 4.25 4 0.31 ± 0.02 -
在长期的试验运行中,每2 d采集1次水样,然后根据国家标准方法,测定水质指标。分析前,通过0.45 µm注射过滤器过滤样品。NH
$ {}_{4}^{+} $ -N采用纳氏试剂分光光度法、NO$ {}_{2}^{-} $ -N使用N-(1-萘基)-乙二胺分光光度法,NO$ {}_{3}^{-} $ -N采取苯酚二磺酸分光光度法。总氮为NH$ {}_{4}^{+} $ -N、NO$ {}_{2}^{-} $ -N和$ {{\mathrm{NO}}}_{3}^{-} $ -N之和,数据分析和绘图由Origin完成。 -
扫描电镜样品制备一般步骤如下:用磷酸盐缓冲液冲洗填料表面;加入戊二醛放入冰箱中固定;使用不同质量浓度的乙醇和乙酸异戊酯等比例混合进行脱水、置换和干燥;最后,采用离子溅射镀膜机对样品进行金属镀膜,并采用扫描电镜对不同阶段的生物膜和生物载体进行形态学表征。污泥样品通过奥特光学显微镜SZ650进行观察并进行拍照。
-
在各阶段运行稳定后的第1天(种泥当天、50 d、100 d、150 d)将载体放在烧杯中用超声波清洗机使载体上的生物膜脱落并采集,以分析微生物群落结构。使用细菌16 s rRNA V3~V4区的引物338 F(ACTCCTACGGGAGGCAG CAG)和引物806 R(GGAC ACTACHVGGGTWTCT AAT)在聚合酶链反应(PCR)中扩增DNA[20]。之后在上海美吉生物医药科技有限公司的Illumina Miseq 2000平台上进行Illumina测序。将测序获得的原始数据序列进行质控和过滤,区分样本后进行分类操作单元(OTU)聚类分析和物种分类学分析。基于分类学信息,在各个分类水平上进行群落结构的统计分析。
-
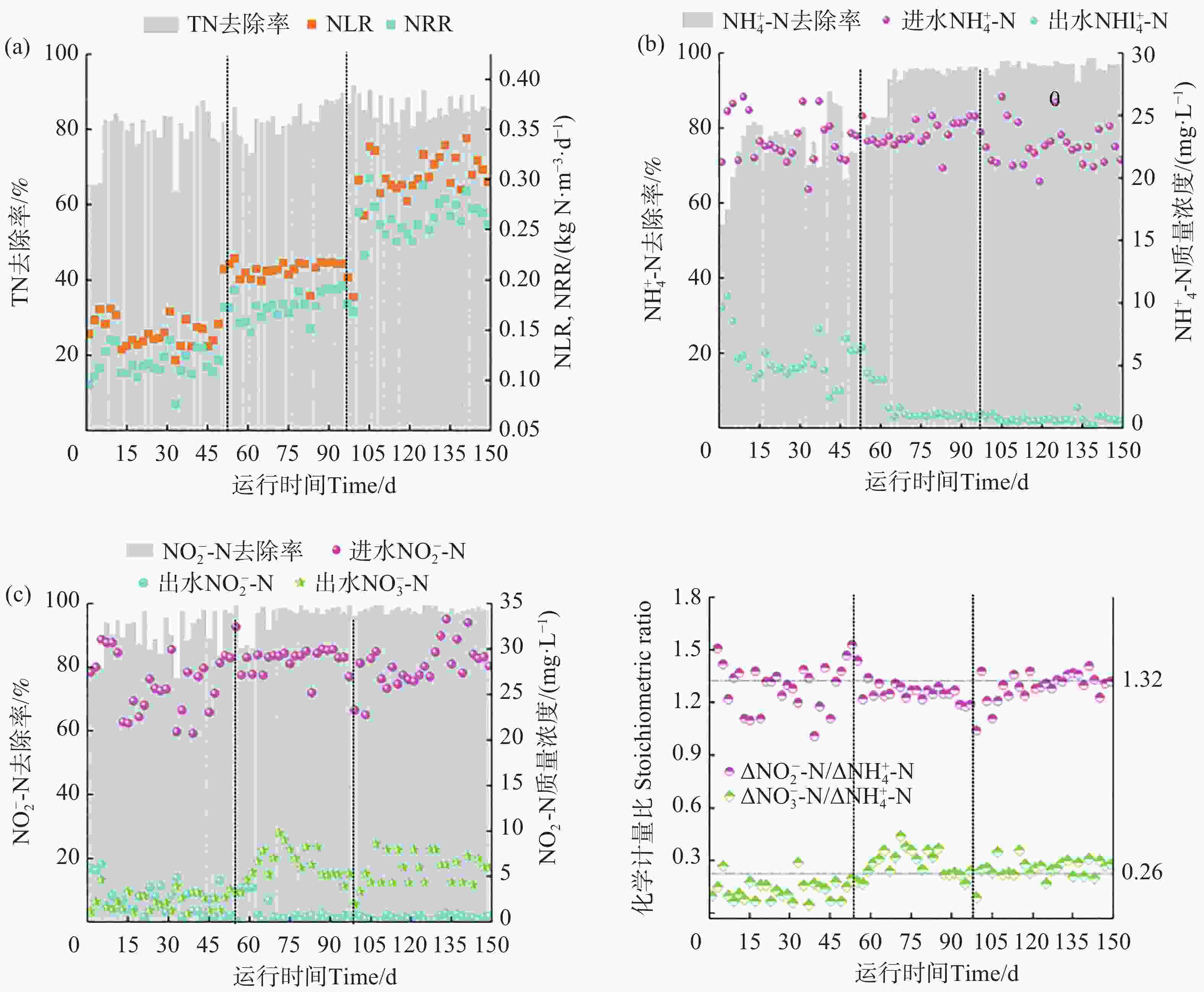
反应器运行过程中的氮质量浓度变化见图3。该试验可以分为3个不同的阶段。在初始阶段(1~50 d),平均的进水NH
$ {}_{4}^{+} $ -N和NO$ {}_{2}^{-} $ -N分别为23.10和25.98 mg·L−1。此外,HRT维持在8.00 h。第1周出水的NH$ {}_{4}^{+} $ -N和NO$ {}_{2}^{-} $ -N去除率较低。运行50 d后,出水NH$ {}_{4}^{+} $ -N和NO$ {}_{2}^{-} $ -N质量浓度平均为5.54 和2.68 mg·L−1。平均出水TN质量浓度为10.44 mg·L−1,低于GB18918 —2002中的一级标准(15.00 mg·L−1)。出水NO$ {}_{3}^{-} $ -N质量浓度呈上升趋势,最终平均值为2.22 mg·L−1,此时ΔNO$ {}_{2}^{-} $ -N/ΔNH$ {}_{4}^{+} $ -N的平均值为1.34高于理论值1.32,$ \Delta {{\mathrm{NO}}}_{3}^{-} $ -N/$ \Delta {{\mathrm{NH}}}_{4}^{+} $ -N的平均值为0.13低于理论值0.26。在第2阶段(51~100 d),将HRT调整为6.00 h。此时氮负荷率(NLR)从0.16 kg·N·m−3·d−1至0.21 kg·N·m−3·d−1,随着HRT的降低,第1周出水NH
$ {}_{4}^{+} $ -N和NO$ {}_{2}^{-} $ -N质量浓度分别为4.81和2.17 mg·L−1,TN去除率为79.29%。随着生物膜的发育,反硝化作用逐渐减弱,厌氧氨氧化作用增强[19],TN去除率在第62天提升至84.50%,随后平均出水NH$ {}_{4}^{+} $ -N和NO$ {}_{2}^{-} $ -N质量浓度分别为1.08 和0.63 mg·L−1。这一阶段平均出水TN质量浓度为8.10 mg·L−1。此阶段厌氧氨氧化菌活性上升,但是ΔNO$ {}_{2}^{-} $ -N/ΔNH$ {}_{4}^{+} $ -N的平均值为1.28,低于理论值1.32。在第3阶段(101~150 d)将HRT从6.00 h下降至4.00 h,HRT的改变使得氮负荷继续提升,这一阶段NH
$ {}_{4}^{+} $ -N和NO$ {}_{2}^{-} $ -N的去除率一直在90.00%以上,并未受到HRT的冲击,TN去除率也高达85.79%,反应器即使在较低的HRT条件下反应器依旧保持良好的脱氮效能。ΔNO$ {}_{2}^{-} $ -N/ΔNH$ {}_{4}^{+} $ -N和ΔNO$ {}_{3}^{-} $ -N/ΔNH$ {}_{4}^{+} $ -N的比值分别为1.30和0.27,均接近理论值,整体运行平稳,此时反应器厌氧氨氧化反应占主导地位[21]。 -
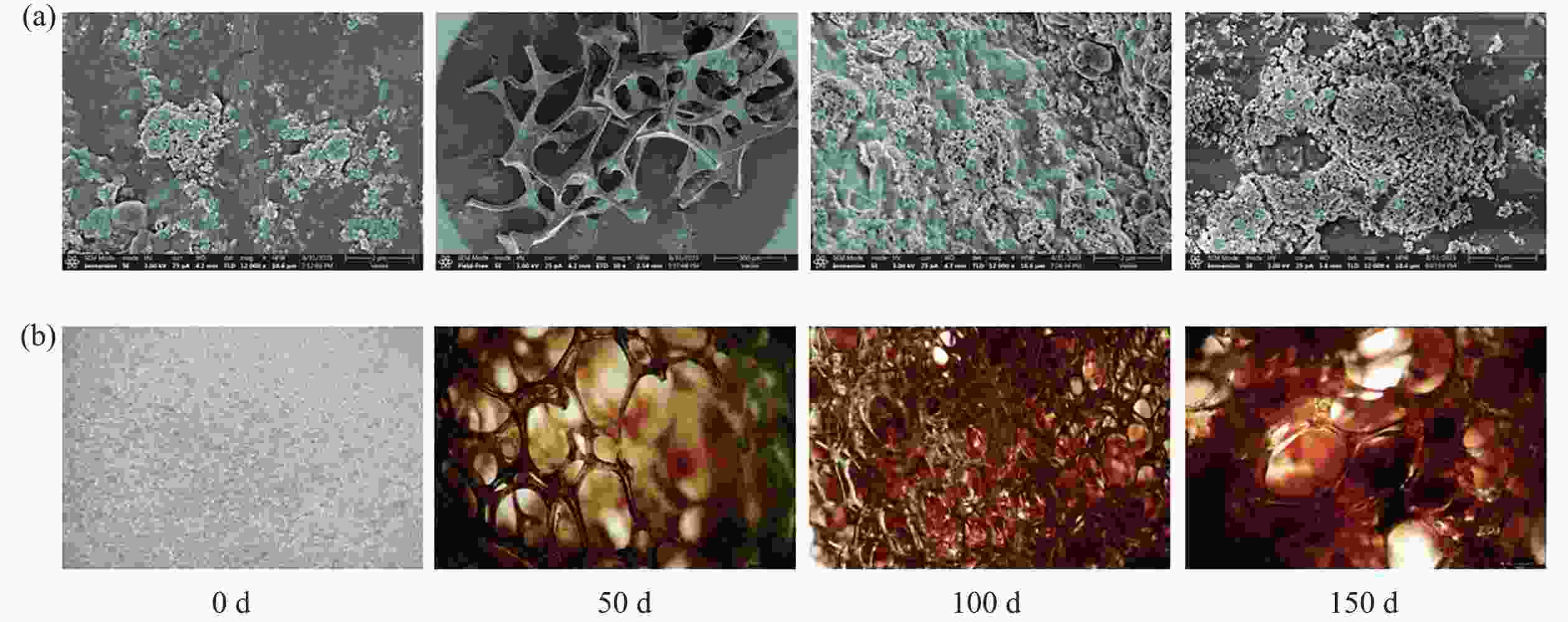
为了更深入地了解厌氧氨氧化生物膜的微观结构,采用立体显微镜和扫描电镜对各个阶段结束后采集的污泥样品进行了观察。图4表示不同阶段生物载体和生物膜的形态特征的变化。整个运行过程中,用立体显微镜观察到聚氨酯海绵载体上生物膜颜色经历了从白色(0 d)到略带红色(50 d)的逐渐变化,然后逐渐加深红色,最后变成典型的红色(150 d)(图4−b)。AnAOB的颜色通常为红色,已显示其来源于细胞色素C[22],且显色度与AnAOB的量和活性息息相关[23]。同时还观察到载体的多空结构有利于厌氧氨氧化菌体的截留,随着反应器的运行,可以观察到载体上布满了红色生物膜,在运行期间内,污泥形态逐渐从接种时的微小絮体转变为团聚的生物膜,附着在生物填料表面的污泥结构逐渐变得致密(图4−a)。
-
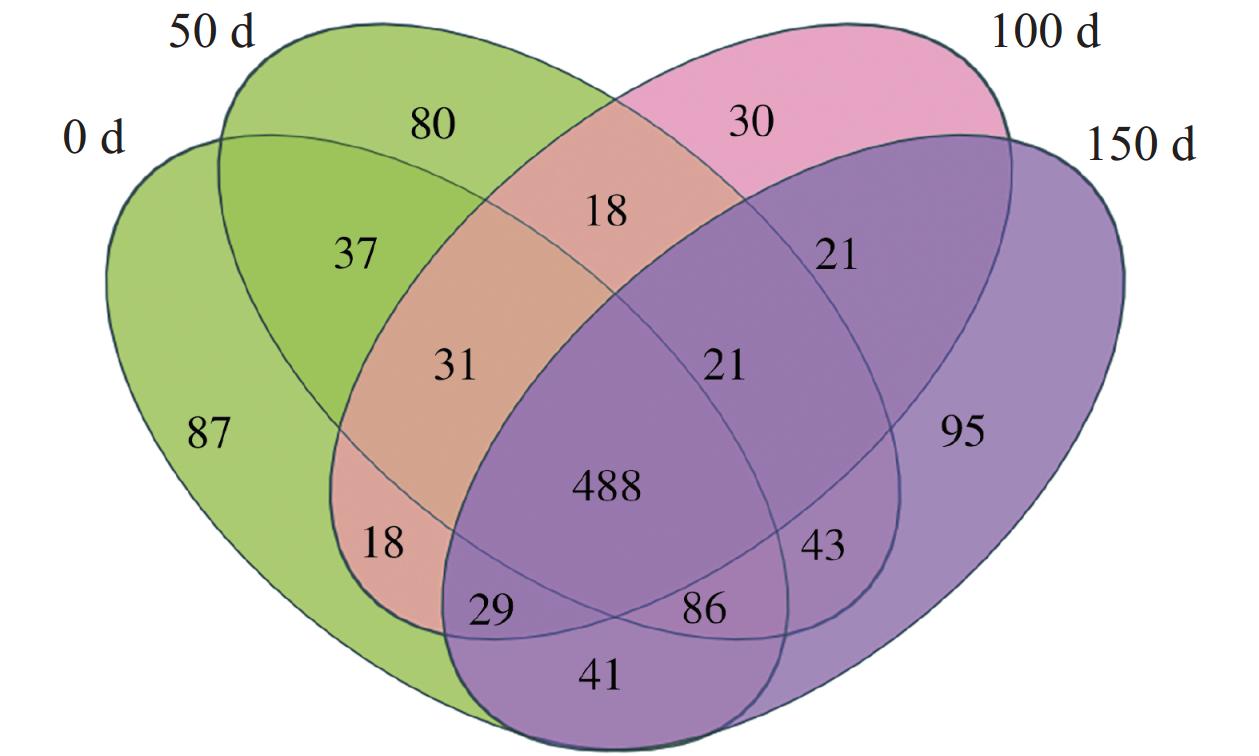
在每个阶段结束之后收集(0、50、100和150 d)生物膜样品,分别标记为种泥当天、50 d、100 d和150 d用于16 s rRNA基因测序。Alpha多样性是指一个特定区域或者生态系统内的多样性,常用的度量指标有Chao1、Shannon、Simpson等反映富集培养过程微生物群落多样性特征。4个样本的覆盖率均大于0.99,说明测序深度可以代表整个细菌群落(表2),根据Alpha多样性指数结果可知,生物膜的OTU数随着反应器的运行逐渐增加。在整个反应过程中,Shannon,Simpson用于描述微生物群落的多样性,随着NLR的变化,微生物多样性在第1和第2阶段大多逐渐上升,在第3阶段下降,ACE、Chao1指数用来表征微生物群落丰度的变化则一直下降。韦恩图进一步揭示了4个样品中共有的OTU数为488,这表明在每个样品中存在明显的差异(图5)。
表 2 反应器微生物多样性指数
Table 2. Microbial diversity index of the reactor
样本
Sampling总序列条数
Total sequences抽平序列数
RarefactionOTUs 多样性指数 Diversity index Shannon Simpson ACE Chao1 coverage 0 d 70 736 50 922 782 3.761 0.106 827.419 808.235 0.998 50 d 51 705 762 4.245 0.048 824.841 802.552 0.998 100 d 53 649 620 4.166 0.049 804.580 787.116 0.998 150 d 50 922 774 3.906 0.062 699.762 680.921 0.998 -
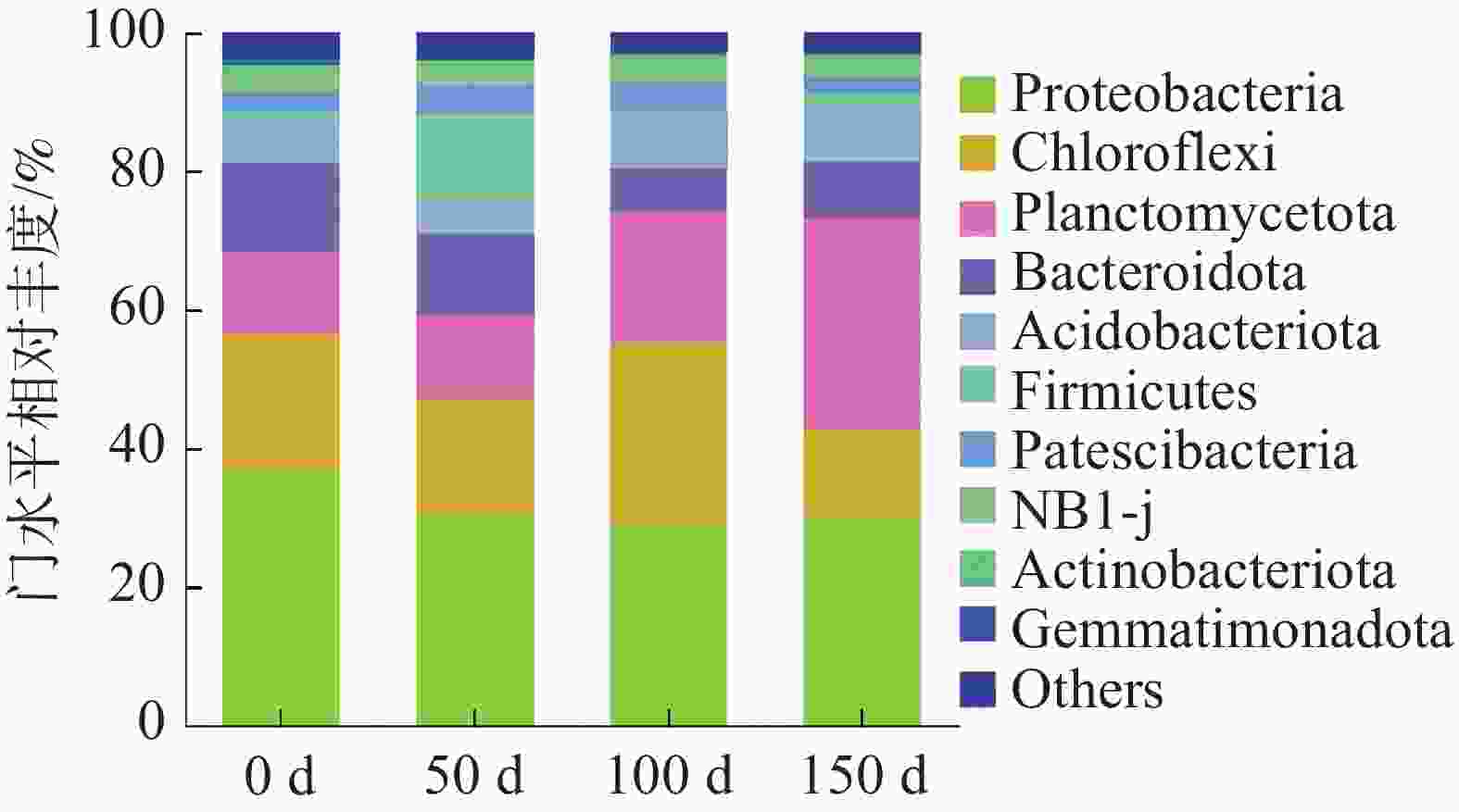
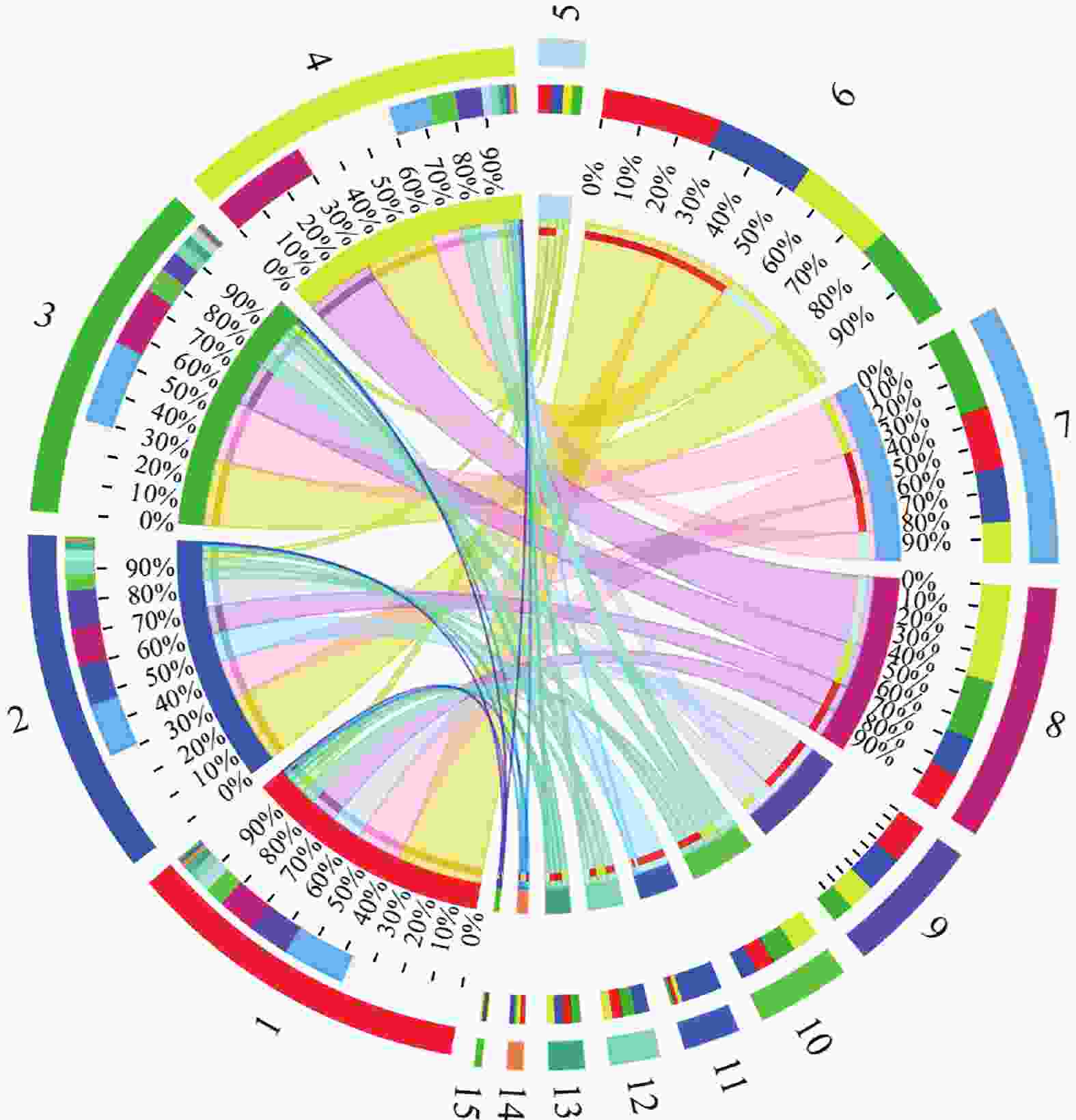
细菌群落在门水平上的相对丰度如图6所示。反应器中的微生物可分为10类,其他未分类细菌归为“other”。结果显示,各个样品的主要们包括变形菌门(Proteobacteria 29.35%~36.97%),绿弯菌门(Chloroflexi 12.53%~25.92%)、浮霉菌门(Planctomycetota 11.81%~30.37%)、拟杆菌门(Bacteroidota 6.26%~12.90%)、酸杆菌门(Acidobacteriota 4.65%~8.22%)和厚壁菌门(Firmicutes 0.81%~12.61%)。Proteobacteria中含有许多异养反硝化菌和硝化菌,这些硝化菌和反硝化菌经常出现在厌氧氨氧化系统中,通过消耗溶解氧为AnAOB提供严格的厌氧环境[24],如图7所示,在不同的氮负荷条件下Proteobacteria一直处于下降趋势,最终下降至30.23%,在最后一个阶段达到最高值30.37%。
-
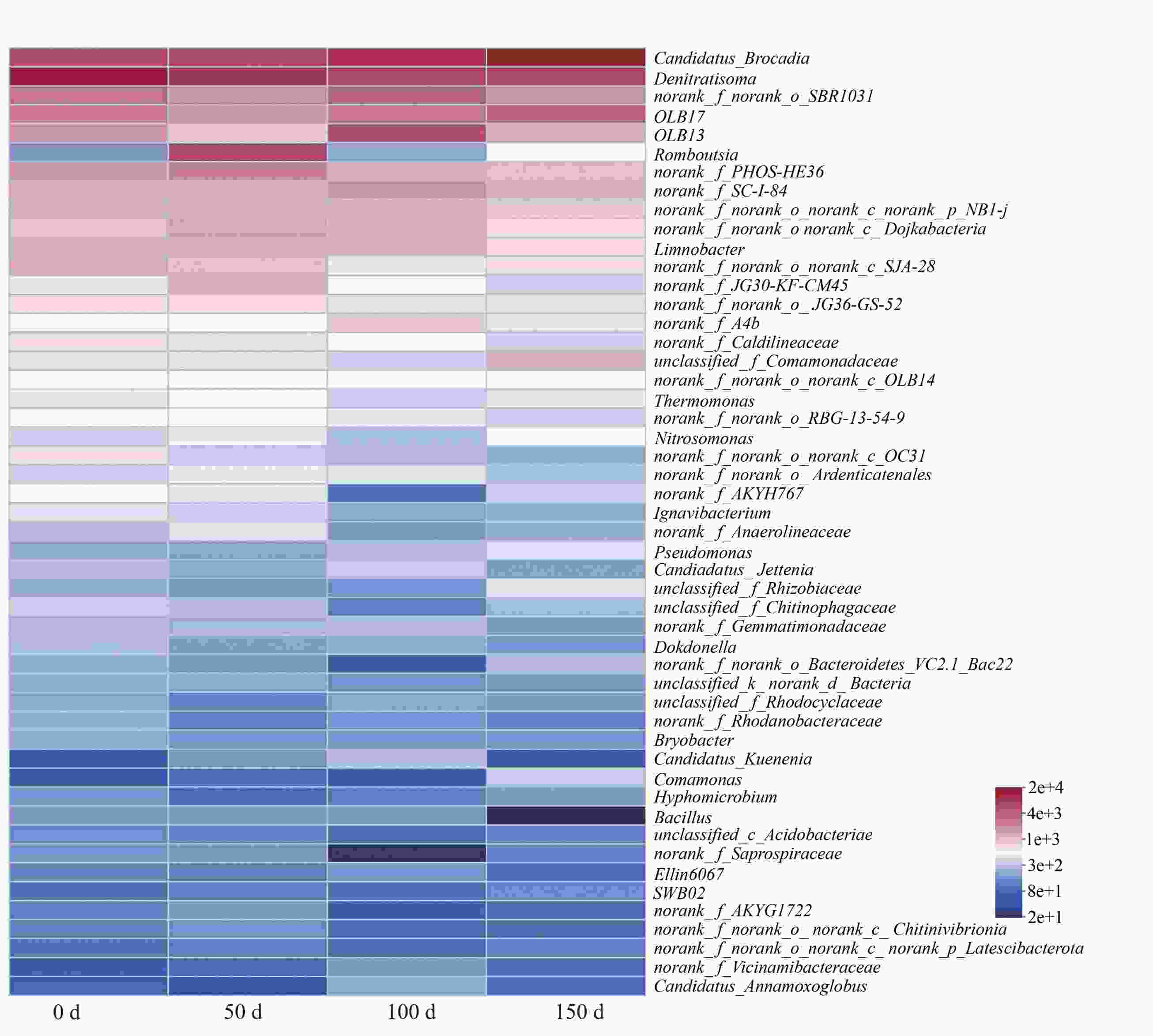
在属的水平上(图8),根据其生态功能分为厌氧氨氧化菌、反硝化菌和硝化菌3大类。厌氧氨氧化菌主要包括4类Candiadatus_Brocadia、Candidatus_Annamoxoglobus、Candiadatus_Jettenia和Candidatus_Kuenenia。随着NLR上升,Candiadatus_Brocadia含量一直占据主导地位,在稳定期(100~150 d)达到29.80%。
反硝化菌如Denitratisoma和Dokdonella可以利用细胞代谢或微生物死亡的有机质进行硝酸盐和亚硝酸的还原[25],随着HRT的下降丰度降为12.28%和0.37%。SBR1031一直处于上升趋势,稳定期占14.05%,并且先前的研究表明SBR1031的代谢功能与氨氮有关[26]。SBR1031在不含有机碳化合物的AnAOB反应器中被广泛检测到,并且可以使用胞外聚合物(Extracellular polymers,EPS)作为碳源,与细胞聚集密切相关,随着HRT的上升,AnAOB分泌EPS供SBR1031使用,同时产生的NO
$ {}_{3}^{-} $ -N被反硝化菌利用发生部分反硝化作用生成NO$ {}_{2}^{-} $ -N被AnAOB利用,菌群之间发生底物的交换进行交叉喂养达到协同脱氮的效果;除此之外系统中的反硝化菌,如OLB13、A4b、SJA-15,在微生物群落中表现出明显的优势。OLB13、和A4b属于Chloroflexi,可以清除细胞碎片和细胞外蛋白,从而促进细菌聚集[27]。值得注意的是,在4个样品中也检测到了少量的Nitrosomonas在种泥中的丰度为0.07%,在稳定期为0.05%。 -
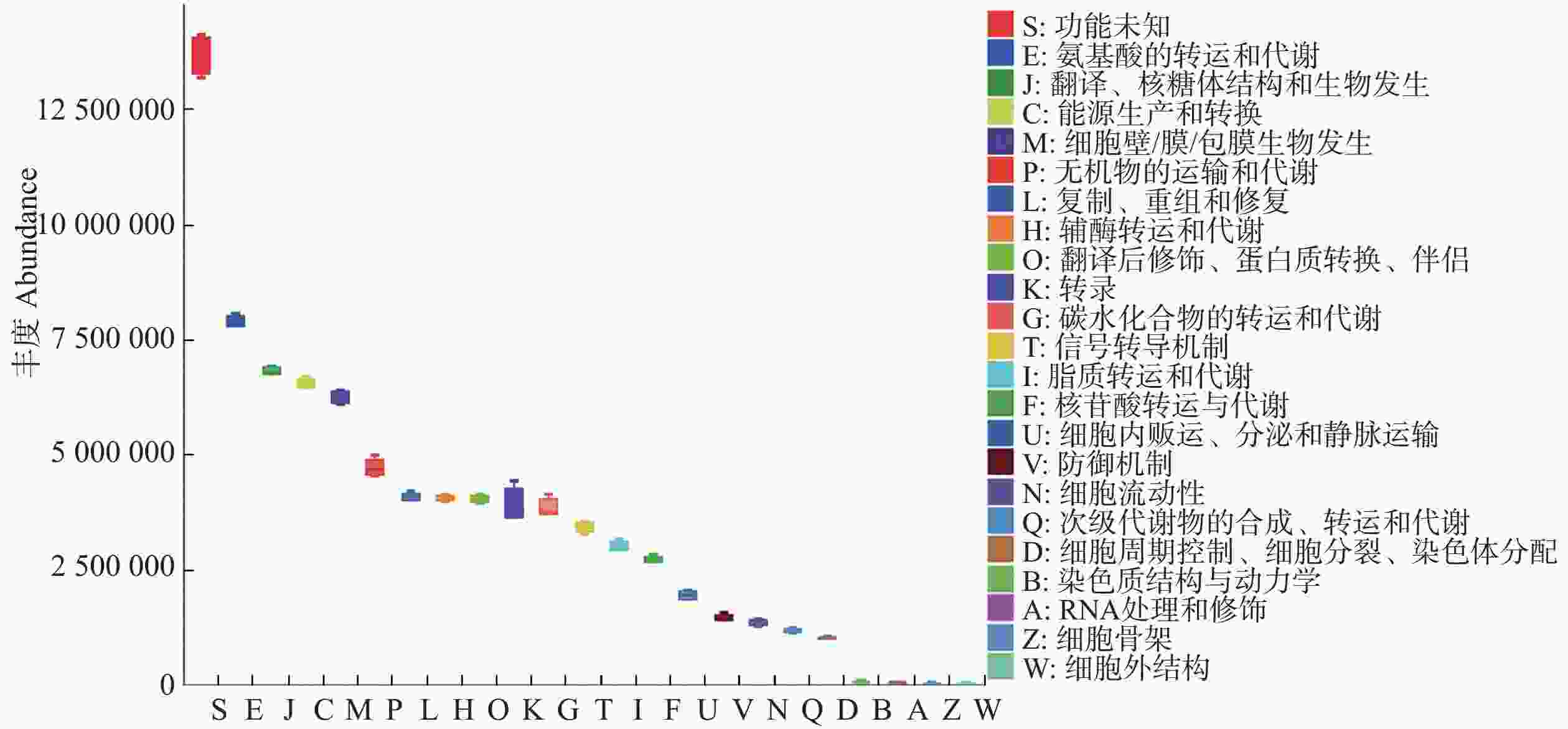
16s rRNA高通量测序结果可以用来预测微生物群落的功能。PICRUSt2功能预测用来预测环境样本中微生物群落的功能信息,通过功能组成和丰度变化了解环境变化过程中一些潜在的微生物功能特征[28],得到COG功能丰度图如下(图9)。生物膜中丰度较高的功能分别是能源的产生和转化功能、氨基酸转运和代谢功能、翻译、核糖体结构和生物生成功能、细胞壁/膜/胞膜的生物生成功能,以及复制重组和修复功能。
-
本研究利用聚氨酯海绵填料作为厌氧氨氧化菌的生物膜载体,富集厌氧氨氧化菌,通过设置不同进水氮负荷观察生物膜系统的脱氮性能及微生物群落变化,结果表明:随着进水氮负荷的上升,总氮去除率不断提高,稳定期总氮去除率高达85.79%,这可能是系统中存在许多异养菌,环境的改变导致微生物自溶释放有机氮,反硝化菌可以利用其他菌种自溶释放的有机物发生反硝化反应[29],NH
$ {}_{4}^{+} $ -N在微生物繁殖过程中会被消耗掉,而进水中的溶解氧也会氧化部分NH$ {}_{4}^{+} $ -N。因此,ΔNO$ {}_{2}^{-} $ -N/ΔNH$ {}_{4}^{+} $ -N低于厌氧氨氧化的理论比值[30],这与高逸凡等[31]研究结果相反,厌氧氨氧化菌活性在第三阶段最高,生物膜发育成熟,AnAOB与系统中异养菌共存达到一个平稳的状态,为证明猜想后续对微生物群落进行分析。有研究结果[32]表明,随着HRT的降低,促使微生物分泌更多的胞外聚合物(extracellular polymers,EPS)来抵御外界环境条件的变化。除了生物膜表面颜色的变化之外,生物膜结构的稀疏性也有相应的变化。测序结果表明:生物膜含有许多不同形式的微生物区系,如球菌、杆菌和少数丝状细菌[33],但球菌最多。球菌可能为AnAOB,杆菌可能为反硝化菌,这与Wang等[34]的结果一致。此外,丝状细菌可以为球形AnAOB聚集提供骨架[35],在第50天后,生物膜中的微生物呈现出具有不规则菜花状形状的压实结构,表明是厌氧氨氧化菌群逐渐被所分泌EPS包裹[36]。一般而言,厌氧氨氧化生物膜的紧凑压实状态使其更能较好地黏附于载体内外表面,进而提升厌氧氨氧化体系的稳定性与脱氮性能。因此,生物载体诱导生物膜形成的潜在机制可能是由于载体表面较粗糙,有利于厌氧氨氧化细菌的沉积,最终在水力与底物负荷冲刷下,逐渐淘洗并增加优势菌群的初始黏附。总而言之,载体的空间结构可以为厌氧氨氧化菌的生长提供足够的空间,实现生物膜外–内侧菌群演替与代谢耦合的“生态位”布局。
微生物多样性指数ACE、Chao1用来表征微生物群落丰度的变化,随着NLR的改变一直下降这与闫冰等[37]研究结果一致,随着厌氧氨氧化生物膜在载体上定殖,环境的改变致使不适应厌氧氨氧化系统环境的物种逐渐被淘汰,最终AnAOB逐渐占据优势,同时生态位相同的物种也会出现竞争,抑制或者淘汰其他竞争微生物,使生物膜中形成以AnAOB为主的微生物群落,从而导致群落结构越来越单一。
环境中的溶解氧有限,随着HRT的改变,系统中的微生物也发生一定变化,较高的流速造成底物不足与AnAOB产生竞争,因此限制了变形菌门的增殖,Planctomycetota中包含厌氧氨氧化菌属,随着氮负荷的变化呈现上升趋势,浮游菌门相对丰度的变化在一定程度上可以反映系统中功能微生物的演替。Chloroflexi通常被发现是颗粒污泥或生物膜反应器中的优势门,其可用作厌氧氨氧化絮凝物的骨架并与AnAOB结合以附着于生物载体其丝状结构可能在造粒中起到骨架的作用[38],与AnAOB形成共生关系这也解释了生物反应器中形成致密生物膜结构的原因。作为异养细菌,它们可以消耗反应系统中的有机物质[39]。在整个试验过程中,Chloroflexi丰度始终处于较高水平,占12.53%~25.92%。Firmicutes已被报道为有助于反应器系统中碳消耗的碳水化合物发酵细菌[40],在第一阶段丰度最高,达到12.61%,这些都与在脱氮过程中获得的更高的总氮去除率相匹配,也证明了这些培养物对系统的适应性和普遍性,当反应器HRT发生变化后以较高的NLR运行时,这些菌群也很活跃[41]。
在高负荷阶段,Candiadatus_Brocadia含量一直占据主导地位,在稳定期(100~150 d)达到29.80%,Zhang等[42]研究表明在具有强剪切力洗涤的情况下检测到厌氧氨氧化菌从Candiadatus_Jettenia到Candiadatus_Brocadia的种群进化。较强的剪切力、较短的水力停留时间和较高的NLR可以使Candiadatus_Brocadia优于其他AnAOB。NLR达到0.31 kg·N·m−3·d−1,AnAOB与异养细菌的共生关系缓解基质短缺对AnAOB的抑制。研究表明,反硝化细菌与AnAOB的交叉互养机制对厌氧氨氧化共生体的生态演化与脱氮协同过程存在促进效应。AnAOB具有产生乙酸盐、甲酸盐、糖原等的潜力,以喂养其共生体,如Denitratisoma和OLB13可以利用Candiadatus_Brocadia产生的有机物将NO
$ {}_{3}^{-} $ -N还原为NO$ {}_{2}^{-} $ -N供AnAOB使用,从而增加厌氧氨氧化系统的NRR和容积氮去除负荷(Nitrogen removal rate,NRE),此外,SRB1031作为生物膜骨架构建的贡献者可将厌氧氨氧化菌稳定固定于生物载体上。以上研究证实,厌氧氨氧化生物膜系统良性运转及相应抗胁迫能力有赖于多功能性菌群的协同互助,即反硝化菌和厌氧氨氧化菌通过共生/竞争效应共同塑造稳定的群落结构。因此,厌氧氨氧化菌、厌氧微生物和反硝化菌的共存确保了厌氧氨氧化生物膜反应器在基质胁迫下的高脱氮效率和稳定性[43]。微生物生长发育过程存在细胞分裂、凋亡及信息交换,本研究中丰度较高的几种功能均与微生物的代谢有关,生物膜形成过程中伴随着菌群的死亡凋谢会产生有机物,有机物被反硝化菌利用发生反硝化反应,同时伴随着能量的转化,较高的HRT促使AnAOB分泌更多的EPS,被丝状菌利用,EPS产生及消耗过程涉及能量转换、氨基酸转运及转录等,说明在系统中,AnAOB和反硝化菌、丝状菌之间存在交叉喂养,利用不同的底物进行协作,使其在较高的NLR下也能保持较高的运行效能。这与前面微生物群落多样性结果一致。细胞壁和细胞膜生物合成功能占比为7.63%,该功能有利于合成细胞膜促进微生物的附着及生长,Chloroflexi作为定殖的先锋物种,为AnAOB提供骨架,最终形成以厌氧氨氧化菌为核心的生物膜,以促进厌氧氨氧化反应高效、稳定地运行。
-
从不同水力停留时间的氮损研究视角下证实,反应器经过长期运行,稳定后TN去除率可达到85.79%,ΔNO
$ {}_{2}^{-} $ -N/ΔNH$ {}_{4}^{+} $ -N和ΔNO$ {}_{3}^{-} $ -N/ΔNH$ {}_{4}^{+} $ -N的比值分别为1.30和0.27,均接近理论值,有利于体系提升抗击负荷能力为优化厌氧氨氧化工艺参数提供依据。经由镜检与SEM发现,在不同工况下生物膜由松散向紧实化演变,预示着生物膜由外侧至内侧形成菌群形态演化与功能代谢耦连的“生态位”分布,对于厌氧氨氧化生物膜工艺的中试放大具有实际的内涵。
经由微生物种群的分析表明,Candidatus_Brocadia为填料生物膜中的主要功能菌,在填料上占比为29.8%,厌氧氨氧化体系的极佳效能得益于厌氧氨氧化菌属与其他菌属之间的共同协作,即硝态氮反硝化形成的亚硝态氮将作为原料供给厌氧氨氧化的代谢。以上试验结果探明了运行参数对滤池菌群演替的影响规律及作用机制,为厌氧氨氧化反应在实际应用中运行提供思路。
不同氮负荷下ANAMMOX运行效能及菌群动态变化
DOI: 10.15886/j.cnki.rdswxb.20240053
 CSTR: 32425.14.j.cnki.rdswxb.20240053
CSTR: 32425.14.j.cnki.rdswxb.20240053
Operational efficacy of ANAMMOX under different nitrogen loads and dynamic changes of the microbial communities
-
摘要: 采用聚氨酯海绵填料作为厌氧氨氧化菌的生物膜载体,富集厌氧氨氧化菌,探究不同进水氮负荷条件下生物膜系统的脱氮性能及微生物群落变化。结果表明:随着进水氮负荷的上升,总氮去除率不断提高,稳定期总氮去除率高达85.79%,出水氮负荷为0.26 kg·N·m−3·d−1,总氮去除达到国家一级标准;同时通过扫描电镜观察到聚氨酯海绵载体上形成了“菜花状”的生物膜,随后通过测序结果表明系统中的厌氧氨氧化菌由Candiadatus_Brocadia未明确分类地位的菌属组成,稳定期占比高达29.80%,最后,总结了在高负荷条件下厌氧氨氧化体系的极佳效能得益于厌氧氨氧化菌属与其他菌属之间的共同协作,即硝态氮反硝化形成的亚硝态氮将作为原料供给厌氧氨氧化的代谢,为今后厌氧氨氧化菌群相关代谢研究及工程实际应用提供综合指导。Abstract: Polyurethane sponge was used as a biofilm carrier for the enrichment of anaerobic ammonia oxidizing bacteria (AnAOB) to investigate the denitrification performance and microbial community changes of the biofilm system under different nitrogen loads of influent water. The results showed that the total nitrogen removal rate increased with the nitrogen load of influent water. The total nitrogen removal rate was as high as 85.79% in the stabilization period, the nitrogen load in effluent was 0.26 kg·N·m−3·d−1, and the total nitrogen removal reached the national standard. Meanwhile, the formation of cauliflower-shaped biofilm on the polyurethane sponge carrier was observed by using the scanning electron microscopy, and the sequencing of the biofilm samples showed that the biofilm system had been used to enrich the anaerobic ammonia oxidizing bacteria (AnAOB). Subsequently, the sequencing showed that the functional microorganisms in the system were Candiadatus brocadia, which accounted for 29.80% of the total number of microorganisms in the stable period. Finally, the changes of cross-feeding interactions between the genera of anaerobic ammonia oxidizing bacteria and other genera of microbiota under high load conditions were summarized, which will provide a comprehensive guideline for the future metabolism research and practical application of the anaerobic ammonia oxidizing bacterial flora in the engineering.
-
Key words:
- ANAMMOX /
- biofilm /
- polyurethane sponge /
- flora characterization /
- HRT
-
图 7 样品与物种关系(门水平)
1. 种泥当天(0 d);2. 50 d;3. 100 d;4. 150 d;5. 其他;6. 变形菌门;7. 绿弯菌门;8. 浮霉菌门;9. 拟杆菌门;10. 酸杆菌门;11. 厚壁菌门;12. 髌骨细菌门;13. NB1-j;14. 放线菌门;15. 芽单胞菌门。
Fig. 7 Sample-species relationships (phylum level)
1. 0 d;2. 50 d;3. 100 d;4. 150 d;5. others;6. Proteobacteria;7. Chloroflexi;8. Planctomycetota;9. Bacteroidota;10. Acidobacteriota;11. Firmicutes;12. Patescibacteria;13. NB1-j;14. Actinobacteriota;15. Gemmatimonadota.
表 1 反应器的运行条件
Table 1 Operating conditions for the reactor
运行时间
Time/d进水NH $ {}_{4}^{+} $ -N/
(mg·L−1)进水NO $ {}_{2}^{-} $ -N/
(mg·L−1)HRT/h 进水NLR/
(kg·m−3·d−1)1~50 20 ± 3.21 25.98 ± 3.02 8 0.15 ± 0.01 51~100 20 ± 5.02 28.72 ± 2.76 6 0.20 ± 0.07 101~150 20 ± 3.11 28.37 ± 4.25 4 0.31 ± 0.02 表 2 反应器微生物多样性指数
Table 2 Microbial diversity index of the reactor
样本
Sampling总序列条数
Total sequences抽平序列数
RarefactionOTUs 多样性指数 Diversity index Shannon Simpson ACE Chao1 coverage 0 d 70 736 50 922 782 3.761 0.106 827.419 808.235 0.998 50 d 51 705 762 4.245 0.048 824.841 802.552 0.998 100 d 53 649 620 4.166 0.049 804.580 787.116 0.998 150 d 50 922 774 3.906 0.062 699.762 680.921 0.998 -
[1] HUANG D Q, FU J J, LI Z Y, et al. Inhibition of wastewater pollutants on the anammox process: a review[J]. Science of the Total Environment, 2022, 803: 150009. doi: 10.1016/j.scitotenv.2021.150009 [2] CHEN H, HU H Y, CHEN Q Q, et al. Successful start-up of the anammox process: influence of the seeding strategy on performance and granule properties[J]. Bioresource Technology, 2016, 211: 594 − 602. doi: 10.1016/j.biortech.2016.03.139 [3] CHEN X Y, LIU L J, BI Y M, et al. A review of anammox metabolic response to environmental factors: characteristics and mechanisms[J]. Environmental Research, 2023, 223: 115464. doi: 10.1016/j.envres.2023.115464 [4] MA B, PENG Y Z, ZHANG S J, et al. Performance of anammox UASB reactor treating low strength wastewater under moderate and low temperatures[J]. Bioresource Technology, 2013, 129: 606 − 611. doi: 10.1016/j.biortech.2012.11.025 [5] VAN DER STAR W R L, ABMA W R, BLOMMERS D, et al. Startup of reactors for anoxic ammonium oxidation: experiences from the first full-scale anammox reactor in Rotterdam[J]. Water Research, 2007, 41(18): 4149 − 4163. doi: 10.1016/j.watres.2007.03.044 [6] LEI Z, WANG L X, WANG J, et al. Partial-nitritation of low-strength anaerobic effluent: a moderate-high dissolved oxygen concentration facilitates ammonia-oxidizing bacteria disinhibition and nitrite-oxidizing bacteria suppression[J]. Science of the Total Environment, 2021, 770: 145337. doi: 10.1016/j.scitotenv.2021.145337 [7] KOUBA V, HŮRKOVÁ K, NAVRÁTILOVÁ K, et al. Effect of temperature on the compositions of ladderane lipids in globally surveyed anammox populations[J]. Science of the Total Environment, 2022, 830: 154715. doi: 10.1016/j.scitotenv.2022.154715 [8] 陈重军, 张敏, 喻徐良, 等. 基质浓度对ABR厌氧氨氧化反硝化脱氮除碳效能影响及动力学特征[J]. 环境科学学报, 2018, 38(9): 3552 − 3560. doi: 10.13671/j.hjkxxb.2018.0153 [9] VAN KESSEL M A H J, STULTIENS K, POL A, et al. Simultaneous anaerobic and aerobic ammonia and methane oxidation under oxygen limitation conditions[J]. Applied and Environmental Microbiology, 2021, 87(13): e0004321. doi: 10.1128/AEM.00043-21 [10] LU Y F, DING Z B, GAO K X, et al. The effect of hydraulic retention time on ammonia and nitrate bio-removal over nitrite process[J]. Environmental Technology, 2020, 41(10): 1275 − 1283. doi: 10.1080/09593330.2018.1530697 [11] WANG P C, LU B, CHAI X L. Rapid start-up and long-term stable operation of the anammox reactor based on biofilm process: status, challenges, and perspectives[J]. Chemosphere, 2023, 336: 139166. doi: 10.1016/j.chemosphere.2023.139166 [12] YUAN Q, JIA Z, ROOTS P, et al. A strategy for fast anammox biofilm formation under mainstream conditions[J]. Chemosphere, 2023, 318: 137955. doi: 10.1016/j.chemosphere.2023.137955 [13] LI R L, ZHU L J, YANG K, et al. Impact of urbanization on antibiotic resistome in different microplastics: evidence from a large-scale whole river analysis[J]. Environmental Science & Technology, 2021, 55(13): 8760 − 8770. doi: 10.1021/acs.est.1c01395 [14] LIU X M, SHENG G P, LUO H W, et al. Contribution of extracellular polymeric substances (EPS) to the sludge aggregation[J]. Environmental Science & Technology, 2010, 44(11): 4355 − 4360. doi: 10.1021/es9016766 [15] 安雪迪, 彭永臻, 李自强, 等. 有机物冲击对颗粒污泥/填料厌氧氨氧化反应器的影响[J]. 中国给水排水, 2018, 34(15): 17 − 23. doi: 10.19853/j.zgjsps.1000-4602.2018.15.004 [16] 李亚峰, 于佳辉, 张文文, 等. 影响UASB厌氧氨氧化反应器脱氮性能的因素研究[J]. 沈阳建筑大学学报(自然科学版), 2018, 34(1): 176 − 182. doi: 10.11717/j.issn:2095-1922.2018.01.20 [17] ZHOU S, ZHANG Z, SUN Z L, et al. Responses of simultaneous anammox and denitrification (SAD) process to nitrogen loading variation: start-up, performance, sludge morphology and microbial community dynamics[J]. Science of the Total Environment, 2021, 795: 148911. doi: 10.1016/j.scitotenv.2021.148911 [18] KARASUTA C, WANG X J, ZHENG X W, et al. Effect of hydraulic retention time on effluent pH in anammox bioreactors: characteristics of effluent pH and pH as an indicator of reactor performance[J]. Journal of Environmental Management, 2021, 280: 111716. doi: 10.1016/j.jenvman.2020.111716 [19] LI H, CAI T, GAO Y J, et al. Long-term performance, microbial evolution and spatial microstructural characteristics of anammox granules in an upflow blanket filter (UBF) treating high-strength nitrogen wastewater[J]. Bioresource Technology, 2023, 367: 128206. doi: 10.1016/j.biortech.2022.128206 [20] ZHANG J H, ZHANG Q, LI X Y, et al. Rapid start-up of partial nitritation and simultaneously phosphorus removal (PNSPR) granular sludge reactor treating low-strength domestic sewage[J]. Bioresource Technology, 2017, 243: 660 − 666. doi: 10.1016/j.biortech.2017.06.129 [21] 罗景文, 杨津津, 李绍康, 等. 填料对ANAMMOX污泥活性恢复的影响及菌群特征[J]. 环境科学, 2022, 43(1): 424 − 431. doi: 10.13227/j.hjkx.202105271 [22] MA H Y, ZHANG Y L, XUE Y, et al. Relationship of heme c, nitrogen loading capacity and temperature in anammox reactor[J]. Science of the Total Environment, 2019, 659: 568 − 577. doi: 10.1016/j.scitotenv.2018.12.377 [23] DING S, ZHENG P, LU H F, et al. Ecological characteristics of anaerobic ammonia oxidizing bacteria[J]. Applied Microbiology and Biotechnology, 2013, 97(5): 1841 − 1849. doi: 10.1007/s00253-013-4697-0 [24] TIAN X, SCHOPF A, AMARAL-STEWART B, et al. Anammox attachment and biofilm development on surface-modified carriers with planktonic-and biofilm-based inoculation[J]. Bioresource Technology, 2020, 317: 124030. doi: 10.1016/j.biortech.2020.124030 [25] SU B S, LIU Q, LIANG H L, et al. Simultaneous partial nitrification, anammox, and denitrification in an upflow microaerobic membrane bioreactor treating middle concentration of ammonia nitrogen wastewater with low COD/TN ratio[J]. Chemosphere, 2022, 295: 133832. doi: 10.1016/j.chemosphere.2022.133832 [26] WANG W Q, LI D, LI S, et al. Characteristics and formation mechanism of hollow anammox granular sludge in low-strength ammonia sewage treatment[J]. Chemical Engineering Journal, 2021, 421: 127766. doi: 10.1016/j.cej.2020.127766 [27] WAN K, YU Y, HU J G, et al. Recovery of anammox process performance after substrate inhibition: reactor performance, sludge morphology, and microbial community[J]. Bioresource Technology, 2022, 357: 127351. doi: 10.1016/j.biortech.2022.127351 [28] 余道道, 孙敬起, 霍唐燃, 等. 沸石载体恢复受饥饿影响厌氧氨氧化菌的性能研究[J]. 北京大学学报(自然科学版), 2021, 57(3): 507 − 516. doi: 10.13209/j.0479-8023.2021.011 [29] YU Y C, GAO D W, TAO Y. Anammox start-up in sequencing batch biofilm reactors using different inoculating sludge[J]. Applied Microbiology and Biotechnology, 2013, 97(13): 6057 − 6064. doi: 10.1007/s00253-012-4427-z [30] 王特, 田凯, 李杰. 厌氧氨氧化菌富集过程影响因素的研究现状[J]. 石油化工应用, 2022, 41(4): 6 − 11. doi: 10.3969/j.issn.1673-5285.2022.04.002 [31] 高逸凡, 邹婷, 刘霄霄, 等. 水力停留时间对厌氧氨氧化工艺的影响[J]. 山东化工, 2022, 51(11): 25 − 27. doi: 10.3969/j.issn.1008-021X.2022.11.009 [32] LI B J, WANG Y, WANG W H, et al. High-rate nitrogen removal in a continuous biofilter anammox reactor for treating low-concentration nitrogen wastewater at moderate temperature[J]. Bioresource Technology, 2021, 337: 125496. doi: 10.1016/j.biortech.2021.125496 [33] SU H, ZHANG D C, ANTWI P, et al. Adaptation, restoration and collapse of anammox process to La(Ⅲ) stress: performance, microbial community, metabolic function and network analysis[J]. Bioresource Technology, 2021, 325: 124731. doi: 10.1016/j.biortech.2021.124731 [34] WANG T, ZHANG H M, YANG F L, et al. Start-up of the Anammox process from the conventional activated sludge in a membrane bioreactor[J]. Bioresource Technology, 2009, 100(9): 2501 − 2506. doi: 10.1016/j.biortech.2008.12.011 [35] FENG K, LOU Y, LI Y T, et al. Conductive carrier promotes synchronous biofilm formation and granulation of anammox bacteria[J]. Journal of Hazardous Materials, 2023, 447: 130754. doi: 10.1016/j.jhazmat.2023.130754 [36] 黄嘉豪, 刘桂文, 朱杰, 等. 改性生物填料载体强化厌氧氨氧化反应器脱氮研究[J]. 生物加工过程, 2022, 20(1): 41 − 49. doi: 10.3969/j.issn.1672-3678.2022.01.006 [37] 闫冰, 夏嵩, 桂双林, 等. 厌氧氨氧化菌富集培养过程微生物群落结构及多样性[J]. 环境科学, 2020, 41(12): 5535 − 5543. doi: 10.13227/j.hjkx.202005278 [38] WANG H, CHEN H, LIU S Y, et al. Inhibition and recovery of UASB-Anammox process: performance characteristics and microbial community dynamics in response to substrate concentration and dissolved oxygen exposure[J]. Journal of Water Process Engineering, 2023, 51: 103472. doi: 10.1016/j.jwpe.2022.103472 [39] LAWSON C E, WU S, BHATTACHARJEE A S, et al. Metabolic network analysis reveals microbial community interactions in anammox granules[J]. Nature Communications, 2017, 8: 15416. doi: 10.1038/ncomms15416 [40] BONASSA G, VENTURIN B, BOLSAN A C, et al. Performance and microbial features of anammox in a single-phase reactor under progressive nitrogen loading rates for wastewater treatment plants[J]. Journal of Environmental Chemical Engineering, 2022, 10(1): 107028. doi: 10.1016/j.jece.2021.107028 [41] WANG H, WANG J J, ZHOU M D, et al. A versatile control strategy based on organic carbon flow analysis for effective treatment of incineration leachate using an anammox-based process[J]. Water Research, 2022, 215: 118261. doi: 10.1016/j.watres.2022.118261 [42] ZHANG A Y, WANG S, YANG M M, et al. Influence of NaCl salinity on the aggregation performance of anammox granules[J]. Journal of Water Process Engineering, 2021, 39: 101687. doi: 10.1016/j.jwpe.2020.101687 [43] 王晓曈, 杨宏, 苏杨, 等. 生物滤池快速启动ANAMMOX运行策略及菌群特征[J]. 环境科学, 2020, 41(7): 3345 − 3355. doi: 10.13227/j.hjkx.201912112 -





 下载:
下载: