-
冰菜(Mesembryanthemum crystallinum)又名冰叶日中花、冰草、冰柱子,属于番杏科、日中花属的一年生草本植物,冰菜富含氨基酸、抗酸化物质等物质,并且富含钠、钾、胡萝卜素等矿物质,具有较高的高营养价值[1]。由于其具有强大的环境适应能力,现已被作为盐生植物模型,用于研究植物应对盐分和水分胁迫响应的基本生理、生化和分子机制[2-4]。成年冰菜具有一系列应对环境压力的调节机制,辐射、干旱、高温以及盐胁迫会刺激冰菜的光合作用类型从C3循环转化为景天酸循环[3],从而在夜间吸收CO2抑制蒸腾作用进而减少水分流失,显著提高水分利用效率[5]。冰菜的另一个显著环境适应性特征是其植株的地上部分存在表皮泡状细胞,也被称为盐囊泡,这些囊泡整齐地排列在冰菜的叶、茎以及花器官表面,在未受到环境胁迫时,这些泡状细胞紧贴表皮表面,当遭遇胁迫时,植株会迅速做出反应,表皮泡状细胞内部积累Na+进而膨胀至总体积的25% [6],完全膨大的表皮泡状细胞内部积累的Na+浓度高达1 mol·L−1[3],此外,囊泡内容物还包括一些醇类物质[7-8], 冰菜盐囊泡的存在是其耐盐的重要因素。扩大的盐囊泡内部积累的类黄酮和花青素可以在其紫外线防护中发挥作用,并可以反射部分辐射保护叶肉细胞免受热损伤[9]。不仅如此,膨大的盐囊泡还可以在阻止昆虫和食草动物食用、吸引传粉媒介以及帮助种子传播中发挥重要作用,还可以隔离并储存重金属和盐等不需要的外来物质[10]。在植物特化细胞的研究中,尤其是分离过程相对简单的细胞,例如花粉、根毛以及保卫细胞等,表皮囊泡细胞相对于其他细胞类型而言更能深入阐明冰菜响应盐胁迫的机理。蛋白组学和转录组学的研究表明,冰菜盐囊泡中醛缩酶和烯醇化酶的活性受到盐处理的诱导而变化,这表明冰菜的表皮囊泡细胞具有代谢活性[11]盐胁迫下冰菜的离子转运、渗透物质积累以及压力信号传导等过程存在着显著变化[12],然而到目前为止,还未见关于盐胁迫下冰菜囊泡比较代谢组学的报道,因此,本研究拟对盐处理前后冰菜盐囊泡提取物进行非靶向代谢组学分析,探索盐处理前后冰菜囊泡代谢物的差异,旨在为冰菜耐盐机理的阐释及生产实践提供一定的理论参考。
-
冰菜(Mesembryanthemum crystallinum)种子用5%次氯酸钠清洗5 min,然后用去离子水表面漂洗2次,点播于基质(V营养土∶V蛭石= 3∶1)中,一周后挑选长势基本一致的幼苗移栽至塑料盆(直径20 cm;3株/盆)中,每两天使用1/2 Hoagland浇灌1次,3周后开始每两天使用含有200 mmol·L−1 NaCl的1/2 Hoagland溶液浇灌1次,对照样品使用等量1/2 Hoagland处理,植物在自然光照和光周期的温室内生长,处理4周后进行取样。使用胰岛素针(27 G,13 mm)吸取冰菜叶或茎盐囊泡内容物针头与叶或茎轴水平以避免取到叶肉细胞,每取50个盐囊泡使用液氮速冻1次,直至样品量达到200 µL即作为单个生物学重复。对照和盐处理植株各取6个生物学重复以备后续分析。
-
取100 µL样本置于1.5 mL Eppendorf管中,加入800 μL提取液(V甲醇︰V水=7∶3,−20 ℃预冷)和20 μL内标,使用组织研磨仪中进行研磨(50 Hz, 5 min),4 ℃水浴超声30 min,−20 ℃冰箱静置1 h。4 ℃,14 000 r·min−1离心15 min。离心后取600 μL上清于0.22 μm滤膜过滤,将过滤后的样本置于上样瓶中等待LC-MS分析。每个样本各取20 μL混合成QC质控样本,用于评估LC-MS分析过程的重复性和稳定性。
-
采用Waters 2D UPLC(waters, USA)串联Q Exactive高分辨质谱仪(Thermo Fisher Scientific, USA)来进行代谢物的分离和检测。
色谱条件:所使用的色谱柱为Hypersil GOLD aQ色谱柱(100×2.1 mm, 1.9 μm, Thermo Fisher Scientific, USA)。流动相为含0.1%甲酸的水溶液(A液)和含0.1%甲酸的100%乙腈(B液)。采用以下梯度进行洗脱:0~2 min,5% B液;2~22 min,5%~95% B液;22~27 min,95% B液;27.1~30 min,5% B液。流速为0.3 mL·min−1,柱温40 ℃,进样量为5 μL。
质谱条件:利用Q Exactive质谱仪(Thermo Fisher Scientific, USA)进行一级、二级质谱数据采集。质谱扫描质核比范围为150~1 500,一级分辨率为70 000,AGC为1×106,最大注入时间(IT, injection time)为100 ms。按照母离子强度,选择Top3进行碎裂,采集二级信息,二级分辨率为35 000,AGC为2e5,最大注入时间(IT)为50 ms,碎裂能量(stepped nce)设置为:20、40、60 eV。离子源(ESI)参数设置:鞘气流速(Sheath gas flow rate)为40,辅助气流速(Aux gas flow rate)为10,喷雾电压(Spray voltage(|KV|))正离子模式为3.80,负离子模式为3.20,离子传输管温度(Capillary temp)为320 ℃,辅助气加热温度(Aux gas heater temp)为350 ℃。
-
使用代谢组学 R 软件包metaX[13]以及代谢组信息分析流程进行数据预处理、统计分析及代谢物分类注释和功能注释。通过主成分分析(Principle Component Analysis, PCA)对多变量的原始数据进行降维,以此分析该数据集中所观测变量的分组、趋势及离群值。使用偏最小二乘法-判别分析(Partial Least Squares Method-Discriminant Analysis,PLS-DA) 模型前2个主成分的 VIP 值,结合单变量分析获得的差异变化倍数(Fold change)和t检验(Student's t test)的结果来筛选差异代谢物。KEGG数据库用于对差异代谢物进行通路富集分析。
-
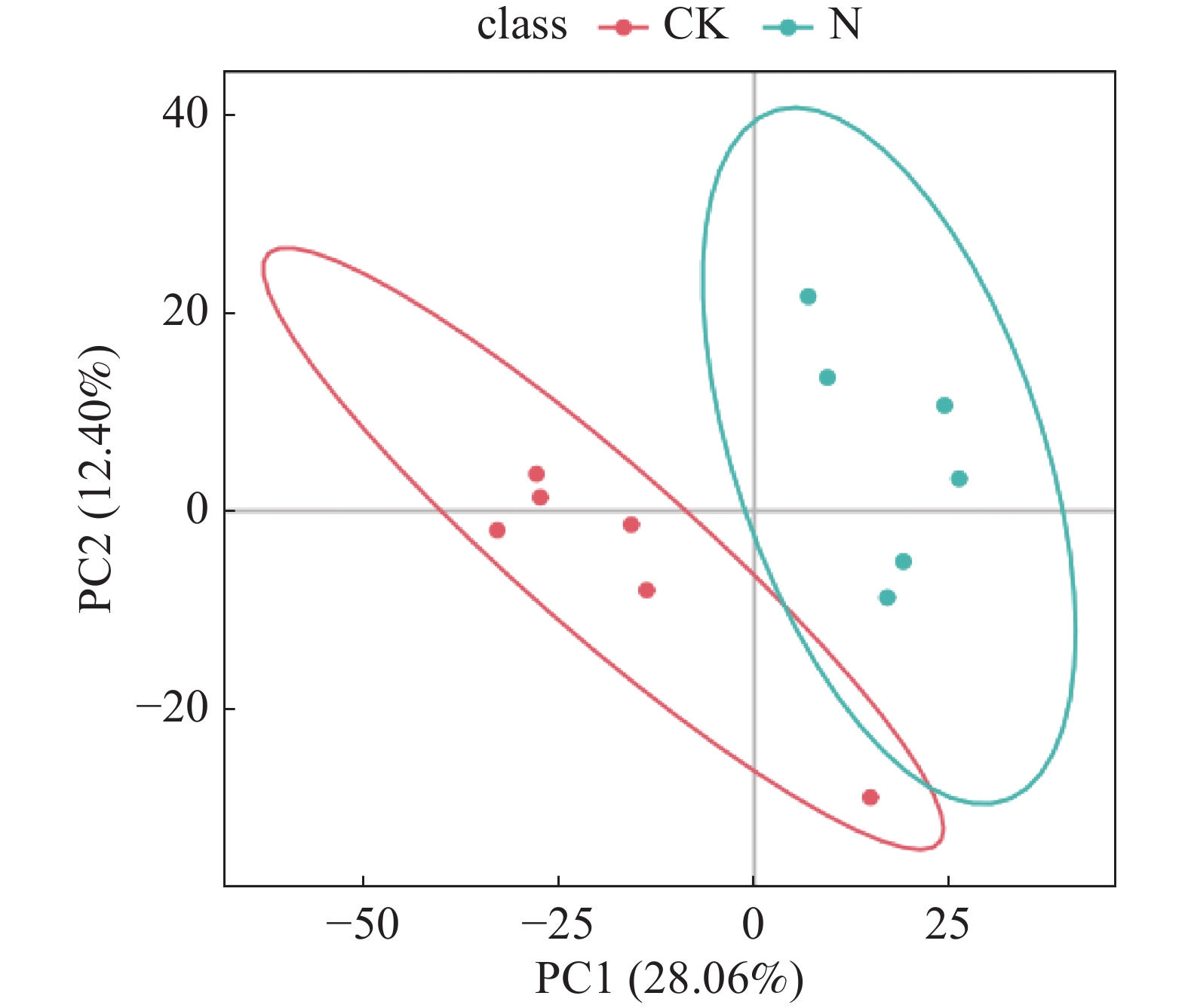
对冰菜盐囊泡代谢物的2组处理数据进行偏最小二乘投影判别分析(PLS-DA),图1是PLS-DA 得分图。从图1可知,2种处理各重复样本彼此之间可以明显分开,PC1根据不同处理对样本进行分离,数据中的最大方差为28.06%,PC2根据样本重复对数据进行分离,数据中的最大方差为12.4%。说明经盐胁迫处理后的冰菜盐囊泡代谢成分存在显著差异。
-
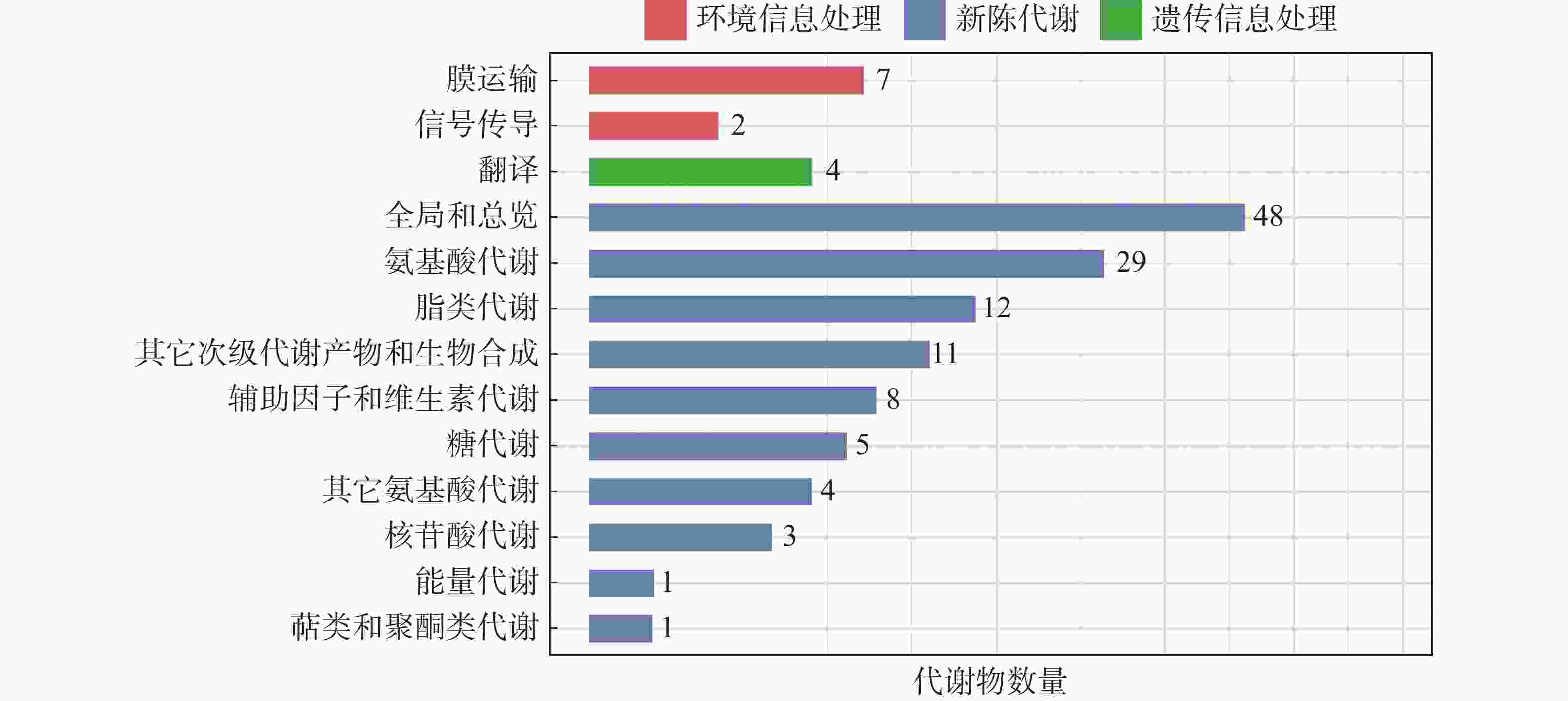
将LC-MS/MS采集的原始数据导入Compound Discoverer 3.1进行数据分析,使用华大自建标准品库对代谢物进行鉴定。结果表明,样品中共检测到了356种已知代谢物,其中,包括正离子模式代谢物290种,负离子模式代谢物179种。为了进一步了解不同代谢物的分类情况和功能特性,对鉴定得到的代谢物进行了分类注释和功能注释。鉴定出的代谢物中有137个被映射到不同代谢通路(图2)。映射到氨基酸代谢(amino acid metabolism)最多,有29种,其次是脂类代谢(lipid metabolism)的12种,此外,还有部分代谢物被映射到其他通路。总体而言,鉴定出的代谢物大部分参与新陈代谢过程,只有9种代谢物参与膜运输和信号传导等环境信息处理过程,4种代谢物参与遗传信息处理过程。
-
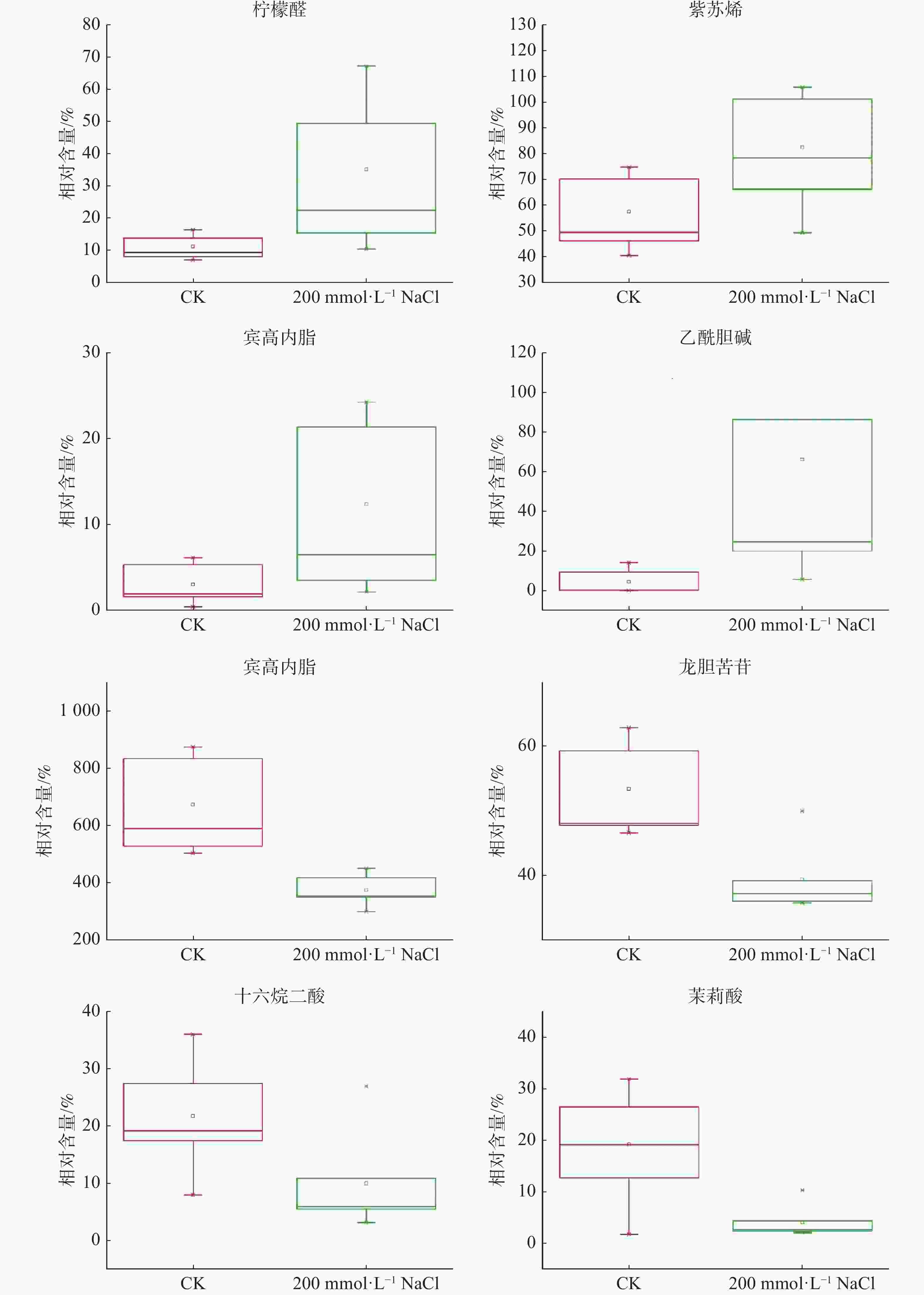
根据设定的筛选条件(VIP≥1,Fold-Change≥1.2或者 ≤0.83,P<0.05),结果表明(表1):在盐处理组中共筛选到37种核心差异代谢物,其中,盐处理后20种代谢物在盐囊泡中的含量显著下调,17种代谢物含量显著上调,上调幅度最大的代谢物是乙酰胆碱,其含量在盐处理后较对照相比上调了超过14倍,下调幅度较大的有亚麻酸(13(s)-hotre)、茉莉酸、甲基双酮以及α-雌二醇等代谢物,这几种代谢物在盐处理后的含量均下调至对照水平的20%左右(图3)。聚类分析表明,这些差异代谢物包含1种苯环型化合物、1种脂肪酰类化合物、3种脂质和类脂分子、1种有机氮化合物、1种有机杂环化合物、2种苯丙烷类和聚酮类化合物、1种类固醇化合物和2种萜类化合物。
表 1 盐处理及对照条件下冰菜盐囊泡核心差异代谢分析
代谢物名称 变化倍数 P值 13(s)-hotre 0.15570994 0.030264727 茉莉酸 Jasmonic acid 0.218569326 0.022545339 甲基双酮 19-norandrostenedione 0.229452659 0.008855389 α-雌二醇 Α-estradiol 0.248734898 0.009438115 Methyl 2-{[2-o-(6-deoxy-α-l-mannopyranosyl)-β-d-glucopyranosyl]oxy}benzoate 0.349857598 0.016001883 N4-(2-methoxyphenyl)-7-nitro-2,1,3-benzoxadiazol-4-amine 0.417636789 0.001939085 11β-羟基雄甾酮 11β-hydroxyandrosterone 0.426117111 0.003515696 Methyl 2-{[2-o-(6-deoxy-α-l-mannopyranosyl)-β-d-glucopyranosyl]oxy}benzoate 0.430390925 0.033490336 (tert-butyl)-2,3,5,6,8,9,11,12-octahydro-1,4,7,10,13- benzopentaoxacyclopentadecine 0.450408981 0.030006846 十六碳烷二酸 Hexadecanedioic acid 0.461182594 0.031592167 反式对香豆酰基酪胺 (2e)-3-(4-hydroxyphenyl)-n-[2-(4-hydroxyphenyl)ethyl]acrylamide 0.469959388 0.032433379 [(3r,4s)-3-({5-[(phenylsulfanyl)methyl]-1,2-oxazol-3-yl}methyl)-4-piperidinyl] -n-(1,3-thiazol-2-yl)acetamide 0.533747968 0.006560631 N-苄基甲酰胺 N-benzylformamide 0.546190634 0.013117271 大麦芽碱 Hordenine 0.556389125 0.000822253 (4-{(r)-hydroxy[(3r)-5-oxo-4-(3-phenylpropyl)-3-morpholinyl]methyl} phenyl)-2-thiophenecarboxamide 0.556594851 0.01902366 腺嘌呤 Adenine 0.582263258 0.030055647 2-(tert-butyl)-6-[(4-chlorophenyl)sulfonyl]pyrazolo[1,5-a]pyrimidin-7-amine 0.613601938 0.04871511 乙酸异丁酯 Azidoindolene 1 0.671186827 0.013985625 2-{2-oxo-2-[4-(1h-pyrrol-1-yl)piperidino]ethoxy}acetic acid 0.675815639 0.009152107 龙胆苦苷 Gentiopicrin 0.737975126 0.0019069 {[(2s,5as,8ar)-1-methyl-5-oxo-2-[3-oxo-3-(2-propyn-1-ylamino)propyl] octahydropyrrolo[3,2-e][1,4]diazepin-6(1h)-yl]methyl}benzoic acid 1.39552841 0.034461568 紫苏烯 Perillene 1.434996617 0.048258974 (3s,4r)-3-(1-hydroxyhexyl)-4-(hydroxymethyl)oxolan-2-one 1.496159643 0.01609641 2,2-二羟甲基丙酸 2,2-bis(hydroxymethyl)propionic acid 1.669194028 0.035891706 β-细辛醚 β-Asarone 1.688749622 0.035694442 己基肉桂醛 Hexylcinnamaldehyde 1.709634669 0.039710719 Methyl 4-methoxy-1h-indole-2-carboxylate 2.543122217 0.043106317 洋川芎内酯h Senkyunolide h 2.720520745 0.014978895 Sts-135 2.727222075 0.03044568 (4as,9ar)-7-(2-acetamidoethyl)-n-allyl-6-oxodecahydro-2h-pyrido[3,4-d] azepine-2-carboxamide 2.872598342 0.034032236 (3β,9ξ)-3,14-dihydroxycarda-5,20(22)-dienolide 3.059240536 0.040582459 柠檬醛 Citral 3.12672361 0.020404139 反-2-甲基-2-戊烯酸 trans-2-Methyl-2-pentenoic Acid 3.243068259 0.04086777 滨蒿内酯 Scoparone 4.075749941 0.038073018 7-甲氧基-4-甲基香豆素 7-Methoxy-4-methylcoumarin 6.469336085 0.025506341 羟基-2-甲氧基苯基β-D-吡喃葡萄糖苷 4-(2-hydroxyethyl)-2-methoxyphenyl β-d-glucopyranoside 6.536820919 0.024910298 乙酰胆碱 Acetylcholine 14.87674752 0.007165993 注:变化倍数是指盐处理后盐囊泡内代谢物含量相对于对照处理条件下该代谢物含量的比值,数据来自于6个生物学重复的平均值。P值代表差异显著程度,P值越小表明差异越显著。 为了进一步了解差异代谢物参与的生化通路,使用KEGG数据库对差异代谢物进行代谢通路富集分析,结果表明(表2):差异代谢物显著富集于6条代谢通路中,包括植物激素信号传导、玉米素生物合成、α亚麻酸代谢、甘油磷脂代谢、酪氨酸代谢以及嘌呤代谢。
表 2 差异代谢物代谢通路富集分析
代谢通路 P值 代谢通路ID KEGG IDs 植物激素信号转导 0.00582837 map04075 C08491 玉米素生物合成 0.01883194 map00908 C00147 α-亚麻酸代谢 0.02122334 map00592 C08491 甘油磷脂代谢 0.02503882 map00564 C01996 酪氨酸代谢 0.03734798 map00350 C06199 嘌呤代谢 0.04532139 map00230 C00147 注:P<0.05的代谢通路为差异代谢物显著富集的代谢通路,P<0.01的代谢通路为差异代谢物极显著富集的代谢通路。 -
植物中大约存在200 000种代谢物[14],然而检测方式、代谢物存在的物种特异性、时空因素以及迅速的代谢等因素严重限制了当前在植物体内可以检测到的代谢物数量,结合多种检测手段可以有效解决这一问题。本研究采用液相色谱串联质谱(LC-MS/MS)技术对冰菜盐囊泡这一特殊细胞进行非靶向代谢组学分析,合并采集正离子和负离子2种模式的数据来提高代谢物覆盖度,最终在冰菜盐囊泡提取物中鉴定出356种已知代谢物,检测到的代谢物的数量显著多于之前关于拟南芥表皮毛单细胞代谢分析报告中代谢物的数量[15]。这一结果可能与特定细胞的代谢多样性有关,也可能得益于代谢组数据库的更新与分析方法的改进。
冰菜的盐囊泡作为一种特殊的细胞具有一定的代谢活性,为了更深入地了解盐囊泡的生化功能及其在冰菜耐盐机制中潜在的生物学作用,笔者研究了盐处理对冰菜盐囊泡代谢的影响,结果表明,在356种检测到的已知代谢物中,盐处理后37 种代谢物的含量在盐囊泡中发生了显著的变化(含量增加的有17种,含量减少的有20种),值得关注的是,盐囊泡中茉莉酸的含量在遭遇盐处理后显著下调,仅为对照的20%左右。在针对冰菜盐囊泡响应盐胁迫的比较转录组研究中,编码茉莉酸合成限速酶丙二烯氧化物环化酶( AOC)的基因表达水平在盐胁迫下显著下调[12],这与本研究的结果一致。但Tani等[16]的研究表明,盐胁迫诱导水稻叶片与根部茉莉酸合成基因的表达,增加了这2种组织中的茉莉酸含量,与本研究结果相反,这可能是由于盐囊泡作为一种高度液泡化的细胞具有一定的储存功能,在未受到胁迫时,冰菜叶片中合成的茉莉酸积累在盐囊泡内,而受到胁迫后囊泡内积累的茉莉酸转移至叶片细胞,通过影响气孔行为和调控蒸腾作用来调节冰菜对胁迫的响应,进而减缓胁迫带来的生理干旱和盐离子本身对冰菜的毒害。
在盐处理后的冰菜盐囊泡中,乙酰胆碱的含量增加最多,盐处理后其在盐囊泡中的含量比对照增加了14倍。有研究表明,乙酰胆碱可以响应非生物胁迫,例如干旱、盐、高温胁迫以及渗透胁迫。干旱条件下使用乙酰胆碱处理烟草能够提高植株渗透调节物质含量并提高抗氧化酶活性,降低烟草体内的过氧化氢和超氧阴离子含量,进而减轻干旱胁迫对烟草造成的氧化损伤[17]。此外,Qin等[18]发现,乙酰胆碱处理可调节叶绿素合成相关基因的表达。冰菜的盐囊泡本身具有一定的光合能力[19],因此,盐囊泡中乙酰胆碱水平的提高有助于盐胁迫下离子的运输与分配,提高冰菜在盐胁迫下的光合能力。一些有机酸的含量也在盐胁迫后的盐囊泡中上调,有机酸可以作为CAM循环中的光和中间体[20]和氨基酸生物合成的前体[21],有机酸丰富的变化可能反映了这几种生化途径在细胞水平上的变化。另外,有机酸还可能作为具有代谢活性的溶质在渗透压调节方面起到一定的作用。
本研究通过代谢组学的方法对冰菜盐囊泡中存在的代谢物进行了系统分析,并鉴定出了盐胁迫造成的冰菜盐囊泡37种代谢物的差异变化,但得到的组学数据中仍有大量代谢物没有得到有效的注释,未来还需用有效的检测手段和分析方法加速这一领域的研究,以便进一步解析冰菜盐囊泡在冰菜抗逆机制方面的作用。
盐胁迫下冰菜盐囊泡细胞的比较代谢组学分析
DOI: 10.15886/j.cnki.rdswxb.20230020
 CSTR: 32425.14.j.cnki.rdswxb.20230020
CSTR: 32425.14.j.cnki.rdswxb.20230020
Comparative metabolomic analysis of epidermal bladder cells in Mesembryanthemum crystallinum under salt stress
-
摘要: 为了研究盐胁迫下冰菜(Mesembryanthemum crystallinum)盐囊泡中代谢物的变化,通过液相色谱串联质谱(LC-MS/MS)技术对对照以及盐处理下冰菜的盐囊泡中的代谢物进行了鉴定及分析,共在冰菜盐囊泡中确定了356个已知代谢物。对差异代谢物的筛选结果表明,有37种代谢物的含量在盐处理后的盐囊泡中发生了显著变化。基于KEGG数据库对差异代谢物进行的代谢通路富集分析表明,KEGG中定义的植物激素信号传导、玉米素生物合成及嘌呤代谢等6条生化途径存在显著扰动。以上结果显示,盐处理能造成冰菜盐囊泡中的代谢物发生显著变化。Abstract: To investigate the changes of metabolites in epidermal bladder cells of the halophytic species Mesembryanthemum crystallinum under salt stress, the metabolites in the epidermal bladder cells of M. crystallinum under control and salt stress were identified and analyzed by using the liquid chromatography tandem mass spectrometry (LC-MS/MS), and a total of 356 known metabolites were identified in the epidermal bladder cells. Analysis of differential metabolites showed that the levels of 37 metabolites in the epidermal bladder cells were significantly changed under the salt stress. Metabolic pathway enrichment analysis of the differential metabolites based on the KEGG database showed significant perturbations in six biochemical pathways defined in KEGG, such as phytohormone signaling, zeatin biosynthesis, purine metabolism, etc. These results indicate that salt treatment can cause significant changes in metabolites in epidermal bladder cells of M. crystallinum .
-
Key words:
- salt stress /
- Mesembryanthemum crystallinum /
- epidermal bladder cells /
- metabolome
-
表 1 盐处理及对照条件下冰菜盐囊泡核心差异代谢分析
代谢物名称 变化倍数 P值 13(s)-hotre 0.15570994 0.030264727 茉莉酸 Jasmonic acid 0.218569326 0.022545339 甲基双酮 19-norandrostenedione 0.229452659 0.008855389 α-雌二醇 Α-estradiol 0.248734898 0.009438115 Methyl 2-{[2-o-(6-deoxy-α-l-mannopyranosyl)-β-d-glucopyranosyl]oxy}benzoate 0.349857598 0.016001883 N4-(2-methoxyphenyl)-7-nitro-2,1,3-benzoxadiazol-4-amine 0.417636789 0.001939085 11β-羟基雄甾酮 11β-hydroxyandrosterone 0.426117111 0.003515696 Methyl 2-{[2-o-(6-deoxy-α-l-mannopyranosyl)-β-d-glucopyranosyl]oxy}benzoate 0.430390925 0.033490336 (tert-butyl)-2,3,5,6,8,9,11,12-octahydro-1,4,7,10,13- benzopentaoxacyclopentadecine 0.450408981 0.030006846 十六碳烷二酸 Hexadecanedioic acid 0.461182594 0.031592167 反式对香豆酰基酪胺 (2e)-3-(4-hydroxyphenyl)-n-[2-(4-hydroxyphenyl)ethyl]acrylamide 0.469959388 0.032433379 [(3r,4s)-3-({5-[(phenylsulfanyl)methyl]-1,2-oxazol-3-yl}methyl)-4-piperidinyl] -n-(1,3-thiazol-2-yl)acetamide 0.533747968 0.006560631 N-苄基甲酰胺 N-benzylformamide 0.546190634 0.013117271 大麦芽碱 Hordenine 0.556389125 0.000822253 (4-{(r)-hydroxy[(3r)-5-oxo-4-(3-phenylpropyl)-3-morpholinyl]methyl} phenyl)-2-thiophenecarboxamide 0.556594851 0.01902366 腺嘌呤 Adenine 0.582263258 0.030055647 2-(tert-butyl)-6-[(4-chlorophenyl)sulfonyl]pyrazolo[1,5-a]pyrimidin-7-amine 0.613601938 0.04871511 乙酸异丁酯 Azidoindolene 1 0.671186827 0.013985625 2-{2-oxo-2-[4-(1h-pyrrol-1-yl)piperidino]ethoxy}acetic acid 0.675815639 0.009152107 龙胆苦苷 Gentiopicrin 0.737975126 0.0019069 {[(2s,5as,8ar)-1-methyl-5-oxo-2-[3-oxo-3-(2-propyn-1-ylamino)propyl] octahydropyrrolo[3,2-e][1,4]diazepin-6(1h)-yl]methyl}benzoic acid 1.39552841 0.034461568 紫苏烯 Perillene 1.434996617 0.048258974 (3s,4r)-3-(1-hydroxyhexyl)-4-(hydroxymethyl)oxolan-2-one 1.496159643 0.01609641 2,2-二羟甲基丙酸 2,2-bis(hydroxymethyl)propionic acid 1.669194028 0.035891706 β-细辛醚 β-Asarone 1.688749622 0.035694442 己基肉桂醛 Hexylcinnamaldehyde 1.709634669 0.039710719 Methyl 4-methoxy-1h-indole-2-carboxylate 2.543122217 0.043106317 洋川芎内酯h Senkyunolide h 2.720520745 0.014978895 Sts-135 2.727222075 0.03044568 (4as,9ar)-7-(2-acetamidoethyl)-n-allyl-6-oxodecahydro-2h-pyrido[3,4-d] azepine-2-carboxamide 2.872598342 0.034032236 (3β,9ξ)-3,14-dihydroxycarda-5,20(22)-dienolide 3.059240536 0.040582459 柠檬醛 Citral 3.12672361 0.020404139 反-2-甲基-2-戊烯酸 trans-2-Methyl-2-pentenoic Acid 3.243068259 0.04086777 滨蒿内酯 Scoparone 4.075749941 0.038073018 7-甲氧基-4-甲基香豆素 7-Methoxy-4-methylcoumarin 6.469336085 0.025506341 羟基-2-甲氧基苯基β-D-吡喃葡萄糖苷 4-(2-hydroxyethyl)-2-methoxyphenyl β-d-glucopyranoside 6.536820919 0.024910298 乙酰胆碱 Acetylcholine 14.87674752 0.007165993 注:变化倍数是指盐处理后盐囊泡内代谢物含量相对于对照处理条件下该代谢物含量的比值,数据来自于6个生物学重复的平均值。P值代表差异显著程度,P值越小表明差异越显著。 表 2 差异代谢物代谢通路富集分析
代谢通路 P值 代谢通路ID KEGG IDs 植物激素信号转导 0.00582837 map04075 C08491 玉米素生物合成 0.01883194 map00908 C00147 α-亚麻酸代谢 0.02122334 map00592 C08491 甘油磷脂代谢 0.02503882 map00564 C01996 酪氨酸代谢 0.03734798 map00350 C06199 嘌呤代谢 0.04532139 map00230 C00147 注:P<0.05的代谢通路为差异代谢物显著富集的代谢通路,P<0.01的代谢通路为差异代谢物极显著富集的代谢通路。 -
[1] AGARIE S, KAWAGUCHI A, KODERA A, et al. Potential of the common ice plant, Mesembryanthemum crystallinum as a new high-functional food as evaluated by polyol accumulation[J]. Plant Production Science, 2009, 12(1): 37 − 46. doi: 10.1626/pps.12.37 [2] LUTTGE U, FISCHER E, STEUDLE E. Membrane potentials and salt distribution in epidermal bladders and photosynthetic tissue of Mesembryanthemum crystallinum L[J]. Plant Cell and Environment, 1978, 1(2): 121 − 129. doi: 10.1111/j.1365-3040.1978.tb00753.x [3] ADAMS P, NELSON D E, YAMADA S, et al. Growth and development of Mesembryanthemum crystallinum (Aizoaceae)[J]. The New Phytologist, 1998, 138(2): 171 − 190. doi: 10.1046/j.1469-8137.1998.00111.x [4] BARKLA B J, VERA-ESTRELLA R, HERNáNDEZ-CORONADO M, et al. Quantitative proteomics of the tonoplast reveals a role for glycolytic enzymes in salt tolerance[J]. The Plant Cell, 2009, 21(12): 4044 − 4058. [5] CUSHMAN J C, BOHNERT H J. CRASSULACEAN ACID METABOLISM: molecular genetics[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1999, 50: 305 − 332. doi: 10.1146/annurev.arplant.50.1.305 [6] STEUDLE E, LÜTTGE U,ZIMMERMANN U. Water relations of the epidermal bladder cells of the halophytic species Mesembryanthemum crystallinum: direct measurements of hydrostatic pressure and hydraulic conductivity[J]. Planta, 1975, 126(3): 229 − 246. doi: 10.1007/BF00388965 [7] PAUL M J, COCKBURN W. Pinitol, a compatible solute in Mesembryanthemum crystallinum L[J]. Journal of Experimental Botany, 1989, 40(10): 1093 − 1098. doi: 10.1093/jxb/40.10.1093 [8] VERNON D M, BOHNERT H J. A novel methyl transferase induced by osmotic stress in the facultative halophyte Mesembryanthemum crystallinum[J]. The EMBO Journal, 1992, 11(6): 2077 − 2085. doi: 10.1002/j.1460-2075.1992.tb05266.x [9] VOGT T, IBDAH M, SCHMIDT J, et al. Light-induced betacyanin and flavonol accumulation in bladder cells of Mesembryanthemum crystallinum[J]. Phytochemistry, 1999, 52(4): 583 − 592. doi: 10.1016/S0031-9422(99)00151-X [10] WAGNER G J, WANG E, SHEPHERD R W. New approaches for studying and exploiting an old protuberance, the plant trichome[J]. Annals of Botany, 2004, 93(1): 3-11. [11] BARKLA B J, VERA-ESTRELLA R, PANTOJA O. Protein profiling of epidermal bladder cells from the halophyte Mesembryanthemum crystallinum[J]. Proteomics, 2012, 12: 2862 − 2865. doi: 10.1002/pmic.201200152 [12] OH D H, BARKLA B J, VERA-ESTRELLA R, et al. Cell type-specific responses to salinity-the epidermal bladder cell transcriptome of Mesembryanthemum crystallinum[J]. The New Phytologist, 2015, 207(3): 627 − 644. doi: 10.1111/nph.13414 [13] WEN B, MEI Z, ZENG C, et al. MetaX: a flexible and comprehensive software for processing metabolomics data[J]. BMC Bioinformatics, 2017, 18: 183. doi: 10.1186/s12859-017-1579-y [14] FIEHN O. Metabolomics:the link between genotypes and phenotypes[J]. Plant Molecular Biology, 2002, 48(1/2): 155 − 171. doi: 10.1023/A:1013713905833 [15] EBERT B, ZöLLER D, ERBAN A, et al. Metabolic profiling of Arabidopsis thaliana epidermal cells[J]. Journal of Experimental Botany, 2010, 61(5): 1321 − 1335. doi: 10.1093/jxb/erq002 [16] TANI T, SOBAJIMA H, OKADA K, et al. Identification of the OsOPR7 gene encoding 12-oxophytodienoate reductase involved in the biosynthesis of jasmonic acid in rice[J]. Planta, 2008, 227(3): 517 − 526. doi: 10.1007/s00425-007-0635-7 [17] 牛改利. 根施乙酰胆碱对模拟干旱下烟草抗旱生理及光合特性的影响[D]. 杨凌: 西北农林科技大学, 2019. [18] QIN C, SU Y Y, LI B S, et al. Acetylcholine mechanism of action to enhance tolerance to salt stress in Nicotiana benthamiana[J]. Photosynthetica, 2019, 57(2): 590 − 598. doi: 10.32615/ps.2019.084 [19] 张乐, 郭欢, 包爱科. 盐生植物的独特泌盐结构-盐囊泡[J]. 植物生理学报, 2019, 55(3): 232 − 240. [20] CUSHMAN J C, BOHNERT H J. Molecular genetics of crassulacean acid metabolism[J]. Plant Physiology, 1997, 113(3): 667 − 676. doi: 10.1104/pp.113.3.667 [21] LÓPEZ-BUCIO J, NIETO-JACOBO M F, RAMíREZ-RODRíGUEZ V, et al. Organic acid metabolism in plants, from adaptive physiology to transgenic varieties for cultivation in extreme soils[J]. Plant Science, 2000, 160(1): 1 − 13. doi: 10.1016/S0168-9452(00)00347-2 -




 下载:
下载: