-
近年来,随着鱼类需求量增加和水产养殖业不断扩大,鱼类疾病也在威胁着养殖产业,造成严重的经济损失。集约化生产模式和抗生素的滥用使得鱼类疾病难以得到有效的预防和控制,且抗生素的滥用容易产生负面影响,如水产养殖系统中抗生素抗性基因(ARGs)的转移[1]和耐药细菌的出现;它们对大多数水生生物具有一定毒性,易残留且对生态环境造成破坏[2]。寻找和研发抗生素的替代饲料添加剂是目前水产养殖中亟待解决的重大问题。益生菌是一种已被确定的抗生素替代品。联合国粮食及农业组织 (FAO) 和世界卫生组织(WHO)将益生菌定义为当在动物体内定植一定数量后对机体产生有益影响的活性微生物[3]。胃肠道是一个复杂的环境,有不同的微生物群落聚集,益生菌可以影响肠道微生物群落,减少疾病的发生[4],如细菌数量增加、多样性减少会引起肠道微生物生态失调,导致疾病。动物机体的免疫也与微生物的组成密切相关[5]。
国内外都有许多关于益生菌对鱼类肠道菌群影响的报道,益生菌能够调节肠道微生物组成,改善肠道健康[6]。廖庆钊等[7]在罗非鱼饲料中添加乙醇假丝酵母,结果表明,投喂乙醇假丝酵母后,罗非鱼肠道中梭杆菌门、鲸杆菌属和艾克曼菌属等有益菌群的丰度显著上调,蓝细菌门丰度减少。Hongqin 等[8]研究结果表明,在饲料中添加1×105 CFU·g−1的丁酸梭菌增加了罗非鱼肠道菌群的多样性和有益菌(如芽孢杆菌)的相对丰度,降低了条件致病菌(如气单胞菌)的相对丰度。在大黄鱼幼鱼的饲料中添加丁酸梭菌,改变了大黄鱼幼鱼肠道微生物群结构,降低了肠道微生物多样性;添加丁酸梭菌可有效提高大黄鱼幼鱼肠道中丁酸梭菌的丰度,降低大黄鱼幼鱼肠道中一些潜在致病菌的丰度,对大黄鱼的生长起到促进作用。Goncalves 等[9]在虹鳟鱼基础日粮中添加益生菌,饲喂7 d后,其肠道微生物多样性增加,厚壁菌门和梭杆菌门丰度增加,这两个门的成员具有有益的作用,而变形菌门丰度降低。
如何让益生菌在使用过程中长久发挥作用是目前研究的重要关注点。冷冻干燥是生产干燥菌粉的经典方法,干燥过程在真空、低温下进行,从而减少了热降解[10]。该方法通过冷冻含有细胞的水溶液并干燥,通过升华去除水分,但益生菌可能由于冰晶的形成、高渗透压导致的膜损伤、DNA变性和水分蒸发而损坏细胞[11],因此,为了保护益生菌在脱水过程中不被破坏,在冷冻干燥前添加干燥介质作为保护剂[12]。添加保护剂可以提高益生菌在冷冻干燥和储存过程中的稳定性[13]。保护剂在冷冻干燥过程中极为重要,本研究选定脱脂奶粉、海藻糖、乳糖和蔗糖4种常见保护剂进行筛选,旨在获得最适合耐硼赖氨酸芽孢杆菌(Lysinibacillus boronitolerans,YS11)冷冻干燥的保护剂。目前YS11对罗非鱼肠道微生物菌群的影响尚不清楚,因此,本研究探究YS11对罗非鱼幼鱼肠道微生物菌群的影响,为罗非鱼养殖产业益生菌使用和病原菌防治提供新的思路。
-
罗非鱼作为实验用鱼,鱼苗购自海南宝路水产科技有限公司文笔峰养殖基地,共250尾,初始平均体质量为(1.11±0.26)g。养殖实验在海南省海南大学实验室的玻璃缸(30 cm×30 cm×80 cm)中完成。鱼预先在实验室环境养殖2周,250尾鱼分5缸,每缸各有50尾。在整个实验过程中使用无氯自来水(自来水静置过夜以去除余氯)。
-
将实验室筛选到的耐硼赖氨酸芽孢杆菌16S rDNA数据放入NCBI中比对,发现与YS11有99.83%的相似度。耐硼赖氨酸芽孢杆菌与甘油混合保存于−80 ℃冰箱。菌种复苏使用1% 的菌体接种,采用LB液体培养基进行培养,用分光光度计在600 nm处的吸光度测定菌液浓度。
-
保护剂为5%蔗糖、10%蔗糖、5%海藻糖、10%海藻糖、10%乳糖、20%乳糖、10%脱脂奶粉、20%脱脂奶粉,以1%蛋白胨作为对照组。实验中使用的保护剂均使用无菌蒸馏水溶解,在115 ℃下灭菌15 min。
-
取1% YS11接种于LB液体培养基中,过夜培养16 h,取108 CFU·L−1的菌体,8350 r·min−1,离心15 min,PBS缓冲液洗涤重悬,离心弃上清,分别与1 mL保护剂混合菌悬液,置于10 mL离心管中,防止由于真空条件下液体溢出。先放置于−20 ℃冰箱,预冷12~24 h,再放入−80 ℃冰箱,放置5 h,再放入真空干燥机,−55 ℃,0.061 mar,干燥18 h。冻干粉制备完成后,存储于4 ℃。
冻干粉复苏:取冻干前同等溶液体积的PBS缓冲液重悬冻干粉。室温静置15 min,取100 μL菌悬液稀释涂板,并计算存活率。
细菌存活率=冻干后活菌数 / 冻干前活菌数 ×100。
-
以鱼粉、豆粕为蛋白源,配菜粕、小麦、面粉、磷酸二氢钙、维生素A、维生素D3、维生素E、烟酰胺、D-泛酸钙、硫酸亚铁、硫酸锰、硫酸锌、硫酸铜等,制成42%粗蛋白及6%粗脂肪的基础饲料。在基础饲料中分别添加YS11、发酵液上清、YS11加发酵液上清制备成3种实验饲料,分别记为YS11组、FB组和FLF组,其中含有耐硼赖氨酸芽孢杆菌有效活菌数为107 CFU·g−1。在基础饲料中添加LB液体培养基作为阴性对照组(LB组),以投喂不添加益生菌的基础饲料为空白对照组(Control)。饲料质量与液体配比(w/v)为10∶3。每天配制新鲜饲料,保存于4 ℃冰箱,饲喂前先取出放置至室温再饲喂。1 d饲喂2次,日投喂量为鱼体质量的7%~10%,分别为上午9:00与下午4:00,每天排出50%原有的水,加入新鲜的水,并清理干净罗非鱼的粪便,饲喂周期为70 d。
-
在饲喂70 d后,分别在5组中随机捞取3尾罗非鱼,置于预冷的解剖盘上,解剖取整段肠道,将组织表面血液和结缔组织用预冷的PBS缓冲液冲洗干净,分装于EP管中,液氮速冻,−80 ℃冰箱保存,由北京百迈客生物科技有限公司进行肠道微生物高通量测序。
-
SPSS软件分析保护剂配方优化实验和罗非鱼高通量测序方面的数据 (SPSS Inc.,Chicago, IL, USA)。采用t检验来检测5%显著性水平下的差异。
-
筛选最佳保护剂的浓度(表1),对照组对YS11无法起到保护作用,冻干后存活菌数为(0.03±0.0021)×108 CFU·mL−1,存活率仅有0.19%,远小于其他冻干保护剂的存活率。与对照组相比,4种保护剂均起到了保护细菌免受低温冻伤的情况。不同浓度的保护剂对细菌起到的保护作用也不相同,对比2个蔗糖浓度下的细菌存活率,10%蔗糖组的存活率为9.20%,而5%蔗糖组的存活率为5.86%。对比2个海藻糖浓度下的细菌存活率,10%海藻糖组的存活率为11.48%,而5% 海藻糖组存活率为4.64%。对比2个乳糖浓度下的细菌存活率,10%乳糖组的存活率为9.93%,而20% 乳糖组的存活率为6.84%。对比2个脱脂奶粉浓度下的细菌存活率,10%脱脂奶粉组的存活率为11.16%,而20% 脱脂奶粉组的存活率为2.42%。通过保护剂筛选实验的优化,发现YS11在10%海藻糖的保护下,能够在干燥后保持较高的存活率。
表 1 保护剂对YS11存活率的影响
组别 冻干前/
(109 CFU·mL−1)冻干后/
(108 CFU·mL−1)存活率/% 1%蛋白胨 1.7 ± 0.06 0.03 ± 0.0021 0.19 5% 蔗糖 1.45 ± 0.03 0.85 ± 0.085 5.86 10% 蔗糖 1.45 ± 0.04 1.33 ± 0.071 9.20 5% 海藻糖 1.5 ± 0.1 0.7 ± 0.038 4.64 10% 海藻糖 1.4 ± 0.07 1.61 ± 0.032 11.48 10% 乳糖 1.48 ± 0.06 1.47 ± 0.08 9.93 20% 乳糖 1.37 ± 0.05 0.94 ± 0.081 6.84 10% 脱脂奶粉 1.5 ± 0.08 1.67 ± 0.091 11.16 20% 脱脂奶粉 1.6 ± 0.09 0.39 ± 0.025 2.42 -
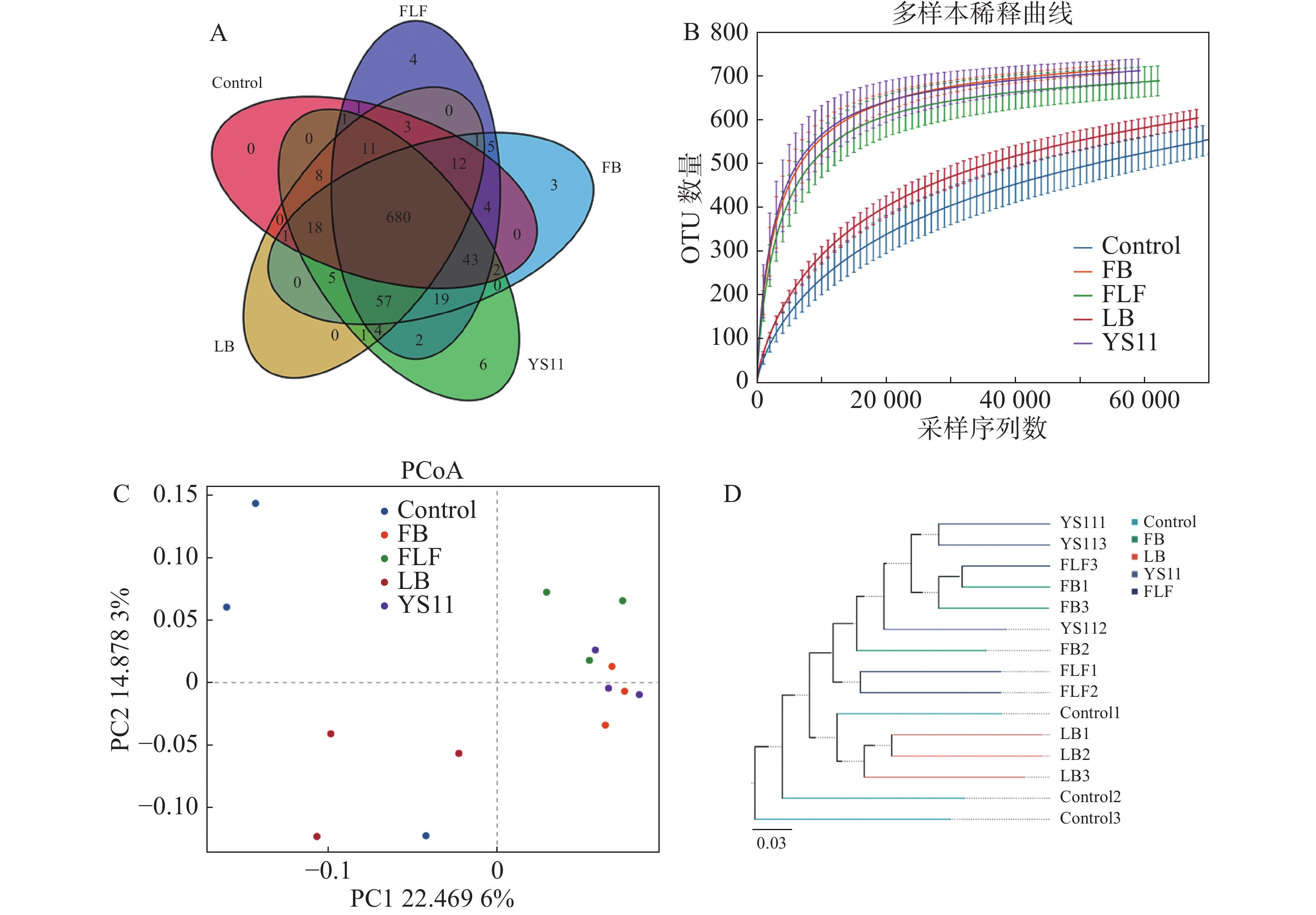
从16S rDNA基因的V3 V4 扩增子中产生1 198 583对Reads,双端 Reads 质控、拼接后共产生 1 195 379 条 Clean Reads,每个样品至少产生 79 369 条 Clean Reads ,平均产生79 692 条 Clean Reads。组装的序列平均长度为410 bp。截止97%的操作分类单位聚类产生了整个数据集的总共10 247个操作分类单位。用α多样性和β多样性对样品内部和样品之间的微生物复杂性进行分析。从维恩图中显示(图1-A),Control组、LB组、YS11组、FB组、FLF组共有特征个数680个OTUs,YS11组、FB组、FLF组中特征个数的OTUs数量分别为6、3和4。从稀释性曲线中(图1 -B),笔者发现15个样本中,YS11组、FB组、FLF组微生物多样性有相似的趋势,接近饱和平台,Control组、LB组微生物多样性有相似的趋势。基于整体群落组成的β多样性分析而言,表明添加YS11后,肠道微生物群的聚集相似程度较高。对10 247个OTUs(按97%序列同一性分组)的UniFrac主坐标分析(PCoA)表明(图1-C),对照组和处理组有明显的分离,且对照最相同处理的样品具有较高的分散性,处理组没有显示出与对照的单独聚类,3个处理组出现较高的聚集。通过非加权组平均法(UPGMA)分析进行样品层次聚类(图1-D),YS11、FB、FLF组的肠道微生物群结构相似,聚集在较高的分支内,而Control组和LB组与处理组不同,聚集在较低的分支内。
-
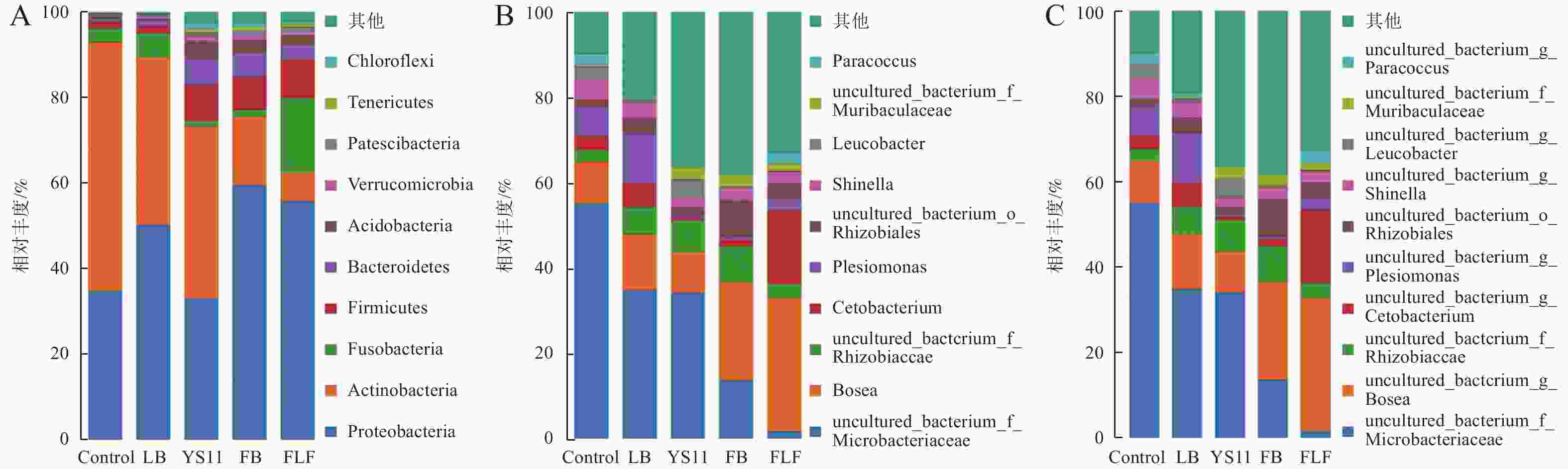
为了确定YS11是如何影响罗非鱼肠道微生物群落,在肠道微生物不同的分类尺度上,比较3组不同处理组的微生物群落差异。在门、属、种水平上最丰富的细菌分类群(前10个)出现在所有鱼类肠道样本中。在门水平上(图2-A),罗非鱼肠道内变形杆菌门(Proteobacteria)、放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)、梭杆菌门(Fusobacteria)构成4个最主要的细菌群落门,其中变形杆菌门在FB组和FLF组的相对丰度高于其他组,在FLF组中厚壁菌门的相对丰度显著高于其他组,其次是拟杆菌门(Bacteroidetes)、酸杆菌门(Acidobacteria)、疣维菌门(Verrucomicrobia)、巴氏杆菌门(Patescibacteria)、软壁菌门(Tenericutes)、绿弯菌门(Chloroflexi)。在属水平上(图2-B),罗非鱼肠道内非培养微杆菌科(uncultured bacterium Microbacteriaceae)、博斯氏菌属(Bosea)、非培养根瘤菌科(uncultured bacterium Rhizobiaceae)、鲸蜡杆菌属(Cetobacterium)为主要细菌属。在种水平上(图2-C),罗非鱼肠道内非培养微杆菌科(uncultured bacterium Microbacteriaceae)、非培养博斯氏菌属(uncultured bacterium Bosea)、非培养根瘤菌科(uncultured bacterium Rhizobiaceae)、非培养鲸蜡杆菌(uncultured bacterium Cetobacterium)为主要细菌种。
-
为了检测罗非鱼肠道中病原菌和益生菌的变化,从肠道微生物属水平菌群相对丰度数据中,计算有益菌和病原菌增加或者减少的读数。结果显示杆菌属、梭菌属在FLF组与对照组相比中存在显著差异,数量增加。放线菌属、双歧杆菌属和乳杆菌属无显著差异(表2)。气单胞菌属和爱德华氏菌属在对照组和处理组中均存在显著差异,数量显著减少,其中爱德华氏菌属在处理组中的数据均降为0(表2)。
表 2 YS11对肠道微生物菌群中益生菌和病原菌增加或减少的读数
/条 Control LB YS11 FB FLF 益生菌 Actinomyces 放线菌属 1±2 2±1 27±18 42±50 29±26 Bacillus 杆菌属 17±10 36±10 114±76 161±172 109±33* Bifidobacterium 双歧杆菌属 7±3 8±5 12±13 27±36 14±9 Fusobacterium 梭菌属 20±8 33±18 179±87 105±70 123±38* Lactobacillus 乳杆菌属 101±45 155±63 802±536 605±330 574±222 病原菌 Aeromonas 气单胞菌属 38±58 231±395 1±1*** 12±4** 8±6* Edwardsiella 爱德华氏菌属 182±313 38±61 0*** 0*** 0*** 注:*代表差异显著;**代表差异极显著;***代表差异显著更甚。 -
本实验在前人研究[14-20]的基础上,采用海藻糖、蔗糖、脱脂奶粉和乳糖作为YS11的保护剂,利用保护剂克服了由于低温对细胞结构破坏导致干燥后存活率低的影响,并筛选出最佳保护剂浓度,结果表明10%海藻糖在保护细菌免受冷冻干燥过程中的损伤较为出色,使细胞在冷冻干燥后仍具有较强的活性,且有利于长期保存。
鱼肠道内环境复杂,由复杂多样的微生物群组成,这些微生物相互作用,影响宿主的各种功能,包括营养、消化发育、免疫和抗病能力[21]。本研究结果表明,通过在基础饲料中添加YS11,可以调节罗非鱼肠道微生物群向更有益的微生物群落发展。由稀释性曲线、PCoA分析和UPGMA分析可知,在OTU水平上,3个处理组与对照组间的微生物群落分布差异较大,对照组间差异较小,且对照组的多样性减少, YS11的菌体和发酵液对罗非鱼肠道微生物群的影响较为相近,可以调节肠道微生物群的结构,增加肠道微生物的多样性和丰度,说明YS11对肠道微生物群发育起到积极作用。本研究结果与前人研究结果相同,即添加益生菌后,能够从稀释性曲线、PCoA分析和UPGMA分析中发现处理组和对照组中存在显著差异。
Hongqin 等[8]在大黄鱼幼鱼期向饲料中添加丁酸梭菌,结果表明在处理组中,幼鱼肠道中的微生物物种丰度下降,显著提高丁酸梭菌属的丰度,降低某些潜在病原菌的丰度。在门水平上,大黄鱼肠道中以变形菌门、厚壁菌门和放线菌门为主要优势菌。在属水平上,检测到雷辛格氏菌、假单胞菌和不明梭状芽孢杆菌为大黄鱼肠道中的优势菌属。在种水平上,耐冷假单胞菌、丁酸梭菌、粪产碱菌成为肠道菌群群落的优势种。Tan等[22]研究报道,从尼罗罗非鱼肠道中分离出的1株菌株为稳定乳杆菌(Rummeliibacillus stabekisii),饲喂8周益生菌后,结果表明,处理组中益生菌相对丰度高,如杆菌属和乳酸菌属显著高于对照组,而病原菌如葡萄球菌和链球菌的相对丰度显著低于对照组。
本研究结果表明,在微生物群落门水平上,变形杆菌门、放线菌门、厚壁菌门、梭杆菌门为最主要的细菌群落门。与对照组相比,处理组放线菌门丰度较低,厚壁菌门和变形菌门丰度较高;在属水平上,处理组博斯氏菌属和鲸醋杆菌属丰度较高,FLF组根瘤菌丰度显著增加。根瘤菌有利于纤维素分解和果胶分解[23],鲸醋杆菌能够抵抗胆汁,代谢肽和碳水化合物产生乙酸[24]。属水平上益生菌和病原菌数量变化的结果发现,与对照组相比,病原菌如爱德华氏菌属和气单胞菌属的丰度下降;益生菌如杆菌属、梭菌属的丰度上升。爱德华氏菌于2013年首次被发现,是侵染全球大多数鱼类的病原体,传播速度快,宿主多,对水产养殖业造成大量经济损失[25]。气单胞菌属中有许多种是危害水产的病原菌,如维氏气单胞菌[26]、嗜水气单胞菌[27]等。结果表明,YS11能够使肠道微生物中的病原菌数量减少,同时使益生菌数量增加。在门水平上,与前人研究结果大致相同,变形菌门的变化有所不同,在属和种水平上,与前人研究结果不同,可能是因为使用的益生菌不同,或者实验鱼不同,对微生物菌群影响也不尽相同。在属水平上, YS11还能够使爱德华氏菌属丰度下降,表现出更好的抑制病原菌的能力,同时促进杆菌属丰度的增加,且促进梭菌属丰度增加,与之前研究结果一致[8,20]。
-
通过研究饲料中添加益生菌耐硼赖氨酸芽孢杆菌YS11,对罗非鱼肠道微生物群落的影响,结果表明,添加益生菌后,肠道微生物群落发生变化,益生菌生存环境得到改善,有利于罗非鱼的生长。本研究的创新点在于探究耐硼赖氨酸芽孢杆菌YS11对罗非鱼肠道微生物群落的影响尚未见报道,本研究的不足在于本实验选取时间点较少。
Screening of protectants for Lysinibacillus boronitolerans and its effects on intestinal microbiota of tilapia
-
摘要: 本研究目的是为了探究耐硼赖氨酸芽孢杆菌(Lysinibacillus boronitolerans,YS11)的保存条件及其对罗非鱼肠道微生物多样性和丰度的影响,为微生物饲料添加剂的研发提供科学依据。选择海藻糖、乳糖、蔗糖和脱脂奶粉4种保护剂,并通过浓度梯度优化筛选最佳保护剂,结果表明,YS11在10%海藻糖中,干燥后保持较高的存活率。罗非鱼幼苗饲喂菌体发酵液,喂养70 d后,通过高通量测序观察YS11对罗非鱼肠道微生物群落的影响,结果表明,添加YS11的处理改变了罗非鱼肠道微生物群及其多样性,提高罗非鱼肠道中有益菌的丰度,降低某些潜在致病菌的丰度。本研究结果证实,10%海藻糖为最佳冷冻干燥保护剂;耐硼赖氨酸芽孢杆菌能够调节肠道微生物群,促进益生菌生长,抑制病原菌生长。Abstract: In order to explore the preservation conditions of Lysinibacillus boronitolerans YS11 and its effect on the diversity and abundance of intestinal microorganisms in tilapia for the research and development of microbial feed additives. Four protectants, i.e. trehalose, lactose, sucrose and skim milk powder, were selected and optimized by concentration gradient. The results confirmed that YS11 maintained a high survival rate after drying in 10% trehalose. Tilapia fingerlings were fed with feeds containing bacterial fermentation broth, and after 70 days of feeding, high-throughput sequencing was performed to observe the effect of the feeds on tilapia intestinal microbial community. The results showed that the feed containing YS11 changed the tilapia gut microbiota and its diversity, increased the abundance of beneficial bacteria in the tilapia gut, and decreased the abundance of some potential pathogenic bacteria. These results confirmed that 10% trehalose was the best freeze-drying protectant. L. boronitolerans can regulate the intestinal microbiota, promote the growth of probiotics, and inhibit the growth of pathogenic bacteria.
-
Key words:
- Lysinibacillus boronitoleran /
- gut microbial community /
- tilapia /
- protectant
-
表 1 保护剂对YS11存活率的影响
组别 冻干前/
(109 CFU·mL−1)冻干后/
(108 CFU·mL−1)存活率/% 1%蛋白胨 1.7 ± 0.06 0.03 ± 0.0021 0.19 5% 蔗糖 1.45 ± 0.03 0.85 ± 0.085 5.86 10% 蔗糖 1.45 ± 0.04 1.33 ± 0.071 9.20 5% 海藻糖 1.5 ± 0.1 0.7 ± 0.038 4.64 10% 海藻糖 1.4 ± 0.07 1.61 ± 0.032 11.48 10% 乳糖 1.48 ± 0.06 1.47 ± 0.08 9.93 20% 乳糖 1.37 ± 0.05 0.94 ± 0.081 6.84 10% 脱脂奶粉 1.5 ± 0.08 1.67 ± 0.091 11.16 20% 脱脂奶粉 1.6 ± 0.09 0.39 ± 0.025 2.42 表 2 YS11对肠道微生物菌群中益生菌和病原菌增加或减少的读数
/条 Control LB YS11 FB FLF 益生菌 Actinomyces 放线菌属 1±2 2±1 27±18 42±50 29±26 Bacillus 杆菌属 17±10 36±10 114±76 161±172 109±33* Bifidobacterium 双歧杆菌属 7±3 8±5 12±13 27±36 14±9 Fusobacterium 梭菌属 20±8 33±18 179±87 105±70 123±38* Lactobacillus 乳杆菌属 101±45 155±63 802±536 605±330 574±222 病原菌 Aeromonas 气单胞菌属 38±58 231±395 1±1*** 12±4** 8±6* Edwardsiella 爱德华氏菌属 182±313 38±61 0*** 0*** 0*** 注:*代表差异显著;**代表差异极显著;***代表差异显著更甚。 -
[1] WANG J H, LU J, ZHANG Y X, et al. Metagenomic analysis of antibiotic resistance genes in coastal industrial mariculture systems [J]. Bioresour Technol, 2018, 189(12): 235 − 43. [2] YANG CHANGWON, SONG GWONHWA, LIM WHASUN. A review of the toxicity in fish exposed to antibiotics [J]. Comp Biochem Physiol C Toxicol Pharmacol, 2020, 237: 108840. doi: 10.1016/j.cbpc.2020.108840 [3] FAO/WHO. Health and nutritional properties of probiotics in food including powder milk with live lactic acid bacteria[R]. Córdoba, Argentina. 2001. [4] SOKOL H, LAY C, SEKSIK P, et al. Analysis of bacterial bowel communities of IBD patients: What has it revealed? [J]. Inflammatory Bowel Diseases, 2008, 14: 858 − 867. doi: 10.1002/ibd.20392 [5] FUESS L, DEN HAAN S, LING F, et al. Immune gene expression covaries with gut microbiome composition in stickleback [J]. mBio, 2021, 12(3): e00145 − 21. [6] 张美玲, 单承杰, 杜震宇. 益生菌与鱼类肠道健康研究进展[J]. 水产学报, 2021(1): 11. [7] 廖庆钊, 陈福艳, 覃雅, 等. 投喂乙醇假丝酵母对罗非鱼生长、免疫和肠道菌群的影响[J]. 南方水产科学, 2021, 17(5): 10 − 17. doi: 10.12131/20200258 [8] LI H, ZHOU Y, LING H, et al. The effect of dietary supplementation with Clostridium butyricum on the growth performance, immunity, intestinal microbiota and disease resistance of tilapia (Oreochromis niloticus) [J]. PLoS One, 2019, 14(12): e0223428. doi: 10.1371/journal.pone.0223428 [9] GONCALVES A T, GALLARDO-ESCÁRATE C. Microbiome dynamic modulation through functional diets based on pre- and probiotics (mannan-oligosaccharides and Saccharomyces cerevisiae) in juvenile rainbow trout (Oncorhynchus mykiss) [J]. J Appl Microbiol, 2017, 122: 1333 − 1347. doi: 10.1111/jam.13437 [10] MIYAMOTO-SHINOHARA Y, SUKENOBE J, IMAIZUMI T, et al. Survival of freeze-dried bacteria [J]. Journal of General & Applied Microbiology, 2008, 54(1): 9 − 24. [11] CONRAD P B, MILLER D P, CIELENSKI P R, et al. Stabilization and preservation of Lactobacillus acidophilus in saccharide matrices [J]. Cryobiology, 2000, 41(1): 17 − 24. doi: 10.1006/cryo.2000.2260 [12] HUBáLEK Z. Protectants used in the cryopreservation of microorganisms [J]. Cryobiology, 2003, 46(3): 205 − 229. doi: 10.1016/S0011-2240(03)00046-4 [13] ZAYED G, ROOS Y H. Influence of trehalose and moisture content on survival of Lactobacillus salivarius subjected to freeze-drying and storage [J]. Process Biochemistry, 2004, 39(9): 1081 − 1086. doi: 10.1016/S0032-9592(03)00222-X [14] CELIK O F, O'SULLIVAN D J. Factors influencing the stability of freeze-dried stress-resilient and stress-sensitive strains of bifidobacteria [J]. J Dairy Sci, 2013, 96: 3506 − 16. doi: 10.3168/jds.2012-6327 [15] MACKENZIE A P. Comparative studies on the freeze-drying survival of various bacteria: gram type, suspending medium, and freezing rate [J]. Developments in Biological Standardization, 1976, 36: 263 − 77. [16] BRENNAN M, WANISMAIL B, JOHNSON M C, et al. Cellular damage in dried Lactobacillus acidophilus [J]. Journal of Food Protection, 1986, 49(1): 47 − 53. doi: 10.4315/0362-028X-49.1.47 [17] LEE J. ATCC preservation methods: freezing and freeze-drying [J]. Journal of Eukaryotic Microbiology, 1992, 39(5): 651 − 651. [18] BRAVO-FERRADA B M, BRIZUELA N, GERBINO E, et al. Effect of protective agents and previous acclimation on ethanol resistance of frozen and freeze-dried Lactobacillus plantarum strains [J]. Cryobiology, 2015, 71(3): 522 − 528. doi: 10.1016/j.cryobiol.2015.10.154 [19] LESLIE S B, ISRAELI E, LIGHTHART B, et al. Trehalose and sucrose protect both membranes and proteins in intact bacteria during drying [J]. Applied & Environmental Microbiology, 1995, 61(10): 78 − 88. [20] CARVALHO ANA S, SILVA JOANA, HO PETER, et al. Effects of various sugars added to growth and drying media upon thermotolerance and survival throughout storage of freeze-dried Lactobacillus delbrueckii ssp. bulgaricus [J]. Biotechnol Prog, 2010, 20(1): 248 − 254. [21] OKOLIEGBE I L, SOLOMON L, DICK A. Exploiting microbial communities associated with marine fish: an indispensable approach to sustainable aquaculture [J]. Nature and Science, 2017, 15(4): 84 − 91. [22] TAN H Y, CHEN S W, HU S Y. Improvements in the growth performance, immunity, disease resistance, and gut microbiota by the probiotic Rummeliibacillus stabekisii in Nile tilapia (Oreochromis niloticus) [J]. Fish & Shellfish Immunology, 2019, 92: 265 − 275. [23] XIA Y, LU M, CHEN G, et al. Effects of dietary Lactobacillus rhamnosus JCM1136 and Lactococcus lactis subsp. lactis JCM5805 on the growth, intestinal microbiota, morphology, immune response and disease resistance of juvenile Nile tilapia, Oreochromis niloticus [J]. Fish & shellfish immunology, 2018, 76: 368 − 379. [24] FINEGOLD S M, VAISANEN M L, MOLITORIS D R, et al. Cetobacterium somerae sp. nov. from human feces and emended description of the genus cetobacterium [J]. Systematic and Applied Microbiology, 2003, 26(2): 177 − 181. doi: 10.1078/072320203322346010 [25] NGUYEN D T, LOPEZ-PORRAS A, MARANCIK D, et al. Genetic characterization of heterologous Edwardsiella piscicida isolates from diverse fish hosts and virulence assessment in a Chinook salmon Oncorhynchus tshawytscha model [J]. J Fish Dis, 2021, 44(12): 1959 − 1970. doi: 10.1111/jfd.13509 [26] ZHANG H, CHEN M, XU Y, et al. An effective live attenuated vaccine against Aeromonas veronii infection in the loach (Misgurnus anguillicaudatus) [J]. Fish & shellfish immunology, 2020, 104: 269 − 278. [27] TOOBA L, SHAHZAD A, ZAHID M, et al. Molecular characterization of Aeromonas hydrophila isolates from diseased fishes in district Kasur, Punjab, Pakistan [J]. Brazilian journal of biology Revista brasleira de biologia, 2022, 84: e254816. -




 下载:
下载: