-
肾茶(Clerodendranthus spicatus)又名肾草、猫须草、猫须公,是唇形科肾茶属多年生草本植物。肾茶全草均可入药,作为传统中药在药用方面有着悠久的历史[1]。在现代医学中,肾茶提取物有多种生物活性,包括肾脏相关疾病治疗及肾脏保护作用[2 − 3],抗炎、镇痛、解热作用[4],抗肿瘤作用[5],抗氧化作用[6],降脂作用和降糖作用等[7]。肾茶还具有延缓衰老的作用,这可能与其抗氧化应激和抗炎作用有关,其中的茶多酚、儿茶素、茶色素等活性成分对慢性肾脏病的进展具有潜在的保护作用[8]。
秀丽隐杆线虫(Caenorhabditis elegans)是独立生活在土壤或水中的常见生物,由于其与人类基因的同源性高达60%~80%,并且其生活史短暂,易于饲养保存,因此,被认为是生物学、医学和毒理学等研究领域中的理想模式生物。近年来,随着抗氧化研究逐渐被关注,秀丽隐杆线虫更是被研究者们青睐[9]。有文献表明,秀丽隐杆线虫已被广泛应用于药物抗氧化、抗衰老作用研究[10 − 12]。
虽然肾茶中富含的黄酮类、酚类成分表明其具有潜在的健康益处,但对肾茶的安全性和健康促进作用进行系统分析较少。因此,本研究以肾茶为主要研究对象,提取制备肾茶乙醇提取物,测定其体外抗氧化活性,并研究其对秀丽隐杆线虫的寿命、生理指标(包括运动能力、脂褐质水平等)的影响,探讨肾茶乙醇提取物的抗氧化活性,以期为肾茶资源的综合开发利用提供理论依据。
-
肾茶由海南大学林学院于旭东副教授提供,采自海南省儋州市宝岛新村海南大学农科基地。野生型秀丽隐杆线虫N2和尿嘧啶缺陷型大肠杆菌OP50,均由美国新泽西州立罗格斯大学(Rutgers University)狄榕老师惠赠。NGM和LB培养基参考文献[13]制作,实验中其他试剂(如 DPPH、ABTS、硫酸镁、氯化钙等)均购自索莱宝公司,均为市售分析纯。
-
肾茶乙醇提取物(KTe)提取方法参考张荣荣等[14]方法并做修改:将干燥的肾茶茎和叶3 kg粉碎后加入12 L 95%(v/v)乙醇浸泡提取3 d(液料比为w肾茶∶v乙醇=4∶1),共提取3次,多层纱布过滤,合并提取液,减压浓缩至无醇味,得到KTe,于4 ℃ 冰箱保存,备用。
-
KTe对DPPH、ABTS自由基清除活性测定参考Huang等[15]方法做部分修改:1)分别取2 mL浓度为0.05、0.1、0.5 、1.25 、2.5 、5 、10 μg·mL−1的KTe溶液,使用维生素C(Vc)作为阳性对照。2)KTe溶液和阳性对照分别与2 mL DPPH、ABTS工作液混匀,避光反应30 min,在紫外分光光度计517 nm(DPPH)、734 nm(ABTS)处测定反应液吸光度,3次重复。3)计算清除率[15]。
-
秀丽隐杆线虫的培养及同步化参考Epstein等[15]方法:以大肠杆菌OP50为食物,采用NGM固体培养基20 ℃培养。在本研究中如无特别说明,将灭活的OP50(65 ℃ , 30 min)涂在NGM平板中进行实验,给药时间为7 d。
-
含药NGM平板制作参考文献[16]方法修改。1)KTe母液的制备:取10 mg的肾茶乙醇提取物加入1 mL的无水乙醇中,配置成10 g·L−1母液,溶解于无水乙醇中,冷藏备用。2)给药方式:同步化后的秀丽隐杆线虫从L4期开始,每天将虫转移到新的培养基上,从而确保秀丽隐杆线虫保持同步,保证食物充足,给药3、7 d后,测定生理指标。3)溶剂对照(SC):使用最大浓度的处理中无水乙醇含量,1%无水乙醇做溶剂对照。
-
寿命实验方法参考文献[17]并做部分修改。同步化后将L4期的秀丽隐杆线虫分别接入20 、50 、100 μg·mL−1浓度下KTe中孵育7 d,每天更换新鲜培养基,以OP50为对照。于第7 d将各组线虫转移至普通NGM培养基上,之后每2 d更换新鲜培养基。每处理10条线虫。每处理重复3次。从转移当天起开始统计线虫存活时间,转移当天记为第0 d。每天观察线虫的生长情况,记录线虫死亡数量,挑出死亡的线虫。直至所有线虫死亡,计算线虫的平均寿命,绘制寿命曲线。
-
同步化后将L4期的秀丽隐杆线虫分别接入20 、50 、100 μg·mL−1 浓度下KTe中孵育7 d,每天更换新鲜培养基,以OP50为对照,每处理10条线虫,每处理重复3次。每日观察记录产卵数及孵化的小虫数量,直至不再观察到线虫产卵为止,计算总产卵数及总孵化数,计算孵化率。
-
同步化后将L4期的秀丽隐杆线虫分别接入20 、50 、100 μg·mL−1浓度下KTe中孵育,以OP50为对照,每天将秀丽隐杆线虫转移到新的NGM平板中。在处理3 d、7 d后进行脂褐素荧光检测。将培养基中的线虫用M9缓冲液转移至1.5 mL离心管中,自然沉降1 min后,弃上清,吸取左旋咪唑溶液(5 mmol·L−1)40 μL于离心管中,麻醉线虫3 min。制作2%琼脂凝胶片,在凝胶片上滴一滴M9缓冲液(20 μL),将挑取线虫移至M9缓冲液滴中,盖片。倒置荧光显微镜观察拍摄线虫肠道脂褐素自发荧光。拍摄条件:激发波长360~370 nm,发射波长420~460 nm,统计分析图片中脂褐素自发荧光强度,每处理10条线虫,每处理重复3次。
-
同步化后将L4期的秀丽隐杆线虫分别接入20 、50 、100 μg·mL−1 浓度下KTe中孵育,以OP50为对照,每天将线虫转移到新的NGM平板中。在处理3 、7 d后计数30 s的咽抽次数。每处理10条线虫,每处理重复3次。
-
选择20 s内头部摆动和身体弯曲次数进行评价,同步化后将L4期的秀丽隐杆线虫分别接入20 、50 、100 μg·mL−1浓度下KTe中孵育,以OP50为对照,每天将线虫转移到新的NGM平板中。于3 、7 d时随机挑取状态良好的秀丽隐杆线虫进行测定。头部摆动次数定义为秀丽隐杆线虫头部从一侧摆动到另一侧,再摆动回最开始的一侧,记为1次;身体弯曲次数定义为秀丽隐杆线虫相对于身体纵轴方向上的1个波长的移动,记为1次。每处理10条线虫,每处理重复3次。
-
同步化后将L4期的秀丽隐杆线虫分别接入20 、50 、100 μg·mL−1 浓度下KTe中孵育,以OP50为对照,每天将线虫转移到新的NGM平板中。在处理3、7 d后测定线虫体长和体宽。用M9缓冲液将秀丽隐杆线虫洗涤并转移到1.5 mL离心管中,静置3 min,弃上清,重复3次。再用M9缓冲液定容至1 mL,将装有秀丽隐杆线虫的1.5 mL离心管转移到55 ℃ 恒温水浴锅中,3 min后秀丽隐杆线虫身体僵直取出离心管于室温静置,然后转移至干净的载玻片上,采用体式显微镜和显微成像系统进行拍照并分析秀丽隐杆线虫的体长和体宽。每处理10条线虫,每处理重复3次。
-
寿命实验所测数据使用用Prism 5软件(美国 GraphPa Software公司)中的Kaplan-Meier生存测定法绘制生存曲线。数据使用Statistical Product Service Solutions(SPSS,IBM公司)软件进行统计学分析。采用Duncan进行单因素方差分析(P≤0.05)采用Tukey’s 方法进行多重比较分析差异显著性(P≤0.05),所有数据均基于平均值±标准差(平均值±SEM)
使用Prism 5生成图形。使用ImageJ 1.51软件分析荧光强度和对孵化量、产卵量、体长、体宽、每20s头部摆动、身体弯曲的次数、荧光强度等数据进行归一化处理。
-
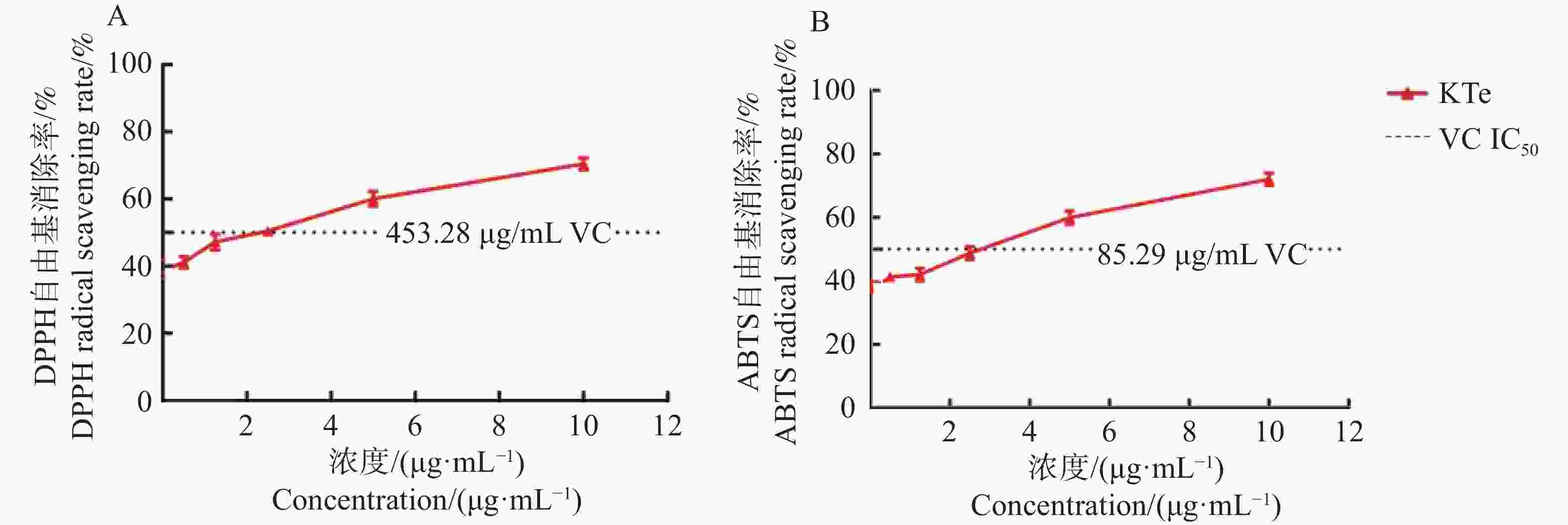
测定加入不同浓度的抗氧化剂或待测样品后的吸光值变化可以筛选自由基清除剂,肾茶提取物可以与DPPH和ABTS自由基反应引起溶液颜色改变,从而导致吸光度的变化。使用DPPH和ABTS自由基清除方法评价肾茶提取物的体外抗氧化活性。由图1可知,KTe对DPPH、ABTS自由基均具有清除作用,且呈一定的量效关系。拟合的自由基清除方程分别为y=1.38x+42.15、y=3.58x+38.87,R2值均大于0.9,根据方程计算KTe在5.69 μg·mL−1对DPPH自由基清除率为50%,在3.11 μg·mL−1 时ABTS自由基清除率为50%。而Vc对DPPH、ABTS产生50 %自由基消除率的浓度分别为453.28 、85.29 μg·mL−1。以上结果表明KTe具有良好的体外抗氧化活性。
-
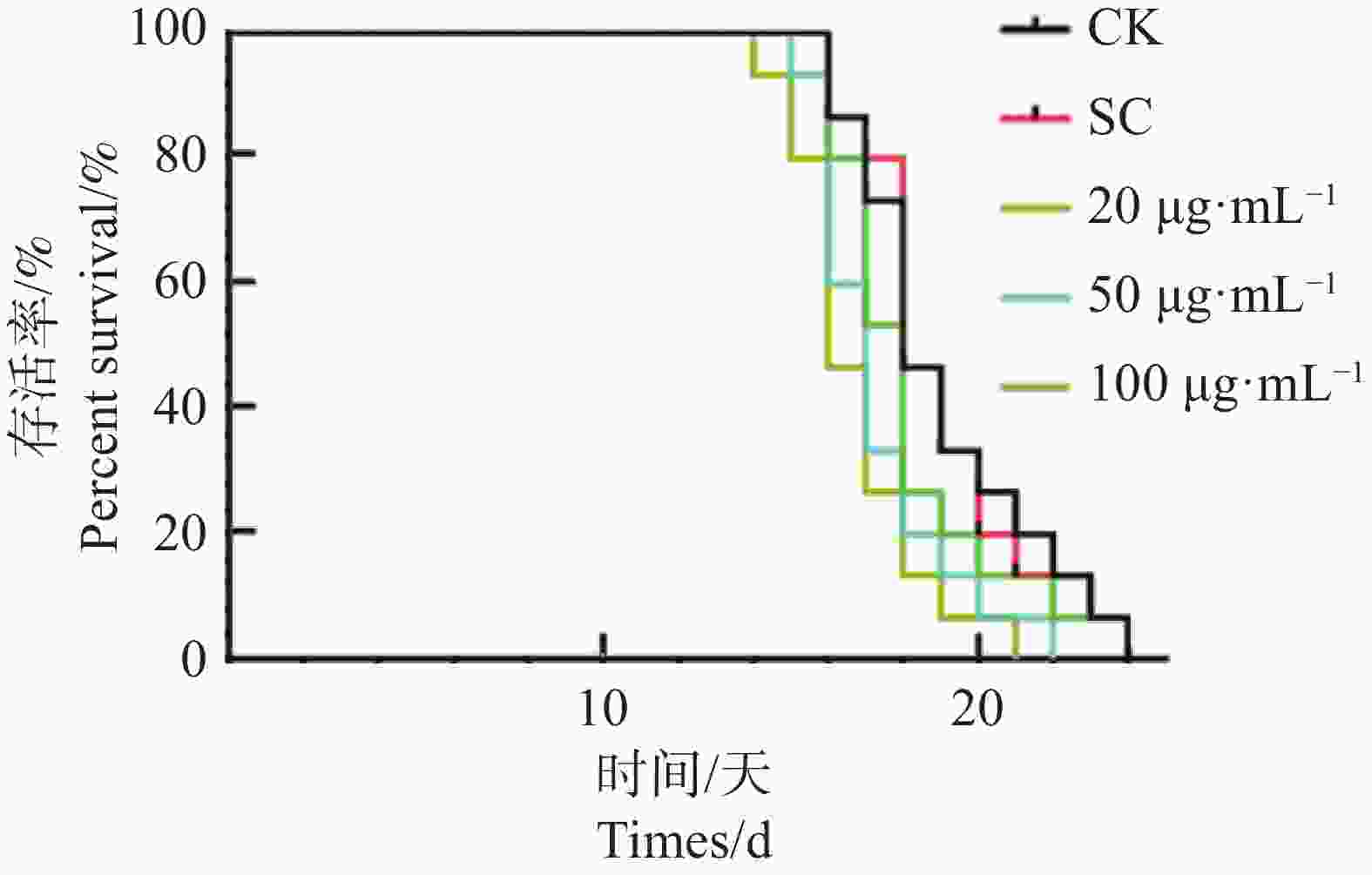
在正常培养条件下,秀丽隐杆线虫寿命约为14~21 d。从KTe对秀丽隐杆线虫寿命的影响结果(图2)可见,各浓度下KTe处理组秀丽隐杆线虫寿命与对照组差异不显著。对照组线虫平均寿命为19.07 d,最大寿命为24 d,SC和20、50、100 μg·mL−1 KTe处理组的线虫平均寿命依次为19.00 、18.20、17.33、16.73 d;最大寿命依次为20、24、22、21 d。以上结果表明KTe对秀丽隐杆线虫无延寿作用,且随着用药浓度增加,秀丽隐杆线虫最大寿命还有所缩短。
-
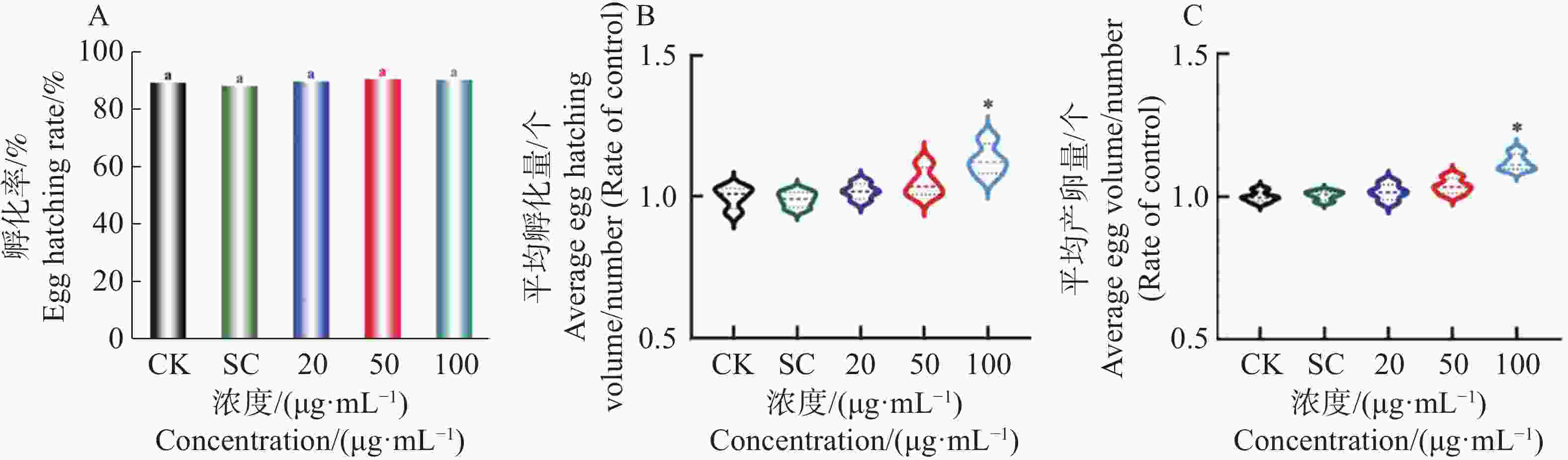
秀丽隐杆线虫的雌雄同体个体的产卵数量和孵化率,不仅可以反映化合物对其生殖毒性的影响,还可能表明该化合物是否具有通过抑制生殖活动来延长秀丽隐杆线虫寿命。测定不同浓度肾茶乙醇提取物对秀丽隐杆线虫产卵量、孵化量以及孵化率的影响结果(图3 B、C)发现,与对照相比,20、50 μg·mL−1肾茶乙醇提取物处理后的线虫产卵量和孵化量无明显差异;100 μg·mL−1肾茶乙醇提取物处理后的线虫产卵量和孵化量有显著性差异提高,所有浓度的肾茶乙醇提取物处理对线虫孵化率均无显著性影响(图3-A )。以上结果可见,KTe不会减弱线虫生殖能力。
-
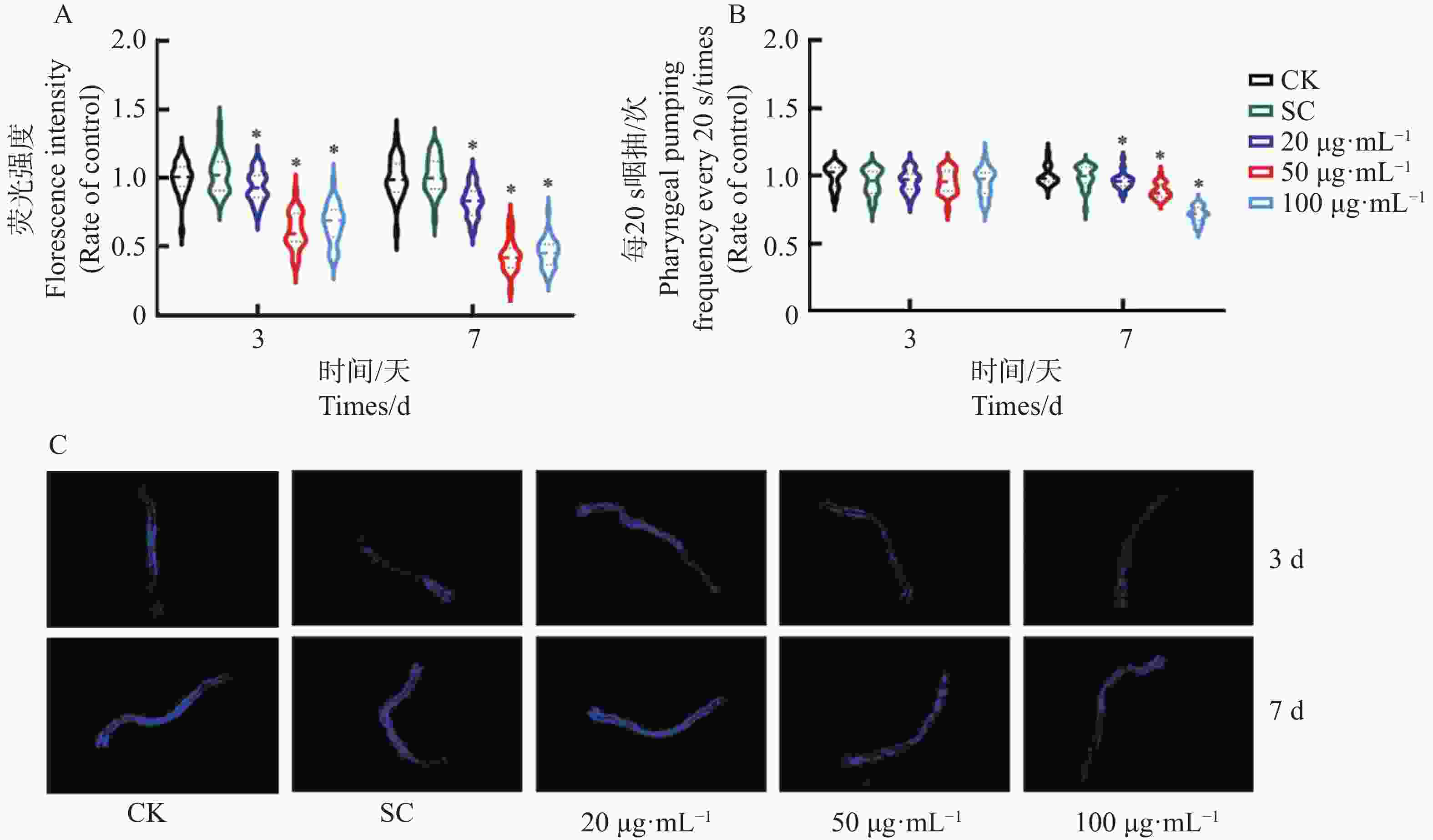
线虫脂褐素含量可反应线虫衰老程度,在荧光条件下,线虫发出的光越亮代表体内积累的脂褐素越多。KTe对秀丽隐杆线虫脂褐素的影响结果(图4-A、C)表明,与对照相比,50、100 μg·mL−1KTe处理3 d后,脂褐素的荧光强度弱且荧光强度显著低于对照组;KTe处理7 d后荧光强度显著低于对照组。以上结果表明,KTe可有效降低线虫在生长期间积累脂褐素的量。
-
咽抽速率能够反应秀丽隐杆线虫摄取食物能力,摄食能力强弱是秀丽隐杆线虫健康水平评价指标。KTe对秀丽隐杆线虫咽抽速率的影响结果(图2-B)发现,KTe处理3 d后,20、50、100 μg·mL−1KTe处理的线虫咽抽次数未出现显著变化;KTe处理7 d后,与对照组相比,KTe处理各浓度每20 s咽抽次数显著性下降,因此秀丽隐杆线虫的咽抽速率显著性下降。以上结果表明,随着用药浓度增加,KTe不会影响低龄线虫的咽抽速率,但随着用药时间增加,KTe会减少老龄线虫咽抽速率。
-
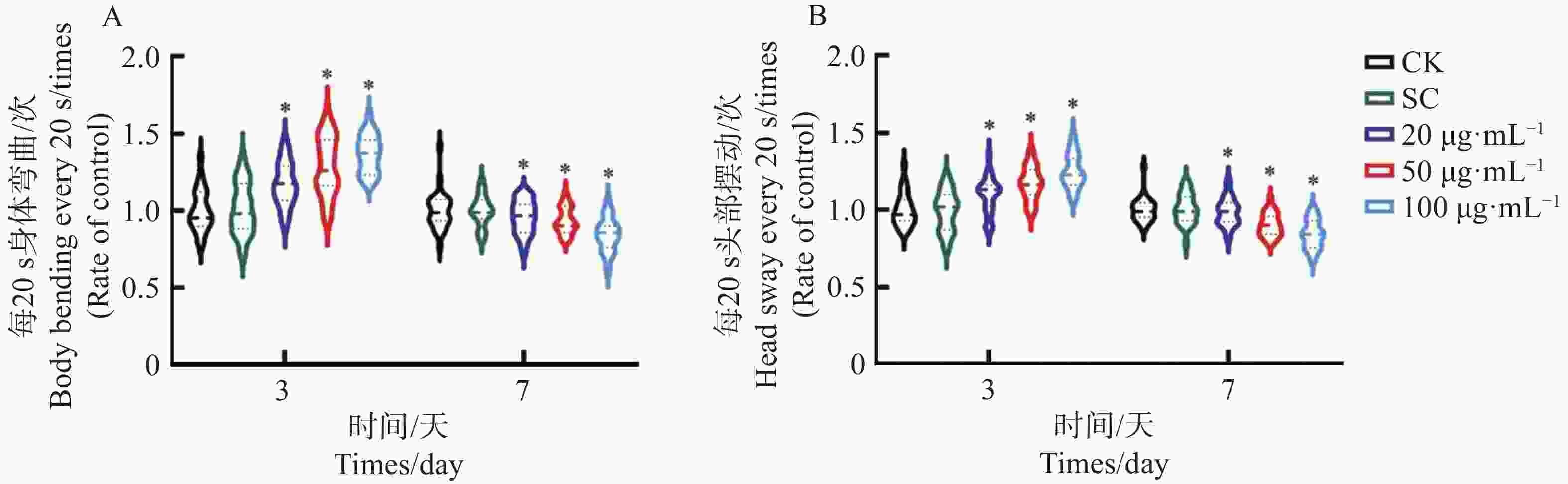
秀丽隐杆线虫的头部摆动和身体弯曲是移动和寻找食物的重要方式。秀丽隐杆线虫的活动随着年龄的增长而减少,在生命的后期,秀丽隐杆线虫对外界刺激变得不敏感,秀丽隐杆线虫头部摆动和身体弯曲的测定结果可以直观反映秀丽隐杆线虫的运动能力和活力。不同浓度肾茶乙醇提取物对秀丽隐杆线虫头部摆动影响的测定结果(图5)表明,使用20 、50、100 μg·mL−1浓度KTe处理线虫3 d后,头部摆动频率均呈上升的趋势,与对照组相比均存在统计学差异(图5-A);使用20 、50 、100 μg·mL−1肾茶乙醇提取物处理线虫7 d后,与对照组相比,各浓度处理组的秀丽隐杆线虫头部摆动和身体弯曲显著减少(图5 -B)。以上结果表明,随着用药浓度增加,KTe能提高低龄线虫的运动活力,随着用药时间增加,KTe会减少老龄线虫运动活力。
-
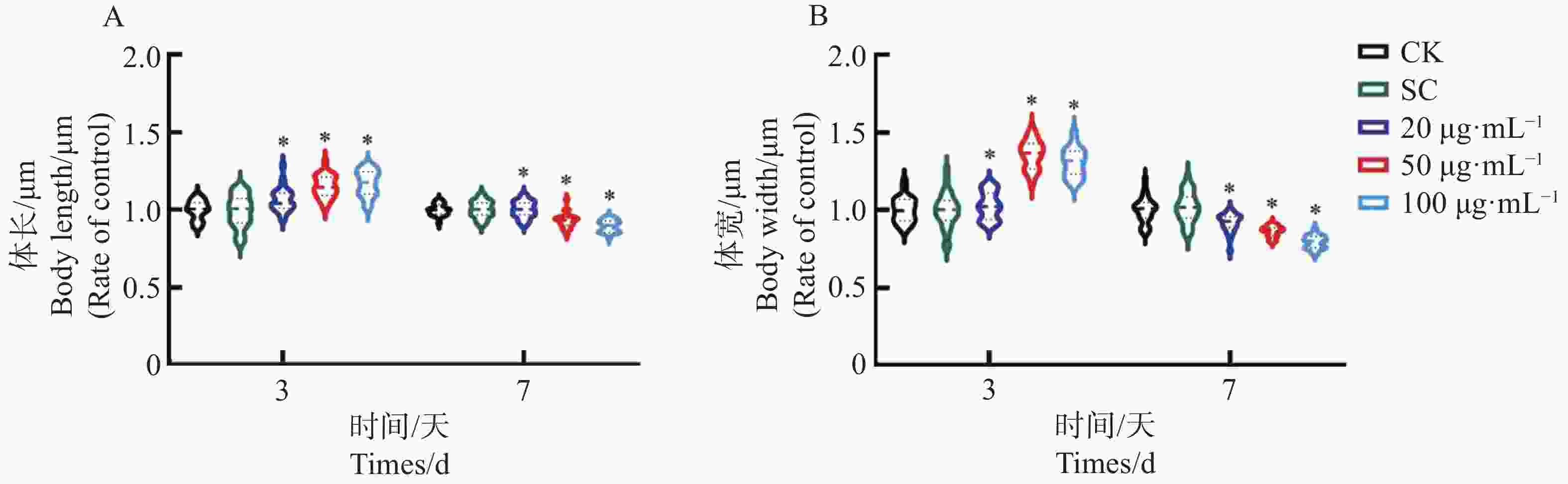
线虫体长体宽可以反应秀丽隐杆线虫的生长发育状态,生长期线虫体长增加,进入衰老期,线虫体长会明显的缩短。KTe对秀丽隐杆线虫体长体宽影响的测定结果(图6A、B)发现,处理3 d,所有浓度的KTe处理组的体长和体宽均呈现上升的趋势,并且与对照组有显著性差异;而处理7 d,所有浓度的KTe处理组的体长与体宽均呈现下降的趋势,并且与对照组相比差异显著。以上结果表明,随着用药浓度增加,KTe会增加低龄线虫的体长和体宽,随着用药时间增加,KTe可减少老龄线虫的体长和体宽。
-
肾茶在医学中起到消炎止痛、抗衰老的效果,
而消炎止痛的作用主要是通过消除自由基来实现的,自由基(Free radical)是指能独立存在,含有未成对电子的原子、原子团、分子或离子。一般认为,机体的新陈代谢过程中会有大量自由基产生,这些自由基引起细胞损伤进而导致衰老,从另一方面来说,衰老是自由基损伤累积的结果,已有研究表明,适当清除自由基可以减少疾病的发生并有效的延长生物的寿命[18 − 19]。本研究测定肾茶乙醇提物(KTe)抗氧化能力发现,KTe对DPPH、ABTS自由基均具有较强的清除作用,且呈一定的量效关系,与前人的研究结果相似[20 − 21]。KTe具有体外抗氧化活性可能是由于肾茶中富含黄酮类化合物,具有较强的抗氧化作用。
近年来,有研究发现一些植物提取物可对秀丽隐杆线虫生长和衰老产生影响,例如,草莓提取物可以延长秀丽隐杆线虫寿命[22]。人参提取物具有广泛的生物活性和对年龄相关疾病有健康益处,也可以延长秀丽隐杆线虫寿命[23]。银杏种仁粉提取物含有丰富的生物碱和黄酮类化合物,可以通过介导脂质代谢和自噬延长秀丽隐杆线虫的寿命[24]。本研究发现KTe有体外抗氧化能力,因此以秀丽隐杆线虫为供试对象,对肾茶乙醇提取物的作用进行了评估,结果显示,给药3 d后,KTe对秀丽隐杆线虫的各项指标如头部摆动、身体弯曲、体长体宽均表现为促进作用,而在给药7 d后,与对照相比,秀丽隐杆线虫脂褐素积累量显著减少,线虫寿命却未增加,所测量的各项指标也均受到抑制,同时,线虫产卵量、孵化量显著减少。分析给药3 d与7 d作用明显不同的原因可能是给药时间太长,导致过量的KTe反而会对线虫产生不良的影响,使得各指标受到抑制,这也可能是在处理7 d后的秀丽隐杆线虫寿命减少的原因。KTe富含的黄酮类、酚酸类化合物起到的抗氧化活性可能是促进秀丽隐杆线虫前期(3 d)运动能力的原因,但秀丽隐杆线虫在长时间暴露于这些化合物环境中(7 d)也会影响产卵量和孵化量,温伟省等[25]提出长期大剂量使用维生素B1、维生素B6、维生素A等均可导致很多的副作用,包括头痛、疲倦、烦躁、食欲减退、腹泻等不良影响。Dam指出虽然适量饮用咖啡与降低2型糖尿病风险相关,但过量摄入咖啡因会对健康产生不良影响[26],因此秀丽隐杆线虫在长时间接触KTe时也会出现不良影响,同时KTe中其他活性成分可能也具有协同作用。
-
KTe具有良好的体外抗氧化活性,具有清除DPPH和ABTS自由基能力。在用药浓度较低且用药时间较短时,KTe对秀丽隐杆线虫咽抽速率无影响,头部摆动、身体弯曲、体长、体宽会得到促进;但当用药浓度较高且用药时间延长,咽抽速率、头部摆动、身体弯曲、体长、体宽都会受到抑制,最终缩短其寿命。此外,在产卵期对秀丽隐杆线虫用药,则会增加其产卵量,而不会影响卵的孵化。本研究结果可为后续肾茶的开发利用提供一定的实验依据。
Antioxidant activity of ethanol extract of kidney tea and its activity against Caenorhabditis elegans
-
摘要: 肾茶(Clerodendranthus spicatus)作为传统中药,具有多种生物活性,近年来,肾茶体外抗氧化活性研究众多,但关于其乙醇提取物在生物体内的抗氧化活性及健康影响研究尚不充分。本研究通过测定肾茶乙醇提取物(KTe)对DPPH、ABTS自由基的清除能力来评价KTe体外抗氧化活性;以秀丽隐杆线虫(Caenorhabditis elegans)作为供试对象,测定KTe对秀丽隐杆线虫的寿命、产卵、孵化情况、脂褐素含量、运动能力等生理指标,以评估体内抗氧化活性。结果表明,KTe具有良好的体外抗氧化活性,能促进低龄线虫各项生理指标,抑制老龄线虫各项生理指标;同时,可使得秀丽隐杆线虫的产卵量显著增加,但对孵化率无显著影响。所获得结果可为后续肾茶开发利用提供参考。Abstract: Clerodendranthus spicatus (Kidney tea, KT), a traditional Chinese medicine, has a variety of biological activities. In recent years there are many studies on the antioxidant activity of kidney tea in vitro, but the research on the antioxidant activity and health effects of its ethanol extract in vivo is not sufficiently documented. In this case, the antioxidant activity of KTe (kidney tea ethanol extract) in vitro was evaluated by measuring the DPPH and ABTS free radical scavenging ability. Caenorhabditis elegans was used to evaluate the antioxidant activity of KTe in vivo. The physiological indexes, such as lifespan, oviposition and hatching, lipofuscin content and movement ability of C.elegans, were determined to evaluate the antioxidant tivity of KTe in vivo. The results showed that KTe had good antioxidant activity in vitro, which could promote the physiological indexes of young nematodes and inhibit the physiological indexes of old nematodes. At the same time, it can significantly increase the number of eggs laid by C.elegans, and has no significant effect on the hatching rate. All these results can provide reference for the subsequent development and utilization of KT.
-
Key words:
- Clerodendranthus spicatus /
- Caenorhabditis elegans /
- ethanol extract /
- antioxidant /
- lifespan.
-
图 3 KTe对秀丽隐杆线虫孵化率(A)、孵化量(B)和产卵量(C)的影响
注:小写字母表示不同组别之间的P≤0.05水平差异显著性,星号表示多组之间差异的显著性(*:P≤0.05,**:0.001≤P≤0.05;***:P≤0.001)
Fig. 3 Effects of KTe on hatching rate( A )、 hatching volume( B )and egg volume( C )of C.elegans
Note: Lowercase letters indicate significance of differences between groups at the P≤0.05 level; the asterisk represents the significance of the difference between multiple groups(*: P≤0.05; **: 0.001≤P≤0.05; ***: P≤0.001)
图 4 KTe对秀丽隐杆线虫健康参数的影响
A : 脂褐素定量;B : 每20s咽抽次数;C : 脂褐素自发荧光代表性图片星号表示多组之间差异的显著性(*:P≤0.05,**:0.001≤P≤0.05;***:P≤0.001)
Fig. 4 Effects of KTe on health parameters of C. elegans
A: Lipofuscin florescence intensity; B: Pharyngeal pumping rate per 20 seconds; C: Representative pictures of lipofuscin autofluorescence The asterisk represents the significance of the difference between multiple groups(*: P≤0.05; **: 0.001≤P≤0.05; ***: P≤0.001)
-
[1] 陈玉链, 谢丽萍, 梁嘉仪, 等. 猫须草治疗慢性肾脏病用药规律[J]. 中医学报, 2023, 38(4): 891 − 895. doi: 10.16368/j.issn.1674-8999.2023.04.147 [2] 王锐, 李云然. 肾茶的化学成分、生物活性及临床应用研究进展[J]. 广东化工, 2020, 47(3): 92 − 93. doi: 10.3969/j.issn.1007-1865.2020.03.042 [3] ASHRAF K, SULTAN S, ADAM A. Orthosiphon stamineus benth. is an outstanding food medicine: review of phytochemical and pharmacological activities[J]. Journal of Pharmacy and Bioallied Sciences, 2018, 10(3): 109 − 118. doi: 10.4103/JPBS.JPBS_253_17 [4] YAM M F, TAN C S, AHMAD M, et al. Vasorelaxant action of the chloroform fraction of Orthosiphon stamineus via NO/cGMP pathway, potassium and calcium channels[J]. The American Journal of Chinese Medicine, 2016, 44(7): 1413 − 1439. doi: 10.1142/S0192415X16500798 [5] AHAMED M B K, AISHA A F A, NASSAR Z D, et al. Cat’s whiskers tea (Orthosiphon stamineus) extract inhibits growth of colon tumor in nude mice and angiogenesis in endothelial cells via suppressing VEGFR phosphorylation[J]. Nutrition and Cancer, 2012, 64(1): 89-99. doi: 10.1080/01635581.2012.630160(查阅网上资料,斜体信息不确定,请确认) [6] YAM M F, BASIR R, ASMAWI M Z, et al. Antioxidant and hepatoprotective effects of Orthosiphon stamineus benth[J]. The American Journal of Chinese Medicine, 2007, 35(1): 115 − 126. doi: 10.1142/S0192415X07004679 [7] 洪霖, 邹小燕, 张禧燕, 等. 肾茶及其活性提取物治疗肾脏相关疾病现代研究进展[J]. 中草药, 2022, 53(24): 7970 − 7979. doi: 10.7501/j.issn.0253-2670.2022.24.035 [8] LOKMAN E F, SAPARUDDIN F, MUHAMMAD H, et al. Orthosiphon stamineus as a potential antidiabetic drug in maternal hyperglycemia in streptozotocin-induced diabetic rats[J]. Integrative Medicine Research, 2019, 8(3): 173 − 179. doi: 10.1016/j.imr.2019.05.006 [9] 刘传铃, 王佳贺. 秀丽线虫衰老模型及机制的研究进展[J]. 国际老年医学杂志, 2020, 41(5): 326 − 330. doi: 10.3969/j.issn.1674-7593.2020.05.015 [10] 李美霖, 王平, 尹灿, 等. 山茱萸多糖延缓秀丽隐杆线虫衰老的药效评价及机制研究[J]. 食品安全质量检测学报, 2022, 13(21): 6996 − 7003. doi: 10.19812/j.cnki.jfsq11-5956/ts.2022.21.025 [11] 袁梦, 阙斐, 肖楚翔, 等. 基于秀丽隐杆线虫模型的樱桃乙醇提取物抗衰老作用研究[J]. 食品工业科技, 2023, 44(13): 375 − 382. doi: 10.13386/j.issn1002-0306.2022070218 [12] 曾智康, 朱晨, 魏瑞霖, 等. 桑椹果粉乙醇提取液对秀丽隐杆线虫衰老的影响及机制[J]. 食品工业科技, 2023, 44(3): 414 − 420. doi: 10.13386/j.issn1002-0306.2022040230 [13] HODGKIN J, DONIACH T. Natural variation and copulatory plug formation in Caenorhabditis elegans[J]. Genetics, 1997, 146(1): 149 − 164. doi: 10.1093/genetics/146.1.149 [14] 张荣荣, 梅文莉, 黄圣卓, 等. 海南栽培肾茶的化学成分研究[J]. 热带亚热带植物学报, 2017, 25(2): 182 − 188. doi: 10.11926/jtsb.3676 [15] HUANG D S, LI C, CHEN Q, et al. Identification of polyphenols from Rosa roxburghii Tratt pomace and evaluation of in vitro and in vivo antioxidant activity[J]. Food Chemistry, 2022, 377: 131922. doi: 10.1016/j.foodchem.2021.131922 [16] EPSTEIN H F, WATERSTON R H, BRENNER S. A mutant affecting the heavy chain of myosin in Caenorhabditis elegans[J]. Journal of Molecular Biology, 1974, 90(2): 291 − 300. doi: 10.1016/0022-2836(74)90374-X [17] ZHAO X, FU K, XIANG K P, et al. Comparison of the chronic and multigenerational toxicity of racemic glufosinate and L-glufosinate to Caenorhabditis elegans at environmental concentrations[J]. Chemosphere, 2023, 316: 137863. doi: 10.1016/j.chemosphere.2023.137863 [18] WANG Y H, YANG J Y, LI X, et al. Optimization of the process of extracting polysaccharides from Agrocybe aegerita and in vitro antioxidant and anti-aging tests[J]. Molecules, 2024, 29(21): 4992. doi: 10.3390/molecules29214992 [19] PIETSCH K, SAUL N, CHAKRABARTI S, et al. Hormetins, antioxidants and prooxidants: defining quercetin-, caffeic acid- and rosmarinic acid-mediated life extension in C. elegans[J]. Biogerontology, 2011, 12(4): 329 − 347. doi: 10.1007/s10522-011-9334-7 [20] 李晓花, 陈蕾西, 牛迎凤, 等. 肾茶多酚提取工艺及其抗氧化活性研究[J]. 天然产物研究与开发, 2016, 28(2): 257 − 261. doi: 10.16333/j.1001-6880.2016.2.016 [21] 薛惠琴, 蔡旋, 熊慧慧, 等. 猫须草不同部位主要营养成分及抗氧化能力比较[J]. 上海农业学报, 2016, 32(3): 30 − 35. doi: 10.15955/j.issn1000-3924.2016.03.06 [22] NAVARRO-HORTAL M D, ROMERO-MÁRQUEZ J M, ESTEBAN-MUñOZ A, et al. Strawberry (Fragaria× ananassa cv. Romina) methanolic extract attenuates Alzheimer’s beta amyloid production and oxidative stress by SKN-1/NRF and DAF-16/FOXO mediated mechanisms in C. elegans[J]. Food Chemistry, 2022, 372(15): 131272. doi: 10.1016/j.foodchem.2021.131272 [23] WANG H, ZHANG S, ZHAI L, et al. Ginsenoside extract from ginseng extends lifespan and health span in Caenorhabditis elegans[J]. Food Function., 2021, 12(15): 6793 − 6808. doi: 10.1039/d1fo00576f [24] SHEN N, ZENG W, LENG F, et al. Ginkgo seed extract promotes longevity and stress resistance of Caenorhabditis elegans[J]. Food & Function, 2021, 12(24): 12395 − 12406. doi: 10.1039/d1fo02823e [25] 温伟省. 维生素类药物滥用的危害及合理使用分析[J]. 中国医药指南, 2015, 13(14): 297 − 298. doi: 10.15912/j.cnki.gocm.2015.14.231 [26] VAN DAM R M, HU F B, WILLETT W C. Coffee, caffeine, and health[J]. New England Journal of Medicine, 2020, 383(4): 369 − 378. doi: 10.1056/NEJMra1816604 -

 点击查看大图
点击查看大图
计量
- 文章访问数: 531
- HTML全文浏览量: 282
- 被引次数: 0



 下载:
下载: