-
无形体属立克次体目(Rickettsiales)无形体科(Anaplasmataceae)无形体属(Anaplasma),是一种重要的蜱传病病原,可引起人或动物的无形体病(Anaplasmosis)[1 − 2]。其中,无形体属下的扁平无形体(Anaplasma platys,A. platys)和嗜吞噬细胞无形体(Anaplasma phagocytophilum,A. phagocytophilum)研究并消除其对人类和伴侣动物构成的巨大威胁,具有重要的人兽共患和公共卫生意义[3 − 4]。A. platys主要感染犬的血小板,导致犬循环性血小板减少症[5 − 6]。病犬会出现发热、嗜睡、食欲下降、体质量减轻以及淋巴结肿大等非特异症状[7]。尽管没有明确证据表明A. platys可以感染人,但近年来有病例报告指出,临床兽医和伴侣犬主人具有感染A. platys的风险[8 − 10],这进一步强调了A. platys对公共卫生的潜在威胁。A. phagocytophilum则主要侵染宿主的中性粒细胞和嗜酸性粒细胞,引起人或犬的粒细胞无形体病[6 − 7]。感染A. phagocytophilum后宿主会表现出发热、腹泻以及意识模糊等非特异症状,部分病患还会出现运动障碍和消化道症状[11 − 12]。
无形体广泛分布于美洲、欧洲和亚洲等地区。例如,在美国的部分地区,7.6%的乡村伴侣犬通过PCR检出感染A. phagocytophilum,欧洲地区的工作犬和流浪犬中的检出率达11%[13];巴西地区A. platys的检出率达15.5%[14],加勒比地区的这一数值可达18.7%[15]。无形体在热带和亚热带地区的流行率普遍更高。例如,犬无形体的血清抗体流行率在缅甸为26.0%,在中国台湾地区为21.1%,在马来西亚为29.0%[16 − 18]。相比之下,位于温带的大部分国家或地区的犬无形体抗体流行率在10%以下[13, 19]。作为一种重要的蜱传病病原,无形体的分布和传播受多种因素影响,其中蜱虫的分布是关键因素之一。血红扇头蜱是无形体的主要传播媒介,因其对环境极强的适应性而广泛分布于世界各地,尤其是热带和亚热带地区[20 − 21],这也解释了上述地区无形体流行率较高的现象。此外,犬的饲养密度以及自身属性(如年龄、品种以及用途等)等因素也会对无形体的传播和分布产生影响[22 − 23]。
海南省是典型的热带亚热带地区,适宜的温度、湿度以及丰富的植被覆盖为蜱虫的生长和发育提供了优良条件[24],这导致海南省内人与动物面临较高的虫媒病风险。迄今为止,针对海南地区伴侣犬无形体病的流行病学调查研究数据非常缺乏,因此,本研究通过调查海口地区伴侣犬无形体抗体的血清流行率,并对其相关风险因素进行初步分析,旨在进一步了解犬无形体病在海南地区的流行情况。在伴侣犬数量迅速增长的大背景下,本研究结果有望为人兽共患无形体病的防控策略制定提供科学依据。
-
2023年3月至2024年3月期间,从海口地区9家动物医院招募受试伴侣犬,所有受试犬的血液样本与临床信息采集均征得犬主知情同意。采样过程的所有操作符合海南大学动物伦理操作规范。调查前根据研究需求设计问卷,在血液样本采集当天由采样人员询问主人回答问卷中的问题。调查问卷包括受试犬的基本信息、户外活动情况、驱虫史、其他信息以及相关临床病史5个部分构成,详细问询内容见表1。
表 1 临床信息调查问卷内容
Table 1. Clinical information questionnaire content
问卷内容
Questionnaire content具体问题
Specific question基本信息
Signalment出生日期
Date of birth品种
Breed性别
Sex户外活动情况
Activities外出活动史
Out-going activities history外出活动地点
Outdoor activity location旅游史
Traveling history驱虫史
Parasite control history外寄生虫感染情况
External parasite infestation history体外驱虫情况
External parasite control其他信息
Other information居住环境是否饲养其他伴侣动物
Co-pet family status受试犬来源
Acquisition source相关临床病史
Related disease history根据主人主诉记录相关病史信息
Disease history based on owner’s statements -
SNAP 4Dx Plus 床旁检测试剂盒(美国IDEXX有限公司)。
-
台式高速冷冻离心机(德国 Eppendorf);立式压力蒸汽灭菌锅(鸡西市辰丰医疗器械制造有限公司);超低温冰箱(海尔集团);S1010掌上离心机(美国赛洛捷克)。
-
从动物臂头静脉采血后,将血液样本置于不含抗凝剂的采血管中,静置10 min后3 000 r·min−1离心5 min,分离血细胞和血清,并在−80 ℃条件下长期储存。
-
将SNAP 4Dx Plus试剂盒中的所有试剂从冰箱取出后在室温下复温30 min,使用试剂商提供的巴氏滴管,取3滴血清样本至样品管中,随后向其中滴加4滴预混液,颠倒混匀并使用掌上离心机瞬时离心后,将样品管中所有液体转移至试剂盒的样品孔中,待液体流过结果窗,到达指定位置后按下激活装置,8 min后读取结果。
-
使用Excel(Microsoft Excel 2013)整理保存数据信息,并将问卷信息整理精简,供后续数据分析使用。
-
使用R(R version 4.3.2)和R Studio(R Studio version 2023.12)对调查问卷所采集的临床信息进行统计分析。首先,通过对二分类变量进行单因素逻辑回归分析和对多分类变量进行似然比检验,识别出潜在的风险因素(统计学显著性水平定义为P<0.25)。随后,将筛选出的所有因素纳入多因素逻辑回归分析中,通过计算方差膨胀因子(VIF)判断因素之间的共线性(阈值定义为VIF<10),并采用后向逐步回归法剔除不显著的变量。最终通过保留P<0.05的显著变量识别出对结果有重要影响的风险因素。模型结果以各水平的系数、P值、优势比(OR)及其95%置信区间(95% CI)的方式呈现。此外,最终模型的拟合优度通过皮尔森卡方检验(Pearson Chi-square Test)、赤池信息准则(AIC)和贝叶斯信息准则(BIC)进行评估,其中皮尔森卡方检验的统计学显著性水平定义为P<0.05。
-
在研究期间,共对184只受试犬的血液样本进行了无形体抗体检测,所有血液样本均记录了采样地点和时间。其中128只受试犬的临床数据信息完整,可用于相关风险因素分析。这128只受试犬的平均年龄为3.6岁。根据其他文献报道,本研究将犬分为幼年犬(≤2岁)、成年犬(2~7岁)、中年犬(7~13岁)以及老年犬(≥13岁)4个年龄,其中成年犬占比最大,达51.2%;幼年犬次之,占30.7%;中年犬和老年犬的比例相对较少,分别为17.3%和0.8%。性别组成方面,雄性犬65只,雌性犬63只。在所有调查的犬品种中,贵宾犬占比最高,达26.6%,随后为比熊犬和柯基犬,分别占18.0%和13.3%。
-
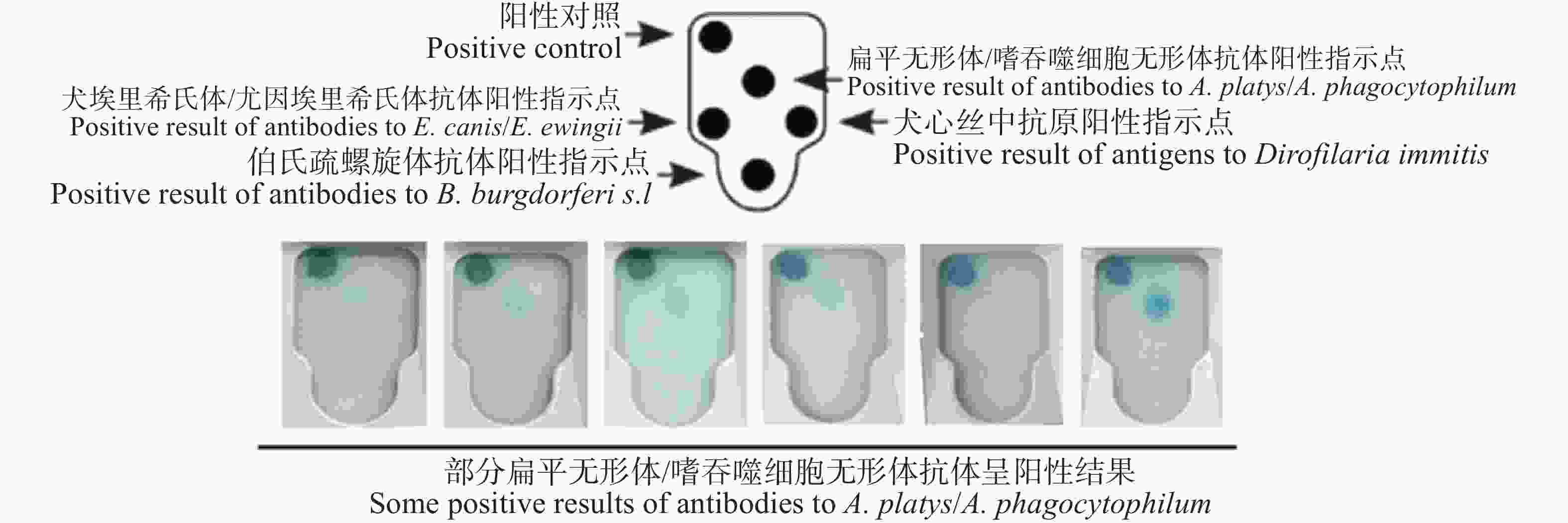
根据SNAP 4Dx Plus试剂盒说明书,该试剂盒可对A. phagocytophilum/A. platys抗体进行检测,部分阳性检测结果如图1所示。通过对海口地区184份血液样本进行检测,发现A. phagocytophilum/A. platys抗体的流行率为7.1%,9家动物医院的阳性率见表2。
表 2 海口地区伴侣犬SNAP 4Dx Plus 检验阳性率
Table 2. Positive rate of SNAP 4Dx Plus test for companion dogs in Haikou area
采样医院
Sampling hospital阳性率/% [阳性数量(个)/总数(个)]
Positive rate/%(Number of
positives/Total number)HKH01 2.0(1/49) HKH02 8.5(4/47) HKH03 14.3(4/28) HKH04 0(0/15) HKH05 11.1(2/18) HKH06 15.4(2/13) HKH07 0(0/6) HKH08 0(0/6) HKH09 0(0/2) 合计
Total7.1(13/184) -
通过对犬年龄、性别、品种、户外活动史、蜱虫叮咬史、体外驱虫情况、所处环境中是否有其他伴侣动物、来源以及旅游史等变量进行分析,识别出潜在的风险因素,分析结果见表3。通过单因素逻辑回归分析和似然比检验发现,犬的年龄、性别、蜱虫叮咬史以及体外驱虫情况可能和无形体血清抗体检测结果存在关联。
表 3 变量筛选
Table 3. Variable filtering
变量
Variable水平
Level样本数量/个
Number of positive/ind阳性数量/个 (阳性率/%)
Number of positive/ind
(positive rate/%)P 值
P value年龄
Age幼年犬
Puppies/Juveniles/Young39 2(5.1) 0.13* 成年犬
Mature65 5(7.7) 中年犬
Senior22 2(9.1) 老年犬
Geriatric1 1(100.0) 性别
Sex雄性
Male65 7(10.8) 0.22* 雌性
Female63 3(4.8) 品种
Breeds纯种犬
Purebred110 9(8.2) 0.70 混血犬
Mixed-breed18 1(5.6) 户外活动史
Out-going history无
No8 0(0.0) 0.99 有
Yes118 10(8.5) 蜱虫叮咬史
Tick infestation history否
No70 2(2.9) 0.01* 是
Yes33 7(21.2) 不清楚
Unclear23 1(4.3) 体外驱虫情况
External parasite control否
No11 2(18.2) 0.21* 是
Yes115 8(7.0) 所处环境中有其他伴侣动物
Co-pet status否
No72 6(8.3) 0.83 是
Yes55 4(7.3) 来源于动保中心收养或流浪动物
Stray or shelter dog否
No105 8(7.6) 0.80 是
Yes17 1(5.9) 旅游史
Traveling history无
No50 2(4.0) 0.31 仅有海南岛内旅游史
Only in the province40 5(12.5) 海南岛外旅游史
In and out of the province33 2(6.1) 注:*指具有统计学意义的潜在风险因素(P<0.25)。
Note: * refers to the variables significant at P < 0.25. -
将单因素逻辑回归分析和似然比检验所得到的潜在风险因素全部纳入多因素逻辑回归分析中。结果显示,所有纳入多因素逻辑回归分析的变量的VIF值均小于10,表明这些变量不存在明显的共线性问题。通过模型优化,最终得到仅含有“蜱虫叮咬史”风险因素的模型。模型表达式如公式(1)所示。
$$ \mathrm{ln}\left(\frac{P}{1-P}\right)=-3.53+2.21\times {x}_{1}+0.53\times {x}_{2} $$ (1) 式中,P表示无形体血清抗体检测为阳性的可能性;
$ \dfrac{P}{1-P} $ 反映了无形体血清抗体检测呈阳性相对于阴性的几率;x则需要根据不同的情况赋予不同的值,当没有蜱虫叮咬史时,$ {x}_{1} $ 和$ {x}_{2} $ 值均取0;当有蜱虫叮咬史时,$ {x}_{1} $ 值取1,$ {x}_{2} $ 值取0;当不清楚是否有蜱虫叮咬史时,$ {x}_{1} $ 值取0,$ {x}_{2} $ 值取1。此外,由最终模型得出的表达式计算显示,有蜱虫叮咬史犬检出无形体抗体阳性的概率为21.2%,并通过计算OR值,可得出有蜱虫叮咬史的犬检出无形体抗体阳性的可能性是无蜱虫叮咬史犬的9倍。最终模型中该风险因素在不同水平下的系数、P值、OR值及其95%置信区间如表4 所示。
表 4 最终模型中各风险因素下不同水平的系数、P值、OR 值及其95%CI
Table 4. The coefficients, P values, OR values and their 95% CIs at different levels of each risk factor in the final model
变量
Variable水平
Level系数
CoefficientP值
P valueOR值(95%CI)
OR value(95% CI)蜱虫叮咬史
Tick infestation history否
No参考
Reference是
Yes2.21 0.01* 9.15(2.06,64.20) 不清楚
Unclear0.53 0.67 1.70(0.08,18.65) 注:*指具有统计学意义的潜在风险因素(P<0.05)。
Note: * refers to the variables significant at P < 0.05.使用皮尔森卡方检验、AIC和BIC对最终模型的拟合优度进行评估。结果显示,皮尔森卡方统计量为124,P值为0.41。AIC值为66.31,BIC值为74.77,和其他模型相比,两者均为最低值。上述结果表明,相较于其他模型而言,最终模型对数据的拟合较好,能够较好地解释数据中的变异性。
-
本研究通过调查海南省海口地区伴侣犬无形体血清抗体的阳性率,初步明确了海口地区无形体血清抗体的流行情况,流行率可达7.1%,这一结果和同处于热带和亚热带地区的哥斯达黎加(6.4%)、巴西(9.8%)以及巴基斯坦(6.4%)的结果相似[25 − 27],但低于周边国家或地区先前报道的数据(21.1%~29.0%)[16 − 18]。导致这种差异的原因一方面是研究对象的不同,另一方面是研究地点的差异。部分研究的调查主体为流浪犬,并纳入了众多非城市地区。与生活在城市的伴侣犬相比,流浪犬或在乡村居住的伴侣犬更加频繁地接触外界环境,且接受医疗检查的机会有限,导致其患虫媒病的概率更高。有研究分别于2012年和2017年对北京、长沙、成都、福州等21个城市的伴侣犬进行了无形体血清抗体的流行率调查,发现除了福州(10.0%)和厦门(8.6%)外,其余地区的流行率均低于本研究结果[28 − 29]。这可能是由于中国南方沿海地区温暖潮湿的气候特点,导致相关蜱类种群的高丰度,从而增加了犬无形体病的患病风险。这表明在适宜蜱虫生长的地区,需要进一步加强虫媒病的防控措施。
本研究结合动物的临床数据,采用与其他研究一致的分类方式,对年龄、体外驱虫状况等因素进行分析,以探讨与无形体抗体阳性结果相关的风险因素[30 − 31]。通过单因素逻辑回归分析,发现犬的年龄、性别、体外驱虫情况以及蜱虫叮咬均会影响无形体血清抗体的检测结果。其中,无形体抗体阳性的年龄偏好与其他研究的结论类似,即老年犬对无形体的易感性较高[31 − 32]。其原因在于与青年犬相比,年龄较大的犬暴露于外界环境的时间更长,增加了媒介生物寄生和感染相关病原的可能[32]。而无形体血清抗体阳性结果的雄性倾向,则可能与雄性群体的行为有关。这些行为使其更容易与蜱虫接触,进而增加感染风险[31]。在多因素逻辑回归分析中,蜱虫叮咬史与无形体血清抗体检测结果呈显著关联,即有蜱虫叮咬史的犬检出无形体抗体阳性的可能性显著高于无蜱虫叮咬史的犬,这一结论和大多数研究一致,进一步证实了蜱虫作为病媒生物的重要角色[22, 30, 33 − 34]。
动物来源和生活环境是影响病原传播的重要因素之一,例如居住在乡村的犬因其接触环境更加多样,户外活动更为频繁,其患虫媒病的风险也会更高[35]。基于这一假设,本研究调查了动物来源和无形体血清抗体阳性结果之间的关系,结果发现,两者之间并没有显著关联。这可能是由于受到了样本量的限制[25]。另一个原因可能为调查过程中未充分考虑动物进入家庭时的年龄。如果动物在幼龄阶段进入家庭,其在高风险环境中的暴露时间有限,接触虫媒和虫媒病病原的机会也会相应减少,一定程度上削弱了动物来源与虫媒病感染风险之间的关联性。此外,犬的饲养密度也是影响虫媒病传播的风险因素之一,同一环境中共同生活的犬数量越多,动物感染虫媒病的风险越大,这可能和蜱虫的生活史和病原在蜱虫中的传播方式有关[22]。为了验证伴侣犬饲养密度和无形体血清抗体结果之间的关联,本研究纳入了“多宠家庭”这一因素,然而结果显示二者并无显著关联。血红扇头蜱属于三宿主蜱,即蜱虫生长发育的3个阶段需要在3个不同的宿主上寄生发育才能完成[36]。在本研究采集的临床信息中,大部分家庭的养犬数量并未超过3只,这可能意味着单个家庭的犬数量不足以支持蜱虫完成完整的生活周期,从而影响病原的传播效率。
本研究使用的床旁检测试剂盒是针对无形体p44/MSP2蛋白所产生的IgG和IgM抗体所设计的,该试剂盒目前广泛应用于兽医临床实践中,针对无形体抗体的检测具有较高的敏感性(94.1%)和特异性(98.4%),但由于抗体的交叉反应,该试剂盒无法对动物感染的具体无形体种类做出判断[37 − 39],因此,本研究只能得出伴侣犬是否存在无形体感染的一般性结论,无法确定动物感染的具体无形体种。此外,由于抗体反应的滞后性和持久性,本研究中使用的试剂盒并不能完全反映动物的感染状态,即当血清学检测显示阳性时,只能说明动物产生了抗原抗体反应,并不能明确表明动物当前正在感染;当血清学检测为阴性时,并不意味着动物一定未发生感染,可能由于感染后并不能即时检测到产生的抗体[40],因此在后续研究中,应使用PCR对病原进行进一步检测,以确定动物的感染状态以及所感染的无形体种。但周飒等[41]通过对海南地区546只犬体表蜱虫所携带的无形体检测发现,没有蜱虫携带A. phagocytophilum,有1.1%的蜱虫携带A. platys。这一结果表明,海南地区犬感染的无形体可能主要为A. platys,而非A. phagocytophilum。此外,在多因素逻辑回归分析中,仅有1个因素被纳入最终模型中,这可能是由于没有考虑到其他混杂因素的作用,例如户外活动频次、驱虫频次等。样本量的限制也可能会降低模型的统计功效,导致某些具有微弱效应的风险因素无法呈现显著关联,进而使其未能被纳入最终模型中。
作为一种重要的人兽共患病病原,无形体对人类健康造成严重威胁。数据显示,2012—2016年,美国共报道了15 778例A. phagocytophilum感染的病例,感染率为每百万人感染7.72例,其中2008—2010年,感染率增幅更是高达53%[13, 42]。尽管A.platys在人类中的报道较少[43],但从Battilani等[7]基于16s rRNA对无形体所构建的进化树分析来看,A. platys和A. phagocytophilum有较近的亲缘关系,暗示着这两种病原在形态、生物特点或生态位上可能表现出一些相似性,具有重要的公共卫生意义。从“全健康”视角分析,犬无形体的高流行率可能意味着与其共处同一环境的人类也面临着感染虫媒病的风险。因此,本研究发现的无形体在海南省海口地区伴侣犬的高流行率不仅说明了无形体对伴侣犬会造成健康威胁,也对与犬有密切接触的宠物主人起到了警示作用。此外,本研究通过风险因素分析,发现有蜱虫叮咬史犬检出无形体抗体阳性的概率为21.2%,进一步明确了蜱虫作为病媒生物的重要角色。考虑到伴侣犬和人类的密切接触,特别是在伴侣犬数量激增的当下,对伴侣犬虫媒病的监测尤为重要。宠物主人应该充分了解虫媒病的潜在危害,同时认识到仅凭动物是否表现出临床症状,无法全面反映其健康状况。为降低伴侣犬感染虫媒病的风险,应尽量减少其在森林、草坪等蜱虫密集区域的活动时间,并定期检查宠物身上的蜱虫寄生情况。一旦发现寄生,应迅速采取措施,做到早发现,早治疗,早预防。此外,从公共卫生和预防医学的角度分析,伴侣犬发挥的“哨兵”作用应得到重视,在伴侣犬虫媒病的流行区域,宠物主人也应该做好自身防护,避免蜱虫叮咬,如发现不适,应及时就医,并向临床医生及时说明和宠物的接触史,为准确诊断争取时间。本研究结果为预防和控制蜱传疾病提供了科学依据,为海南地区伴侣犬无形体流行情况的深入研究奠定了基础。
致谢:诚挚感谢各采样医院及相关医务人员在研究设计、数据收集以及受试犬主人沟通等方面的大力支持与无私协助,为本研究的顺利开展提供了坚实保障。同时感谢海南医科大学尹飞飞研究员在研究设计初期提供的宝贵意见和建议,为本研究的顺利推进奠定了坚实基础。
海口地区伴侣犬无形体血清流行病学调查及相关风险因素分析
DOI: 10.15886/j.cnki.rdswxb.20240153
 CSTR: 32425.14.j.cnki.rdswxb.20240153
CSTR: 32425.14.j.cnki.rdswxb.20240153
Anaplasma spp. seroepidemiological research and related risk factor analysis of companion dogs in Haikou
-
摘要: 嗜吞噬细胞无形体和扁平无形体是热带和亚热带地区广泛流行的两种蜱传病病原。对其进行深入调查研究,具有重要的人兽共患和公共卫生意义。迄今为止,针对海南地区伴侣犬的无形体血清流行病学调查研究数据非常缺乏。通过使用标准商品化试剂盒对海口地区184只伴侣犬的无形体抗体进行检测,并结合128份临床调查问卷对相关风险因素进行分析。结果显示,海口地区伴侣犬嗜吞噬细胞无形体/扁平无形体的血清抗体流行率为7.1%。通过建模计算发现,在所有调查研究的风险因素中,蜱虫叮咬和无形体血清抗体阳性显著相关,进一步明确了蜱虫作为病媒生物的重要角色。研究结果为海南地区伴侣犬无形体的流行病学研究奠定了基础,为预防和控制无形体病提供了科学依据。Abstract: As two tick-borne pathogens that are widely prevalent in tropical and subtropical regions, Anaplasma platys (A. platys) and Anaplasma phagocytophilum (A. phagocytophilum) are of great zoonotic and public health significance. To date, seroepidemiological investigations and analysis of associated risk factors for A. phagocytophilum and A. platys in companion dogs in Hainan are not documented. In this study, 184 companion dogs in the Haikou area of Hainan Province were tested for antibodies to Anaplasma spp. by using a standard commercialized kit, and the associated risk factors were analyzed with 128 clinical questionnaires. The results showed that the seroprevalence of antibodies of companion dogs to A. phagocytophilum/A. platys in Haikou area was 7.1%. Modeling calculations revealed a significant correlation between tick bites and seropositive antibodies to Anaplasma spp. among all investigated risk factors, further clarifying the important role of ticks as a vector. This study lays the foundation for the Anaplasma spp. epidemiologic study of companion dogs in Hainan province, and provides an important scientific basis for the prevention and control of anaplasmosis.
-
Key words:
- Anaplasma spp. /
- seroepidemiological research /
- risk factors /
- companion dogs
-
表 1 临床信息调查问卷内容
Table 1 Clinical information questionnaire content
问卷内容
Questionnaire content具体问题
Specific question基本信息
Signalment出生日期
Date of birth品种
Breed性别
Sex户外活动情况
Activities外出活动史
Out-going activities history外出活动地点
Outdoor activity location旅游史
Traveling history驱虫史
Parasite control history外寄生虫感染情况
External parasite infestation history体外驱虫情况
External parasite control其他信息
Other information居住环境是否饲养其他伴侣动物
Co-pet family status受试犬来源
Acquisition source相关临床病史
Related disease history根据主人主诉记录相关病史信息
Disease history based on owner’s statements表 2 海口地区伴侣犬SNAP 4Dx Plus 检验阳性率
Table 2 Positive rate of SNAP 4Dx Plus test for companion dogs in Haikou area
采样医院
Sampling hospital阳性率/% [阳性数量(个)/总数(个)]
Positive rate/%(Number of
positives/Total number)HKH01 2.0(1/49) HKH02 8.5(4/47) HKH03 14.3(4/28) HKH04 0(0/15) HKH05 11.1(2/18) HKH06 15.4(2/13) HKH07 0(0/6) HKH08 0(0/6) HKH09 0(0/2) 合计
Total7.1(13/184) 表 3 变量筛选
Table 3 Variable filtering
变量
Variable水平
Level样本数量/个
Number of positive/ind阳性数量/个 (阳性率/%)
Number of positive/ind
(positive rate/%)P 值
P value年龄
Age幼年犬
Puppies/Juveniles/Young39 2(5.1) 0.13* 成年犬
Mature65 5(7.7) 中年犬
Senior22 2(9.1) 老年犬
Geriatric1 1(100.0) 性别
Sex雄性
Male65 7(10.8) 0.22* 雌性
Female63 3(4.8) 品种
Breeds纯种犬
Purebred110 9(8.2) 0.70 混血犬
Mixed-breed18 1(5.6) 户外活动史
Out-going history无
No8 0(0.0) 0.99 有
Yes118 10(8.5) 蜱虫叮咬史
Tick infestation history否
No70 2(2.9) 0.01* 是
Yes33 7(21.2) 不清楚
Unclear23 1(4.3) 体外驱虫情况
External parasite control否
No11 2(18.2) 0.21* 是
Yes115 8(7.0) 所处环境中有其他伴侣动物
Co-pet status否
No72 6(8.3) 0.83 是
Yes55 4(7.3) 来源于动保中心收养或流浪动物
Stray or shelter dog否
No105 8(7.6) 0.80 是
Yes17 1(5.9) 旅游史
Traveling history无
No50 2(4.0) 0.31 仅有海南岛内旅游史
Only in the province40 5(12.5) 海南岛外旅游史
In and out of the province33 2(6.1) 注:*指具有统计学意义的潜在风险因素(P<0.25)。
Note: * refers to the variables significant at P < 0.25.表 4 最终模型中各风险因素下不同水平的系数、P值、OR 值及其95%CI
Table 4 The coefficients, P values, OR values and their 95% CIs at different levels of each risk factor in the final model
变量
Variable水平
Level系数
CoefficientP值
P valueOR值(95%CI)
OR value(95% CI)蜱虫叮咬史
Tick infestation history否
No参考
Reference是
Yes2.21 0.01* 9.15(2.06,64.20) 不清楚
Unclear0.53 0.67 1.70(0.08,18.65) 注:*指具有统计学意义的潜在风险因素(P<0.05)。
Note: * refers to the variables significant at P < 0.05. -
[1] DAHMANI M, LOUDAHI A, MEDIANNIKOV O, et al. Molecular detection of Anaplasma platys and Ehrlichia canis in dogs from Kabylie, Algeria[J]. Ticks and Tick-Borne Diseases, 2015, 6(2): 198 − 203. doi: 10.1016/j.ttbdis.2014.12.007 [2] DINIZ P P V P, DE AGUIAR D M. Ehrlichiosis and anaplasmosis: an update[J]. Veterinary Clinics of North America: Small Animal Practice, 2022, 52(6): 1225 − 1266. doi: 10.1016/j.cvsm.2022.07.002 [3] YU Z J, WANG H, WANG T H, et al. Tick-borne pathogens and the vector potential of ticks in China[J]. Parasites & Vectors, 2015, 8(1): 24. doi: 10.1186/s13071-014-0628-x [4] DÍAZ-SÁNCHEZ A A, OBREGÓN D, SANTOS H A, et al. Advances in the epidemiological surveillance of tick-borne pathogens[J]. Pathogens, 2023, 12(5): 633. doi: 10.3390/pathogens12050633 [5] YBAÑEZ A P, PEREZ Z O, GABOTERO S R, et al. First molecular detection of Ehrlichia canis and Anaplasma platys in ticks from dogs in Cebu, Philippines[J]. Ticks and Tick-Borne Diseases, 2012, 3(5/6): 288 − 293. doi: 10.1016/j.ttbdis.2012.10.032 [6] ATIF F A, MEHNAZ S, QAMAR M F, et al. Epidemiology, diagnosis, and control of canine infectious cyclic thrombocytopenia and granulocytic anaplasmosis: emerging diseases of veterinary and public health significance[J]. Veterinary Sciences, 2021, 8(12): 312. doi: 10.3390/vetsci8120312 [7] BATTILANI M, DE ARCANGELI S, BALBONI A, et al. Genetic diversity and molecular epidemiology of Anaplasma[J]. Infection, Genetics and Evolution, 2017, 49: 195 − 211. doi: 10.1016/j.meegid.2017.01.021 [8] MAGGI R G, MASCARELLI P E, HAVENGA L N, et al. Co-infection with Anaplasma platys, Bartonella henselae and Candidatus Mycoplasma haematoparvum in a veterinarian[J]. Parasites & Vectors, 2013, 6(1): 103. doi: 10.1186/1756-3305-6-103 [9] BREITSCHWERDT E B, HEGARTY B C, QUROLLO B A, et al. Intravascular persistence of Anaplasma platys, Ehrlichia chaffeensis, and Ehrlichia ewingii DNA in the blood of a dog and two family members[J]. Parasites & Vectors, 2014, 7(1): 298. doi: 10.1186/1756-3305-7-298 [10] BEN SAID M, BELKAHIA H, MESSADI L. Anaplasma spp. in North Africa: a review on molecular epidemiology, associated risk factors and genetic characteristics[J]. Ticks and Tick-Borne Diseases, 2018, 9(3): 543 − 555. doi: 10.1016/j.ttbdis.2018.01.003 [11] CHIREK A, SILAGHI C, PFISTER K, et al. Granulocytic anaplasmosis in 63 dogs: clinical signs, laboratory results, therapy and course of disease[J]. Journal of Small Animal Practice, 2018, 59(2): 112 − 120. doi: 10.1111/jsap.12787 [12] MACQUEEN D, CENTELLAS F. Human granulocytic anaplasmosis[J]. Infectious Disease Clinics of North America, 2022, 36(3): 639 − 654. doi: 10.1016/j.idc.2022.02.008 [13] EL HAMIANI KHATAT S, DAMINET S, DUCHATEAU L, et al. Epidemiological and clinicopathological features of Anaplasma phagocytophilum infection in dogs: a systematic review[J]. Frontiers in Veterinary Science, 2021, 8: 686644. doi: 10.3389/fvets.2021.686644 [14] SOARES R, RAMOS C A, PEDROSO T, et al. Molecular survey of Anaplasma platys and Ehrlichia canis in dogs from Campo Grande, Mato Grosso do Sul, Brazil[J]. Anais da Academia Brasileira de Ciências, 2017, 89(1): 301 − 306. doi: 10.1590/0001-3765201720150556 [15] ALHASSAN A, HOVE P, SHARMA B, et al. Molecular detection and characterization of Anaplasma platys and Ehrlichia canis in dogs from the Caribbean[J]. Ticks and Tick-Borne Diseases, 2021, 12(4): 101727. doi: 10.1016/j.ttbdis.2021.101727 [16] YUASA Y, TSAI Y L, CHANG C C, et al. The prevalence of Anaplasma platys and a potential novel Anaplasma species exceed that of Ehrlichia canis in asymptomatic dogs and Rhipicephalus sanguineus in Taiwan[J]. Journal of Veterinary Medical Science, 2017, 79(9): 1494 − 1502. doi: 10.1292/jvms.17-0224 [17] BAWM S, KHAING Y, CHEL H M, et al. Molecular detection of Dirofilaria immitis and its Wolbachia endosymbionts in dogs from Myanmar[J]. Current Research in Parasitology & Vector-Borne Diseases, 2023, 4: 100148. doi: 10.1016/j.crpvbd.2023.100148 [18] KONTO M, TUKUR S M, WATANABE M, et al. Molecular and serological prevalence of Anaplasma and Ehrlichia sp. among stray dogs in East Malaysia[J]. Tropical Biomedicine, 2017, 34(3): 570 − 575. [19] SAINZ Á, ROURA X, MIRÓ G, et al. Guideline for veterinary practitioners on canine ehrlichiosis and anaplasmosis in Europe[J]. Parasites & Vectors, 2015, 8(1): 75. doi: 10.1186/s13071-015-0649-0 [20] PASCOE E L, NAVA S, LABRUNA M B, et al. Predicting the northward expansion of tropical lineage Rhipicephalus sanguineus sensu lato ticks in the United States and its implications for medical and veterinary health[J]. PLoS One, 2022, 17(8): e0271683. doi: 10.1371/journal.pone.0271683 [21] DANTAS-TORRES F, OTRANTO D. Rhipicephalus sanguineus (Brown dog tick)[J]. Trends in Parasitology, 2022, 38(11): 993 − 994. doi: 10.1016/j.pt.2022.08.011 [22] PIANTEDOSI D, NEOLA B, D'ALESSIO N, et al. Seroprevalence and risk factors associated with Ehrlichia canis, Anaplasma spp., Borrelia burgdorferi sensu lato, and D. immitis in hunting dogs from southern Italy[J]. Parasitology Research, 2017, 116(10): 2651 − 2660. doi: 10.1007/s00436-017-5574-z [23] LEE S, LEE H, PARK J W, et al. Prevalence of antibodies against Anaplasma spp., Borrelia burgdorferi sensu lato, Babesia gibsoni, and Ehrlichia spp. in dogs in the Republic of Korea[J]. Ticks and Tick-Borne Diseases, 2020, 11(4): 101412. doi: 10.1016/j.ttbdis.2020.101412 [24] STICH R W, BLAGBURN B L, BOWMAN D D, et al. Quantitative factors proposed to influence the prevalence of canine tick-borne disease agents in the United States[J]. Parasites & Vectors, 2014, 7(1): 417. doi: 10.1186/1756-3305-7-417 [25] MONTENEGRO V M, BONILLA M C, KAMINSKY D, et al. Serological detection of antibodies to Anaplasma spp., Borrelia burgdorferi sensu lato and Ehrlichia canis and of Dirofilaria immitis antigen in dogs from Costa Rica[J]. Veterinary Parasitology, 2017, 236: 97 − 107. doi: 10.1016/j.vetpar.2017.02.009 [26] MENDES-DE-ALMEIDA F, ALVES L C, DO AMARAL FERNANDES P, et al. Infection with Dirofilaria immitis and other infections in cats and dogs from Rio de Janeiro, Brazil: the need for prophylactic enforcement[J]. Acta Parasitologica, 2021, 66(3): 962 − 968. doi: 10.1007/s11686-021-00345-z [27] IATTA R, SAZMAND A, NGUYEN V L, et al. Vector-borne pathogens in dogs of different regions of Iran and Pakistan[J]. Parasitology Research, 2021, 120(12): 4219 − 4228. doi: 10.1007/s00436-020-06992-x [28] XIA Z, YU D, MAO J, et al. The occurrence of Dirofilaria immitis, Borrelia burgdorferi, Ehrlichia canis and Anaplasma phagocytophium in dogs in China[J]. Journal of Helminthology, 2012, 86(2): 185 − 189. doi: 10.1017/S0022149X11000198 [29] ZHANG J W, LIU Q B, WANG D M, et al. Epidemiological survey of ticks and tick-borne pathogens in pet dogs in south-eastern China[J]. Parasite, 2017, 24: 35. doi: 10.1051/parasite/2017036 [30] LIN Y, ZHOU S, UPADHYAY A, et al. Molecular detection and phylogenetic characterization of Anaplasma spp. in dogs from Hainan province/Island, China[J]. Veterinary Sciences, 2023, 10(5): 339. doi: 10.3390/vetsci10050339 [31] FACILE V, SABETTI M C, BALBONI A, et al. Detection of Anaplasma spp. and Ehrlichia spp. in dogs from a veterinary teaching hospital in Italy: a retrospective study 2012-2020[J]. Veterinary Research Communications, 2024, 48(3): 1727 − 1740. doi: 10.1007/s11259-024-10358-4 [32] HAZELRIG C M, GETTINGS J R, CLEVELAND C A, et al. Spatial and risk factor analyses of vector-borne pathogens among shelter dogs in the Eastern United States[J]. Parasites & Vectors, 2023, 16(1): 197. doi: 10.1186/s13071-023-05813-1 [33] ACOSTA-JAMETT G, WEITZEL T, LÓPEZ J, et al. Prevalence and risk factors of antibodies to Anaplasma spp. in chile: a household-based cross-sectional study in healthy adults and domestic dogs[J]. Vector-Borne and Zoonotic Diseases, 2020, 20(8): 572 − 579. doi: 10.1089/vbz.2019.2587 [34] MIRANDA E A, HAN S W, RIM J M, et al. Serological evidence of Anaplasma spp., Borrelia burgdorferi and Ehrlichia canis in dogs from the Republic of Korea by rapid diagnostic test kits[J]. Journal of Veterinary Science, 2022, 23(2): e20. doi: 10.4142/jvs.21215 [35] EBANI V V, BERTELLONI F, TORRACCA B, et al. Serological survey of Borrelia burgdorferi sensu lato, Anaplasma phagocytophilum, and Ehrlichia canis infections in rural and urban dogs in Central Italy[J]. Annals of Agricultural and Environmental Medicine, 2014, 21(4): 671 − 675. doi: 10.5604/12321966.1129912 [36] 琚瑞利. 福州地区硬蜱分布情况调查及微小牛蜱生物学特性研究[D]. 福州: 福建师范大学, 2011. [37] BEALL M J, MAINVILLE C A, ARGUELLO-MARIN A, et al. An improved point-of-care ELISA for the diagnosis of anaplasmosis and ehrlichiosis during the acute phase of tick-borne infections in dogs[J]. Topics in Companion Animal Medicine, 2022, 51: 100735. doi: 10.1016/j.tcam.2022.100735 [38] MOVILLA R, GARCÍA C, SIEBERT S, et al. Countrywide serological evaluation of canine prevalence for Anaplasma spp., Borrelia burgdorferi (sensu lato), Dirofilaria immitis and Ehrlichia canis in Mexico[J]. Parasites & Vectors, 2016, 9(1): 421. doi: 10.1186/s13071-016-1686-z [39] STILLMAN B A, MONN M, LIU J Y, et al. Performance of a commercially available in-clinic ELISA for detection of antibodies against Anaplasma phagocytophilum, Anaplasma platys, Borrelia burgdorferi, Ehrlichia canis, and Ehrlichia ewingii and Dirofilaria immitis antigen in dogs[J]. Journal of the American Veterinary Medical Association, 2014, 245(1): 80 − 86. doi: 10.2460/javma.245.1.80 [40] RICHARDSON S S, MAINVILLE C A, ARGUELLO-MARIN A, et al. A second-generation, point-of-care immunoassay provided improved detection of Anaplasma and Ehrlichia antibodies in PCR-positive dogs naturally infected with Anaplasma or Ehrlichia species[J]. Journal of Veterinary Diagnostic Investigation, 2023, 35(4): 366 − 373. doi: 10.1177/10406387231172723 [41] 周飒, 林洋, 祖海月, 等. 海南4个地区犬体表蜱种鉴定及其无形体携带情况[J]. 热带生物学报, 2023, 14(2): 159 − 165. doi: 10.15886/j.cnki.rdswxb.2023.02.004 [42] BAKER A, WANG H H, MOGG M, et al. Increasing incidence of anaplasmosis in the United States, 2012 Through 2016[J]. Vector-Borne and Zoonotic Diseases, 2020, 20(11): 855 − 859. doi: 10.1089/vbz.2019.2598 [43] ANDRÉ M R. Diversity of Anaplasma and Ehrlichia/Neoehrlichia agents in terrestrial wild carnivores worldwide: implications for human and domestic animal health and wildlife conservation[J]. Frontiers in Veterinary Science, 2018, 5: 293. doi: 10.3389/fvets.2018.00293 -




 下载:
下载: