-
因具有生物毒性与富集性等多种特征,重金属作为水环境中常见的污染物之一[1-2],近年来引起了社会各界的广泛关注[3-4]。多项研究结果表明水环境中的重金属可通过食物相与水相2种途径被鱼体吸收并进入到食物链与食物网中[5]。在对鱼类的正常生命活动产生负面影响的同时,重金属也会随着食物链直接危害消费者的生命健康[6-8]。金枪鱼隶属鲈形目(Pereiformes)鲭科(Scombridae)金枪鱼属(Thunnus)[9],具有肉质鲜美、易于消化等特点,且富含多种对人体有益的营养物质(如二十二碳六烯酸、二十碳五烯酸等)[10-11],是全球消费数量最多的鱼类之一。此外,作为海洋中的顶级捕食者,金枪鱼具有较高的营养级,并在大洋的生态循环中充当着重要的角色[12-13]。然而,由于重金属难排出易富集的特点,使得高营养级的金枪鱼是大洋食物链中重金属富集的终端之一。Araujo等[14]抽样调查发现:约有一半栖息于东太平洋海域的黄鳍金枪鱼(Thunnus albacares)肌肉与肝脏中Cd、Hg和Pb的含量超标,且肝脏中重金属含量显著高于肌肉。Dervnick等[15]在总结并重新分析了夏威夷海域黄鳍金枪鱼体内Hg含量的年变化趋势后,认为该海域黄鳍金枪鱼体内的Hg含量正以每年3.8%的速度上升。Melgar等[8]研究发现长期食用黄鳍金枪鱼,可能导致西班牙6岁儿童面临体内无机砷(iAs)及Hg含量超标的风险。因此,探究黄鳍金枪鱼重金属富集特征、评估重金属食品安全状况对消费者的健康安全至关重要。
南海是中国近海中面积最大、水最深的海区,位于东亚和东南亚之间,连接太平洋与印度洋,被中国、泰国及马来西亚等9个国家所环绕,具有“亚洲地中海”之称[16-17]。除地理位置重要外,南海还蕴藏着丰富的热带渔业资源[17]。仅2015年,全球50%以上的渔船在南海进行捕捞作业。在南海所捕获的海鱼不仅被南海周边国家的人民所享用,还出口到了世界多个国家。然而,在周边国家生活、工业及海水水产养殖三重污染的影响下,南海及其周边海域重金属污染问题日益严重[18]。如海南岛近岸海域水质因受采矿业及金属冶炼等作业的影响,水中重金属含量超标[18];Polprasert[19]对泰国湄公河河口及泰国湾海域的重金属污染研究表明,该海域水体中Cd、Cu及Cr富集显著,水体已经受到人类活动的影响而污染;谢文平等[20]对珠江三角洲水质进行评价,认为水体已受到重金属污染,主要污染物为Cr、Pb等重金属元素。
为了解南海黄鳍金枪鱼体内重金属的富集特征及重金属食品安全状况,以3种体型(大、中、小)的南海黄鳍金枪鱼为研究对象,检测了南海黄鳍金枪鱼肌肉与肝脏中Cd(镉)、Ba(钡)、As(砷)、Cu(铜)、Fe(铁)、Cr(铬)、Se(硒)及Zn(锌)8种重金属元素的含量,分析了8种重金属元素随体型变化在肌肉与肝脏中的累积趋势及组织分布特征,评估了不同体型黄鳍金枪鱼可食用部分(肌肉)重金属安全风险并针对我国居民给出了每日无风险摄入值,旨在为南海黄鳍金枪鱼重金属研究及其食品安全提供数据支持和评价参考,也为我国南海海鱼消费安全提供参考数据。
-
样品于2021年3月至2022年5月以钓竿的方式捕获于南海中部海域(17°41′N-18°17′N,110°60′E-112°14′E),共计40尾。根据各样本体型大小,将40尾黄鳍金枪鱼样本分为大(叉长范围为73.00~127.00 cm)、中(48.00~72.00 cm)、小(30.00~47.00 cm)3个体型组。样品捕获上船后,立即解剖样品。随后,将黄鳍金枪鱼肌肉组织以及肝脏组织样品分出并清洗装入干净的培养皿中,随后放入冰盒中保存。待船靠岸后,立即将样品转移至实验室−20℃冰箱中低温保存,待后续实验分析。
-
为检测重金属浓度,待肌肉与肝脏样品在室温下解冻后,用纯水洗涤2次以去除肌肉与肝脏表面吸附的重金属,随后将样品放入烘箱中,60℃烘干48 h。烘干后的样品放入消解管中,每管加入5.00 mL进口硝酸(67.70%,Fisher Scientific,Geel,Belgium)及2.00 mL过氧化氢。消解管静止1 h后,放入消解仪中消解48 h。消解完毕后,参照(GB 5009.14—2017)利用电感耦合等离子体质谱仪(inductively coupled plasma-mass spectroscopy,ICP-MS;iCAP RQ Thermo Fisher,USA)测量待测样品中8种重金属含量。参考标准物质为扇贝(GBW10024)。在检测时,全部实验样本设置2个平行样以提高实验准确度,并且利用空白试剂矫正样品浓度。Cr、Fe、Cu、Zn、As、Se、Cd及Ba的回收率分别为95.3%~100.6%,94.4%~98.2%,88.7%~101.2%,87.5%~99.8%,96.9%~100.9%,86.2%~98.2%,98.6%~100.7%,90.3%~100.0%。Cr、Fe、Cu、Zn、As、Se、Cd及Ba的检出线(LOD)分别为0.1710、1.8542、0.0220、0.1136、0.0165、0.1783、0.0041、0.0054 μg·L−1。在利用ICP-MS仪器测定样品中重金属含量外,还计算了样品烘干后的失水率(具体失水率计算为大中小个体的黄鳍金枪鱼各取1条,称其烘干前及烘干后的质量,以此求得不同大小的黄鳍金枪鱼失水率,并以此求得平均失水率为(75.00±2.40)%,后续实验取75%进行计算)。通过失水率可将ICP-MS仪器所测得样品重金属含量进行换算,从而得到湿样品中重金属的含量。因此,本研究所呈现的重金属含量为湿质量。
-
参照(GB 2762-2017)对南海黄鳍金枪鱼肌肉中重金属含量状况进行评价。
-
参考单因子污染指数法,评估黄鳍金枪鱼肌肉组织中8种重金属的安全状况,具体计算公式为:
$$ P_i=C_i / S_i $$ (1) 式中,Pi表示i重金属的污染指数,Ci表示i重金属的实际检测数据即在肌肉组织中的含量(mg·kg−1),Si表示i重金属的标准限量(参考GB 2762—2017,mg·kg−1)。当Pi<0.2时,表示该重金属元素无安全风险;当0.2≤Pi≤0.6时,表示具有轻微的安全风险;当0.6<Pi<1.0时,表明具有中度安全风险;Pi≥1.0,表明具有巨大的安全风险[21]。
-
参考每日实际摄入量(Exp)公式[22]及Cd与As的每周可耐受摄入量,给出取食者的每日无风险摄入值(Daily limit intake,DIlim),具体计算公式如下:
$$ D I_{l i m}=B W \times P T W I_i / C_i \times 7 $$ (2) 式中,DIlim为每日无风险摄入值(g·d−1),PTWIi为i金属每周可耐受摄入量(根据JECFA,Cd与As分别为每周7 μg·kg−1和15 μg·kg−1[23]),BW为目标人群体质量(成人与儿童平均体质量分别为70 kg和20 kg[14]),Ci为i金属的实际含量(mg·kg−1)。
-
数据分析采用GraphPad Prism 8.0 (GraphPad Software Inc, San Diego, CA, U.S.A.),根据数据方差是否齐性,分别用ANOVA(数据方差为齐性)及Welch ANOVA(数据方差不为齐性)判断小、中及大体型的黄鳍金枪鱼肌肉与肝脏中重金属含量变化是否具有显著差异;根据数据方差是否齐性,分别用T(数据方差为齐性)及Welch T检验(数据方差不为齐性)判断重金属在不同体型黄鳍金枪鱼肌肉与肝脏中含量分布是否具有显著分布特征,P<0.05表明差异显著。
-
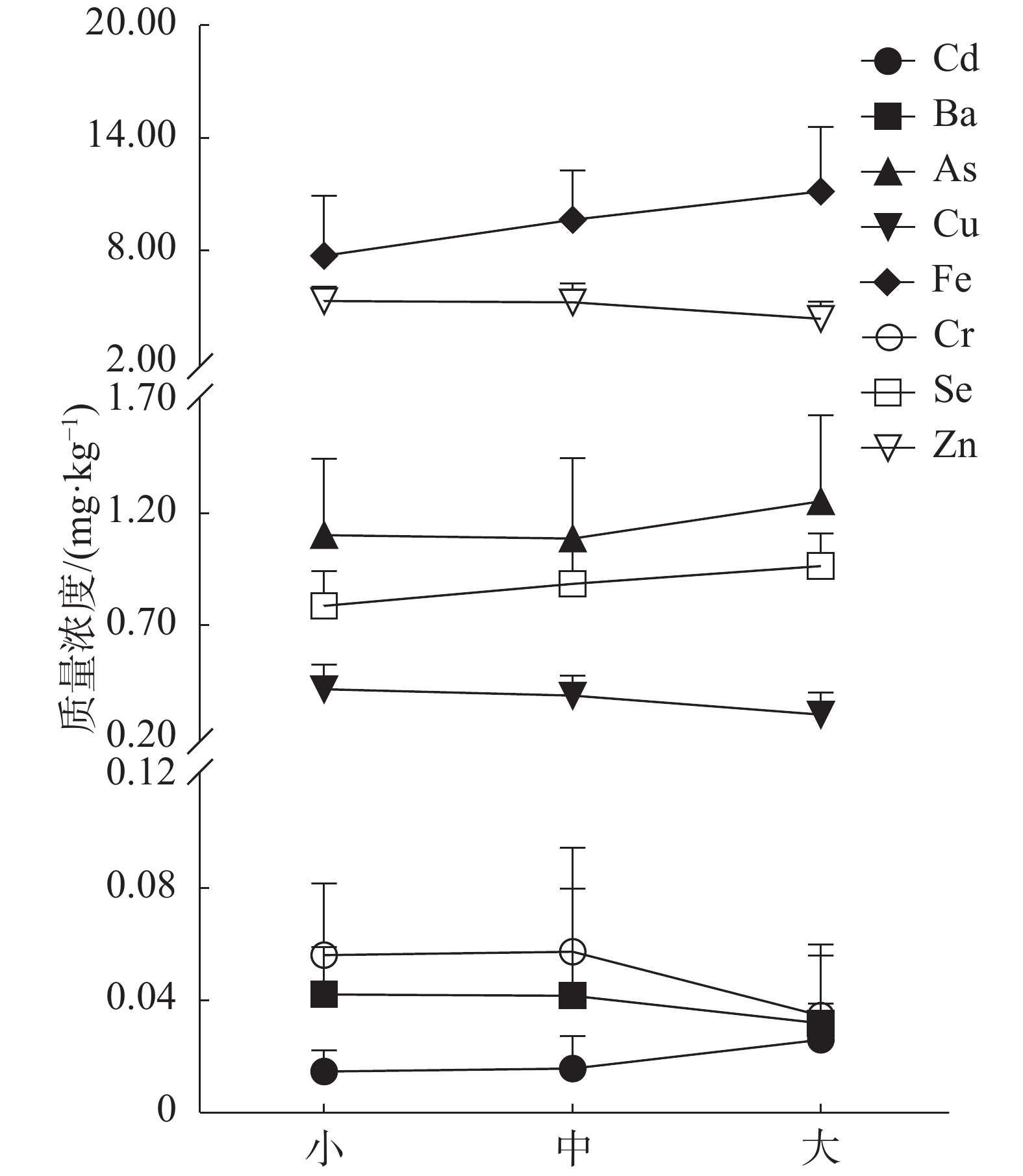
肌肉中重金属含量变化特征如图1所示,Fe、Se和Cd的含量随着体型的变大逐渐上升(P<0.05),均在大个体组中达到最高含量,具体数值分别为11.16、0.96和0.03 mg·kg−1;Zn与Cu含量变化趋势与之相反(P<0.05),其含量随鱼体增长而下降,最高值于小个体组中出现,具体数值分别为5.30、0.42 mg·kg−1;As、Ba及Cr在各阶段含量变化差异不显著(P>0.05)。
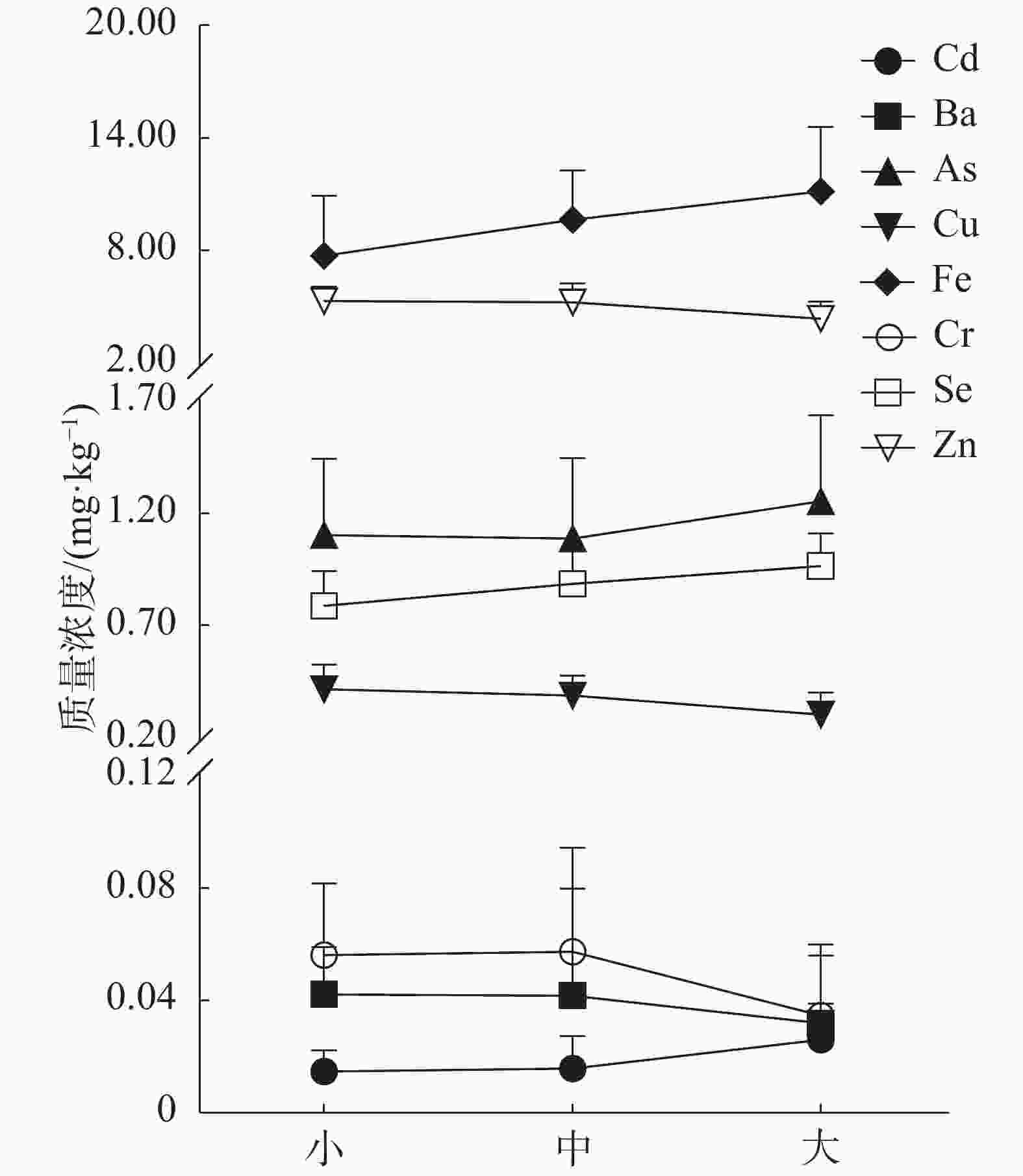
在肝脏中(图2),Fe、Se、Cu和Cd的含量随着体型的变大而不断上升(P<0.05),均在大个体组中达到最高含量,具体数值分别为89.60、13.35、9.76和6.98 mg·kg−1;随着体型的不断变大,Cr含量逐渐下降(P<0.05),最高含量为小个体组中的0.09 mg·kg−1;Zn、Ba和As3种重金属在各体型阶段含量变化不存在显著差异(P>0.05)。
-
重金属在肝脏与肌肉中组织分布特征结果表明(表1),Cd,As,Cu,Fe,Se和Zn在肝脏中的含量均高于肌肉,且差异具有显著性(P<0.05);在肌肉与肝脏中的组织分布特征不受鱼体增长变化的影响。随着鱼体的增长,Ba在肝脏中的含量均高于肌肉中的含量,但是二者在3个体型组中的差异均不显著(P>0.05)。2个体型组中,Cr的含量在肌肉与肝脏中均无显著差异(P>0.05)。
表 1 不同体型黄鳍金枪鱼中重金属元素在肌肉和肝脏中含量比较分析
重金属元素 显著性检验P值 小 中 大 Cd <0.000 1* <0.000 1* <0.000 1* Ba 0.058 6 0.623 0 0.877 2 As <0.000 1* <0.000 1* <0.000 1* Cu <0.000 1* 0.000 3* <0.000 1* Fe <0.000 1* <0.000 1* <0.000 1* Cr 0.095 7 0.381 5 0.276 2 Se <0.000 1* <0.000 1* <0.000 1* Zn <0.000 1* <0.000 1* <0.000 1* 说明:*表示差异显著(P<0.05)。 -
本研究中,全部样本的重金属含量均低于我国国家标准限量(GB 2762-2017),因此,南海黄鳍金枪鱼肌肉中重金属含量检测结果符合我国食品国家安全标准。然而,单因素污染指数结果(表2)显示,虽然Cr在各体型组中单因素指数均低于0.20,处于无风险水平,但大个体组中Cd的单因素指数为0.26,且iAs在3个体型组中的单因素指数结果均超过了0.2,分别为0.33、0.36和0.38。上述结果表明南海黄鳍金枪鱼仍存在轻微的重金属安全风险。根据JECFA所规定的Cd、As每周可耐受摄入量(PTWI),并以大个体组中Cd及As的含量为参考,分别计算了成人及儿童每天可摄入南海黄鳍金枪鱼的最大值。由表3可知,As为2种重金属中对人体健康影响较大的重金属元素,成人与儿童每天可摄入南海黄鳍金枪鱼最大值(无风险摄入值)分别为120.00 g·d−1和37.71 g·d−1。
表 2 不同体型黄鳍金枪鱼肌肉组织中重金属元素单因素污染指数
不同体型 重金属元素污染指数 Cr Cd iAs* 小 0.03 0.15 0.33 中 0.03 0.16 0.33 大 0.02 0.26 0.38 注:*根据Núñez[23]的研究结果:无机砷占总砷的3%换算得来。 表 3 黄鳍金枪鱼无风险每日重金属摄入量
重金属
元素含量
Ci每周
可耐受
摄入量/g平均
体质量/kg
BW每日无风险
摄入值/g
DIlim成人 儿童 成人 儿童 Cd 0.03 7.00 70 22 2 333.33 733.33 As 1.25 15.00 120.00 37.71 -
因具有较长的半衰期以及对配体高亲和性的特点,当外界水环境以及饵料所包含的重金属通过黄鳍金枪鱼呼吸、捕食等生命活动吸收进入到体内后,会在鱼体内不断累积并且难以排出体外[7]。但受到栖息环境、自身新陈代谢及重金属元素在鱼体生命活动中所承担的作用等多种因素的影响,不同元素在黄鳍金枪鱼体内的累积趋势存在区别[24]。陈海刚等[25]发现必需元素(如Cu、Zn及Cr)在水生生物体内具有明显的累积趋势,这与本研究中Fe、Se 2种必需元素在肌肉与肝脏中的含量变化趋势一致。其原因可能为,必需元素参与了鱼体的新陈代谢、生长发育及繁育,甚至部分元素还是鱼体内某些蛋白的组分或是活化剂[26],所以一般情况下必需元素在鱼体内呈现累积趋势。然而本研究中Zn、Cu及Cr 3种必需重金属元素的含量随鱼体增长在肌肉或肝脏中均存在不同程度的下降,导致该现象的主要原因可能与“生长稀释”有关。闫海鱼[27]认为当鱼体处于体长增速减缓,而体质量增速加快的时期时,该时期鱼体内重金属浓度会被稀释,含量趋势呈下降状态[27]。金枪鱼也被观察到存在类似的生长特征[28]。除此之外,还有学者发现不同种类的重金属元素在被吸收进入鱼体后,可能会发生拮抗作用,导致特定的金属元素在鱼体内含量下降。例如,镉元素通过竞争性结合锌的配体,使得锌元素长期以不稳定且易于排出体外的离子态存在于细胞中,无法形成稳定的络合物,最终导致锌的浓度变化呈现下降趋势[29]。而本研究中2种非必需金属元素As与Ba含量随鱼体增长同样存在不同程度下降的主要原因,可能是由金属硫蛋白(Metallothionein, MT)所致。鱼体内存在着对羧酸、氨及硫等基团具有高亲和力的金属硫蛋白,该蛋白能与非必须金属元素快速结合并随着胆汁一起排出至鱼体外,以此降低非必须元素在鱼体内的含量,从而维持鱼体正常的生命活动[30]。
食物相中的重金属是黄鳍金枪鱼体内重金属的主要来源[31],若优势饵料种类发生改变则会导致鱼体内重金属累积趋势发生变化[32]。本研究中,除了As以及Ba外,其余6种重金属虽在肌肉或肝脏中累积趋势存在差异,但各含量均在大个体组中发生了大幅度的变化,与小、中个体组具有显著差异,该现象可能与黄鳍金枪鱼的食性转变有关。朱国平等[33]研究发现,黄鳍金枪鱼与其他生长跨度较大的鱼类相似,随着口器发育的逐渐完善及繁殖等生命活动的需要,在特定时期会发生食性转变。Potier等[34]研究发现,黄鳍金枪鱼的食性会在其叉长90 cm左右时发生转变,食性转变后的黄鳍金枪鱼以甲壳类动物为食,而转变前主要以大洋中上层的鱼类及头足类为捕食目标,该现象也被其他学者证实[35]。因此,本研究中大个体组(叉长范围为73~127 cm)的黄鳍金枪鱼体内Fe、Se及Cd等6种重金属含量均与另外2个体型组的6种重金属存在显著差异的现象,可能由黄鳍金枪鱼摄食生物学特性所导致。
-
鱼体由多个器官构成,且每个器官不仅具有独特的形态结构,还在生命活动中承担着不同的作用[36],如肠道作为鱼体的消化器官之一,在鱼体内扮演着消化食物和吸收营养的角色[36]。由于形态和功能存在差异,使得鱼体内各器官对重金属的吸收能力存在区别[37]。Hussein等[38]研究结果表明,埃及海域黄鳍金枪鱼体内重金属具有明显的分布特异性:重金属主要在肝脏内富集,且肝脏中多种重金属的含量远高于肌肉。有学者在其他的鱼类中也得出了类似的结论[39]。以上结论与本研究中Cd、As及Cu等6种元素的分布结果一致。导致以上现象出现的原因在于肝脏中存在着大量的金属硫蛋白,因此,肝脏是鱼体主要的解毒器官,也是鱼体中重金属富集程度较高的器官之一[40]。肌肉中重金属含量较低的主要原因可能与肌肉的代谢速率有关。在通常情况下,与肝脏等高速新陈代谢的器官相比,肌肉的代谢速率较慢,因此肌肉中重金属的累积速率低于肝脏[41]。此外,肌肉中所含的重金属绝大数多数来源于血液,而血液中大部分重金属在抵达肌肉之前已被肝脏等解毒器官滤过并排出体外,该现象可能也是导致肌肉重金属含量较低的原因之一。
然而,除了Cd、As和Cu等6种元素具有明显的分布特征外,Ba和Cr 2种重金属在肝脏及肌肉中的含量均无明显差异。Endo[42]猜测导致上述现象发生的原因可能是由于鱼体的生长发育以及新陈代谢改变了鱼体内某些重金属的累积动力学,使得肝脏与肌肉中这类重金属含量没有明显差异,具体机理还需深入研究。
-
若长期食用Cd以及As超标的黄鳍金枪鱼,可导致消费者患多种重金属相关疾病,如心血管疾病、发育异常、神经紊乱及癌症等[7]。因此,为了评估消费金枪鱼是否存在重金属安全风险,多位学者对不同海域的金枪鱼展开了重金属食品安全风险评估。然而,由于不同海域水环境中重金属浓度存在差异,导致了各地区所得相关结果不同。例如,Chen等[43]抽样调查发现分布于大西洋海域部分的大眼金枪鱼肌肉中Cd含量偏高,存在食品安全风险;Araujo[14]等认为东太平洋海域部分黄鳍金枪鱼体内Cd、Hg及Pb含量超标,需谨慎食用;Al-busaidi等[44]则认为阿拉伯海域的黄鳍金枪鱼体内重金属含量处于可接受水平,不存在食品安全风险。通过与我国食品中相关重金属限量标准进行比较及计算单因素污染指数,本研究认为部分南海黄鳍金枪鱼存在轻微的As与Cd食品安全风险,这与文献[43]的结果相似。除食物中有毒重金属元素的含量是评价食品重金属安全风险高低的关键因素外,消费者每日摄入量也是影响食品安全风险高低的主要因素之一[45]。因此,针对南海黄鳍金枪鱼,给出成人及儿童每日无风险摄入量,对我国消费者的健康安全十分重要。Araújo等[14]认为,成人每周摄入东太平洋黄鳍金枪鱼191 g以下不存在重金属安全风险。这与本研究的成人每日无风险摄入值为120 g相差较大,究其原因可能是受到研究对象的体型大小(Araújo等[14]研究的黄鳍金枪鱼全长范围为74~163 cm,较本研究样本大)及研究海域海洋特征(东太平洋海域多火山,水中重金属浓度含量较高)的影响,导致Araújo等[14]所研究海域黄鳍金枪鱼体内重金属元素含量较高,从而降低了每周最大摄入值的剂量。与我国实际成人及儿童日常人均摄入水产品量(成人为64.15 g·d−1,儿童为17.00 g·d−1,是成人剂量的26.5%[18])相比,本研究中成人及儿童每日无风险摄入值的结果均大于我国国民实际摄入水产品值。因此,综合实际情况考虑,本研究认为目前南海黄鳍金枪鱼不存在食品重金属安全风险。
Heavy metal bioaccumulation and food safety of Thunnus albacares from the South China Sea
-
摘要: 为了解南海黄鳍金枪鱼(Thunnus albacares)体内重金属富集特征及其食品安全性,对大、中、小3种体型的南海黄鳍金枪鱼肌肉与肝脏中8种重金属(Cd、Ba、As、Cu、Fe、Cr、Se、Zn)含量进行了测定。结果表明,随着体型的变化,各重金属元素的累积特征不同,肌肉中Fe、Se和Cd的含量随着体型变大而不断增加;Zn与Cu则相反;而As、Ba、Cr的含量在3个体型组中无显著变化。在肝脏组织中,Fe、Se、Cu和Cd的含量随体型变大而不断增加;Cr累积趋势相反;Zn、As、Ba的含量在3个体型组中无显著变化。在3个体型组的肝脏中Cd、As、Cu、Fe、Se和Zn含量均显著高于肌肉对应金属元素含量,而Ba、Cr的含量在肌肉与肝脏中无显著差异。在重金属食品安全方面,可食用部分(肌肉)中各重金属元素含量均低于我国食品安全国家标准,但Cd与 iAs的单因素污染指数表明南海黄鳍金枪鱼存在轻微的重金属安全风险,因此,建议成人和儿童每日摄入南海黄鳍金枪鱼应分别小于120.00和37.71 g。Abstract: Yellowfin tuna (Thunnus albacares) is one of the most popular fish consumed worldwide. It is crucial to determine the risk of yellowfin tuna that heavy metals pose to consumer health. In order to understand the heavy metal bioaccumulation characteristics and food safety in yellowfin tuna from the South China Sea, eight heavy metals (Cd, Ba, As, Cu, Fe, Cr, Se, and Zn) in muscle and liver tissues of the yellowfin tuna were determined. The yellowfin tuna were divided to three groups with different body sizes (large, medium, and small). The findings showed that the bioaccumulation of heavy metal elements in the yellowfin tuna varied significantly with body size. Specifically, the levels of Fe, Se, and Cd in muscle increased with body size (P<0.05), while the levels of Zn and Cu decreased with body size, and the levels of As, Ba, and Cr did not vary significantly with body size (P>0.05). The levels of Fe, Se, Cu, and Cd in liver increased steadily with body size (P<0.05), the Cr level decreased with body size (P<0.05), and the contents of Zn, As and Ba in the tuna with all the body sizes had no significant changes (P>0.05). The levels of Cd, As, Cu, Fe, Se, and Zn were substantially higher in liver than in muscle in the groups of all the three body sizes (P<0.05). In terms of food safety, the concentration of each heavy metal element in muscle was lower than that in the National Food Safety Standards of China (GB 2762-2017). The single-factor contamination index of Cd and iAs suggested the yellowfin tuna from the South China sea have a slight risk of heavy metals to human health, and it is hence recommended that the daily intake of the yellowfin tuna caught in the South China Sea be less than 120.00 g for adults and 37.71 g for children.
-
Key words:
- South China Sea /
- Thunnus albacares /
- heavy metals /
- enrichment /
- distribution in organs /
- food safety assessment
-
表 1 不同体型黄鳍金枪鱼中重金属元素在肌肉和肝脏中含量比较分析
重金属元素 显著性检验P值 小 中 大 Cd <0.000 1* <0.000 1* <0.000 1* Ba 0.058 6 0.623 0 0.877 2 As <0.000 1* <0.000 1* <0.000 1* Cu <0.000 1* 0.000 3* <0.000 1* Fe <0.000 1* <0.000 1* <0.000 1* Cr 0.095 7 0.381 5 0.276 2 Se <0.000 1* <0.000 1* <0.000 1* Zn <0.000 1* <0.000 1* <0.000 1* 说明:*表示差异显著(P<0.05)。 表 2 不同体型黄鳍金枪鱼肌肉组织中重金属元素单因素污染指数
不同体型 重金属元素污染指数 Cr Cd iAs* 小 0.03 0.15 0.33 中 0.03 0.16 0.33 大 0.02 0.26 0.38 注:*根据Núñez[23]的研究结果:无机砷占总砷的3%换算得来。 表 3 黄鳍金枪鱼无风险每日重金属摄入量
重金属
元素含量
Ci每周
可耐受
摄入量/g平均
体质量/kg
BW每日无风险
摄入值/g
DIlim成人 儿童 成人 儿童 Cd 0.03 7.00 70 22 2 333.33 733.33 As 1.25 15.00 120.00 37.71 -
[1] 黑儿平, 上官宇先, 喻华, 等. 成都平原农田蔬菜重金属含量及污染评价[J]. 热带生物学报, 2022, 13(1): 1 − 8. doi: 10.3969/j.issn.1674-7054.2022.1.hnrdnydxxb202201001 [2] 杨宁, 李东海, 杨小波, 等. 铅锌矿区周边土壤重金属污染及植物富集特征[J]. 热带生物学报, 2021, 12(4): 500 − 507. doi: 10.3969/j.issn.1674-7054.2021.4.hnrdnydxxb202104014 [3] ZAMORA-LEDEZMA C, NEGRETE-BOLAGAY D, FIGUEROA F, et al. Heavy metal water pollution: A fresh look about hazards, novel and conventional remediation methods [J]. Environmental Technology and Innovation, 2021, 22: e101504. doi: 10.1016/j.eti.2021.101504 [4] AKCAY H, OGUZ A, KARAPIRE C. Study of heavy metal pollution and speciation in Buyak Menderes and Gediz river sediments [J]. Water Res, 2003, 37(4): 813 − 822. doi: 10.1016/S0043-1354(02)00392-5 [5] TABARI S, SARAVI S S S, BANDANY G A, et al. Heavy metals (Zn, Pb, Cd and Cr) in fish, water and sediments sampled form Southern Caspian Sea, Iran [J]. Toxicology and Industrial Health, 2010, 26(10): 649 − 656. doi: 10.1177/0748233710377777 [6] BRIFFA J, SINAGRA E, BLUNDELL R. Heavy metal pollution in the environment and their toxicological effects on humans [J]. Heliyon, 2020, 6(9): e4691. [7] BOSCH A C, O'NEILL B, SIGGE G O, et al. Heavy metals in marine fish meat and consumer health: A review [J]. Journal of the Science of Food and Agriculture, 2016, 96(1): 32 − 48. doi: 10.1002/jsfa.7360 [8] MELGAR M J, NúñEZ R, GARCíA M á. Selenium intake from tuna in Galicia (Spain): Health risk assessment and protective role against exposure to mercury and inorganic arsenic [J]. Science of the Total Environment, 2019, 694: e133716. doi: 10.1016/j.scitotenv.2019.133716 [9] HONRYO T, TANAKA T, GUILLEN A, et al. Effect of water surface condition on survival, growth and swim bladder inflation of yellowfin tuna, Thunnus albacares (Temminck and Schlegel), larvae [J]. Aquaculture Research, 2016, 47(6): 1832 − 1840. doi: 10.1111/are.12641 [10] ROOKER J R, BREMER J R A, BLOCK B A, et al. Life history and stock structure of atlantic bluefin tuna (Thunnus thynnus) [J]. Reviews in Fisheries Science, 2007, 15(5): 265 − 310. [11] BLOCK B A, DEWAR H, BLACKWELL S B, et al. Migratory movements, depth preferences, and thermal biology of Atlantic bluefin tuna [J]. Science, 2001, 293(5533): 1310 − 1314. doi: 10.1126/science.1061197 [12] HOUSSARD P, LORRAIN A, TREMBLAY-BOYER L, et al. Trophic position increases with thermocline depth in yellowfin and bigeye tuna across the western and central Pacific Ocean [J]. Progress in Oceanography, 2017, 154: 49 − 63. doi: 10.1016/j.pocean.2017.04.008 [13] 银利强, 孔业富, 吴忠鑫, 等. 南海中西部海域春季三种金枪鱼类的营养生态位比较[J]. 生态学杂志, 2020, 39(12): 4121 − 4130. doi: 10.13292/j.1000-4890.202012.030 [14] ARAúJO C V M, CEDEñO-MACIAS L A. Heavy metals in yellowfin tuna (Thunnus albacares) and common dolphinfish (Coryphaena hippurus) landed on the Ecuadorian coast [J]. Science of the Total Environment, 2016, 541: 149 − 154. doi: 10.1016/j.scitotenv.2015.09.090 [15] DREVNICK P E, LAMBORG C H, HORGAN M J. Increase in mercury in Pacific yellowfin tuna [J]. Environmental Toxicology and Chemistry, 2015, 34(4): 931 − 934. doi: 10.1002/etc.2883 [16] SUN R, SUN Y, XIE X, et al. Bioaccumulation and human health risk assessment of DDT and its metabolites (DDTs) in yellowfin tuna (Thunnus albacares) and their prey from the South China Sea [J]. Marine Pollution Bulletin, 2020, 158: e111396. doi: 10.1016/j.marpolbul.2020.111396 [17] LIU J, XU X, DING Z, et al. Heavy metals in wild marine fish from South China Sea: levels, tissue- and species-specific accumulation and potential risk to humans [J]. Ecotoxicology, 2015, 24(7-8): 1583 − 1592. doi: 10.1007/s10646-015-1451-7 [18] 旷泽行, 汪慧娟, 谷阳光, 等. 海南岛昌化江河口海域生物体质量金属富集特征与概率健康风险评价[J]. 海洋环境科学, 2021, 40(5): 699 − 706. doi: 10.12111/j.mes.20200208 [19] POLPRASERT C. Heavy metal pollution in the Chao Phraya River estuary, Thailand [J]. Water Research, 1982, 16(6): 775 − 784. doi: 10.1016/0043-1354(82)90004-5 [20] 谢文平, 陈昆慈, 朱新平, 等. 珠江三角洲河网区水体及鱼体内重金属含量分析与评价[J]. 农业环境科学学报, 2010, 29(10): 1917 − 1923. [21] 白艳艳, 潘秋仁, 贾玉珠. 2015年厦门市售水产动物及藻类食品中重金属污染状况评价[J]. 实用预防医学, 2017, 24(11): 1314 − 1317. doi: 10.3969/j.issn.1006-3110.2017.11.010 [22] 王慧, 王博, 刘思洁. 吉林省居民膳食铅暴露风险评估[J]. 卫生研究, 2019, 48(3): 488 − 492. doi: 10.19813/j.cnki.weishengyanjiu.2019.03.022 [23] NúñEZ R, GARCíA M á, ALONSO J, et al. Arsenic, cadmium and lead in fresh and processed tuna marketed in Galicia (NW Spain): Risk assessment of dietary exposure [J]. Science of the Total Environment, 2018, 627: 322 − 331. doi: 10.1016/j.scitotenv.2018.01.253 [24] 万慧珊, 程波, 宋晓红, 等. 循环水养殖欧洲鲈鱼(Dicentrarchus labrax)重金属污染状况与富集分布特征[J]. 渔业科学进展, 2017, 38(5): 83 − 91. doi: 10.11758/yykxjz.20160826001 [25] 陈海刚, 贾晓平, 林钦, 等. 混合暴露条件下近江牡蛎对重金属的积累与释放特征[J]. 应用生态学报, 2008(4): 922 − 927. doi: 10.13287/j.1001-9332.2008.0201 [26] 张晓举, 赵升, 冯春晖, 等. 渤海湾南部海域生物体内的重金属含量与富集因素[J]. 大连海洋大学学报, 2014, 29(3): 267 − 271. doi: 10.3969/J.ISSN.2095-1388.2014.03.013 [27] 闫海鱼, 冯新斌, 刘霆, 等. 贵州百花湖鱼体汞污染现状[J]. 生态学杂志, 2008(8): 1357 − 1361. doi: 10.13292/j.1000-4890.2008.0254 [28] API M, BONFANTI E, LOMBARDO F, et al. Effects of age on growth in Atlantic bluefin tuna (Thunnus thynnus) [J]. General and Comparative Endocrinology, 2018, 265: 64 − 70. doi: 10.1016/j.ygcen.2018.01.010 [29] 连祥霖, 桑红. 锌对铅、汞致单核巨噬细胞系统毒性的拮抗作用[J]. 福建医学院学报, 1993(3): 230 − 231. [30] SAMUEL M S, DATTA S, KHANDGE R S, et al. A state of the art review on characterization of heavy metal binding metallothioneins proteins and their widespread applications [J]. Science of the Total Environment, 2021, 775: 145829. doi: 10.1016/j.scitotenv.2021.145829 [31] ASMAH R, BINEY C A. Distribution of heavy metals in tissues and organs of tuna [J]. International Journal of Fisheries and Aquatic Studies, 2014, 1(6): 82 − 86. [32] 王亚炜, 魏源送, 刘俊新. 水生生物重金属富集模型研究进展[J]. 环境科学学报, 2008(1): 12 − 20. doi: 10.3321/j.issn:0253-2468.2008.01.002 [33] 朱国平, 许柳雄, 周应祺, 等. 印度洋中西部水域黄鳍金枪鱼的食性及其季节性变化[J]. 水产学报, 2008(5): 725 − 732. [34] POTIER M, MARSAC F, LUCAS V, et al. Feeding partitioning among tuna taken in surface and mid-water layers: The case of yellowfin (Thunnus albacares) and bigeye (T. obesus) in the western tropical Indian Ocean [J]. Western Indian Ocean Journal of Marine Science, 2004, 3(1): 51 − 62. [35] ZUDAIRE I, MURUA H, GRANDE M, et al. Variations in the diet and stable isotope ratios during the ovarian development of female yellowfin tuna (Thunnus albacares) in the Western Indian Ocean [J]. Marine Biology, 2015, 162(12): 2363 − 2377. doi: 10.1007/s00227-015-2763-0 [36] LE H, SHAO X T, KROGDAHL Å, et al. Intestinal function of the stomachless fish, ban wrasse (Labrus bergylta) [J]. Frontiers in Marine Science, 2019, 6: 1 − 15. [37] OLATUNJI A E, NJOKU U G, BEKEH A F. Heavy metal analysis of selected estuarine fish species from Oron River, Oron Local Government Area, Akwa Ibom State, Nigeria [J]. American Journal of Zoology, 2021, 4(4): 50 − 56. [38] HUSSEIN A, KHALED A. Determination of metals in tuna species and bivalves from Alexandria, Egypt [J]. The Egyptian Journal of Aquatic Research, 2014, 40(1): 9 − 17. doi: 10.1016/j.ejar.2014.02.003 [39] GU Y, LIN Q, HUANG H, et al. Heavy metals in fish tissues/stomach contents in four marine wild commercially valuable fish species from the western continental shelf of South China Sea [J]. Marine Pollution Bulletin, 2017, 114(2): 1125 − 1129. doi: 10.1016/j.marpolbul.2016.10.040 [40] JARIĆ I, VIŠNJIĆ-JEFTIĆ Z, CVIJANOVIĆ G, et al. Determination of differential heavy metal and trace element accumulation in liver, gills, intestine and muscle of sterlet (Acipenser ruthenus) from the Danube River in Serbia by ICP-OES [J]. Microchemical Journal, 2011, 98(1): 77 − 81. doi: 10.1016/j.microc.2010.11.008 [41] DWIVEDI A C, TIWARI A, MAYANK P. Seasonal determination of heavy metals in muscle, gill and liver tissues of Nile tilapia, Oreochromis niloticus (Linnaeus, 1758) from the tributary of the Ganga River, India [J]. Zoology and Ecology, 2015, 25(2): 166 − 171. doi: 10.1080/21658005.2015.1020012 [42] ENDO T, HISAMICHI Y, HARAGUCHI K, et al. Hg, Zn and Cu levels in the muscle and liver of tiger sharks (Galeocerdo cuvier) from the coast of Ishigaki Island, Japan: Relationship between metal concentrations and body length [J]. Marine Pollution Bulletin, 2008, 56(10): 1774 − 1780. doi: 10.1016/j.marpolbul.2008.06.003 [43] CHEN C Y, CHEN Y T, CHEN K S, et al. Arsenic and five metal concentrations in the muscle tissue of bigeye tuna (Thunnus obesus) in the Atlantic and Indian Oceans [J]. Marine Pollution Bulletin, 2018, 129(1): 186 − 193. doi: 10.1016/j.marpolbul.2018.02.028 [44] AL-BUSAIDI M, YESUDHASON P, AL-MUGHAIRI S, et al. Toxic metals in commercial marine fish in Oman with reference to national and international standards [J]. Chemosphere, 2011, 85(1): 67 − 73. doi: 10.1016/j.chemosphere.2011.05.057 [45] ORDIANO-FLORES A, GALVáN-MAGAñA F, ROSILES-MARTINEZ R. Bioaccumulation of mercury in muscle tissue of yellowfin tuna, Thunnus albacares, of the Eastern Pacific Ocean [J]. Biological Trace Element Research, 2011, 144(1-3): 606 − 620. doi: 10.1007/s12011-011-9136-4 -





 下载:
下载: