-
海草是一种能够生活在热带与温带海域中的单子叶植物[1],是目前唯一可以在海水中完成生活史的被子植物[2]。受光照等环境因子的影响,海草的分布被限制在浅海海域[3],一般在6 m以内的潮间带和潮下带[4]。海草生态系统作为重要的蓝碳生态系统之一,其年净初级生产力可达1012 g·m−2[5],具有高效的固碳能力[6]。此外,海草能为许多海洋生物提供栖息、繁育和觅食的场所[7],具有减弱海浪能、固着底质、吸附悬浮颗粒物质以及改善水质等功能[8]。由于人类活动和全球气候变化的影响,全球海草床正在发生大规模的退化与消失[9],其中,人类活动引起的水体透光率降低被认为是导致海草生态系统退化的主要原因之一[10]。光照强度是决定海草生长、存活和分布的主要因素[11]。弱光环境下,由于光合速率降低,海草积累有机物及增加自身生物量的途径受阻[12],维持其正常生长发育所需要的能量来源减少[13],从而引起生长速率降低[14],在极低光照环境下,甚至会导致海草生态系统的退化与消失[15]。当光照强度降低时,海草大多可以通过形态特征和生理特性的改变来提高对有限光照的利用率,从而抵御弱光环境的胁迫[16]。叶片是植物进行光合作用的主要场所,其形态特征的变化可以直观地反映光照环境的变化对植物的影响及植物对不同光照环境的响应[17]。在弱光环境下,海草的叶片形态通常是减小而不是增大[17],这能够有效地减少叶片的呼吸需求[18]。但是也有研究表明,大洋波喜荡草(Posidonia oceanica)在光照减少初期通过增大叶宽来增加光合作用的面积[19]。可见不同海草在弱光环境下的形态特征响应存在差异,深入探讨其差异的原因和驱动机制,对于掌握适宜海草生长发育的光照环境具有积极意义。
光照强度的变化还会引起海草生物量积累及分配的变化。通常情况下,植物对光照减少的响应策略是将更多的生物量资源分配给地上部分,通过增加地上部分的生物量增强光捕获能力[20]。而相关研究表明,当光照减少时,海草生物量对地下部分的分配比地上部分更多[21]。当前关于不同环境下海草对生物量的分配尚不完全清楚,研究海草在不同光照环境下对生物量的调节与分配对明确其抵御弱光胁迫的机制具有一定的参考意义。
C、N、P是植物生长发育过程中的关键元素[22],植物的这些元素含量及其生态化学计量特征在不同的光照环境下具有一定的差异性[23]。RUIZ[24]的研究结果表明,50 d的遮光处理使大洋波喜荡草叶片部分的N、P含量有所增加;DAHL等[25]的研究结果表明,遮光处理使泰来草(Thalassia hemprichii)根茎部分的C含量显著减少;PREMARATHNE等[26]的室内研究结果表明,弱光处理使贝克喜盐草(Halophila beccarii)地上部分的C、N含量显著减少,其在弱光处理下的总碳储量仅约为全光照处理的1/2。这些关键元素的含量变化能够有效地反映海草对不同光照环境响应的本质。
海菖蒲(Enhalus acoroides)是一种单子叶水鳖科的大型海草,其广泛分布于印度洋-西太平洋区域,在我国仅分布于海南岛[27]。养殖活动和陆源污染物的排放等人为干扰使水体环境呈现富营养状态,这种环境会造成附着生物的增多(悬浮物的增加),从而降低海水的透光率和溶解氧,进而抑制海草的光合作用[28],导致海菖蒲的分布面积逐渐下降[29]。目前我国对海菖蒲的研究主要包括资源调查[30]、遗传结构[31]和生态恢复等[28],关于环境因子对海菖蒲的影响研究鲜有报道,而通过人工遮光手段研究不同透光率情境下海菖蒲的响应尚未见报道。本研究以海菖蒲为研究对象,通过原位搭建遮光棚,研究不同光照环境下海菖蒲的形态特征及元素含量的变化情况,研究结果将有助于揭示海草在弱光环境下的响应机制,阐明海草生态系统衰退的原因,为海草生态系统的恢复与保护提供理论依据。
-
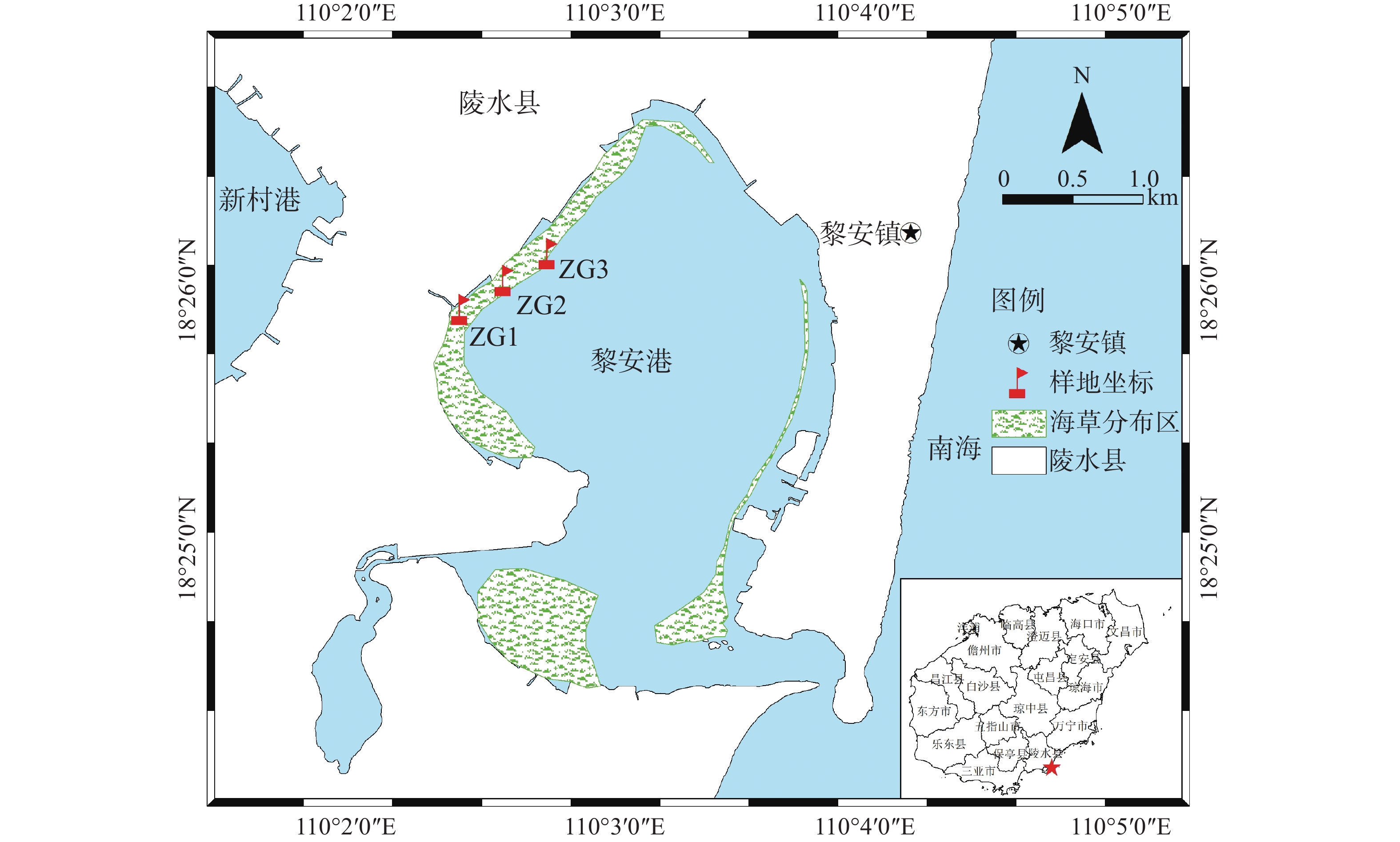
遮光实验在海南省陵水黎族自治县的黎安港进行。黎安港属热带海洋性季风气候,年平均气温25.4 ℃,雨量充沛,是一个自然形成的半封闭状态潟湖,仅由1条约60 m宽的潮汐汊道与外海相通[32]。港内海草资源丰富,分布面积约1.42 km2,种类有海菖蒲、泰来草、卵叶喜盐草(Halophila ovalis)和圆叶丝粉草(Cymodocea rotundata)等[33]。但是由于长期受人为干扰,目前黎安港海草床正逐渐发展为以海菖蒲为单一优势种的生态系统。因此,本实验选取海菖蒲为研究对象,并在展开遮光实验前对样地区域海菖蒲的生态学特征进行了本底调查(表1)。
表 1 海菖蒲的生态学特征(平均值±标准误差)
样地 叶长/cm 叶宽/cm 茎长/cm 叶片数/片 植株密度/(株∙m−2) 生物量/(kg∙m−2) ZG1 34.67±0.93b 1.74±0.04a 9.37±0.73a 4.68±0.15a 218.67±32.44a 1.49±0.16a ZG2 42.37±1.42c 1.77±0.04a 7.70±0.54a 6.78±0.19c 154.67±10.67a 1.16±0.13a ZG3 27.64±1.28a 1.72±0.03a 8.96±0.55a 5.89±0.21b 160.00±36.95a 1.14±0.24a 注: ZG1、ZG2、ZG3为3个重复样地,下同。 -
于2020−12−04在研究区域内选择位于潮间带呈片状分布、长势基本一致的海菖蒲海草床(进行遮光的区域仅有海菖蒲分布),搭建2 m×2 m的遮光棚,棚高略大于完全漂浮状态海菖蒲植株高度。遮光材料采用同种密度的黑色遮光网,通过改变遮光网层数并使用水下照度计(ZDS-10W-2D型)原位测量遮光网正下方的光照强度来确定遮光量。光照测量于正午阳光充足时进行,测量结果见表2。
表 2 原位光照测量值
样地 全光照/lx 单层遮光/lx 遮光强度/% 全光照/lx 双层遮光/lx 遮光强度/% ZG1 76000 28300 62.76 78400 6580 91.61 78700 27800 64.68 76900 7000 90.90 75300 29400 60.96 76200 7800 89.76 ZG2 56500 18500 67.26 51800 2530 95.12 59200 20500 65.37 52400 3310 93.68 58300 22700 61.06 55600 2890 94.80 ZG3 36900 14500 60.70 25800 2280 91.16 28500 12400 56.49 26900 2560 90.48 35200 16700 52.56 26200 1680 93.59 平均值 61.32 92.34 根据光照测量结果,两种遮光处理的遮光率分别近似为60%(单层遮光)和90%(双层遮光),依次标记为中度遮光组(MS)和重度遮光组(HS),同时以全光照处理(无遮光网)作为对照组(CK)。在研究区域内选取3个重复样地,间隔约200 m,每个重复样地内设置3种光照处理,每个处理设置3组重复,共27个样方(图1)。为了减少其他海洋生物附着引起的实验误差,需要每个月定期前往样地更换遮光网。
-
在2021−03−26的大潮期间,水位降低,海菖蒲露出水面时进行采样。在试验小区用25 cm×25 cm的采样框采集遮光棚正下方的海草样,将采样框内的海菖蒲连同根茎一起挖出,在原位用海水将海菖蒲上的泥沙冲洗干净。然后运输至实验室。
-
将带回实验室的海菖蒲取出,用蒸馏水对其进行冲洗,并用刀片小心刮去叶片表面的附着生物。首先测量并记录海菖蒲的叶长、叶宽、茎长、叶片数与植株数,然后用吸水纸吸干其表面水分,随后按照地上部分和地下部分(分别为叶片和根茎)剪取。经处理后的海草样放入电热鼓风干燥箱(DHG-9053A型)内,60 ℃烘干至恒重(72 h),称量各部分的干质量。
-
将每组处理内烘干的海草样按照地上部分与地下部分分别混匀后用植物粉碎机(SUS304型)进行粉碎,用于叶片部分与根茎部分有机碳、全氮和全磷含量的测定。元素含量的测定参照《土壤农化分析》[34]。有机碳含量的测定采用重铬酸钾-硫酸氧化法;全氮含量的测定采用半微量凯氏定氮法;全磷含量的测定采用钼锑抗比色法[34]。
-
采用Excel 2019和SPSS 26.0软件对数据进行处理与分析,不同光照处理下海菖蒲的形态特征与元素含量的差异性采用单因素方差分析(one-way ANOVA)和最小显著法(LSD)进行检验(α=0.05)。绘图采用Origin 9.8软件。
-
随着遮光强度的增加,海菖蒲的各项形态特征呈现不同程度的下降趋势(表3)。与全光照处理相比,60%遮光处理的叶长和叶宽分别减少了14.9%和10.9%;90%遮光处理的叶长和叶宽分别减少了27.8%和16.4%,遮光对叶片形态影响显著(P<0.05)。茎长与叶片数在不同遮光处理下的变化趋势相同,两种遮光处理下较全光照处理显著减少(P<0.05)。植株密度随着遮光强度的增加逐渐减少,但其影响没有达到显著水平(P>0.05)。
-
海菖蒲的地上部分生物量、地下部分生物量和总生物量总体表现出随着遮光强度的增加而减少的变化趋势(表4),全光照处理下的生物量均大于遮光处理。从不同部位生物量来看,遮光处理显著降低了地上部分生物量(P<0.05),而地下部分生物量受遮光的影响不显著(P>0.05)。
表 3 不同遮光处理对海菖蒲形态特征的影响(平均值±标准误差)
光照处理 叶长/cm 叶宽/cm 茎长/cm 叶片数/片 植株密度/(株∙m−2) CK 34.98±0.96a 1.65±0.02a 5.69±0.08a 4.34±0.09a 160.00±19.96a MS 29.78±1.17b 1.47±0.02b 5.13±0.09b 3.60±0.11b 145.78±11.14a HS 25.25±1.16c 1.38±0.02c 4.90±0.10b 3.35±0.11b 122.67±9.24a 注:同列不同字母表示差异显著(P<0.05)。CK:对照组;MS:中度遮光组;HS:重度遮光组。下同。 表 4 不同遮光处理对海菖蒲生物量的影响(平均值±标准误差)
光照处理 地上部分生物量/(kg∙m−2) 地下部分生物量/(kg∙m−2) 总生物量/(kg∙m−2) CK 0.16±0.01a 0.77±0.11a 0.93±0.12a MS 0.11±0.01b 0.66±0.08a 0.78±0.08a HS 0.09±0.01b 0.49±0.09a 0.58±0.09b 从分配比例来看,60%的遮光处理下生物量提高了向地下部分的分配而降低了向地上部分的分配(图2),但其影响没有达到显著性水平(P>0.05)。
-
3种光照处理下海菖蒲叶片的C、N、P含量均大于根茎(图3)。遮光处理使根茎和叶片的C含量呈现不同程度的减少趋势,其中,根茎的C含量在90%遮光处理下较全光照处理显著减少(P<0.05),但叶片的C含量在各处理间未达到差异显著性水平(P>0.05)。遮光处理下叶片的N、P含量分别较对照处理增加了10.78%~12.91%和43.45%~45.73%,遮光处理显著增加了叶片的N、P含量(P<0.05)。尽管遮光处理下根茎的N、P含量稍有减少,但其影响没有达到显著水平(P>0.05)。从分配比例来看,弱光环境下,C、N、P对叶片的分配比例有所增加,而减少了对根茎的分配比例,但均未达到显著性影响(P>0.05)。
遮光处理使海菖蒲叶片的碳氮比(C∶N)、碳磷比(C∶P)和氮磷比(N∶P)均随着遮光强度的增加而显著降低(P<0.05)(表5)。在不同光照处理下,叶片的C∶N和C∶P均小于根茎,而在全光照处理下叶片的N∶P大于根茎。根茎的C∶N随着遮光强度的增加逐渐降低,其C∶P和N∶P则随着遮光强度的增加呈现先降低后升高的变化趋势,但均未达到显著性影响(P>0.05)。综合来看,叶片的C∶N、C∶P和N∶P受遮光处理的影响较根茎要大。
表 5 不同遮光处理对海菖蒲的C∶N、C∶P和N∶P的影响(平均值±标准误差)
光照处理 叶片 根茎 C∶N C∶P N∶P C∶N C∶P N∶P CK 22.89±1.01a 250.31±25.74a 10.78±0.78a 27.99±1.24a 268.30±28.38a 9.45±0.79a MS 20.66±0.70a 175.86±17.02b 8.41±0.61b 27.71±1.49a 246.41±21.25a 8.88±0.67a HS 19.79±0.73b 164.06±13.14b 8.22±0.44b 27.45±1.38a 248.20±30.55a 8.96±0.99a -
海草的生长与分布对光照强度的变化较为敏感[4],与藻类、浮游生物等海洋生物相比,海草的最低光照要求更高[35]。研究表明,海草生活的海底环境必须要接收海水表面入射辐照度11%的光照才能维持海草的正常生长发育[3]。为了适应海底的弱光环境,海草会在形态上表现出可塑性[36],即通过改变形态特征以进一步适应环境变化[37]。光照强度的变化会直接影响海草的叶长、叶宽和植株密度等形态特征[38],能够直观地反映海草对光照强度降低的适应变化。在BERTELLI等[39]的研究中,40%与90%的遮光处理使鳗草(Zostera marina)的叶长与叶宽显著低于全光照处理。本研究取得了基本一致的结果,光照强度降低对海菖蒲的生长产生了显著的抑制作用,其叶长、叶宽、茎长和叶片数与遮光强度呈显著负相关。海草这种叶片形态的调整能够有效地降低自身的呼吸消耗,是其对弱光环境的一种适应[18]。但是,并非所有的海草物种在不同的光照环境下都具有较高的形态可塑性。形态较小,生长较快的喜盐草属(Halophila)能够通过调整叶片形态以迅速适应新的光照环境[40]。而形态较大、生长缓慢的波喜荡草属(Posidonia)在短期光照胁迫环境下无明显的形态变化,这类海草物种根茎发达,通常能够依赖自身丰富的碳水化合物储备以抵御胁迫环境[41]。这种形态变化的差异反映了不同海草物种对光照变化的响应差异。
-
海草通过光合作用进行有机物质的积累,从而增加自身的生物量。本研究发现海菖蒲的生物量随着遮光强度的增加显著减少,说明在弱光环境下,光合速率降低,生物量的积累有所减少。这与PREMARATHNE等[26]的研究结果一致,即光照的可利用性会影响海草的初级生产力,表现为低光照处理下贝克喜盐草的地上部分生物量显著减少。本研究还发现海菖蒲地上部分生物量对光照变化的响应较地下部分生物量强。叶片是植物直接感应光照变化的器官,其作为对环境因子响应的最直观的指标,可以反映海草物种对光照变化的可塑性。地上部分生物量的减少既能反映弱光环境下海草的生长发育状况,同时也表明海草通过减少自遮荫缓解弱光环境的胁迫[42],即海草通过减小叶面积以避免其叶片自身形成的光照遮挡。
光照环境的变化会影响植物对生物量资源的分配与利用[43]。一般来说,弱光环境下,海草的相对生长速率减缓,地下部分生物量比地上部分生物量减少的幅度更大,其通过增加地上部分的分配来提高叶片的光合速率[44]。本研究表明,弱光环境使海菖蒲的生物量减少了对地上部分的分配,增加了对地下部分的投资。这将有利于根茎部分的生长,增加对营养元素的吸收与利用。植物在外界环境胁迫下,也会将资源分配给地下部分,从而获取更多的地下养分资源以提高其生存能力,物种的种间差异可能会导致生物量分配在光照环境变化时的响应差异[43]。本研究海菖蒲生物量的这种分配差异并不显著,这可能与遮光起始时间、遮光强度以及遮光的持续时间等有关。本研究仅研究了短期遮光处理对海菖蒲的影响,至于在长期的弱光环境下海菖蒲的生理生态特征及其资源分配方式会发生怎样的变化,还有待进一步的研究探讨。
-
植物对C、N、P的吸收、利用与光合作用有关,同时C、N、P是光合作用过程中的关键元素[45]。本研究结果表明,遮光处理下海菖蒲叶片和根茎的C含量减少,这可能是由于弱光环境下光合速率降低,造成其合成的有机物质减少。此外,遮光处理促进了海菖蒲叶片N、P的积累,使叶片N、P含量显著高于全光照处理,而根茎部分的N、P含量有所减少,这可能是因为在光照减少时,海菖蒲将更多的养分分配到地上部分以促进其对光能的吸收与利用。在不同光照环境下,植物对C、N、P的吸收与分配能够表现出一定的生态化学计量特征[22],同时也反映了植物对不同光照环境的响应。本研究结果表明,遮光处理下叶片的C∶N、C∶P和N∶P显著降低。这可能是由于光照强度降低,海菖蒲有机物质的合成减少,C含量降低,而N、P增加了对叶片的分配比例以提高光合速率。Peralta等[11]研究发现诺氏鳗草(Zostera noltii)地上部分与地下部分的C含量随着光照的减少而降低,N含量则增加,从而导致C∶N降低。本研究结果与文献[11]的一致。
-
遮光处理对海菖蒲的形态特征、生物量以及营养元素含量等均有影响。光照减少会抑制海菖蒲的生长发育,使其叶片形态和植株密度减小,生物量降低。从分配比例来看,遮光处理下海菖蒲生物量增加了对地下部分的分配,而减少了对地上部分的分配,这将有利于增加根茎部分对营养元素的吸收,有效地缓解弱光环境的胁迫。此外,遮光处理也会显著影响海菖蒲的C、N、P含量,光合速率降低使根茎部分的C含量显著减少,N、P含量通过增加对叶片的分配以促进海菖蒲的生长发育,从而提高其对光能的捕获能力。本研究通过对海菖蒲展开原位遮光的影响研究,探讨海草生态系统对光照减少的响应方式,为恢复和保护海草生态系统提供参考依据。
Effects of shading on morphological characteristics and element content of Enhalus acoroides
-
摘要: 为了探索海草在弱光环境下的响应机制,阐明海草生态系统衰退的原因,以海南优势种海菖蒲(Enhalus acoroides)为研究对象,通过原位搭建遮光棚模拟不同的光照强度,研究海菖蒲的形态特征、生物量和元素含量等对短期光照减少的响应规律。结果表明:不同遮光处理下,海菖蒲的叶长、叶宽、茎长、叶片数以及植株密度均低于全光照处理;海菖蒲地上部分生物量在遮光处理下显著降低,而地下部分生物量受遮光影响不显著;在遮光处理下,海菖蒲叶片与根茎的有机碳(C)含量均呈现减少的趋势,而全氮(N)、全磷(P)含量向叶片的分配比例较根茎多,说明弱光环境诱导海菖蒲将更多的能量和养分分配给地上部分,从而更好地增强自身的光合作用;遮光处理显著降低了叶片的碳磷比(C∶P)和氮磷比(N∶P),根茎的碳氮比(C∶N)稍有降低,C∶P和N∶P呈现先降低后升高的变化趋势,但影响均未达到显著性水平。说明光照减少会抑制海菖蒲的生长发育。Abstract: In order to explore the response mechanism of seagrass in low light environment and clarify the reasons for the decline of seagrass ecosystem, Enhalus acoroides as the dominant species in Hainan was selected for analysis. Shades were built in situ in the sampling sites to simulate different light intensities, and E. acoroides under the shades were sampled to determine their morphological characteristics, biomass and element contents. The results showed that the leaf length, leaf width, stem length, leaf number, and plant density of E. acoroides were all lower under different shading treatments than under the control. The aboveground biomass of E. acoroides was significantly decreased under shading treatments, but the underground biomass was not significantly affected by shading treatments. Under the shading treatments, the C content of the leaves and the rhizome showed a decreasing trend, and the allocation ratio of total N and total P contents in the leaves was higher than that in the rhizome, indicating that the low light environment induces E. acoroides to distribute more energy and nutrients to the aboveground parts, thereby better enhancing its own photosynthesis. Shading treatments significantly reduced the C:P and N:P ratios in the leaves, and the C:N ratio in the rhizomes slightly decreased, while the C:P and N:P ratios in the rhizomes showed a trend of decreasing first and then increasing although their impact was not at a significant level. The experiments indicated that the light reduction would inhibit growth and development of E.acoroides.
-
Key words:
- Enhalus acoroides /
- shading /
- morphological characteristic /
- element content
-
表 1 海菖蒲的生态学特征(平均值±标准误差)
样地 叶长/cm 叶宽/cm 茎长/cm 叶片数/片 植株密度/(株∙m−2) 生物量/(kg∙m−2) ZG1 34.67±0.93b 1.74±0.04a 9.37±0.73a 4.68±0.15a 218.67±32.44a 1.49±0.16a ZG2 42.37±1.42c 1.77±0.04a 7.70±0.54a 6.78±0.19c 154.67±10.67a 1.16±0.13a ZG3 27.64±1.28a 1.72±0.03a 8.96±0.55a 5.89±0.21b 160.00±36.95a 1.14±0.24a 注: ZG1、ZG2、ZG3为3个重复样地,下同。 表 2 原位光照测量值
样地 全光照/lx 单层遮光/lx 遮光强度/% 全光照/lx 双层遮光/lx 遮光强度/% ZG1 76000 28300 62.76 78400 6580 91.61 78700 27800 64.68 76900 7000 90.90 75300 29400 60.96 76200 7800 89.76 ZG2 56500 18500 67.26 51800 2530 95.12 59200 20500 65.37 52400 3310 93.68 58300 22700 61.06 55600 2890 94.80 ZG3 36900 14500 60.70 25800 2280 91.16 28500 12400 56.49 26900 2560 90.48 35200 16700 52.56 26200 1680 93.59 平均值 61.32 92.34 表 3 不同遮光处理对海菖蒲形态特征的影响(平均值±标准误差)
光照处理 叶长/cm 叶宽/cm 茎长/cm 叶片数/片 植株密度/(株∙m−2) CK 34.98±0.96a 1.65±0.02a 5.69±0.08a 4.34±0.09a 160.00±19.96a MS 29.78±1.17b 1.47±0.02b 5.13±0.09b 3.60±0.11b 145.78±11.14a HS 25.25±1.16c 1.38±0.02c 4.90±0.10b 3.35±0.11b 122.67±9.24a 注:同列不同字母表示差异显著(P<0.05)。CK:对照组;MS:中度遮光组;HS:重度遮光组。下同。 表 4 不同遮光处理对海菖蒲生物量的影响(平均值±标准误差)
光照处理 地上部分生物量/(kg∙m−2) 地下部分生物量/(kg∙m−2) 总生物量/(kg∙m−2) CK 0.16±0.01a 0.77±0.11a 0.93±0.12a MS 0.11±0.01b 0.66±0.08a 0.78±0.08a HS 0.09±0.01b 0.49±0.09a 0.58±0.09b 表 5 不同遮光处理对海菖蒲的C∶N、C∶P和N∶P的影响(平均值±标准误差)
光照处理 叶片 根茎 C∶N C∶P N∶P C∶N C∶P N∶P CK 22.89±1.01a 250.31±25.74a 10.78±0.78a 27.99±1.24a 268.30±28.38a 9.45±0.79a MS 20.66±0.70a 175.86±17.02b 8.41±0.61b 27.71±1.49a 246.41±21.25a 8.88±0.67a HS 19.79±0.73b 164.06±13.14b 8.22±0.44b 27.45±1.38a 248.20±30.55a 8.96±0.99a -
[1] 杨宗岱. 中国海草植物地理学的研究[J]. 海洋湖沼通报, 1979(2): 41 − 46. [2] 王锁民, 崔彦农, 刘金祥, 等. 海草及海草场生态系统研究进展[J]. 草业学报, 2016, 25(11): 149 − 159. doi: 10.11686/cyxb2016025 [3] DUARTE C M. Seagrass depth limits [J]. Aquatic Botany, 1991, 40(4): 363 − 377. doi: 10.1016/0304-3770(91)90081-F [4] DENNISON W C, ORTH R J, MOORE K A, et al. Assessing water quality with submersed aquatic vegetation [J]. BioScience, 1993, 43(2): 86 − 94. doi: 10.2307/1311969 [5] DUARTE C M, CHISCANO C L. Seagrass biomass and production: a reassessment [J]. Aquatic Botany, 1999, 65(1): 159 − 174. [6] 邱广龙, 林幸助, 李宗善, 等. 海草生态系统的固碳机理及贡献[J]. 应用生态学报, 2014, 25(6): 1825 − 1832. [7] 韩秋影, 施平. 海草生态学研究进展[J]. 生态学报, 2008(11): 5561 − 5570. doi: 10.3321/j.issn:1000-0933.2008.11.040 [8] 李文涛, 张秀梅. 海草场的生态功能[J]. 中国海洋大学学报(自然科学版), 2009, 39(5): 933 − 939. [9] WAYCOTT M, DUARTE C M, CARRUTHERS T J B, et al. Accelerating loss of seagrasses across the globe threatens coastal ecosystems [J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(30): 12377 − 12381. doi: 10.1073/pnas.0905620106 [10] ORTH R J, CARRUTHERS T J B, DENNISON W C, et al. A global crisis for seagrass ecosystems [J]. BioScience, 2006, 56(12): 987 − 996. doi: 10.1641/0006-3568(2006)56[987:AGCFSE]2.0.CO;2 [11] PERALTA G, PEREZ-LLORENS J L, HERNANDEZ I, et al. Effects of light availability on growth, architecture and nutrient content of the seagrass Zostera noltii Hornem [J]. Journal of Experimental Marine Biology and Ecology, 2002, 269(1): 9 − 26. doi: 10.1016/S0022-0981(01)00393-8 [12] RUIZ J M, ROMERO J. Effects of disturbances caused by coastal constructions on spatial structure, growth dynamics and photosynthesis of the seagrass Posidonia oceanica [J]. Marine Pollution Bulletin, 2003, 46(12): 1523 − 1533. doi: 10.1016/j.marpolbul.2003.08.021 [13] SILVA J, BARROTE I, COSTA M M, et al. Physiological responses of Zostera marina and Cymodocea nodosa to light-limitation stress [J]. PLOS ONE, 2013, 8(11): e81058. doi: 10.1371/journal.pone.0081058 [14] LONGSTAFF B J, DENNISON W C. Seagrass survival during pulsed turbidity events: the effects of light deprivation on the seagrasses Halodule pinifolia and Halophila ovalis [J]. Aquatic Botany, 1999, 65(1): 105 − 121. [15] LONGSTAFF B J, LONERAGAN N R, O'DONOHUE M J, et al. Effects of light deprivation on the survival and recovery of the seagrass Halophila ovalis (R. Br. ) Hook [J]. Journal of Experimental Marine Biology and Ecology, 1999, 234(1): 1 − 27. doi: 10.1016/S0022-0981(98)00137-3 [16] RALPH P J, DURAKO M J, ENRIQUEZ S, et al. Impact of light limitation on seagrasses [J]. Journal of Experimental Marine Biology and Ecology, 2007, 350(1): 176 − 193. [17] GORDON D M, GREY K A, CHASE S C, et al. Changes to the structure and productivity of a Posidonia sinuosa meadow during and after imposed shading [J]. Aquatic Botany, 1994, 47(3/4): 265 − 275. [18] CAMPBELL S J, MILLER C J. Shoot and abundance characteristics of the seagrass Heterozostera tasmanica in Westernport estuary (south-eastern Australia) [J]. Aquatic Botany, 2002, 73(1): 33 − 46. doi: 10.1016/S0304-3770(02)00002-5 [19] VIA J D, STURMBAUER C, SCHNWEGER G, et al. Light gradients and meadow structure in Posidonia oceanica: ecomorphological and functional correlates [J]. Marine Ecology Progress Series, 1998, 163: 267 − 278. doi: 10.3354/meps163267 [20] MEDIAVILLA S, ESCUDERO A. Differences in biomass allocation patterns between saplings of two co-occurring Mediterranean oaks as reflecting different strategies in the use of light and water [J]. European Journal of Forest Research, 2010, 129(4): 697 − 706. doi: 10.1007/s10342-010-0375-2 [21] LEE K-S, DUNTON K H. Effect of in situ light reduction on the maintenance, growth and partitioning of carbon resources in Thalassia testudinum banks ex König [J]. Journal of Experimental Marine Biology and Ecology, 1997, 210(1): 53 − 73. doi: 10.1016/S0022-0981(96)02720-7 [22] PACIULLO D S C, GOMIDE C A M, CASTRO C R T, et al. Morphogenesis, biomass and nutritive value of Panicum maximum under different shade levels and fertilizer nitrogen rates [J]. Grass and Forage Science, 2017, 72(3): 590 − 600. doi: 10.1111/gfs.12264 [23] 王振南, 杨惠敏. 植物碳氮磷生态化学计量对非生物因子的响应[J]. 草业科学, 2013, 30(6): 927 − 934. [24] RUIZ J M, ROMERO J. Effects of in situ experimental shading on the Mediterranean seagrass Posidonia oceanica [J]. Marine Ecology Progress, 2001, 215: 107 − 120. doi: 10.3354/meps215107 [25] DAHL M, DEYANOVA D, LYIMO L D, et al. Effects of shading and simulated grazing on carbon sequestration in a tropical seagrass meadow [J]. Journal of Ecology, 2016, 104(3): 654 − 664. doi: 10.1111/1365-2745.12564 [26] PREMARATHNE C, JIANG Z J, HE J L, et al. Low light availability reduces the subsurface sediment carbon content in Halophila beccarii from the South China Sea [J]. Frontiers in Plant Science, 2021, 12: 664060. doi: 10.3389/fpls.2021.664060 [27] 郑凤英, 邱广龙, 范航清, 等. 中国海草的多样性、分布及保护[J]. 生物多样性, 2013, 21(5): 517 − 526. [28] 于硕, 张景平, 崔黎军, 等. 基于种子法的海菖蒲海草床恢复[J]. 热带海洋学报, 2019, 38(1): 49 − 54. [29] 陈石泉, 王道儒, 吴钟解, 等. 海南岛东海岸海草床近10 a变化趋势探讨[J]. 海洋环境科学, 2015, 34(1): 48 − 53. [30] 王道儒, 吴钟解, 陈春华, 等. 海南岛海草资源分布现状及存在威胁[J]. 海洋环境科学, 2012, 31(1): 34 − 38. doi: 10.3969/j.issn.1007-6336.2012.01.008 [31] 蒋凯, 高辉, 陈小勇. 海南岛海菖蒲种群克隆多样性和遗传结构[J]. 应用生态学报, 2018, 29(2): 397 − 402. [32] 陈石泉, 庞巧珠, 蔡泽富, 等. 海南黎安港海草床分布特征、健康状况及影响因素分析[J]. 海洋科学, 2020, 44(11): 57 − 64. [33] 蔡泽富, 陈石泉, 吴钟解, 等. 海南岛海湾与潟湖中海草的分布差异及影响分析[J]. 海洋湖沼通报, 2017(3): 74 − 84. [34] 鲍士旦. 土壤农化分析[M]. 第3版. 北京: 中国农业出版社, 2000: 285-292. [35] ABAL E G, LONERAGAN N, BOWEN P, et al. Physiological and morphological responses of the seagrass Zostera capricorni Aschers, to light intensity [J]. Journal of Experimental Marine Biology and Ecology, 1994, 178(1): 113 − 129. doi: 10.1016/0022-0981(94)90228-3 [36] WAYCOTT M, LONGSTAFF B J, MELLORS J. Seagrass population dynamics and water quality in the Great Barrier Reef region: A review and future research directions [J]. Marine Pollution Bulletin, 2005, 51(1): 343 − 350. [37] 郭美玉, 李文涛, 杨晓龙, 等. 鳗草在荣成天鹅湖不同生境中生长的适应性[J]. 应用生态学报, 2017, 28(5): 1498 − 1506. [38] LEONI V, VELA A, PASQUALINI V, et al. Effects of experimental reduction of light and nutrient enrichments (N and P) on seagrasses: A review [J]. Aquatic Conservation:Marine and Freshwater Ecosystems, 2008, 18(2): 202 − 220. doi: 10.1002/aqc.842 [39] BERTELLI C M, UNSWORTH R K F. Light stress responses by the eelgrass, Zostera marina(L) [J]. Frontiers in Environmental Science, 2018, 6(39): 1 − 13. [40] YAAKUB S M, CHEN E, BOUMA T J, et al. Chronic light reduction reduces overall resilience to additional shading stress in the seagrass Halophila ovalis [J]. Marine Pollution Bulletin, 2014, 83(2): 467 − 474. doi: 10.1016/j.marpolbul.2013.11.030 [41] OLSEN B, ENRIQUEZ S, DUARTE C M. Depth-acclimation of photosynthesis, morphology and demography of Posidonia oceanica and Cymodocea nodosa in the Spanish Mediterranean Sea [J]. Marine Ecology Progress, 2002, 236: 89 − 97. doi: 10.3354/meps236089 [42] ENRIQUEZ S, PANTOJA-REYES N I. Form-function analysis of the effect of canopy morphology on leaf self-shading in the seagrass Thalassia testudinum [J]. Oecologia, 2005, 145(2): 235 − 243. [43] WEINER J. Allocation, plasticity and allometry in plants [J]. Perspectives in Plant Ecology Evolution and Systematics, 2004, 6(4): 207 − 215. doi: 10.1078/1433-8319-00083 [44] COLLIER C J, LAVERYavery P S, MASINI R J, et al. Morphological, growth and meadow characteristics of the seagrass Posidonia sinuosa along a depth-related gradient of light availability [J]. Marine Ecology Progress Series, 2007, 337: 103 − 115. doi: 10.3354/meps337103 [45] GROOT D C D, BOOGAARD R V D, MARCELIS L F M, et al. Contrasting effects of N and P deprivation on the regulation of photosynthesis in tomato plants in relation to feedback limitation [J]. Journal of Experimental Botany, 2003, 54(389): 1957 − 1967. doi: 10.1093/jxb/erg193 -





 下载:
下载: