-
苯并[a]芘(Benzo(a) pyrene,BaP)是美国环保局(EPA)优先检测的16种多环芳烃(Polycyclic aromatic hydrocarbons,PAHs)中危害最大的一种[1]。其分布广泛,致癌性强且化学性质稳定,可通过地表径流、污水排放、海洋倾废及大气沉降等途径输入海洋环境中,对海洋生态系统和人类健康构成了极大的威胁[2-5]。研究表明,BaP可以在珊瑚体内富集,导致珊瑚虫NADPH色素P450 C减少[6],影响珊瑚的正常生长发育,扰动或破坏珊瑚与虫黄藻的共生关系,从而导致珊瑚白化[7-8]。2015年海南省洋浦湾表层沉积物中总的PAHs质量分数达到158 3.2~570 1.7 µg·kg−1,海口湾海水PAHs的质量浓度达到420.2~2 539.1 ng·L−1,污染程度已达中等水平,具有潜在的生态风险[9-10]。此外,XIANG等[11]的研究显示,由于生物蓄积,珊瑚中PAHs浓度明显高于周围沉积物,环境中的PAHs已经对珊瑚的健康产生了一定的影响。因此,针对BaP对珊瑚−虫黄藻共生体的胁迫研究,对保护南海珊瑚礁生态系统具有重要意义。
珊瑚礁是海洋生态系统的重要组成部分,然而由于人类活动和自然环境的变化,全球珊瑚礁生态系统正面临日益严重的退化趋势[12]。造礁石珊瑚和虫黄藻的共生关系是珊瑚礁生态系统的重要基础[13],虫黄藻生活于珊瑚内胚层细胞质中,受到珊瑚与虫黄藻形成的一种共生体结构的保护[14]。虫黄藻对珊瑚至关重要,它通过珊瑚虫获得代谢产物CO2、N和P进行光合作用,同时为珊瑚虫提供溶解氧和有机物如葡萄糖、甘油、氨基酸等,促进珊瑚的生长[15-17]。但是,当环境条件发生剧烈变化时,例如温度上升,环境污染物胁迫等,会影响虫黄藻与珊瑚的共生关系,从而导致珊瑚白化[18]。
珊瑚白化是一种重要的生理现象,会导致珊瑚钙化速率与生长速度降低、繁殖力下降、疾病增多和大量死亡,最终导致整个珊瑚礁生态系统功能与多样性的退化[19]。当发展到肉眼可见白化现象时,珊瑚体内的虫黄藻己经损失了70%~90%;当环境因子的变化超过珊瑚虫的耐受范围,虫黄藻的光合器官受到损伤,导致光合效率下降[20]。珊瑚白化一段时间后,如果无法恢复正常或者应激持续时间过长,将会导致珊瑚死亡[21]。在珊瑚白化过程中,虫黄藻的呼吸效率、密度以及叶绿素a的含量都有可能改变[22]。因此,维持珊瑚−虫黄藻的共生关系对于珊瑚礁生态系统的恢复力和耐受性都至关重要[23]。VAN等[24]提出协同进化提高珊瑚适应性的理论,强调培育环境耐受性珊瑚的重要性。ANTHONY等[25]主张将协同基因流、协同进化、系统生物学、栖息地工程化保护和污染物控制联合应用到未来珊瑚礁的保护之中。因此,本研究针对BaP胁迫时3种不同属珊瑚(Pocillopora damicornis,Montipora digitata,Acropora formosa)的光合与呼吸效率、密度以及叶绿素a的含量这些生理指标的变化,探究不同种属珊瑚对PAHs类污染物胁迫的敏感性,不仅可以增强人们对于珊瑚−虫黄藻共生关系的理解,还可以为选育环境耐受性珊瑚种质提供重要参考。
-
本实验所用鹿角杯型珊瑚(Pocillopora damicornis,P.d),指状蔷薇珊瑚(Montipora digitata,M.d),美丽鹿角珊瑚(Acropora formosa,A.f)均来自海南省万宁。实验用水为天然过滤海水,盐度35(便携式盐度计,LS10T),pH值为7.9~8.1(便携式pH计,PHB1),含氧量(8.0 ± 0.5) mg·L−1(Presens,Oxy-4 mini)。实验用苯并[a]芘(BaP)购自Sigma,DMSO购自Solarbio。容器为PE透明硬质塑料水箱(规格为79 cm×38 cm×26.5 cm),内附式水循环系统(森森,JQP-500F)。
-
将成体的珊瑚截取为10~15 cm大小的块状,用国象牌胶水固定于陶瓷底座上并编号,在水族箱中驯养1周[(温度:(27 ± 1) ℃;pH:8.0 ± 0.1;盐度:35]。实验中设置1个对照组和5个胁迫组,分别为DMSO溶剂对照组和1.0 μg·L−1 BaP、12.5 μg·L−1 BaP、25.0 μg·L−1 BaP、50.0 μg·L−1 BaP、100.0 μg·L−1 BaP,每组放置3种珊瑚,每种珊瑚安排9个重复。实验中每天定时更换新的海水并分别加入体积相同的DMSO和BaP溶液。7:00~19:00用LED水族灯进行补光。分别在胁迫第0天、第3天、第5天、第7天后取样,样品置于液氮快速冷冻后放进超低温−80 ℃冰箱备用。
-
剪取约1 g的珊瑚样品,用洗牙器将其表面的虫黄藻冲洗干净,收集藻液并计录体积,珊瑚骨骼烘干后测表面积。用玻璃棒搅拌10 min将藻液混匀,吸取10 mL加入离心管中,加入1 mL甲醛振荡混匀(可置于0 ℃保存)。虫黄藻计数采用血细胞计数法,吸取少许藻液,滴在血细胞计数板边缘,使藻液渗入计数区。将血细胞计数板置于显微镜下计数,每组藻样计数8~10次,取平均值。
用石蜡包埋法测定珊瑚样品表面积[26]。选取7块高为5.0 cm,半径分别为0.40、0.50、0.60、0.75、1.00、1.50、2.00 cm的圆柱体木块作为标准物。用恒温水浴锅将两种不同熔点的固体石蜡分别加热到熔融温度直至完全熔化[高熔点石蜡:(63 ± 1) ℃;低熔点石蜡:(57 ± 1 )℃]。将标准物和珊瑚骨骼样品先浸入高熔点石蜡熔融液中,静置3 s后取出并轻微摇动,防止形成蜡滴,25 ℃放置30 min后用分析天平称取质量,记为m1。随后将裹上高熔点石蜡的物品再浸入低熔点石蜡熔融液中,重复上述步骤,称取质量,记为m2。构建标准物的质量差(m2 − m1)与表面积的线性回归方程(y=23.435x+10.513,R2=0.99)。最后,将珊瑚样品的质量差代入方程中计算得到珊瑚样品的表面积。
-
剪取约1 g的珊瑚样品,用洗牙器将其表面的虫黄藻冲洗干净并收集藻液,用玻璃棒搅拌10 min将藻液混匀,取10 mL于铝箔遮光的离心管中,用Whatman GF/F玻璃纤维滤膜抽滤藻液,抽干后将滤膜对折,放进研钵中加入少量石英砂和丙酮研磨5 min,冲洗,转移到遮光离心管中,定容至5 mL,在4 ℃下,避光萃取24 h。转速4 000 r·mim−1离心10 min,然后用针式滤器过滤上清液得到叶绿素a的丙酮提取液。用酶标仪测量在750、664、647、630 nm波长下提取液的吸光值。叶绿素a浓度计算公式参照HJ 897—2017标准[27]。
-
试验数据用Excel 2010汇总处理,用GraphPad Prism 8.0分析作图,用SPSS Statistics 23进行显著性比较,P< 0.05为差异显著。
-
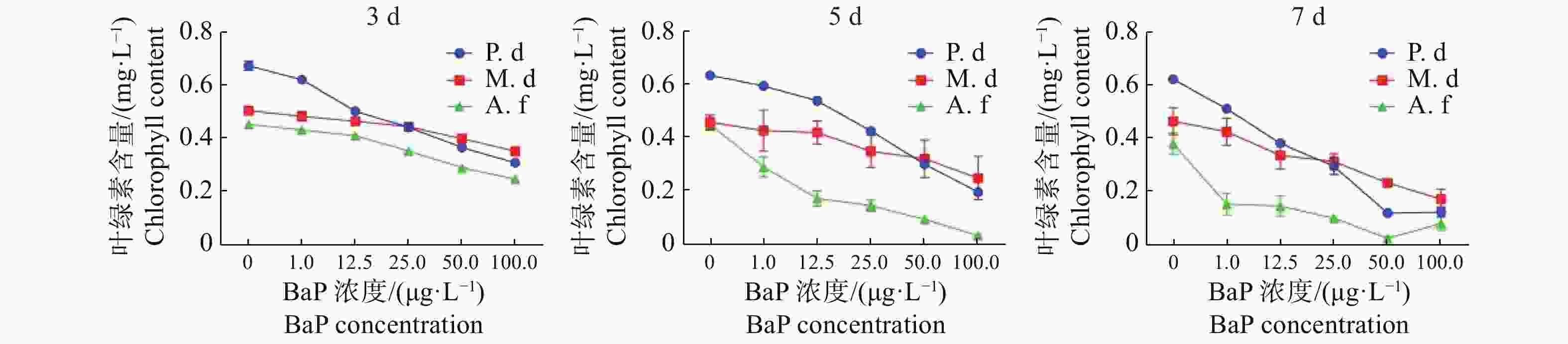
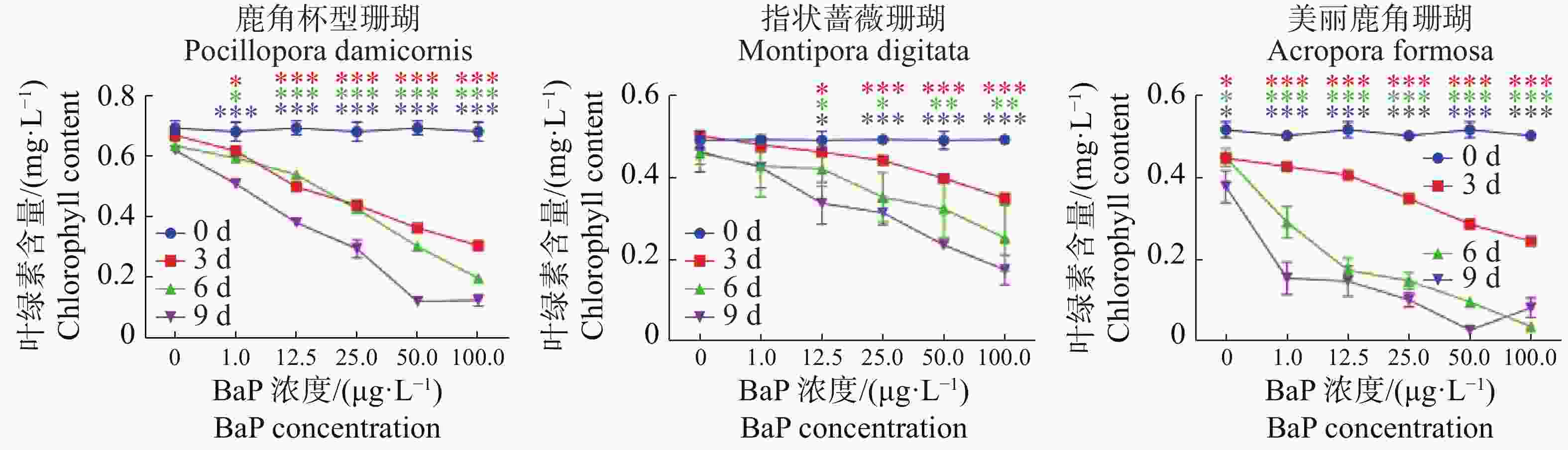
由图1可知,对于同一种珊瑚,以0天为对照,随着胁迫时间的增加叶绿素a含量整体呈下降趋势。与0天相比,指状蔷薇珊瑚在12.5 μg·L−1时叶绿素含量差异不显著(P>0.05),而鹿角杯型珊瑚和美丽鹿角珊瑚差异显著(P< 0.05)。3种珊瑚在胁迫7 d时,叶绿素a含量下降的变化达极显著(P <0.01)。由图2可知,与0 μg·L−1的DMSO对照组相比,3种珊瑚叶绿素a含量在胁迫后都出现显示出了下降趋势,其中,美丽鹿角珊瑚分别在100 μg·L−1胁迫5 d和50 μg·L−1胁迫7 d时,叶绿素a含量接近0 mg·L−1。3种珊瑚随着胁迫浓度的增加叶绿素a含量显著下降,同一胁迫浓度下,时间越久叶绿素a含量下降越显著。其中,指状蔷薇珊瑚的叶绿素a变化程度较低,表现出较强的耐受性,美丽鹿角珊瑚对BaP胁迫敏感。
-
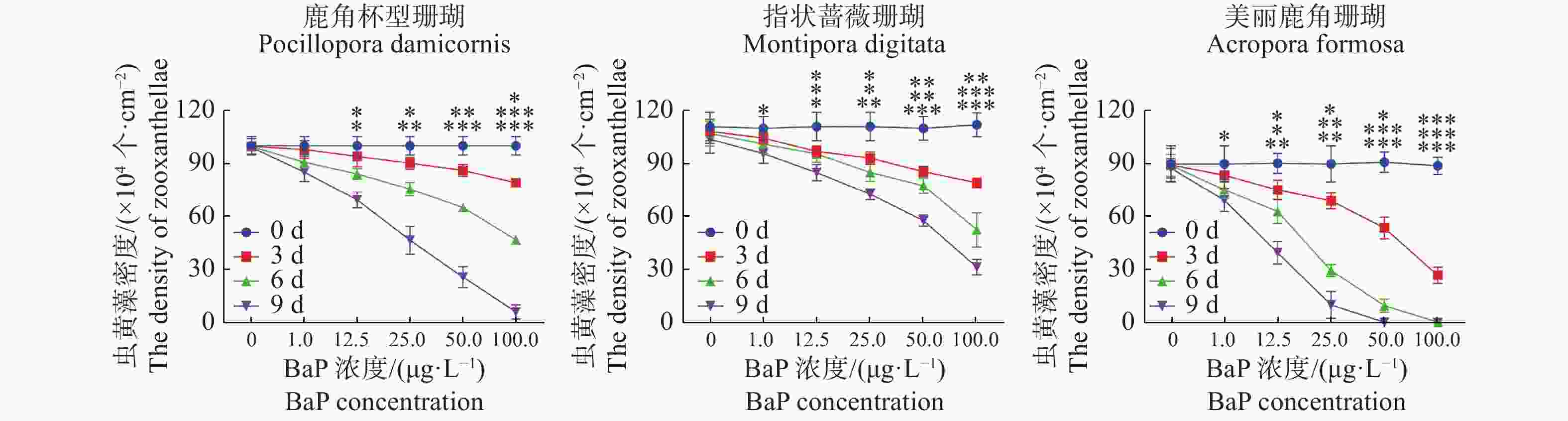
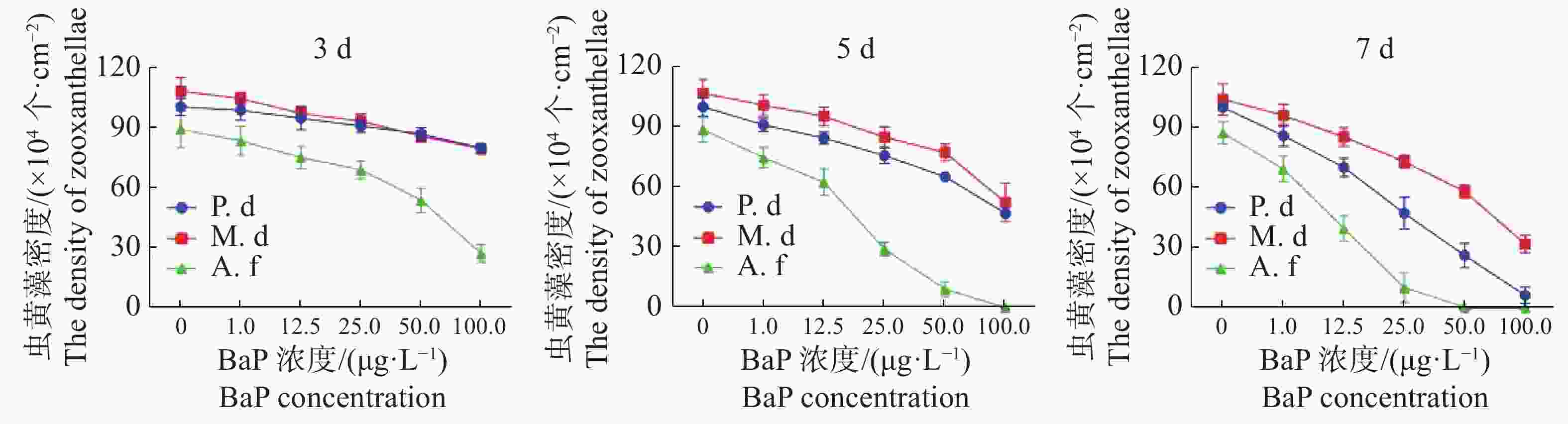
共生虫黄藻密度的变化与叶绿素a含量的变化显现出相似趋势。t检验差异显著(P < 0.05)。由图3和图4可知,美丽鹿角珊瑚的共生虫黄藻密度减少更严重。在100 μg·L−1胁迫5 d时,美丽鹿角珊瑚的虫黄藻密度降至(0.6287 ± 0.2489)×104 个·cm−2,此时已经严重白化;在50 μg·L−1胁迫7 d时,美丽鹿角珊瑚的虫黄藻密度降到(0.5297 ± 0.1465)×104 个·cm−2,鹿角杯型珊瑚在100 μg·L−1胁迫7 d后,虫黄藻密度下降到最低水平[(6.3726 ± 3.9607)×104 个·cm−2],而相同胁迫条件下的指状蔷薇珊瑚与虫黄藻的共生关系则显示出更强的稳定性。
-
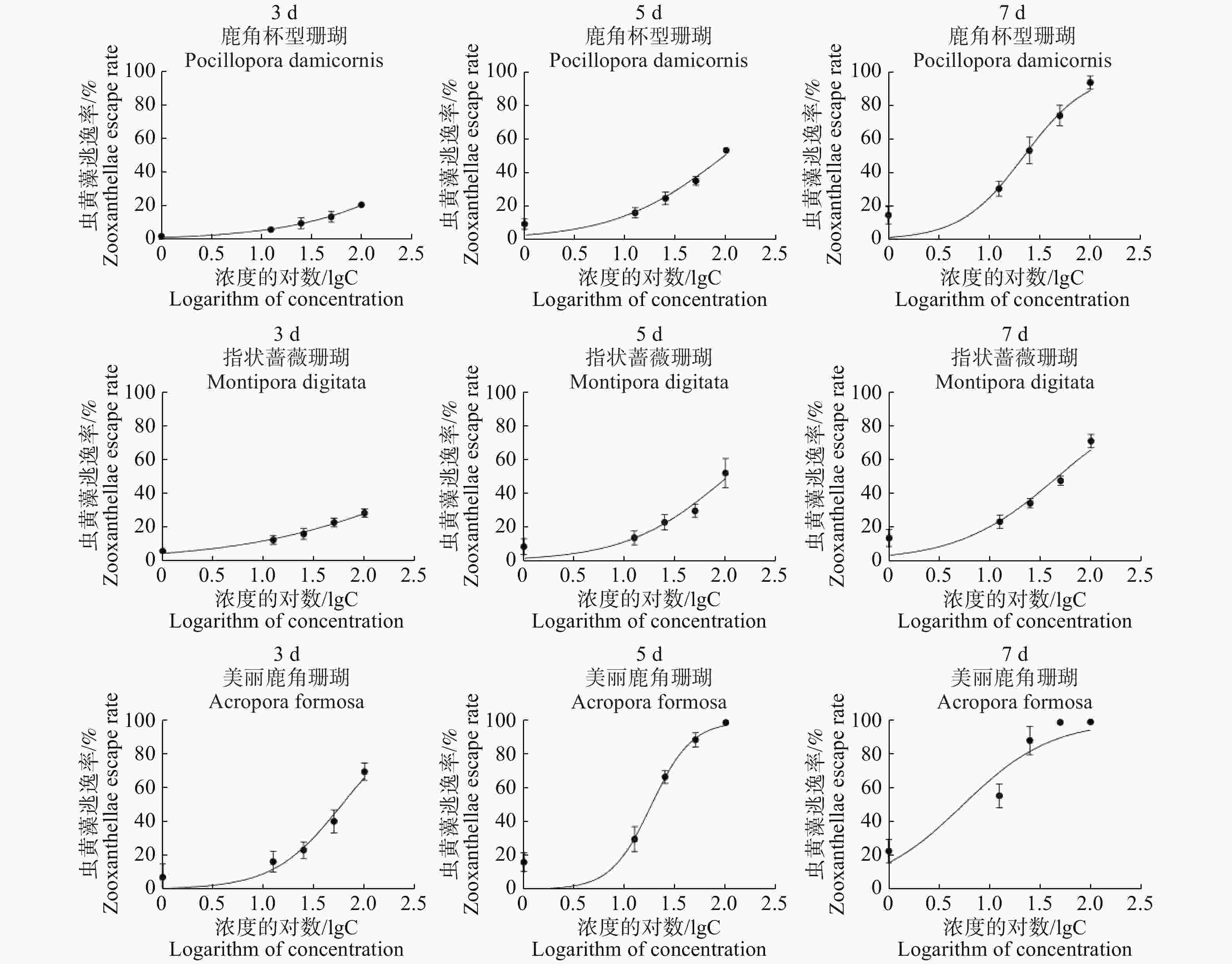
本研究中使用GraphPad Prism 8.0的非线性回归曲线来计算半数效应浓度EC50的值[28-29],拟合模型为“Logistic模型”。
操作中,首先要在Excel 2010中将虫黄藻密度的数值mean和标准差SD转换为虫黄藻的逃逸率(%)和标准差率(%)作为mean(%)和SD(%),胁迫浓度值转化为log10。采用“XY”功能选项输入GraphPad Prism 8.0后选“分析工具栏(Analyses)”中的曲线拟合工具,再选择“Dose-response-Stimulation”功能选项中的“Log(agonist)vs. normalized response-Variable slope”即可拟合出曲线(图5),并自动计算出EC50的值。
由表1可知,3种珊瑚的BaP胁迫7 d的半数效应浓度(EC50)分别为指状蔷薇珊瑚47.00 μg·L−1,鹿角杯型珊瑚22.15 μg·L−1,美丽鹿角珊瑚5.38 μg·L−1。由此可知,在BaP胁迫下,3种珊瑚耐受能力依次为:指状蔷薇珊瑚>鹿角杯型珊瑚>美丽鹿角珊瑚。
表 1 3种珊瑚的半数效应浓度
Table 1. The median effective concentration of three corals
种类
Species胁迫时间/d
Exposure time回归方程
Regression equation相关系数
Correlation(R2)EC50/
(μg·L−1)95%置信区间/
(μg·L−1)
Confidence interval鹿角杯型珊瑚
Pocillopora damicornis3 Y=100/1+10^((2.912−X)× 0.642) 0.994 9 817.40 520.00~1 517.00 5 Y=100/1+10^((1.989−X) × 0.791) 0.928 8 97.47 61.95~325.90 7 Y=100/1+10^((1.345−X) × 1.377) 0.924 4 22.15 9.15~35.86 指状蔷薇珊瑚
Montipora digitata3 Y=100/1+10^((2.875−X) × 0.464) 0.912 6 750.40 402.60~1 927.00 5 Y=100/1+10^((2.017−X) × 0.868) 0.855 4 104.10 78.50-173.70 7 Y=100/1+10^((1.672−X) × 0.882) 0.903 6 47.00 37.98~59.97 美丽鹿角珊瑚
Acropora formosa3 Y=100/1+10^((1.774−X) × 1.283) 0.909 3 59.37 49.66~73.01 5 Y=100/1+10^((1.262−X) × 2.164) 0.935 6 18.27 15.29~21.39 7 Y=100/1+10^((0.730−X) × 0.988) 0.888 5 5.38 2.95~12.84 注:表中的^表示次方的运算符号。
Note: The ^ in the table represents the exponentiation symbol. -
珊瑚和虫黄藻的生理响应是研究珊瑚−虫黄藻共生体的关键指标,对后续深入研究具有重要的参考价值。笔者在研究中发现,随着胁迫时间的增加,珊瑚分泌粘液增多,虫黄藻逃逸后水质明显变浑浊。这可能是由于珊瑚对于PAHs具有生物富集作用,并且珊瑚受胁迫时产生的粘液对PAHs的富集起重要作用[30]。珊瑚受到特定的PAHs的破坏作用可以通过存在紫外线辐射而进一步增强,这称为光毒性,光毒性会与PAHs共同作用对珊瑚产生影响[31]。因此,在探究BaP胁迫下珊瑚−虫黄藻的生理指标变化的实验过程中,要有效控制温度、光照、营养盐变化的影响[31-33]。然而珊瑚−虫黄藻共生体除了这2种生物存在的同时还有其他生物,例如藻类、细菌等微生物,附着在珊瑚骨骼表面[34]。
本研究测定了珊瑚−虫黄藻共生体的光合与呼吸效率、共生虫黄藻叶绿素a含量、共生虫黄藻密度,通过数据拟合计算得出珊瑚−虫黄藻共生体的半数效应浓度EC50。结果表明,在BaP胁迫下,3种珊瑚耐受能力依次为:指状蔷薇珊瑚 > 鹿角杯型珊瑚 > 美丽鹿角珊瑚,即3种珊瑚中,美丽鹿角珊瑚对BaP胁迫最敏感。这与骆雯雯[35]的研究结论一致:鹿角珊瑚在异常温度急性胁迫下耐受性最差。同时,也与JAFARABADI等[36]的研究结论一致。据报道,美丽鹿角珊瑚在10 μg·L−1的BaP暴露72 h后,体内的CAT酶活性显著增加,而SOD酶和T-AOC酶活性显著降低,这会导致珊瑚体内产生过多的ROS,造成更大的氧化应激损伤[37]。在基因表达方面,细胞防御相关基因表达水平的变化发生在大部分抗氧化酶活性之前。在BaP暴露24 h时,Hsp90基因的表达水平在美丽鹿角珊瑚中受到了显著的抑制,P-gp基因表达水平受到显著诱导,Hsp90基因可被用作生物标记物以监控鹿角珊瑚的健康[38]。也有研究报道,在外界污染物的胁迫下,Hsp90基因的表达水平达到峰值之后,会随着胁迫时间的延长而不断降低[39]。因此,本研究探索了对BaP胁迫敏感珊瑚的鉴定方法,为后续从基因转录表达水平以及蛋白质表达差异性方面研究胁迫响应机制打下了基础。
Effect of Benzo [α] pyrene Stress on the Zooxanthellae Density and Content of Chlorophyll a in Three Scleractinians
-
摘要: 苯并[a]芘[Benzo(a) pyrene,BaP]是一种在环境中广泛存在的有毒的环境污染物,珊瑚是构成珊瑚礁生态系统的基石,具有重要的价值。本研究以南海3种典型的造礁石珊瑚:鹿角杯型珊瑚(Pocillopora damicornis)、指状蔷薇珊瑚(Montipora digitata)和美丽鹿角珊瑚(Acropora formosa)为研究对象,分别设置二甲基亚砜(DMSO)溶剂对照组和1.0、12.5、25.0、50.0、100.0 μg·L−1的BaP胁迫组。分别在胁迫第0天、第3天、第5天、第7天后取样。测定了珊瑚−虫黄藻共生体的共生虫黄藻密度及其叶绿素a含量的变化,并通过“Logistic模型”拟合出共生虫黄藻逃逸的半数效应浓度(EC50)。结果表明:BaP胁迫7 d的EC50分别为指状蔷薇珊瑚47.00 μg·L−1、鹿角杯型珊瑚22.15 μg·L−1、美丽鹿角珊瑚5.38 μg·L−1。综合分析各项生理指标,在BaP胁迫下,美丽鹿角珊瑚更敏感,3种珊瑚耐受力排序为:指状蔷薇珊瑚>鹿角杯型珊瑚>美丽鹿角珊瑚。Abstract: Benzo [α] pyrene (Benzo (a) pyrene, BaP) is a toxic environmental pollutant that exists widely in the environment. Corals are the cornerstones of coral reef ecosystems with important values. Three typical reef-building corals in the South China Sea, Pocillopora damicornis, Montipora digitata, Acropora formosa, and Acropora formosa, were selected and treated with BaP at the concentrations of 1 μg·L−1, 12.5 μg·L−1, 25 μg·L−1, 50 μg·L−1, 100 μg·L−1, respectively, with the DMSO solvent as control. Samples were collected on the initial 0th day; the 3rd, 5th, and 7th day after exposure to the BaP stress at different concentrations. The photosynthetic and respiratory metabolism rate, the density of the symbiotic zooxanthellae and the change of chlorophyll a content of the coral-zooxanthellae symbiont were measured, and “Logistic model” was used to fit the median effective concentration (EC50) of BaP for the symbiotic zooxanthellae. The results showed that the EC50 of BaP on the 7th day was 47.00 μg·L−1 for M. digitata, 22.15 μg·L−1 for P. damicornis, and 5.38 μg·L−1 for A. formosa. Comprehensive analysis of various physiological indicators showed that A. formosa was most sensitive to BaP among the three corals which were tolerant to BaP in the order of M. digitata > P. damicornis > A. formosa.
-
Key words:
- Benzo (a) pyrene /
- stress /
- EC50 /
- sensitivity
-
表 1 3种珊瑚的半数效应浓度
Table 1 The median effective concentration of three corals
种类
Species胁迫时间/d
Exposure time回归方程
Regression equation相关系数
Correlation(R2)EC50/
(μg·L−1)95%置信区间/
(μg·L−1)
Confidence interval鹿角杯型珊瑚
Pocillopora damicornis3 Y=100/1+10^((2.912−X)× 0.642) 0.994 9 817.40 520.00~1 517.00 5 Y=100/1+10^((1.989−X) × 0.791) 0.928 8 97.47 61.95~325.90 7 Y=100/1+10^((1.345−X) × 1.377) 0.924 4 22.15 9.15~35.86 指状蔷薇珊瑚
Montipora digitata3 Y=100/1+10^((2.875−X) × 0.464) 0.912 6 750.40 402.60~1 927.00 5 Y=100/1+10^((2.017−X) × 0.868) 0.855 4 104.10 78.50-173.70 7 Y=100/1+10^((1.672−X) × 0.882) 0.903 6 47.00 37.98~59.97 美丽鹿角珊瑚
Acropora formosa3 Y=100/1+10^((1.774−X) × 1.283) 0.909 3 59.37 49.66~73.01 5 Y=100/1+10^((1.262−X) × 2.164) 0.935 6 18.27 15.29~21.39 7 Y=100/1+10^((0.730−X) × 0.988) 0.888 5 5.38 2.95~12.84 注:表中的^表示次方的运算符号。
Note: The ^ in the table represents the exponentiation symbol. -
[1] CHANG K, FANG G, CHEN J, et al. Atmospheric polycyclic aromatic hydrocarbons (PAHs) in Asia: A review from 1999 to 2004 [J]. Environmental Pollution, 2006, 142(3): 388 − 396. doi: 10.1016/j.envpol.2005.09.025 [2] 王泰. 海河河口水环境中POPs的污染特征及来源解析[D]. 北京: 清华大学, 2010. [3] MESQUITA S R, DROOGE B L V, RECHE C, et al. Toxic assessment of urban atmospheric particle-bound PAHs: Relevance of composition and particle size in Barcelona (Spain) [J]. Environmental Pollution, 2014, 184(1): 555 − 562. [4] 刘敏, 侯立军, 邹惠仙, 等. 长江口潮滩表层沉积物中多环芳烃分布特征[J]. 中国环境科学, 2001, 21(4): 343 − 346. doi: 10.3321/j.issn:1000-6923.2001.04.014 [5] HEIT M, TAN Y, KLUSEK C, et al. Anthropogenic trace elements and polycyclic aromatic hydrocarbon levels in sediment cores from two lakes in the Adirondack acid lake region [J]. Water Air and Soil Pollution, 1981, 15(4): 441 − 464. doi: 10.1007/BF00279426 [6] RAMOS R, GARCÍA E. Induction of mixed-function oxygenase system and antioxidant enzymes in the coral Montastraea faveolata on acute exposure to benzo(a)pyrene [J]. Comparative Biochemistry and Physiology - Part C: Toxicology & Pharmacology, 2007, 144(4): 348 − 355. [7] POULSEN A, BURNS K, LOUGH J, et al. Trace analysis of hydrocarbons in coral cores from Saudi Arabia [J]. Organic Geochemistry, 2006, 37(12): 1913 − 1930. doi: 10.1016/j.orggeochem.2006.07.011 [8] MARTINEZ M D C G, ROMERO P R, BANASZAK A T. Photoinduced toxicity of the polycyclic aromatic hydrocarbon, fluoranthene, on the coral, Porites divaricata. [J]. Journal of Environmental Science & Health Part A Toxic/hazardous Substances & Environmental Engineering, 2007, 42(10): 1495 − 1502. [9] LI P, DIAO X, ZHANG Y, et al. Polycyclic aromatic hydrocarbons in surface sediment from Yangpu Bay, China: Distribution, sources and risk assessment [J]. Marine Pollution Bulletin, 2015, 99(1/2): 312 − 319. [10] LI Y, LI P, MA W, et al. Spatial and temporal distribution and risk assessment of polycyclic aromatic hydrocarbons in surface seawater from the Haikou Bay, China [J]. Marine Pollution Bulletin, 2015, 92(1/2): 244 − 251. [11] XIANG N, JIANG C, YANG T, et al. Occurrence and distribution of Polycyclic aromatic hydrocarbons (PAHs) in seawater, sediments and corals from Hainan Island, China [J]. Ecotoxicology and Environmental Safety, 2018, 152: 8 − 15. doi: 10.1016/j.ecoenv.2018.01.006 [12] 黄晖, 李秀保. 南海珊瑚生物学与珊瑚礁生态学[J]. 科学通报, 2013, 58(17): 1573. [13] BLACKALL L L, WILSON B, OPPEN M J H V. Coral—the world’s most diverse symbiotic ecosystem [J]. Molecular Ecology, 2015, 24(21): 5330 − 5347. doi: 10.1111/mec.13400 [14] OPPEN M J H V, GATES R D. Conservation genetics and the resilience of reef building corals [J]. Molecular Ecology, 2010, 15(13): 3863 − 3883. [15] CHEN C S, LIN H P, YEH C C, et al. Use of a fluorescent membrane probe to identify zooxanthellae in hospite among dissociated endoderm cell culture from coral [J]. Protoplasma, 2005, 226(3/4): 175 − 179. [16] TITLYANOV E A, TITLYANOVA T V. Symbiotic Relationships between microalgal zooxanthellae and reef-building coral polyps in the process of autotrophic and heterotrophic nutrition [J]. Russian Journal of Marine Biology, 2020, 46(5): 307 − 318. doi: 10.1134/S1063074020050107 [17] BAROTT K L, VENN A A, PEREZ S O, et al. Coral host cells acidify symbiotic algal microenvironment to promote photosynthesis [J]. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(2): 607 − 612. doi: 10.1073/pnas.1413483112 [18] HUGHES T P, KERRY J T, LVAREZ-NORIEGA M, et al. Global warming and recurrent mass bleaching of corals [J]. Nature, 2017, 543(7645): 373 − 377. doi: 10.1038/nature21707 [19] DOWNS C A, OSTRANDER G K, ROUGEE L, et al. The use of cellular diagnostics for identifying sub-lethal stress in reef corals [J]. Ecotoxicology, 2012, 21(3): 768 − 782. doi: 10.1007/s10646-011-0837-4 [20] 李泽鹏. 主要环境因子对滨珊瑚的胁迫作用研究[D]. 湛江: 广东海洋大学, 2012. [21] 沈城, 刘楚吾, 刘丽. 温度胁迫及恢复初期稀杯盔形珊瑚共生虫黄藻Hsp70、Hsp90、psaA、psbA基因表达分析[J]. 热带海洋学报, 2016, 35(3): 72 − 78. doi: 10.11978/2015056 [22] MIZEREK T L, BAIRD A H, MADIN J S. Species traits as indicators of coral bleaching [J]. Coral Reefs, 2018, 37: 1 − 10. doi: 10.1007/s00338-017-1615-4 [23] STIMSON J, SAKAI K, SEMBALI H. Interspecific comparison of the symbiotic relationship in corals with high and low rates of bleaching-induced mortality [J]. Coral Reefs, 2002, 21(4): 409 − 421. doi: 10.1007/s00338-002-0264-3 [24] VAN OPPEN M J H, OLIVER J K, PUTNAM H M, et al. Building coral reef resilience through assisted evolution [J]. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(8): 2307 − 2313. doi: 10.1073/pnas.1422301112 [25] ANTHONY K, BAY L K, COSTANZA R, et al. New interventions are needed to save coral reefs [J]. Nature Ecology & Evolution, 2017, 1(10): 1420 − 1422. [26] 梁宇娴, 俞晓磊, 郭亚娟, 等. 3种传统方法对不同珊瑚表面积测量的适用性及其校准方法——以3D扫描技术为基准[J]. 热带海洋学报, 2020, 39(1): 85 − 93. [27] 环境保护部. 水质 叶绿素a的测定 分光光度法: HJ 897−2017[S]. 北京: 中国环境出版社, 2018. [28] LI J L, LIU X Y, XIE J T, et al. A Comparison of Different Estimation Methods for Fungicide EC50and EC95 Values [J]. Journal of Phytopathology, 2015, 163(4): 239 − 244. doi: 10.1111/jph.12312 [29] 于童, 白喜云, 解晓晶, 等. 应用GraphPad Prism 5.0(R)软件计算药物的EC50[J]. 药学进展, 2012, 36(4): 180 − 183. doi: 10.3969/j.issn.1001-5094.2012.04.006 [30] HAN M, ZHANG R, YU K, et al. Polycyclic aromatic hydrocarbons (PAHs) in corals of the South China Sea: occurrence, distribution, bioaccumulation, and considerable role of coral Mucus [J]. Journal of Hazardous Materials, 2019, 384: 1 − 8. [31] OVERMANS S, NORDBORG M, DIAZ-RUA R, et al. Phototoxic effects of PAH and UVA exposure on molecular responses and developmental success in coral larvae[J].Aquatic Toxicology, 2018, 198: 165 − 174. [32] 晁华. NO3−、NH4+和PO43−对珊瑚的胁迫作用[D]. 湛江: 广东海洋大学, 2016. [33] 李淑, 余克服, 施祺, 等. 造礁石珊瑚对低温的耐受能力及响应模式[J]. 应用生态学报, 2009(9): 2289 − 2295. [34] 廖芝衡, 余克服, 王英辉. 大型海藻在珊瑚礁退化过程中的作用[J]. 生态学报, 2016, 36(21): 6687 − 6695. [35] 骆雯雯. 涠洲岛造礁石珊瑚共生体系对异常温度胁迫响应的实验研究[D]. 南宁: 广西大学, 2019. [36] JAFARABADI A R, BAKHTIARI A R, ALIABADIAN M, et al. First report of bioaccumulation and bioconcentration of aliphatic hydrocarbons (AHs) and persistent organic pollutants (PAHs, PCBs and PCNs) and their effects on alcyonacea and scleractinian corals and their endosymbiotic algae from the Persian Gulf, Iran: Inter and intra-species differences [J]. Science of The Total Environment, 2018, 627: 141 − 157. [37] XIANG N, JIANG C, HUANG W, et al. The impact of acute benzo(a)pyrene on antioxidant enzyme and stress-related genes in tropical stony corals (Acropora spp.) [J]. Science of the Total Environment, 2019, 694: 1 − 6. [38] 项楠. 珊瑚礁区PAHs分布特征及对珊瑚的毒理效应[D]. 海口: 海南大学, 2018. [39] LIU H H, WU J, XU M S. A novel biomarker for marine environmental pollution of HSP90 from Mytilus coruscus [J]. Marine Pollution Bulletin, 2016, 111(1/2): 428 − 434. -




 下载:
下载: