-
三基序蛋白21(Tripartite motif-containing protein 21, TRIM21)又称Ro52或SS-A,广泛表达于各种细胞中[1]。TRIM21属于TRIM大家族的一员,它由N端的RING结构域、B-box结构域以及卷曲螺旋结构域(Coiled-coil)组成,其中,卷曲螺旋结构域构成了N端尾部。此外,它还有1个可变的C末端,所以TRIM家族也被称为RBCC家族[2-4]。TRIM 家族最显著的结构特征是RBCC结构域在顺序和空间上的高度保守性。目前发现TRIM超家族共有80多个成员,主要在细胞质及细胞核中表达,它参与细胞增殖、分化、凋亡以及细胞信号转导等多种生物学过程[5-6]。研究表明,E3泛素连接酶TRIM21与人类疾病密切相关,如TRIM21对血管内皮功能紊乱和急性肺损伤具有重要的作用,在一定程度上TRIM21减轻了肺部炎症的复发[7]。此外,在患有系统性红斑狼疮的外周血单核细胞中TRIM21的表达量明显升高,因此,TRIM21还与系统性红斑狼具有相关性[8]。除了与人类疾病的关系之外,TRIM21还参与固有免疫相关的生物学过程,具有抗病毒功能,尤其抑制逆转录病毒的复制增殖[9]。可见,TRIM21基因mRNA表达的定量检测是研究者深入挖掘TRIM21功能的基础。因此,本研究通过TRIM21基因序列设计引物,常规PCR扩增后将其与pMD-18T载体连接,以该重组质粒为模板,建立了SYBR Green ⅠPCR检测方法,为更深入研究TRIM21在疾病及病毒增殖中的功能提供技术支持。
-
本实验所用人胚肾细胞(HEK293)、人宫颈癌细胞(Hela)、金仓鼠肾细胞(BHK-21)、小鼠成肌细胞(C2C12)、猪肾细胞(PK15和IBRS-2)、人胰腺癌细胞(PANC-1)、人肝癌细胞(Huh7和PANC-1)等均由西北民族大学生物工程与技术重点实验室保存及提供。细胞培养基为10% FBS DMEM,所有细胞均在37 ℃,5%CO2培养箱中进行培养。
-
胰蛋白酶、新生牛血清和DMEM培养基购自兰州民海生物工程有限公司;细胞总RNA提取试剂盒RNAiso plus、LA-Taq聚合酶、M-MLV反转录酶、pMD-18T vector,EcoR I,Xba I购自TaKaRa有限公司;随机引物、DEPC水购自上海生工;质粒小提试剂盒及胶回收试剂盒购自全式金有限公司;SYBR Green购自美国ABI有限公司;大肠杆菌感受态细胞BL21,pcDNA3.1,pMD-18T-TRIM13,pMD-18T-IFITM1,pMD-18T-Vipron载体均由西北民族大学生物工程与技术重点实验室提供。
-
根据Genbank上公布的TRIM21基因序列(GenBank号:BC010861.1),运用Primer3.0设计1对常规引物(即TRIM21-F,TRIM21-R),在TRIM21的上游和下游分别加入限制性酶切位点,EcoRI和Xba I,该引物预扩增片段长度为1 428 bp。同时,在不同种属保守区域设计了1对荧光定量的引物 (即TRIM21-qF和TRIM21-qR),引物由上海生工合成(表1)。
表 1 引物序列
Table 1. Sequence of primers
引物名称 Primer 引物序列 Primer sequence 5′-3′ 扩增长度 Length/bp Universal primer TRIM21-F 5′-GGAATTCATGGCTTCAGCAGCACGCTTGACAATGAT-3′ 1 428 TRIM21-R 5′-GCTCTAGATCAATAGTCAGTGGATCCTTGTGATCCAATA-3′ SYBR Green ⅠPCR Primer TRIM21-qF 5′- CAGCAGCACGCTTGACAATGATG-3′ 80 TRIM21-qR 5′-GATGCTCACAGGCTCCACGAAG-3′ -
根据RNAiso Plus 试剂盒说明书提取Hela细胞中的RNA,反转录获得cDNA。反转录采用两步法进行,以得到的cDNA为模板扩增TRIM21基因。PCR反应体系为:TRIM21-F/R各1 µL(20 µmol·L−1),10×LA PCR buffer(含Mg2+)5 µL,dNTP(10 mmol·L−1) 8 µL,LA TaqDNA聚合酶0.5 µL,cDNA5 µL,DEPC水29.5 µL,总体系50 µL。反应条件:95 ℃变性5 min;55 ℃退火30 s,72 ℃延伸90 s,共35个循环。将获得的PCR产物用1%的琼脂糖凝胶进行电泳检测。
PCR产物回收后连接至克隆载体pMD-18T。将连接产物转化至大肠杆菌感受态细胞BL21中,37 ℃,220 r·min−1摇1 h后将其均匀涂布于含氨苄青霉素的固体平板上,在37 ℃培养箱培养10 h左右,随机挑取单个菌斑扩增,菌液PCR验证阳性菌液送西安擎科生物测序部进行测序鉴定,将该重组质粒标准品命名为TRIM21-Standard。
-
通过应用SYBR Green 染料法,以构建好的TRIM21-Standard为模板,用荧光定量引物TRIM21qF/qR在ABI PCR仪上进行扩增反应及分析。以出现荧光的Ct值最小,荧光阈值最高且溶解曲线为单峰,即没有非特异性扩增产物作为标准,对引物浓度及温度等条件进行优化。
-
以优化好的条件建立标准曲线确保检测方法能检测到最小拷贝数。测定TRIM21-Standard的浓度,用DEPC水进行10倍倍比稀释,分别以3.77×107,3.77×106,3.77×105,3.77×104,3.77×103 copies·µL−1 5个梯度作为模板,进行荧光定量PCR反应。反应结束后,用ABI PCR扩增仪软件自行计算并建立标准曲线。
-
选择本实验室已构建的pMD-18T-TRIM13,pMD-18T-IFITM1,pMD-18T-Vipron和TRIM21-Standard以105拷贝数作为模板,进行荧光定量PCR反应,验证其特异性。
-
将TRIM21-Standard标准品进行倍比稀释,共稀释8个浓度梯度,即3.77×108~3.77×101 copies·µL−1,然后进行qPCR和普通PCR反应,检测2种方法能检测到的最低拷贝数,进而比较2种方法的灵敏性。
-
选取3.77×107,3.77×106,3.77×105 copies·µL−1的TRIM21-Standard作为模板,每个拷贝数做3个重复孔,分别做3次独立的试验,然后对组内和组间的重复性进行评价。
-
选几种人源、猪源及鼠源等的9种细胞,提取RNA后进行定量反转录,然后利用建立的荧光定量PCR方法检测细胞中TRIM21的mRNA表达水平,明确该方法在细胞间的通用性和可靠性。
-
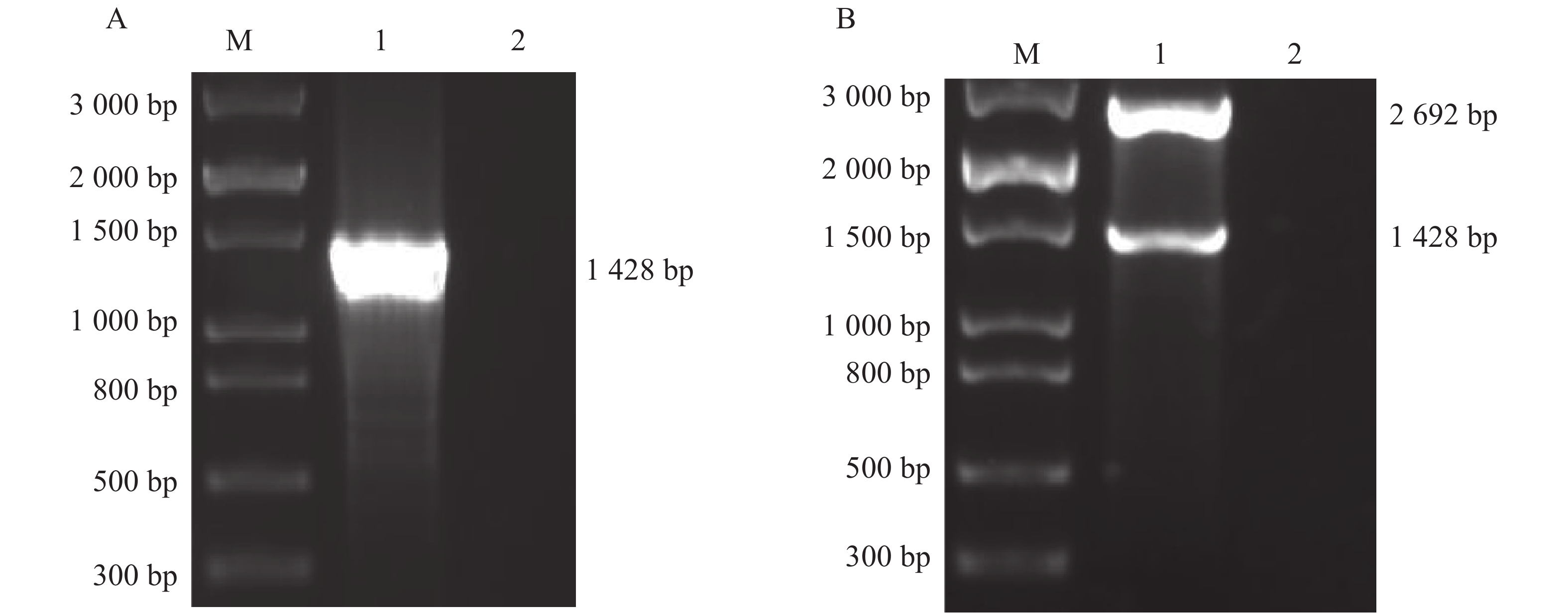
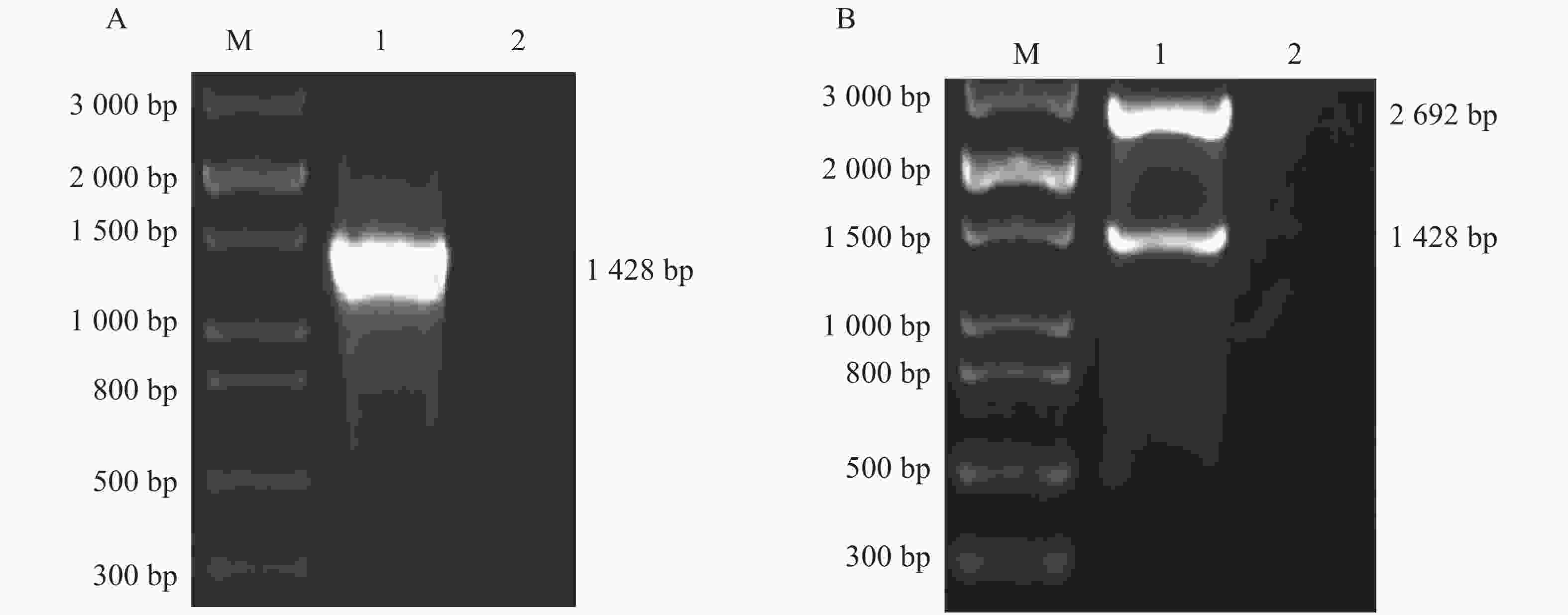
提取Hela细胞RNA后测定浓度,细胞的OD260/280的比值在1.8~2.0之间,说明提取的RNA纯度较高。通过PCR扩增细胞中的TRIM21后,用1%核酸胶进行检测,目的大小符合预期,约1 428 bp,即PCR扩增成功(图1A)。回收该目的条带后连接pMD-18T克隆载体并双酶切及测序验证(图1B)。将验证合适的质粒命名为TRIM21-Standard,测定浓度并计算拷贝数。
-
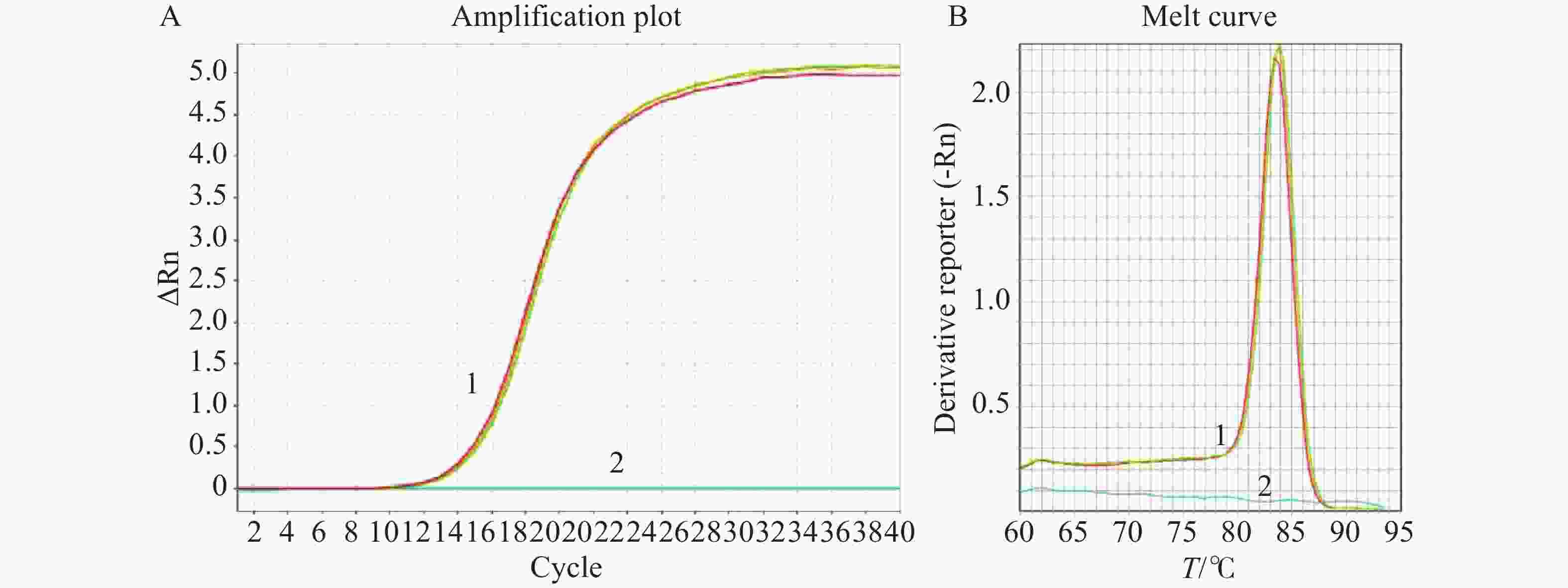
最终优选的SYBR Green荧光定量PCR的最佳反应体系为:SYBR® Select Master Mix 10 µL,无菌DEPC水6 µL,TRIM21-qF/qR(10 µmol·L−1)各1 µL,模板2 µL,即总体系为20 µL。反应条件为:95 ℃ 30 s;95 ℃ 5 s;60 ℃ 34 s,共40个循环。在该条件下得到PCR扩增曲线及有单一峰的溶解曲线(图2),说明在该条件下,TRIM21荧光定量引物在扩增时无非特异性产物及引物二聚体的产生。
-
取TRIM21-Standard质粒标准品,浓度为590 ng·µL−1,用拷贝数计算公式:拷贝数(copies·µL−1)=[6.02×1023×(质粒浓度ng·µL−1×10−9)]/DNA length×660得出该标准品拷贝数约为3.77×1011copies·µL−1,以3.77×107,3.77×106,3.77×105,3.77×104,3.77×103稀释度为模板进行荧光定量PCR,得到标准曲线方程为Y=−3.522logX+41.703,相关系数R2为0.999,扩增效率(Eff)为92.289%,满足R2>0.99。且质粒标准品与Ct值之间具有良好的线性关系(图3),在该条件下溶解曲线无非特异性扩增及引物二聚体出现,说明标准曲线建立成功。
-
取从101~108稀释的TRIM21-Standard标准质粒,每个稀释度3个重复,然后进行荧光定量和普通PCR反应,结果表明(图4),荧光定量PCR检测到的最小质粒拷贝数为3.77×101 copies·µL−1,而普通PCR的检测下限为3.77×102 copies·µL−1,因此,建立的SYBR Green I 荧光定量的方法灵敏性较高,比普通PCR高出10倍。
-
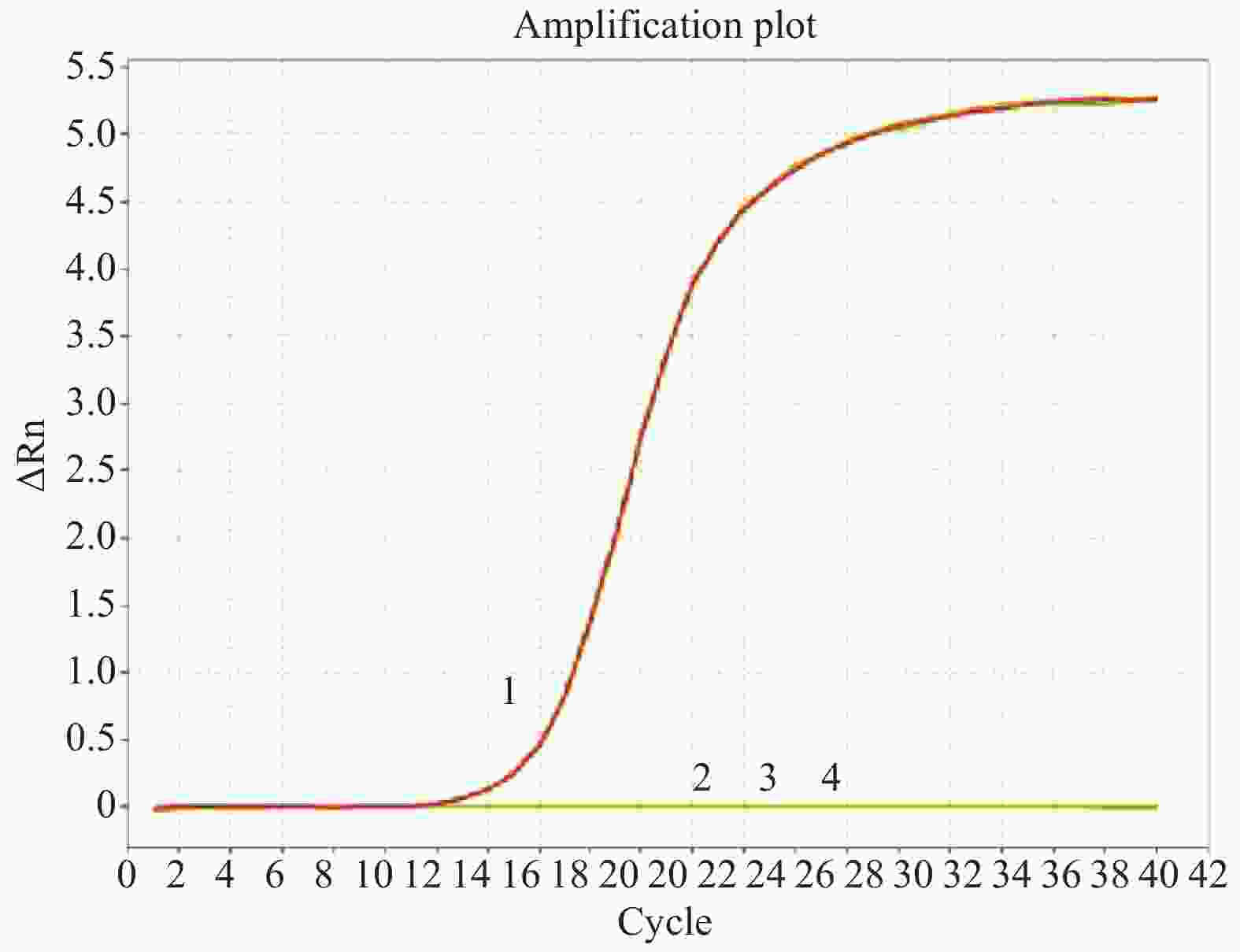
选实验室已构建好的几种质粒进行特异性验证,分别以pMD-18T-TRIM21,pMD-18T-TRIM13,pMD-18T-IFITM1,pMD-18T-Vipron为模板,通过本试验建立的TRIM21 SYBR Green I 荧光定量PCR扩增的方法,检测这几种重组质粒的表达情况。从图5可知,只有pMD-18T-TRIM21出现特异性扩增、其他基因都没有扩增,说明本实验建立的方法具有良好的特异性。
-
以107,106,105 copies·µL−13个稀释度分别为模板,进行重复性验证,然后通过Ct值分析组内和组间的差异。结果表明(表2),组内、组间变异系数分别为0.08%~0.252%,0.257%~0.427%,即组内和组间拷贝数的变异系数都<5%,说明本实验建立的方法重复性好,具有较高的稳定性。
表 2 SYBR Green I 实时荧光定量PCR重复性试验
Table 2. SYBR Green I real-time PCR repeatability test
质粒浓度/
(copies·µL−1)
Plasmids重复次数
Repetitions组内重复(Intra-assay repetition) 组间重复(Inter-assay repetition) Mean Ct SD CV/% Mean Ct SD CV/% 3.77×10−7 3 17.442 0.044 0.252 17.548 0.075 0.427 3.77×10−6 3 21.450 0.027 0.125 21.406 0.055 0.257 3.77×10−5 3 24.723 0.020 0.080 24.656 0.097 0.393 -
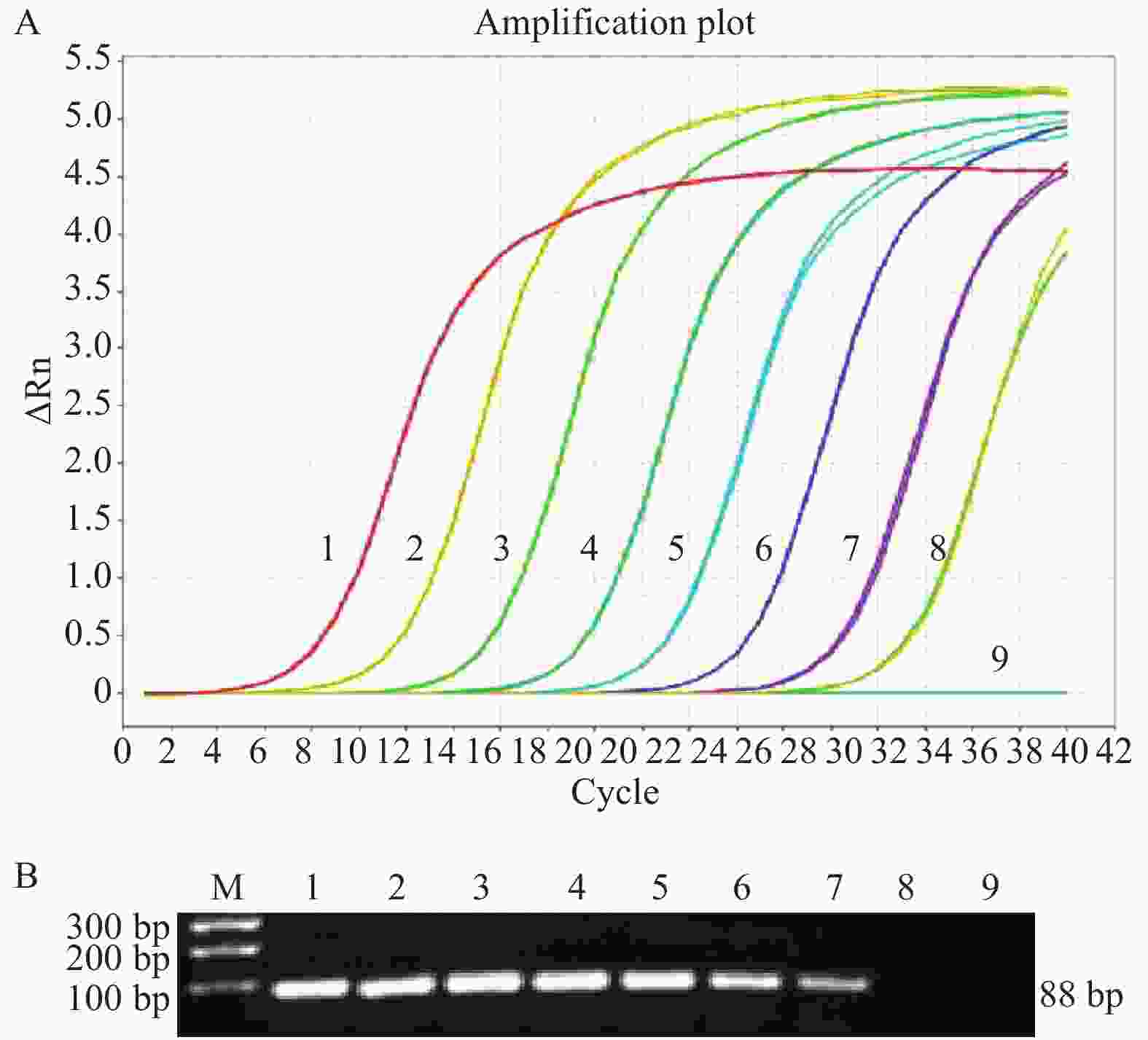
使用已建立的TRIM21 SYBR Green I 荧光定量PCR方法,检测人源、鼠源和猪源等9种细胞中TRIM21的表达。结果显示(表3),该方法能检测出不同种属细胞中TRIM21基因的表达,各个细胞中TRIM21的表达量有所差异,在Hela细胞中TRIM21的表达量较高,在ISBR-2细胞中比较低。因此,本实验建立的方法具有种属通用性和稳定性,可以用来检测不同细胞中TRIM21基因。
表 3 SYBR Green I 实时荧光定量PCR检测不同种属细胞中的TRIM21基因
Table 3. Detection of TRIM21gene in different cells by using SYBR Green I real-time PCR
细胞名称
Cell nameCt值
Ct value拷贝数
Copy number/(copies·µL−1)PK15 35.34 63.99 HepG2 26.72 1.80×104 C2C12 31.15 9.88×102 BHK21 34.97 81.57 ISBR-2 36.50 29.93 Hela 24.99 5.58×104 HEK293 26.58 1.96×104 Huh7 27.32 1.22×104 PANC-1 25.87 3.13×104 -
近年来,研究发现TRIM家族蛋白具有多种生物学功能,包括转录调控、细胞分化、凋亡和肿瘤发生等多种细胞过程[9]。起初,TRIM21主要集中在自身免疫性疾病的研究中,被认为TRIM21是导致干燥综合征和系统性红斑狼疮的自身抗原[10]。随着对TRIM21蛋白的深入研究,发现TRIM21与人类疾病如癌症、肿瘤等密切相关。JUDITH M等人研究发现,TRIM21与LFG具有一定的相互作用,LFG作为跨膜蛋白保护神经细胞抑制Fas诱导的凋亡,而TRIM21对LFG进行负调节,促进肿瘤细胞的凋亡[11]。在一项淋巴瘤的研究中发现,TRIM21在淋巴瘤组织中的表达比正常组织中的要少[12]。说明TRIM21在人类疾病中扮演着重要的作用。但是,TRIM21在不同组织中的表达及机制的研究还存在一定的局限,因此,本实验建立了一种SYBR Green Ⅰ荧光定量PCR方法,可为TRIM21的研究提供一定的参考和技术支持。
目前,常规PCR、荧光定量PCR,Northern blot及基因芯片是检测基因mRNA的主要方法[13-16]。荧光定量PCR作为分子生物学研究中定量检测的经典方法,被广泛应用于兽医学、医学、病理学等各个领域中[17]。笔者以TRIM21为研究对象,建立一种快速检测的方法。经过条件的优化,该方法扩增的溶解曲线为单峰,且Tm值比较平均,避免了非特异性的扩增。另外,此方法灵敏度较高,最低检测拷贝数达到了37.7 copies·µL−1。建立的标准曲线方程R2的值为0.999,扩增效率较高,进而通过检测不同样品的Ct值推算出基因的拷贝数。本实验建立的TRIM21 SYBR Green Ⅰ荧光定量PCR检测方法简单、敏感性高、具有可重复性、检测结果准确,可用于TRIM21基因表达的检测。
Establishment of SYBR Green I Real-time PCR for Quantitative Detection of TRIM21 Gene
-
摘要: 三基序蛋白21(TRIM21)与癌症、肿瘤及固有免疫等密切相关。为了快速检测TRIM21基因的表达,根据Genbank中公布的TRIM21基因序列设计引物,通过常规PCR扩增该基因后克隆至pMD-18T载体上,测序并鉴定正确后制备重组质粒,以pMD-18T-TRIM21重组质粒作为标准品进行荧光定量PCR并建立标准曲线。采用重复性、特异性及灵敏性等试验,成功建立了检测TRIM21基因的荧光定量PCR检测方法。结果显示,该方法灵敏度高,最低检测下限为37.7 copies·μL−1,比普通PCR高出10倍。在3次独立的试验中,组内和组间变异系数较小,具有较高的可重复性,同时,还能检出不同细胞中TRIM21的表达。因此,该荧光定量方法可为TRIM21的检测及临床研究提供技术支持。Abstract: TRIM21 is closely associated with cancer, tumor, and innate immunity, etc. In order to detect TRIM21 gene expression quickly, primers were designed and synthesized according to the sequence of TRIM21 gene in the Genbank. The TRIM21 gene was amplified by conventional PCR and cloned into pMD-18T vector.After sequencing and identification, the recombinant plasmid was prepared and used for SYBR Green I real-time PCR to establish standard curves, based on which the PCR method was successfully established after repetition, specificity and sensitivity tests. This method was high in sensitivity, and its minimum detection limit was 37.7 copies·μL−1, which was 10 times higher than that of the conventional PCR. Three separate repetition tests of this method showed that the inter-assay and intra-assay repetitions had a lower coefficient of variation, less than 5%, indicating a high repetition. Meanwhile, TRIM21 expression was also detected in different cells. Therefore, the TRIM21 gene SYBR Green I real-time PCR method establishedshould behelpful for the detection of TRIM21 gene expression and clinical research.
-
Key words:
- TRIM21 /
- real-time PCR /
- standard curve /
- method
-
图 4 TRIM21实时荧光定量PCR(A)与普通PCR(B)灵敏性试验
1~8:3.77×108,3.77×107,3.77×106,3.77×105,3.77×104,3.77×103,3.77×102,3.77×101拷贝·µL−1;9:阴性对照;M:100 bp DNA Marker。
Fig. 4 TRIM21 real-time PCR (A) and routine PCR (B) sensitivity test
1−8: 3.77×108, 3.77×107, 3.77×106, 3.77×105, 3.77×104, 3.77×103, 3.77×102, 3.77×101copies·µL−1; 9: Negative control; M: 100 bp DNA Marker.
表 1 引物序列
Table 1 Sequence of primers
引物名称 Primer 引物序列 Primer sequence 5′-3′ 扩增长度 Length/bp Universal primer TRIM21-F 5′-GGAATTCATGGCTTCAGCAGCACGCTTGACAATGAT-3′ 1 428 TRIM21-R 5′-GCTCTAGATCAATAGTCAGTGGATCCTTGTGATCCAATA-3′ SYBR Green ⅠPCR Primer TRIM21-qF 5′- CAGCAGCACGCTTGACAATGATG-3′ 80 TRIM21-qR 5′-GATGCTCACAGGCTCCACGAAG-3′ 表 2 SYBR Green I 实时荧光定量PCR重复性试验
Table 2 SYBR Green I real-time PCR repeatability test
质粒浓度/
(copies·µL−1)
Plasmids重复次数
Repetitions组内重复(Intra-assay repetition) 组间重复(Inter-assay repetition) Mean Ct SD CV/% Mean Ct SD CV/% 3.77×10−7 3 17.442 0.044 0.252 17.548 0.075 0.427 3.77×10−6 3 21.450 0.027 0.125 21.406 0.055 0.257 3.77×10−5 3 24.723 0.020 0.080 24.656 0.097 0.393 表 3 SYBR Green I 实时荧光定量PCR检测不同种属细胞中的TRIM21基因
Table 3 Detection of TRIM21gene in different cells by using SYBR Green I real-time PCR
细胞名称
Cell nameCt值
Ct value拷贝数
Copy number/(copies·µL−1)PK15 35.34 63.99 HepG2 26.72 1.80×104 C2C12 31.15 9.88×102 BHK21 34.97 81.57 ISBR-2 36.50 29.93 Hela 24.99 5.58×104 HEK293 26.58 1.96×104 Huh7 27.32 1.22×104 PANC-1 25.87 3.13×104 -
[1] OZATO K, SHIN D M, CHANG T H, et al. TRIM family proteins and their emerging roles in innate immunity [J]. Nat Rev Immunol, 2008(8): 849 − 860. [2] REYMOND A. The tripartite motif family identifies cell compartments [J]. EMBO J., 2001, 20: 2140 − 2151. doi: 10.1093/emboj/20.9.2140 [3] KHAN R, KHAN A, ALI A, et al. The interplay between viruses and TRIM family proteins [J]. Rev Med Virol, 2019, 29(2): e2028. doi: 10.1002/rmv.2028 [4] TOROK M, ETKIN LD. Two B or not two B Overview of the rapidly expanding B-box family of proteins [J]. Differentiation, 2001(67): 63 − 71. [5] TOMONORI K, ASHISH J, SEONG W C, et al. TRIM-directed selective autophagy regulates immune activation [J]. Autophagy, 2017, 13(5): 989 − 990. doi: 10.1080/15548627.2016.1154254 [6] WANG Y, TONG X, YE X. Ndfip1 negatively regulates RIG-I-dependent immune signaling by enhancing E3 ligase Smurf1-mediated MAVS 640 degradation [J]. J. Immuno, 2012(189): 5304 − 5313. [7] LI L, WEI J X, MALLAMPALLI R K, et al. TRIM21 mitigates human lung microvascular endothelial cells inflammatory responses to lipopolysaccharide [J]. American Journal of Respiratory Cell and Molecular Biology, 2019(10): 776 − 785. doi: 10.1165/rcmb.2018-0366OC [8] XUE B B, LI H Y, GUO M M, et al. TRIM21 Promotes Innate Immune Response to RNA Viral Infection through Lys27-linked Polyubiquitination of MAVS [J]. Journal of Virology, 2018, 92(14): 1 − 49. [9] MERONI G, DIEZ-ROUX G. TRIM/RBCC, a novel class of ‘single protein RING finger’ E3 ubiquitin ligases [J]. Bioessays, 2005, 27(11): 1147 − 1157. doi: 10.1002/bies.20304 [10] BEN-CHETRIT E, CHAN E, SULLIVAN K, et al. A 52-kD protein is a novel component of the SS-A/Ro antigenic particle [J]. The Journal of Experimental Medicine, 1988, 167(5): 1560 − 1571. doi: 10.1084/jem.167.5.1560 [11] DALHUS B, MICHAELSEN T E, SANDLIE I, et al. TRIM21, a negative modulator of LFG in breast carcinoma MDA-MB-231 cells in vitro [J]. Journal of Immunology, 2015, 47(5): 1634 − 1646. [12] BRAUNER S, ZHOU W, BACKLIN C, et al. Reduced expression of TRIM21/Ro52 predicts poor prognosis in diffuse large B-celllymphoma patients with and without rheumatic disease [J]. Journal of Internal Medicine, 2015, 278(3): 323 − 332. doi: 10.1111/joim.12375 [13] CALLEJA-MACIAS I E, KALANTARI M, BERNARD H U. Cholinergic signaling through nicotinic acetylcholine receptors stimulates the proliferation of cervical cancer cells: an explanation for the molecular role of tobacco smoking in cervical carcinogenesis [J]. Cancer, 2009, 124(5): 1090 − 1096. [14] CUI H, LAN X, GUO C, et al. Preparation of monoclonal antibody against human KIAA0100 protein and Northern blot analysis of human KIAA0100 gene [J]. J. Pharm Anal, 2017, 7(3): 190 − 195. doi: 10.1016/j.jpha.2017.02.001 [15] GUO Y, XIE X, GUO C, et al. Effect of electro-acupuncture on gene expression in heart of rats with stress-induced pre-hypertension based on gene chip technology [J]. J. Tradit Chin Med, 2015, 35(3): 285 − 294. doi: 10.1016/S0254-6272(15)30099-6 [16] LI W F, DAI H, OU Q, et al. Overexpression of microRNA-30a-5p inhibits liver cancer cell proliferation and induces apoptosis by targeting MTDH/PTEN/AKT pathway [J]. Tumour Biol, 2016, 37(5): 5885 − 5895. doi: 10.1007/s13277-015-4456-1 [17] NAVARRO E, SERRANO-HERAS C, CASTABO M J, et al. Real-time PCR detection chemistry [J]. Clin Chim Acta, 2015, 439: 231 − 250. doi: 10.1016/j.cca.2014.10.017 -




 下载:
下载: