-
雄蕊合生是花内雄蕊通过花丝和(或)花药愈合生长在一起的现象,可分为花丝合生、花药合生、花丝花药均合生3大类[1-2]。雄蕊合生直接影响着花内雌雄蕊的空间位置和传粉过程,是传粉生物学和植物学研究中的一个重要性状和主要分类依据[1]。花药合生(anther union)是雄蕊合生的主要方式之一,花内的雄蕊全部或部分通过花药合生在一起, 花丝相互分离[1-2]。这种合生方式能够将花内花药和花粉聚集在同一个空间位置,并通过合生结构稳定花药的空间位置、调节雌蕊和雄蕊之间的空间距离,提高花粉落置在传粉者身体上的精确性,降低了花粉浪费[2-3]。花药合生现象集中出现在菊科(Asteraceae)、堇菜科(Violaceae)、葫芦科(Cucurbitaceae)、爵床科(Acanthaceae)、苦苣苔科(Gesneriaceae)、夹竹桃科(Apocynaceae)等植物中[1]。花药合生又可分为两种类型:聚药雄蕊(花内所有花药共同合生)、花药成对合生(花内雄蕊成对分别合生,常出现在二强雄蕊中)[1-3]。在苦苣苔科芒毛苣苔属(Aeschynanthus)[4]和长冠苣苔属(Rhabdothamnopsis)[5]的二强雄蕊中,花药合生现象非常典型,一对长雄蕊和一对短雄蕊的花药分别以顶端紧密黏合的方式成对合生[4]。但是,目前关于花药合生程度(即合生部位黏合程度)和合生强度(黏合部位被分离开的力学强度)对传粉过程和传粉者适应机制还缺乏针对性研究。
红花芒毛苣苔(Aeschynanthus moningeriae)是苦苣苔科芒毛苣苔属植物,主要分布在中国的广东和海南等地。该植物花大,由大型鸟类访问取食花蜜;成对合生的2对花药伸出花冠筒,便于开展相关的操纵实验。因此,本研究通过操纵实验和野外观察研究红花芒毛苣苔的开花生物学、花药合生强度及传粉过程,旨在探究红花芒毛苣苔花药合生的花期发育动态及其与传粉者行为的适应关系。
-
红花芒毛苣苔(Aeschynanthus moningeriae)为苦苣苔科藤本植物,花为红色或橙红色,呈弯曲筒状,数朵结成顶生聚伞花序。红花芒毛苣苔花果期在10月—翌年3月,盛花期在12月—翌年1月。红花芒毛苣苔喜湿热环境,主要生长在广东和海南林下溪边石上或树上。
本研究的野外实验地点位于海南热带雨林国家公园五指山“昌化江之源”河沟两岸(18°54′30.41″N,109°40′43.77″E),光照充足,水汽充盈,河沟边潮湿岩石上和林中树上生长有大量红花芒毛苣苔(图1)。
-
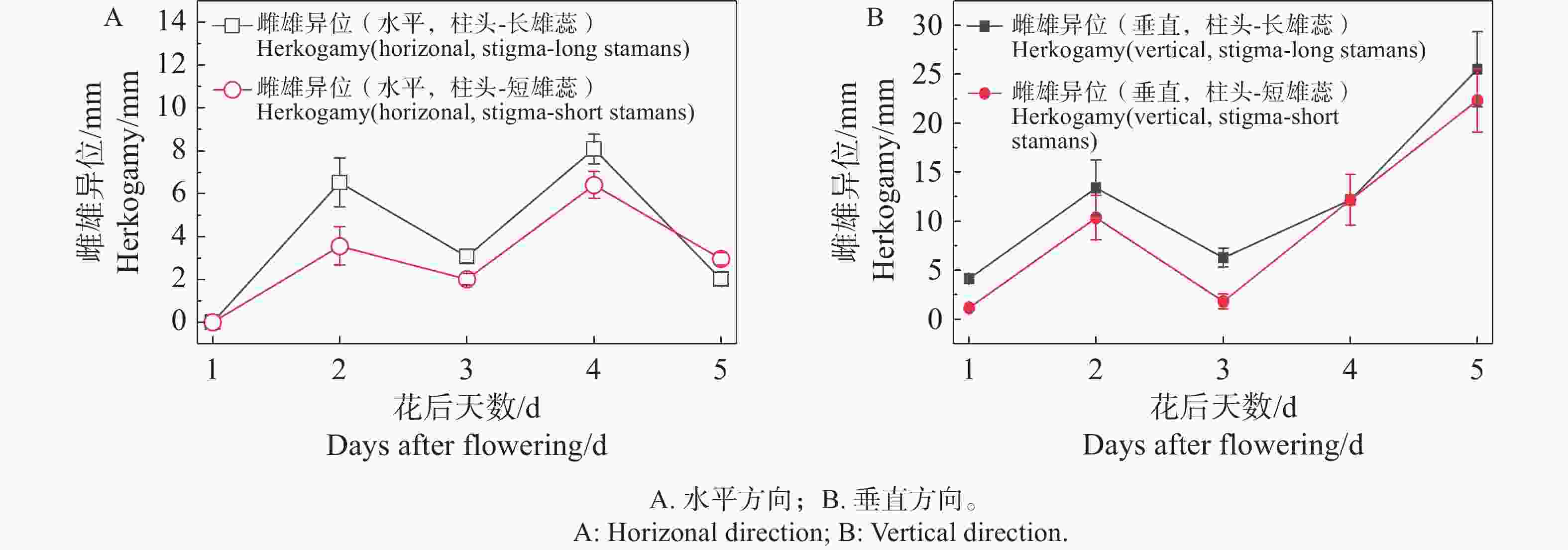
2024-12-27—2025-01-06,在研究地点随机选取标记 15 朵花蕾,每天 9:00 —10:00、 12:00 — 13:00 和 15:00—16:00各观察1次,直到花朵完全萎蔫,记录单花开花进程、雌雄蕊的变化。用电子游标卡尺(标康 BK-318,精度 0.01 mm)测量30朵花的花部特征和不同开花阶段的水平与垂直端的雌雄异位(柱头和最近雄蕊合生花药的空间距离),每个阶段至少5朵。
红花芒毛苣苔单花寿命可达5 ~ 7 d。在花期,每隔1 d取相应的花进行后续的实验。
-
每隔1 d取花粉放在盛有15%(m/m )蔗糖溶液的离心管中让其萌发。24 h后用光学显微镜(XTL-10C,100×)统计花粉萌发率。柱头活性可用双氧水检测,将上述5个花期的柱头泡入3%(V/V)的双氧水[6]。大量产生气泡的柱头为有活性柱头,无气泡或气泡很少的柱头没有活性[7]。重复数为10朵花。
-
每隔1 d取花进行解剖观察,拍照并记录不同花期阶段雌蕊与雄蕊合生花药结构的发育情况。取不同植株上的10朵正处于散粉期的红花芒毛苣苔花(完整、无虫咬、病害),分别将长、短雄蕊分离出花冠筒,注意保持自然合生状态,分别保存在FAA固定液中带回实验室,使用石蜡切片技术纵切两对雄蕊的合生花药,在光学显微镜(XTL-10C,100×)下观察其合生结构。
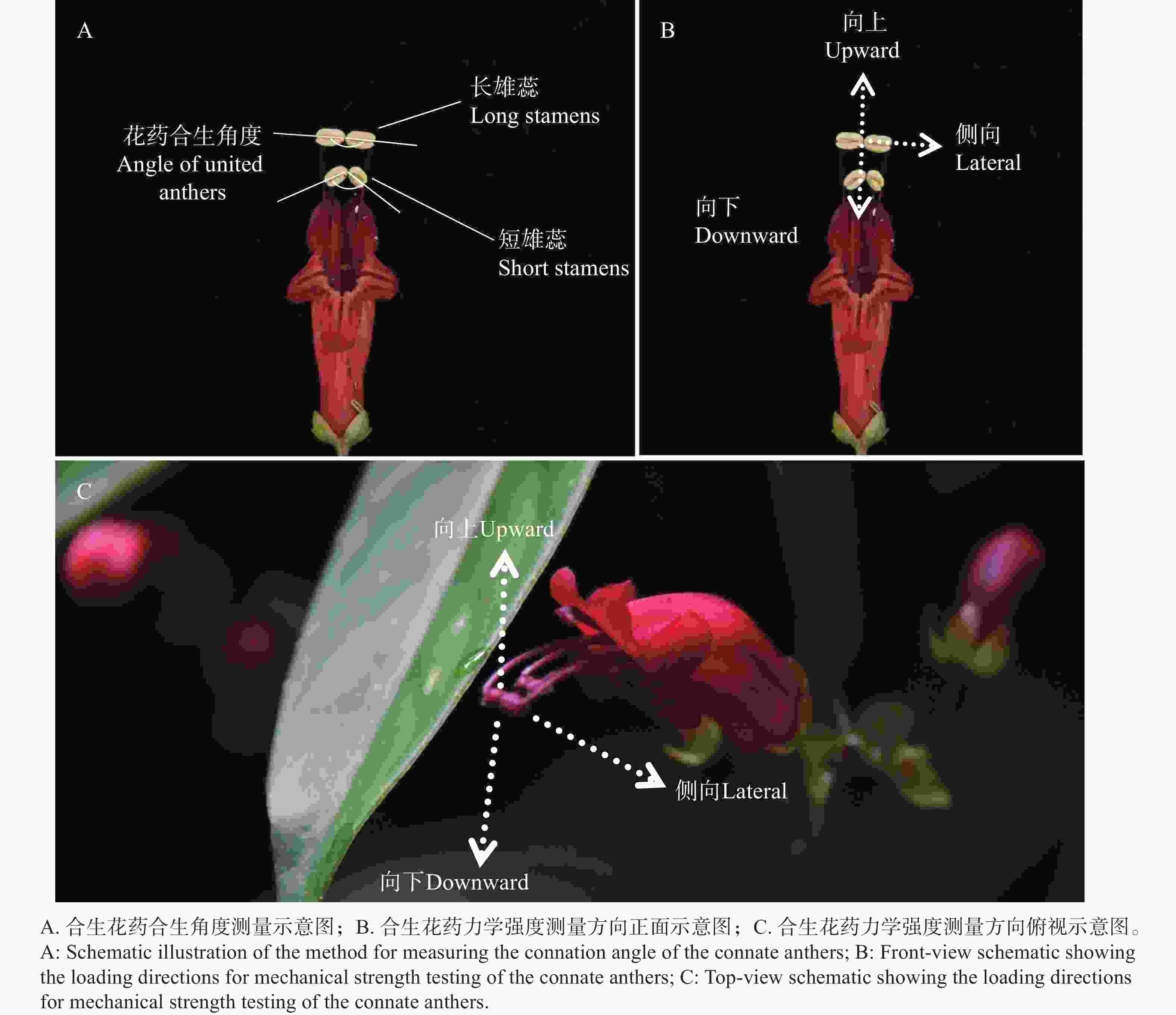
将纵切的2对合生雄蕊的显微图片导入测量软件FiJi Image J中,分别以2对花药合生位置为中轴点,画1条中轴线作为对称线,画出每个花药中心线,延长经过中轴线,测量其两对花药的黏合程度和合生角度(图2-A),作为花药合生程度的判断指标。
-
为确定花药合生程度(花药合生部位被分开时的力学强度)及其与传粉者访花行为和带来的压力的关系,使用数显式推拉力计(艾德堡HP-3,3N,最小分辨力为0.001 N),分别对2对合生花药的合生部位进行缓慢施力,施力方向分别为向上、向下、侧向3个方向(模拟访花者的接触方向和力度),使其合生的花药分离,分别记录2对合生花药分离时的力学强度,作为花药合生程度的主要判断指标。每组实验重复至少6次。
-
取不同植株且刚开放的花6朵,用便携式光谱仪(赛曼S3000-UV-NIR)和光纤反射探针(Fiber Y 400 μm)测量花冠筒、花冠筒裂片上的黑色条纹及花下第1片叶的反射率。光源采用脉冲氙灯(Xe-02),参考光使用标准反射白板(WB-02)。测量时将探针倾斜45°并置于距离花瓣表面5 mm处。用SpectraProV3.3(杭州塞曼科技有限公司)整理反射率数据[8]。
-
2024-12—2025-01,连续7~9 d,每天08:00—17:00时段,观察访花者类型和访花行为,记录访花者种类、访花时间、访花次数及访花者是否接触柱头和两对雄蕊、访花时花部各结构的形变情况,访花者身体是否携带花粉。通过查找相关文献获取访花者的形态数据[9-10]。
-
获得的花部形态、访花频率、花瓣反射率等数据使用WPS 365中的表格功能进行整理,用平均值±标准差表示并作柱状图。合生花药的力学强度数据使用软件IBM SPSS Statistic 26进行配对样本t检验;雌雄异位数据、花粉活性与柱头可授性使用Origin 2025b进行作图。
-
红花芒毛苣苔为两性花,为聚伞花序,花序梗较长,每个花序上有4~5朵花,花冠呈筒状,红色,花冠筒弯曲并向外开口,能够产生大量的花蜜,散粉时期的花冠筒长度和花冠筒开口宽度、高度分别为(21.84±2.83)mm、(6.12±1.12)mm、(11.02±1.03)mm;长雄蕊长度为(39.15±2.57)mm,短雄蕊长度为(36.12±1.97)mm,雌蕊长度为(23.83±2.28)mm;柱头成熟期的长雄蕊长度为(38.98±2.60)mm,短雄蕊长度为(36.27±2.24)mm,雌蕊长度为(34.62±2.21)mm。花具5裂片,上唇2浅裂,下唇3深裂,裂片狭卵形,有3条暗红色或黑色纵纹,延申至花冠筒内部;雌蕊位于两对合生雄蕊的下部,花冠筒开口处;雄蕊为二强雄蕊,有稀疏短毛,花丝合生于花冠筒,稍伸出花冠口部,花药成对合生,每对花药以顶端愈合合生在一起,长雄蕊合生花药形似长方形,短雄蕊合生花药则呈椭圆形(图2)。
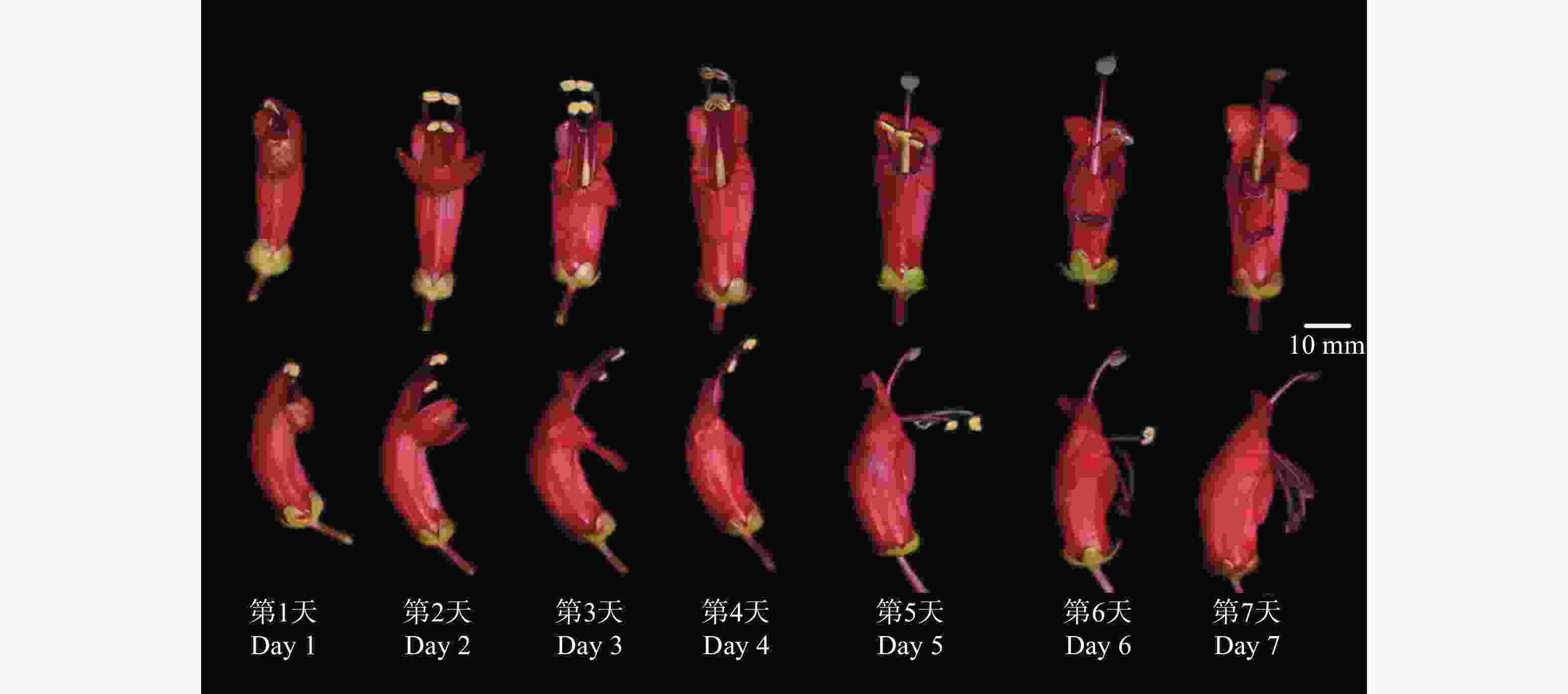
红花芒毛苣苔的单花周期为5~7 d,花裂片展开顺序:上唇瓣、左右唇瓣先行展开,下唇瓣最后展开。短雄蕊先于长雄蕊伸出花冠筒,等到左右两个唇瓣打开之后长雄蕊才伸出花冠筒,花药在伸出花冠筒时就已开裂,露出花粉,具有一定活性,雌雄异熟,雄蕊先熟(花药散粉的雄性阶段早于柱头可受的雌性阶段)(图3)。
在花开第1天(花蕾期),雌雄蕊被包裹在花冠筒内,2对合生雄蕊弯曲折叠,位于雌蕊上方,部分花蕾中雄蕊花药已经开裂,露出花粉。第2天,雌蕊位于花冠筒喉处,柱头颜色为紫红色,2对合生雄蕊完全伸出花冠筒,花药饱满,花粉丰富(散粉期)。随后,花柱逐渐伸长伸出花冠筒,接近雄蕊,当花柱伸长到短雄蕊花药下方时,柱头膨大,颜色从紫红色变透明,分泌黏液;雄蕊花药略变扁,雄蕊花丝还未明显向下弯曲(柱头可授期)。在第5天时,雌蕊花柱继续伸长,超出花药位置,柱头仍然分泌有少量黏液。第6天,两对合生雄蕊花丝变软变细,颜色变暗,向下弯曲超过90°,花粉色泽变淡。第7天后,2对合生雄蕊花药干扁,雄蕊花丝完全下垂,紧贴花冠筒下腹面。
随着花期,柱头和合生花药的空间距离在水平端与垂直端都有明显的动态变化过程。当花完全开放后,随着柱头的伸长,雌雄异位的距离不断缩小,直至柱头成熟,雌雄蕊接触在一起,随后雌蕊继续向上伸长,两对合生雄蕊则向下弯曲直至垂落贴着花冠筒,雌雄异位更加明显(图4)。
-
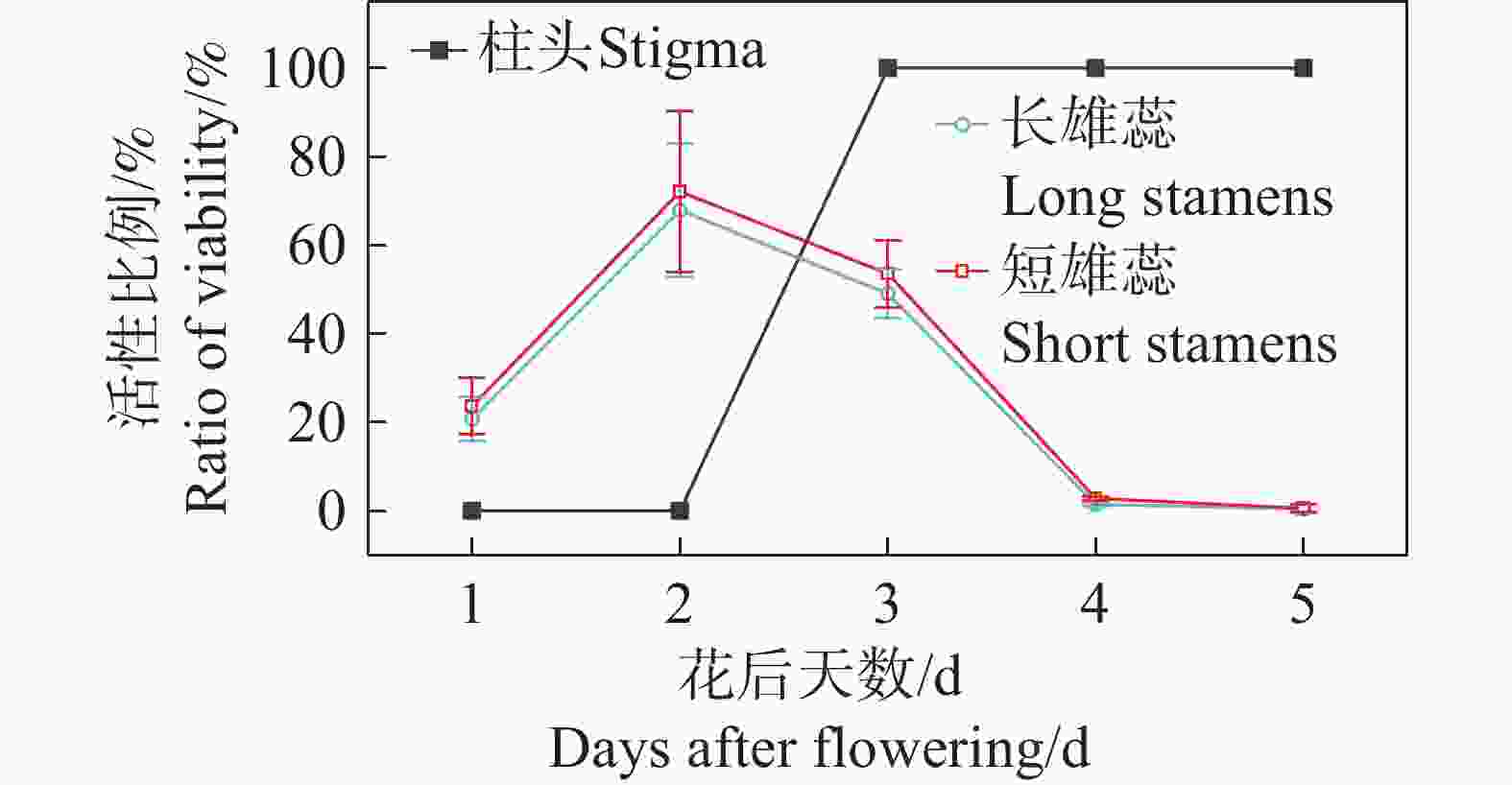
红花芒毛苣苔的花粉在花瓣裂片打开时就有一定活性,但其活性较低(长雄蕊,20.75%±4.94%;短雄蕊,23.64%±6.50%),花粉活性在花开后第1~2天达到最大值(长雄蕊,67.90%±14.97%;短雄蕊,72.13%±18.25%),之后逐渐降低,最后完全失去活性。柱头在开花前没有活性,在花开放后的第3天活性达到最高值,随后活性持续3~4 d(图5)。
-
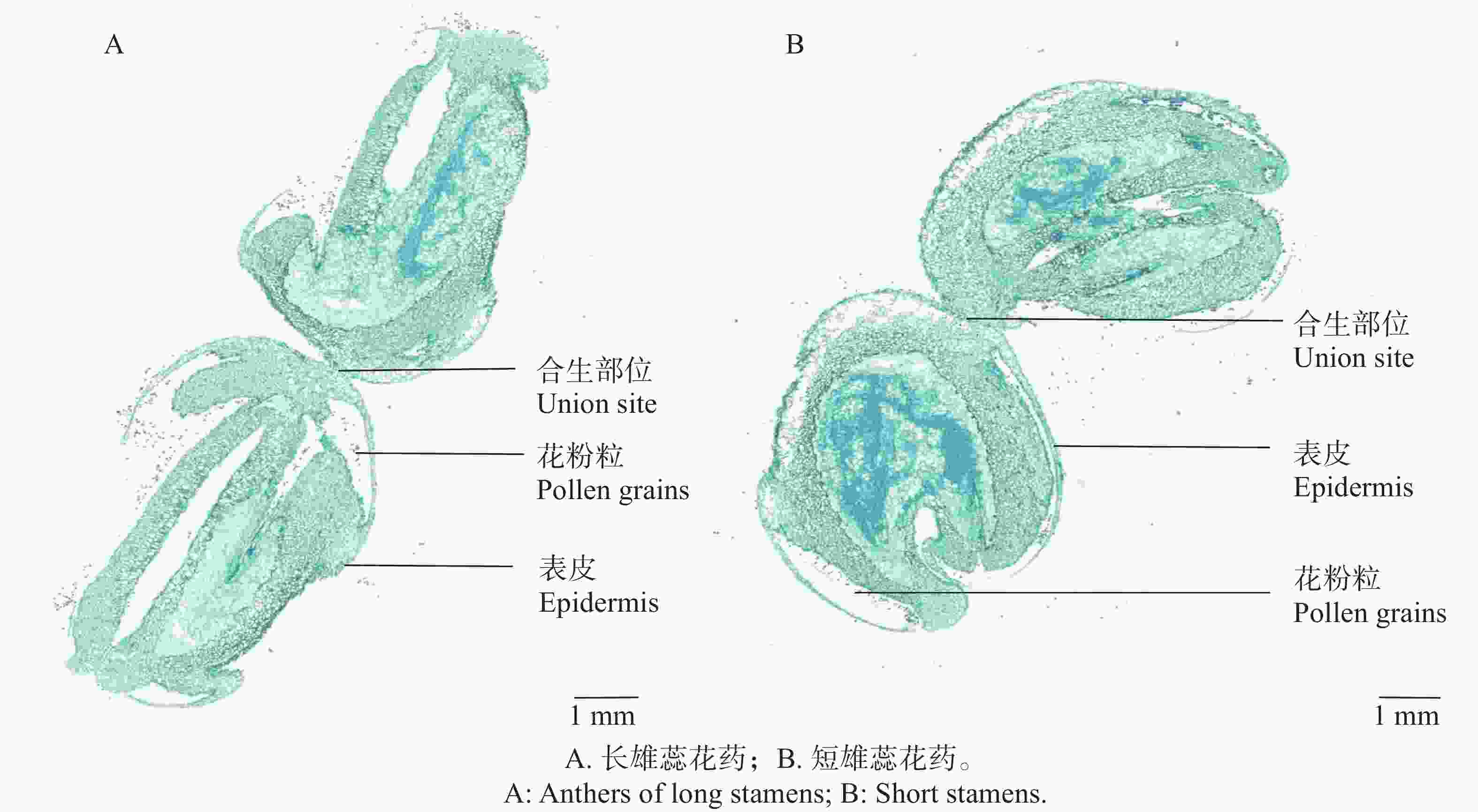
红花芒毛苣苔的2对雄蕊花药在花蕾期时就已经黏合生长在一起,并以一定程度贴合折叠位于雌蕊上方。花开放过程中,两对合生花药不断向外伸长,折叠程度变小。最终在花完全开放后,两对雄蕊伸出花冠筒,其中长雄蕊的合生花药以平行姿势合生在一起,合生角度约为180°(图6-A),短雄蕊合生花药则以约115°的角度合生(图6-B)。
观察2对合生花药解剖结构图,两对合生花药均以顶端表皮黏合的方式形成合生(图6-A、B)。长雄蕊合生花药形状类似长方形,短雄蕊则类似椭圆形状;长雄蕊与短雄蕊花药合生的程度和角度不同,短雄蕊花药合生的接触长度为(521.63±4.57)µm,长雄蕊合生接触长度为(203.33±2.51)µm。短雄蕊花药合生程度即黏合部分更大。
-
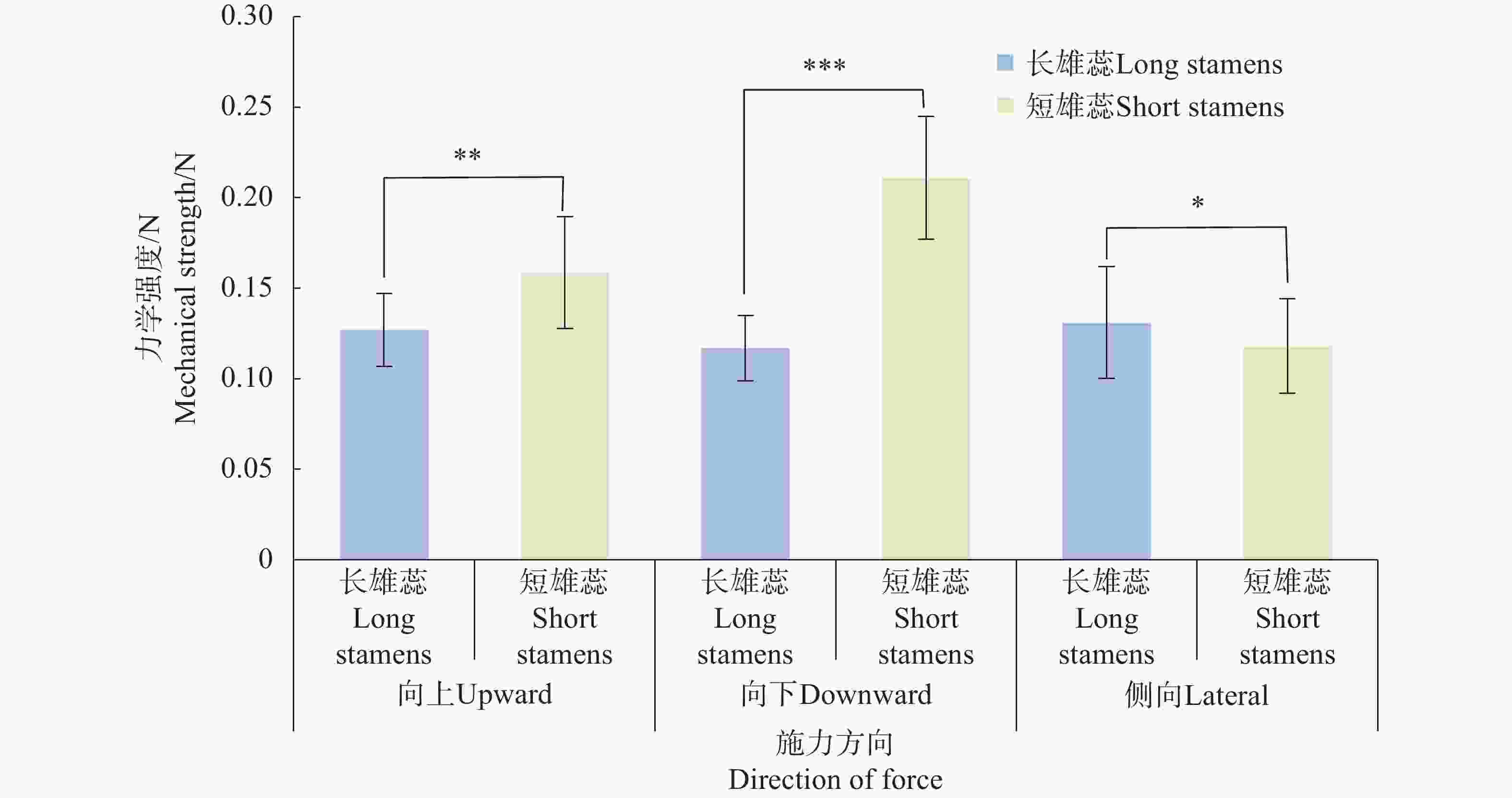
在3个不同的施力方向中,短雄蕊合生花药在向上(F=0.159±0.031N)、向下(F=0.211±0.034N)施力时的力学强度显著高于长雄蕊合生花药(向上:F=0.127±0.020 N;向下:F=0.117±0.018 N),说明合生短雄蕊在受力时较合生长雄蕊稳定,花药不易分离 (图7)。在侧向施力时,长雄蕊(F=0.131±0.031N)则强于短雄蕊(F=0.118±0.026N)。
-
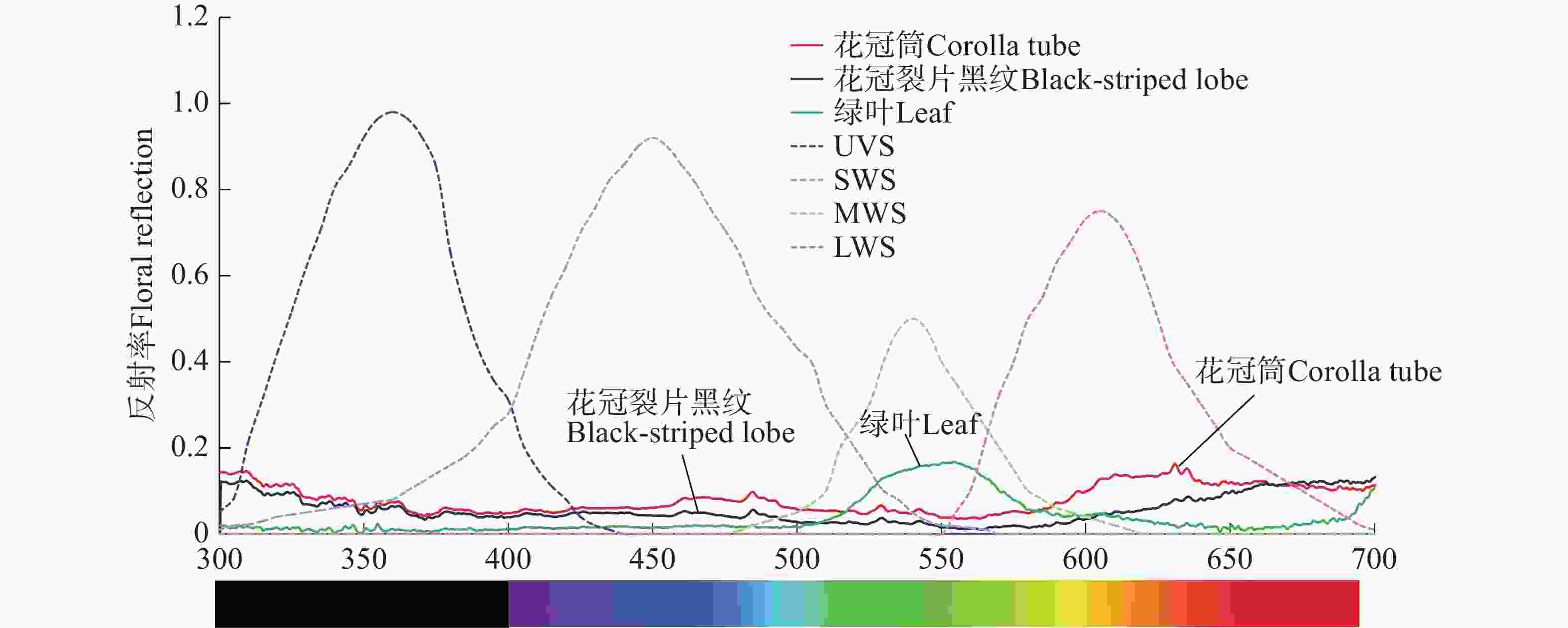
红花芒毛苣苔花冠筒反射率波长范围集中在580~700 nm,花冠裂片黑纹反射率在整个波长范围内都较低,红花芒毛苣苔叶片在550 nm处的反射率出现峰值(图8)。这表明,红花芒毛苣苔的红色花冠筒能够吸引鸟类,花冠裂片黑纹与花冠筒的反射率呈现显著不同(图8),能被叉尾太阳鸟区分,可能起到蜜导的作用。
-
在五指山研究样地,仅观察到叉尾太阳鸟(Aethopyga latouchii)雄鸟访问红花芒毛苣苔。该物种体型小,行动速度快,能够站在枝条(图9-A)或短暂悬停在空中(图9-B)吸食红花芒毛苣苔的花蜜。由于叉尾太阳鸟飞行速度极快,本研究没有捕获到个体进行个体大小的实际测量。根据文献[9]在海南捕捉的叉尾太阳鸟个体数据,访花的叉尾太阳鸟雄鸟体重在5~8 g,全长~120 mm,喙长15~17 mm;雌鸟体重在5~8.5g,全长88~105 mm,喙长14.1~19 mm。
叉尾太阳鸟1次最低访问花朵数为3朵,最高为17朵,在日均9小时的访花观察中,总访花次数为29次,在观察时一般能够观察到叉尾太阳鸟在1次访问中能够都访问到散粉期和柱头可授期的花,为红花芒毛苣苔完成自交或异交传粉。在访问散粉期和柱头可授期的花的过程中,叉尾太阳鸟先用喙伸入并压下花冠筒,或有时会将两对合生花药压下再伸入花冠筒中,用舌头吸取花冠筒底部的花蜜,其头部能够触碰到红花芒毛苣苔的散粉时期的合生花药和柱头可授期的柱头(图9-B、C)。由此可以确定,叉尾太阳鸟是红花芒毛苣苔的有效传粉者。
叉尾太阳鸟访问花后第4~7天的雌性功能期的花时,用喙伸入并压低花冠筒,其头部接触到两对雄蕊花药的花粉和雌蕊柱头,当鸟喙基部接触到柱头的时候,可以把鸟喙基部携带的来自短雄蕊合生花药的花粉落置在柱头上(图9-B)。当其鸟喙将两对雄蕊压下,从2对雄蕊和柱头中间伸入花冠筒吸取花蜜,其头部只接触到柱头,此时鸟头部黏着的花粉被传递到已经成熟(柱头膨大)的柱头上(图9-C)。当柱头还未成熟,仍处于花冠筒喉部时,叉尾太阳鸟的身体未能接触到柱头(图9-D)。
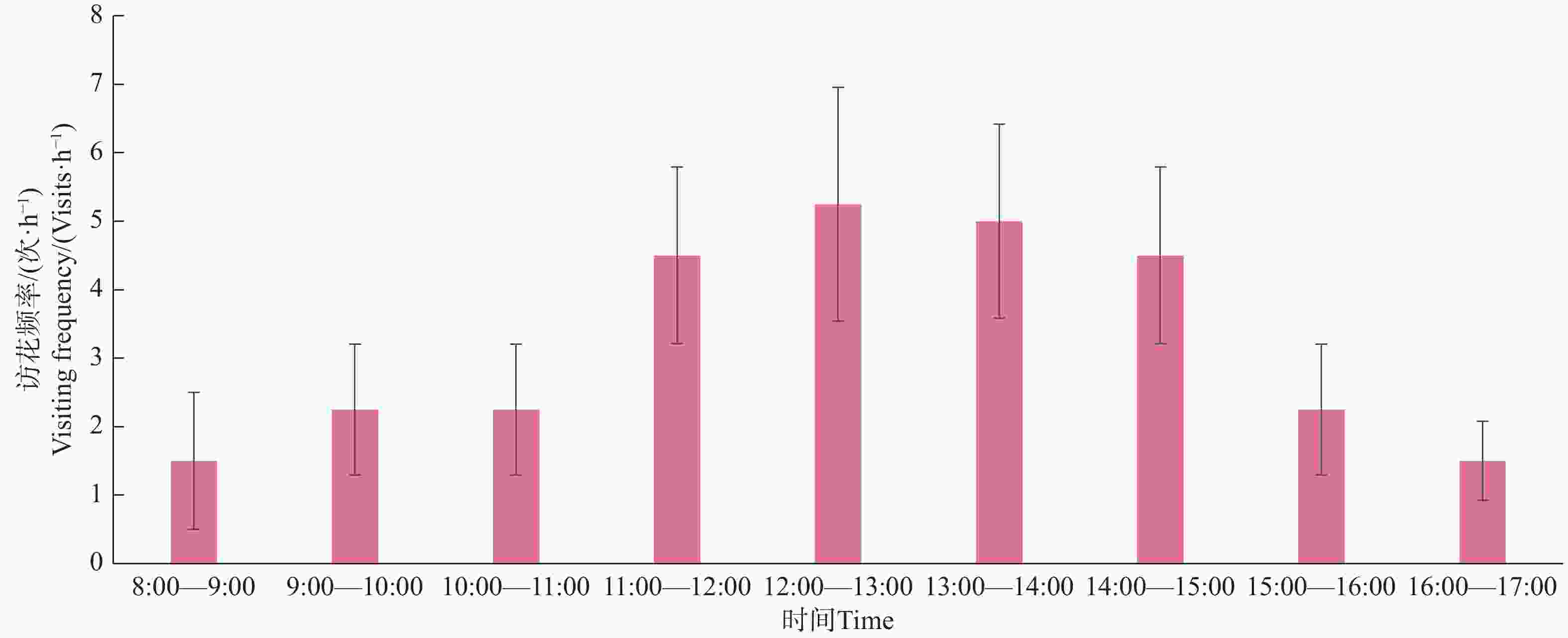
叉尾太阳鸟雄鸟访花时间集中在中午11:00—14:30。叉尾太阳鸟访花前先站在枝条观察,后以悬停在空中或站在枝条上(较少)用喙伸入并压低花冠筒,吸取花蜜,然后快速飞走(图9),平均访花时间(1.58±0.63)s,单次访花3~17朵。在每日平均9 h观察中,总访花次数达29次(图10)。
-
红花芒毛苣苔的合生花药状态会随花冠筒的发育逐步调整,从花蕾期的贴合折叠状态,到花冠筒开放后,2对合生雄蕊完全伸出花冠筒,花药完全展开,最终长雄蕊花药形成180°的平行合生,短雄蕊花药形成115°的钝角合生,红花芒毛苣苔雄蕊这种形态的变化是由花丝和花药缓慢运动造成的,能够在花开放后提供了一个空间位置固定的、集中且完整的花粉呈现面,利于传粉者的接触。
本研究中两对合生花药发育较为同步,花粉活性比例在不同开花阶段较为一致,并且花药在成熟花蕾期时就已开裂,花粉具有一定活性。力学测试结果表明,短雄蕊在受到向上或者向下的力时,其合生结构分离所需要的力显著大于长雄蕊。这些形态、结构性与力学特性的差异表明,两对雄蕊在花中的机械功能可能不同,短雄蕊更稳固的花药合生结构可抵抗传粉者访问时带来的形变分离的压力,而长雄蕊由于远伸出花冠筒,容易受到访花者带来的侧向作用力,在侧向上相对较高的花药合生强度可以维持整个雄蕊群的空间位置。这种形态结构和功能上的差异性,保障了二强雄蕊合生花药结构在传粉过程中的整体稳定性。
-
合生花药解剖结构和力学强度的结果表明,短雄蕊的合生程度大于长雄蕊的合生程度,短雄蕊在受到向上或者向下的力时,其合生结构分离所需要的力显著大于长雄蕊。这说明,短雄蕊的稳定性强于长雄蕊,这样的结构设计能够让短雄蕊在受到叉尾太阳鸟喙伸入花冠筒被其“从下而上”或“从上而下”施压时尽可能保持合生状态。由于短雄蕊的合生花药位置更靠近花冠筒开口,鸟喙和喙基部、前额等较硬部位对短雄蕊的合生花药造成的压力比对长雄蕊的合生花药的更为直接和集中,可能会导致其短雄蕊合生花药分离,所以在合生程度和力学强度上短雄蕊优于长雄蕊。这是对鸟类访花行为的适应,目的是维持合生状态,固定花药在花冠筒内的空间位置,保证传粉的成功。
红花芒毛苣苔的2对合生花药的在形态结构和力学特性上的差异性,极大程度的适应了叉尾太阳鸟的访花行为:花丝长度不一致,导致2对合生雄蕊在花内的位置不同;长雄蕊合生花药形状类似长方形,短雄蕊则类似椭圆形状;此外,长雄蕊合生花药角度为180°,这样的角度能够最大程度的适应叉尾太阳鸟较为宽阔的头部,短雄蕊合生花药角度为115°,呈现倒“V”型合生,这样的设计能够准确的适应和接触到面积较窄的喙基部和鸟的前额,让雄蕊的花药花粉最大程度接触传粉者身体部位,增加花粉被成功移出的几率,提高传粉的精确度和传粉效率[11]。
在本研究中,红花芒毛苣苔的传粉者只有叉尾太阳鸟,主要取食花蜜。合生花药将花药和花粉集中在花内的一个特定空间位置,同时还增强雄蕊的强度,在传粉者访花过程触碰雄蕊时能维持花药的相对位置[1,3]。长、短雄蕊合生花药的角度和力学强度的差异适应了叉尾太阳鸟不同部位对花粉的接触,极大提高传粉准确性和传粉效率。因此,红花芒毛苣苔雄蕊的合生花药形成了高度特化的传粉机制,保证了在单一传粉者环境下的繁殖成功。
-
在不同的花期阶段中,雌雄蕊空间位置会发生变化,这是由于雌蕊的伸长和雄蕊花丝的缓慢的弯曲而造成的,与芒毛苣苔不同的是,红花芒毛苣苔雌蕊在伸长到接近短雄蕊花药附近时开始就具有活性,且此时雄蕊还未明显向下弯曲;但二者相同的是,能在不同时间把雌雄蕊放在同一个空间位置,来调整散粉或授粉过程,保证传粉的顺利进行,提高传粉效率,红花芒毛苣苔是雄蕊先熟,雌雄成熟期有短暂的重合,但仍然可以在一定程度上避免雌雄干扰、促进异交和具有延迟自交保障的作用[12-16]。
与红花芒毛苣苔同属的植物芒毛苣苔(Aeschynanthus acuminatus)的一项研究发现,芒毛苣苔的有效传粉者为3种雀形目鸟类,其鸟喙、鸟头部形态、长度与芒毛苣苔的花冠筒、雌雄蕊形态结构高度匹配,柱头成熟时的位置与散粉时期的雄蕊位置一致,此时雄蕊已经弯曲并且花粉脱落。3种雀形目鸟类可以位于枝条上或以悬停访花,通过头部接触移出花粉,并在下一次访花时将花粉传递到已经成熟的雌蕊柱头上[4]。从花部形态和访花观察结果来看,叉尾太阳鸟喙短于花冠筒,在访花时其头部接触到成熟的雄蕊和雌蕊,这与同属的芒毛苣苔的传粉研究一致。在叉尾太阳鸟访问的红花荷(Rhodoleia championii)传粉生物学研究中,也发现叉尾太阳鸟能够通过站在枝条或短暂悬停等方式有效传粉[17]。
红花芒毛苣苔的访花者只有叉尾太阳鸟,鸟类感知的波长为300~700 nm[4,18]。从花瓣反射率结果来看,红花芒毛苣苔的花色为红色或橙红色,处于鸟类可识别的范围内,说明叉尾太阳鸟能够在复杂的环境背景中识别到红花芒毛苣苔的花,红花芒毛苣苔的花冠筒裂片上黑色条纹反射率较低,与花冠筒红色形成色差,具蜜导作用,能够突出显示花冠筒开口,为叉尾太阳鸟指引访花入口,保证传粉的顺利进行[19-20]。
-
红花芒毛苣苔短雄蕊的合生程度更高,且在抵抗上下方向分离的力学强度显著强于长雄蕊,表明2对雄蕊在机械功能上存在分化。长雄蕊合生花药的平行结构适应传粉者宽阔的头顶,而短雄蕊合生花药的倒“V”型结构则适应叉尾太阳鸟的喙基部与前额。由于短雄蕊合生花药主要被鸟喙基部触碰,其冲击力远大于鸟前额接触长雄蕊合生花药的力。因此,短雄蕊更强的花药合生程度在较大的冲击力之下能够保持花药合生状态,稳定花药和花药相对位置,提高了花粉落置在传粉者部位,提高了传粉精确性和降低花粉的浪费。
可见,红花芒毛苣苔的合生花药并非简单的结构黏连,而是一个在发育、形态、力学和功能上特化的结果,是在与叉尾太阳鸟的专性传粉关系中提高花粉输出率的关键适应性状。在今后的研究中,可能需要进一步开展叉尾太阳鸟访花时的冲击力量化研究,分析冲击力和花药合生强度(分离的力学强度)的关系、花药合生与离生状态下的花丝弹性模量等特征,更准确解析花药合生与鸟类传粉的适应规律。
Mechanical strength of anther connation and its pollination adaptation of the bird- pollinated Aeschynanthus moningeriae (Gesneriaceae)
-
摘要: 为探究鸟媒传粉植物红花芒毛苣苔(Aeschynanthus moningeriae)合生花药的传粉适应意义,研究了海南五指山分布的红花芒毛苣苔种群开花生物学、合生花药的发育过程与力学特性及其对传粉过程的影响。结果表明:1)红花芒毛苣苔二强雄蕊的一长一短2对花药的顶端在花蕾期就已呈黏合状态,并在整个花期发育过程中保持合生状态;长、短雄蕊的合生花药最终分别形成约180°(平行)和115°(倒“V”型)的角度。2)短雄蕊的花药合生程度更大,合生力学强度在向上(F=0.159±0.031N)、向下(F=0.211±0.034N)方向上都显著高于长雄蕊合生花药(向上:F=0.127±0.020 N;向下:F=0.117±0.018 N)。3)叉尾太阳鸟(Aethopyga latouchii)是其唯一有效传粉者,对红花芒毛苣苔红色花冠及裂片上的黑色条纹(蜜导)敏感;长雄蕊和短雄蕊的合生花药主要分别接触鸟的额头和鸟喙基部,在鸟类头部形成更大范围的花粉沉积区,从而提高了后续访花过程柱头接受花粉的概率。由于访花时鸟喙基部的冲击力较大,短雄蕊更强的合生程度和强度可以保持花药合生状态,维持花药相对稳定的位置和促进花粉输出。Abstract: Anther connation is an important floral trait that influences pollination accuracy and efficiency by altering anther arrangement and anther-stigma separation (herkogamy). The flowering biology, the mechanical properties of connate anthers, and the pollination process of Aeschynanthus moningeriae (Gesneriaceae)at Mt. Wuzhi in Hainan Island, China were examined to investigate the developmental pattern of anther connation and pollination adaptation in the bird-pollinated A. moningeriae. The results showed that A. moningeriae is hermaphroditic, with didynamous stamens containing anthers in pairs from the bud stage and that anthers were coherent throughout the whole flowering period. The long anther pair ultimately formed an angle of approximately 180° (parallel) while the short anther pair grow at 115° (inverted V-shape). The short anther pair was connated with more fused part than the long anther pair. The mechanical strength of the short anther pair was F=0.159 ± 0.031 N and F=0.211 ± 0.034 N in the upward and downward directions respectively, which is significantly higher than that of the long anther pair (upward: F=0.127 ± 0.020 N; downward: F=0.117 ± 0.018 N). The fork-tailed sunbird (Aethopyga latouchii) was the only effective pollinator. The red corolla, along with the black stripes on the lobes, function as a nectar guide. The long anther pair was mainly touched by the bird forehead, while the short anther pair was contacted mainly by the narrow base of the bird beak. Such separated pollen deposition increased the contact probobality of the stigma with pollen. Because the bird beak exerted stronger force on anthers, the higher mechanical strength with higher fusion proportion of the short anther pair can thus maintain at a fusion mode and spatial position of the connate anthers under stronger force, increasing pollen removal ratio.
-
Key words:
- Gesneriaceae /
- didynamous stamens /
- stamen developmentl herkogamy /
- dichogamy /
- pollination mechanism /
-
-
[1] 任明迅. 植物雄蕊合生的多样性、适应意义及分类学意义初探[J]. 植物分类学报, 2008, 46(4): 452−466. [2] 任明迅. 雄蕊合生植物半边莲的花部综合征与繁育系统[J]. 植物生态学报, 2009, 33(2): 361−368. https://doi.org/10.3773/j.issn.1005-264x.2009.02.014 doi: 10.3773/j.issn.1005-264x.2009.02.014 [3] Ren M X, Tang J Y. Anther fusion enhances pollen removal in Campsis grandiflora, a Hermaphroditic flower with didynamous stamens [J]. International Journal of Plant Sciences, 2010, 171(3): 275−282. https://doi.org/10.1086/650157 doi: 10.1086/650157 [4] Chen K H, Lu J Y, Wang C N. Effective pollination of Aeschynanthus acuminatus (Gesneriaceae) by generalist passerines, in sunbird-absent East Asia [J]. Scientific Reports, 2019, 9(1): 17552. https://doi.org/10.1038/s41598-019-53035-2 doi: 10.1038/s41598-019-53035-2 [5] Ling S J, Lu T, Ren M X. A novel type of mirror-image flowers caused by lateral bending of the floral tube in a bumblebee-pollinated plant [J]. Flora, 2020, 272: 151694. https://doi.org/10.1016/j.flora.2020.151694 doi: 10.1016/j.flora.2020.151694 [6] Dafni A. Pollination ecology: a practical approach [M]. Oxford: Oxford University Press, 1992: 59-85. [7] 孙浩然, 凌少军, 任明迅. 圆唇苣苔属(Gyrocheilos)花柱侧偏弯折现象及其传粉适应机制[J]. 广西植物, 2023, 43(5): 817−826. https://doi.org/10.11931/guihaia.gxzw202112007 doi: 10.11931/guihaia.gxzw202112007 [8] 王銮凤, 张同同, 向文倩, 等. 珍稀濒危沉水植物水菜花传粉生物学研究[J]. 广西植物, 2024, 44(1): 157−166. https://doi.org/10.11931/guihaia.gxzw202212002 doi: 10.11931/guihaia.gxzw202212002 [9] 广东省昆虫研究所动物室, 中山大学生物系. 海南岛的鸟兽[M]. 北京: 科学出版社, 1983: 270−271. [10] 龚燕兵, 黄双全. 传粉昆虫行为的研究方法探讨[J]. 生物多样性, 2007, 15(6): 576−583. https://doi.org/10.1360/biodiv.070155 doi: 10.1360/biodiv.070155 [11] 田润炜, 陆嘉惠, 李学禹, 等. 光果甘草二体雄蕊的发育及其适应意义[J]. 植物生态学报, 2013, 37(7): 641−649. https://doi.org/10.3724/SP.J.1258.2013.00066 doi: 10.3724/SP.J.1258.2013.00066 [12] 任明迅. 两性花的雄蕊运动: 多样性和适应意义[J]. 植物生态学报, 2010, 34(7): 867−875. https://doi.org/10.3773/j.issn.1005-264x.2010.07.012 doi: 10.3773/j.issn.1005-264x.2010.07.012 [13] 任明迅, 夏婧, 孟千万. 雄蕊: 生态与进化[M]. 北京: 科学出版社, 2016: 77-87. [14] Ren M X, Tang J Y. Up and down: stamen movements in Ruta graveolens (Rutaceae) enhance both outcrossing and delayed selfing [J]. Annals of Botany, 2012, 110(5): 1017−1025. https://doi.org/10.1093/aob/mcs181 doi: 10.1093/aob/mcs181 [15] Armbruster W S, Corbet S A, Vey A J M, et al. In the right place at the right time: Parnassia resolves the herkogamy dilemma by accurate repositioning of stamens and stigmas [J]. Annals of Botany, 2014, 113(1): 97−103. https://doi.org/10.1093/aob/mct261 doi: 10.1093/aob/mct261 [16] Lewis D. Incompatibility, stamen movement and pollen economy in a heterostyled tropical forest tree, Cratoxylum formosum (Guttiferae) [J]. Proceedings of the Royal Society B: Biological Sciences, 1982, 214(1195): 273−283. https://doi.org/10.1098/rspb.1982.0010 doi: 10.1098/rspb.1982.0010 [17] Gu L, Luo Z L, Zhang D X, et al. Passerine pollination of Rhodoleia championii (Hamamelidaceae) in subtropical China [J]. Biotropica, 2010, 42(3): 336−341. https://doi.org/10.1111/j.1744-7429.2009.00585.x doi: 10.1111/j.1744-7429.2009.00585.x [18] 向文倩, 任明迅. 木棉黄花个体的适应意义[J]. 生物多样性, 2019, 27(4): 373−379. https://doi.org/10.17520/biods.2019003 doi: 10.17520/biods.2019003 [19] Dafni A, Kevan P G. Floral symmetry and nectar guides: ontogenetic constraints from floral development, colour pattern rules and functional significance [J]. Botanical Journal of the Linnean Society, 1996, 120(4): 371−377. https://doi.org/10.1111/j.1095-8339.1996.tb00487.x doi: 10.1111/j.1095-8339.1996.tb00487.x [20] Johnson S D. Bird pollination [J]. Current Biology, 2022, 32(20): R1059−R1060. https://doi.org/10.1016/j.cub.2022.06.081 doi: 10.1016/j.cub.2022.06.081 -

 点击查看大图
点击查看大图
计量
- 文章访问数: 24
- HTML全文浏览量: 10
- 被引次数: 0



 下载:
下载: