-
海南岛是中国唯一的全热带大陆性岛屿,地处中国大陆最南端、亚洲热带北缘,面积约3.4万km2,是全球生物多样性热点地区[1]。其中,维管植物超
4000 种,特有植物达480余种[2-3]。岛上自然植被和生物多样性集中分布在海南热带雨林国家公园[1, 3-4],山脉与沟谷等复杂地形促进了物种多样性的形成[5-6]。苦苣苔科(Gesneriaceae)包含两个亚科,即苦苣苔亚科(Cyrtandroideae)和大岩桐亚科(Gesnerioideae)[7-8]。海南岛和中国西南部是苦苣苔亚科的物种多样性分布中心[9-10]。岛上分布着超过25种苦苣苔亚科植物,其中包括11个特有种[11-13],特有率高达44%。相对于岛上苦苣苔亚科马铃苣苔属(Oreocharis)、蛛毛苣苔属(Paraboea)和扁蒴苣苔(Cathayanthe biflora)局域分布的特有类群,烟叶报春苣苔广泛分布于海南热带雨林国家公园[3, 14-15],其分布范围涵盖霸王岭、俄贤岭、尖峰岭、鹦哥岭、黎母山、仙安石林、五指山及七仙岭等区域[16-17]。受昌化江河谷、海南中线高速公路等因素的隔离作用,烟叶报春苣苔呈现出明显的谱系地理结构[6, 17]。
植物通过花部结构筛选、吸引传粉者,传粉昆虫则通过适应性变异适配花部结构[18-19]。同一物种不同地理种群的花部特征也可能为适应不同的传粉者而发生改变[20-22]。烟叶报春苣苔具有显著的谱系地理结构,但这种地理隔离是否进一步驱动了种群间花部性状的分化,仍有待探究。其次,烟叶报春苣苔存在黄花、紫花两种个体,黄花植株趋向于高海拔分布(>1,000 m),紫花植株趋向于低海拔生长(<1,000 m),两种花色个体传粉系统的适应性差异尚不可知。
本研究首先对不同地理种群花部综合征进行测量,分析地理隔离是否驱动花部特征产生分化;其次,针对烟叶报春苣苔紫花、黄花种群,通过测量花部综合征、观测开花物候及访花昆虫,分析不同花色种群可能存在的传粉机制差异。
-
烟叶报春苣苔是苦苣苔科(Gesneriaceae)苦苣苔亚科(Cyrtandroideae)报春苣苔属(Primulina)的植物,为海南岛特有种,广泛分布于海南热带雨林国家公园。该种生长于山谷林中或溪边石上,在石灰岩与非石灰岩生境中均有分布,海拔范围为300~1,300 m[10, 15]。该种为多年生草本,花筒呈漏斗状,花冠为紫色或黄色、两侧对称,花筒内具2或3个斑点作为蜜导;雄蕊2枚、合生,可全年开花(图1)。
-
为明确烟叶报春苣苔不同地理种群花部特征的分化规律,在整个分布区选取不同地理种群开展野外调查。根据生境异质性及地理隔离程度,共设置8个地理种群(附表1)。在盛花期,随机选取20株以上的健康植株,每株选取2~3朵盛开的花进行测量。根据方差分析的要求,每个种群至少采集30朵花的数据(附表2)。在野外,采用游标卡尺(精度0.01 mm)对以下3个关键花部性状进行测量:花大小(花冠最大横向直径)、花喉宽度(花冠喉部最窄处的横向距离)及花筒长(从花冠喉部处至花筒基部的纵向长度)。同时,记录每个种群的经纬度和海拔高度,并基于地理坐标通过ArcGIS 10.8软件[23]计算种群间的直线距离(单位:km)。
所有花部特征的数据均经过正态性检验和方差齐性检验,符合参数检验条件。数据分析在R 4.4.3软件[24]中完成,显著性水平设为P<0.05。首先,以地理种群为分组变量,分别对花大小、花喉宽度和花筒长进行单因素方差分析(one-way ANOVA),检验不同地理种群间单一花部特征的差异显著性,该分析通过rstatix包[25]完成。其次,以花大小、花喉宽度和花筒长的组合为响应变量,进行多元方差分析(MANOVA),检验地理种群间花部特征组合的整体差异,该分析通过car包[26]完成。最后,采用皮尔逊(Pearson)相关系数分析花大小、花喉宽度和花筒长的整体相关性,通过显著性检验判断相关性的统计学可靠性,该分析用corrplot包[27]完成。
为探究地理距离、海拔对整体花部性状的影响,以地理距离、海拔为自变量,花大小、花喉宽度和花筒长为因变量,利用基础函数lm进行线性回归分析。
-
为探究烟叶报春苣苔不同花色种群的开花动态差异,选取紫花、黄花各1个种群开展开花动态研究。其中,紫花种群位于昌江黎族自治县王下乡王下河河谷(109º07′05.10″ E,19º01′26.27″ N,海拔450 m)(图1-C);黄花种群位于霸王岭东一林场附近(109º09′36.73″ E,19º07′13.46″ N,海拔1,011 m)(图1-D)。
2025年5月24日至10月29日,对上述两个监测种群的固定样地开展定点连续观测,对种群物候进行为期7~10天的连续记录与拍照,同时记录每日天气状况,尽可能控制天气因素对访花昆虫的潜在影响。在两个种群中分别选取30株处于花苞期的植株进行挂牌标记,对其开花动态实施连续观察:采用精度为1 mm的电子游标卡尺测定花大小、花喉宽度、花筒长、雄蕊长(花药至花筒底部的距离)、花柱长(柱头至花筒底部的距离)、雌雄异位(herkogamy)程度(花药与柱头间的距离)等花部性状,每隔2 h观察记录一次,直至柱头萎蔫。
采用单因素方差分析和多元方差分析检验花色对花部特征的影响。针对花大小、花喉宽度、花筒长3个特征,分别以花色为自变量进行单因素方差分析,检验不同花色在单一花部特征上的差异显著性。为检验花色对花部特征组合的整体效应,将3个花部特征作为联合因变量,以花色为自变量进行多元方差分析,进一步验证花色对花部特征协同变异的影响。
-
为明确烟叶报春苣苔不同花色种群的访花昆虫组成及传粉行为差异,针对上述两个种群的访花昆虫及行为进行连续7-10天观察,每日观察时段设定为上午9:00至下午17:00。观察时选取处于盛花期的开放花朵,实时记录昆虫访花相关数据,具体包括昆虫访花时间、昆虫数量、昆虫种类、单只昆虫停留时间、同一昆虫在同一时间段内访问的花朵数量等;同时进行视频拍摄,详细描述昆虫的访花行为特征。观察过程中重点关注传粉昆虫与花内各器官的接触情况,其中能够同时接触到柱头和花药的昆虫被界定为有效传粉昆虫。
-
在所有地理种群中,烟叶报春苣苔的花部特征测量结果如下:花大小均值为2.26±0.09 cm,花喉宽度均值为0.94±0.06 cm,花筒长均值为4.07±0.11 cm(图2)。单因素方差分析结果显示,不同地理种群间的三个关键花部特征均无显著差异:花大小(F = 0.919,P = 0.996)、花喉宽度(F = 0.408,P = 1.00)及花筒长(F = 0.292,P = 0.991),表明地理因素对各花部特征的独立影响不显著。
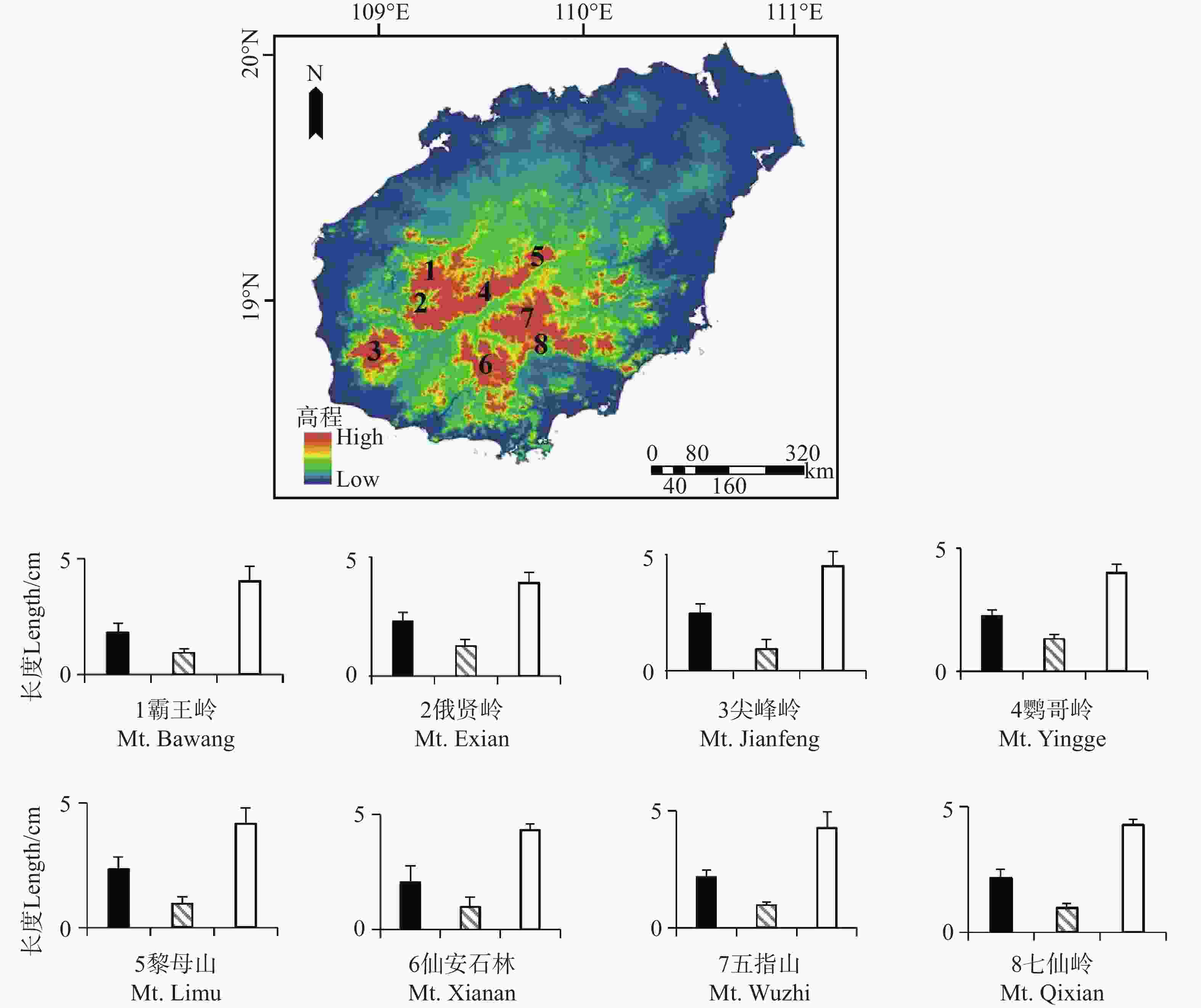
图 2 烟叶报春苣苔不同地理种群的花部特征(■花大小,

Figure 2. Floral traits of different geographic populations of P. heterotricha (■ Floral size;

多元方差分析表明,不同地理种群间的花部特征组合(花大小、花喉宽度及花筒长)存在显著差异(Pillai = 0.176,P =
0.0035 ;Wilks = 0.826,P =0.0020 ;Hotelling-Lawley = 0.207,P =0.0011 ;Roy = 0.194,P = 6.31×10−7),四种检验方法均显示地理因素对花部特征整体表型有显著影响。其次,任意两地理种群间的花部特征整体表型没有差异(P>0.05)。花大小和花喉宽度呈极强正相关(r = 0.987,P = 9.92×10−192),花大小和花筒长呈极强负相关(r = −0.989, P = 1.55×10−198),花喉宽度和花筒长呈极强负相关(r = −0.990,P = 4.54×10−206)。
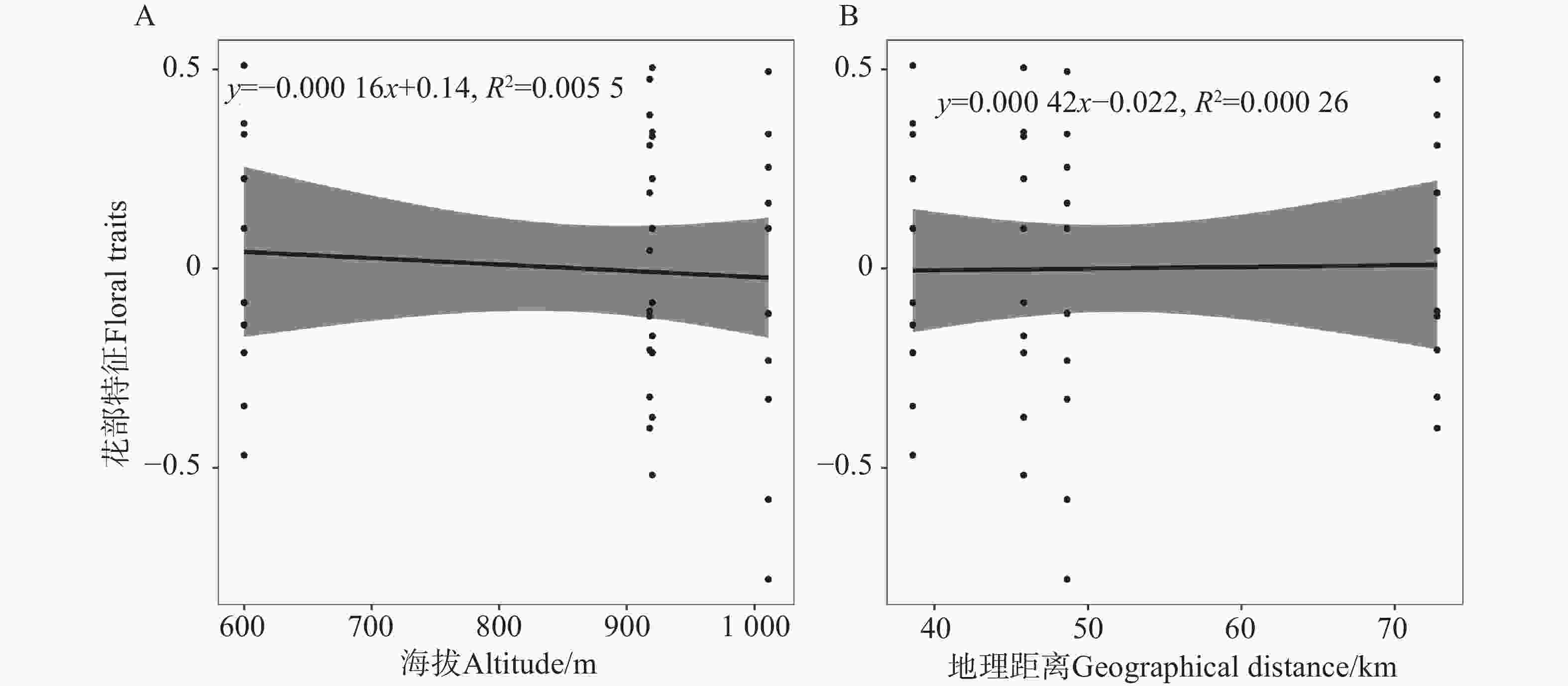
地理距离与花部特征的线性回归分析显示,地理距离与花大小(P =
0.9995 )、花喉宽度(P =0.9863 )及花筒长(P =0.9336 )均无显著相关性。海拔与花部特征的线性回归分析显示,花大小(P =0.8323 )、花喉宽度(P =0.8303 )和花筒长(P =0.9742 )均与海拔无显著相关性。所有指标的回归系数接近0,且R2值极小(图3)。 -
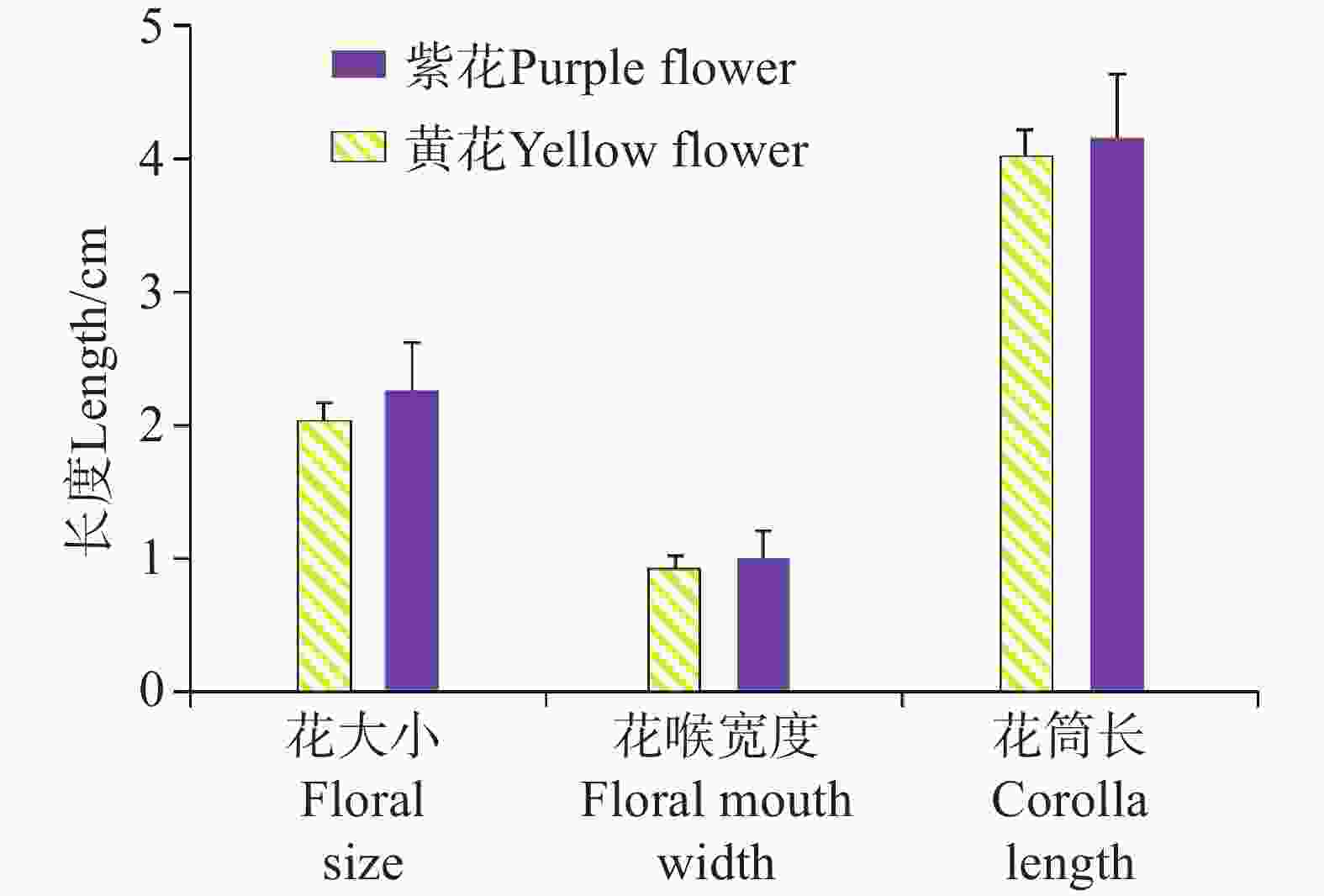
在花部特征方面,选取两个不同花色种群各30朵成熟的花冠进行测定(附表3)。黄花种群花大小平均值为2.12±0.02 cm,花喉宽度为0.90±0.02 cm,花筒长为4.04±0.04 cm;紫色花冠种群花大小平均值为2.13±0.02 cm,花喉宽度为0.90±0.02 cm,花筒长为4.05±0.04 cm(附表3, 图4)。单因素方差分析结果显示,不同花色在三个关键花部特征上均无显著差异:花大小(F = 0.337,P = 0.564)、花喉宽度(F = 0.444,P = 0.508)及花筒长(F = 0.108,P = 0.743),表明花色对各花部特征的独立影响不显著。经过多元方差分析进一步检验,花色对花部特征组合的整体效应,即花色对花大小、花喉宽度和花筒长的协同变异无显著影响(Wilks =
0.9574 ,P =0.5071 )。 -
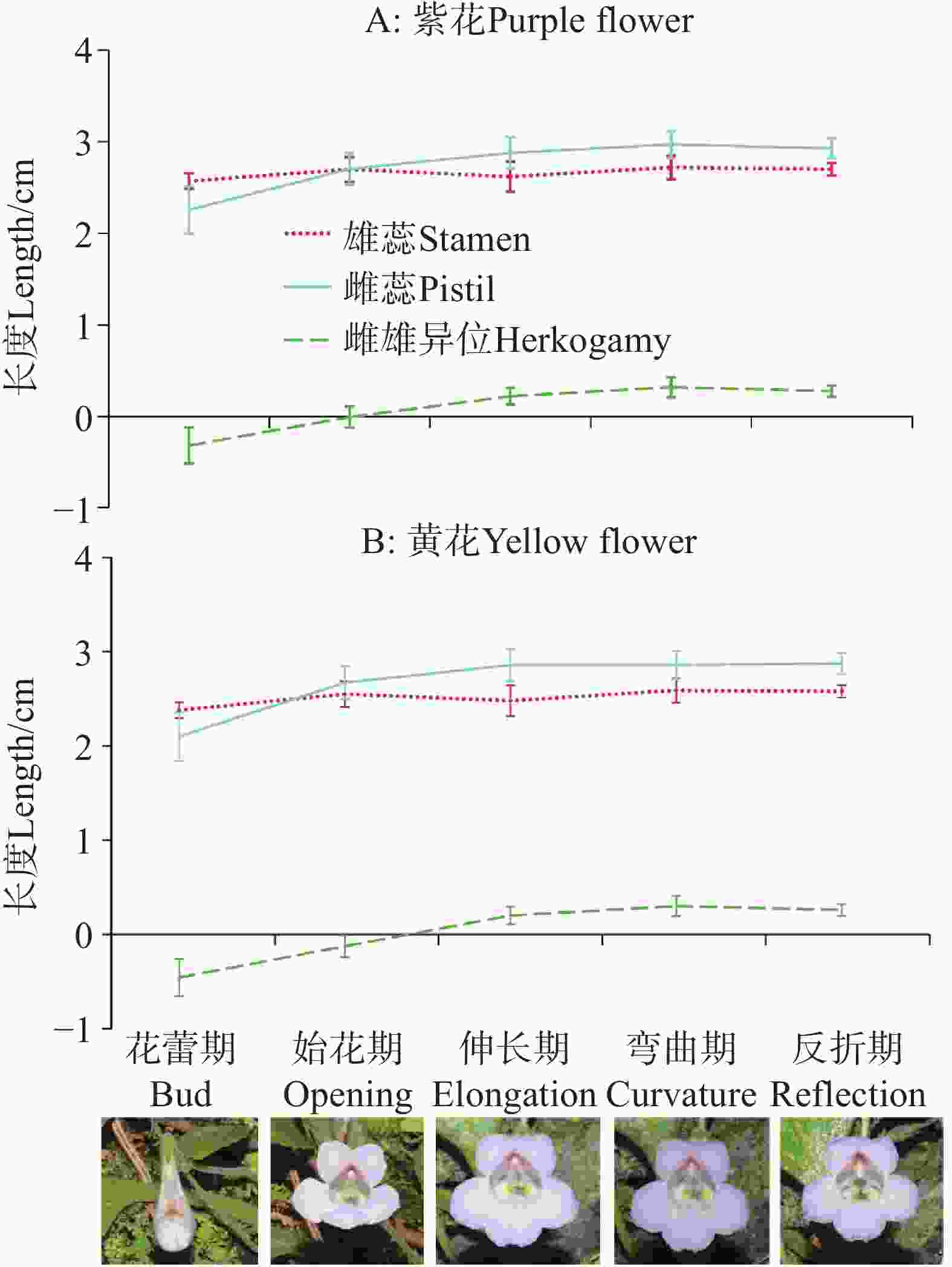
基于本研究前期野外实地系统观察,结合单花发育全过程的动态追踪记录,依据柱头是否伸长、弯曲角度等形态特征,以及是否脱离花筒喉部等空间位置变化,可将烟叶报春苣苔单朵花的生活史划分为以下六个阶段:(1)花蕾期:花冠呈紧实花骨朵状,尚未开放;(2)始花期:花朵刚刚开放,柱头尚未伸长;(3)伸长期:柱头开始显著伸长,脱离花筒喉部区域,其形态变化肉眼可清晰观察;(4)弯曲期:伸长后的柱头出现明显的弯曲生长趋势;(5)反折期:柱头弯曲角度超过90°,且弯曲程度随发育进程持续加大;(6)落花期:花冠完全脱落,仅残留花柱,此时自然授粉过程已完成。
开花进程与花期特征如下:单朵花从发育完全的花蕾到花冠裂片完全展开约耗时1天,开裂过程具有特定顺序——花朵下唇的右裂片先伸展张开,随后左裂片向左方展开,此时下唇的中裂片被上唇包裹;2~3小时后,上下唇裂片完全分离,各自向上下方向展开,开放约2~3小时后,裂片完全舒展,花朵进入正式开放状态。单朵花的花期约为5~7天,整个种群的花期主要集中在3~11月,其余时间偶有零星开花现象。
烟叶报春苣苔的合生花药始终保持在花筒喉部位置,花柱在始花期在雄蕊后方,在伸长期、弯曲期和反折期从花筒喉部位置逐渐伸长并弯曲,雌雄异位程度相对变化较小(图5)。两种花色种群在不同开花阶段雄蕊长、雌蕊长和雌雄异位程度没有显著差异(P>0.05;附表4;图5-A–B),三个指标变化趋势一致。
-
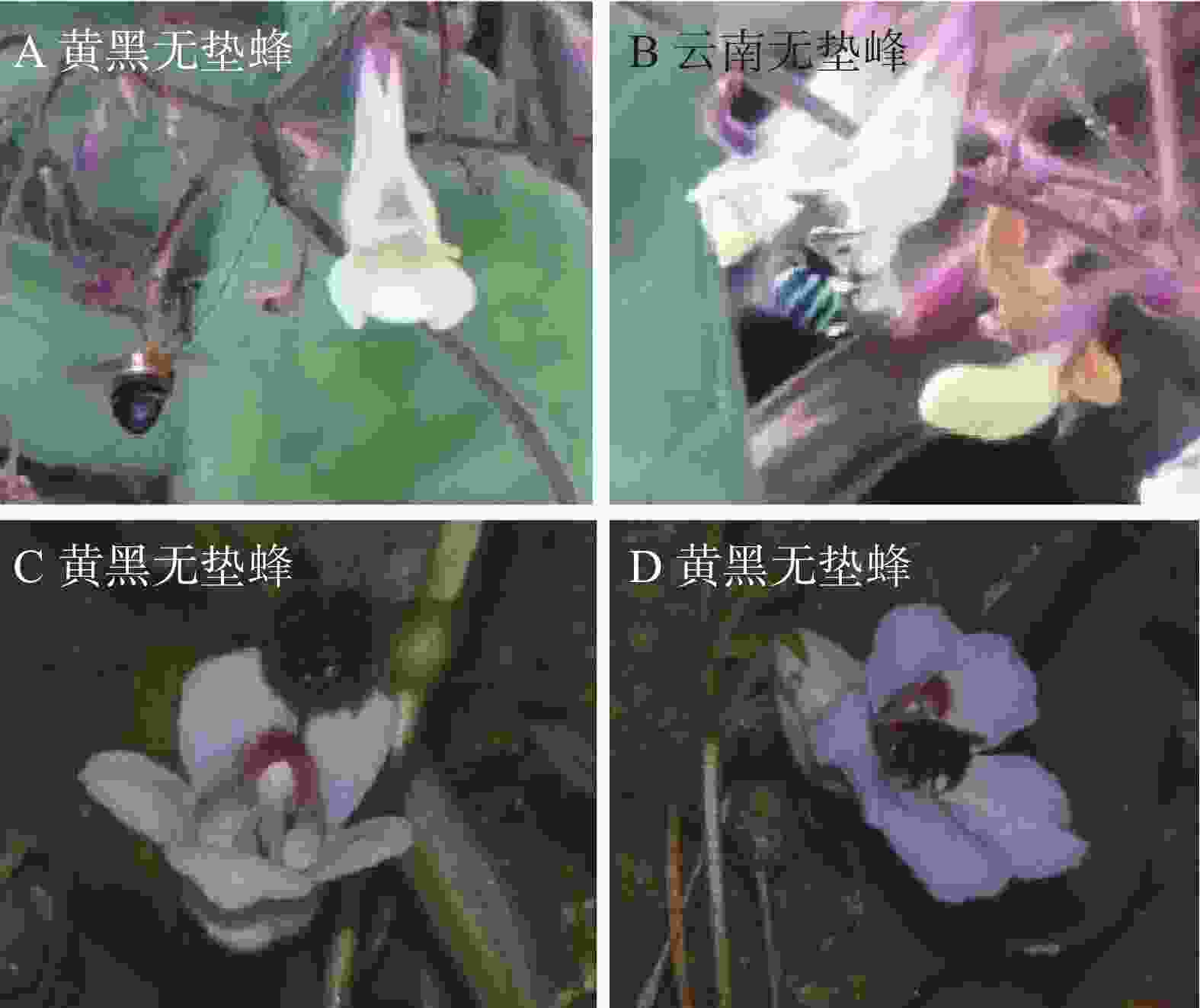
黄花个体的主要访花者为黄黑无垫蜂(Amegilla leptocoma)和云南无垫蜂(A. yunnanensis)(图6-A–B),紫花个体主要访花者为黄黑无垫蜂(图6-C–D)。两种访花者均通过头部和背部接触花药与柱头,均属有效传粉者,且不同花色种群的访花昆虫行为无差异。所有访花者单花停留时间为2~3秒,单次访问花朵数量为3~8朵。在每日平均7小时的传粉观察中,黄花种群的黄黑无垫蜂与云南无垫蜂总访花次数为75次左右,其中黄黑无垫蜂47次(占比62.7%)、云南无垫蜂28次(占比37.3%);紫色花冠种群黄黑无垫蜂的访花次数为56次。
-
在苦苣苔科植物中,传粉者介导的花部综合征对物种分化具有重要作用[28],因此可通过花表型特征预测该类群的花部综合征及传粉者类群[28-29]。烟叶报春苣苔的花部特征表现为漏斗状花冠、两侧对称,花色呈紫色或黄色,且主要以少量花蜜和花粉作为传粉回报物,基于这些特征可推测其主要传粉者为蜂类[14, 30]。花大小、花喉宽度和花筒长与访花者体型大小密切相关,是决定昆虫能否顺利进入花冠筒完成传粉过程的关键功能性状[29, 31]。单因素方差分析表明,烟叶报春苣苔不同地理种群的花大小、花喉宽度及花筒长均无显著差异,表明地理隔离没有驱动单一花部特征的定向分化。而三者的特征组合呈现显著分化,且任意两种群间未呈现种群特异性的分化模式,表明该分化并非种群特异性。功能性状的相关性常反映协同适应策略,三个花部特征具有极强的相关性,表明该花部结构可能具有功能协同性,是地理因素介导下不同花部特征的组合优化。其次,相关性分析显示,地理距离、海拔与花部特征组合无显著关联,表明该分化并非由距离或海拔梯度下的环境筛选所导致。
海南岛和邻近地区具有相似的传粉模式,以蜂类传粉最为常见传粉机制[30, 32-33]。蜂类传粉机制被认为比鸟类传粉更加泛化[31, 34]。烟叶报春苣苔的主要传粉者为黄黑无垫蜂和云南无垫蜂,这两种传粉者广泛分布于海南热带雨林国家公园[35]。海南岛山脉地形复杂、沟壑纵横,孕育出该岛近80%的特有植物[2]。这种复杂山脉形成的地理隔离,可能先阻碍黄黑无垫蜂和云南无垫蜂的基因交流,驱动其种群分化为具有体型、行为差异的局部种群;进而对烟叶报春苣苔的花大小、花喉宽度、花筒长等与传粉者体型适配的关键功能性状施加定向选择,促进了烟叶报春苣苔花部特征的地理变异。未来仍需通过系统性传粉观察,探究不同地理区域的传粉者类群组成及形态、行为特征的变异情况,明确花部特征地理变异的根本原因。
花色对于吸引传粉昆虫至关重要,色彩艳丽的花朵更易引发传粉者的访花行为[36]。蜜蜂对黄色、紫色和白色最为敏感[37],能将人类视觉中的紫色识别为紫色、将黄色识别为蓝绿色[38-39],而烟叶报春苣苔的黄色与紫色花冠均在蜜蜂的敏感色谱范围内,推测其可被主要传粉者有效识别。尽管两种花色种群的花部形态、开花动态无显著差异,但花色作为传粉者视觉识别的关键信号,其是否影响传粉者访花偏好仍需实证验证。其次,两种花色的种群在花期、传粉者种类上表现出不同。其中,黄花种群的盛花期为4~10月,紫花种群盛花期则延迟1~2个月。
黄花种群的传粉者主要为黄黑无垫蜂和云南无垫蜂,而紫花种群的传粉者以黄黑无垫蜂为主。类似现象在海南岛特有种海南凤仙花(Impatiens hainanensis)中也有发现,其传粉者因生长海拔不同而存在差异[35]:低海拔区域中传粉者为黑黄无垫蜂,高海拔区域中则为绿条无垫蜂(A. zonata),但该物种未发生传粉生态型的分化。黄黑无垫蜂雄蜂体长14~16 mm,雌蜂体长13~16 mm;云南无垫蜂雄峰体长15~16 mm,雌蜂体长13~15 mm[40],两种蜂类体型大小相差不大。从协同进化的角度,体型相同的传粉者不易形成明显的选择压力差异,导致花部形态基本保持一致。其次,烟叶报春苣苔紫色和黄花种群基因流较弱[17],花色多态性的维持可能与种群生境条件的影响有关。
总之,烟叶报春苣苔不同地理种群的花部特征有显著差异,表明该类群的花部形态已产生地理变异,可能与传粉者类型或体型的改变有关。尽管烟叶报春苣苔存在黄花与紫花两种个体,但不同花色种群在花部特征、开花动态等特征上均无显著差异,表明传粉者并非驱动其花色分化的关键因素。花色多样性的形成机制仍需深入探究,未来可从分子角度研究花色多样性形成的根本原因。本研究明确了海南特有植物烟叶报春苣苔在海南热带雨林国家公园花部特征的地理变异和花色多样性的传粉适应,不仅揭示了该植物的传粉和局域生态适应过程,也为海南热带雨林国家公园生物多样性保护和传粉服务功能评估提供了科学支撑。
Geographical variation in floral traits and pollination adaptation of floral color diversity of Primulina heterotricha (Gesneriaceae), an endemic species of Hainan Island, China
-
摘要: 海南岛作为全球生物多样性热点地区之一,其生物多样性集中分布于海南热带雨林国家公园。烟叶报春苣苔(Primulina heterotricha)为海南岛特有植物,分布十分广泛,且具有黄花、紫花两种个体。首先,为明确不同地理种群花部特征的分化规律,通过测定不同地理种群的花大小、花喉宽度及花筒长等关键性状,分析地理隔离对花部性状分化的潜在驱动作用。其次,围绕两种花色分化及传粉机制差异,对比研究黄花和紫花个体的开花动态和访花昆虫及其访花行为,揭示不同花色种群可能存在的传粉机制差异。多元方差分析结果表明,不同地理种群间整体花部特征有显著差异(P<0.05),地理距离和海拔对其影响不显著;不同花色种群花部特征无显著差异(P>0.05)。在不同开花阶段,两种花色种群的雄蕊长度、雌蕊长度及雌雄异位程度均无显著差异(P>0.05),但随着花期柱头逐渐伸长并超过花药位置。访花昆虫观测显示,黄花种群的主要访花昆虫有黄黑无垫蜂与云南无垫蜂,紫花种群则为黄黑无垫蜂。因此,黄花个体具有更泛化的访花者,紫花个体传粉更加特化。本研究对烟叶报春苣苔不同地理种群花部特征的分化规律、花色多样性的传粉适应进行了研究,为海南热带雨林国家公园生物多样性保护、传粉服务功能评估提供了科学依据。Abstract: Hainan Island, as one of the global biodiversity hotspots, has its biodiversity concentrated in National Park of Hainan Tropical Rainforest. Primulina heterotricha, an endemic plant of Hainan Island, has a widespread distribution and consists of two floral color morphs: yellow-flowered and purple-flowered individuals. First, to clarify the differentiation pattern of floral traits among different geographical populations, we measured key floral traits including flower size, floral mouth width, and corolla tube length across various geographical populations, and analyzed the potential driving effect of geographical isolation on the differentiation of these floral traits. Second, focusing on the differentiation of two floral color morphs and the differences in pollination mechanisms, we comparatively analyzed the flowering dynamics of yellow-flowered and purple-flowered individuals, as well as flower-visiting insects and their visiting behaviors, to reveal the possible differences in pollination mechanisms between populations with different flower colors. A multivariate analysis of variance (MANOVA) revealed significant differences in floral traits among different geographical populations (P < 0.05), but geographical distance and altitude had no significant effect on floral traits. Populations with different floral colors also did not show significant difference in floral traits (P > 0.05). Moreover, at different flowering stages, there were no significant differences in stamen length, pistil length and herkogamy degree between the two floral color populations (P > 0.05), but the stigma gradually elongated and exceeded the position of the anthers as the flowering period progressed. Observations on flower-visiting insects indicated that the main flower-visiting insects of yellow-flowered populations were Amegilla leptocoma and A. yunnanensis, while the main flower-visiting insect of the purple-flowered populations was A. leptocoma. Thus, yellow-flowered individuals have a more generalized assemblage of flower visitors, whereas purple-flowered individuals exhibit a more specialized pollination system. This study investigated the differentiation pattern of floral traits among different geographical populations, floral color diversity and pollination adaptation process of P. heterotricha, and provides a scientific basis for biodiversity conservation and pollination service function assessment in National Park of Hainan Tropical Rainforest..
-
Key words:
- Hainan Island /
- floral syndrome /
- floral color /
- flowering dynamics /
- pollination system
-
-
[1] Myers N, Mittermeier R A, Mittermeier C G, et al. Biodiversity hotspots for conservation priorities [J]. Nature, 2000, 403(6772): 853−858. https://doi.org/10.1038/35002501 doi: 10.1038/35002501 [2] Francisco-Ortega J, Wang Z S, Wang F G, et al. Seed plant endemism on Hainan Island: a framework for conservation actions [J]. The Botanical Review, 2010, 76(3): 346−376. https://doi.org/10.1007/s12229-010-9055-7 doi: 10.1007/s12229-010-9055-7 [3] 杨小波. 海南植物名录[M]. 北京: 科学出版社, 2013. (查阅网上资料, 未找到对应的页码信息, 请确认) [4] 杨小波. 海南植物图志-第三卷[M]. 北京: 科学出版社, 2015. (查阅网上资料, 未找到对应的页码信息, 请确认) [5] 李歌, 凌少军, 陈伟芳, 等. 昌化江河谷隔离对海南岛特有植物盾叶苣苔遗传多样性的影响[J]. 广西植物, 2020, 40(10): 1505−1513. https://doi.org/10.11931/guihaia.gxzw201808024 doi: 10.11931/guihaia.gxzw201808024 [6] Ling S J, Caujapé-Castells J, Tang L, et al. Phylogeographic patterns driven by river isolations in an island-endemic montane plant [J]. Authorea, 2024. (查阅网上资料,未找到对应的卷期页码信息,请确认) https://doi.org/10.22541/au.170667125.55077758/v1 [7] Burtt B L. Studies on the gesneriaceae of the old world XXIV: tentative keys to the tribes and genera [J]. Notes from Royal Botanic Garden Edinburgh, 1962, 24(3): 205−220. https://doi.org/10.24823/nrbge.1963.2624 doi: 10.24823/nrbge.1963.2624 [8] 中国科学院中国植物志编辑委员会. 中国植物志第六十九卷[M]. 北京: 科学出版社, 1990. (查阅网上资料, 未找到对应的页码信息, 请确认) [9] 李振宇, 王印政. 中国苦苣苔科植物[M]. 郑州: 河南科学技术出版社, 2005. (查阅网上资料, 未找到对应的页码信息, 请确认) [10] 广西壮族自治区中国科学院广西植物研究所. 华南苦苣苔科植物[M]. 南宁: 广西科学技术出版社, 2010. (查阅网上资料, 未找到对应的页码信息, 请确认) [11] Ling S J, Qin X T, Song X Q, et al. Genetic delimitation of Oreocharis species from Hainan Island [J]. PhytoKeys, 2020, 157: 59−81. https://doi.org/10.3897/phytokeys.157.32427 doi: 10.3897/phytokeys.157.32427 [12] Ling S J, Guan S P, Wen F, et al. Oreocharis jasminina (Gesneriaceae), a new species from mountain tops of Hainan Island, South China [J]. PhytoKeys, 2020, 157: 121−135. https://doi.org/10.3897/phytokeys.157.50246 doi: 10.3897/phytokeys.157.50246 [13] Ling S J, Wen F, Ren M X. Oreocharis hainanensis (Gesneriaceae), a new species from karst regions in Hainan Island, South China [J]. Phytotaxa, 2022, 538(4): 281−291. https://doi.org/10.11646/phytotaxa.538.4.2 doi: 10.11646/phytotaxa.538.4.2 [14] 凌少军, 孟千万, 唐亮, 等. 海南岛苦苣苔科植物的地理分布格局与系统发育关系[J]. 生物多样性, 2017, 25(8): 807−815. https://doi.org/10.17520/biods.2016360 doi: 10.17520/biods.2016360 [15] 邢福武, 周劲松, 王发国, 等. 海南植物物种多样性编目[M]. 武汉: 华中科技大学出版社, 2012. (查阅网上资料, 未找到对应的页码信息, 请确认) [16] 凌少军. 海南岛苦苣苔科的“区域生命之树”及特有种烟叶唇柱苣苔在昌化江两侧的分化[D]. 海口: 海南大学, 2017. [17] Jin W T, Ling S J, Chung M G, et al. Human fragmentation effects are genetically detectable after 6 years in an island-endemic plant [J]. Ecology and Evolution, 2025, 15(5): e71310. https://doi.org/10.1002/ece3.71310 doi: 10.1002/ece3.71310 [18] 史刚荣. 虫媒植物与传粉昆虫的协同进化[J]. 生物学杂志, 1996(3): 46−48. https://doi.org/10.3969/j.issn.1003-5508.2005.06.007 doi: 10.3969/j.issn.1003-5508.2005.06.007 [19] 任明迅, 夏婧, 孟千万. 雄蕊: 生态与进化[M]. 北京: 科学出版社, 2016. (查阅网上资料, 未找到对应的页码信息, 请确认) [20] Anderson B, Alexandersson R, Johnson S D. Evolution and coexistence of pollination ecotypes in an African Gladiolus (Iridaceae) [J]. Evolution, 2009, 64(4): 960−972. https://doi.org/10.1111/j.1558-5646.2009.00880.x doi: 10.1111/j.1558-5646.2009.00880.x [21] Van Der Niet T, Pirie M D, Shuttleworth A, et al. Do pollinator distributions underlie the evolution of pollination ecotypes in the Cape shrub Erica plukenetii? [J]. Annals of Botany, 2014, 113(2): 301−315. https://doi.org/10.1093/aob/mct193 doi: 10.1093/aob/mct193 [22] 钱贞娜, 孟千万, 任明迅. 风筝果镜像花的雌雄异位变化及传粉生态型的形成[J]. 生物多样性, 2016, 24(12): 1364−1372. https://doi.org/10.17520/biods.2016248 doi: 10.17520/biods.2016248 [23] Esri. ArcGIS desktop: release 10.8. 1 [R]. Redlands: Environmental Systems Research Institute, 2020. (查阅网上资料, 未找到本条文献信息, 请确认) [24] R Core Team. R: a language and environment for statistical computing [R]. Vienna, Austria: R Foundation for Statistical Computing, 2024. [25] Kassambara A. Rstatix: pipe-friendly framework for basic statistical tests [J]. R Package Version 0.7. 0, 2021. (查阅网上资料, 未找到本条文献信息, 请确认) [26] Fox J, Weisberg S. An R companion to applied regression [M]. 3rd ed. Thousand Oaks: SAGE Publications, 2019. (查阅网上资料, 未找到对应的页码信息, 请确认) [27] WEI T Y, SIMKO V, LEVY M, et al. Orrplot: visualization of a correlation matrix [R/OL]. R Package Version 0.95, (2024-10-14). https://CRAN.R-project.org/package=corrplot.(查阅网上资料,未找到引用日期信息,请确认) [28] Martén-Rodríguez S, Almarales-Castro A, Fenster C B. Evaluation of pollination syndromes in Antillean gesneriaceae: evidence for bat, hummingbird and generalized flowers [J]. Journal of Ecology, 2009, 97(2): 348−359. https://doi.org/10.1111/j.1365-2745.2008.01465.x doi: 10.1111/j.1365-2745.2008.01465.x [29] Rosas-Guerrero V, Aguilar R, Martén-Rodríguez S, et al. A quantitative review of pollination syndromes: do floral traits predict effective pollinators? [J]. Ecology Letters, 2014, 17(3): 388−400. https://doi.org/10.1111/ele.12224 doi: 10.1111/ele.12224 [30] Ling S J, Meng Q W, Tang L, et al. Pollination syndromes of Chinese gesneriaceae: a comparative study between Hainan island and neighboring regions [J]. The Botanical Review, 2017, 83(1): 59−73. https://doi.org/10.1007/s12229-017-9181-6 doi: 10.1007/s12229-017-9181-6 [31] Fenster C B, Armbruster W S, Wilson P, et al. Pollination syndromes and floral specialization [J]. Annual Review of Ecology, Evolution, and Systematics, 2004, 35: 375−403. https://doi.org/10.1146/annurev.ecolsys.34.011802.132347 doi: 10.1146/annurev.ecolsys.34.011802.132347 [32] Gao J Y, Ren P Y, Yang Z H, et al. The pollination ecology of Paraboea rufescens (Gesneriaceae): a buzz-pollinated tropical herb with mirror-image flowers [J]. Annals of Botany, 2006, 97(3): 371−376. https://doi.org/10.1093/aob/mcj044 doi: 10.1093/aob/mcj044 [33] 温放, 符龙飞, 韦毅刚. 两种广西特有报春苣苔属(苦苣苔科)植物传粉生物学研究[J]. 广西植物, 2012, 32(5): 571−578. https://doi.org/10.3969/j.issn.1000-3142.2012.05.001 doi: 10.3969/j.issn.1000-3142.2012.05.001 [34] Rodríguez-Gironés M A, Santamaría L. Why are so many bird flowers red? [J]. PLoS Biology, 2004, 2(10): e350. https://doi.org/10.1371/journal.pbio.0020350 doi: 10.1371/journal.pbio.0020350 [35] 钟云芳, 张哲, 宋希强, 等. 海南凤仙花不同海拔种群的传粉生物学[J]. 生物多样性, 2014, 22(4): 467−475. https://doi.org/10.3724/SP.J.1003.2014.13243 doi: 10.3724/SP.J.1003.2014.13243 [36] Menghini M. 蜜蜂眼中的花朵[J]. 文铮, 译. 科学世界, 2004(3): 66−69. [37] 于尔根·陶茨. 蜜蜂的神奇世界[M]. 苏松坤, 译. 北京: 科学出版社, 2008. (查阅网上资料, 未找到对应的页码信息, 请确认) [38] Menzel R, Blakers M. Colour receptors in the bee eye - Morphology and spectral sensitivity [J]. Journal of Comparative Physiology, 1976, 108(1): 11−13. https://doi.org/10.1007/BF00625437 doi: 10.1007/BF00625437 [39] Osorio D, Vorobyev M. Photoreceptor sectral sensitivities in terrestrial animals: adaptations for luminance and colour vision [J]. Proceedings of the Royal Society B: Biological Sciences, 2005, 272(1574): 1745−1752. https://doi.org/10.1098/rspb.2005.3156 doi: 10.1098/rspb.2005.3156 [40] 吴燕如, 何琬, 王淑芳. 云南蜜蜂志[M]. 昆明: 云南科技出版社, 1988. (查阅网上资料, 未找到对应的页码信息, 请确认) -

 点击查看大图
点击查看大图
计量
- 文章访问数: 191
- HTML全文浏览量: 132
- 被引次数: 0



 下载:
下载: