-
埃及伊蚊(Aedes aegypti)是登革热、塞卡热、黄热病等疾病的主要传播媒介之一[1 - 2]。蚊虫防控是控制蚊媒病流行的最有效的手段之一[3]。目前,化学防治仍然是治蚊的主要手段,不过传统杀虫剂的大量反复使用,导致日趋严重的“3R”问题出现,因此开发高效低毒、多靶点、环保绿色的杀虫剂品种迫在眉睫[4 − 6]。光活化药剂能够在可见光或近紫外光照射下吸收光子能量转变为激发态,产生活性氧,从而对机体细胞造成氧化损伤,引发生物膜和细胞器结构与功能的破坏[7 - 8]。由于该类药剂的优良特性包括不易产生抗性、易自然降解等,其在医药领域[9 − 12]、农药领域均具有广泛的研究价值[13 − 16]。近年来,呋喃香豆素类、卟啉类和吖啶类等光活化杀虫剂的研究潜力逐渐被挖掘[17 - 18]。文献[19]研究表明,卟啉能够显著抑制巨片形吸虫幼虫乙酰胆碱酯酶的活性,并且经日光活化后抑制效果增强。其中,吖啶类化合物具有较大的共轭体系[20],并表现出广泛的生物活性及光活化荧光特性。Xiao等[21]研究表明,吖啶衍生物能够诱导埃及伊蚊细胞产生大量外源ROS,引发中肠氧化应激,破坏中肠细胞细胞器并影响中肠正常生理功能诱导埃及伊蚊死亡。文献[22]通过IVS研究表明吖啶衍生物对于烟曲霉、亚洲玉米螟等靶标生物的几丁质酶表现出明显的抑制活性,酶活测定也充分验证了这一结果。本研究以吖啶衍生物作为供试药剂,研究其对埃及伊蚊的杀虫活性,筛选高活性化合物,并对其作用机制进行初步探讨,旨在发现具有光活化活性的杀虫剂,为光活化药剂在农业领域的研发提供参考。
-
Infinite 200 pro型连续波长多功能微孔板检测仪,瑞士帝肯(Tecen)公司;UV-1100型紫外分光光度计,上海美谱达仪器有限公司;NE910型正置生物荧光显微镜,宁波永新光学股份有限公司;CF1524R型台式高速微量冷冻离心机,美国赛洛捷克(Scilogex)公司;LUKYM-11型样品冷冻研磨仪,广州露卡测序仪器有限公司。
-
95% (w/w)9-苯基吖啶、97%(w/w) 9,10-二氢吖啶、98%(w/w) 9-氯吖啶、98%(w/w) 9-甲基吖啶、98%(w/w) 9-氨基吖啶、98%(w/w)吖啶酮均购自上海麦克林生化科技股份有限公司;超氧化物歧化酶(superoxide dismutase, SOD)活性检测试剂盒、过氧化氢酶(catalase, CAT)活性检测试剂盒、过氧化物酶(peroxidase, POD)活性检测试剂盒均购自北京盒子生工科技有限公司;几丁质酶活性检测试剂盒、活性氧检测试剂盒、丙二醛(malondialdehyde, MDA)含量检测试剂盒、乙酰胆碱酯酶活性检测试剂盒均购自北京索莱宝生物科技有限公司。幼蚊饲料为前民饲料(由进口鱼粉、鸡肉粉、玉米、豆豉、麦麸、碎米等天然原材料组成,不含任何添加剂,均衡满足幼蚊所需),购自沈阳市洪区前民动物实验饲料厂。
-
埃及伊蚊(Aedes aegypti)由海南大学热带农林学院骆焱平实验室提供。
-
埃及伊蚊的饲养:将埃及伊蚊卵块放入37 ℃的脱氯水中,于温度26~29 ℃、空气相对湿度60%~70%条件下孵化;待幼虫孵化,取蚊幼饲料投放入水槽中饲喂,直至化蛹;吸取蚊蛹放入养虫笼中待其羽化,使用8%(w/v)的葡萄糖水进行饲喂,以小白鼠喂血供其产卵需要;将卵块存放于干燥处,一般放置2 d以上才能孵化使用[23]。
以9-苯基吖啶为例,将供试药剂用二甲基亚砜(DMSO)配置成100 mg·L−1母液,然后使用脱氯水将药剂稀释至0.2、0.4、0.6、0.8、1.0 mg·L−1 5个质量浓度[DMSO为1%(v/v)]。移取30头个体大小相近、生长良好的四龄初期幼虫,放置于6 cm培养皿,吸干多余液体,加入10 mL药液,以1% DMSO为对照,每个处理设3个重复。将所有培养皿置于紫外线箱(完全黑暗)中3 h后,打开紫外灯照射3 h,同时进行一组黑暗平行处理;24 h后观察幼虫中毒症状。除明显死亡的幼虫外,幼虫抽搐垂死且沉于水底视为死亡,记录死亡幼虫数量,计算死亡率[24]和亚致死浓度。
-
参照1.4的方法,配置LC25(0.474 mg·L−1)、LC50(0.717 mg·L−1)、LC75(1.086 mg·L−1)浓度的9-苯基吖啶溶液,以1%(v/v)的二甲基亚砜为对照,紫外线处理试虫,记录死亡数和存活数;将存活的幼虫吸出,以脱氯水洗涤2~3次,使用脱氯水培养,放置于养蚊笼内,每天观察记录幼虫化蛹、羽化的情况,计算化蛹率、蛹死亡率和羽化率[25]。
-
粗酶液的制备:吸取经1.5处理的埃及伊蚊四龄幼虫,置于1.5 mL离心管内,用注射器吸取多余液体,研磨后称取0.1 g幼虫组织。在离心管中加入1 mL提取液,在冰浴条件下研磨成匀浆,按照试剂盒说明书提供的条件离心,取上清液备用。酶活性测定:采取几丁质酶检测试剂盒测定试虫几丁质酶含量变化。
-
参照李迅等[26]的活性氧(reactive oxygen species, ROS)测定方法,吸取经上述处理的埃及伊蚊四龄幼虫用PBS冲洗3次,在25 ℃下于2 μmol·L−1的DCFH-DA荧光染色液中避光孵育30 min;以PBS洗涤3次后,置于载玻片上,使用荧光显微镜在同一曝光下观察并拍照;使用Image J对图像中的荧光强度进行统计分析。
-
按照1.6方法处理试虫,采用超氧化物歧化酶(superoxide dismutase, SOD)活性检测试剂盒、过氧化氢酶(CAT)活性检测试剂盒、过氧化物酶(peroxidase, POD)活性检测试剂盒测定试虫抗氧化酶活性的变化[26 − 27]。
-
按照1.6方法处理试虫,采用丙二醛(MDA)含量检测试剂盒测定试虫MDA含量变化。
-
按照1.6方法处理试虫,采用乙酰胆碱酯酶活性检测试剂盒测定试虫乙酰胆碱酯酶的活性变化。
-
按照Abbott公式计算校正死亡率,计算公式如下:
$$ \mathrm{死}\mathrm{亡}\mathrm{率}(\text{%})=\frac{\mathrm{处}\mathrm{理}\mathrm{前}\mathrm{活}\mathrm{虫}\mathrm{数}-\mathrm{处}\mathrm{理}\mathrm{后}\mathrm{活}\mathrm{虫}\mathrm{数}}{\mathrm{处}\mathrm{理}\mathrm{前}\mathrm{活}\mathrm{虫}\mathrm{数}}\times 100 $$ (1) $$\mathrm{校}\mathrm{正}\mathrm{死}\mathrm{亡}\mathrm{率}(\text{%}) = \frac{\mathrm{处}\mathrm{理}\mathrm{组}\mathrm{死}\mathrm{亡}\mathrm{率} - \mathrm{对}\mathrm{照}\mathrm{组}\mathrm{死}\mathrm{亡}\mathrm{率}}{100-\mathrm{对}\mathrm{照}\mathrm{组}\mathrm{死}\mathrm{亡}\mathrm{率}}\times 100 $$ (2) 使用Excel 2010软件计算回归方程;使用SPSS 16.0进行LSD差异显著性分析(P>0.05)。所有实验数据均有3次独立重复,结果以平均值±标准差(Mean ± SEM)表示。
-
毒力测定结果表明(表1),经紫外线处理后供试药剂均表现出一定的致死效果,其中9-苯基吖啶毒力最强,效果最为明显,LC50仅为0.717 mg·L−1;其次9-氯吖啶、9,10-二氢吖啶、9-甲基吖啶也具有较好的杀蚊幼活性,LC50小于4 mg·L−1;吖啶酮效果最差,LC50大于600 mg·L−1。同时,在黑暗的平行处理中,药剂处理均没有出现死亡的幼虫。
表 1 供试药剂对埃及伊蚊四龄幼虫的毒力作用
Table 1. Virulence of the compounds to the larvae of Aedes aegypti
化合物
Compound毒力回归方程
Regression equationR2 LC50/(mg·L−1) 95%置信区间/(mg·L−1)
95% confidence interval/(mg·L−1)9-苯基吖啶 y = 5.5457 +3.7768 x0.9613 0.717 0.592~0.816 9-氯吖啶 y = 1.9814 +5.8382 x0.9905 3.235 2.961~3.503 9,10-二氢吖啶 y = 1.186 + 7.7985 x0.9546 3.104 2.823~3.334 9-甲基吖啶 y = 1.3004 +6.3832 x0.9497 3.775 3.441~4.123 9-氨基吖啶 y = − 8.4443 +7.3738 x0.9777 66.993 60.735~68.794 吖啶酮 y = −76.212 + 28.891x 0.9746 646.754 634.731~659.075 -
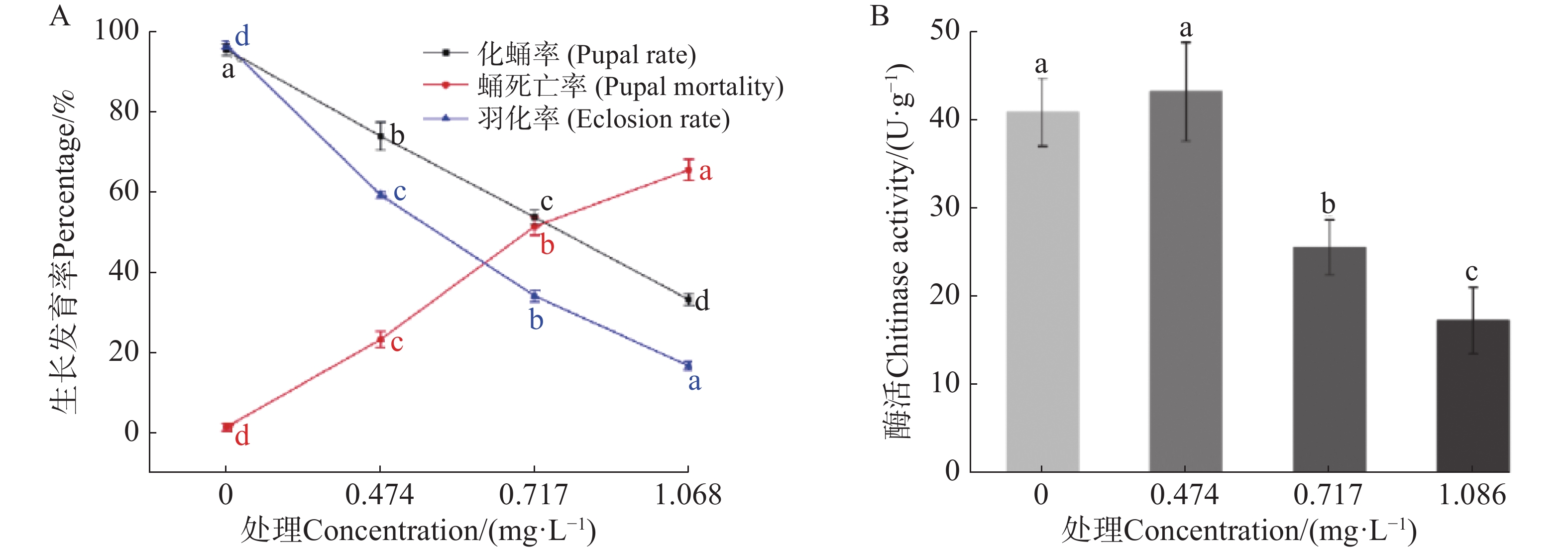
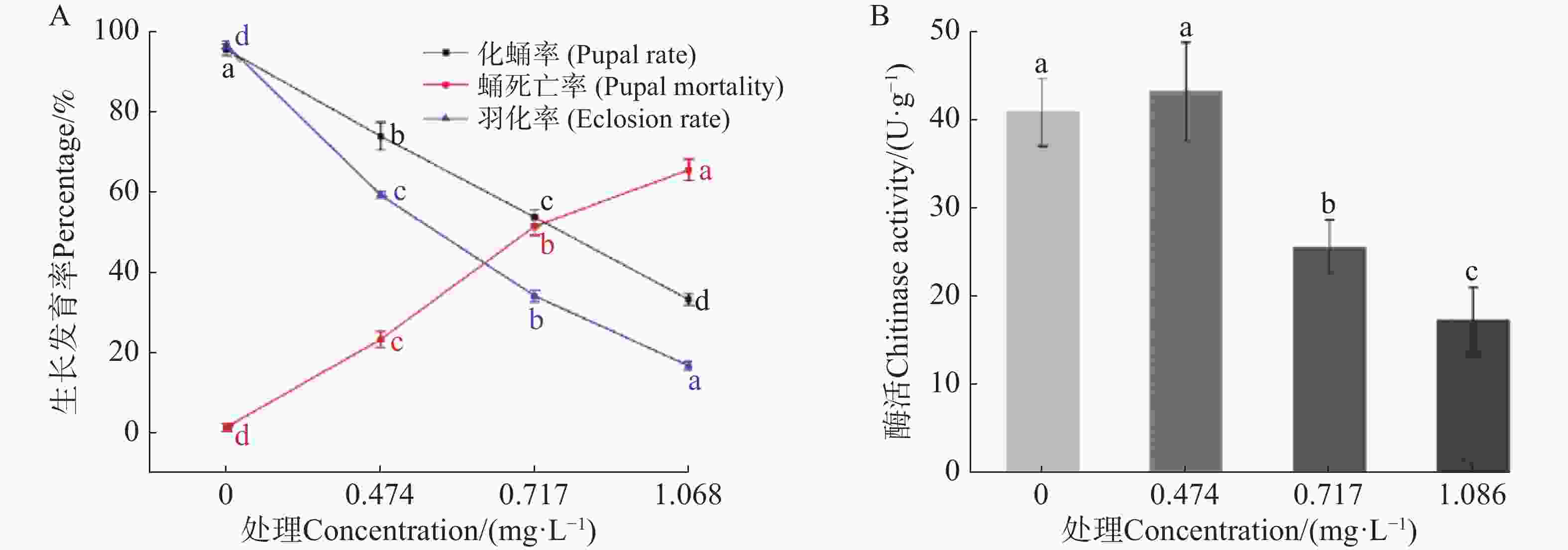
由毒力测定发现9-苯基吖啶对埃及伊蚊四龄幼虫的毒力最强,进一步测定该药剂LC25(0.474 mg·L−1)、LC50(0.717 mg·L−1)、LC75(1.086 mg·L−1)质量浓度处理对埃及伊蚊幼虫生长发育的影响,结果如图1。由图1−A可知,在9-苯基吖啶的影响下伊蚊幼虫化蛹率和羽化率与对照相比均显著降低,而蛹的死亡率与对照相比则显著升高,同时均具有质量浓度依赖性;在LC25、LC50、LC75处理下,化蛹率分别为73.80%、53.60%、33.10%,羽化率分别为59.13%、34.00%、16.60%,而蛹的死亡率则为23.17%、51.33%、65.43%。可见9-苯基吖啶能够显著抑制埃及伊蚊幼虫后续的生长发育。
-
测定9-苯基吖啶对于埃及伊蚊幼虫几丁质酶的活性的影响,结果如图1−B所示;由图1−B可知,在较低浓度下幼蚊几丁质酶活并没有显著变化,而随着浓度的提升,酶活受到了显著的抑制效果,并且具有浓度依赖性,说明9-苯基吖啶可能通过影响几丁质酶的活性来抑制埃及伊蚊幼虫后续的生长发育。
-
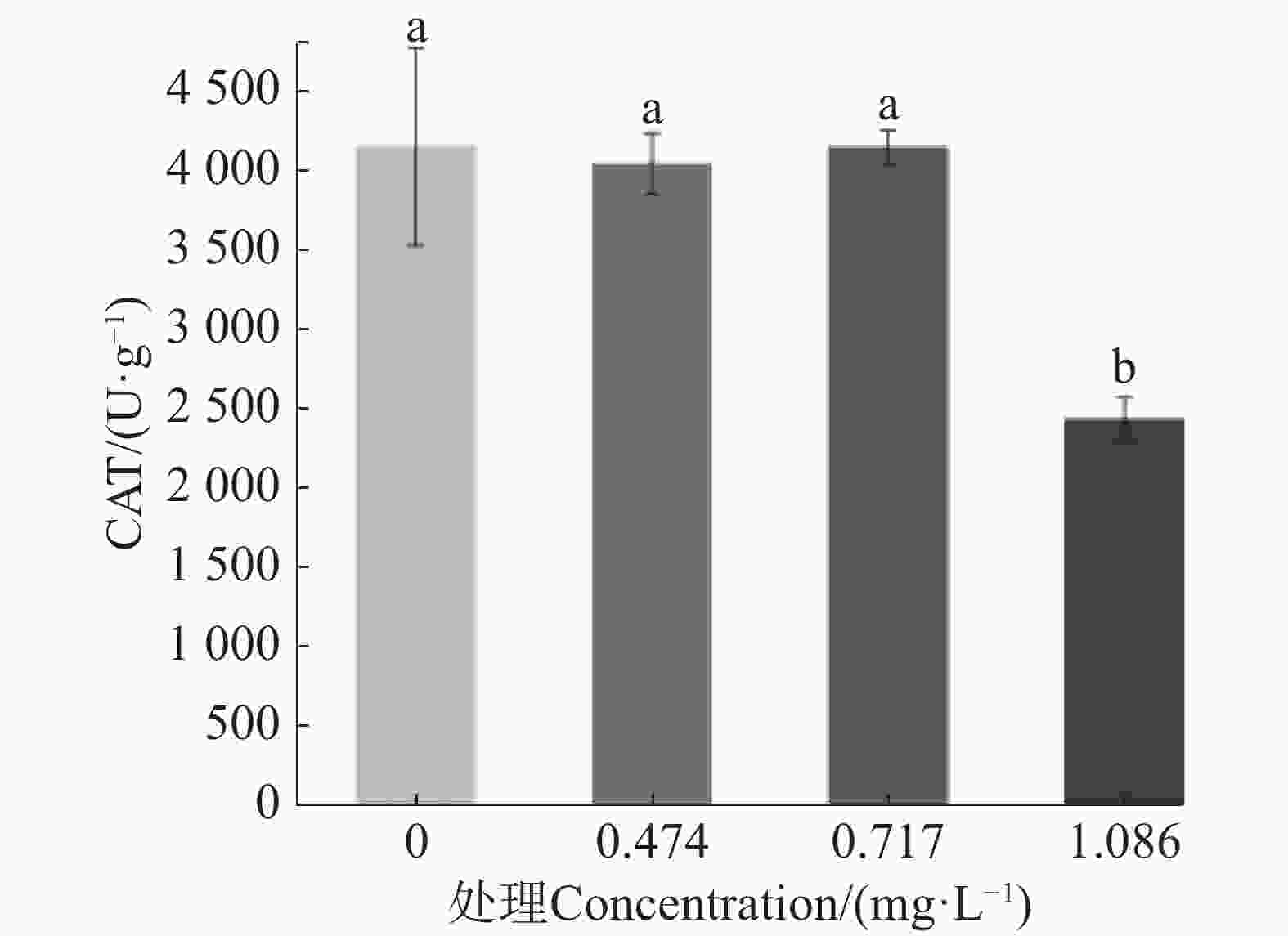
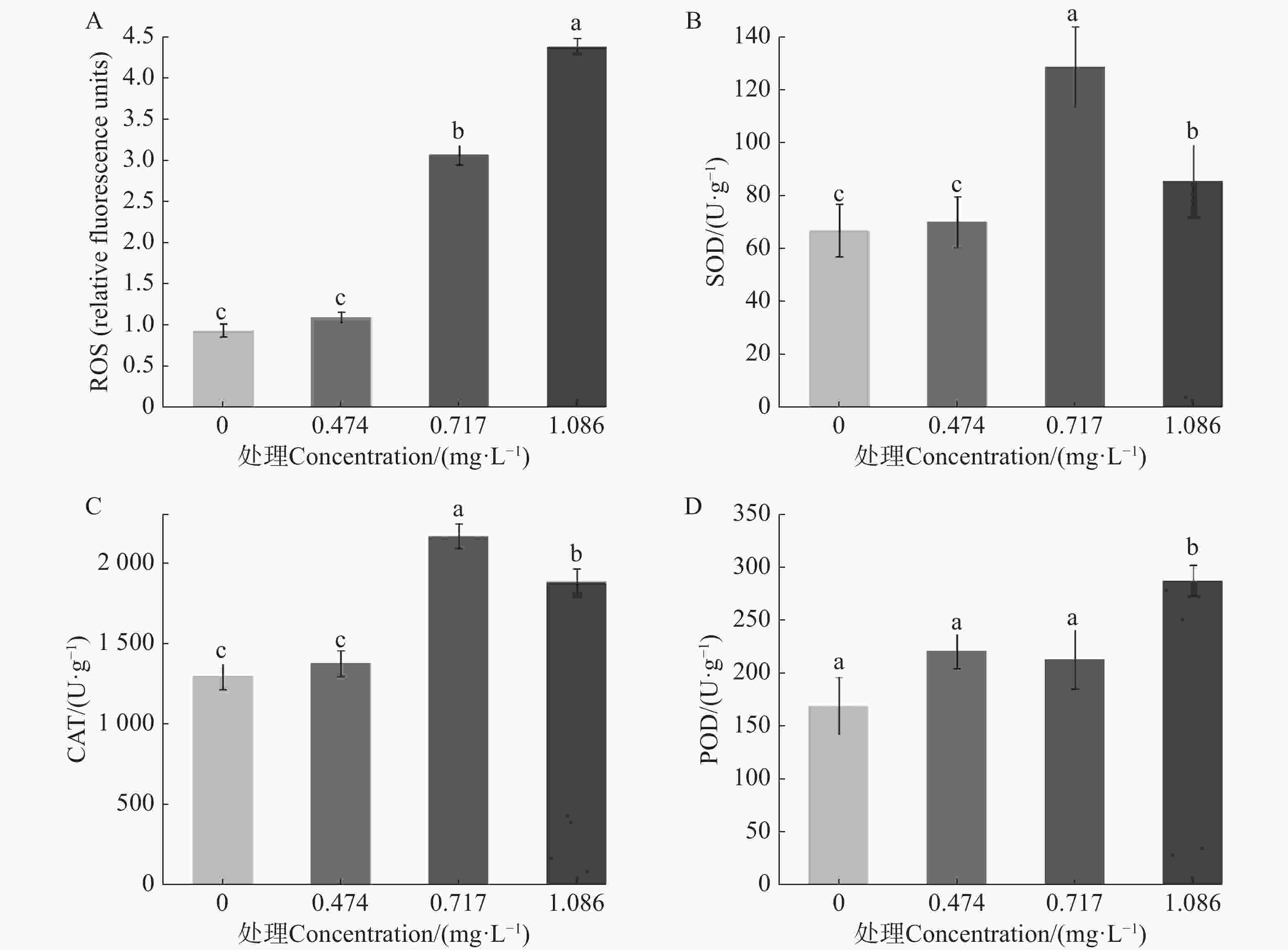
测定9-苯基吖啶对埃及伊蚊幼虫ROS、SOD酶、CAT酶及POD酶的影响,结果如图2所示。在LC25药剂处理下,埃及伊蚊幼虫体内活性氧与对照相比无显著差异,但随着质量浓度升高,在LC50、LC70药剂处理下,埃及伊蚊幼虫体内产生了大量的活性氧,并且活性氧相对含量随着处理药剂的质量浓度升高而升高(图2−A)。同时,在LC25药剂处理下,埃及伊蚊幼虫体内SOD酶、CAT酶活性与对照相比也没有表现出明显的差异;而随着处理质量浓度升高,试虫体内SOD酶、CAT酶活性均表现出先升高后降低的趋势,但总体水平均显著高于对照(图2−B、C);同时,在LC25、LC50质量浓度药剂处理下试虫体内POD酶活性有所提升但是并不显著,而当药物质量浓度达到LC75时酶活性显著提高。推测在药物处理的作用下,细胞内活性氧大量积累,进而导致与活性氧清除有关的SOD酶、CAT酶和POD酶活性提升,但是随着药物质量浓度的提升,过量的活性氧引起细胞氧化损伤,从而导致SOD酶、CAT酶活性降低。
-
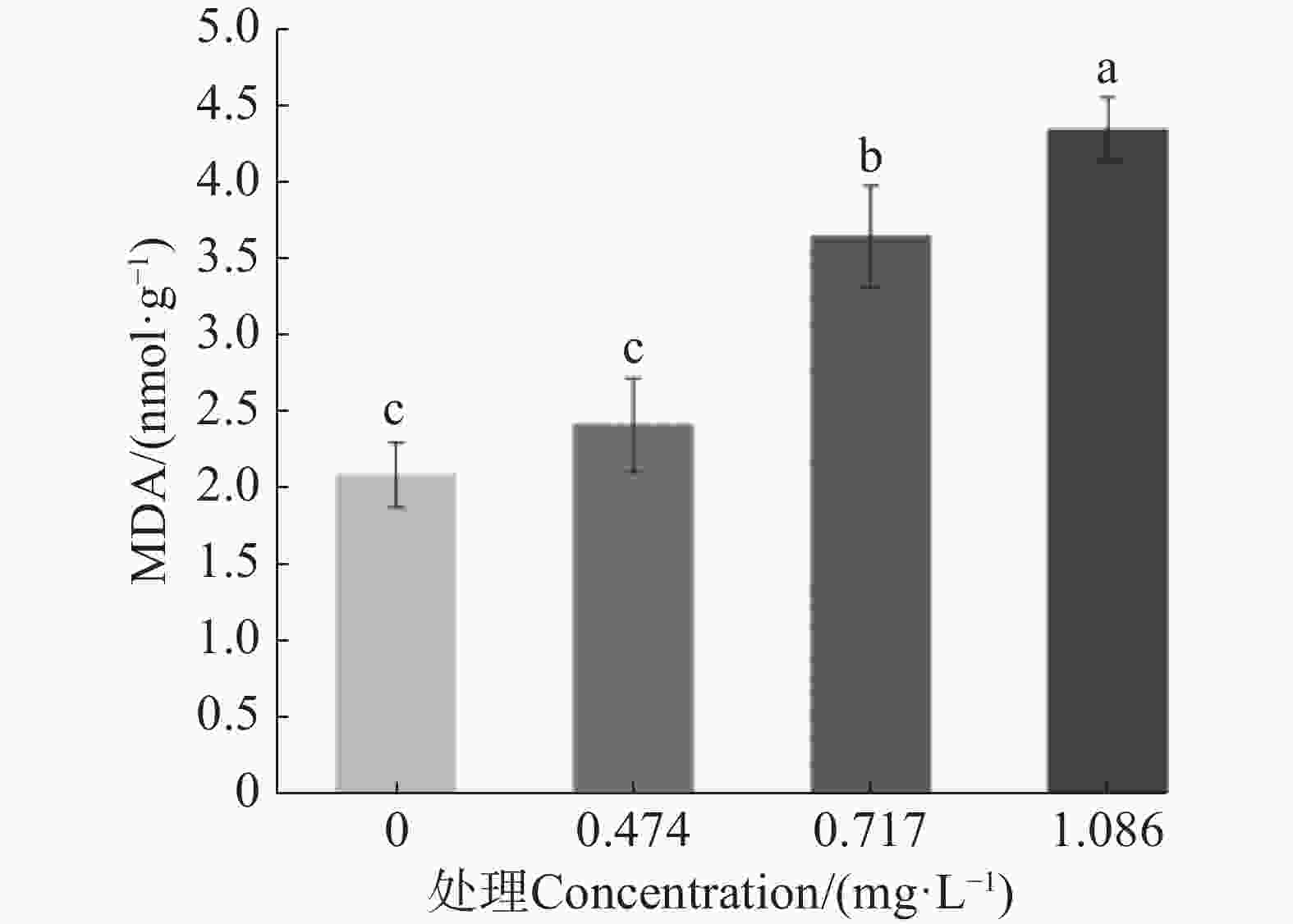
测定了经9-苯基吖啶处理后MDA含量的变化,结果如图3所示。在LC25质量浓度下,蚊幼体内MDA含量与对照没有明显差异;然而随着药物浓度提升,MDA含量也随之逐渐升高,并显著高于对照。这是由于随着药物质量浓度的提升,细胞内活性氧积累,SOD酶和CAT酶不能够及时清除大量的活性氧,过量的活性氧引发脂质过氧化增加,MDA含量因此提升。
-
在较高浓度的9-苯基吖啶处理下,幼虫出现了抽搐或不活跃的症状,因此推断其具有一定的神经毒性。测定了9-苯基吖啶对于乙酰胆碱酯酶活性的影响,结果如图4所示,可以发现,在LC75的质量浓度下,9-苯基吖啶显著抑制了乙酰胆碱酯酶的活性。
-
光活化药剂在可见光或近紫外光照射下可产生活性氧基团,从而对机体细胞造成氧化损伤[28 - 29]。对于本研究测定的吖啶衍生物杀幼蚊活性可知,在黑暗下各药剂对埃及伊蚊四龄幼虫均无活性,但经紫外线照射后,活性明显增强,因此表明供试化合物均为光活化药剂。但不同药剂之间,杀幼蚊活性差别较大,其中9-苯基吖啶的LC50为0.717 mg·L−1,而吖啶酮的LC50为646.754 mg·L−1。分析吖啶酮活性不高的原因可能是该化合物本身对幼蚊毒性不高,也可能是该化合物光激活需要波长较强、能力更高的光线[30]。
通过幼虫氧化应激活性测定结果表明,LC50质量浓度9-苯基吖啶处理与对照相比体内产生了大量的活性氧,SOD酶和CAT酶活性明显增加。这可能是因为9-苯基吖啶在紫外线下发生光敏化氧化后与靶标分子生成了超氧阴离子自由基(O2−),所以SOD酶活性随之提升,将O2−催化成过氧化氢、过氧化物和氧气,然后CAT酶活性也显著提高将过氧化氢催化成水和氧气,POD酶活性也开始提高将过氧化物还原为无毒物质。然而,随着药物质量浓度的提升,O2−和过氧化氢等活性氧化合物超出细胞的负荷,不能及时得到清除,进而对幼虫造成不可逆的破坏,SOD酶、CAT酶等酶受到损伤因而活性受到抑制。同时,过量的活性氧引发脂质过氧化增加,生成大量的MDA,这也是药物处理后MDA含量显著提高的原因。
对药剂处理后的试虫进行持续观察发现,与对照相比埃及伊蚊化蛹率和羽化率均显著降低,而蛹的死亡率显著升高,并且均具有质量浓度依赖性。蜕皮是昆虫的生长发育进程必不可少的生理活动,特别是其化蛹、羽化发育进程,几丁质酶是调节昆虫蜕皮过程的关键酶,部分吖啶类衍生物表现出一定的几丁质酶抑制活性[22],本研究发现,供试的化合物9-苯基吖啶确实可以显著影响几丁质酶活性,证实了这一结论。另外,在LC50质量浓度处理下,幼蚊会出现抽搐的症状,经测定AchE得到了显著的抑制。因此,根据本研究获得数据推断,9-苯基吖啶通过产生ROS对于机体造成损伤表现出杀虫活性,过量的活性氧对于几丁质酶活性产生明显抑制,使得试虫不能正常化蛹、羽化;AchE活性也受到明显抑制,使得幼虫处于过度兴奋的状态。
-
本研究测定了黑暗和紫外照射下6种吖啶衍生物的杀幼蚊活性,结果为黑暗条件下供试化合物无活性,经紫外照射后化合物活性显著增高,其中9-苯基吖啶活性最高;9-苯基吖啶苯环上的π键进一步增大了分子的共轭体系,活性更为显著。进一步探究9-苯基吖啶作用机制发现,该化合物可以诱导幼蚊产生ROS,引起试虫体内SOD、CAT酶活性呈现先升高后降低的趋势、POD酶活性提升并诱发脂质过氧化,影响试虫生长发育,抑制几丁质酶活性,并且在LC70下还能够抑制AchE的活性,引起试虫兴奋。这些结果表明,9-苯基吖啶能够通过诱导细胞产生活性氧对机体正常的生理功能造成损伤,从而表现出杀虫活性。同时,吖啶化合物在哺乳动物体内经氧化后与葡萄糖醛酸等形成结合物排出体外[31]。综上所述,9-苯基吖啶表现出多靶点、高活性的特点,因此具有开发成光活化杀虫剂的潜力。
9-苯基吖啶对埃及伊蚊的杀虫活性及作用机制初探
DOI: 10.15886/j.cnki.rdswxb.20240172
 CSTR: 32425.14.j.cnki.rdswxb.20240172
CSTR: 32425.14.j.cnki.rdswxb.20240172
The insecticidal activity and mechanism of 9-Phenylacridine on Aedes aegypti
-
摘要: 光活化药剂能够在可见光或近紫外光照射下吸收光子能量转变为激发态,产生活性氧,从而对机体细胞造成氧化损伤,引发生物膜和细胞器结构与功能的破坏。由于该类药剂的优良特性包括不易产生抗性、易自然降解等,其在医药领域、农药领域均具有广泛的研究价值。本研究以埃及伊蚊为供试靶标生物,测定9-苯基吖啶等6种吖啶衍生物的杀幼蚊活性,并对高活性化合物作用机制进行初探。结果表明,供试化合物均为光敏性化合物,经紫外照射后化合物杀虫活性均显著升高,其中,9-苯基吖啶活性最高,LC50为0.717 mg·L−1,且均可使埃及伊蚊化蛹率和羽化率显著降低,蛹死亡率显著升高,同时显著抑制几丁质酶活性。试虫体内活性氧(reactive oxygen species, ROS)水平显著上升,超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT)活性呈现先升高后降低的趋势,过氧化物酶(peroxidase, POD)酶活性提高,LC75质量浓度的药剂处理能够抑制乙酰胆碱酯酶(acetylcholinesterase, AchE)的活性。为此,推测9-苯基吖啶通过诱导试虫机体产生ROS,造成机体氧化损伤从而发挥杀虫活性,其具有开发光活化杀幼蚊药虫剂的潜力。Abstract: In order to develop insecticides with photoactivation activity, Aedes aegypti was used as the target organism to determine the insecticidal activity of 6 acridine derivatives and explore the activity mechanism of the highly active compound. The results showed that all the tested compounds were photosensitive and had no insecticidal activity under dark conditions. The insecticidal activity of all compounds increased significantly after UV irradiation, among which 9-phenylacridine had the highest activity (LC50 = 0.717 mg·L−1). At the concentrations of LC50 and LC75, the 9-phenylacridine could significantly reduce the pupation rate and emergence rate and increase the mortality rate of pupae while inhibit chitinase activity; the ROS level was increased in the tested insects; the activities of SOD and CAT showed a trend of increasing first and then decreasing; the activity of POD increased. What’s more the AchE activity was inhibited by 9-phenylacridine with LC75 concentration. It is speculated that 9-phenylacridine can induce the organism to produce ROS and cause oxidative damage to the organism, thus exerting insecticidal activity. It is concluded that 9-phenylacridine has the potential to be developed into photoactivated insecticide.
-
Key words:
- acridine derivatives /
- Aedes aegypti /
- photoactivation /
- oxidative stress
-
图 2 9-苯基吖啶对埃及伊蚊幼虫氧化应激的影响
A. 不同质量浓度的药物对于蚊幼ROS相对含量的影响。数据已标准化至对照组(设为1);B. 不同质量浓度的药物对于蚊幼SOD酶活性的影响;C. 不同质量浓度的药物对于蚊幼CAT酶活性的影响;D. 不同质量浓度的药物对于蚊幼POD酶活性的影响;不同小写字母表示不同处理数据间在P<0.05水平存在显著性差异。
Fig. 2 Effect of 9-phenylacridine on oxidative stress in Aedes aegypti larvae
A. Effects of different concentrations of 9-phenylacridine on the relative content of ROS in Aedes aegypti larvae. Date normalized to the control group(set as 1); B. Effects of different concentrations of 9-phenylacridine on SOD enzyme activity of Aedes aegypti larvae; C. Effects of different concentrations of 9-phenylacridine on CAT enzyme activity of Aedes aegypti larvae; D. Effects of different concentrations of 9-phenylacridine on POD enzyme activity of Aedes aegypti larvae. The values followed by different letters on the bars were significantly different (P<0.05).
表 1 供试药剂对埃及伊蚊四龄幼虫的毒力作用
Table 1 Virulence of the compounds to the larvae of Aedes aegypti
化合物
Compound毒力回归方程
Regression equationR2 LC50/(mg·L−1) 95%置信区间/(mg·L−1)
95% confidence interval/(mg·L−1)9-苯基吖啶 y = 5.5457 +3.7768 x0.9613 0.717 0.592~0.816 9-氯吖啶 y = 1.9814 +5.8382 x0.9905 3.235 2.961~3.503 9,10-二氢吖啶 y = 1.186 + 7.7985 x0.9546 3.104 2.823~3.334 9-甲基吖啶 y = 1.3004 +6.3832 x0.9497 3.775 3.441~4.123 9-氨基吖啶 y = − 8.4443 +7.3738 x0.9777 66.993 60.735~68.794 吖啶酮 y = −76.212 + 28.891x 0.9746 646.754 634.731~659.075 -
[1] 赵明惠. 海南岛及雷州半岛埃及伊蚊和白纹伊蚊种群遗传特征和宏病毒组研究[D]. 北京: 军事科学院, 2023. doi: 10.27193/d.cnki.gjsky.2023.000164 [2] 高强, 冷培恩. 登革热防控的现状与展望[J]. 中国热带医学, 2024, 24(1): 40 − 48. doi: 10.13604/j.cnki.46-1064/r.2024.01.08 [3] 刘鲁宏. 论登革热的传播模式、蚊媒及防控[J]. 临床医药文献电子杂志, 2018, 5(13): 188 − 189. doi: 10.16281/j.cnki.jocml.2018.13.155 [4] 兰学梅, 魏春, 朱进, 等. 中国–老挝登革热重点地区埃及伊蚊孳生习性及杀虫剂抗性水平比较研究[J]. 中国媒介生物学及控制杂志, 2023, 34(2): 238 − 243. doi: 10.11853/j.issn.1003.8280.2023.02.016 [5] 李雅姝, 唐建霞, 朱国鼎. 蚊虫杀虫剂代谢抗性研究进展[J]. 中国热带医学, 2021, 21(4): 375 − 379. doi: 10.13604/j.cnki.46-1064/r.2021.04.15 [6] 张腾云, 徐文, 张鸣姗, 等. 超高效液相色谱–串联质谱法检测东寨港海水中磺胺类药物残留[J]. 热带生物学报, 2019, 10(2): 197 − 203. doi: 10.15886/j.cnki.rdswxb.2019.02.016 [7] 张筑宏, 吴接呈, 骆焱平. 光活化农药作用机理的研究进展[J]. 武汉工程大学学报, 2020, 42(1): 18 − 27. doi: 10.19843/j.cnki.CN42-1779/TQ.201908007 [8] 杨静, 廖美德. 光活化农药的研究进展[J]. 现代农药, 2014, 13(3): 11 − 16. doi: 10.3969/j.issn.1671-5284.2014.03.003 [9] ZHANG W J, LV Y X, HUO F J, et al. Photoactivation inducing multifunctional coupling of fluorophore for efficient tumor therapy in situ[J]. Advanced Materials, 2024, 36(23): 2314021. doi: 10.1002/adma.202314021 [10] NOVOHRADSKY V, MARKOVA L, KOSTRHUNOVA H, et al. A cyclometalated IrIII complex conjugated to a coumarin derivative is a potent photodynamic agent against prostate differentiated and tumorigenic cancer stem cells[J]. Chemistry: A European Journal, 2021, 27(33): 8547 − 8556. doi: 10.1002/chem.202100568 [11] OLIVEIRA H, ARAÚJO P, PEREIRA A R, et al. Photoactivated cell-killing amino-based flavylium compounds[J]. Scientific Reports, 2021, 11(1): 22005. doi: 10.1038/s41598-021-01485-y [12] TIAN Y, WANG L, QIAN Y Y, et al. DNA-Targeting bioactive photosensitizer for chemo-photodynamic therapy of malignant tumor[J]. ACS Materials Letters, 2024, 6(3): 969 − 975. doi: 10.1021/acsmaterialslett.3c01511 [13] BEN AMOR T, JORI G. Sunlight-activated insecticides: historical background and mechanisms of phototoxic activity[J]. Insect Biochemistry and Molecular Biology, 2000, 30(10): 915 − 925. doi: 10.1016/S0965-1748(00)00072-2 [14] BRAGA G Ú L, SILVA-JUNIOR G J, BRANCINI G T P, et al. Photoantimicrobials in agriculture[J]. Journal of Photochemistry and Photobiology B: Biology, 2022, 235: 112548. doi: 10.1016/j.jphotobiol.2022.112548 [15] GONG Z X, YU T Z, CAI Z, et al. UV/esterase dual responsive nanosystems based on protoporphyrin IX-polyethylene glycol monomethyl ether for enhanced photodynamic bactericidal and herbicidal effects[J]. European Polymer Journal, 2024, 215: 113213. doi: 10.1016/j.eurpolymj.2024.113213 [16] XU Q, FENG H, SHAO X S. Light-induced activities of novel Naphtho[1, 8-ef]isoindole-7, 8, 10(9H)-trione and oxoisoaporphine derivatives towards mosquito larvae[J]. Bioorganic & Medicinal Chemistry Letters, 2021, 15(48): 128225. doi: 10.1016/j.bmcl.2021.128225 [17] WU J C, WANG L Y, ZHANG Y F, et al. Synthesis and Photoactivated toxicity of 2-Thiophenylfuranocoumarin induce midgut damage and apoptosis in Aedes aegypti larvae[J]. Journal of Agricultural and Food Chemistry, 2021, 69(3): 1091 − 1106. doi: 10.1021/acs.jafc.0c07237 [18] FABRIS C, OUÉDRAOGO R K, COPPELLOTTI O, et al. Efficacy of sunlight-activatable porphyrin formulates on larvae of Anopheles gambiae M and S molecular forms and An. arabiensis: a potential novel biolarvicide for integrated malaria vector control[J]. Acta Tropica, 2012, 123(3): 239 − 243. doi: 10.1016/j.actatropica.2012.05.011 [19] SINGH D K, SINGH D J. Photoactivated chlorophyllin and acetylcholinesterase/cytochrome oxidase activity in Fasciola gigantica cercaria larvae[J]. Pharmacognosy Journal, 2018, 10(4): 768 − 772. doi: 10.5530/pj.2018.4.129 [20] KOZURKOVA M, SABOLOVA D, KRISTIAN P. A new look at 9-substituted acridines with various biological activities[J]. Journal of Applied Toxicology, 2021, 41(1): 175 − 189. doi: 10.1002/jat.4072 [21] XIAO X, GAO Q, WANG L Y, et al. Photoactivated 9-methylacridine destroys midgut tissues of Aedes aegypti larvae by targeting ROS-mediated apoptosis in the mitochondrial pathway of midgut cells[J]. Journal of Photochemistry and Photobiology B: Biology, 2024, 254: 112893. doi: 10.1016/j.jphotobiol.2024.112893 [22] DE OLIVEIRA VIANA J, SOUZA E S, SBARAINI N, et al. Scaffold repositioning of Spiro-acridine derivatives as fungi Chitinase inhibitor by target fishing and in vitro studies[J]. Scientific Reports, 2023, 13(1): 7320. doi: 10.1038/s41598-023-33279-9 [23] 王丕玉, 董利民, 吴超, 等. 云南省埃及伊蚊实验室种群的建立[J]. 医学动物防制, 2006, 22(10): 735 − 736. doi: 10.3969/j.issn.1003-6245.2006.10.015 [24] 余森泉, 董存柱, 苏绿, 等. 16种含马兜铃内酰胺衍生物类中药甲醇提取物对家蝇和埃及伊蚊活性筛选[J]. 热带作物学报, 2019, 40(5): 1002 − 1007. doi: 10.3969/j.issn.1000-2561.2019.05.024 [25] 吴岳捷. 槟榔碱对埃及伊蚊跨代发育毒性分析及对其几丁质酶的抑制作用研究[D]. 海口: 海南大学, 2023. doi: 10.27073/d.cnki.ghadu.2023.000576 [26] 李迅, 刘彤霄, 李隆琦, 等. 薄荷醇对果蝇产卵驱避作用及毒杀效果[J]. 昆虫学报, 2024, 67(7): 964 − 975. doi: 10.16380/j.kcxb.2024.07.007 [27] 徐成滨, 王宇心, 孔伟浩, 等. 溴氰虫酰胺对羊角月牙藻的急性毒性效应[J]. 热带生物学报, 2019, 10(2): 135 − 139. doi: 10.15886/j.cnki.rdswxb.2019.02.006 [28] MASSIOT J, ROSILIO V, MAKKY A. Photo-triggerable liposomal drug delivery systems: from simple porphyrin insertion in the lipid bilayer towards supramolecular assemblies of lipid-porphyrin conjugates[J]. Journal of Materials Chemistry B, 2019, 7(11): 1805 − 1823. doi: 10.1039/C9TB00015A [29] DICHIARA M, PREZZAVENTO O, MARRAZZO A, et al. Recent advances in drug discovery of phototherapeutic non-porphyrinic anticancer agents[J]. European Journal of Medicinal Chemistry, 2017, 142: 459 − 485. doi: 10.1016/j.ejmech.2017.08.070 [30] 徐汉虹, 田永清. 光活化农药[M]. 北京: 化学工业出版社, 2008: 163. [31] 何绍雄, 王殿英, 史桂兰, 等. 9-(对甲苯胺基)吖啶的代谢研究[J]. 中国药学杂志, 1982, 17(4): 56. -




 下载:
下载: