-
木薯(Manihot esculenta Crantz)是大戟科木薯属植物。木薯、马铃薯(Solanum tuberosum L.)和红薯(Ipomoea batatas L.)并称为世界三大薯类作物,其块根富含淀粉,是热带地区重要的粮食作物和能源作物[1]。在中国,木薯种植主要分布在华南地区,其广泛应用于乙醇生产、淀粉生产、其他加工工业原料生产、饲用和食用等领域[2]。当前随着木薯产业的蓬勃发展和大量需求,为提高木薯产量而过度使用化肥严重地危害了土壤和环境的生态平衡,因此迫切需要绿色环保的有益微生物菌肥来减少化肥的使用量[3]。
有益微生物菌肥在改善土壤理化性质、促进作物生长和改善作物品质、提高作物抗逆性和抗病性等方面均具有重要作用[4]。在促进植物生长方面,通过激活植物养分吸收利用基因的表达来促进植物对养分的吸收是有益微生物菌肥的重要促生原因之一。如接种假单胞菌(Pseudomonas nitroreducens)IHBB13561后,拟南芥(Arabidopsis thaliana)和莴苣(Lactuca sativa L.)根中硝态氮转运蛋白基因NRT2.1、NRT2.2、NTR2.6表达量显著上升,提高了拟南芥和莴苣的叶绿素含量、氮含量及生物量[5]。接种芽孢杆菌Bacillus pumilus INR-7、Bacillus subtilis IN937a和Bacillus safensis T4后,通过激活拟南芥根中的硝酸盐转运蛋白基因AtNRT1、AtNTR1.2、AtNRT2.3和铵转运蛋白基因AtAMT1.2、AtAMT1.3、AtAMT1.5的表达来增强了氮的吸收,提高了拟南芥幼苗的含氮量以及叶绿素含量和生物量[6]。接种芽孢杆菌(Bacillus subtilis) BsL1后,拟南芥硝态氮转运蛋白基因AtNRT2.1、AtNRT2.2、AtNRT2.5和AtNRT2.6的表达量较未接种显著上升,同时硝酸还原酶活性显著上升,提高了拟南芥的含氮量,促进了拟南芥和莴苣的生长[7]。Pii等[8]发现,施用Azospirillum brasilense Cd菌后,显著增强了玉米(Zea mays L.)根中硝态氮转运蛋白基因ZmNRT2.2及铵转运蛋白基因ZmAMT1.1的表达,增强玉米对氮的吸收,同时发现玉米根中ZmGOGAT蛋白基因表达量升高,增强了氮的同化利用,从而提高了玉米产量。接种芽孢杆菌(Bacillus velezensis) SQR9后,通过诱导拟南芥和水稻根中硝态氮及铵转运蛋白基因AtNRT2.1、 AtNRT2.2、AtAMT1.2、AtAMT1.3、OsNAR2.1、OsNRT2.3和OsAMT1的表达,增强了对氮的吸收,提高了根中的氮含量,促进了拟南芥和水稻(Oryza sativa L.)的生长[9]。接种芽孢杆菌BS03后,通过提高了叶绿素含量及光合能力及含氮量,显著提高了柑橘(Citrus reticulata)的产量[10]。在木薯中发现,接种丛枝菌根真菌异形根孢囊霉DAOM197198能够显著增强木薯根中5个铵转运蛋白基因和11个硝态氮转运蛋白基因的表达,从而提高木薯的株高和根长[11]。
灰黄青霉(Penicillium griseofulvum) CF3是一株对多种作物具有促生防病效果的生防真菌。申光辉等[12]研究发现,灰黄青霉CF3的无菌发酵滤液对草莓(Fragaria × ananassa(Weston)Duchesne ex Rozier)根腐病的致病病原真菌有较强的拮抗作用,且稀释后的无菌发酵滤液能促进甜瓜种子的萌发和生长。陈杰等[13]研究发现,灰黄青霉CF3菌剂能促进马铃薯生长,防治多种马铃薯常见的土传病原真菌。谌昕伟等[14]研究发现,灰黄青霉CF3在木薯促生和对木薯细菌性枯萎病具有良好的生物防治效果,但其促生机理尚不清楚。
本研究在课题组前期研究基础上,采用盆栽试验方法,通过研究木薯叶片光合色素含量、光合速率指标、木薯根和叶片的养分含量、氮吸收转运同化等相关基因表达等指标,从植物营养出发,进一步阐释灰黄青霉CF3促进木薯生长的机理,为其推广应用提供理论基础。
-
灰黄青霉 (P. griseofulvum) CF3,由实验室保存提供。‘华南9号’(SC9)木薯,由海南大学儋州校区本课题组实验基地提供。
-
将红土与营养土按照质量比为3∶1的比例拌匀后,装入高16.4 cm,底部直径12.8 cm,盆口直径17.5 cm的花盆中,每盆装土1.5 kg。试验分为对照组CK和处理组CF3,各10盆重复。对照组不添加灰黄青霉CF3,试验组每盆添加4.5 g灰黄青霉CF3孢子粉(CF3孢子数为2.75×109 cfu·g−1),与土壤混合搅拌均匀。随后将木薯剪成15 cm长的种茎,插入上述准备好的盆钵土里面,地上部分露出2个芽点。待木薯生长30 d后,测定相关指标。
-
取生长30 d的木薯倒三叶,各处理分别选取5片叶片,用体积分数95%(v/v)的乙醇浸提叶绿素,使用Biotek公司生产的Synergy H1全波长分光光度计在波长665、649和470 nm下测吸光度值,进行光合色素含量的计算。
-
在晴朗天气上午九点半到十一点半,使用CIRAS‐3便携式光合测定仪器(汉莎科学仪器有限公司)对生长30 d的木薯倒三叶进行净光合速率 (Assimilation Rate,A)、蒸腾速率(Transpiration rate,E)、气孔导度(Stomatal conductance,Gs)和水分利用效率(Water use efficiency,WUE)的测定。
-
木薯根和叶片烘干后,称取0.5 g,采用浓硫酸消煮后加入过氧化氢氧化,同时制作标准曲线,使用德国布朗卢比公司生产的SEAL Auto Analyzer 3型连续流动分析仪进行全氮测定。土壤样品风干后,过100目筛,称取0.5 g加入浓硫酸消煮,以硝普钠作为催化剂,加入水杨酸钠和次氯酸钠反应生成蓝色化合物,使用AA3型连续流动分析仪在660 nm波长处测定其吸收值。
-
取30 d大小的木薯根系,3个独立重复,清水洗掉土壤,液氮速冻,送北京诺禾致源公司进行转录组测序,测序仪为Illunina NovaSeq
6000 ,原始数据过滤后采用DEGseq2分析方法计算基因表达量FPKM值,根据基因表达量FPKM值作图。 -
用Excel软件录入数据;利用Prism软件作图,数据来源于3个生物学重复,误差棒为其平均值±标准差;采用SPSS的t-检验法对两组数据进行显著性分析,其中ns表示P>0.05,*表示P<0.05,**表示P<0.01,***表示P<0.001,****表示P<
0.0001 。 -
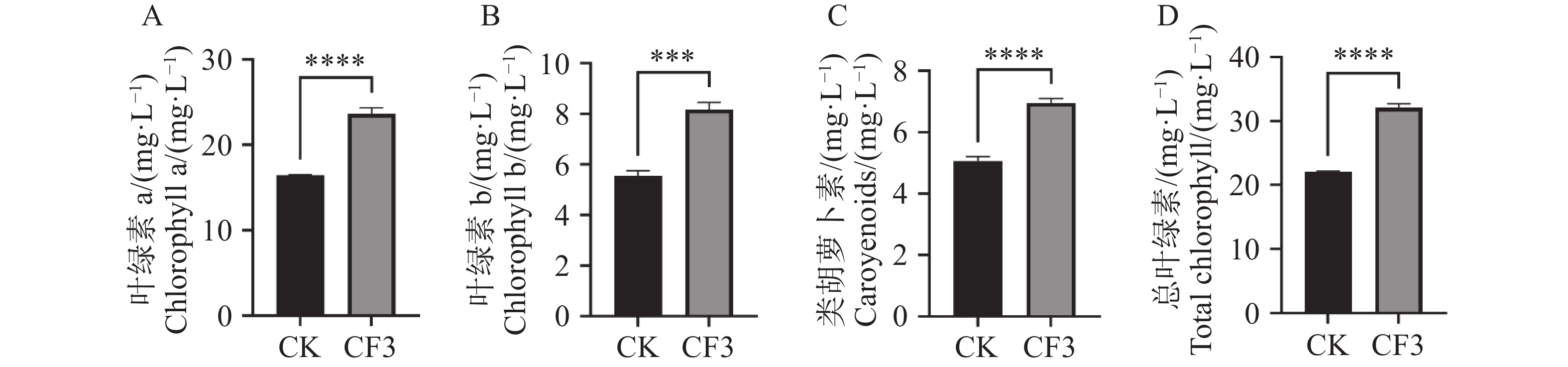
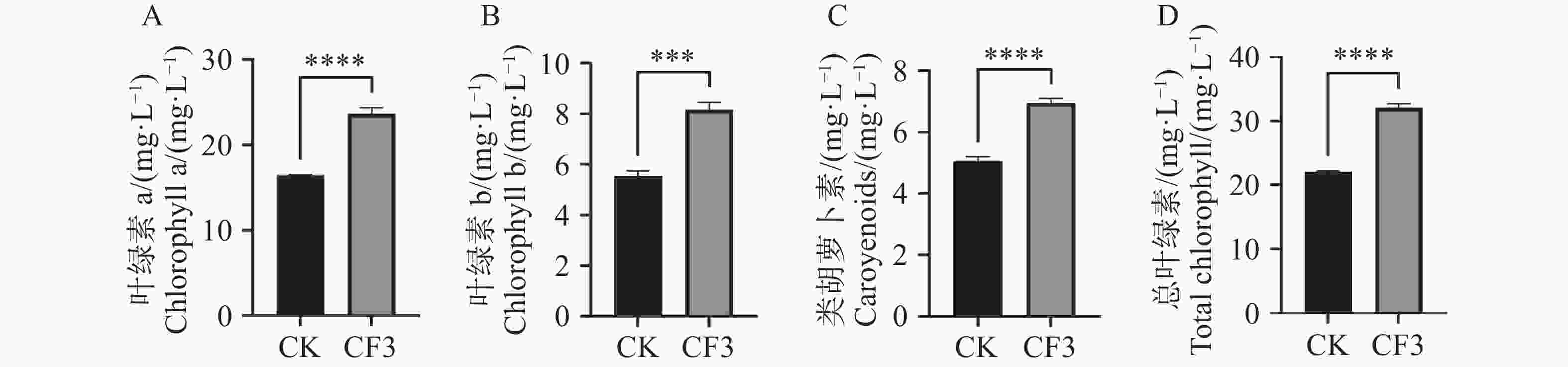
植物叶片中光合色素负责光能的吸收传递和转换,光合色素含量的高低则显著影响着作物的产量。因此,对盆栽接种CF3后的木薯叶片光合色素进行测定。由图1可知,接种灰黄青霉CF3的木薯叶绿素a、叶绿素b、类胡萝卜素和总叶绿素浓度分别比未接种对照提高了44%、47%、38%和46%,表明接种CF3后,显著提高了盆栽木薯叶片光合色素的含量。
-
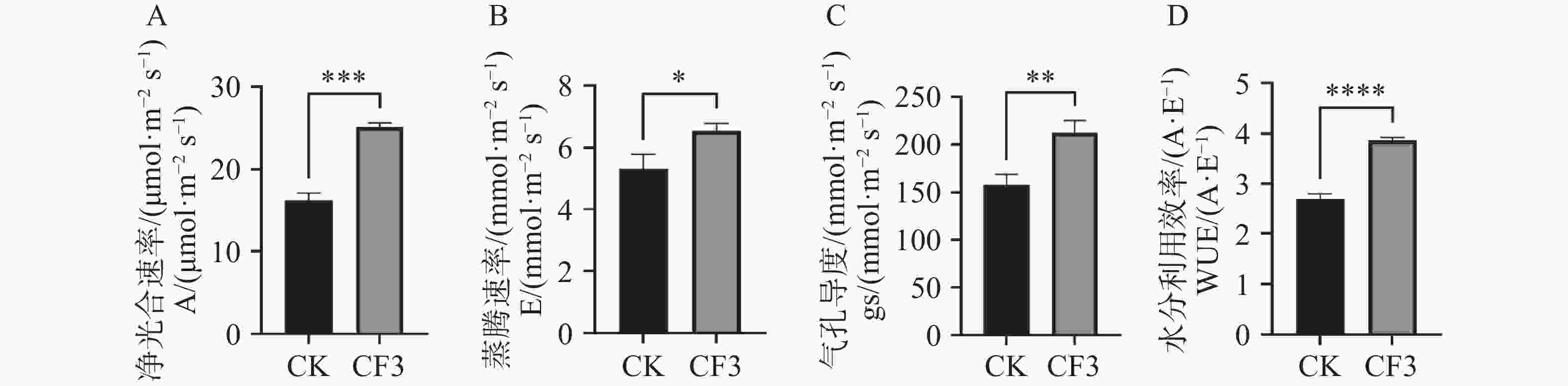
光合色素含量的提高能够促进光合效率的提高,对接种灰黄青霉CF3后的木薯叶片光合速率指标进行测定,由图2可知,接种CF3的盆栽木薯净光合速率、蒸腾速率、气孔导度和水分利用效率分别比对照提高了55%、23%、35%和43%,表明接种CF3可以显著增强盆栽木薯的光合能力。
-
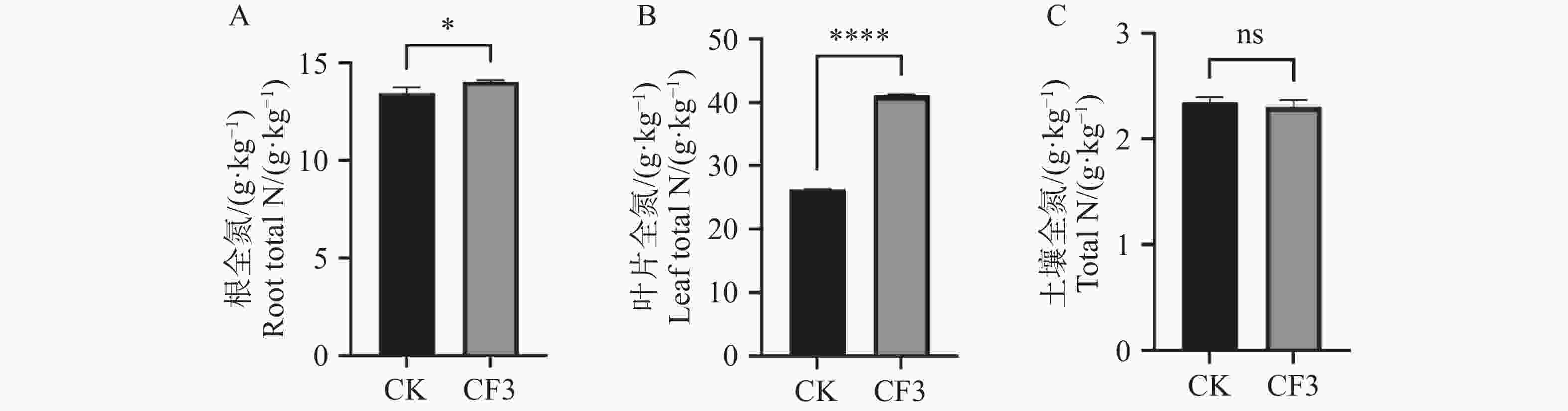
氮元素为植物养分吸收利用最重要的元素之一,光合色素的增高与氮元素的供应紧密相关,因此,本研究对接种灰黄青霉CF3后木薯根系和叶片中的含氮量进行了测定,由图3可知,接种灰黄青霉CF3的木薯根系中全氮含量较未接种显著提高了4.5%(图3−A),接种灰黄青霉CF3的木薯叶片中全氮含量较未接种显著提高了56%(图3−B),木薯叶片中的氮含量提升幅度显著高于根中的全氮含量。土壤全氮含量未有显著差异(图3−C),表明接种灰黄青霉CF3后未能引起土壤全氮的变化,而根中及叶片中氮含量的升高可能与木薯氮转运蛋白基因及同化蛋白基因的表达有关。
-
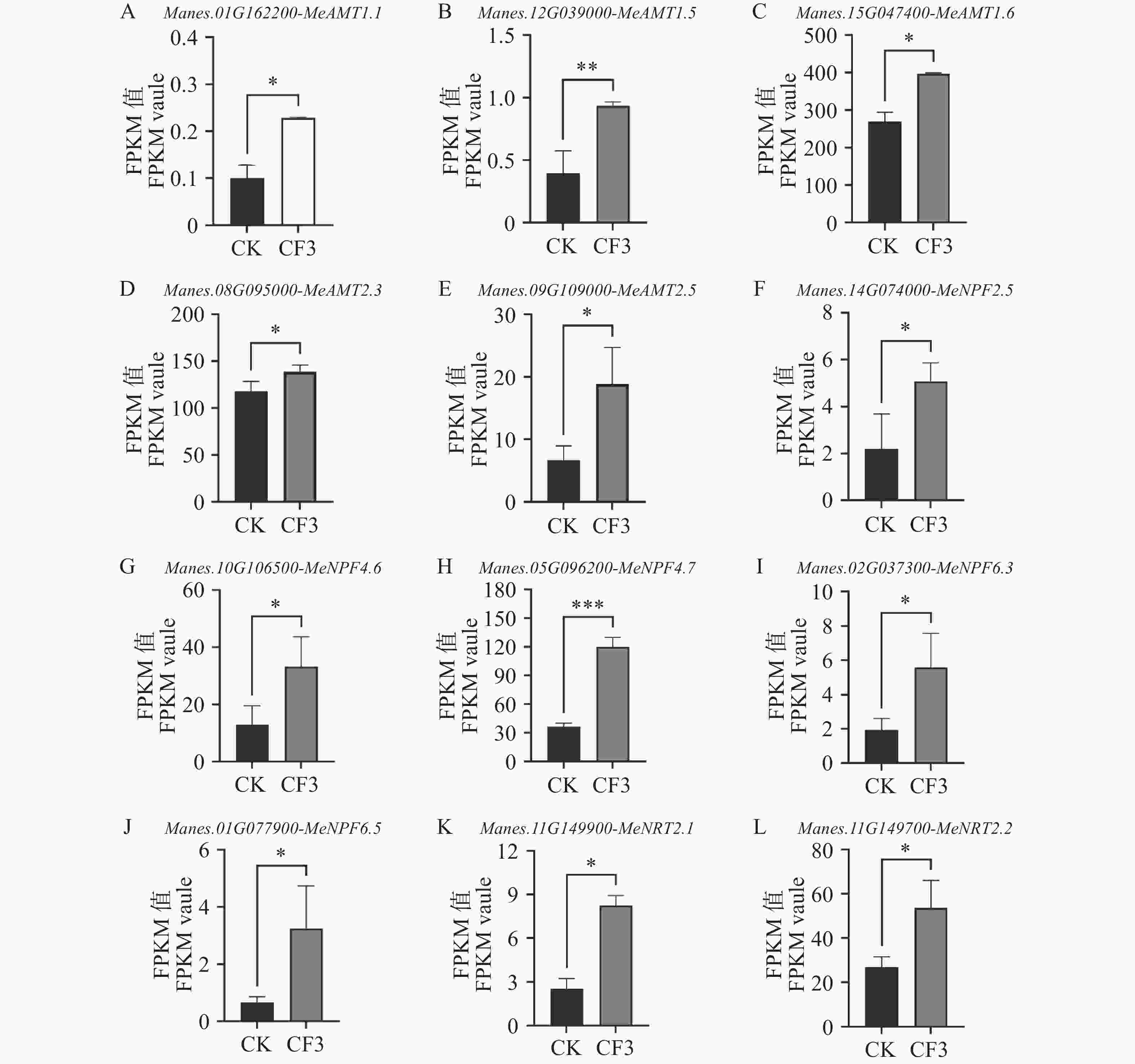
接种灰黄青霉CF3后,木薯根系和叶片的氮含量上升。对接种CF3及未接种对照的木薯根系进行转录组测序,根系转录组测序结果表明,木薯铵转运蛋白基因MeAMT1.1、MeAMT1.5、MeAMT1.6、MeAMT2.3、MeAMT2.5的表达量较未接种显著升高,分别比对照提高了127.71%、135.51%、47.55%、17.70%和182.25%,其中,MeAMT1.1、MeAMT1.5和MeAMT2.5的表达量变化均升高了一倍以上(图4−A~E)。同时,硝态氮转运蛋白基因MeNPF2.5、MeNPF4.6、MeNPF4.7、MeNPF6.3、MeNPF6.5和MeNRT2.1、MeNRT2.2的表达量较未接种也均显著增高,其表达量较对照提高了131.89%、158.47%、229.29%、188.98%、397.04%、225.62%和98.98%(图4−F~L)。其中,MeNPF6.5的表达量提高接近4倍,且硝态氮转运蛋白基因的平均升高幅度高于铵转运蛋白基因,表明接种灰黄青霉CF3后,激活了木薯根中的铵态氮和硝态氮转运蛋白基因的表达来增加了对土壤氮元素的吸收。
-
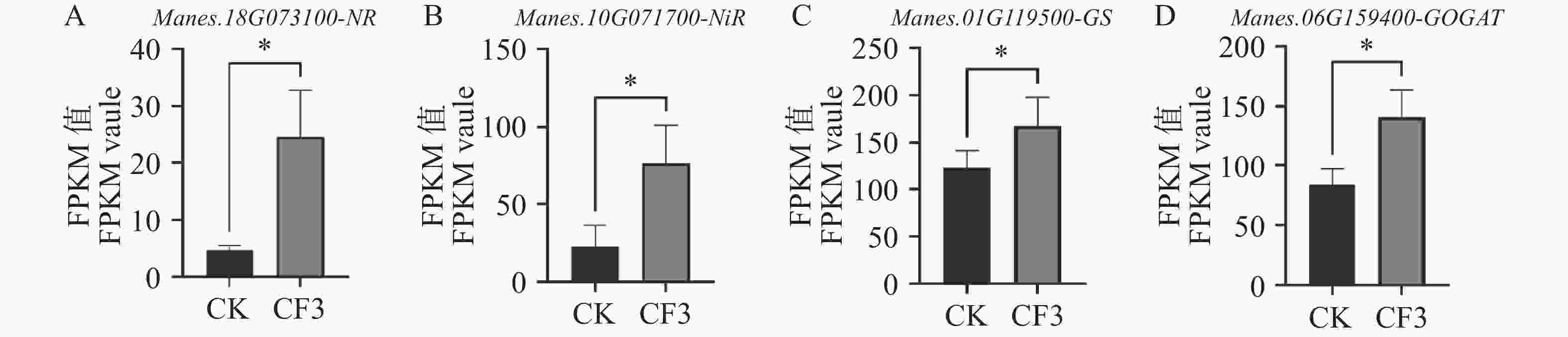
硝酸盐被植物根系通过转运蛋白吸收后,再通过硝酸还原酶(nitrate reductase,NR)和亚硝酸还原酶(nitrite reductase,NiR)被还原成铵盐,后在谷氨酰胺合成酶(glutamine synthetase,GS)和谷氨酸合成酶(glutamate synthase,GOGAT)的作用下同化成氨基酸,随后通过转氨作用生成多种氨基酸参与植物的生长发育各过程,完成了氮元素的吸收利用[15]。因此,我们对木薯根系的硝酸还原酶基因、亚硝酸还原酶基因、谷氨酰胺合酶基因、谷氨酸合酶基因的表达量变化进行了研究。结果表明,木薯根中硝酸还原酶基因NR (图5−A)、亚硝酸还原酶基因NiR(图5−B)、谷氨酰胺合酶基因GS(图5−C)和谷氨酸合酶基因GOGAT(图5−D)的表达量在接种CF3后均显著上升,较CK分别升高了426.20%、234.89%、69.16%和36.86%。其中,硝酸还原酶NR作为诱导酶,在接种灰黄青霉CF3后表达量上升倍数最高,说明CF3可以通过诱导木薯根中硝酸盐的还原和氨的同化,促进了氮的吸收利用。
-
利用有益微生物菌肥来降低化肥使用量,提高作物产量是维持农业可持续发展的一条重要途径[16]。土壤中氮元素是作物生长发育所需的最重要的大量元素之一,土壤中氮素的缺少会导致植物叶片发育不良、失绿,进一步严重影响产量,而氮肥的过量使用则会导致成本上升及环境污染如土壤酸化及富营养化等[15]。有益微生物菌肥通过固氮、硝化、反硝化等方式改变土壤中氮素的存在形态及通过分泌挥发性有机化合物等方式来调节植物氮转运蛋白基因的表达[17]。在植物对土壤中的氮元素吸收过程中,硝态氮和铵态氮是植物吸收的两种主要形式,植物通过根中的硝酸盐转运蛋白和铵转运蛋白分别进行硝态氮和铵态氮的吸收。硝酸盐转运蛋白主要包括低亲和力的NPF家族蛋白成员和高亲和力的NRT2家族成员,铵转运蛋白同样包括了低亲和力的AMT1家族蛋白成员和高亲和力的AMT2蛋白家族,两者协同促进了植物根系对氮的吸收。
已有文献表明,有益微生物能够促进植物对氮的吸收能力来促进植物生长,但不同有益微生物调控植物根系氮吸收同化基因表达的分子机理不尽相同。如接种芽孢杆菌属的不同小种及组合可以同时提高硝酸盐转运蛋白家族NPF和NRT2基因的表达及铵转运蛋白家族AMT1和AMT2基因的表达来促进拟南芥对氮的吸收并提高叶绿素含量及生物量[6]。接种植物促生菌Phyllobacterium STM196主要诱导了拟南芥硝酸盐转运蛋白基因AtNRT2.5 和AtNRT2.6,促进了拟南芥的生长[18 − 19]。接种荧光假单胞菌Pf-16,在48 h前,通过提高了AMT1.3(Solyc03g045070.1.1)的表达,而降低了NRT2.1(Solyc00g090860.1.1)和NRT2.4(Solyc11g-069760.1.1)基因的表达来促进番茄(Solanum lycopersicum)的生长[20]。接种A. brasilense FP2后,诱导小麦(Triticum aestivum L.)根中的氮吸收基因NPF2.1和氮同化基因GS1的表达,增强了小麦对氮的吸收利用,促进了小麦的生长[21]。接种细菌阿氏肠杆菌BFD160、韩国假单胞菌TFD26和亚麻假单胞菌BFS112的组合菌剂可以通过显著增强甜瓜的氮吸收基因AMT2的表达和磷转运基因PHT1的表达增强了西瓜的叶绿素含量,光合效率及产量[22]。接种木霉菌T42促进了烟草根系的生长、提高了烟草的生物量及总氮含量,其硝态氮转运蛋白基因NRT2.1、NRT2.2和谷氨酰胺合成酶GS基因的表达显著增高,但其铵转运蛋白基因AMT1表达量较未接种无显著差异[23]。接种哈茨木霉菌T-22提高了NRT1基因的表达和光合系统Ⅱ 10 kD多肽蛋白的表达、促进了高粱的根长、叶绿素含量及氮含量[24]。菌根真菌Rhizophagus irregularis通过提高水稻硝态氮转运蛋白基因OsNPF2.2、OsNPF1.3、 OsNPF6.4和OsNPF4.12的高表达来促进水稻的生长,提高水稻生物量[25]。随后,Wang等[26]又证实,水稻根中的OsNPF4.5被菌根真菌R.irregularis诱导高表达,同时OsAMT3.1、OsNR1、OsNR2、OsNiR、OsGS1、OsGS2基因也被诱导高表达,说明菌根真菌可以同时诱导硝态氮转运蛋白基因、铵转运蛋白基因及硝酸还原酶NR、亚硝酸还原酶NiR、谷氨酰胺合成酶基因的表达,促进对氮的吸收利用。
灰黄青霉CF3作为促生真菌,可以促进木薯的生长,但其作用机理未知。本试验表明,接种灰黄青霉CF3后,提高了木薯对土壤中氮元素的吸收、增加了木薯根和叶片中的氮含量,提高了叶片中叶绿素的含量及增强了木薯的光合效率,促进了木薯的生长。进一步的研究表明,接种灰黄青霉CF3后,显著激活了木薯根中的铵转运蛋白基因MeAMT1.1、MeAMT1.5、MeAMT1.6,MeAMT2.3和MeAMT2.5的表达。Wang等[27]发现,在拟南芥中过表达MeAMT1.5能够提高拟南芥对氮的吸收效率,显著促进了拟南芥的生长。本研究还发现,木薯根中7个硝态氮转运蛋白基因MeNPF2.5、MeNPF4.6、MeNPF4.7、MeNPF6.3、MeNPF6.5、MeNRT2.1和MeNRT2.2的表达被激活。Zou等[28]发现在拟南芥中过表达MeNRT2.1基因可以提高拟南芥叶片的叶绿素含量,同时增加了拟南芥的生物量。本研究发现MeAMT1.5、MeNRT2.1等基因在接种灰黄青霉CF3后,表达量上升,提高了木薯的氮吸收效率,显著促进了木薯的生长。上述在拟南芥中过表达MeAMT1.5和MeNRT2.1基因提高拟南芥氮吸收效率和促进了拟南芥的生长的结果也间接证明了我们的结果。此外,灰黄青霉还激活了木薯硝酸还原酶NR、亚硝酸还原酶NiR、谷氨酰胺合成酶基因的表达,增强了对土壤中氮的吸收,提高了叶片中叶绿素的含量及光合作用,促进了木薯的生长。然而,灰黄青霉是否可以通过促进其他养分的吸收如磷元素、钾元素,以及是否能够分泌植物激素如生长素、细胞分裂素等方式来促进木薯生长,还值得更进一步的深入研究。
-
盆栽实验接种灰黄青霉CF3后,可以增强木薯铵转运蛋白基因、硝态氮转运蛋白基因及木薯硝酸还原酶NR、亚硝酸还原酶NiR、谷氨酰胺合成酶基因的表达,促进了木薯根系对土壤中氮的吸收,提高了木薯叶片中叶绿素的含量及光合作用,促进了木薯的生长。本研究结果为CF3的田间应用奠定了理论基础。
灰黄青霉CF3对木薯促生作用机理的初步研究
DOI: 10.15886/j.cnki.rdswxb.20250045
 CSTR: 32425.14.j.cnki.rdswxb.20250045
CSTR: 32425.14.j.cnki.rdswxb.20250045
Mechanism of promoting growth of cassava by Penicillium griseofulvum CF3
-
摘要: 植物根际促生菌可以显著促进植物生长,已有研究表明,灰黄青霉CF3能促进木薯生长。本研究为进一步探究灰黄青霉CF3促生作用的机理,采用菌剂接种的盆栽试验,通过木薯光合色素、光合速率、氮含量测定以及木薯氮转运和同化相关基因表达等指标,从植物氮素吸收利用角度,深入阐释CF3促进木薯生长的机理。结果表明:接种CF3的木薯叶片相较对照组,其叶绿素a、叶绿素b、类胡萝卜素和总叶绿素浓度分别提高了44%、47%、38%和46%,同时其净光合速率、气孔导度、水分利用效率和蒸腾速率分别提高了55%、35%、43%和23%;其叶片氮含量提高了56%,其根氮含量分别提高了4.5%,土壤总含氮量没有显著差异;转录组结果表明,根中铵转运蛋白基因MeAMT2.5、硝态氮转运蛋白基因MeNPF6.5、硝酸盐还原基因MeNR、MeNiR及铵同化基因MeGS和MeGOGAT在接种CF3后表达量显著升高。结论:接种灰黄青霉CF3后,激活了木薯根和叶片中氮转运相关基因、硝酸盐还原基因、铵同化基因等的表达,从而提高了木薯根和叶片中氮含量,进而提高了叶绿素的含量,增强了光合作用,从而促进了木薯生长。本研究为进一步阐释灰黄青霉CF3对木薯的促生机理,并为灰黄青霉CF3的田间应用奠定了理论基础。Abstract: Previous studies have shown that Penicillium griseofulvum CF3 can promote the growth of cassava. In order to further explore the mechanism of the growth-promoting effect of P. griseofulvum CF3, cassava leaves were inoculated with CF3 in a pot experiment. The results showed that the cassava leaves inoculated with CF3 increased the concentrations of chlorophyll a, chlorophyll b, carotenoids, and total chlorophyll by 44%, 47%, 38%, and 46%, respectively, compared to the control group. At the same time, their net photosynthetic rate, stomatal conductance, water use efficiency, and transpiration rate were increased by 55%, 35%, 43%, and 23%, respectively. The total nitrogen content in the leaves was increased by 56% while the total nitrogen in the roots increased by 4.5%, respectively. However, no significant alteration was observed in the total soil nitrogen content. The transcriptomic analysis showed that the expression of ammonium nitrogen transporter genes, nitrate nitrogen transporter genes, nitrate reduction genes and ammonium assimilation genes were significantly increased in the roots after inoculation with CF3. All these results indicated that inoculation with P. griseofulvum CF3 activated the expression of nitrogen transporter genes, nitrate reductase genes, ammonium assimilation gene in the cassava roots, thereby, increasing the nitrogen content in the cassava roots and leaves, which in turn increased the content of chlorophyll and enhanced photosynthesis, thus promoting the growth of cassava. This study lays a theoretical foundation for further elucidation of the growth-promoting mechanism of P. griseofulvum CF3 on cassava and for its field application.
-
Key words:
- Penicillium griseofulvum CF3 /
- cassava /
- growth promotion /
- nitrogen transporter
-
图 2 灰黄青霉CF3对盆栽木薯光合作用的影响
A. 净光合速率;B. 蒸腾速率;C. 气孔导度;D. 水分利用效率;数据为3个生物学重复的平均值±标准差;*表示P<0.05;**表示P<0.01;***表示P<0.001;****表示P<
0.0001 。Fig. 2 2 Effects of Penicillium griseofulvum CF3 on the photosynthesis of potted cassava
A. Assimilation rate (A); B. Transpiration rate (E); C. Stomatal conductance (Gs); D. Water use efficiency (WUE). Data are represented as means ± SD from three biological replicates; * represents P<0.05; ** represents P<0.01; *** represents P<0.001; **** represents P<
0.0001 .图 3 灰黄青霉CF3对盆栽木薯叶片和根养分含量的影响
A. 根全氮;B. 叶片全氮;C. 土壤全氮;*表示P<0.05;****表示P<0.0001;ns表示P>0.05。
Fig. 3 Effects of Penicillium griseofulvum CF3 on nutrient content of cassava leaves and roots in a pot experiment
A. Total N content in root; B. Total N content in leaves; C. Total N content in soil. Data are represented as means ± SD from three biological replicates; * represents P<0.05; **** represents P<
0.0001 ; ns represents P>0.05.图 4 灰黄青霉CF3对木薯根系中氮转运基因表达量的影响
A. 铵转运蛋白基因MeAMT1.1;B. 铵转运蛋白基因MeAMT1.5;C. 铵转运蛋白基因MeAMT1.6;D. 铵转运蛋白基因MeAMT2.3;E. 铵转运蛋白基因MeAMT2.5;F. 硝态氮转运蛋白基因MeNPF2.5;G. 硝态氮转运蛋白基因MeNPF4.6;H. 硝态氮转运蛋白基因MeNPF4.7;I. 硝态氮转运蛋白基因MeNPF6.3;J. 硝态氮转运蛋白基因MeNPF6.5;K. 硝态氮转运蛋白基因MeNRT2.1;L. 硝态氮转运蛋白基因MeNRT2.2;数据为3个生物学重复的FPKM平均值±标准差;*表示P<0.05;**表示P<0.01;*** 表示 P<0.001。
Fig. 4 Effects of Penicillium griseofulvum CF3 on expression level of nitrogen transporter genes in cassava roots
A. Ammonium transporter gene MeAMT1.1; B. Ammonium transporter gene MeAMT1.5; C. Ammonium transporter gene MeAMT1.6; D. Ammonium transporter gene MeAMT2.3; E. Ammonium transporter gene MeAMT2.5; F. Nitrate transporter gene MeNPF2.5; G. Nitrate transporter gene MeNPF4.6; H. Nitrate transporter gene MeNPF4.7; I. Nitrate transporter gene MeNPF6.3; J. Nitrate transporter gene MeNPF6.5; K. Nitrate transporter gene MeNPF2.1; L. Nitrate transporter gene MeNPF2.2. Data are represented as means ± SD from three biological replicates; * represents P<0.05; ** represents P<0.01; *** represents P<0.001.
图 5 灰黄青霉CF3对木薯根系中硝酸根还原及氨同化基因表达量的影响
A. 硝酸还原酶基因NR;B. 亚硝酸还原酶基因NiR;C. 谷氨酰胺合成酶基因GS;D. 谷氨酸合成酶基因GOGAT数据为三个生物学重复的FPKM平均值±标准差;*表示P<0.05。
Fig. 5 Effects of Penicillium griseofulvum CF3 on the expression level of NR, Nir, GS and GOGAT in cassava roots
A. Nitrate reductase gene NR; B. Nitrite reductase gene NiR; C. Glutamine synthetase gene GS; D. Glutamate synthase gene GOGAT. Data are represented as means ± SD from three biological replicates; * represents P<0.05.
-
[1] 严华兵, 叶剑秋, 李开绵. 中国木薯育种研究进展[J]. 中国农学通报, 2015, 31(15): 63 − 70. doi: 10.11924/j.issn.1000-6850.casb14110159 [2] 时涛, 李超萍, 王国芬, 等. 中国木薯病害研究进展与展望[J]. 热带作物学报, 2023, 44(12): 2355 − 2368. doi: 10.3969/j.issn.1000-2561.2023.12.001 [3] 蔡杰, 张洁, 喻珊, 等. 施肥方式对木薯根际土壤细菌多样性与群落结构特征的影响[J]. 福建农林大学学报(自然科学版), 2022, 51(1): 15 − 20. doi: 10.13323/j.cnki.j.fafu(nat.sci.).2022.01.002 [4] 武杞蔓, 张金梅, 李玥莹, 等. 有益微生物菌肥对农作物的作用机制研究进展[J]. 生物技术通报, 2021, 37(5): 221 − 230. doi: 10.13560/j.cnki.biotech.bull.1985.2020-0846 [5] TRINH C S, LEE H, LEE W J, et al. Evaluation of the plant growth-promoting activity of Pseudomonas nitroreducens in Arabidopsis thaliana and Lactuca sativa[J]. Plant Cell Reports, 2018, 37(6): 873 − 885. doi: 10.1007/s00299-018-2275-8 [6] CALVO P, ZEBELO S, MCNEAR D, et al. Plant growth-promoting rhizobacteria induce changes in Arabidopsis thaliana gene expression of nitrate and ammonium uptake genes[J]. Journal of Plant Interactions, 2019, 14(1): 224 − 231. doi: 10.1080/17429145.2019.1602887 [7] LEE S, TRỊNH C S, LEE W J, et al. Bacillus subtilis strain L1 promotes nitrate reductase activity in Arabidopsis and elicits enhanced growth performance in Arabidopsis, lettuce, and wheat[J]. Journal of Plant Research, 2020, 133(2): 231 − 244. doi: 10.1007/s10265-019-01160-4 [8] PII Y, ALDRIGHETTI A, VALENTINUZZI F, et al. Azospirillum brasilense inoculation counteracts the induction of nitrate uptake in maize plants[J]. Journal of Experimental Botany, 2019, 70(4): 1313 − 1324. doi: 10.1093/jxb/ery433 [9] CHEN Y, LI Y C, FU Y S, et al. The beneficial rhizobacterium Bacillus velezensis SQR9 regulates plant nitrogen uptake via an endogenous signaling pathway[J]. Journal of Experimental Botany, 2024, 75(11): 3388 − 3400. doi: 10.1093/jxb/erae125 [10] PÉREZ-PIQUERES A, MARTÍNEZ-ALCÁNTARA B, CANET R, et al. Plant growth-promoting microorganisms as natural stimulators of nitrogen uptake in citrus[J]. PLoS One, 2025, 20(2): e0311400. doi: 10.1371/journal.pone.0311400 [11] GAO Y, HUANG S Y, WANG Y J, et al. Analysis of the molecular and biochemical mechanisms involved in the symbiotic relationship between Arbuscular mycorrhiza fungi and Manihot esculenta Crantz[J]. Frontiers in Plant Science, 2023, 14: 1130924. doi: 10.3389/fpls.2023.1130924 [12] 申光辉, 薛泉宏, 张晶, 等. 草莓根腐病拮抗真菌筛选鉴定及其防病促生作用[J]. 中国农业科学, 2012, 45(22): 4612 − 4626. doi: 10.3864/j.issn.0578-1752.2012.22.007 [13] 陈杰, 郭天文, 汤琳, 等. 灰黄青霉CF3对马铃薯土传病原真菌的拮抗性及其促生作用[J]. 植物保护学报, 2013, 40(4): 301 − 308. doi: 10.13802/j.cnki.zwbhxb.2013.04.006 [14] 谌昕伟, 朱柏光, 陈点华, 等. 灰黄青霉CF3对木薯病原菌的拮抗性及其促生作用[J]. 分子植物育种, 2022, 20(24): 8231 − 8236. doi: 10.13271/j.mpb.020.008231 [15] LIU X J, HU B, CHU C C. Nitrogen assimilation in plants: current status and future prospects[J]. Journal of Genetics and Genomics, 2022, 49(5): 394 − 404. doi: 10.1016/j.jgg.2021.12.006 [16] 沈仁芳, 赵学强. 土壤微生物在植物获得养分中的作用[J]. 生态学报, 2015, 35(20): 6584 − 6591. doi: 10.5846/stxb201506051140 [17] BARGAZ A, LYAMLOULI K, CHTOUKI M, et al. Soil microbial resources for improving fertilizers efficiency in an integrated plant nutrient management system[J]. Frontiers in Microbiology, 2018, 9: 1606. doi: 10.3389/fmicb.2018.01606 [18] MANTELIN S, DESBROSSES G, LARCHER M, et al. Nitrate-dependent control of root architecture and N nutrition are altered by a plant growth-promoting Phyllobacterium sp[J]. Planta, 2006, 223(3): 591 − 603. doi: 10.1007/s00425-005-0106-y [19] KECHID M, DESBROSSES G, ROKHSI W, et al. The NRT2.5 and NRT2.6 genes are involved in growth promotion of Arabidopsis by the plant growth-promoting rhizobacterium (PGPR) strain Phyllobacterium brassicacearum STM196[J]. New Phytologist, 2013, 198(2): 514 − 524. doi: 10.1111/nph.12158 [20] SCOTTI R, D’AGOSTINO N, ZACCARDELLI M. Gene expression profiling of tomato roots interacting with Pseudomonas fluorescens unravels the molecular reprogramming that occurs during the early phases of colonization[J]. Symbiosis, 2019, 78(2): 177 − 192. doi: 10.1007/s13199-019-00611-9 [21] CAMILIOS-NETO D, BONATO P, WASSEM R, et al. Dual RNA-seq transcriptional analysis of wheat roots colonized by Azospirillum brasilense reveals up-regulation of nutrient acquisition and cell cycle genes[J]. BMC Genomics, 2014, 15(1): 378. doi: 10.1186/1471-2164-15-378 [22] MURGESE P, SANTAMARIA P, LEONI B, et al. Ameliorative effects of PGPB on yield, physiological parameters, and nutrient transporter genes expression in barattiere (Cucumis melo L. )[J]. Journal of Soil Science and Plant Nutrition, 2020, 20(2): 784 − 793. doi: 10.1007/s42729-019-00165-1 [23] SINGH B N, DWIVEDI P, SARMA B K, et al. Trichoderma asperellum T42 reprograms tobacco for enhanced nitrogen utilization efficiency and plant growth when fed with N nutrients[J]. Frontiers in Plant Science, 2018, 9: 163. doi: 10.3389/fpls.2018.00163 [24] KABIR A H, THAPA A, HASAN M R, et al. Local signal from Trichoderma afroharzianum T22 induces host transcriptome and endophytic microbiome leading to growth promotion in sorghum[J]. Journal of Experimental Botany, 2024, 75(22): 7107 − 7126. doi: 10.1093/jxb/erae340 [25] DRECHSLER N, COURTY P E, BRULÉ D, et al. Identification of arbuscular mycorrhiza-inducible Nitrate Transporter 1/Peptide Transporter Family (NPF) genes in rice[J]. Mycorrhiza, 2018, 28(1): 93 − 100. doi: 10.1007/s00572-017-0802-z [26] WANG S S, CHEN A Q, XIE K, et al. Functional analysis of the OsNPF4.5 nitrate transporter reveals a conserved mycorrhizal pathway of nitrogen acquisition in plants[J]. Proceedings of the National Academy of Sciences of the United States of America, 2020, 117(28): 16649 − 16659. doi: 10.1073/pnas.2000926117 [27] WANG Y, XIA Y Q, YOU L L, et al. Characterization of ammonium absorption by ammonium-preferential cassava[J]. Journal of Plant Physiology, 2025, 304: 154401. doi: 10.1016/j.jplph.2024.154401 [28] ZOU L P, QI D F, SUN J B, et al. Expression of the cassava nitrate transporter NRT2.1 enables Arabidopsis low nitrate tolerance[J]. Journal of Genetics, 2019, 98(3): 74. doi: 10.1007/s12041-019-1127-9 -




 下载:
下载: