-
宫颈癌是女性第4大最常见的癌症,虽然它是一种可预防的癌症,但全球每年约有52.8万名妇女被诊断患有宫颈癌,死亡26.6万例,其中85%的死亡病例发生在发展中国家[1]。宫颈癌的发展是一个历时数年的缓慢过程,因为宫颈癌在早期没有明显症状,所以当检测出时大多已经到了晚期。人乳头瘤病毒(HPV),尤其是16和18 HPV的感染是发展为宫颈癌的主要危险因素[2]。宫颈癌细胞HeLa是研究宫颈癌的典型细胞系,它不同于人类的一般细胞,HeLa细胞具有无限增殖的能力,而且增殖速度异常迅速[3]。细胞凋亡是一种程序性死亡,与癌症的发生发展密切相关,促进癌细胞发生凋亡是治疗癌症的主要方法之一[4]。细胞死亡受体通路和线粒体通路是现阶段比较认同的2条引起细胞凋亡的途径[5],在线粒体凋亡通路中,Caspase-9为凋亡的启动者,其活化后产生Cleaved Caspase-9活化片段[6],Caspase-3是执行凋亡的因子[7],当其发生活化后会产生一个活性片段即Cleaved Caspase-3,它能够反映Caspase-3的活化程度以及细胞发生凋亡的程度[8]。线粒体通路引起的凋亡首先是使线粒体膜电位丧失从而增加它的通透性,这样细胞色素C等使细胞发生凋亡的物质就会从线粒体中释放出来。细胞色素C会和Caspase-9等因子相互作用,使Caspase-3激活,从而启动Caspase依赖的凋亡通路[9]。
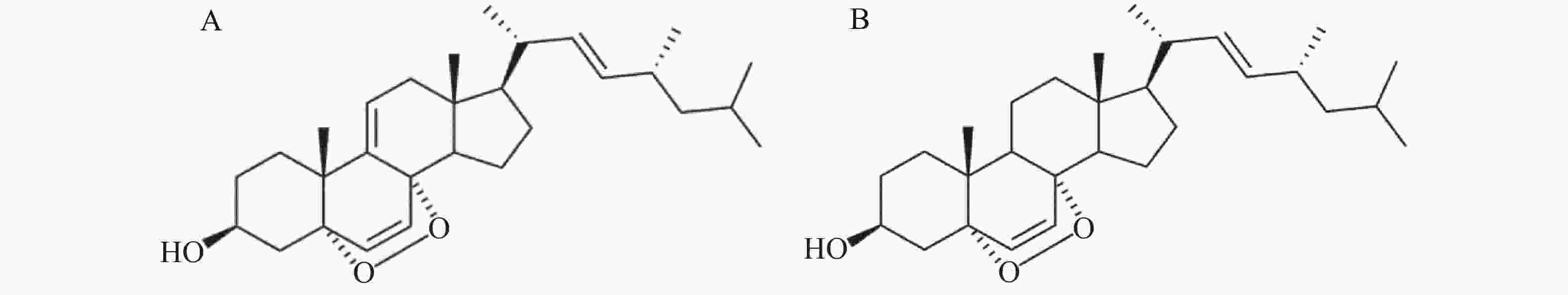
FINDLAY等[10]首次在海葵中分离得到WP-1[(22E, 24R)-5, 8-epidioxy-5α, 8α-ergosta-6, 9(11), 22E-trien-3β-ol],之后又先后在海南粗榧内生真菌S26[11]、可食用蘑菇[12]等中分离出该化合物。研究表明,WP-1对肝癌细胞Hep3B有明显的细胞毒性,可以使细胞DNA断裂和染色质浓缩从而诱导肝癌细胞Hep3B发生凋亡,但是对正常细胞的毒性较低,说明其具有一定的特异性[13]。它还可以抑制白血病细胞HL60活力,并通过诱导CDKN1A表达来抑制结直肠癌细胞HT29的生长,从而引起细胞周期停滞和凋亡[14]。上述研究结果均表明WP-1具有一定的抗肿瘤活性,但其对宫颈癌的作用目前尚不清楚。本实验所用的WP-1是本课题组从红树林植物角果木(Ceriops tagal)内生真菌Cytospora sp.中分离鉴定的麦角甾醇类化合物[15],笔者采用MTT比色法和克隆形成实验等来研究WP-1对HeLa细胞增殖、凋亡的影响,旨在为其临床应用及新药开发提供依据。
-
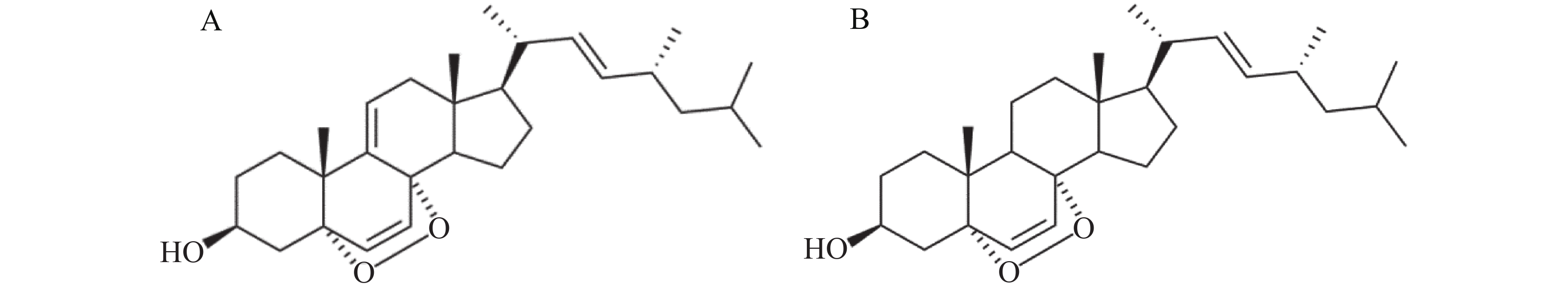
人宫颈癌细胞(HeLa)购自中国科学院上海细胞库,WP-1[(22E,24R)5, 8-epidioxy-5α, 8α-ergosta-6, 22E-dien-3β-ol]由本课题组成员提取并纯化[12],其结构如图1A所示。MEM细胞培养基(中科迈晨);胎牛血清(Gibco);吉姆萨染料(合肥Biosharp生物);Hoechst33258染色试剂盒(碧云天生物科技有限公司);噻唑蓝(MTT)(美国Sigma公司);磷酸盐缓冲溶液(PBS)、胰蛋白酶、PVDF膜(0.22 μm),Anti-Capase-3 Antibody,Anti-Cleaved Caspase-3 Antibody,Anti-Caspase-9 Antibody,Anti-Cleaved Caspase-9 Antibody,Anti-β-actin Antibody,Goat Anti-Mouse IgG,Goat Anti-Rabbit IgG均购自武汉博士德生物;无水乙醇、二甲基亚砜(DMSO)等其他常用化学试剂购自广州化学试剂厂。
-
CO2细胞培养箱(英国RS Biotech公司),高压灭菌锅(日本株式会社),酶标仪(上海科华公司),倒置荧光显微镜(日本Olympus),超低温冰箱(日本SANYO),制冰机(美国Grant公司),超净工作台(苏州净化设备有限公司),恒温水浴锅(上海精宏仪器设备有限公司)。
-
将宫颈癌细胞系HeLa和人正常肝细胞系L02分别放在含有 w=10% FBS+0.1 mg·L−1链霉素+0.1 U·L−1青霉素的MEM培养基中,然后置于37 ℃含有 φ=5% CO2的细胞培养箱培养。每天换液,隔天传代,冻存在液氮罐中保存备用[16]。
-
用胰蛋白酶消化处于对数生长期的HeLa或L02细胞,以每孔5 000的细胞密度接种在96孔板中。将细胞放在培养箱中培养24 h以粘附,然后用 w=0.1% DMSO(作为对照)或不同浓度的WP-1(0.01,0.10,1.00,5.00,10.00,20.00和40.00 μmol·L−1 )处理24 h。除去培养基并用PBS洗涤,然后在室温下与100 μL培养基和20 μL MTT一起孵育4 h。除去培养基,加入200 μL DMSO溶解MTT甲瓒晶体。在摇床上轻轻摇动后,用酶标仪读取在570 nm下的吸光度[16]。
-
将细胞(每孔2×102细胞)置于6孔板中,第2天,对贴壁细胞用不同浓度的WP-1(5.00,10.00和20.00 μmol·L−1)或 w=0.1% DMSO处理24 h。在添加含有 w=10% FBS的新鲜培养基之前,先去除含药的培养基。在培养期间的适当时间,用新鲜培养基替换旧培养基,约半个月后取出培养板。除去原始培养基,用PBS洗涤2次,然后向每个孔中加入1 mL甲醇,持续15 min以固定细胞。固定后将甲醇洗净,并用PBS轻轻冲洗,加入适量的吉姆萨染料染色30 min,最后用无菌水洗净并在空气中干燥,然后在显微镜下观察菌落。计数超过50个细胞的菌落,通过将无WP-1的菌落数定义为100%,计算菌落形成的百分比[17]。
-
将细胞以每孔2×105个细胞铺于6孔板中,第2天至细胞贴壁后,在细胞中加入不同浓度的WP-1(5.00,10.00和20.00 μmol·L−1)或 w=0.1% DMSO处理24 h。加药处理后,将细胞放在普通倒置显微镜下观察细胞形态的变化,并拍照[18]。
-
将细胞密度控制为每孔2×105个,接种在6孔板中,培养过夜。用不同浓度(5.00,10.00 μmol·L−1)的WP-1或 w=0.1% DMSO处理HeLa细胞24 h,然后用0.5 mL固定液固定10 min。吸出固定液后,将细胞用PBS洗涤2次,并用Hoechst 33258染色5 min。除去染色液后,用PBS清洗2次。加入1滴荧光猝灭剂,并在荧光显微镜下观察[19]。
-
用WP-1(5.00,10.00和20.00 μmol·L−1)或 w=0.1%DMSO处理24 h后,收集细胞用PBS洗涤3次。将细胞加入到PMSF裂解物中,在冰上放置15 min(每5 min涡旋振荡30 s),然后在4 ℃下以12 000 r·m−1离心5 min。通过BSA蛋白质测定试剂盒对蛋白质浓度进行测定。将提取的蛋白质煮沸5 min后,将蛋白质样品在 w=10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶上分离,转移到聚偏二氟乙烯(PVDF)膜上,并用 w=5%脱脂奶粉封闭1 h。用含5%脱脂奶粉的TBST稀释Caspase-3,Cleaved Caspase-3,Caspase-9,Cleaved Caspase-9或β-actin的一抗。在常温下,将奶粉和PVDF膜覆盖在稀释的抗体上2 h。用TBST洗涤3次后,将膜与稀释的二抗在常温下孵育1 h。将发光液体施加到膜上约3 min,并使用显影剂定影液在黑暗中显示条带[19]。
-
每个实验至少重复3次,每次均为独立实验。采用One-Way-ANOVA分析(SPSS 9.0软件)统计分析数据,差异被认为在P ≤ 0.05水平上具有显著性,数据表示为平均值±标准偏差( SD)。
-
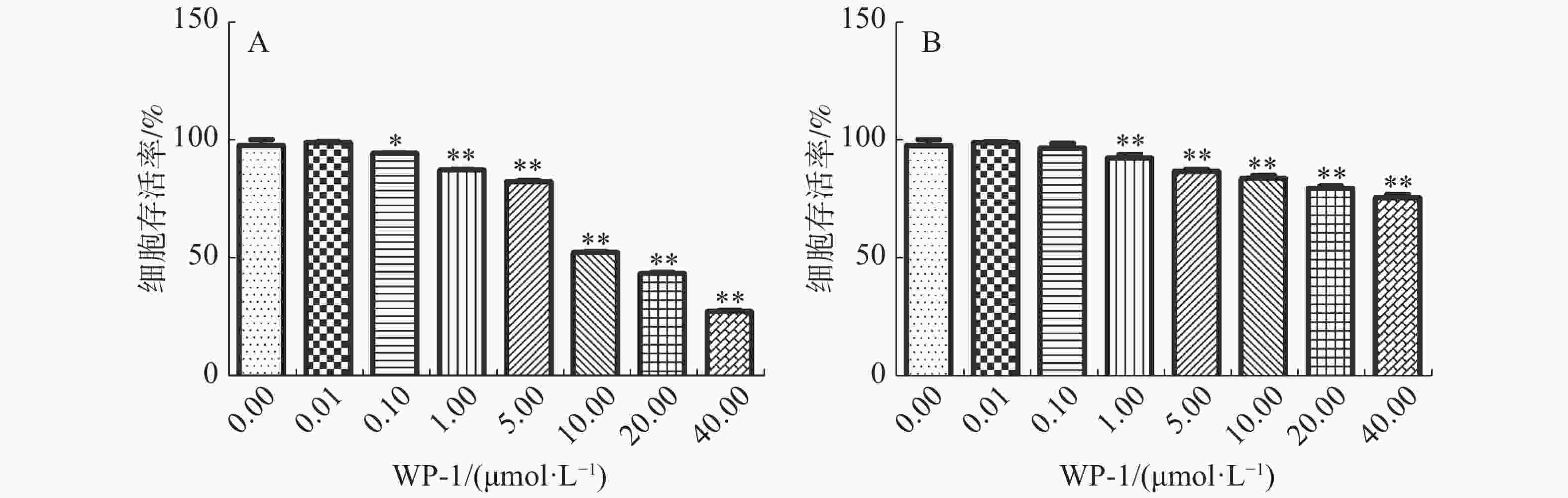
研究表明,WP-1可以显著抑制HeLa细胞的增殖。HeLa细胞存活率随着药物浓度的增加而降低,当药物浓度分别为0.01,0.10,1.00,5.00,10.00,20.00,40.00 μmol·L−1时,对HeLa细胞的抑制率分别为1.04%,5.66%(P≤0.05),12.70%(P≤0.01),17.56%(P≤0.01),47.61%(P≤0.01),56.38%(P≤0.01),72.60%(P≤0.01)。WP-1对HeLa细胞的半抑制浓度即IC50值为(10.67±0.09)μmol·L−1(图2A)。但是WP-1对正常细胞的毒性并不明显(图2B),当药物浓度达到40.00 μmol·L−1时,对正常细胞的抑制率仅为24.27%(P≤0.01)。
-
从图3可知,WP-1对HeLa细胞的克隆形成能力具有明显的抑制作用,WP-1浓度越高,克隆形成率越低,当药物浓度分别为5.00,10.00,20.00 μmol·L−1时,克隆形成率分别为80.00%,54.67%和42.00%。这表明WP-1对HeLa细胞的生长具有很强的长期抑制作用。
-
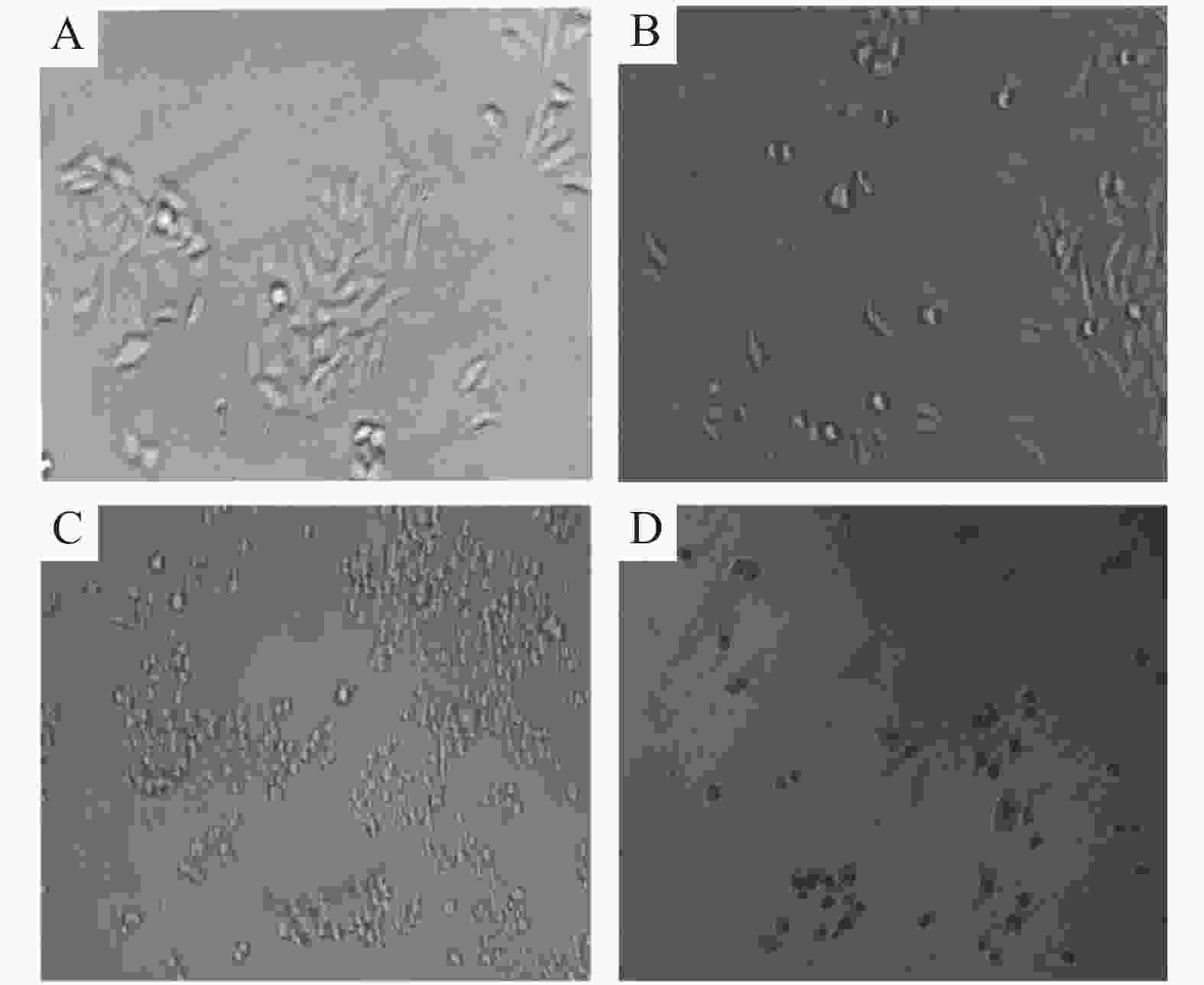
使用5.00,10.00,20.00 μmol·L−1的WP-1或 w=0.10%的DMSO处理细胞,然后在显微镜下观察细胞形态发生的变化。当细胞发生凋亡时,其形态会出现明显的变化,比如细胞会发生皱缩、变圆,原本贴壁的细胞也会脱离壁而漂浮存在。从图4可见,未加药的细胞背景很干净,细胞呈透明的长条状,而加药后细胞会呈现皱缩的球形,细胞间的排列也变得松散,透明度减弱,贴壁的细胞也漂浮而存在。
-
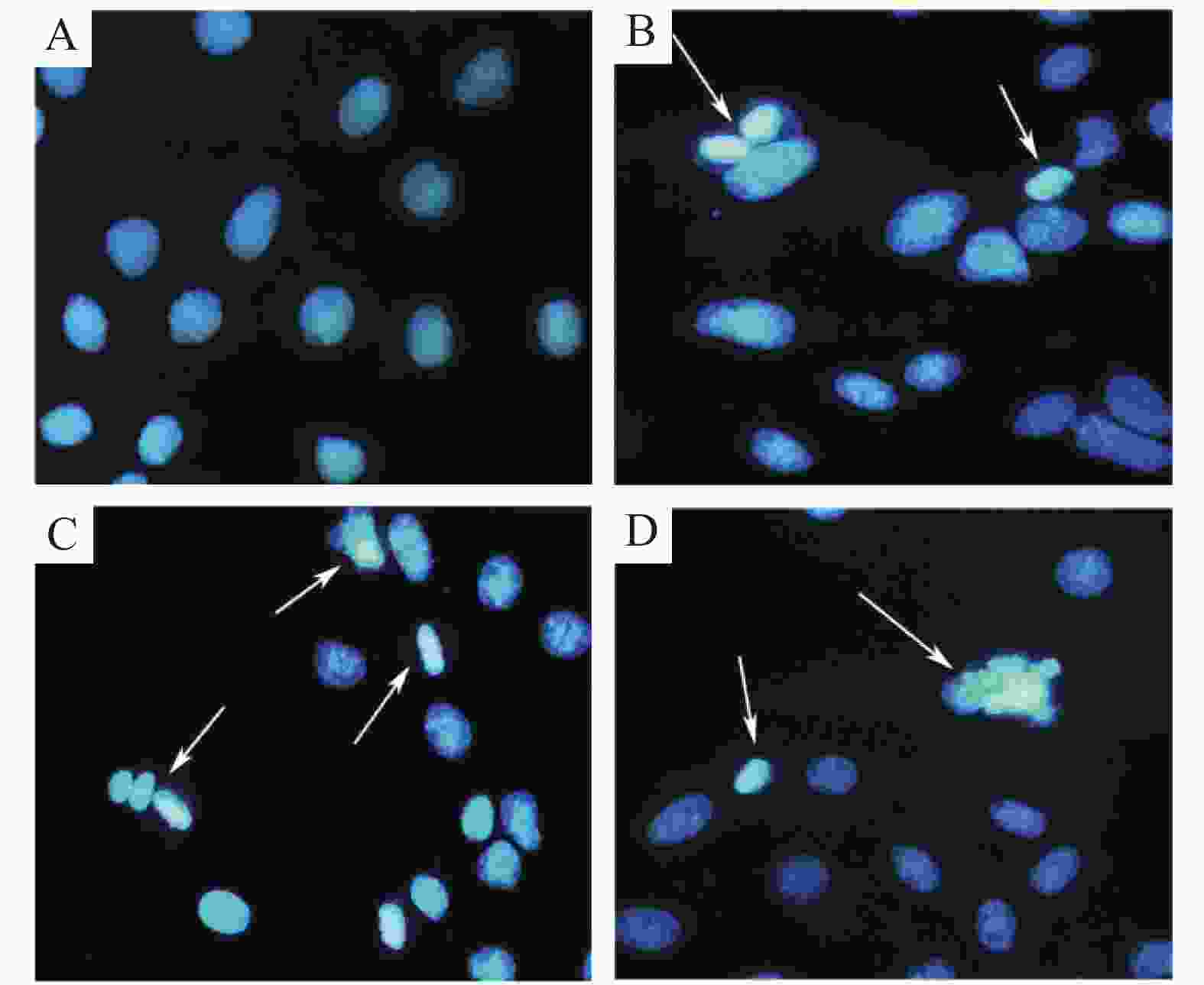
用Hoechst 33258核染色研究WP-1的凋亡诱导作用,用不同浓度的WP-1(5.00,10.00,20.00 μmol·L−1)或 w=0.1% DMSO处理HeLa 24 h,并通过Hoechst 33258染色观察细胞凋亡。如图5所示,未处理的细胞可看到细胞核被染成均匀蓝色,而处理后细胞核呈碎块状致密浓染。
-
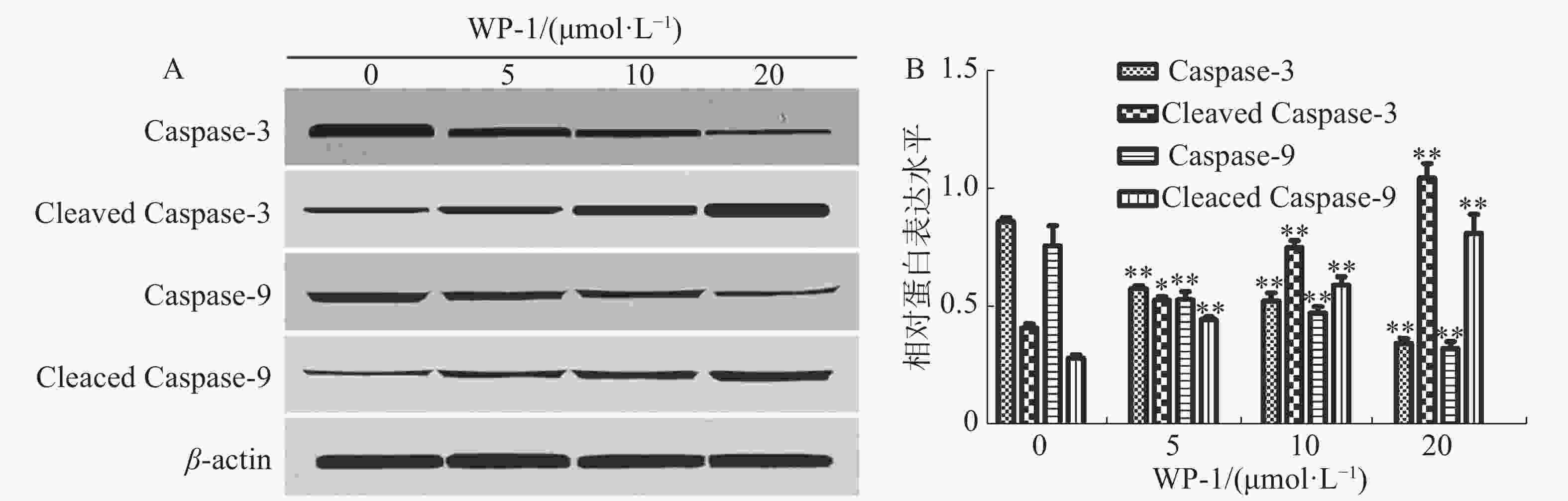
细胞凋亡或细胞自杀是细胞死亡的一种形式,其在形态和生化上不同于坏死,Caspase的激活在细胞凋亡的过程中起着核心作用,它属于半胱氨酸蛋白酶家族,生化激活后是造成细胞凋亡的形态学变化的主要原因,包括线粒体损伤,核膜破裂,DNA片段化,染色质浓缩和凋亡小体形成[10]。如图6所示,WP-1下调了Caspase-3和Caspase-9蛋白,而上调了Cleaved Caspase-3,Cleaved Caspase-9蛋白。该实验结果进一步的证明了WP-1能够促进HeLa细胞凋亡。
-
WP-1是本实验室前期从红树林植物角果木内生真菌中提取的天然产物,属于麦角甾醇类化合物[15]。麦角甾醇具有多种生物活性,如对细菌和肿瘤都有一定的抑制作用[20-21]。EP[5α,8α-epidioxy-(22E,24R)-ergosta-6,22-dien-3β-ol]是WP-1的类似物,它比WP-1少1个双键,结构如图1B所示,先前确定为黄曲霉提取物中的主要凋亡诱导剂[22]。据报道,EP是由麦角甾醇生物氧化合成的[23],也可以通过单线态氧的光氧化而形成[24]。KOBORI等[25]报道EP通过抑制NF-κB和C /EBPβ转录活性以及MARPK磷酸化来抑制LPS诱导的炎症反应,并抑制某些癌细胞的生长以诱导HL60人白血病细胞的凋亡[26]。WP-1比EP多1个双键,据报道它具有比EP更高的生物活性,并通过诱导CDKN1A的表达抑制HT29细胞的生长,从而引起细胞凋亡周期阻滞与细胞凋亡[14]。
本实验测定了WP-1对宫颈癌细胞HeLa的抑制作用,同时也测定了该化合物对HeLa细胞凋亡的影响。结果表明,WP-1对宫颈癌细胞HeLa具有显著的抑制效果,而且随着药物浓度的增加,HeLa细胞的存活率显著降低,当药物浓度达到(10.67±0.09)μmol·L−1时,其对细胞的抑制率为50.00%(P≤0.01),但是其对正常细胞的毒性很小,当药物浓度达到40.00 μmol·L−1时,对正常细胞的抑制率仅为24.27%(P≤0.01),这表明该化合物具有一定的特异性,与文献[13]报道的结果一致。同时,WP-1对HeLa细胞克隆率也有显著的影响,该药物能明显抑制细胞的克隆形成,当药物浓度为5.00,10.00,20.00 μmol·L−1时,抑制率分别为20.00%(P≤0.01),45.33%(P≤0.01)和58.00%(P≤0.01),可以看出,随着药物浓度的增加,HeLa细胞的克隆形成率显著降低。为了研究WP-1对宫颈癌细胞HeLa凋亡的影响,通过直接观察法和Hoechst 33258核染色来研究细胞的形态变化,并通过蛋白免疫印迹法来检测相关凋亡蛋白的变化。本研究表明,加药后的细胞会呈现皱缩的球形,HeLa细胞核呈碎块状致密浓染。而且随着WP-1浓度的增加,与凋亡相关的蛋白Caspase-3及Caspase-9的表达下调,Cleaved Caspase-3,Cleaved Caspase-9的表达明显上调,这表明,WP-1可以抑制HeLa细胞的增殖,并通过下调Caspase-3,Caspase-9的表达和上调Cleaved Caspase-3,Cleaved Caspase-9的表达促进HeLa细胞发生凋亡,所以猜测该化合物使通过线粒体通路来引起细胞发生凋亡。以上证据均显示,WP-1可以抑制宫颈癌细胞的增殖以及促进其凋亡,这为该化合物开发研究宫颈癌药物提供了实验基础,其作用机理还有待深入研究。
Effects of Bio-active Molecules Isolated from Endophytic Fungi of Ceriops tagal on the Proliferation and Apoptosis of HeLa Cells
-
摘要: 为了解红树林植物角果木(Ceriops tagal)内生壳囊孢属真菌Cytospora sp.提取物WP-1[(22E, 24R)-5, 8-epidioxy-5α, 8α-ergosta-6, 9(11), 22E-trien-3β-ol]抑制人宫颈癌HeLa细胞的效果,笔者采用MTT比色法、克隆形成实验、Hoechst 33258染色和蛋白免疫印迹法来研究WP-1对HeLa细胞增殖和凋亡的影响。结果表明,随着WP-1浓度增加,HeLa细胞的存活率显著降低,而且该提取物能明显抑制HeLa细胞的克隆形成,当其浓度达到10 μmol·L−1时,HeLa细胞出现染色质浓缩以及核小体碎裂的凋亡现象。蛋白免疫印迹法结果显示,随着WP-1剂量的增加,与凋亡相关的蛋白Caspase-3及Caspase-9的表达下调,Cleaved Caspase-3,Cleaved Caspase-9的表达明显上调。本实验结果显示,WP-1可以抑制HeLa细胞的增殖,并促进HeLa细胞发生凋亡。Abstract: In order to understand the effect of WP-1 [(22E, 24R)-5, 8-epidioxy-5α, 8α-ergosta-6, 9(11), 22E-trien-3β-ol] isolated from Cytospora sp., an endophytic fungus from the mangrove plant Ceriops tagal on human cervical cancer HeLa cells, the proliferation and apoptosis of HeLa cells treated with WP-1 was determined and analyzed by using MTT colorimetry, clone formation, Hoechst 33258 staining and Western blot. It was found that with the increase of WP-1 concentration the survival rate of the HeLa cells decreased significantly, and that the WP-1 significantly inhibited the colony formation of cells. When treated with WP-1 at a concentration of 10 μmol·L−1 the HeLa cells showed chromatin condensation and nucleosome fragmentation, which were characteristic of apoptosis. Western blot analysis showed that with the increase of WP-1 dose, the expressions of apoptosis-related proteins Caspase-3 and Caspase-9 were down-regulated in the HeLa cells, while the expressions of Cleaved Caspase-3 and Cleaved Caspase-9 were significantly up-regulated. The results show that WP-1 can inhibit the proliferation of HeLa cells and promote apoptosis of HeLa cells.
-
-
[1] SCHWALBE N. Human papillomavirus (HPV) and related cancers in the global alliance for vaccines and immunization (GAVI) countries. A WHO/ICO HPV information centre report foreword [J]. Vaccine, 2012, 30(4): 1 − 83. [2] COMPARETTO C, BORRUTO F. Cervical cancer screening: a never-ending developing program [J]. World Journal of Clinical Cases, 2015, 3(7): 82 − 92. [3] 裘伟廷. 海里埃塔·拉克丝:缔造“永生”传奇[J]. 世界文化, 2017(6): 54 − 56. doi: 10.3969/j.issn.1005-9172.2017.06.025 [4] DILLON C P, GREEN D R. Molecular cell biology of apoptosis and necroptosis in cancer [J]. Advances in Experimental Medicine and Biology, 2016, 930: 1 − 23. [5] XIONG Y, LU Q J, ZHAO J, et al. Metformin inhibits growth of hepatocellular carcinoma cells by inducing apoptosis via mitochondrion-mediated pathway [J]. Asian Pacific Journal of Cancer Prevention, 2012, 13(7): 3275 − 3279. doi: 10.7314/APJCP.2012.13.7.3275 [6] 尤良震, 吴袁元, 尹昀东, 等. 丹蛭降糖胶囊对高糖诱导的人脐静脉内皮细胞凋亡及线粒体途径与死亡受体途径的影响[J]. 中华中医药杂志, 2019(8): 3675 − 3680. [7] TSAI Y H, LIN J J, MA Y S, et al. Fisetin inhibits cell proliferation through the induction of G0/G1 phase arrest and Caspase-3-mediated apoptosis in mouse leukemia cells [J]. American Journal of Chinese Medicine, 2019, 47(4): 1 − 23. [8] JOHANNA B, BROCK H, KATHRYN L, et al. A Caspase-3 reporter for fluorescence lifetime imaging of single-cell apoptosis [J]. Cells, 2018, 7(6): 1 − 20. [9] YAN S L, HUANG C Y, WU S T, et al. Oleanolic acid and ursolic acid induce apoptosis in four human liver cancer cell lines [J]. Toxicology in Vitro, 2010, 24(3): 842 − 848. doi: 10.1016/j.tiv.2009.12.008 [10] FINDLAY J A,PATIL A D. A novel sterol peroxide from the sea anenome Metridium senile [J]. Steroids, 1984, 44(3): 261 − 265. [11] 陈苹, 吴娇, 戴好富, 等. 海南粗榧内生真菌S26化学成分研究[J]. 中国药物化学杂志, 2008, 18(4): 279 − 283. doi: 10.3969/j.issn.1005-0108.2008.04.010 [12] NIUE A W, OMOLO J O, CHEPLOGOI P K, et al. Cytotoxic ergostane derivatives from the edible mushroom Termitomyces microcarpus (Lyophyllaceae) [J]. Biochemical Systematics & Ecology, 2018, 76: 12 − 14. [13] CHEN Y K, KUO Y H, CHIANG B H, et al. Cytotoxic activities of 9,11-dehydroergosterol peroxide and ergosterol peroxide from the fermentation mycelia of Ganoderma lucidum cultivated in the medium containing leguminous plants on Hep3B cells [J]. Journal of Agricultural & Food Chemistry, 2009, 57(13): 5713 − 5719. [14] MASUKO K, MITSURU Y, MAYUMI O K, et al. 5α,8α-Epidioxy-22E-ergosta-6,9(11),22-trien-3β-ol from an edible mushroom suppresses growth of HL60 leukemia and HT29 colon adenocarcinoma cells [J]. Biological & Pharmaceutical Bulletin, 2006, 29(4): 755 − 759. [15] DENG Q, LI G, SUN M Y, et al. A new antimicrobial sesquiterpene isolated from endophytic fungus Cytospora sp. from the Chinese mangrove plant Ceriops tagal [J]. Natural Product Research, 2020, 34(10): 1404 − 1408. doi: 10.1080/14786419.2018.1512993 [16] YANG H C, WANG J Y, BU X Y, et al. Resveratrol restores sensitivity of glioma cells to temozolamide through inhibiting the activation of Wnt signaling pathway [J]. Journal of Cellular Physiology, 2019, 234(5): 6783 − 6800. doi: 10.1002/jcp.27409 [17] 宁晓燕. RNA干扰抑制h POT1表达对人胃癌细胞生物学特性的影响[D]. 上海: 第三军医大学, 2007. [18] 罗凤仙, 解静, 钱颖艳, 等. 辣木生物碱抑制宫颈癌Hela细胞增殖和诱导其凋亡的作用[J]. 现代食品科技, 2020, 36(2): 18 − 24. [19] YANG Y, JIA G, WANG Q, et al. Tubeimoside-1 induces glioma apoptosis through regulation of Bax/Bcl-2 and the ROS/Cytochrome C/Caspase-3 pathway [J]. Oncotargets & Therapy, 2015, 8: 303 − 311. [20] 郭玮, 罗琼, 刘帅, 等. 麦角甾醇对S180荷瘤小鼠抑瘤作用及机制[J]. 中国公共卫生, 2015, 31(12): 1606 − 1608. doi: 10.11847/zgggws2015-31-12-24 [21] LIN M Z, LI H J, ZHAO Y, et al. 2-Naphthoic acid ergosterol ester, an ergosterol derivative, exhibits anti-tumor activity by promoting apoptosis and inhibiting angiogenesis [J]. Steroids, 2017, 122: 9 − 15. doi: 10.1016/j.steroids.2017.03.007 [22] LIN C N, KUO S H, WON S J. Steroids of formosan Ganoderma amboinense [J]. Phytochemistry, 1993, 32(6): 1549 − 1551. doi: 10.1016/0031-9422(93)85177-S [23] BATES M L, REID W W, WHITE J D. Duality of pathways in the oxidation of ergosterol to its peroxide in vivo [J]. Journal of the Chemical Society Chemical Communications, 1976(2): 44 − 45. doi: 10.1039/c39760000044 [24] TRIGOS A, ORTEGA-REGULES A. Selective destruction of microscopic fungi through photo-oxidation of ergosterol [J]. Mycologia, 2002, 94(4): 563 − 568. doi: 10.1080/15572536.2003.11833184 [25] KOBORI M, YOSHIDA M, OHNISHI-KAMEYAMA M, et al. Ergosterol peroxide from an edible mushroom suppresses inflammatory responses in RAW264.7 macrophages and growth of HT29 colon adenocarcinoma cells [J]. British Journal of Pharmacology, 2007, 150(2): 209 − 219. doi: 10.1038/sj.bjp.0706972 [26] TAKEI T, YOSHIDA M, OHNISHI-KAMEYAMA M, et al. Ergosterol peroxide, an apoptosis-inducing component isolated from Sarcodon aspratus (Berk.) S. Ito [J]. Bioscience Biotechnology & Biochemistry, 2005, 69(1): 212 − 215. -




 下载:
下载: