-
桉树(Eucalyptus spp.)原产于澳大利亚,具有树形高大、生长迅速、轮伐期短及用途广泛等特点,已成为全球许多地区的优良经济树种[1]。随着桉树人工林的大面积推广种植,病虫害问题也日益突出,对桉树的生长和生态环境造成了严重威胁。近年来,桉树人工林的病虫害种类显著增多,常见虫害包括为害枝干的天牛类、小蠹类、蝙蝠蛾类和透翅蛾类等钻蛀性害虫[2]。其中,桉蝙蛾(Endoclita vietnamensis)是目前已知危害树种最多的钻蛀性害虫之一,作为一种典型的本土昆虫转移寄主危害外来引种树种桉树,主要危害一至二年生的速生人工桉树林。其幼虫钻蛀树干取食危害,形成无法愈合的蛀道,严重影响桉树的木材产量和质量,给广西桉树人工林产业带来了巨大的经济损失和生态环境破坏[3]。
尽管桉蝙蛾的危害日益严重,但国内外关于其生殖系统的研究较少。国外研究主要集中在桉蝙蛾的空间分布和危害监测方面,如Nair[4]报道了其在印度东部、缅甸和泰国危害柚木(Tectona grandis)的情况,但缺乏对其生殖系统的深入研究。在繁殖能力方面,研究表明雌虫能边飞翔边产卵,产卵期为9~10 d,单雌怀卵量高达7 000~13 000粒,远超其他同为鳞翅目(Lepidoptera)的昆虫[5]。此外,桉蝙蛾的取食行为和空间分布也受到了关注,研究发现其是一种高度多食性的本地物种,已将桉树作为主要寄主,并且其空间分布模式与其生物学特征密切相关[6]。
昆虫的生殖系统结构和发育过程与其繁殖能力密切相关。研究表明,昆虫的生殖系统在不同目、科、种之间存在显著差异,这些差异反映了昆虫在进化过程中对不同生态环境的适应[7]。例如,膜翅目(Hymenoptera)胡蜂科(Vespidae)的雌性成虫产卵器特化为防御武器螫,而鞘翅目(Coleoptera)瓢虫科(Coccinellidae)昆虫的产卵器则无此特化现象[8]。昆虫的繁殖能力不仅取决于其生殖系统的结构,还与生殖系统的发育过程密切相关。昆虫的生殖系统发育过程通常受到多种因素的影响,包括营养状况、环境条件和交配行为等[9]。例如,脂肪体是昆虫生长、变态、生殖等生理机能的重要组织,其在昆虫生命活动过程中提供营养物质和代谢产物,并具有解毒作用[10]。交配行为对昆虫生殖系统发育的影响也备受关注。许多研究表明,交配行为可以加速昆虫生殖系统的发育进程,提高产卵量和受精率[11]。
鉴于桉蝙蛾的繁殖能力较强,且其生殖系统结构特点尚不明确,本研究通过对桉蝙蛾雌性成虫生殖系统的解剖、图像采集和结构观察,明确其生殖系统结构及其发育过程。这不仅有助于完善桉蝙蛾的形态特征研究,还对明确其生活习性、交配行为、发生规律和发展动态具有重要意义,为桉蝙蛾的监测预报和有效防控提供科学依据。通过深入了解桉蝙蛾雌性生殖系统的发育规律,可以确定最佳防治时期,为制定综合防控策略提供理论支持。
-
本研究的桉蝙蛾源于2024年11月至12月采集自广西壮族自治区黄冕林场范围内的8至10龄幼虫。幼虫在实验室中基于一种人工饲养专利技术饲养[12],直至羽化。饲养条件为全暗环境,温度23±2 ℃,湿度70%至80%,每15 d更换一次饲料。幼虫化蛹后,按性别特征(雌性腹部第8节间“人”字纹路,雄性腹部第9节生殖孔)分装于塑料试管,置于全暗,温度25±2 ℃,湿度80%~90%的环境中。待蛹色转为黑褐色时,将雌雄蛹分别移至羽化笼中羽化。实验选取1、3、5、7日龄未交配及交配后3日龄的桉蝙蛾雌性成虫作为供试对象。每个日龄组别及交配后3日龄的雌蛾分别解剖观察5头,所有个体均来自同一批次羽化且饲养条件一致的群体。
-
将成虫置于密闭容器内,加入蘸有乙酸乙酯的脱脂棉进行麻醉,待其失去行动能力后取出。剪去触角、足、翅等附肢,用清水或乙醇清洗体表鳞片,减少解剖干扰。将虫体背向上固定于解剖蜡盘,倒入任氏液覆盖虫体。用解剖剪刀从尾部沿中线剪至胸部,再横向剪开胸部与腹部连接处,形成“T”形切口。展开背部体壁并固定,暴露内脏。用滴管吸取任氏液冲洗内脏脂肪体,清晰显露生殖器官相连的气管和脂肪体,随后用镊子小心去除多余组织。完整分离内、外生殖系统后,将其置于盛有任氏液的透明解剖盘中,再次冲洗,去除多余脂肪体和肌肉,直至器官结构清晰。桉蝙蛾雌性生殖系统位于腹部后端,结构复杂且器官细小,尤其侧输卵管韧性较差,在常规解剖路径下极易断裂或缺失,影响整体结构的完整性。此外,脂肪体丰富、气管缠绕严重,增加了目标器官的分离难度。选择从腹部背面尾端向胸部纵向剪开,避开侧输卵管附着点,有效减少了器官损伤。同时,使用任氏液冲洗并辅以显微镊精细剥离,提高生殖器官的完整暴露率。对照相关文献,初步确定桉蝙蛾雌蛾生殖系统的主要器官。若后续实验已明确主要生殖器官,此步骤可省略。
-
在图像采集与观察过程中,将样本置于LED高透光拷贝台(A3)上,调整亮度至器官形态清晰可见。使用佳能EOS单反相机拍摄完整的生殖系统图像,并采用超景深三维显微系统VHX−600捕捉内生殖器官的细节图像,以便进行对比分析。
-
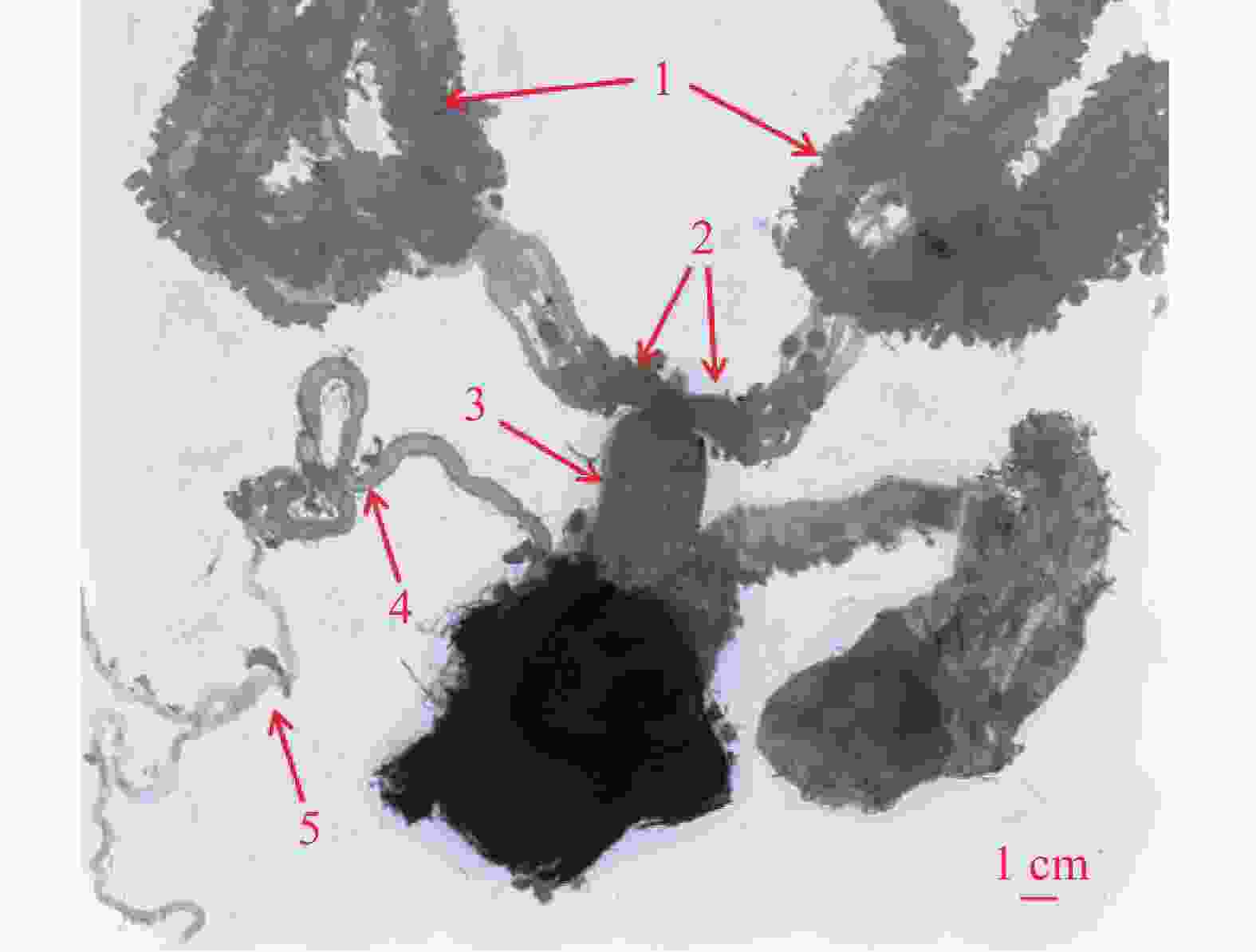
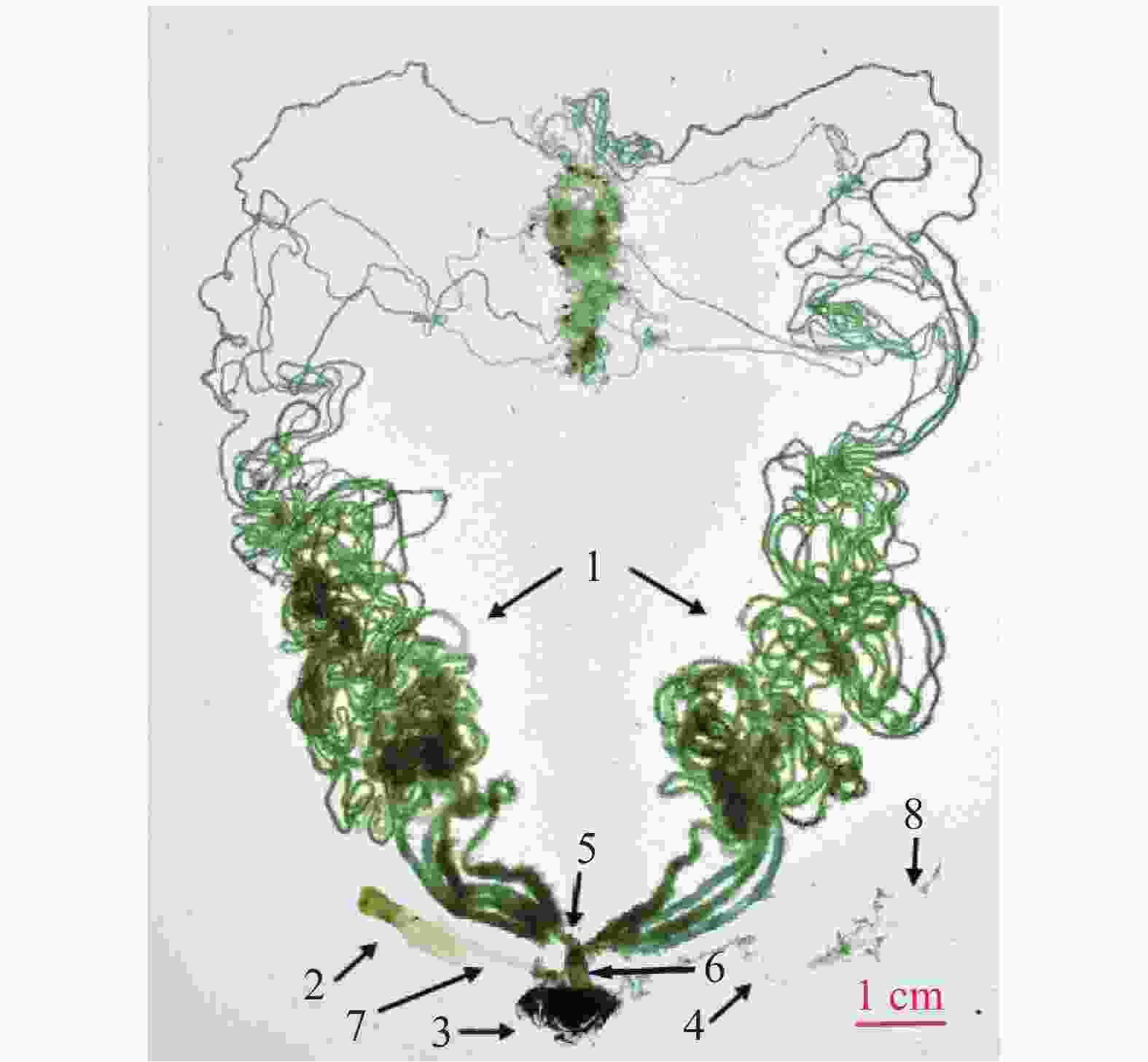
桉蝙蛾雌性生殖系统位于腹部第1节至第9节,包括内生殖器和外生殖器。其中,外生殖器由产卵器(ovipositor)、交配囊(copulatory bursa)以及附属的产卵瓣(valvulae)、产卵孔(oviporus)、交配囊管(ductus bursae)组成;内生殖器由卵巢(ovary)、中输卵管(common oviduct)、侧输卵管(lateral oviducts)和受精囊(spermatheca)以及附属的受精囊腺(spermathecal gland)组成(图1)。
-
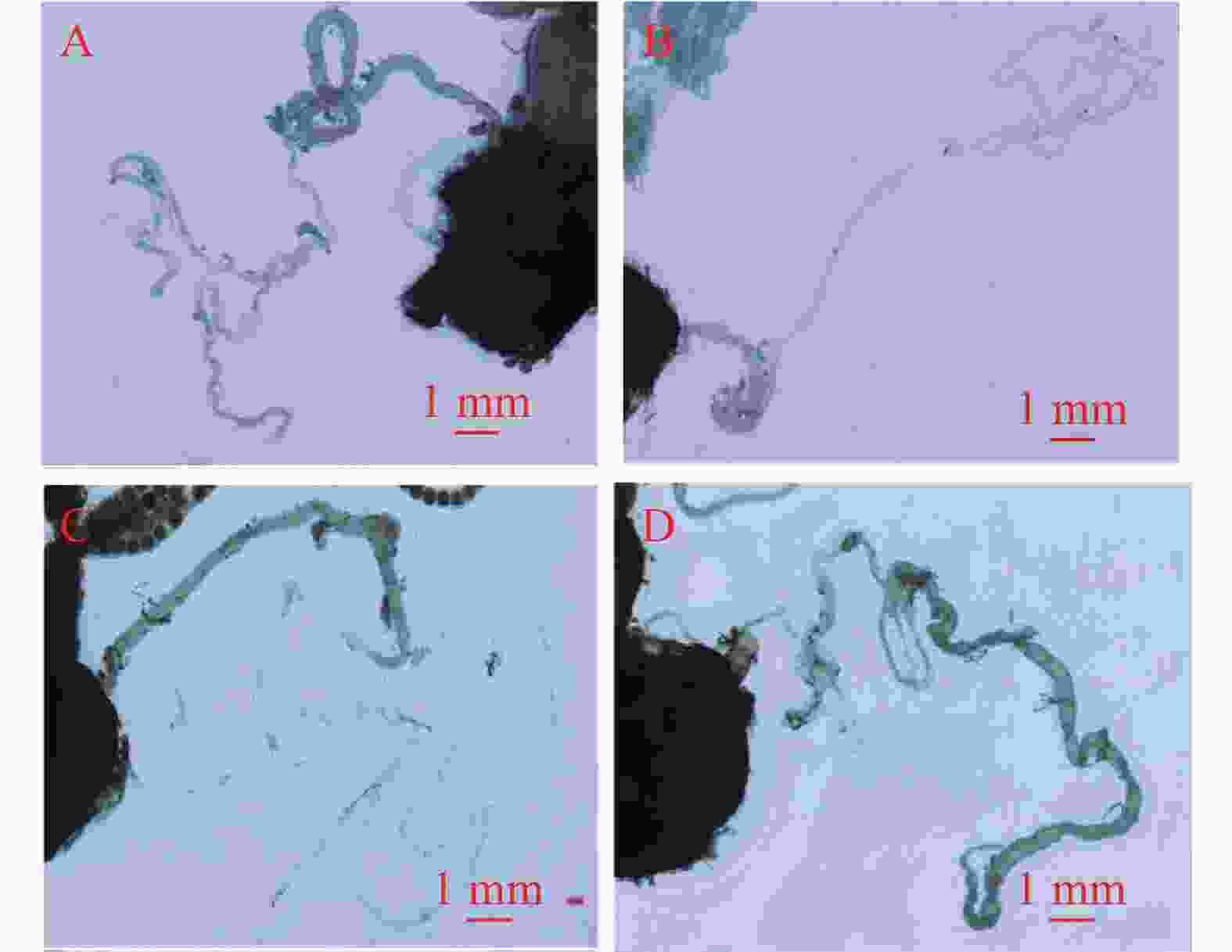
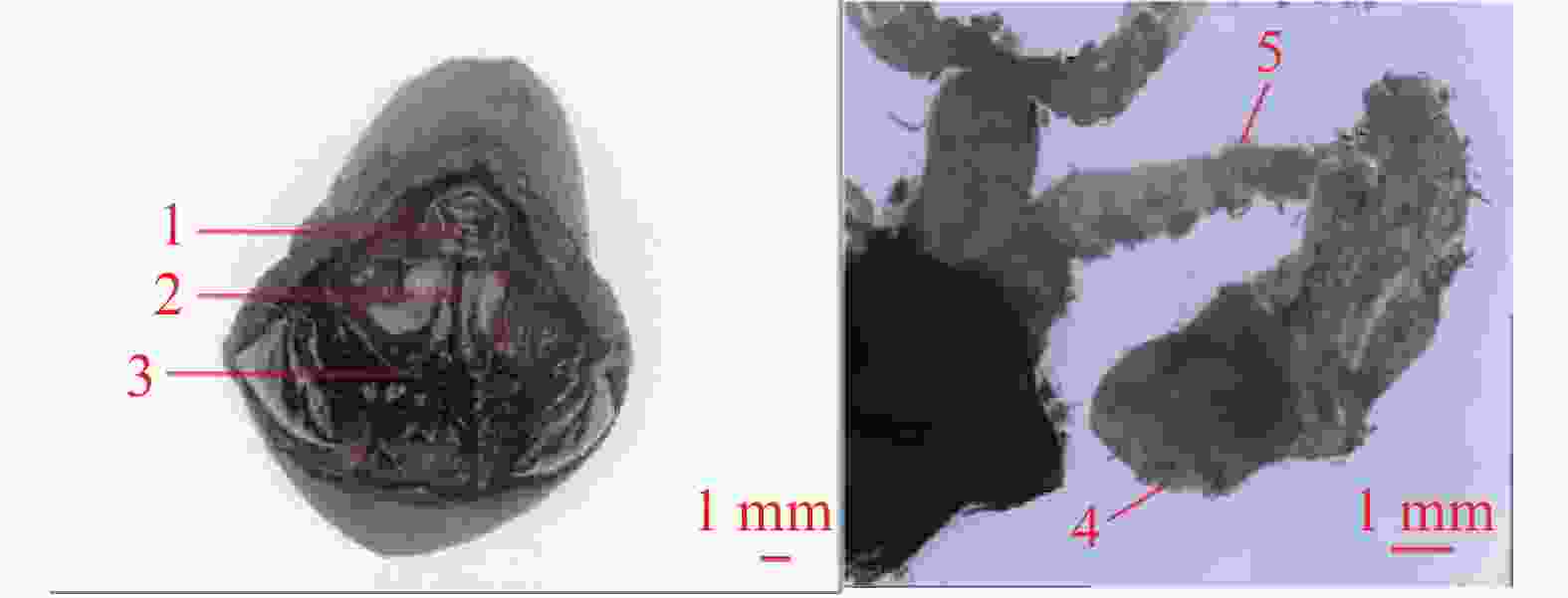
交配囊靠近腹部背面,从尾部延伸至第4腹节,呈淡黄色长袋状,由交配囊管与交配孔相连。交配囊管同样位于腹部背面,呈淡黄色圆筒形,通过蠕动、皱缩进行运动。交配囊与交配囊管具有良好的弹性和韧性,延展性强。未交配雌蛾的交配囊空瘪且透明度高(图2),而交配后的雌蛾交配囊则膨大,透明度低且表面紧绷,交配囊管也膨大,其中的精包隐约可见。交配雌蛾解剖后可观察到大量呈团状或块状排列的白色精子。精包呈乳白色,具有弹性特征,形状为扭曲的棒状,尾部逐渐变细,精包体与精包管之间没有明显界限(图3)。第8腹节腹板呈元宝形,正面有“山”字形结构,中间有一峰突,两侧有拇指状骨片指向峰突。峰突位于骨板上,与漏斗状的交配孔相扣合。若将该结构向腹面拉开,则可露出凹陷处,即交配囊导管的开口—交配孔(图2)。
-
产卵器位于第9腹节。从尾部正面观察,第8腹节背板相互接合形成圆弧形横片的肛乳突,肛孔则隐藏于其下方。肛孔下方有1处突起盖在1道横缝上,该横缝为产卵孔。交配孔与产卵孔之间,可见由第9腹节体腔膜形成的3块略骨化的皱起,其下方有1处横的唇形膜。此膜下为1特殊通道,即导精沟,交配囊中的精子可沿此沟转移入受精囊体内(图2)。
-
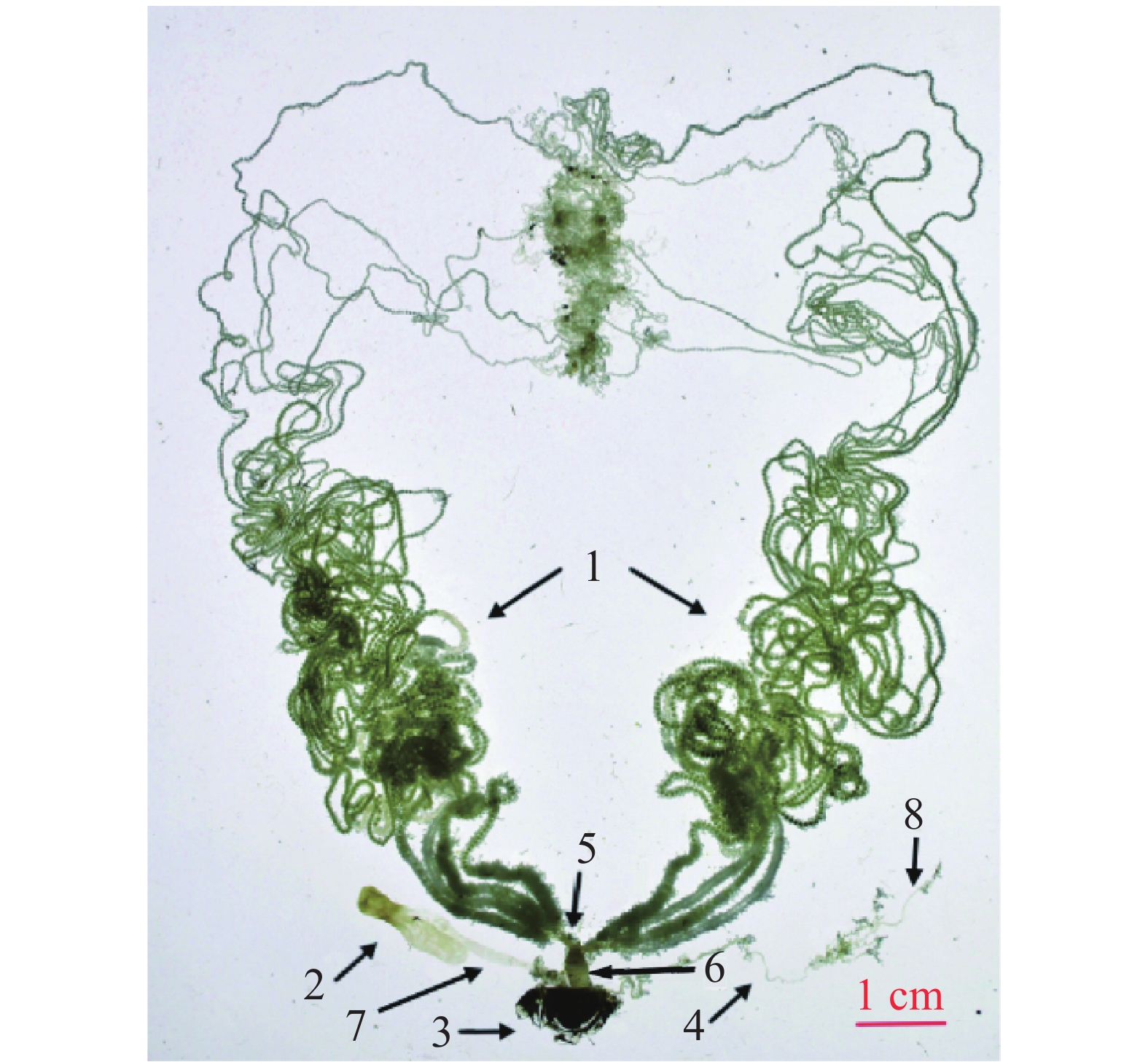
桉蝙蛾雌性成虫具有左右对称的一对多滋式卵巢,每侧卵巢包含4支卵巢管。卵巢管间缠绕有微气管和脂肪体,顶端可达第2腹节。卵巢管发达且弯曲盘绕,管壁薄而透明,细长且弹性差,越接近端丝部分越细。卵巢管中的卵随成熟程度不同呈现白色、浅黄色或黑色,基部常被丰富簇状脂肪体包裹,并汇合于侧输卵管(图4)。
-
中输卵管靠近腹部腹面,呈半透明乳白色,较侧输卵管粗短。从中部延伸至第8腹节,前端连接两侧输卵管,后端通向生殖腔,并经产卵孔开口于体外,与左右两束侧输卵管连通呈“Y”字形(图4)。
-
左右两侧各有一根较短的侧输卵管,附着于腹面体壁,呈半透明乳白色,基部膨大,前端直接与卵巢相连,后端汇合于中输卵管。管状结构韧性一般,是连接卵巢与中输卵管的重要通道(图4)。
-
受精囊位于中输卵管底部附近,靠近产卵口,呈细小透明管状,具有良好的弹性和伸缩性。其管体肾形,与受精囊管呈“S”形扭曲。受精囊端部延伸出一根细长的受精囊腺,腺体中部分叉,具有分泌功能,为精子提供营养和保护(图4)。
-
本试验共解剖并观察了不同日龄的雌性桉蝙蛾25头(其中1日龄5头、3日龄5头、5日龄5头、7日龄5头、交配后3日龄5头)。通过对其交配囊颜色变化、卵巢管粗细、卵粒颜色分布、脂肪体状态等指标的对比分析,发现同一日龄组别内各雌蛾生殖器官的形态特征高度相似,仅存在轻微个体差异,表现为卵巢管增粗程度略有不同、脂肪体饱满度存在微小波动等。
-
(1)交配囊
1日龄雌蛾的交配囊呈浅黄色,周围脂肪体丰满,透光性低,囊壁较厚且形态饱满。3日龄交配囊转为黄褐色,脂肪体依然饱满,但透光度稍低,体积较1日龄时膨大,囊壁也有所增厚。至5日龄,交配囊变为褐色,周围的脂肪体开始减少,透光度增加,囊壁变薄。7日龄交配囊呈深褐色,脂肪体进一步减少,透光度持续升高,囊壁变薄且出现轻微萎缩迹象(图5)。
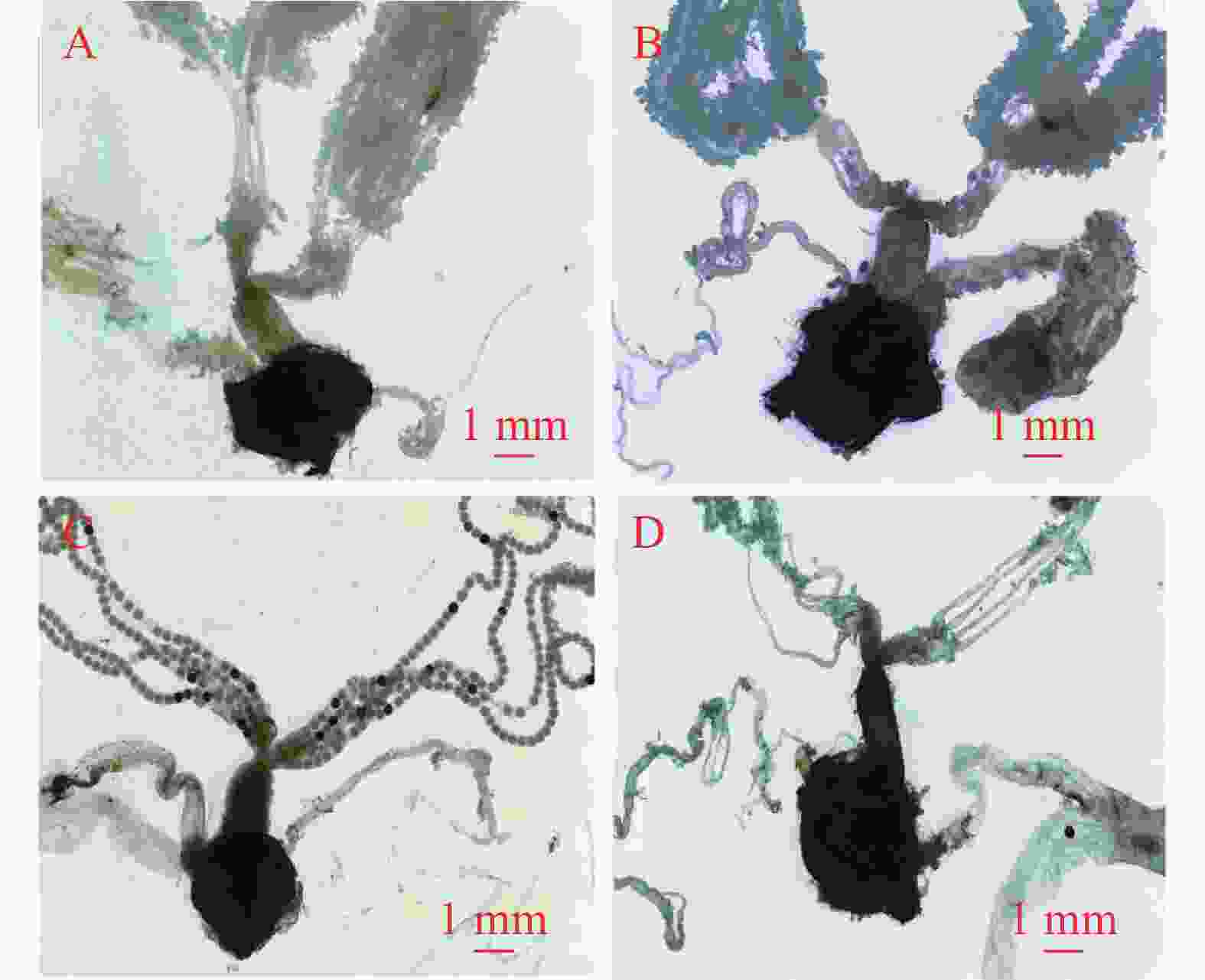
图 5 不同日龄未交配雌蛾性生殖系统的主要器官
Figure 5. The main organs of the reproductive system of unmated female E. vietnamensis at different days of age
(2)靠近侧输卵管的卵巢管
1日龄雌蛾靠近侧输卵管的卵巢管较细小,附着较多饱满脂肪体,卵粒较少。3日龄时,卵巢管增粗,脂肪体数量增多且饱满,卵粒数量增加,管内排列着白色卵粒。5日龄时,卵巢管进一步增粗,但脂肪体数量较3日龄减少且变得干瘪,管内卵粒排列紧密,部分呈黑色。7日龄时,卵巢管变细,脂肪体稀少且干瘪,弹性差、易变形,卵粒数量减少(图5)。
(3)中输卵管
1日龄雌蛾的中输卵管呈淡黄色,内有少量白色卵粒,分布稀疏,空隙较大。3日龄时,中输卵管变为乳白色,卵粒以白色和黄色为主,数量较前一日龄增多,排列较密,管壁增厚。5日龄时,中输卵管呈褐色,卵粒排列紧密,黑色和黄色卵粒数量增加,管壁开始变薄。至7日龄,中输卵管颜色加深为深褐色,出现轻度萎缩,内部几乎无卵粒残留(图5)。
(4)受精囊
1日龄雌蛾的受精囊为乳白色,表面光滑;3日龄时变为浅黄色,表面变得不平整;5日龄时呈褐色,表面不平整并出现萎缩迹象;至7日龄,受精囊仍为褐色,但脂肪体附着减少,表面内陷且萎缩明显(图6)
-
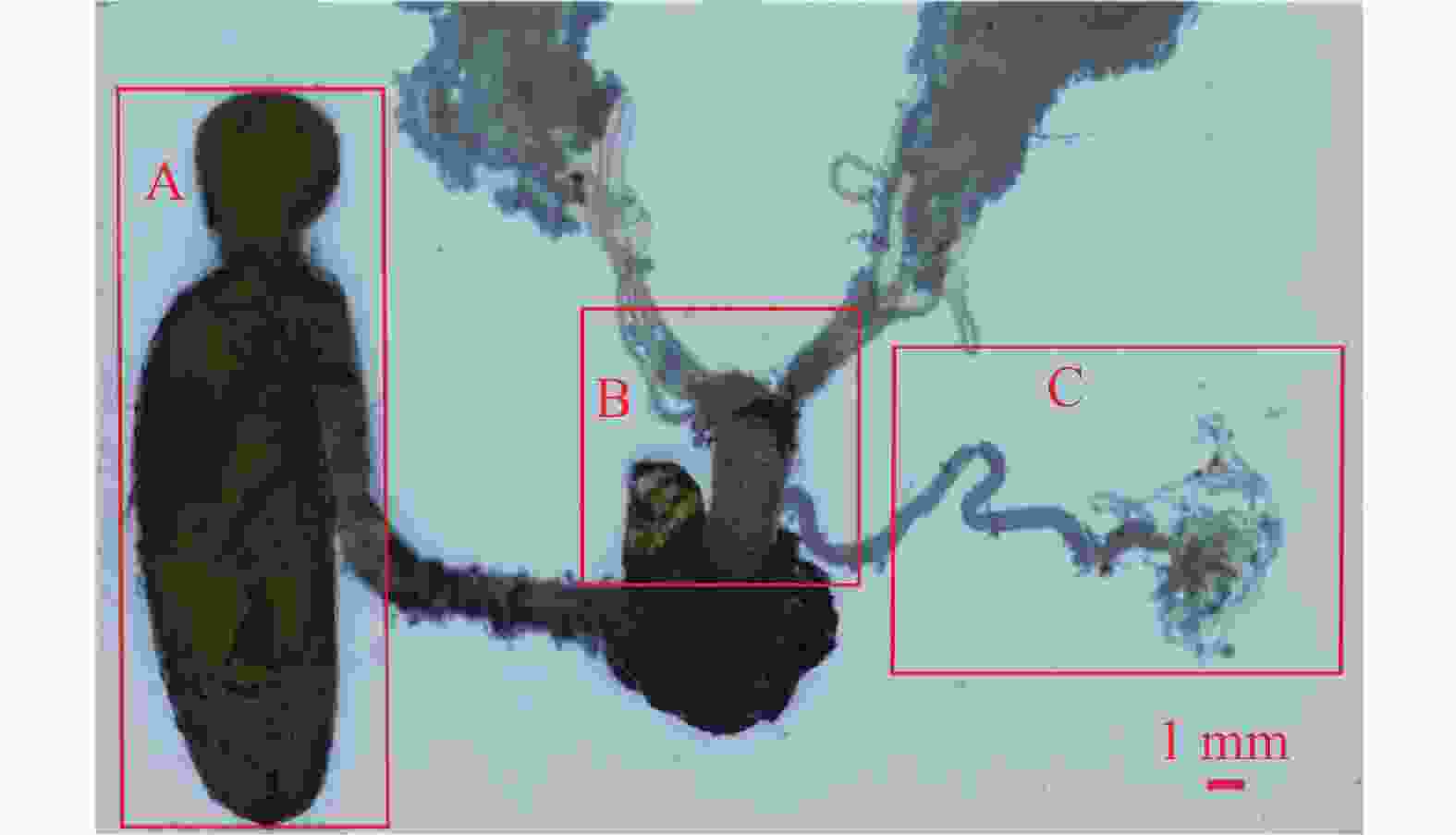
交配后的3日龄雌蛾内生殖器变化显著。其脂肪体数量较同日龄未交配个体明显减少,形态干瘪;靠近侧输卵管的卵巢管变得细小且易变形,管壁变薄,内部卵粒稀少且多不成熟(图7)。侧输卵管和中输卵管均呈乳白色,出现一定程度的萎缩,管壁变薄,内部卵粒数量减少;受精囊则保持乳白色,表面光滑。交配囊显著膨大,透明度降低,表面紧绷,其上附着少量微气管,交配囊管也呈现膨大状态,内部精包隐约可见(图8)。
-
昆虫生殖系统的结构与其繁殖能力密切相关,不同种类之间在器官组成和功能上存在显著差异,尤其在目级分类单元中表现尤为明显[7]。本研究通过解剖观察桉蝙蛾雌性成虫生殖系统,并参考同属蝠蛾科的白马蝠蛾(Hepialus baimaensis)、湖南棒蝠蛾(Napialus hunanesis)和玉龙蝠蛾(Hepialus yulongensis)的相关研究[13-15],发现其外生殖器包括产卵瓣、产卵孔、交配囊、交配囊管及交配孔,内生殖器则由一对发达的多滋式卵巢、一根中输卵管、两根侧输卵管及一个受精囊组成,整体结构与湖南棒蝠蛾最为相似,主要区别在于交配囊的附着位置及精包颜色:桉蝙蛾交配囊位于腹部背面,精包呈乳白色;而湖南棒蝠蛾交配囊位于腹部腹面,精包呈淡黄色。
昆虫附腺通常分泌胶状黏性物质,有助于卵的固定与保护[16]。然而,桉蝙蛾与湖南棒蝠蛾一样缺乏附腺,其产出的卵光滑、坚硬且相互不粘连,进一步验证了这一结构特征。结合前人研究中提到的产卵行为(边飞行边产卵)[5]和本研究对生殖系统结构的观察,推测这种生理和行为特性共同作用,可能是其种群迅速扩增的重要原因。本研究表明桉蝙蛾雌蛾与苹果蠹蛾类似,具有一对发育良好的多滋式卵巢[17],并被大量脂肪体和微气管紧密包裹,这种结构不仅提供了物理保护,也可为持续产卵提供营养支持。脂肪体作为昆虫体内重要的代谢组织,承担着营养储存、能量供给以及解毒等多种生理功能[9]。随着日龄增长,脂肪体逐渐减少,说明其在羽化后的生殖和代谢活动中被大量消耗。因此,调控脂肪体含量或结构可能成为抑制桉蝙蛾生长发育的有效途径,但这需要进一步研究以明确其具体机制。交配后3日龄雌蛾的脂肪体减少更为明显,各器官普遍出现萎缩趋势,这可能是因为交配行为加速了脂肪体的消耗。交配囊及其导管富有弹性与延展性,交配后可充盈膨大、内部精子以块状或团状形式储存,可能是其高繁殖力的关键因素之一。此外,交配后个体的侧输卵管柔韧性下降,卵巢萎缩更明显,脂肪体发黄且数量减少,这些变化进一步表明交配行为对生殖系统的影响。结合高根银[11]关于家蚕雌蛾成熟度与产卵量关系的研究推测,交配行为可能加速了桉蝙蛾雌蛾生殖系统的发育进程,促使其尽快达到最大产卵量与受精率。
在实验方法方面,本研究参考了鳞翅目其他科昆虫的生殖系统研究方法[18-20],针对桉蝙蛾雌蛾生殖器官的特殊性,优化了解剖路径:由于其侧输卵管韧性较差,若从腹部腹面向胸部纵向剪开易造成器官断裂或缺失,故选择从腹部背面尾端向胸部纵向剪开,能更完整地分离出整个生殖系统。图像采集采用单反相机拍摄整体结构与显微镜系统拍摄局部细节相结合的方式,全面展示了其生殖系统结构。
尽管如此,本研究仍存在一定局限。所选雌蛾日龄仅为1、3、5、7日龄,未能涵盖连续日龄,难以准确判断卵巢发育成熟及衰退的具体时间点;其次,仅着重剖析主要生殖器官的特点,诸如部分神经组织及其他细小附属结构等,虽与生殖生理活动存在潜在关联,但尚未在本研究中进行深入探究;再者,每次解剖样本数量有限,实验重复量不足以完全排除个体差异,且样品无法长期保存,限制了后续研究的开展。建议后续研究选取连续日龄的雌蛾样本,区分交配与未交配个体进行对照分析;增加样本数量与重复次数,提升数据代表性;同时探索标本保存技术,为深入解析桉蝙蛾生殖系统发育规律提供基础材料。
-
本研究通过解剖、图像采集和结构观察,详细探究了桉蝙蛾雌蛾生殖系统的结构特点及其随日龄增长和交配状态的变化规律。结果表明,桉蝙蛾雌性生殖系统由内生殖器和外生殖器组成,外生殖器包括产卵器、交配囊、交配囊管等结构,内生殖器则由卵巢、输卵管、受精囊及其附属腺体构成。随着日龄增长未交配雌蛾的生殖系统各器官呈现显著变化,交配后3日龄雌蛾的生殖系统也表现出明显变化。本研究明确了桉蝙蛾雌蛾生殖系统的结构特点及其发育规律,为掌握其繁殖特性、生物学及发生规律提供了科学依据。前期研究认为羽化后1~5 d的成虫可作为潜在的防治时期,但为进一步深入探究其生物学特性及发生规律,需开展更具针对性的研究,如探究不同防治方法在各日龄成虫及幼虫阶段的应用效果等。
The female reproductive system and age-related changes of Endoclita vietnamensis
-
摘要: 为明确桉蝙蛾雌蛾生殖系统的结构特点及其发育规律,本研究通过对桉蝙蛾雌性成虫生殖系统的解剖、图像采集和结构观察,分析其生殖系统的主要器官及其发育过程。结果显示,桉蝙蛾雌性生殖系统由内生殖器和外生殖器组成,其中外生殖器包括产卵器、交配囊等,内生殖器包括卵巢、输卵管等。随着日龄增长,未交配雌性桉蝙蛾的交配囊、卵巢管、输卵管和受精囊呈现出显著的形态变化;交配后3日龄雌性桉蝙蛾的生殖系统也表现出明显变化,如卵巢管变细、输卵管萎缩、脂肪体减少等。本研究为掌握桉蝙蛾繁殖特性、生物学及发生规律提供了科学依据,有助于进一步研究其生活习性和交配行为。Abstract: To clarify the structural characteristics and development of the female reproductive system of Endoclita vietnamensis, the main organs of E. vietnamensis and their developmental processes were analyzed through dissection, image acquisition, and structural observation of the reproductive system of female adults. The results indicated that the female reproductive system of E. vietnamensis comprises internal and external genitalia, with the external genitalia including the ovipositor and copulatory bursa, and the internal genitalia including the ovary and oviduct. With an increase in age, significant morphological changes occurred in the copulatory bursa, ovarian tubes, oviducts, and spermatheca of unmated female E. vietnamensis. Moreover, the reproductive system of mated 3-day-old female E. vietnamensis exhibited marked changes, such as thinned ovarian tubes, shrunken oviducts, and reduced fat bodies. These findings provide a scientific basis for understanding of the reproductive characteristics, biology, and occurrence patterns of E. vietnamensis, facilitating further research into its life habits and mating behaviors.
-
-
[1] 叶玲, 陈彬鑫, 苏维剑, 等. 桉树的生长特性与种植管理技术初探[J]. 南方农业, 2021, 15(21): 79−80. https://doi.org/10.19415/j.cnki.1673-890x.2021.21.038 doi: 10.19415/j.cnki.1673-890x.2021.21.038 [2] 韦志霄. 广西地区桉树常见病虫害防治技术[J]. 南方农业, 2021, 15(14): 19−20. https://doi.org/10.19415/j.cnki.1673-890x.2021.14.009 doi: 10.19415/j.cnki.1673-890x.2021.14.009 [3] 杨秀好, 罗基同, 吴耀军, 等. 林木重大钻蛀性害虫桉蝙蛾分布与危害[J]. 中国森林病虫, 2021, 40(4): 34−40. https://doi.org/10.19688/j.cnki.issn1671-0886.20210008 doi: 10.19688/j.cnki.issn1671-0886.20210008 [4] Nair K S S. Tropical forest insect pests [M]. Cambridge, UK: Cambridge University Press, 2007: 348-353. [5] 王缉健, 杨秀好, 罗基同, 等. 桉蝙蛾生物学研究[J]. 中国森林病虫, 2015, 34(1): 9−13. https://doi.org/10.3969/j.issn.1671-0886.2015.01.003 doi: 10.3969/j.issn.1671-0886.2015.01.003 [6] Yang X H, Qin J L, Luo Y Q, et al. Geostatistical analysis of spatial distribution of Endoclita signifer larvae on Eucalyptus [J]. American Journal of Agriculture and Forestry, 2018, 6 (6): 226−236. https://doi.org/10.11648/j.ajaf.20180606.20 doi: 10.11648/j.ajaf.20180606.20 [7] 嵇保中, 刘曙雯, 曹丹丹. 昆虫生殖系统[M]. 北京: 科学出版社, 2014: 1052. [8] 谭青青. 中国胡蜂科部分代表种类形态学特征及系统发育关系研究[D]. 西安: 西北大学, 2019. [9] 葛君, 李兵, 沈卫德. 昆虫脂肪体与抗药性的关系研究现状与分析[J]. 江苏农业科学, 2010, 38(6): 183−185. https://doi.org/10.3969/j.issn.1002-1302.2010.06.071 doi: 10.3969/j.issn.1002-1302.2010.06.071 [10] 郦卫弟, 时敏, 陈学新. 颈双缘姬蜂寄生引起小菜蛾蛹脂肪体形态和超微结构的变化[J]. 昆虫学报, 2007, 50(7): 662−666. https://doi.org/10.16380/j.kcxb.2007.07.010 doi: 10.16380/j.kcxb.2007.07.010 [11] 高根银. 不同成熟度雌蛾交配对产卵和受精的影响[J]. 江苏蚕业, 2012, 34(4): 25−26. [12] 广西大学. 一种桉蝙蛾全生活史周期的人工饲养方法: 中国, 116686788A[P]. 2023-09-05. https: //pss-system.cponline.cnipa.gov.cn/documents/detail?prevPageTit=changgui. [13] 王建国, 魏洪义, 沈荣武, 等. 湖南棒蝠蛾成虫生殖系统的解剖[J]. 江西农业大学学报, 1997, 19(2): 9−12. https://doi.org/10.13836/j.jjau.1997027 doi: 10.13836/j.jjau.1997027 [14] 杨大荣, 李朝达, 沈发荣, 等. 白马蝠蛾生殖习性的研究[J]. 动物学研究, 1991, 12(4): 361−366. [15] 赵万源, 杨大荣, 沈发荣, 等. 玉龙蝠蛾生殖的观察[J]. 昆虫学报, 1989, 32(3): 382−384. https://doi.org/10.16380/j.kcxb.1989.03.023 doi: 10.16380/j.kcxb.1989.03.023 [16] 靳远祥. 家蚕雌性附腺功能蛋白质组研究[D]. 杭州: 浙江大学, 2004. [17] 刘宁, 张彩虹, 张艳, 等. 苹果蠹蛾卵成熟过程及卵巢发育分级研究[J]. 果树学报, 2018, 35(9): 1098−1104. https://doi.org/10.13925/j.cnki.gsxb.20180118 doi: 10.13925/j.cnki.gsxb.20180118 [18] 王丹. 江西省草螟亚科分类学研究(鳞翅目, 草螟科)[D]. 南昌: 江西农业大学, 2019. https://doi.org/10.27177/d.cnki.gjxnu.2019.000058 [19] 王晓芳. 中国黄粉蝶亚科昆虫雌性生殖系统研究(鳞翅目: 粉蝶科)[D]. 杨凌: 西北农林科技大学, 2010. [20] 许竟文. 日龄和交配状态对亚洲玉米螟雌蛾生殖适合度与雄蛾内生殖系统特征的影响[D]. 沈阳: 沈阳农业大学, 2020. https://doi.org/10.27327/d.cnki.gshnu.2020.000186 -




 下载:
下载: