-
肥厚型心肌病(hypertrophic cardiomyopathy,HCM)是猫最常见的心脏病,严重影响猫的健康,有研究表明,至少40%的猫猝死与心脏病(尤其是心脏纤维化)有关[1]。心脏纤维化是HCM猫心脏典型病理变化,特点为以胶原为代表的细胞外基质(extracellular matrix,ECM)合成增多、降解不足从而引起ECM蛋白过度沉积[2]。心脏成纤维细胞是参与心脏纤维化主要细胞类型,其生理状态下主要功能是产生胶原蛋白等细胞外基质成分,通过产生和降解ECM成分不断改变细胞外环境维持动态平衡,以维持心脏组织的结构和运作[3-4]。当心脏组织受到损伤或者病变时,成纤维细胞激活并参与心脏损伤后的ECM重塑,过度的反应会导致心脏发生重塑不良[5-6]。最近研究提出猫HCM的心脏纤维化病理进程由巨噬细胞驱动,活化的巨噬细胞可释放促血管生成和促纤维化的介质,诱导新的间质血管形成、成纤维细胞增殖和活化、肌成纤维细胞的发育和间质胶原的沉积[7]。现已知转化生长因子β 1(transforming growth factor beta,TGFβ1)信号通路是人心脏纤维化的主要促纤维化通路[8],通过诱导含有应力纤维的α-SMA的形成和促进ECM基因的表达,使心脏成纤维细胞活化为分泌型肌成纤维细胞。虽然已知猫的心肌病、心脏纤维化与凝血功能异常及炎症有关,但猫心脏纤维化发生的具体的病理机制尚不明确。因此,心脏成纤维细胞被认为是解释猫心脏纤维化病理机制、开发心脏纤维化的新型生物标志物的关键研究对象。目前,在小鼠和大鼠心脏中已经有成功分离原代心脏成纤维细胞并进行体外培养的报道,然而还没有研究表明已开发出猫心脏成纤维细胞模型。鉴于心脏组织获取的局限性,分离培养原代猫心脏成纤维细胞是未来建立体外心脏纤维化细胞模型的关键点。本研究将通过收集临床猫组织样本,分离培养猫心脏成纤维细胞,进行细胞形态学观察与细胞表型鉴定实验,拟用该细胞构建心脏纤维化体外模型,服务于猫心脏纤维化的临床基础研究。
-
于海口合作动物医院对意外受孕猫进行子宫卵巢摘除术,采集妊娠中期胎囊组织,迅速低温运输至实验室,用无菌器械切开胎囊获得猫胚胎。试验操作符合海南大学动物伦理操作规范。
-
电泳缓冲液、转膜缓冲液、PBS(赛维尔生物,中国);RIPA裂解液、蛋白酶抑制剂(碧云天,中国);Tween 20(源叶生物,中国);Western Blot专用抗体稀释液(博士德,中国);新西兰特级山羊血清、Advanced DMEM/F-12、新西兰特级胎牛血清、Ⅱ型胶原酶、青霉素–链霉素溶液、TrypLE™ Express酶(1×)、L-谷氨酰胺(Gibco,美国);CD31抗体(bs-019)(Bioss,美国);Vimentin抗体(V6839)、α-SMA抗体(A2547)(Sigma,德国);Image-iT™ FX信号增强剂、Goat anti-Rabbit IgG(H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor™ 568、Goat anti-Mouse IgG, IgM, IgA(H+L)Secondary Antibody, Alexa Fluor™ 488、Goat anti-Mouse IgG (H+L) Secondary Antibody,HRP(Invitrogen,美国);GAPDH Rabbit Polyclonal Antibody(10494-1-AP)(proteintech,中国);丙酮溶液(西陇科学);Tween 20(北京兰杰柯);重组人TGFβ1蛋白溶液(R&D system)
-
二氧化碳培养箱(上海力申科学仪器有限公司);Agilent BioTek Cytation 1(奥恒生物);倒置显微镜(无陌光学);全波长酶标仪(TECAN,瑞士);蛋白电泳仪(北京君意东方电泳设备有限公司);全自动化学发光系统(Tanon,中国);超净工作台(泰斯特,中国);电热恒温水浴锅(上海精宏实验设备有限公司);电子天平(上海佑科仪器仪表有限公司);移液器(Eppendorf,德国);立式压力蒸汽灭菌锅(鸡西市辰丰医疗器械制造有限公司)
-
将猫胚胎转移至细胞间内的超净工作台内,通过中线开胸方法将猫胚胎心脏从胸腔中取出。用含有1%青霉素–链霉素溶液(V/V)的预冷无菌1×PBS冲洗心脏,切除可见的大血管与心房等部分,最终获得心室肌组织。将切碎的心室肌组织碎块置于15 mL离心管中,加入3 mL无菌Ⅱ型胶原酶溶液(125 IU·mL−1,由完全培养基配制),于4 ℃消化16 h。轻柔吹散组织碎块使其尽可能溶解。将细胞悬液离心后,弃胶原酶溶液,完全培养基重悬细胞后再次离心并弃液。加入5 mL完全培养基重悬细胞,接种在T25细胞培养瓶中,于CO2培养箱内培养。每48~72 h换一次液,定期在倒置显微镜下观察细胞形态与生长变化,并拍照记录。当细胞融合度达80%~90%时,使用TrypLE™ Express消化,以1:2进行传代培养。
-
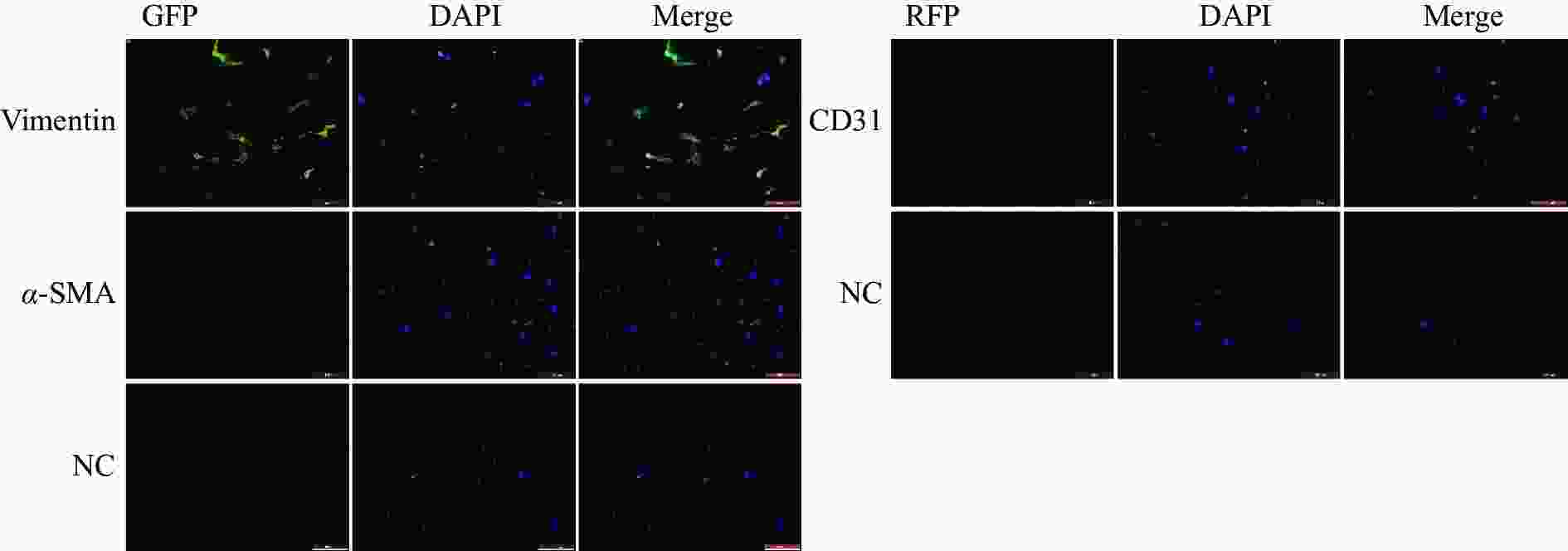
将培养至第一代的细胞进行消化与重悬,按照每孔1×104个的细胞密度接种于腔室载破片上。24 h后弃去培养基,PBS洗涤细胞3次,使用丙酮溶液在−20 ℃冰箱中固定10 min,PBS 洗涤3次。山羊血清室温封闭1 h,Image-iT™ FX 信号增强剂室温孵育30 min。利用抗体稀释液(0.1%山羊血清 + 0.1%Tween 20 + PBS)将一抗稀释至所需浓度,分别为Vimentin(V:V=1:1 600)、α-SMA(V:V=1:400)与CD31(V:V=1:100)抗体,4 ℃冰箱孵育过夜。次日PBS洗涤3次后加入荧光二抗,室温、阴湿环境中孵育 1 h。滴加含有DAPI的防荧光淬灭剂,封片剂封片后转移至BioTek Cytation 1荧光显微镜下观察。
-
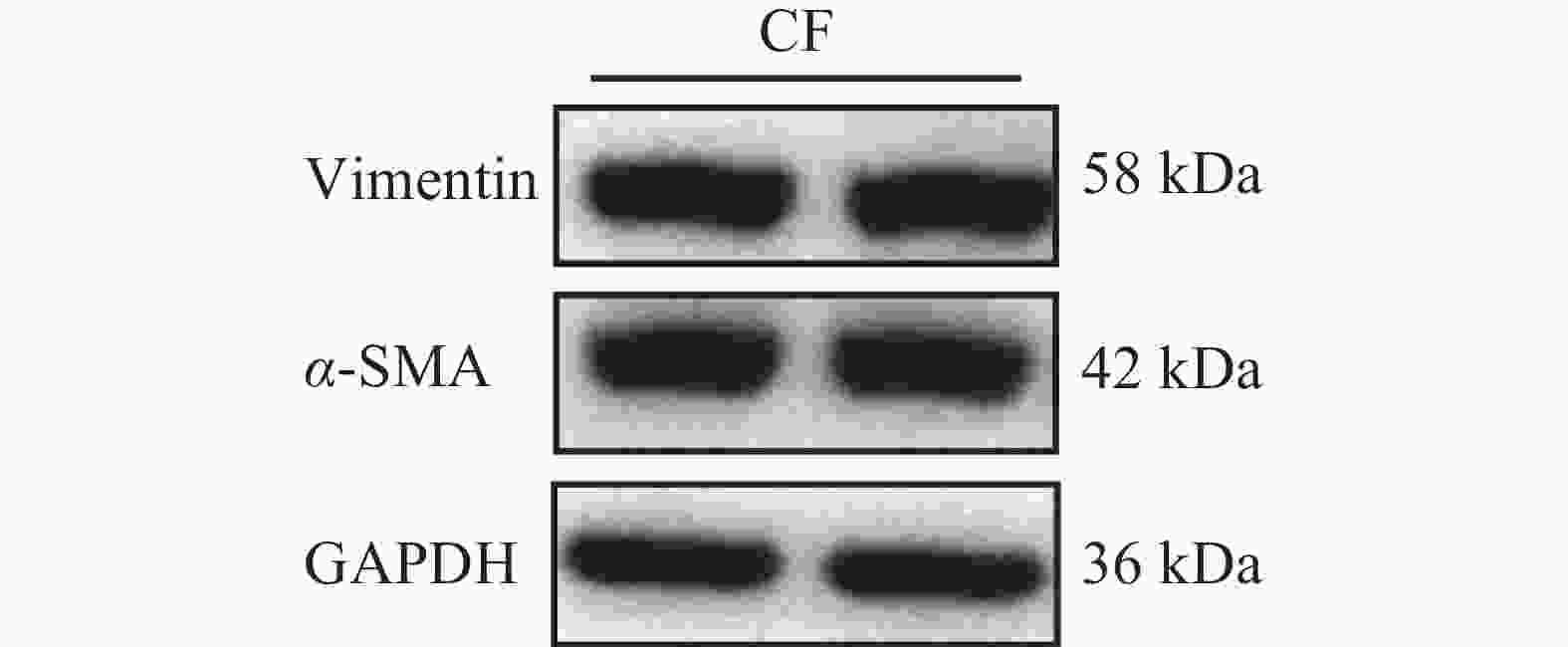
将培养至第5代的细胞进行消化与离心,使用RIPA提取细胞蛋白,按照BCA法蛋白质浓度测定试剂盒说明书测定蛋白浓度。上样体系为10 μL,用5×蛋白上样缓冲液与蛋白样本混匀,在100 ℃的条件下进行10 min变性处理。采用聚丙烯酰胺凝胶电泳技术进行蛋白质分离,电泳条件为恒压80 V,20 min,样品进入分离胶后,切换至恒压120 V电泳至分离胶底部。利用PVDF膜进行湿转印法,条件为恒压80 V,55 min。将转印好的PVDF膜取出放入封闭液[5%(V/V)脱脂蛋白粉]中,置于水平摇床上室温封闭1.5 h。将已封闭的PVDF膜浸没于目的蛋白抗体,分别为Vimentin(V:V=1:2 000)与α-SMA(V:V=1:2 000),内参蛋白为GAPDH(V:V=1:10 000),条件为4 ℃冰箱孵育16 h。最后使用ECL发光液进行显影,将其均匀涂在 PVDF 膜上后,利用全自动化学发光系统进行曝光。Vimentin与α-SMA的曝光时间为0.5 s。
-
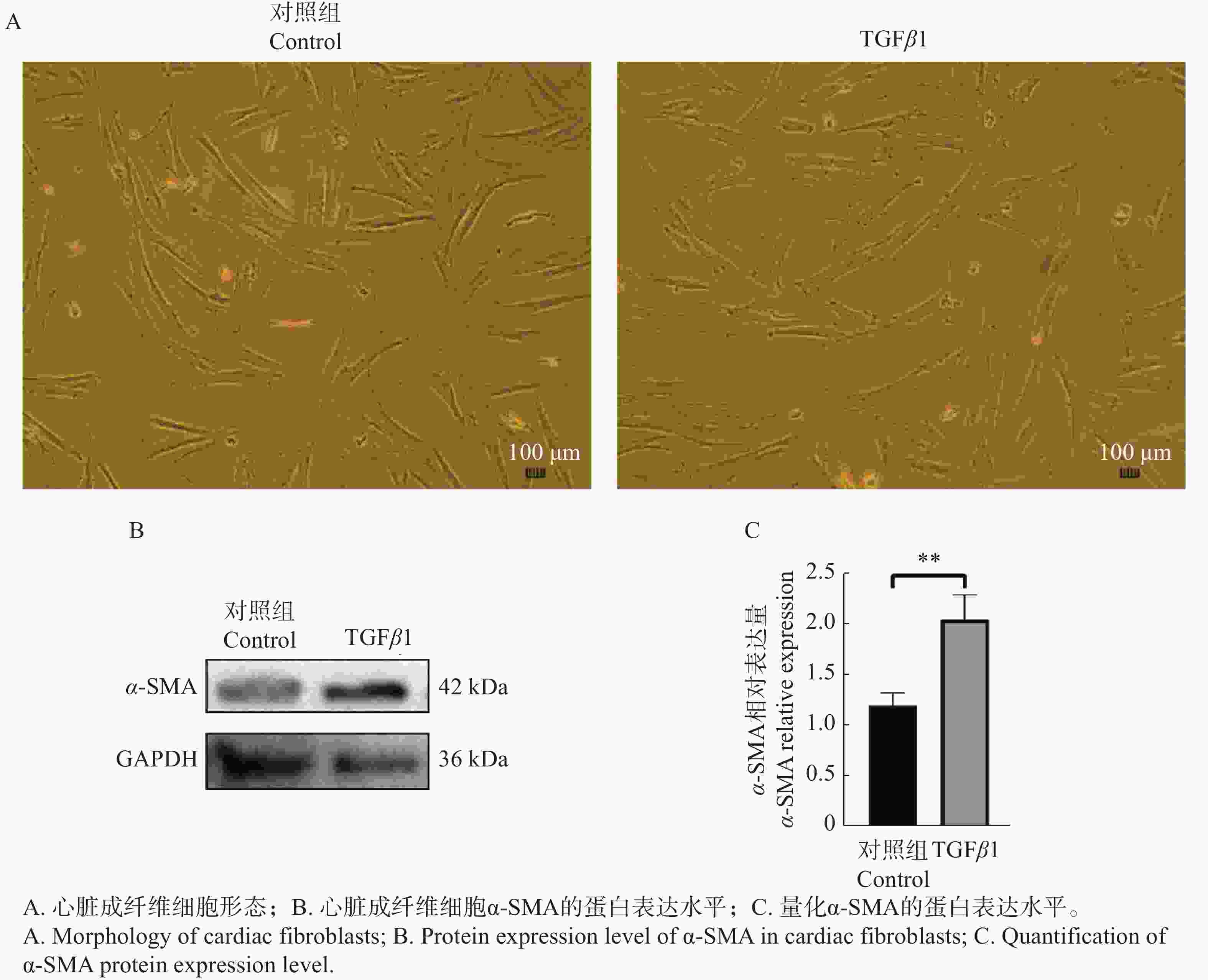
将冻存的第2代猫心脏纤维细胞复苏培养,直至细胞达到90%融合度(V/V)。消化并收集细胞,将细胞传代于T25细胞培养瓶,用于后续细胞刺激试验。当细胞融合度为80%(V/V),将细胞完全培养液换为不含胎牛血清的细胞培养基,饥饿处理24 h。处理组细胞培养瓶中滴加配置好的TGFβ1溶液(TGFβ1最终在培养基内质量浓度为5 ng·mL−1),以8字法将培养液与试剂充分混匀,对照组添加等量不含胎牛血清的细胞培养液。在48 h后收集对照组与处理组样本的细胞沉淀,保存于−80 ℃冰箱,后续用于蛋白免疫印记试验。使用ImageJ软件计算目的蛋白与内参蛋白条带的灰度值,利用软件GraphPad Prism 9.0 建立柱状图。
-
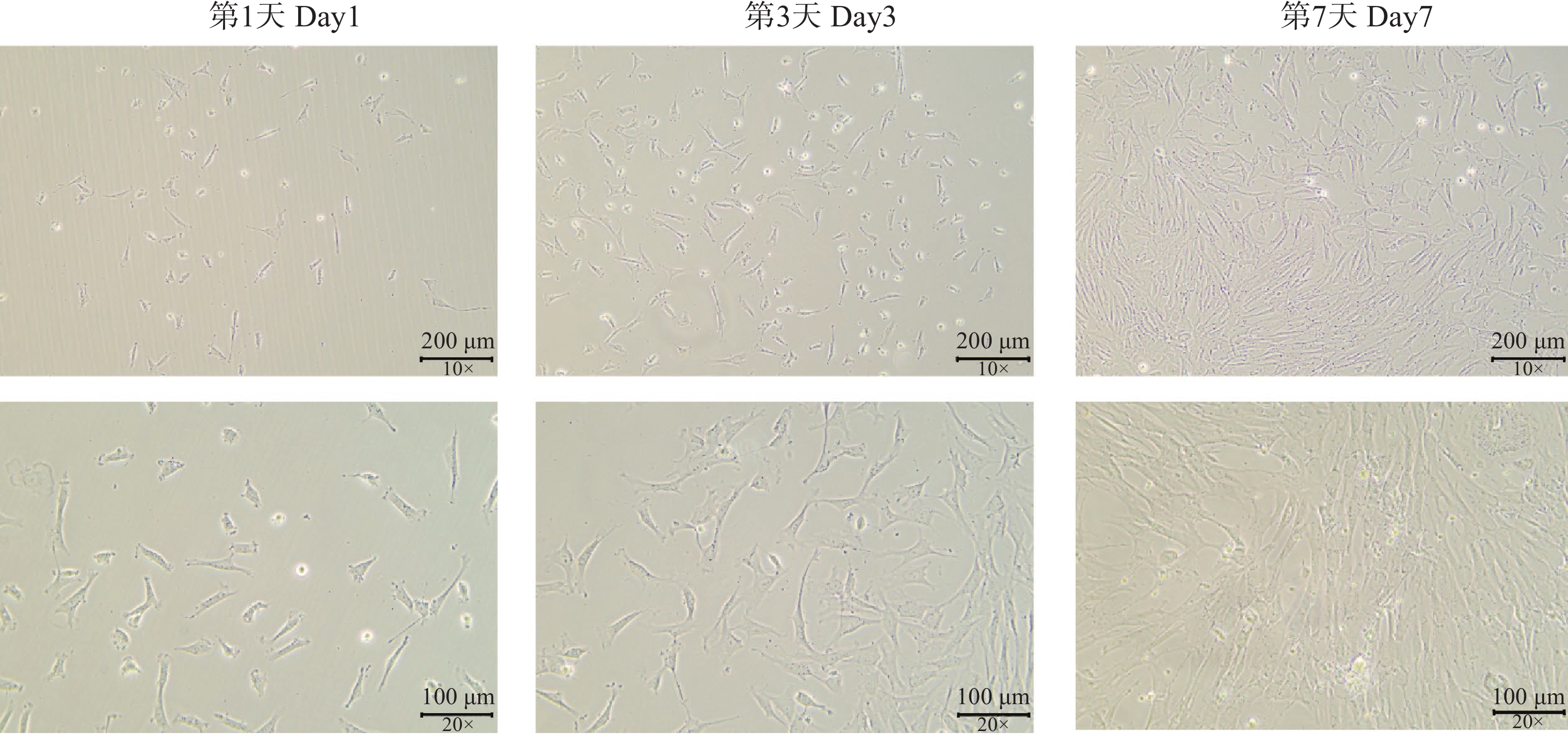
分离所得细胞在倒置显微镜下观察(图1)呈梭形、不规则三角形、多角形和扁平星形,中央有卵圆形核,胞质突起,生长时呈放射状,符合间充质细胞形态。细胞在体外培养第3天时开始出现明显增殖,体外培养第7 天时细胞融合度可达到80%(V/V)。细胞传代至第5~6代时,增殖速率显著减慢,细胞个体增大。
-
免疫荧光染色结果显示,成纤维细胞标志物Vimentin在细胞中呈阳性表达,且荧光信号较强,成纤维细胞活化的标志物α-SMA在部分细胞中呈阳性表达,内皮细胞标志物CD31为阴性表达(图2)。免疫印记结果显示Vimentin与α-SMA蛋白表达皆为阳性(图3)。实验结果表明,该细胞表型鉴定结果为心脏成纤维细胞。
-
心脏成纤维细胞在经过48 h的TGFβ1刺激后,从细胞形态学上并未观察到明显的变化,蛋白免疫印记结果显示α-SMA蛋白表达水平升高(图4)。
-
本实验使用酶消化法对原代猫心脏成纤维细胞进行体外分离,并实现了稳定传代培养,结合细胞形态学与细胞特征标志物鉴定,可判定分离培养的细胞符合原代心脏成纤维细胞特征。经TGFβ1诱导后,活化的成纤维细胞标志物α-SMA蛋白在刺激48 h后表达水平升高,说明TGFβ1刺激促进了猫原代心脏纤维细胞的活化。该细胞可用于猫的心脏纤维化体外研究,为进一步了解猫心脏纤维化发病机制奠定基础。
研究心脏纤维化需要大量的临床样本支持,但由于心肌组织采样损伤大,在临床实践中往往较难获得,样本数量受限。在实验动物“4R”原则中,呼吁人类增强伦理观念,倡导应用无知觉材料替代有知觉动物的方法[9]。建立心脏纤维化体外模型,替代实验动物,可缓解猫与人类心脏纤维化研究面临的临床样本稀缺问题。基于心脏成纤维细胞在心脏纤维化中所起的关键作用,体外培养心脏成纤维细胞建立心脏纤维化模型是常用手段,从小鼠与大鼠上已成功分离培养了心脏成纤维细胞。分离培养心脏成纤维细胞结果表明,细胞形态呈纺锤形,连续传代至第3代,细胞始终保持其特征性的梭形外观[10]。本研究观察到细胞胞体呈梭形、不规则三角形、多角形和扁平星形,中央有卵圆形核,胞质突起,生长时呈放射状,符合心脏成纤维细胞的形态。Vimentin是一种中间丝蛋白,是间充质细胞谱系的典型标志物,也是心脏成纤维细胞最敏感、最经典的标志物[11]。CD31是内皮细胞的标志物,常用与Vimentin结合来区分成纤维细胞与内皮细胞[12]。表达平滑肌肌动蛋白α-SMA是肌成纤维细胞的重要特征[13],当心脏受到损伤时,成纤维细胞激活转化为肌成纤维细胞,在损伤修复中起着关键作用。具有高度收缩性的α-SMA通过特殊的细胞表面结构与ECM连接,重塑周围的ECM。本研究分离培养的细胞均表达Vimentin蛋白,并且不表达CD31蛋白,活化的成纤维细胞的标志物α-SMA仅少量呈阳性,表明分离得到纯度较高的心脏成纤维细胞。
获得纯净的成纤维细胞群体对于阐明其在修复和纤维化中的功能起到至关重要作用,最流行和最成熟的富集成纤维细胞的方法是通过酶对组织消化后进行选择性黏附,然而酶消化法也存在着无法区分静止和激活的成纤维细胞的局限性[14]。在一项心脏纤维化研究中,分离培养的新生小鼠原代心脏成纤维细胞被证明比永生化细胞系具有更好的生物学相关性[15]。但在经过两到三次传代培养后,心脏成纤维细胞易向肌成纤维细胞转分化,表现为α-SMA表达升高[16]。另有文献报道称,原代培养心脏成纤维细胞难以在细胞培养瓶中长时间维持原有的状态,是因为该细胞的表型可塑性和机械应力比较敏感[17],这与本研究在实验当中所观察到的结果相符:在实验中观察到经过传代培养后部分心脏成纤维细胞处于活化状态(α-SMA阳性),且增殖速率减缓。 Galie等[18]研究结果表明,培养基中血清含量的减少会导致大鼠心脏成纤维细胞α-SMA表达水平上升,促进了心脏成纤维细胞向活化表型的转变。本研究前期也尝试了用不同血清浓度培养基对细胞进行培养,但细胞α-SMA 水平并无明显差异。有关如何降低心脏成纤维细胞在体外培养的活化程度、优化细胞培养条件等问题,未来工作可聚焦于采用水凝胶系统对细胞进行三维培养、降低机械应力刺激、优化细胞接种密度、添加与促活化相关细胞因子的抑制剂等,具体有待于进一步研究。现有研究结果表明,人心脏纤维化主要受转化生长因子β( transforming growth factor beta,TGFβ )调控[19]。在体外建立心脏纤维化模型常用TGFβ1进行诱导,本研究根据Humeres等[20]的试验条件,选用最终质量浓度为5 ng·mL−1的TGFβ1溶液进行刺激。研究结果表明,在该质量浓度条件下,TGFβ1刺激48 h能够促进心脏纤维细胞的活化。初步验证TGFβ1刺激能够促进猫原代心脏纤维细胞的活化,用猫原代心脏成纤维细胞建立纤维化模型的条件有待于进一步优化。
-
本研究采用酶消化法成功分离了猫心脏成纤维细胞,培养了可稳定传代的猫心脏成纤维细胞,初步验证TGFβ1可激活猫原代心脏成纤维细胞转化为肌成纤维细胞。下一步拟于体外建立心脏纤维化模型,为今后开展心脏纤维化相关研究奠定基础。
Isolation, identification and application of cardiac fibroblasts in cats
-
摘要: 心脏纤维化是导致患心脏病动物猝死的重要原因,心脏成纤维细胞是参与心脏纤维化主要细胞类型。本研究成功分离了猫原代心脏细胞,并实现在体外传代培养5代,经细胞形态学与分子生物学方法鉴定,符合心脏成纤维细胞特点。经TGFβ1诱导后,活化的成纤维细胞标志物α-SMA蛋白在刺激48 h后表达水平升高,说明TGFβ1刺激促进了猫原代心脏纤维细胞的活化。研究结果可为探究心脏纤维化发病机制提供依据,为心脏纤维化研究提供细胞学基础。Abstract: Cardiac fibrosis is an important cause of sudden death in animals with heart disease. Cardiac fibroblast is one of the main cell types involved in cardiac fibrosis. In this study, primary cardiac cells were successfully isolated from cats and successfully cultured in vitro for five generations. The cells were characterized by using cell morphology and molecular biology methods and were found to meet the characteristics of cardiac fibroblasts. After TGFβ1 stimulation, the activated fibroblast marker α-SMA protein increased its expression level after 48 hours of stimulation, indicating that TGFβ1 stimulation promoted the activation of primary cardiac fibroblasts in cats. The results can provide reference for exploring the pathogenesis of cardiac fibrosis and provide a cytological basis for the study of cardiac fibrosis.
-
Key words:
- cat /
- cardiac fibrosis /
- cardiac fibroblast /
- isolation and culture
-
-
[1] Luis Fuentes V, Abbott J, Chetboul V, et al. ACVIM consensus statement guidelines for the classification, diagnosis, and management of cardiomyopathies in cats [J]. Journal of Veterinary Internal Medicine, 2020, 34(3): 1062−1077. https://doi.org/10.1111/jvim.15745 doi: 10.1111/jvim.15745 [2] Ho C Y, López B, Coelho-Filho O R, et al. Myocardial fibrosis as an early manifestation of hypertrophic cardiomyopathy [J]. The New England Journal of Medicine, 2010, 363(6): 552−563. https://doi.org/10.1056/NEJMoa1002659 doi: 10.1056/NEJMoa1002659 [3] Camelliti P, Borg T K, Kohl P. Structural and functional characterisation of cardiac fibroblasts [J]. Cardiovascular Research, 2005, 65(1): 40−51. https://doi.org/10.1016/j.cardiores.2004.08.020 doi: 10.1016/j.cardiores.2004.08.020 [4] Souders C A, Bowers S L K, Baudino T A. Cardiac fibroblast: the renaissance cell [J]. Circulation Research, 2009, 105(12): 1164−1176. https://doi.org/10.1161/CIRCRESAHA.109.209809 doi: 10.1161/CIRCRESAHA.109.209809 [5] Berry M F, Engler A J, Joseph Woo Y, et al. Mesenchymal stem cell injection after myocardial infarction improves myocardial compliance [J]. American Journal of Physiology Heart and Circulatory Physiology, 2006, 290(6): H2196−2203. https://doi.org/10.1152/ajpheart.01017.2005 doi: 10.1152/ajpheart.01017.2005 [6] Vanhoutte D, Schellings M, Pinto Y, et al. Relevance of matrix metalloproteinases and their inhibitors after myocardial infarction: a temporal and spatial window [J]. Cardiovascular Research, 2006, 69(3): 604−613. https://doi.org/10.1016/j.cardiores.2005.10.002 doi: 10.1016/j.cardiores.2005.10.002 [7] Kitz S, Fonfara S, Hahn S, et al. Feline hypertrophic cardiomyopathy: the consequence of cardiomyocyte-initiated and macrophage-driven remodeling processes? [J]. Veterinary Pathology, 2019, 56(4): 565−575. https://doi.org/10.1177/0300985819837717 doi: 10.1177/0300985819837717 [8] Ragazzini S, Scocozza F, Bernava G, et al. Mechanosensor YAP cooperates with TGF-β1 signaling to promote myofibroblast activation and matrix stiffening in a 3D model of human cardiac fibrosis [J]. Acta Biomaterialia, 2022, 152: 300−312. https://doi.org/10.1016/j.actbio.2022.08.063 doi: 10.1016/j.actbio.2022.08.063 [9] Kang M, Long T, Chang C, et al. A review of the ethical use of animals in functional experimental research in China based on the “four R” principles of reduction, replacement, refinement, and responsibility [J]. Medical Science Monitor, 2022, 28: e938807. [10] Sahadevan P, Allen B G. Isolation and culture of adult murine cardiac atrial and ventricular fibroblasts and myofibroblasts [J]. Methods, 2022, 203: 187−195. https://doi.org/10.1016/j.ymeth.2021.04.004 doi: 10.1016/j.ymeth.2021.04.004 [11] Doppler S A, Carvalho C, Lahm H, et al. Cardiac fibroblasts: more than mechanical support [J]. Journal of Thoracic Disease, 2017, 9(S1): S36−S51. https://doi.org/10.21037/jtd.2017.03.122 doi: 10.21037/jtd.2017.03.122 [12] Tarbit E, Singh I, Peart J N, et al. Biomarkers for the identification of cardiac fibroblast and myofibroblast cells [J]. Heart Failure Reviews, 2019, 24(1): 1−15. https://doi.org/10.1007/s10741-018-9720-1 doi: 10.1007/s10741-018-9720-1 [13] Kurose H. Cardiac fibrosis and fibroblasts [J]. Cells, 2021, 10(7): 1716. https://doi.org/10.3390/cells10071716 doi: 10.3390/cells10071716 [14] Melzer M, Beier D, Young P P, et al. Isolation and characterization of adult cardiac fibroblasts and myofibroblasts [J]. Journal of Visualized Experiments, 2020, (157). https://doi.org/10.3791/60909 doi: 10.3791/60909 [15] Kumar S, Nagesh D, Ramasubbu V, et al. Isolation and culture of primary fibroblasts from neonatal murine hearts to study cardiac fibrosis [J]. Bio-protocol, 2023, 13(4): e4616. [16] Rohr S. Cardiac fibroblasts in cell culture systems: myofibroblasts all along? [J]. Journal of Cardiovascular Pharmacology, 2011, 57(4): 389−399. https://doi.org/10.1097/FJC.0b013e3182137e17 doi: 10.1097/FJC.0b013e3182137e17 [17] Landry N M, Rattan S G, Dixon I M C. An improved method of maintaining primary murine cardiac fibroblasts in two-dimensional cell culture [J]. Scientific Reports, 2019, 9(1): 12889. https://doi.org/10.1038/s41598-019-49285-9 doi: 10.1038/s41598-019-49285-9 [18] Galie P A, Westfall M V, Stegemann J P. Reduced serum content and increased matrix stiffness promote the cardiac myofibroblast transition in 3D collagen matrices [J]. Cardiovascular Pathology, 2011, 20(6): 325−333. https://doi.org/10.1016/j.carpath.2010.10.001 doi: 10.1016/j.carpath.2010.10.001 [19] Bracco Gartner T C L, Crnko S, Leiteris L, et al. Pirfenidone has anti-fibrotic effects in a tissue-engineered model of human cardiac fibrosis [J]. Frontiers in Cardiovascular Medicine, 2022, 9: 854314. https://doi.org/10.3389/fcvm.2022.854314 doi: 10.3389/fcvm.2022.854314 [20] Humeres C, Vivar R, Boza P, et al. Cardiac fibroblast cytokine profiles induced by proinflammatory or profibrotic stimuli promote monocyte recruitment and modulate macrophage M1/M2 balance in vitro [J]. Journal of Molecular and Cellular Cardiology, 2016, 101: 69−80. https://doi.org/10.1016/j.yjmcc.2016.10.014 doi: 10.1016/j.yjmcc.2016.10.014 -




 下载:
下载: