-
黄瓜是中国的主栽蔬菜之一,种植面积约120万hm2,产量与种植规模均居世界首位[1],但受高复种指数与常年集约化种植的影响,土传病害发生严重。由尖孢镰刀菌黄瓜专化型(Fusarium oxysporum f.sp. cucumerinum)引发的枯萎病尤为突出,在中国的年平均发病率为10%~30%,重病区更是高达80%~90%,已成为导致黄瓜产量损失的主要病害[2-3]。目前生产中广泛采用化学杀菌剂来防治该病害,但其负面影响日趋凸显,不仅威胁人类健康,还会造成环境污染、土壤微生物区系失衡及耐药菌株产生[4]。嫁接、轮作等措施防效较好,但操作繁琐,工作量大,成本较高[5]。此外,黄瓜的抗病品种较少,且因尖孢镰刀菌存在多种专化型和生理小种,易发生基因水平转移,连续种植会导致抗性丧失[6]。
有益微生物能够有效地抑制植物病原真菌,不破坏土壤生态,还能降低病原菌抗药性的演化风险[7]。目前,已有多种生防菌株被报道可用于黄瓜枯萎病防控[8]。例如,金黄垂直链霉菌DF06可通过分泌拮抗物质直接抑制病原菌菌丝生长,以及诱导植物产生系统抗性等方式有效防治黄瓜枯萎病[9];贝莱斯芽孢杆菌VJH504能够产生β-1,3-葡聚糖酶、纤维素酶等细胞壁降解酶抑制黄瓜枯萎病菌[10];棘孢木霉FJ035可通过产生拮抗物质、与病原菌进行空间竞争和促进黄瓜生长等机制协同防治黄瓜枯萎病[11]。这些有益微生物的应用为黄瓜枯萎病的绿色防控提供了多元技术路径,也为构建可持续的黄瓜病害综合防治体系奠定了重要基础。
木霉(Trichoderma spp.)是目前研究最广泛的生防真菌,其兼具生长迅速、适应性强及多机制协同作用等特性,还可分泌蛋白质、小肽及次生代谢物等大量抑菌活性的分子[12-14]。近年来,木霉分泌的抑菌物质作为直接抑制病原菌的关键因子被广泛研究。例如,棘孢木霉LN004的次生代谢产物大黄素通过竞争性结合果胶杆菌群体感应相关蛋白ExpI和ExpR,阻断N-酰基高丝氨酸内酯(AHL)信号,抑制生物膜及胞外多糖形成,显著降低细菌性软腐病发生率[15];猥木霉LS019-2菌株能够产生挥发性有机化合物6PP,有效地抑制荔枝霜疫霉的菌丝生长和孢子囊萌发,并严重破坏菌丝体的超微结构[16]; Trichoderma parareesei N4-3分泌的细胞壁降解酶与蛋白酶可破坏病原真菌细胞壁,抑制孢子萌发并削弱其侵染力[17]。本研究以黄瓜枯萎病菌(F. oxysporum)为靶标,从49株实验室保存的木霉菌株中筛选优异拮抗菌株,并对其抑菌活性物质及功能进行初步探究,旨在为新型木霉生物农药的开发提供理论依据。
-
供试菌株:木霉菌株HL088、DQ-1、FJ069、GZ070、HL048、HL092、HL100、LS019-2、NM082、AH003、AH009、HN018、HN082101-2、HN082104-2、HN082106-2、HN082108-3、HN082213-4、HN083003-1、HN090114-2、SC010、SC016、FJ087、GZ007、GZ0018、GZ020、GZ034、HL008、HL093、HL119、HL131、NM102、NM167、QH060、SC003、SC008、SC012、SC013、SC019、SC037、SC098、SD002、XJ012、XJ028、XJ067、XJ079、XJ081、XM004-12、XM005-31、ZJ019以及黄瓜枯萎病菌SCCFo1,所有菌株均由本实验室分离保存。
培养基 :马铃薯葡萄糖琼脂(PDA)培养基(土豆200 g•L−1、琼脂粉18 g·L−1、葡萄糖20 g·L−1);玉米粉葡萄糖琼脂培养基(CMD)培养基(玉米粉30 g·L−1、葡萄糖18 g·L−1、琼脂18 g·L−1),合成低营养琼脂培养基(SNA)培养基(磷酸二氢钾1.0 g·L−1、氯化钾10.5 g·L−1、硝酸钾1.0 g·L−1、硫酸镁0.5 g·L−1、葡萄糖0.2 g·L−1,蔗糖0.2 g·L−1和琼脂18 g·L−1)。
-
将活化后的木霉与黄瓜枯萎病菌菌丝块分别接种于同一PDA平板两端(间距6 cm),以单独接种病原菌的平板作为对照。28℃培养10 d后,测量病原菌菌落半径并计算相对抑制率。拮抗作用等级根据木霉对病原菌的覆盖面积进行评定:Ⅰ级,木霉完全覆盖病原菌菌落;Ⅱ级,覆盖面积>2/3;Ⅲ级,覆盖面积1/3~2/3;Ⅳ级,覆盖面积<1/3;Ⅴ级,病原菌占据整个平板[18]。
$$ \begin{split} &抑制率=(对照组菌落半径-处理组菌落半径)/\\&对照组菌落半径\times 100\% \end{split} $$ -
将活化好的木霉菌丝块接种于覆盖无菌玻璃纸(cellophane)的PDA平板上,28℃培养36 h后移除,随后,在相同平板中央接种病原菌,接种后的平板于28℃培养5 d,测量病原菌菌落直径并计算菌丝生长抑制率。将覆盖玻璃纸但未接种木霉的平板设为对照,移除玻璃纸后在平板中央接种病原菌,并于相同条件下(28℃,培养5 d)培养。
-
将活化后的木霉菌丝块分别转接至PDA、CMD及SNA培养基,于28℃培养箱中黑暗培养,测定其分生孢子、分生孢子梗、厚垣孢子的形态特征以及菌落生长模式。采用CTAB法提取木霉菌株基因组DNA。分别扩增rpb2和tef1基因片段,引物分别为tef1-728F(5′-CATCGAGAAGTTCGAGAAGG-3′)和tef1-R(5′-AACTTGCAGGCAATGTGG-3′);rpb2-5f (5′-GAYGAYMGWGATCAYTTYGG-3′)和rpb2-7cr(5′-CCCATRGCTTGYTTRCCCAT-3′)。使用天根DNA纯化回收试剂盒(DP214)回收PCR产物(操作按说明书进行),并送至北京擎科生物科技股份有限公司进行测序。将测序结果在NCBI数据库中进行BLAST比对,下载同源性高的相关木霉菌株序列。利用MEGA X软件对下载序列进行比对,并采用邻接法(Neighbor-Joining)构建系统发育树(Bootstrap值 =
1000 )。 -
蛋白粗提液制备:将木霉孢子悬浮液(107个·mL−1)接种于大米培养基,25℃发酵22 d。发酵产物用预冷的10 mmol·L−1 Tris-HCl缓冲液(pH6.8)于4℃条件下浸泡48 h,经双层无菌纱布过滤,4℃条件下5 000 × g离心15 min,取上清液过0.22 μm无菌滤膜,获得无菌粗提液。
硫酸铵分级沉淀[19]:向等量无菌粗提液中缓慢加入硫酸铵粉末,使其饱和度分别达到20%、40%、60%、80%和100%(w/v),于4℃静置过夜。随后在4℃、10 000 × g条件下离心30 min收集沉淀,并用10 mmol·L−1 PBS缓冲液(pH7.4)复溶,经0.22 μm滤膜过滤后,采用BCA法测定各饱和度下沉淀溶液的蛋白浓度。
抑菌活性测定:将不同饱和度硫酸铵沉淀所得粗蛋白溶液,分别加入PDA培养基中,使其终浓度为300 μg·mL−1,以添加等体积PBS缓冲液的PDA平板作为对照。平板凝固后,于中央接种黄瓜枯萎病菌菌丝块,28℃培养6 d后测量菌落直径,计算菌丝生长抑制率,筛选抑菌效果最佳的粗蛋白溶液。
-
将抑菌效果最佳的粗蛋白溶液送至上海百趣生物科技有限公司进行质谱鉴定。原始数据文件使用SpectroMine(
4.2.230428.52329 ;Biognosys AG)软件应用Pulsar检索引擎进行数据库搜索,搜索结束后进行定性分析。结合数据库与已发表文献对质谱鉴定到的蛋白进行功能注释。 -
采用Omega E.Z.N.A.® Total RNA Kit I(R6840)提取近木霉总RNA。使用天根FastKing RT Kit(KR116)进行基因组DNA去除及cDNA合成,具体操作参照制造商说明书。所得cDNA保存于-20℃备用。
基于质谱鉴定结果,设计特异性引物(TriCho75-BamHI-F-tycz/TriCho75-EcoRI-R-tycz,不含N端信号肽,引物序列见表1)扩增目标抑菌蛋白编码基因。PCR产物经1%(w/v)琼脂糖凝胶电泳验证后,使用凝胶回收试剂盒纯化目标片段,−20℃保存备用。采用BamHI和EcoRI双酶切处理pET32a表达载体,经凝胶纯化后与目标片段在T4 DNA连接酶作用下16℃连接过夜。连接产物热激法转化至大肠杆菌BL21(DE3)感受态细胞,通过PCR筛选阳性克隆。
表 1 抑菌蛋白原核表达构建引物
Table 1. Primers for construction of prokaryotic expression vector of antimicrobial proteins
名称 Primer 引物序列(5′—3′) Sequence(5′—3′) TriCho75-BamHI-F-tycz caaggccatggctgatatcGGATCCTTTGATCTCCCAGACAACTTG TriCho75-EcoRI-R-tycz ttgtcgacggagctcGAATTCCTATGCCTGGAGACCAGCAAC 阳性克隆接种于含100 μg·mL−1氨苄青霉素的LB液体培养基,37℃振荡培养至OD600为0.5~0.7时,加入0.5 mmol·L−1 IPTG于16℃诱导表达12 h。同时设置空载体pET32a转化菌株为阴性对照。使用Ni-NTA His标签蛋白纯化系统(Beyond Biotechnology,中国)纯化重组蛋白。通过12% SDS-PAGE验证蛋白表达[20]。
-
制备黄瓜枯萎病菌孢子悬浮液,并用无菌水调整至终浓度为107个·mL−1。将孢子悬浮液与不同浓度(5 、10 、15 μmol·L−1 )的纯化重组蛋白混合于PD培养基中,以pET32a空载体转化的BL21(DE3)重组蛋白作为阴性对照。28℃、180 r·min−1振荡培养7 h后,观察孢子萌发情况并拍照记录,芽管长度大于孢子短轴则记为萌发。
将500 μL重组蛋白轻轻涂布于PDA平板上,以去离子水和BL21-pET32a-His为阴性对照,在平板中央接种黄瓜枯萎病菌菌丝块,在28℃下培养3 d后显微观察菌丝形态变化,待阴性对照菌落长满平板后,测量各处理组菌落直径,计算生长抑制率。
-
使用IBM SPSS Statistics 21软件对量化数据进行统计分析,并进行单因素方差分析(ANOVA)分析,使用Tukey检验和Dunnett t 检验分析均值,P < 0.05。所有实验独立重复3次(n = 3),图表中的数据采用平均值±标准差的方式表示。
-
采用平板对峙法测定了49株木霉对黄瓜枯萎病菌的拮抗作用。结果显示所有供试木霉菌株均表现出不同程度的抑菌活性,抑制率范围为75.18%~89.74%,其中22株木霉的抑制率超过85%(表2)。根据拮抗系数评价标准,菌株HL088、T069、XM004-12、C013、SC012、GZ070、GZ034、HN018、HN082104-2、HL092、XJ087、ZJ019等12株木霉表现出Ⅰ级拮抗活性,表明这些菌株具有显著的拮抗效果。
表 2 49株木霉对黄瓜枯萎病菌生长抑制率和拮抗系数
Table 2. Inhibition rate and antagonistic coefficient of 49 Trichoderma strains against F. oxysporum
菌株
Isolates抑制率/%
Inhibition
rate/%拮抗系数
Antagonistic coefficient菌株
Isolates抑制率/%
Inhibition
rate/%拮抗系数
Antagonistic coefficientHL088 87.19 ± 0.42 Ⅰ GZ034 81.39 ± 3.74* Ⅰ DQ-1 83.70 ± 1.04* Ⅲ HL008 85.71 ± 0.81* Ⅲ FJ069 88.17 ± 0.72 Ⅰ HL093 88.73 ± 0.99* Ⅰ GZ070 87.15 ± 0.62 Ⅱ HL119 83.71 ± 1.71 Ⅰ HL048 85.87 ± 1.01 Ⅳ HL131 87.71 ± 2.78 Ⅳ HL092 84.54 ± 2.28* Ⅱ NM102 83.83 ± 2.22* Ⅱ HL100 80.72 ± 1.13* Ⅱ NM167 83.00 ± 1.29* Ⅰ LS019-2 81.85 ± 1.65* Ⅴ QH060 84.46 ± 1.76* Ⅲ NM082 83.71 ± 1.52* Ⅱ SC003 85.83 ± 1.40 Ⅰ AH003 83.62 ± 1.96* Ⅰ SC008 85.65 ± 1.91* Ⅳ AH009 84.02 ± 3.73* Ⅴ SC012 84.85 ± 1.30* Ⅱ HN018 87.52 ± 1.25 Ⅰ SC013 89.74 ± 0.36 Ⅰ HN082101-2 82.04 ± 1.10* Ⅴ SC019 84.42 ± 2.43* Ⅱ HN082104-2 81.76 ± 3.40* Ⅱ SC037 84.98 ± 0.48* Ⅰ HN082106-2 83.71 ± 2.26* Ⅰ SC098 87.80 ± 2.09 Ⅴ HN082108-3 84.94 ± 0.17* Ⅳ SD002 85.58 ± 1.38* Ⅴ HN082213-4 75.19 ± 3.42* Ⅲ XJ012 87.27 ± 1.15 Ⅱ HN083003-1 81.33 ± 1.76* Ⅴ XJ028 83.79 ± 1.01* Ⅱ HN090114-2 86.08 ± 1.70 Ⅱ XJ067 89.26 ± 1.64 Ⅲ SC010 83.93 ± 1.83* Ⅱ XJ079 84.44 ± 0.93* Ⅳ SC016 83.64 ± 1.67* Ⅱ XJ081 81.85 ± 3.95* Ⅱ FJ087 84.29 ± 2.41* Ⅰ XM004-12 86.15 ± 3.43 Ⅰ GZ007 88.05 ± 0.52 Ⅱ XM005-31 86.94 ± 1.62 Ⅰ GZ018 88.90 ± 3.47 Ⅰ ZJ019 88.32 ± 0.97 Ⅰ GZ020 87.96 ± 0.87 Ⅳ 注:表中数据表示平均值±标准差(n ≥ 3),用单因素方差分析(ANOVA)和Tukey多重比较进行统计分析,*表示与所有处理中最高数值具有显著差异(P < 0.05)。 Note:Data represents mean ± SD on the basis of n ≥ 3. Significance was analyzed using one-way ANOVA with Tukey’s test; "*" indicates significant differences compared to the highest value among all treatments(P < 0.05). 通过代谢产物抑制实验进一步测定木霉菌株的抑菌效果。结果显示49株木霉在PDA培养基上的代谢物对黄瓜枯萎病菌为5.76%~92.92%(表3)。其中HL088菌株的代谢产物表现出最强的抑制活性(92.92%),而AH003菌株的抑制效果最弱(5.76%)。基于上述实验结果,选择拮抗效果最优的HL088菌株进行后续实验研究。
表 3 49株木霉的代谢产物对黄瓜枯萎病菌的抑制率
Table 3. Inhibition rate of metabolites from 49 strains of Trichoderma on F. oxysporum
菌株
Isolates抑制率/%
Inhibition rate/%菌株
Isolates抑制率/%
Inhibition rate/%菌株
Isolates抑制率/%
Inhibition rate /%HL088 92.92 ± 0.10 HN083003-1 62.23 ± 5.05 * SC003 28.40 ± 0.91 * DQ-1 57.69 ± 1.36 * HN090114-2 14.01 ± 1.79 * SC008 55.39 ± 6.99 * FJ069 7.87 ± 1.58 * SC010 59.59 ± 1.37 * SC012 40.72 ± 2.46 * GZ070 61.64 ± 0.68 * SC016 39.55 ± 2.58 * SC013 44.66 ± 2.26 * HL048 60.24 ± 0.69 * FJ087 13.74 ± 1.60 * SC019 28.70 ± 1.68 * HL092 60.77 ± 1.06 * GZ007 45.55 ± 0.91 * SC037 24.66 ± 13.21 * HL100 60.96 ± 0.68 * GZ018 34.34 ± 2.74 * SC098 9.35 ± 0.47 * LS019-2 22.98 ± 2.16 * GZ020 39.95 ± 0.79 * SD002 6.69 ± 1.13 * NM082 65.11 ± 4.48 * GZ034 62.84 ± 3.04 * XJ012 34.45 ± 2.79 * AH003 5.63 ± 1.62 * HL008 50.62 ± 2.24 * XJ028 5.65 ± 1.15 * AH009 68.76 ± 4.22 * HL093 17.97 ± 1.82 * XJ067 15.17 ± 0.98 * HN018 58.64 ± 0.88 * HL119 38.81 ± 4.72 * XJ079 6.02 ± 0.78 * HN082101-2 12.56 ± 3.35 * HL131 54.29 ± 2.64 * XJ081 13.40 ± 1.32 * HN082104-2 71.84 ± 1.14 * NM102 15.85 ± 1.12 * XM004-12 67.69 ± 0.89 * HN082106-2 69.16 ± 1.24 * NM167 16.67 ± 0.64 * XM005-31 30.82 ± 0.68 * HN082108-3 67.59 ± 5.34 * QH060 8.68 ± 1.45 * ZJ019 8.48 ± 1.04 * HN082213-4 8.31 ± 1.05 * 注:表中数据表示平均值±标准差(n≥3),用单因素方差分析(ANOVA)和Tukey多重比较进行统计分析,*表示与所有处理中最高数值具有显著差异(P<0.05)。 Note: Data represents mean ± SD on the basis of n≥3. Significance was analyzed by using one-way ANOVA with Tukey’s test; "*" indicates significant differences compared to the highest value among all treatments(P<0.05). -
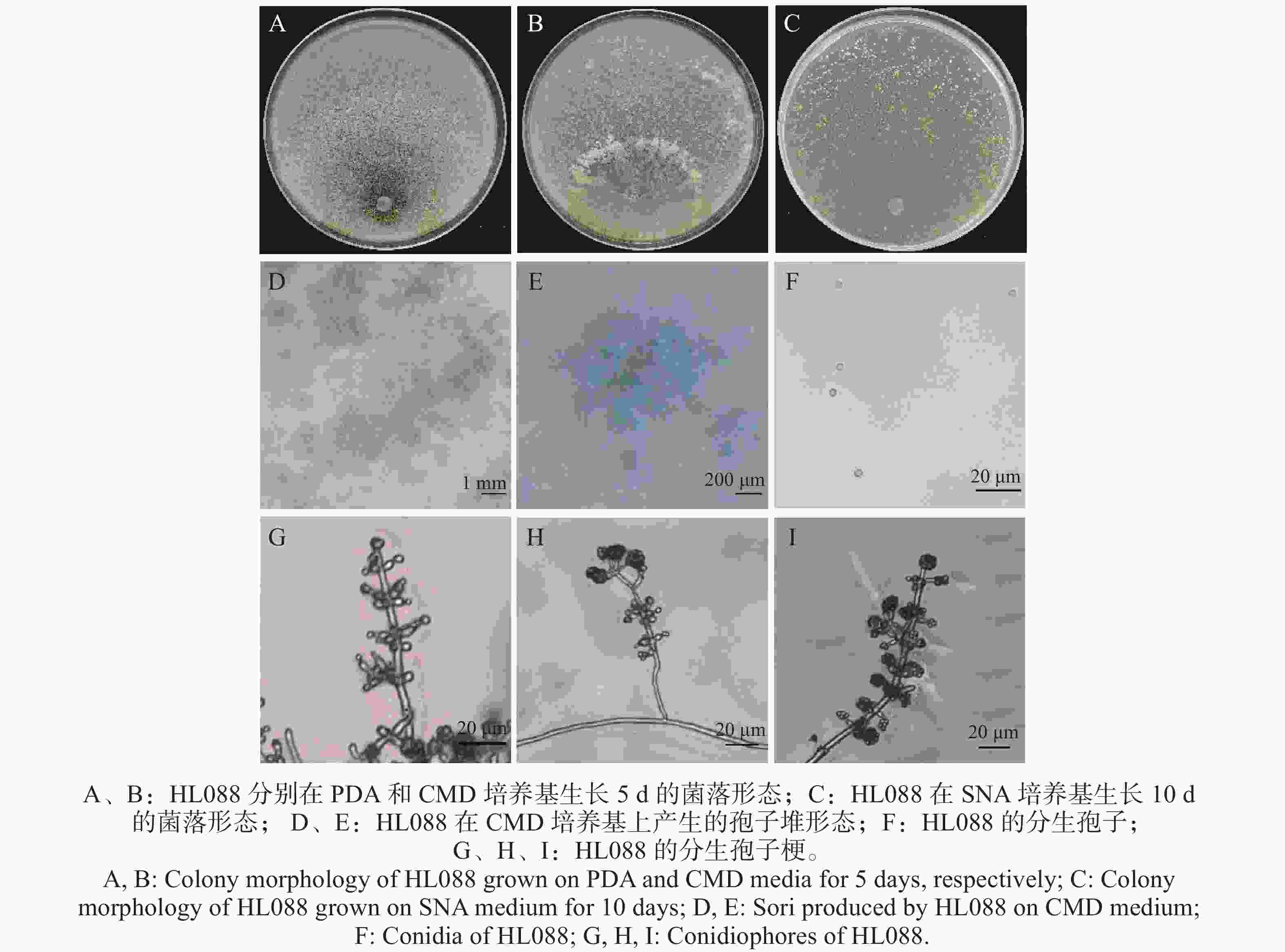
木霉菌株HL088的形态学特征(图1):在PDA培养基上生长迅速,4~5 d即可从直径9 cm培养皿边缘扩展至全皿,菌落呈同心环状,质地密集,初期为白色,后期逐渐转为绿色至深绿色,气生菌丝发达,分生孢子产量丰富;在CMD培养基上4~5 d可长满直径9 cm培养皿,菌落边界清晰,气生菌丝稀疏,能形成产孢簇,整体呈绿色;在SNA平板上生长较慢,约10 d长满直径9 cm培养皿,菌落形态与CMD培养基上培养相似,但生长量显著减少,气生菌丝极少,分生孢子呈黄绿色;显微镜观察显示,其分生孢子堆呈绿色羊毛状,分生孢子为椭圆形或近圆形,表面光滑,轮廓清晰;分生孢子梗主轴间隔较远,侧枝多呈直角或稍向上倾斜,极少再次分枝,单生、成对或三轮生,主轴末端的瓶梗粗壮至近壶状,且明显肿胀。
通过PCR扩增获得木霉菌株HL088的tef1(
1158 bp)和rpb2(1078 bp)基因片段。利用NCBI Blast同源比对和系统发育树分析,菌株HL088与近深绿木霉菌株S489和S385聚于同一分支(图2)。结合形态学特征,将菌株HL088鉴定为近深绿木霉(T. paratroviride)。该菌株的tef1基因和rpb2基因序列已提交至GenBank数据库,登录号分别为PP444473和PP444474。 -
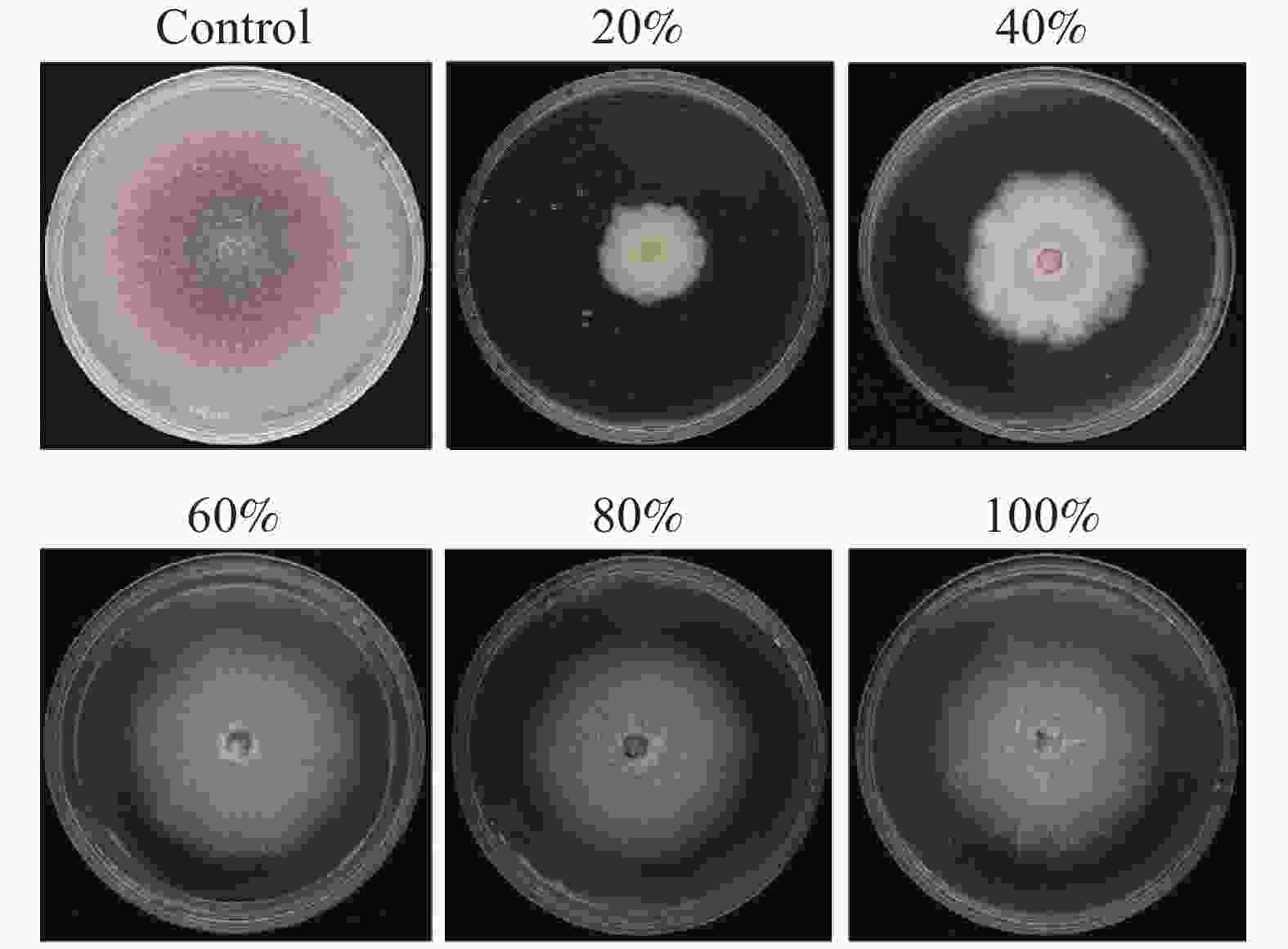
对近深绿木霉HL088发酵产物的提取物进行硫酸铵分级沉淀处理,并测定各组分的抑菌活性。结果显示,20%、40%、60%、80%及100%饱和度硫酸铵沉淀所得蛋白粗提液对黄瓜枯萎病菌均有一定抑制作用,其中20%饱和度硫酸铵沉淀的蛋白粗提液(300 μg·mL−1)抑制效果最佳,平均抑制率为68.83%(图3)。
-
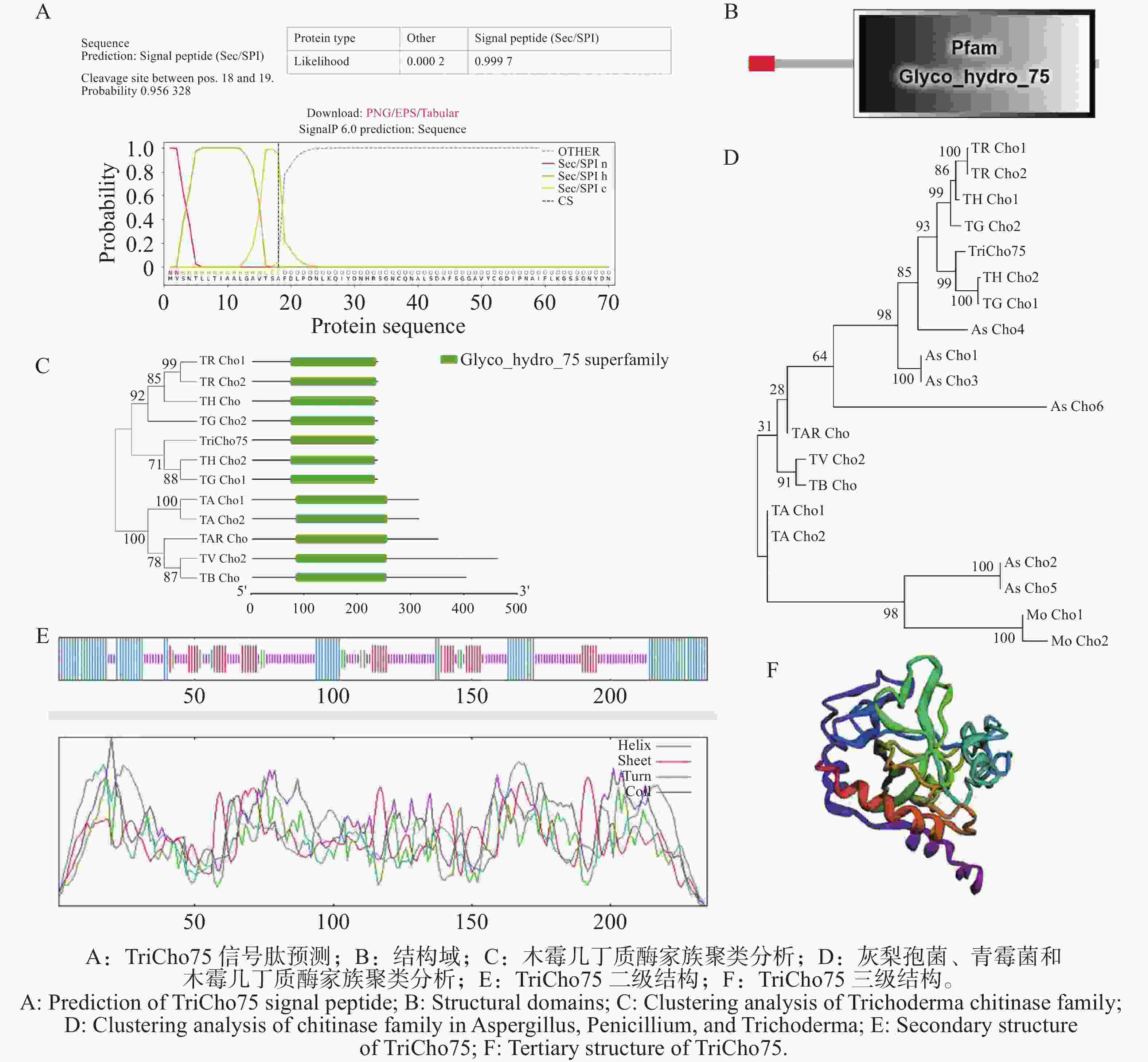
通过nano LC-MS/MS分析,共鉴定到559个蛋白质及1 544条多肽。结合文献比对与功能注释,推测其中1个糖苷水解酶75(GH75)家族壳聚糖酶可能为潜在抑菌蛋白,并将其命名为TriCho75。生物信息学分析表明,TriCho75的N端1~18位氨基酸被预测为信号肽区域(图4-A)。该蛋白含有典型的GH75家族结构域,即羰基水解酶超家族结构域(图4-B)。系统进化分析显示,TriCho75与盖姆斯木霉(T. gamssi)的TG Cho1、哈茨木霉(T. harzianum)的TH Cho2亲缘关系最近,序列相似性达83%,聚于同一进化支(图4-C)。在与其他病原真菌的比较中,TriCho75与曲霉(Aspergillus sp.)和青霉(Penicillium sp.)的壳聚糖酶As Cho4同源性为62%(图4-D)。对TriCho75蛋白结构的预测结果显示,其二级结构由α-螺旋(31.06%)、β-折叠(16.6%)、β-转角(4.68%)和无规则卷曲(47.6%)构成(图4-E);其三级结构由这些二级结构元件折叠盘绕构成(图4-F)。因此,将TriCho75初步鉴定为近深绿木霉HL088来源的1个GH75家族壳聚糖酶。
-
通过菌落PCR及测序筛选出含有正确插入片段的DH5α阳性克隆,并将质粒转化至表达宿主BL21(DE3)中。对BL21转化子的PCR验证结果表明,空载体对照与重组载体均成功转化,扩增条带大小与预期一致。使用IPTG诱导转化菌株表达蛋白,经镍柱亲和纯化后,通过SDS-PAGE可在相应分子量处观察到TriCho75-His(44.6 kDa)及空载体蛋白(22 kDa)的特异性条带(图5)。
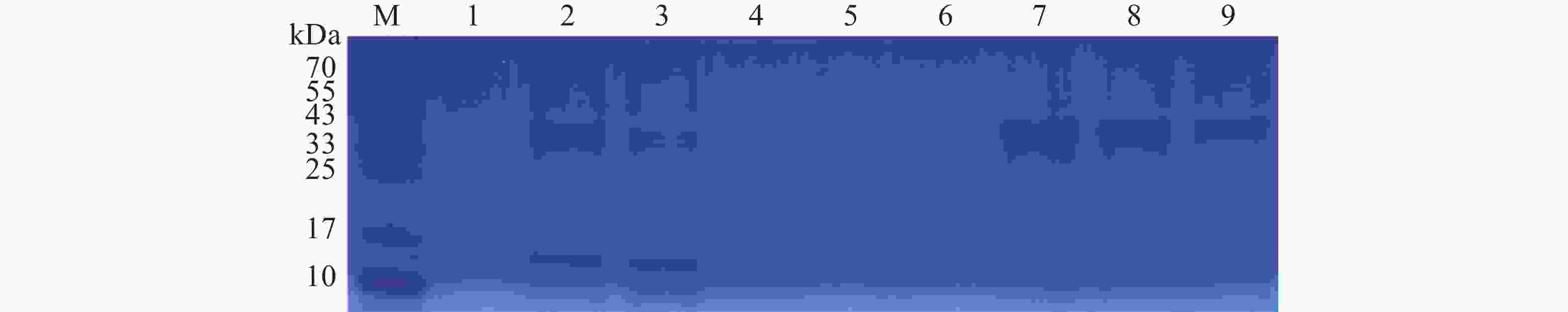
图 5 空载体BL21-pET32a-His和重组蛋白TriCho75的SDS-PAGE电泳检测
Figure 5. SDS-PAGE analysis of BL21-pET32a and BL21-pET32a-TriCho75
测定了不同浓度重组蛋白TriCho75对黄瓜枯萎病菌孢子萌发的影响。结果显示,与阴性对照相比,5、10、15 μmol·L−1的TriCho75均能抑制孢子萌发,且抑制效果随重组蛋白浓度增加而提高。在5 μmol·L−1下,孢子萌发受到抑制但仍可萌发;当浓度升至10 μmol·L−1时,多数孢子萌发被抑制,且孢子形态出现明显畸形;而在15 μmol·L−1下,孢子萌发被完全抑制,且所有孢子均表现为畸形(图6)。此外,浓度为15 μmol·L−1纯化后的重组蛋白TriCho75处理的黄瓜枯萎病菌孢子平均萌发率为3.33%(对照处理为93.67%, n = 100),抑制率达96.44%。
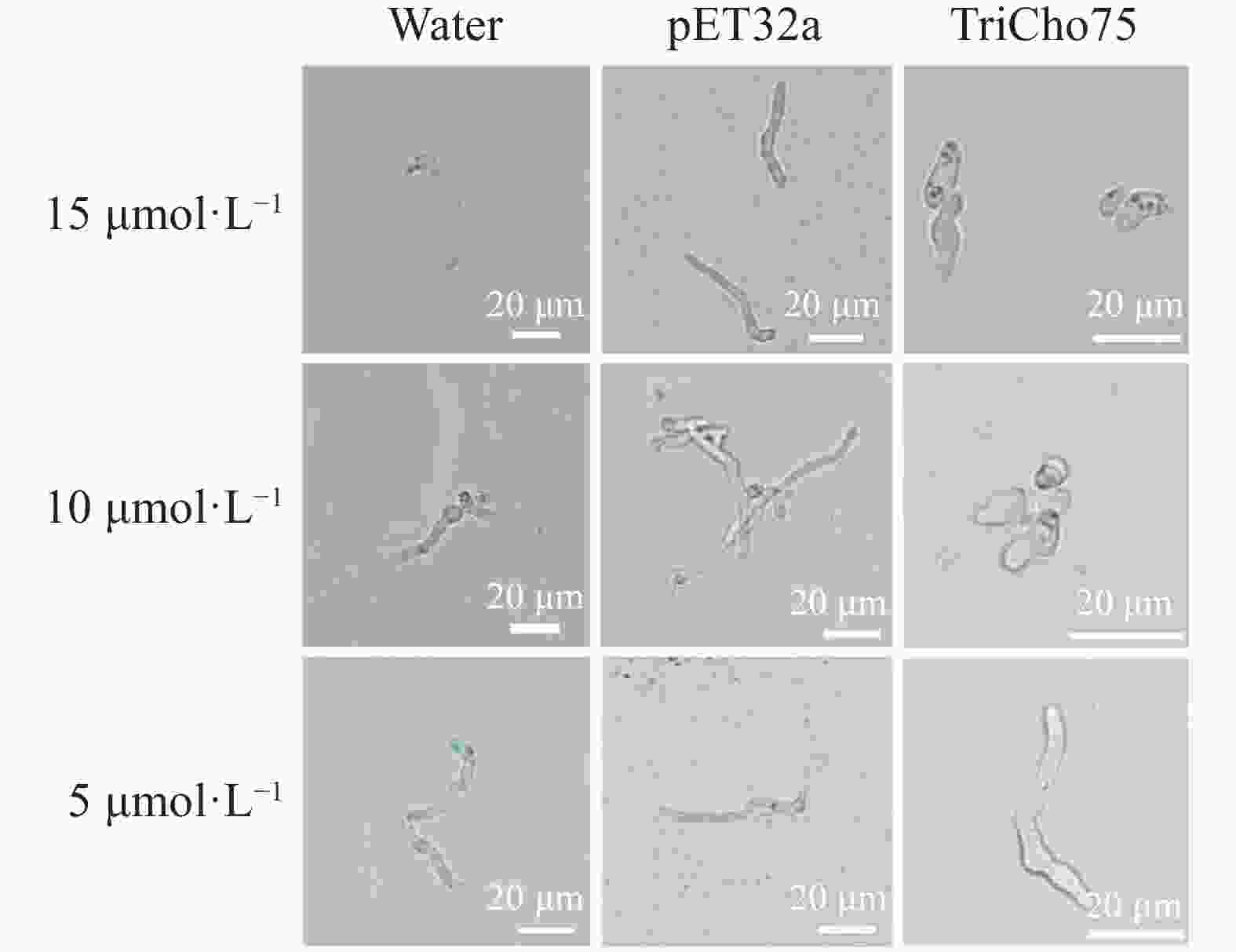
图 6 不同浓度TriCho75重组蛋白对黄瓜枯萎病菌孢子形态影响
Figure 6. Effects of TriCho75 recombinant protein at different concentrations on spores of F. oxysporum
本团队还测定了重组蛋白TriCho75(15 μmol·L−1)对黄瓜枯萎病菌菌丝生长的抑制效果。结果表明,其对黄瓜枯萎病菌菌丝的平均抑制率为60.59%(n = 3)。此外,经重组蛋白TriCho75处理后,病原菌菌丝形态相较于对照出现明显异常,表现为扭曲、粗细不均和生长不规则(图7)。
-
随着人口增长、资源消耗与环境污染问题的日益严峻,传统农业模式面临着巨大挑战[21]。在此背景下,农作物病害防控策略正逐步转向以生物防治和生态调控为核心的绿色技术体系,新型绿色农药及微生物农药的研发也成为植物保护领域的重要方向[22]。木霉作为最重要的生防真菌之一,目前已报道超过400个种,但在农业中实际应用的生防菌剂仍局限于少数几种,如哈茨木霉、绿木霉和深绿木霉等,极大的限制了生防技术的发展[23]。本研究筛选的近木霉菌株HL088对黄瓜枯萎病菌具有显著抑制作用,通过形态学及分子生物学将其鉴定为近深绿木霉,与之前报道相一致。近深绿木霉由Jaklitsch和Voglmayr基于形态特征首次鉴定[24],后于2015年由张广志等在中国首次报道,为该属的中国新记录种[25]。本研究对该菌株的报道进一步丰富了木霉生防资源,为开发针对黄瓜枯萎病的高效生防菌剂提供了优良候选菌株。
近年来,近深绿木霉的生防潜力逐渐受到关注,已有研究报道其可抑制Rhizoctonia solani、Cytospora plurivora、Neoscytalidium dimidiatum和Armillaria spp.等植物病原菌[26-27]。然而,目前关于近深绿木霉高活性菌株的筛选与开发仍较为有限,尤其是对黄瓜枯萎病菌的抑制效果和作用机制尚不明确。本研究中,通过平板对峙试验观察到,近深绿木霉HL088菌株的生长速率显著高于黄瓜枯萎病菌,可迅速占据大部分培养空间,表现出强大的空间与营养竞争能力;此外,HL088菌株的非挥发性代谢产物对病原菌菌丝生长具有强烈的抑制活性,表明其可产生高活性拮抗物质。上述结果也验证了木霉生防功效基于多种机制的协同作用[28]。
为进一步解析近深绿木霉HL088的抑菌物质,本研究通过质谱分析技术对其粗蛋白提取物进行鉴定,成功筛选出一种具有潜在抑菌活性的蛋白TriCho75。序列分析表明,TriCho75与GH75家族壳聚糖酶具有高度同源性,并包含该家族典型的保守结构域。通过原核表达体系成功获得重组TriCho75蛋白,抑菌活性测定结果表明,该蛋白对黄瓜枯萎病菌具有显著抑制作用,不仅能够抑制菌丝生长、降低孢子萌发率,还可破坏其孢子和菌丝的结构。已有研究报道,生防微生物产生的壳聚糖酶具显著的抑制植物病原真菌活性[29]。如:枯草芽孢杆菌SH21产生的壳聚糖酶可通过引起尖孢镰刀菌菌丝消融、扭曲、异常以及细胞壁凹陷来抑制其生长[30];Pedobacter sp. PR-M6来源的壳聚糖酶对灰霉病菌、立枯丝核菌和腐皮镰刀菌均表现出抑制活性,并显著影响其孢子萌发[31]。然而,关于木霉来源壳聚糖酶在直接抑制植物病原真菌中的具体作用,目前尚未见报道。本研究首次在近深绿木霉中鉴定并功能验证了具有明确抑菌活性的壳聚糖酶TriCho75,其对病原菌的抑制和对孢子及菌丝结构的破坏作用与先前研究相一致,且直接证实了壳聚糖酶在木霉-病原真菌互作中的重要作用。这一发现从拮抗分子层面揭示了TriCho75直接参与近深绿木霉HL088抑制黄瓜枯萎病菌的机制潜能。
尽管本研究筛选并验证了TriCho75是HL088菌株重要的抗菌蛋白,但其非挥发性代谢产物对黄瓜枯萎病菌的超高抑制活性表明,蛋白类物质尚不足以完全解释其全部拮抗作用。这表明菌株代谢组中极有可能还存在其他未被发现的活性物质(如抗菌小分子、次级代谢产物或小肽等)。因此,后续研究将进一步聚焦于非蛋白类拮抗物质的挖掘,以全面解析HL088菌株中蛋白与非蛋白组分协同的拮抗机制。
-
本研究筛选并鉴定出一株对黄瓜枯萎病菌具有显著拮抗活性的近深绿木霉HL088,并明确其产生的壳聚糖酶TriCho75对黄瓜枯萎病菌表现出多重抑制作用,可有效抑制病原菌菌丝生长、孢子萌发、以及破坏菌丝和孢子的结构。上述结果表明,近深绿木霉HL088具有开发为防治黄瓜枯萎病的新型生防制剂的潜力。
Screening of antagonistic Trichoderma against Fusarium oxysporum f.sp. cucumerinum and functional analysis of its antifungal protein
-
摘要: 由尖孢镰刀菌黄瓜专化型(Fusarium oxysporum f.sp. cucumerinum)引起的黄瓜枯萎病是危害较严重的土传真菌病害之一,至今黄瓜枯萎病的有效防控仍是生产上的难点。本研究通过平板对峙法获得1株对黄瓜枯萎病菌具有显著拮抗作用的木霉菌株HL088,经形态学和分子生物学联合分析,被鉴定为近深绿木霉(Trichoderma paratroviride)。进一步通过硫酸铵分级沉淀与质谱分析,从该菌株固体发酵提取物中获得一种潜在的抑菌蛋白,壳聚糖酶TriCho75。原核表达与功能验证表明,重组蛋白TriCho75(15 μmol·L−1)能有效抑制黄瓜枯萎病菌的孢子萌发(抑制率96.44%)与菌丝生长(抑制率60.59%)。显微形态观察表明,重组蛋白TriCho75能造成黄瓜枯萎病菌孢子发生皱缩与畸形,并导致菌丝扭曲及粗细不均。以上结果表明,近深绿木霉HL088有成为黄瓜枯萎病生物防治剂的开发潜能。Abstract: Cucumber fusarium wilt, caused by Fusarium oxysporum f.sp. cucumerinum, is one of the most devastating soil-borne fungal diseases, and its effective control remains a significant challenge in agricultural production. A Trichoderma strain HL088 exhibiting pronounced antagonistic activity against the F. oxysporum was obtained through dual culture technique and screening of antifungal metabolites. Morphological and molecular identification showed the strain HL088 is Trichoderma paratroviride. Furthermore, a potential antifungal protein, chitosanase TriCho75 was identified from the solid-state fermentation extract of this strain by employing ammonium sulfate precipitation and mass spectrometry analysis. Prokaryotic expression and functional validation demonstrated that the recombinant protein TriCho75 (15 μmol·L−1) effectively inhibited both conidial germination (with an inhibition rate of 96.44%) and mycelial growth (with an inhibition rate of 60.59%) of F. oxysporum. Microscopic examination revealed that the recombinant protein TriCho75 caused shrinkage and malformation of the conidia, leading to hyphal distortion and irregular thickness in F. oxysporum. These results indicate that T. paratroviride HL088 displays its potential as a biocontrol agent for managing plant Fusarium wilt diseases.
-
图 5 空载体BL21-pET32a-His和重组蛋白TriCho75的SDS-PAGE电泳检测
M:Marker;1:BL21-pET32a;2:BL21-pET32a-TriCho75的细菌裂解液;3:BL21-pET32a-TriCho75的上样穿流液;4~5:BL21-pET32a-TriCho75洗涤液1~2:6~9:BL21-pET32a-TriCho75的洗脱液1~4
Fig. 5 SDS-PAGE analysis of BL21-pET32a and BL21-pET32a-TriCho75
Lane M is Marker; Lane 1 is BL21-pET32a; Lane 2 is the bacterial lysate of BL21-pET32a-TriCho75; Lane 3 is the loading buffer of BL21-pET32a-TriCho75; Lanes 4-5 represent wash solutions 1-2 of BL21-pET32a-TriCho75; Lanes 6-9 represent elution samples 1-4 of BL21-pET32a-TriCho75.
表 1 抑菌蛋白原核表达构建引物
Table 1 Primers for construction of prokaryotic expression vector of antimicrobial proteins
名称 Primer 引物序列(5′—3′) Sequence(5′—3′) TriCho75-BamHI-F-tycz caaggccatggctgatatcGGATCCTTTGATCTCCCAGACAACTTG TriCho75-EcoRI-R-tycz ttgtcgacggagctcGAATTCCTATGCCTGGAGACCAGCAAC 表 2 49株木霉对黄瓜枯萎病菌生长抑制率和拮抗系数
Table 2 Inhibition rate and antagonistic coefficient of 49 Trichoderma strains against F. oxysporum
菌株
Isolates抑制率/%
Inhibition
rate/%拮抗系数
Antagonistic coefficient菌株
Isolates抑制率/%
Inhibition
rate/%拮抗系数
Antagonistic coefficientHL088 87.19 ± 0.42 Ⅰ GZ034 81.39 ± 3.74* Ⅰ DQ-1 83.70 ± 1.04* Ⅲ HL008 85.71 ± 0.81* Ⅲ FJ069 88.17 ± 0.72 Ⅰ HL093 88.73 ± 0.99* Ⅰ GZ070 87.15 ± 0.62 Ⅱ HL119 83.71 ± 1.71 Ⅰ HL048 85.87 ± 1.01 Ⅳ HL131 87.71 ± 2.78 Ⅳ HL092 84.54 ± 2.28* Ⅱ NM102 83.83 ± 2.22* Ⅱ HL100 80.72 ± 1.13* Ⅱ NM167 83.00 ± 1.29* Ⅰ LS019-2 81.85 ± 1.65* Ⅴ QH060 84.46 ± 1.76* Ⅲ NM082 83.71 ± 1.52* Ⅱ SC003 85.83 ± 1.40 Ⅰ AH003 83.62 ± 1.96* Ⅰ SC008 85.65 ± 1.91* Ⅳ AH009 84.02 ± 3.73* Ⅴ SC012 84.85 ± 1.30* Ⅱ HN018 87.52 ± 1.25 Ⅰ SC013 89.74 ± 0.36 Ⅰ HN082101-2 82.04 ± 1.10* Ⅴ SC019 84.42 ± 2.43* Ⅱ HN082104-2 81.76 ± 3.40* Ⅱ SC037 84.98 ± 0.48* Ⅰ HN082106-2 83.71 ± 2.26* Ⅰ SC098 87.80 ± 2.09 Ⅴ HN082108-3 84.94 ± 0.17* Ⅳ SD002 85.58 ± 1.38* Ⅴ HN082213-4 75.19 ± 3.42* Ⅲ XJ012 87.27 ± 1.15 Ⅱ HN083003-1 81.33 ± 1.76* Ⅴ XJ028 83.79 ± 1.01* Ⅱ HN090114-2 86.08 ± 1.70 Ⅱ XJ067 89.26 ± 1.64 Ⅲ SC010 83.93 ± 1.83* Ⅱ XJ079 84.44 ± 0.93* Ⅳ SC016 83.64 ± 1.67* Ⅱ XJ081 81.85 ± 3.95* Ⅱ FJ087 84.29 ± 2.41* Ⅰ XM004-12 86.15 ± 3.43 Ⅰ GZ007 88.05 ± 0.52 Ⅱ XM005-31 86.94 ± 1.62 Ⅰ GZ018 88.90 ± 3.47 Ⅰ ZJ019 88.32 ± 0.97 Ⅰ GZ020 87.96 ± 0.87 Ⅳ 注:表中数据表示平均值±标准差(n ≥ 3),用单因素方差分析(ANOVA)和Tukey多重比较进行统计分析,*表示与所有处理中最高数值具有显著差异(P < 0.05)。 Note:Data represents mean ± SD on the basis of n ≥ 3. Significance was analyzed using one-way ANOVA with Tukey’s test; "*" indicates significant differences compared to the highest value among all treatments(P < 0.05). 表 3 49株木霉的代谢产物对黄瓜枯萎病菌的抑制率
Table 3 Inhibition rate of metabolites from 49 strains of Trichoderma on F. oxysporum
菌株
Isolates抑制率/%
Inhibition rate/%菌株
Isolates抑制率/%
Inhibition rate/%菌株
Isolates抑制率/%
Inhibition rate /%HL088 92.92 ± 0.10 HN083003-1 62.23 ± 5.05 * SC003 28.40 ± 0.91 * DQ-1 57.69 ± 1.36 * HN090114-2 14.01 ± 1.79 * SC008 55.39 ± 6.99 * FJ069 7.87 ± 1.58 * SC010 59.59 ± 1.37 * SC012 40.72 ± 2.46 * GZ070 61.64 ± 0.68 * SC016 39.55 ± 2.58 * SC013 44.66 ± 2.26 * HL048 60.24 ± 0.69 * FJ087 13.74 ± 1.60 * SC019 28.70 ± 1.68 * HL092 60.77 ± 1.06 * GZ007 45.55 ± 0.91 * SC037 24.66 ± 13.21 * HL100 60.96 ± 0.68 * GZ018 34.34 ± 2.74 * SC098 9.35 ± 0.47 * LS019-2 22.98 ± 2.16 * GZ020 39.95 ± 0.79 * SD002 6.69 ± 1.13 * NM082 65.11 ± 4.48 * GZ034 62.84 ± 3.04 * XJ012 34.45 ± 2.79 * AH003 5.63 ± 1.62 * HL008 50.62 ± 2.24 * XJ028 5.65 ± 1.15 * AH009 68.76 ± 4.22 * HL093 17.97 ± 1.82 * XJ067 15.17 ± 0.98 * HN018 58.64 ± 0.88 * HL119 38.81 ± 4.72 * XJ079 6.02 ± 0.78 * HN082101-2 12.56 ± 3.35 * HL131 54.29 ± 2.64 * XJ081 13.40 ± 1.32 * HN082104-2 71.84 ± 1.14 * NM102 15.85 ± 1.12 * XM004-12 67.69 ± 0.89 * HN082106-2 69.16 ± 1.24 * NM167 16.67 ± 0.64 * XM005-31 30.82 ± 0.68 * HN082108-3 67.59 ± 5.34 * QH060 8.68 ± 1.45 * ZJ019 8.48 ± 1.04 * HN082213-4 8.31 ± 1.05 * 注:表中数据表示平均值±标准差(n≥3),用单因素方差分析(ANOVA)和Tukey多重比较进行统计分析,*表示与所有处理中最高数值具有显著差异(P<0.05)。 Note: Data represents mean ± SD on the basis of n≥3. Significance was analyzed by using one-way ANOVA with Tukey’s test; "*" indicates significant differences compared to the highest value among all treatments(P<0.05). -
[1] 张圣平, 苗晗, 薄凯亮, 等. “十三五”我国黄瓜遗传育种研究进展[J]. 中国蔬菜, 2021(4): 16−26. https://doi.org/10.19928/j.cnki.1000-6346.2021.1015 doi: 10.19928/j.cnki.1000-6346.2021.1015 [2] Yang F, Jiang H Y, Chang G Z, et al. Effects of rhizosphere microbial communities on cucumber fusarium wilt disease suppression [J]. Microorganisms, 2023, 11(6): 1576. https://doi.org/10.3390/microorganisms11061576 doi: 10.3390/microorganisms11061576 [3] 兰成忠, 甘林, 代玉立, 等. 黄瓜枯萎病菌拮抗菌的筛选、鉴定和防效测定[J]. 中国生物防治学报, 2023, 39(1): 184−193. https://doi.org/10.16409/j.cnki.2095-039x.2023.02.006 doi: 10.16409/j.cnki.2095-039x.2023.02.006 [4] Wang R, An X Y, Lv Y D, et al. Trichoderma asperellum GD040 upregulates defense-related genes and reduces lesion size in Coffea canephora leaves inoculated with Colletotrichum cairnsense [J]. Biological Control, 2023, 181: 105213. https://doi.org/10.1016/J.BIOCONTROL.2023.105213 doi: 10.1016/J.BIOCONTROL.2023.105213 [5] 杨倩, 薛璐, 郭慧, 等. 植物根际促生菌防治黄瓜枯萎病的研究进展[J]. 中国瓜菜, 2022, 35(1): 1−8. https://doi.org/10.3969/j.issn.1673-2871.2022.01.001 doi: 10.3969/j.issn.1673-2871.2022.01.001 [6] Dong O X, Ronald P C. Genetic engineering for disease resistance in plants: recent progress and future perspectives [J]. Plant Physiology, 2019, 180(1): 26−38. https://doi.org/10.1104/pp.18.01224 doi: 10.1104/pp.18.01224 [7] 吴焕振, 杨野, 崔秀明, 等. 农业生物防治技术的现状及改进策略[J]. 生物技术进展, 2024, 14(5): 697−711. https://doi.org/10.19586/j.2095-2341.2024.0104 doi: 10.19586/j.2095-2341.2024.0104 [8] Xu S, Xie X W, Zhao Y R, et al. Whole-genome analysis of Bacillus velezensis ZF2, a biocontrol agent that protects cucumis sativus against corynespora leaf spot diseases [J]. 3 Biotech, 2020, 10(4): 186. https://doi.org/10.1007/s13205-020-2165-y doi: 10.1007/s13205-020-2165-y [9] 石义妃, 耿佩冰, 吴皓, 等. 金黄垂直链霉菌DF06的分类鉴定及防病促生作用[J]. 中国生物防治学报, 2023, 39(2): 407−417. https://doi.org/10.16409/j.cnki.2095-039x.2023.02.011 doi: 10.16409/j.cnki.2095-039x.2023.02.011 [10] Yang F, Jiang H Y, Ma K, et al. Genome sequencing and analysis of Bacillus velezensis VJH504 reveal biocontrol mechanism against cucumber Fusarium wilt [J]. Frontiers in Microbiology, 2023, 14: 1279695. https://doi.org/10.3389/FMICB.2023.1279695 doi: 10.3389/FMICB.2023.1279695 [11] Wang R, Yu X L, Yin Y P, et al. Biocontrol of cucumber Fusarium wilt by Trichoderma asperellum FJ035 dependent on antagonism and spatiotemporal competition with Fusarium oxysporum [J]. Biological Control, 2023, 186: 105334. https://doi.org/10.1016/j.biocontrol.2023.105334 doi: 10.1016/j.biocontrol.2023.105334 [12] Chen J L, Sun S Z, Miao C P, et al. Endophytic Trichoderma gamsii YIM PH30019: a promising biocontrol agent with hyperosmolar, mycoparasitism, and antagonistic activities of induced volatile organic compounds on root-rot pathogenic fungi of Panax notoginseng [J]. Journal of Ginseng Research, 2016, 40(4): 315−324. https://doi.org/10.1016/j.jgr.2015.09.006 doi: 10.1016/j.jgr.2015.09.006 [13] Tyśkiewicz R, Nowak A, Ozimek E, et al. Trichoderma: the current status of its application in agriculture for the biocontrol of fungal phytopathogens and stimulation of plant growth [J]. International Journal of Molecular Sciences, 2022, 23(4): 2329. https://doi.org/10.3390/ijms23042329 doi: 10.3390/ijms23042329 [14] Lv D M, Zhang WX, Meng X F, et al. A novel fusion transcription factor drives high cellulase and xylanase production on glucose in Trichoderma reesei [J]. Bioresource Technology, 2023, 370: 128520. https://doi.org/10.1016/j.biortech.2022.128520 doi: 10.1016/j.biortech.2022.128520 [15] Zhan X, Wang R, Zhang M M, et al. Trichoderma-derived emodin competes with ExpR and ExpI of Pectobacterium carotovorum subsp. carotovorum to biocontrol bacterial soft rot [J]. Pest Management Science, 2024, 80(3): 1039−1052. https://doi.org/10.1002/ps.7835 doi: 10.1002/ps.7835 [16] Xing M Y, Zhao J, Zhang J Y, et al. 6-Pentyl-2H-pyran-2-one from Trichoderma erinaceum is fungicidal against litchi downy blight pathogen Peronophythora litchii and preservation of litchi [J]. Journal of Agricultural and Food Chemistry, 2023, 71(49): 19488−19500. https://doi.org/10.1021/acs.jafc.3c03872 doi: 10.1021/acs.jafc.3c03872 [17] Long W Q, Chen Y F, Wei Y Z, et al. A newly isolated Trichoderma parareesei N4-3 exhibiting a biocontrol potential for banana fusarium wilt by Hyperparasitism [J]. Frontiers in Plant Science, 2023, 14: 1289959. https://doi.org/10.3389/FPLS.2023.1289959 doi: 10.3389/FPLS.2023.1289959 [18] 陈迪, 侯巨梅, 邢梦玉, 等. 7株木霉菌对火龙果3种病原菌的拮抗作用[J]. 热带作物学报, 2020, 41(12): 2501−2506. https://doi.org/10.3969/j.issn.1000-2561.2020.12.018 doi: 10.3969/j.issn.1000-2561.2020.12.018 [19] Wang R, Liang X, Long Z, et al. An LCI-like protein APC2 protects ginseng root from Fusarium solani infection [J]. Journal of Applied Microbiology, 2021, 130(1): 165−178. https://doi.org/10.1111/jam.14771 doi: 10.1111/jam.14771 [20] 罗汶婧, 王博瑞, 马红彬, 等. 合成菌群在促进农业可持续发展中的研究进展[J]. 微生物学报, 2025, 65(10): 4308−4325. https://doi.org/10.13343/j.cnki.wsxb.20250213 doi: 10.13343/j.cnki.wsxb.20250213 [21] 韩锦, 高明博, 王林虹, 等. 生物农药在可持续农业发展中的应用与前景[J]. 西北农业学报, 2025, 34(8): 1373−1385. https://doi.org/10.7606/j.issn.1004-1389.2025.08.001 doi: 10.7606/j.issn.1004-1389.2025.08.001 [22] Woo S L, Hermosa R, Lorito M, et al. Trichoderma: a multipurpose, plant-beneficial microorganism for eco-sustainable agriculture [J]. Nature Reviews Microbiology, 2023, 21(5): 312−326. https://doi.org/10.1038/s41579-022-00819-5 doi: 10.1038/s41579-022-00819-5 [23] Xue M, Wang R, Zhang C Y, et al. Screening and identification of Trichoderma strains isolated from natural habitats in China with potential agricultural applications [J]. BioMed Research International, 2021, 2021(1): 7913950. https://doi.org/10.1155/2021/7913950 doi: 10.1155/2021/7913950 [24] Jaklitsch W M, Voglmayr H. Biodiversity of Trichoderma(Hypocreaceae)in southern europe and macaronesia [J]. Studies in Mycology, 2015, 80(1): 1−87. https://doi.org/10.1016/j.simyco.2014.11.001 doi: 10.1016/j.simyco.2014.11.001 [25] 张广志, 张新建, 陈凯, 等. 木霉属中国新记录种Trichoderma paratroviride[J]. 山东科学, 2015, 28(5): 35−40. https://doi.org/10.3976/j.issn.1002-4026.2015.05.006 doi: 10.3976/j.issn.1002-4026.2015.05.006 [26] Wang C, Zhang W Y. Evaluating effective Trichoderma isolates for biocontrol of Rhizoctonia solani causing root rot of Vigna unguiculata [J]. Journal of Integrative Agriculture, 2019, 18(9): 2072−2079. https://doi.org/10.1016/S2095-3119(19)62593-1 doi: 10.1016/S2095-3119(19)62593-1 [27] Chen L Q, Bóka B, Kedves O, et al. Towards the biological control of devastating forest pathogens from the genus Armillaria [J]. Forests, 2019, 10(11): 1013. https://doi.org/10.3390/f10111013 doi: 10.3390/f10111013 [28] Guzmán-Guzmán P, Etesami H, Santoyo G. Trichoderma: a multifunctional agent in plant health and microbiome interactions [J]. BMC Microbiology, 2025, 25(1): 434. https://doi.org/10.1186/s12866-025-04158-2 doi: 10.1186/s12866-025-04158-2 [29] Han Y J, Gao P X, Yu W G, et al. N-Terminal seven-amino-acid extension simultaneously improves the pH stability, optimal temperature, thermostability and catalytic efficiency of chitosanase CsnA [J]. Biotechnology Letters, 2018, 40(1): 83. https://doi.org/10.1007/s10529-017-2444-9 doi: 10.1007/s10529-017-2444-9 [30] Pang Y X, Yang J J, Chen X Y, et al. An antifungal chitosanase from Bacillus subtilis SH21 [J]. Molecules, 2021, 26(7): 1863. https://doi.org/10.3390/MOLECULES26071863 doi: 10.3390/MOLECULES26071863 [31] SONG Y S, SEO D J, JUNG W J. Characterization and antifungal activity of chitosanase produced by Pedobacter sp. PR-M6 [J]. Microbial Pathogenesis, 2019, 129: 277−283. https://doi.org/10.1016/j.micpath.2019.02.026 doi: 10.1016/j.micpath.2019.02.026 -

 点击查看大图
点击查看大图
计量
- 文章访问数: 92
- HTML全文浏览量: 46
- 被引次数: 0




 下载:
下载: