-
主持人:郭志强
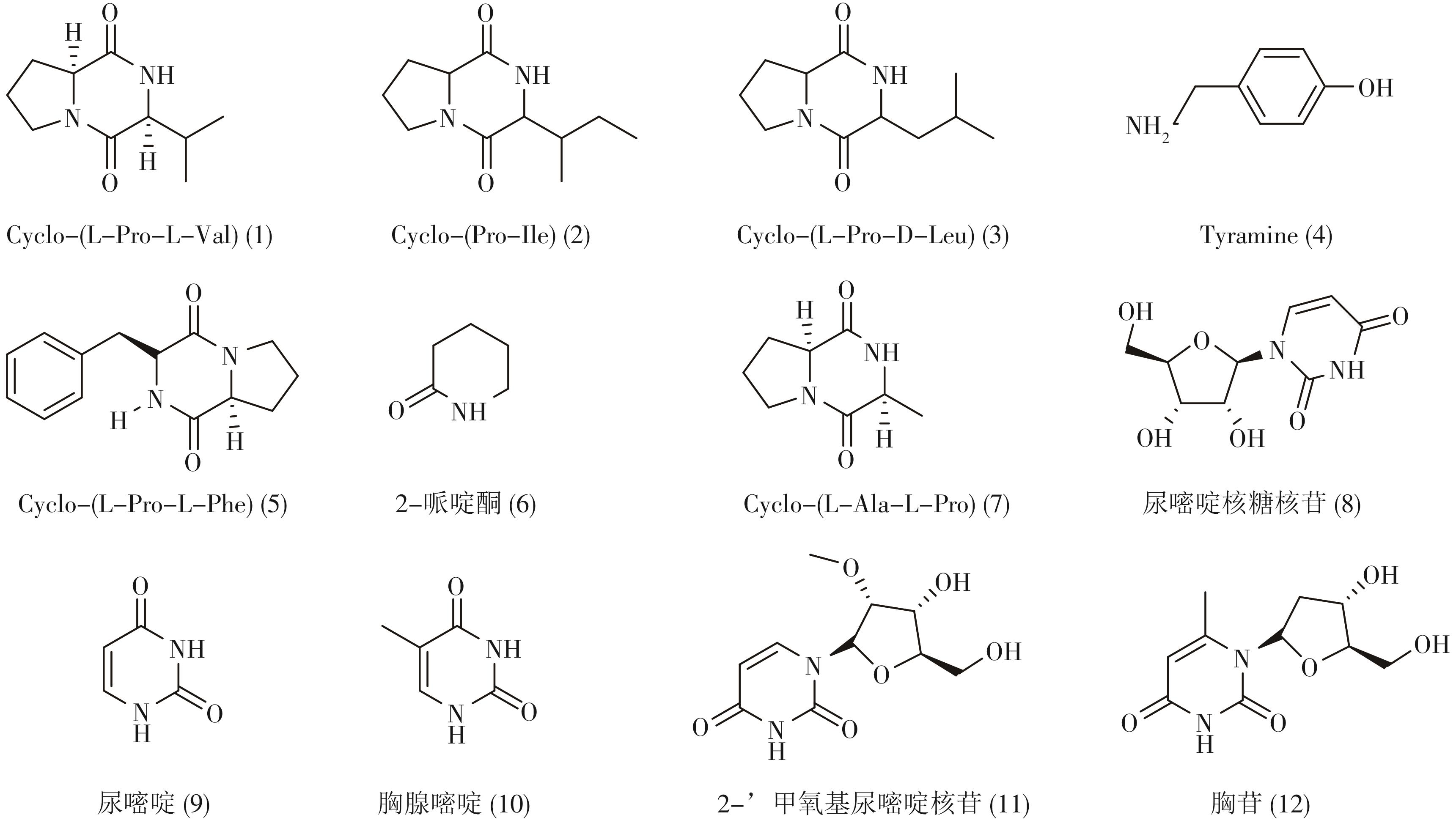
瘤背石磺(Onchidium struma)是一种南海特色资源,又名土海参、土鲍、泥龟等,属软体动物门,腹足纲,缩柄眼目,石磺科,是进化的无壳贝类[1];常分布于我国海南、广西、广东、上海、江苏等地的沿海低盐度的潮间带高潮区;石磺有治哮喘、助消化、消除疲劳、明目的功效[2],具有重要的药用价值。由于石磺早期研究材料属种尚未完善,系统分类滞后,石磺研究的步伐相对缓慢,目前对石磺的研究主要集中在分类、繁殖、神经系统、多糖、营养价值等方面[3]。Marianna等[4]从石磺中分离获得1种吡喃酮聚丙酸酯,Wang等[5]对3种聚丙酸酯类化合物进行了结构再鉴定,王博闻[6]等从瘤背石磺中提取分离1个新型酰胺类化合物onchumamide,对人肿瘤细胞具有中等毒性活性。石磺的化学成分及药理活性研究虽得到进一步发展,但关于瘤背石磺的化学成分研究还不够全面。为了深入阐明瘤背石磺的活性成分,开发我国特色海洋资源,本研究采用多项分离纯化方法,包括硅胶、凝胶、薄层色谱及半制备高效液相等,对瘤背石磺乙酸乙酯浸膏进行分离纯化,得到12个化合物。测定它们的理化性质和波谱数据,和文献比较,结构鉴定为Cyclo-(L-Pro-L-Val) (1)、Cyclo-(Pro-Ile) (2)、Cyclo-(L-Pro-D-Leu) (3)、Tyramine (4)、Cyclo-(L-Pro-L-Phe) (5)、2-哌啶酮 (6)、Cyclo-(L-Ala-L-Pro) (7)、尿嘧啶核糖核苷(8)、尿嘧啶(9)、胸腺嘧啶(10)、2’-甲氧基尿嘧啶核苷(11)、胸苷(12),其中,化合物(1 ~ 6,11)均为首次从瘤背石磺中分离得到。
-
BRUKERAV Ⅲ 400和600型核磁共振仪(德国布鲁克公司);硅胶(200 ~ 300目,青岛海洋化工有限公司);Sephadex LH-20(凝胶柱色谱);硅胶薄层板(青岛海洋化工有限公司,GF254,0.20 ~ 0.25 mm);高效液相采用岛津液相色谱LC-16系统,配SPD-16检测器和YMC柱(ODS,2.5 mm×250 mm, 5 μm);甲醇、乙酸乙酯为分析纯(广州西陇化工股份有限公司),HPLC等均为色谱纯(天津市康科德科技有限公司)。
-
样品于2021年9月采集于海南临高,样品种属由海南医学院李友宾研究员鉴定为瘤背石磺。样品采集后于-20 ℃保存于海南医学院药学院重点实验室。
-
将采集的瘤背石磺20 kg用甲醇提取3次,每次7 d,合并提取液,低温减压浓缩得到666.9 g的浸膏;将浸膏溶于50%甲醇中,随后用醋酸乙酯进行萃取,合并萃取液并低温减压浓缩,获得3.6 g的醋酸乙酯浸膏[7];将醋酸乙酯浸膏经过硅胶柱层析完成粗组分的分离,二氯甲烷/丙酮梯度洗脱(体积比=1∶0-0∶1),根据化合物的极性分布,得到6个组分(记为A-F)。B2-B5经Sephadex LH-20柱色谱,采用甲醇作为洗脱得到5个组分(记为Fr B 2-5① ~ ⑤),Fr B2-5①经半制备高效液相色谱(50%甲醇,流速2 mL·min-1,UV=210,254 nm)得到化合物1(0.7 mg)、化合物2(2.3 mg)、化合物3(5.3 mg)。C1-C4经Sephadex LH-20柱色谱,采用甲醇作为洗脱得到7个组分(FrC1-4① ~ ⑦),Fr C1-4②经半制备高效液相色谱(甲醇-0.1%甲酸水=1∶1,流速2 mL·min-1,UV=210,254 nm)得到化合物4(6.4 mg)、化合物5(1.6 mg)。C9-C11经Sephadex LH-20柱色谱,采用甲醇作为洗脱得到6个组分(Fr C1-4① ~ ⑥),Fr C9-11①经半制备高效液相色谱(45%甲醇,流速2 mL·min-1,UV=210,254 nm)得到化合物6(2.5 mg)。D1-D5经Sephadex LH-20柱色谱,采用甲醇作为洗脱得到7个组分(Fr D1-5① ~ ⑦),Fr D1-5①经半制备高效液相色谱(30%甲醇,流速2 mL·min-1,UV=210,254 nm)得到化合物7(1.7 mg);Fr D1-5③采用同样的条件得到化合物9(17.2 mg)、化合物10(14.6 mg)。D6-D9经半制备高效液相色谱(30%甲醇,流速2 mL·min-1,UV=210,254 nm)得到化合物8(14.1 mg)。F1经Sephadex LH-20柱色谱,采用甲醇作为洗脱得到5个组分(Fr F1① ~ ⑤),F1②经半制备高效液相色谱(20%甲醇,流速2 mL·min-1,UV=210,254 nm)得到化合物11(2.8 mg)、化合物12(46.8 mg)。
-
笔者从瘤背石磺乙酸乙酯层中一共分离得到12个化合物,并根据1H NMR、13C NMR 和ESI-MS数据鉴定了化合物1 ~ 12的结构(图1)。
化合物1:白色粉末,核磁波谱数据:1H NMR (600 MHz, CD3OD)δH: 4.17 (1H, t, J=7.2 Hz, H-2), 4.00 (1H, s, H-5), 3.52 (2H, m, H-1'), 2.46 (1H, m, H-3’), 2.29 (1H, m, H-3’), 1.99 (1H, m, H-4’), 1.91 (2H, m, H-2’), 1.07 (3H, d, J=7.2 Hz, H-5’), 0.91 (3H, d, J=7.2 Hz, H-5’); 13C NMR (600 MHz, CD3OD)δC: 171.1 (C-3), 166.1 (C-6), 60.1 (C-2), 58.6 (C-5), 44.7 (C-1’), 28.4 (C-4’), 28.1 (C-3’), 21.8 (C-2’), 17.4 (C-5’), 15.2 (C-5’)。以上数据经与文献[8]对照,基本一致,确定化合物结构为Cyclo-(L-Pro-L-Val)。
化合物2:白色粉末,核磁波谱数据:1H NMR (600 MHz, CD3OD)δH: 4.19 (1H, t, J=8.4 Hz, H-6), 4.07(1H, d, J=4.8 Hz, H-9), 3.53 (2H, m, H-3), 2.32 (1H, m, H-10), 2.16 (1H, m, H-5a), 2.03 (1H, m, H-4a), 1.95 (1H, m, H-5), 1.93 (1H, m, H-4b), 1.44 (1H, m, H-11a), 1.31 (1H, m, H-11b), 1.07 (3H, d, J=7.1 Hz, H-13), 0.93 (3H, t, J=7.2 Hz, H-12) ; 13C NMR (600 MHz, CD3OD)δC:171.1 (C-1), 166.2 (C-7), 59.9 (C-9), 58.6 (C-6), 44.8 (C-3), 35.6 (C-10), 28.1 (C-5), 24.0 (C-11), 21.8 (C-4), 14.1(C-13), 11.2(C-12)。以上数据经与文献[9]对照,基本一致,确定化合物结构为Cyclo-(Pro-Ile)。
化合物3:白色粉末,核磁波谱数据:1H NMR (600 MHz, CD3OD)δH: 4.26 (1H, t, J=9.0 Hz, H-3), 4.13 (1H, m, H-1), 3.51 (2H, m, H-7), 2.31 (1H, m, H-5b), 2.04 (1H, m, H-5a), 2.03 (1H, m, H-6b), 2.01 (1H, m, H-8b), 1.93 (1H, m, H-6a), 1.89 (1H, m, H-9), 1.51 (1H, m, H-8a), 0.96 (3H, d, J=4.2 Hz, H-10), 0.95 (3H, d, J=3.6Hz, H-11); 13C NMR (600 MHz, CD3OD)δC: 171.4 (C-4), 167.5 (C-2), 58.9 (C-3), 53.2 (C-1), 45.0 (C-7), 38.0 (C-8), 27.7 (C-5), 24.4 (C-6), 22.3 (C-9), 21.9 (C-10), 20.8 (C-11)。以上数据经与文献[9]对照,基本一致,确定化合物结构为Cyclo-(L-Pro-D-Leu)。
化合物4:无色固体,核磁波谱数据:1H NMR (600 MHz, CD3OD)δH: 7.00 (2H, d, J=8.4 Hz, H-2,6), 6.64 (2H, d, J=8.4 Hz, H-3,5), 2.78 (2H, t, J=8.4 Hz, H-8); 13C NMR (600 MHz, CD3OD)δC:155.3 (C-4), 129.7 (C-2), 128.4 (C-1), 114.5 (C-3), 41.2 (C-8), 29.2 (C-7)。以上数据经与文献[10]对照,基本一致,确定化合物结构为Tyramine。
化合物5:白色粉末,核磁波谱数据:1H NMR (600 MHz, CD3OD)δH: 7.20-7.26 (1H, m, H-2’), 7.20-7.26 (1H, m, H-3’), 7.20-7.26 (1H, m, H-4’), 4.41 (1H, ddd, J=1.2,4.8,10.2 Hz, H-9), 4.04 (1H, ddd, J=1.8, 6.0, 12.6 Hz, H-6), 3.50 (1H, m, H-3a), 3.34 (1H, m, H-3b), 3.14 (1H, dd, J=3.0, 14.4 Hz, H-10a), 3.13 (1H, dd, J=3.0, 14.4 Hz, H-10b), 2.06 (1H, m, H-5b), 1.78 (2H, m, H-4), 1.20 (1H, m, H-5a); 13C NMR (600 MHz, CD3OD)δC: 169.6 (C-7), 165.5 (C-1), 136.6 (C-1’), 129.6 (C-2’), 128.0(C-3’), 126.6 (C-4’), 58.6 (C-6), 56.2 (C-9), 44.5 (C-3), 36.8 (C-10), 27.9 (C-5), 21.3 (C-4)。以上数据经与文献[11]对照,基本一致,确定化合物结构为Cyclo-(L-Pro-L-Phe)。
化合物6:淡黄色油状物,核磁波谱数据:1H NMR (600 MHz, CD3OD)δH: 3.24 (2H, m, H-6), 2.27 (2H, m, H-3), 1.78 (2H, m, H-4), 1.73 (2H, m, H-5); 13C NMR (600 MHz, CD3OD)δC: 173.5 (C-2), 41.5 (C-6), 30.5 (C-3), 21.6(C-4), 20.2 (C-5)。以上数据经与文献[12]对照,基本一致,确定化合物结构为2-哌啶酮。
化合物7:白色针晶,核磁波谱数据:1H NMR (600 MHz, CD3OD)δH: 4.23 (1H, m, H-2), 4.16 (1H, m, H-2’), 3.50 (2H, m, H-5), 2.27 (1H, m, H-3a), 2.00 (3H, m, H-3b), 1.36 (3H, d, J=6.8Hz, H-3’);13C NMR (600 MHz, CD3OD)δC: 171.6 (C-1), 168.9 (C-1’), 59.0 (C-2), 50.6 (C-2’), 45.0 (C-5), 27.7 (C-3), 22.2 (C-4), 14.3 (C-3’)。以上数据经与文献[13]对照,基本一致,确定化合物结构为Cyclo-(L-Ala-L-Pro)。
化合物8:白色固体,核磁波谱数据:1H NMR (600 MHz, CD3OD)δH: 7.39 (1H, d, J=7.2 Hz, H-6), 5.46 (1H, d, J=7.7 Hz, H-1’), 5.00 (1H, d, J=3.6 Hz, H-5), 4.62 (1H, d, H-2’), 4.62 (1H, m, H-3’), 3.83 (1H, m, H-4’), 3.76 (1H, dd, J=6.1,10.3 Hz, H-5’a), 3.71 (1H, dd, J=7.6,11.6 Hz, H-5’b);13C NMR (600 MHz, CD3OD)δC: 164.8 (C-4), 152.0 (C-2), 142.7 (C-6), 108.5 (C-5), 100.7 (C-1’), 84.0 (C-4’), 74.7 (C-3’), 71.4 (C-2’), 63.6 (C-5’)。以上数据经与文献[14]对照,基本一致,确定化合物结构为尿嘧啶核糖核苷。
化合物9:白色固体,核磁波谱数据:1H NMR (600 MHz, CD3OD)δH: 7.35 (1H, d, J=10.8 Hz, H-6), 5.41 (1H, d, J=11.4 Hz, H-5) ; 13C NMR (600 MHz, CD3OD)δC: 164.9 (C-5), 152.1 (C-2), 142.9 (C-6), 100.7 (C-6) 。以上数据经与文献[15]对照,基本一致,确定化合物结构为尿嘧啶。
化合物10:白色无定型粉末,核磁波谱数据:1H NMR (600 MHz, CD3OD)δH: 10.80 (2H, br s, 1-NH,3-NH), 1.73 (3H, d, J=1.2 Hz, H-7);13C NMR (600 MHz, CD3OD)δC: 165.4 (C-4), 152.0 (C-2), 138.3 (C-6), 108.1 (C-5), 12.3 (C-7)。以上数据经与文献[16]对照,基本一致,确定化合物结构为胸腺嘧啶。
化合物11:白色粉末,核磁波谱数据:1H NMR (600 MHz, CD3OD)δH: 8.05 (1H, d, J=8.4 Hz, H-6), 5.92 (1H, d, J=3.6 Hz, H-1’), 5.66 (1H, d, J=7.8 Hz, H-5), 4.21 (1H, t, J=5.4 Hz, H-3’), 3.95 (1H, d, J=3.0 Hz, H-4’), 3.83 (1H, d, J=12.4 Hz, H-5’a), 3.81 (1H, d, J=6.8 Hz, H-2’), 3.73 (1H, d, J=9.4 Hz, H-5’b);13C NMR (600 MHz, CD3OD)δC: 168.9 (C-4), 151.4 (C-2), 140.9 (C-6), 101.1 (C-5), 87.4 (C-1’), 84.6 (C-4’), 83.6 (C-2’), 68.3 (C-3’), 60.2 (C-5’), 57.4 (-OCH3)。以上数据经与文献[17]对照,基本一致,确定化合物结构为2’-甲氧基尿嘧啶核苷。
化合物12:无色针晶,核磁波谱数据:1H NMR (600 MHz, CD3OD)δH: 7.46 (1H, d, J=2.4 Hz, H-2), 6.07 (1H, t, J=10.2 Hz, H-1’), 4.28 (1H, dt, J=3.0,6.0 Hz, H-4’), 3.83 (1H, q, J=6.6 Hz, H-3’), 3.64 (2H, m, H-5’), 2.16 (2H, m, H-2’), 1.68 (3H, d, J=1.8Hz, H-7); 13C NMR (600 MHz, CD3OD)δC: 166.6 (C-5), 151.8 (C-6), 137.4 (C-2), 111.3 (C-3), 86.5 (C-1’), 85.0 (C-4’), 70.4 (C-3’), 61.2 (C-5’), 38.6 (C-2’), 11.6 (C-7) 。以上数据经与文献[18]对照,基本一致,确定化合物结构为胸苷。
本研究从瘤背石磺中分离得到12个化合物,包含5个(化合物1 ~ 3、5和7)环二肽类化合物,5个(化合物8 ~ 12)核苷类化合物,2个(化合物4和6)其他类化合物。
-
本研究通过对瘤背石磺甲醇提取物的乙酸乙酯部位进行化学成分的分离,应用多种色谱和波谱鉴定方法,从南海瘤背石磺的乙酸乙酯部位中分离纯化得到12个化合物,其中包括5个环二肽类化合物,5个核苷类化合物,2个其他类化合物,其中化合物1 ~ 6和化合物11为首次从瘤背石磺中分离得到,化合物1 ~ 3和化合物5均为环二肽类化合物。
本研究丰富了瘤背石磺的环二肽类成分,使瘤背石磺的化学成分得到进一步完善。环二肽类化合物在药物化学中是个重要的药效基团,具有很强的生理活性,研究表明,环二肽具有抑制毒素、细胞凋亡、镇痛、抗糖尿病等生理活性。化合物1为RXRα受体的部分激动剂,对RXRα受体起竞争性促进作用。且随着浓度增强,竞争性越强,对RXRα受体转录活性的促进作用越弱。其存在影响与核受体相关的疾病,如肥胖,糖尿病,肺癌,乳腺癌等的潜在能力[19]。据报道,化合物1、3、5显示抗鳗弧菌作用,其MIC值分别为0.05、0.05、0.03 ug·mL-1[20]。化合物4(Tyramine)能通过痕量胺相关受体(TAAR1)减少血清素能和多巴胺能信号传导,在突触间隙中作为神经递质起着至关重要的作用[21],对帕金森病、亨廷顿病、偏头痛等神经性疾病的药物研究起到一定的启发作用。化合物7在浓度为400 ug·mL-1,12 h时内对南方根结线虫表现出较好的麻痹效果,而在18 h时,这种麻痹效果基本解除[22]。后续可对化合物1 ~ 5以及化合物7进行进一步研究,丰富瘤背石磺提取物的生物活性。
本研究通过对南海瘤背石磺的化学成分进行深入研究,获得了多种结构的化合物,进一步丰富了瘤背石磺的化学成分的多样性,尤其是环二肽类成分的发现,进一步完善了瘤背石磺化学成分和生物活性的多样性,为瘤背石磺的成分研究提供了理论依据,可为后续瘤背石磺的化学成分和生物活性的研究提供参考。
Analysis of chemical constituents of extracts from Onchidium verruculatum
-
摘要: 采用多种分离纯化方法,包括硅胶、凝胶、薄层色谱以及半制备高效液相等;并结合瘤背石磺生化特性、NMR数据分析及文献比较,对化合物进行结构鉴定。从瘤背石磺中分离鉴定出12个化合物,经鉴定结构为Cyclo-(L-Pro-L-Val)( 1 )、Cyclo-(Pro-Ile)( 2 )、Cyclo-(L-Pro-D-Leu)( 3 )、Tyramine(4)、Cyclo-(L-Pro-L-Phe)( 5 )、2-哌啶酮( 6 )、Cyclo-(L-Ala-L-Pro)( 7 )、尿嘧啶核糖核苷( 8 )、尿嘧啶( 9 )、胸腺嘧啶( 10 )、2’-甲氧基尿嘧啶核苷( 11 )、胸苷( 12 )。化合物( 1 ~ 6 , 11 )均为首次从瘤背石磺中分离得到。Abstract: Onchidium verruculatum, a characteristic resource in the South China Sea, was extracted and isolated by using a variety of separation and purification methods, including silica gel, Sephadex LH-20, thin layer chromatography and semi-prepared HPLC. The structures of the compounds were identified by combining their biochemical characteristics, NMR data analysis and reference comparison. Twelve compounds were isolated from Onchidium verruculatum, and their structures were identified as Cyclo-(L-Pro-L-Val) ( 1 ), Cyclo-(Pro-Ile) ( 2 ), Cyclo-(L-Pro-D-Leu) ( 3 ), Tyramine ( 4 ), Cyclo-(L-Pro-L-Phe) ( 5 ), 2-Piperidone ( 6 ), Cyclo-(L-Ala-L-Pro) ( 7 ), uracil ribonucleoside ( 8 ), uracil ( 9 ), thymine ( 10 ), 2'-methoxyuracil nucleoside ( 11 ), thymidine ( 12 ). Compounds ( 1-6, 11 ) were isolated for the first time from Onchidium verruculatum.
-
Key words:
- Onchidium verruculatum /
- chemical constituent /
- HPLC
注释:1) 钟云芳 -
[1] 宋佩林. 瘤背石磺多糖的分离纯化、理化性质及降血糖活性研究 [D]. 镇江: 江苏大学, 2020. [2] 吕庭莉, 杲绍强, 张虎, 等. 瘤背石磺体腔细胞分类、免疫相关酶特性及初步转录组学分析 [J]. 海洋学报, 2022, 44(2): 84-93. [3] 孙变娜, 沈和定, 吴洪喜, 等. 崇明岛瘤背石磺的化学成分研究 [J]. 天然产物研究与开发, 2014, 26(7): 987-989. [4] CARBONE M, GAVAGNIN M, MATTIA C A, et al. Structure of onchidione, a bis-γ-pyrone polypropionate from a marine pulmonate mollusk [J]. Tetrahedron, 2009, 65(22): 4404-4409. [5] WANG J R, CARBONE M, GAVAGNIN M, et al. Assignment of absolute configuration of bis-γ-pyrone polypropionates from marine pulmonate molluscs [J]. European Journal of Organic Chemistry, 2012(6): 1107-1111. [6] 王博闻, 陈德力, 马国需, 等. 瘤背石磺中1个新的酰胺类化合物 [J]. 中草药, 2019, 50(23): 5666-5669. [7] 陈德力, 刘洋洋, 冯剑,等. 一种瘤背石磺提取物的制备方法和应用:201710636701.8[P].2017-11-24. [8] 艾文, 林秀萍, 秦淳, 等. 一株红树植物秋茄内生真菌次级代谢产物的研究 [J]. 中国海洋药物, 2014, 33(3): 76-80. [9] 李旸, 王芳, 张普照, 等. 美洲大蠊化学成分研究 [J]. 中药材, 2015, 38(10): 2038-2041. [10] SUN J F, WU Y, YANG B, et al. Chemical constituents of marine sponge Halichondria sp. from South China Sea [J]. Chemistry of Natural Compounds, 2015, 51(5): 975-977. [11] FURTADO N A J C, PUPO M T, CARVALHO I, et al. Diketopiperazines produced by an Aspergillus fumigatus Brazilian strain [J]. Journal of the Brazilian Chemical Society, 2005, 16(6b): 1448-1453. [12] 李国强, 李韵仪, 李桃, 等. 水蛭的化学成分研究 [J]. 天津中医药, 2018, 35(9): 703-705. [13] 林宗豪, 丁文平, 李艳群, 等. 海洋来源放线菌Demequina litorisediminis SCSIO 53428的化学成分研究 [J]. 中南药学, 2020, 18(2): 213-217. [14] 周淑梅, 周琨, 肖定军. 南海小束格海绵中的天然含氮化合物 [J]. 中国海洋药物, 2005, 24(4): 31-35. [15] 汤婧, 徐锐, 赵雪, 等. 亚洲兰茂牛肝菌的化学成分及其活性 [J]. 菌物学报, 2023, 42(6): 1345-1359. [16] 胡一丹, 俞立. 半夏生物碱类化学成分研究 [J]. 中国处方药, 2022, 20(1): 32-34. [17] 洪奎, 谢雪, 王雪晶, 等. 红花中含氮类化学成分研究 [J]. 中草药, 2014, 45(21): 3071-3073. [18] 金天云, 孙凤清, 唐旭利, 等. 养殖喘水苔海绵Tedania anhelans化学成分及其生物活性研究 [J]. 中国海洋药物, 2022, 41(1): 45-50. [19] 林伟翔. 两株深海放线菌抗肿瘤活性成分研究 [D]. 广州: 广东药科大学, 2019. [20] 李德海, 顾谦群, 朱伟明, 等. 海洋放线菌11014中抗肿瘤活性成分的研究 I.环二肽 [J]. 中国抗生素杂志, 2005, 30(8): 449-452. [21] DHAKAL S, MACREADIE I. Tyramine and amyloid beta 42: a toxic synergy [J]. Biomedicines, 2020, 8(6): 145. [22] 包正雪. 两株紫色紫孢菌(Purpureocillium lavendulum)中的次生代谢产物及其杀线虫活性[D]. 昆明: 云南大学, 2022. -






 下载:
下载:
