-
水稻是全世界重要的粮食作物之一,其产量的稳定对粮食安全具有重要的意义[1]。白叶枯病是水稻三大病害之一,也是一个世界性水稻病害。常规发病时可使水稻减产10%~20%,严重时减产50%以上,甚至绝收[2]。目前,对于该病的化学防治存在见效差,成本高和污染重等缺陷[3],因此培育抗白叶枯病的水稻新品种是控制该病的绿色、经济有效的办法。准确的抗性鉴定是培育抗病品种的前提条件,当前对水稻白叶枯病的抗性鉴定大多是在田间利用“剪叶法”进行人工接种。但是在大田接种会出现以下问题:1)由于田间环境因素复杂多变,难以保证抗性结果的一致性及稳定性;2)接种叶片上的菌液,随着风雨或者水流,迁移至其他的水稻田,危及周边水稻的产量。水稻白叶枯病离体鉴定能解决上述问题。迄今,国内外关于水稻白叶枯病的离体鉴定只有少量报道。何汉生等[4]发现了接种叶脉喷菌量、菌株数与田间病斑长度和病级的相关性;朱永生等[1]在离体叶片保绿营养液(成分为蔗糖、柠檬酸、硫酸铝、8−羟基喹啉)的基础上,建立水稻白叶枯病离体鉴定体系。由于接种叶脉的喷菌量存在难以精准测量及含蔗糖保绿液的易污染的问题。因此,本研究期望建立一种简易、稳定的水稻白叶枯病离体抗病性鉴定体系,避免田间接种菌液带来的安全隐患,进而助力水稻抗白叶枯病分子育种。
-
供试水稻材料为本实验室保存的田间抗性鉴定5个等级的种质,分别为高抗白叶枯病种质(HR)ZS261(由中国水稻研究所提供)、抗病种质(R)ZS061(由上海市农业生物基因中心提供)、中抗种质(MR)ZS353(中国农业科学院作物科学研究所提供)、中感种质(MS)ZS074(由上海市农业生物基因中心提供)、感病种质(S)ZS176(由湖南杂交水稻研究中心提供)。供试白叶枯病菌为海南优势生理小种HN01,由本实验室提供。
-
田间选取生长健壮、叶色浓绿、无病无害的稻叶,剪取若干,进行水稻叶片离体保绿体系的摸索。叶片均取自三亚崖州区海南大学坝头基地(18.225 109°N,109.093 36°E)。
-
白叶枯病菌冰上融化,在超净工作台用枪头蘸取菌液在PSA培养基(马铃薯蔗糖琼脂培养基)上划线,吹干后,用封口膜密封平板边缘,放在28 ℃培养箱中倒置培养3~5 d。蘸取新长出的单菌落在新的PSA平板上划线,培养3~4 d扩繁,备用。
田间接种:刮取白叶枯病菌,用无菌水稀释成3×108 个·mL−1,用剪刀蘸取菌液,剪去田间水稻叶尖1~2 cm,每株水稻剪3~5片叶子,每剪完1株水稻重新蘸取1次菌液。接菌后一般14 d后观察发病情况,统计病斑长度。
离体叶片接种:用灭菌剪刀蘸取菌液剪取水稻叶片中部成6 cm的叶片段,每处理剪取3个叶片,再设不接菌叶片为对照组。用橡皮筋将3张叶片的一端归置整齐后用橡皮筋捆成1捆,然后将整齐的一端朝下放入装有300 mL营养液的2 L塑料烧杯中,上覆塑料薄膜,用橡皮筋扎口保湿,放入28 ℃光照培养箱中,设定光照时间为12 h,黑暗培养时间为12 h。培养7 d后观察、拍照、统计发病情况。
-
早在1992年,游树鹏等[5]比较了 1.0 µmol·L−1(约0.22 mg·L−1)TDZ与5 mg·L−1 6-BA对大麦离体叶片的保鲜效果,张桂春等[6]研究结果表明3 mg·L−1 KT对小麦离体叶片具有良好的保鲜效果。鉴于大麦、小麦与水稻同属禾本科植物,因此本研究对3种植物激素分别设置6个:1)6-BA分别为0、3、4、5、6、7 mg·L−1;2)KT质量浓度分别为0、1、2、3、4、5 mg·L−1;3)TDZ质量浓度分别为0、0.1、0.16、0.22、0.28、0.34 mg·L−1。为探究对不同长度的离体叶片的保绿效果,分别处理了8、12、16 cm叶片。将300 mL营养液倒入2 L的塑料烧杯中,从分蘖盛期的水稻植株上每个品种或单株取3张长度一致的不带杆的完全展开叶片。用橡皮筋将3张叶片的一端归置整齐后用橡皮筋捆成1捆,然后将整齐的一端朝下放入烧杯中。将烧杯置于28 ℃光照环境下培养。每隔3 d观察1次。
-
为了更准确地筛选保绿效果最优的激素浓度,采用SPAD−502型叶绿度仪测定不同激素、不同浓度保鲜7 d后的叶绿素含量相对值(SPAD)。校准仪器后,将SPAD−502的测量夹轻轻放在待测叶片上,并避免对叶片造成压迫或损伤。在每个叶片上选择3个测量点,以获得代表性的平均值。将收集到的数据用SPSS进行分析。
-
为验证离体接菌鉴定的可靠性,本研究通过分析田间接菌的病斑长度和离体接菌的病斑长度的相关性,建立回归方程。首先,量取病叶病斑长度,其中每个处理至少3个重复,对数据进行分析,根据数据的特点选取合适的模型,使用统计软件SPSS对数据进行回归拟合,进行残差分析和诊断检查来评估模型是否适合所有的数据点,检查是否有离群点或模型不适用的地方。
-
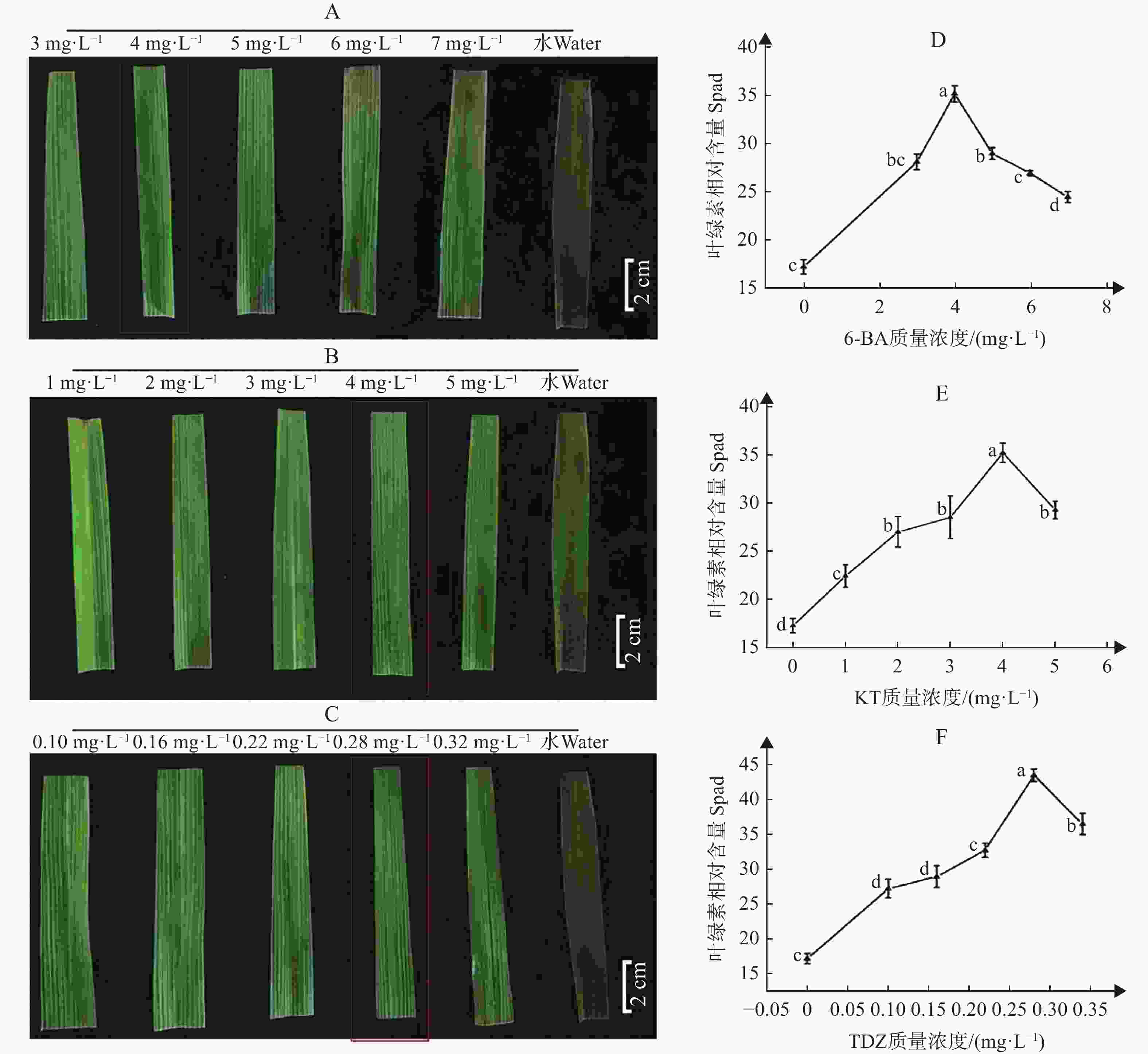
为了确定最适合离体培养的水稻叶片长度,在前人研究的基础上,本研究设置了3种植物激素的候选优化保绿质量浓度,分别为5 mg·L−1 6-BA、3 mg·L−1 KT和0.22 mg·L−1 TDZ。结果显示,水稻叶片离体培养7 d后,5 mg·L−1 6-BA、3 mg·L−1 KT和0.22 mg·L−1 TDZ对8 cm的离体叶片均具有较好的保绿效果(图1−A、D、G),但无论何种激素作为保绿剂,保绿效果从高到低依次为8 cm > 12 cm > 16 cm,说明离体叶片越短保绿效果越好(图1)。
-
为进一步筛选最优的保绿剂及其,以上述候选优化为中间数值,本研究对6-BA、KT、TDZ 3种植物激素均设置了6个质量浓度,分别对8 cm离体叶片进行处理。结果显示,离体培养7 d后,质量浓度过低或过高,3种激素对离体叶片的保绿效果均较差,其中6-BA保绿效果最优的为4.0 mg·L−1(图2−A、D),KT的最优为4.0 mg·L−1(图2−B、E),TDZ的最优为0.28 mg·L−1(图2−C、F)。叶绿素相对含量进一步表明保绿效果最好的为0.28 mg·L−1 TDZ,而4 mg·L−1 6-BA与4 mg·L−1 KT效果相当(图2−D、E、F)。
-
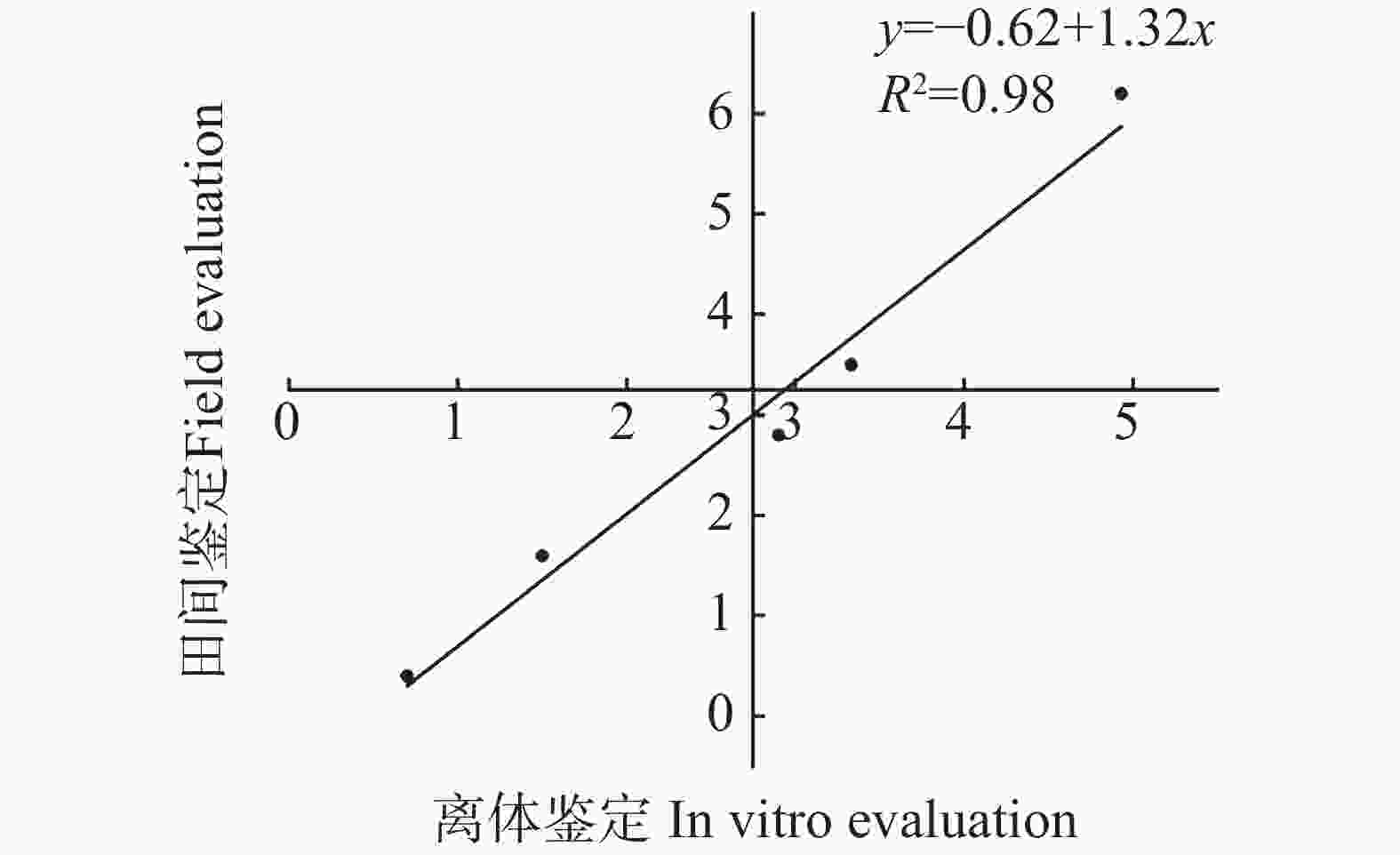
鉴于上述实验中发现离体叶片越短,保绿效果越好,同时考虑到田间接种病斑达到5 cm以上才判断为感病,因此本研究以6 cm离体叶片在0.28 mg·L−1 TDZ处理下进行后续的白叶枯病离体鉴定。为确定接种水稻白叶枯病菌的离体叶片的发病严重程度与田间接种叶片的发病趋势是否一致,本研究利用课题组前期已明确抗性强度的各品种进行水稻离体叶片白叶枯病抗性鉴定。结果表明,接种7 d后,田间表现“高抗”种质的离体叶片病斑长度为0.70 cm,表现“抗”种质的病斑长度为1.50 cm,表现“中抗”种质的病斑长度为2.90 cm,表现“中感”种质的病斑长度为3.33 cm,表现“感”种质的病斑长度为4.93 cm(表1)。离体叶片病斑与田间接种叶片病斑成正相关,其回归方程为y=−0.62+1.32x (R2=0.98)(图3),以上数据说明离体叶片抗性鉴定结果与田间抗性分级结果(图4)完全一致。
表 1 不同抗性水稻品种病斑扩展情况
Table 1. Disease lesion expansion in rice varieties with resistance at different levels
品种
Variety等级
Scale离体叶片病斑长度/cm
Lesion length of detached leaf/cm田间接种病斑长度/cm
Lesion length of leaf inoculated in the field/cmZS261 HR 0.70 ± 0.05 0.40 ± 0.04 ZS061 R 1.50 ± 0.17 1.60 ± 0.12 ZS353 MR 2.90 ± 0.17 2.80 ± 0.14 ZS074 MS 3.33 ± 0.26 3.50 ± 0.24 ZS176 S 4.93 ± 0.53 6.20 ± 0.56 -
朱永生等[1]与李海青等[7]利用蔗糖、柠檬酸、硫酸铝、8−羟基喹啉作为水稻离体叶片的保鲜剂的研究结果显示,较低浓度的保鲜剂有利于水稻叶片的离体培养,但超过一定浓度后,反而会促进叶片的衰老,本研究利用植物激素作为保鲜剂也取得了相同的结果,但由于本研究只评估了6个激素浓度对离体叶片7 d的保绿效果,如果要获得更长时间的效果或更优的激素浓度,建议在本研究获得的优化激素浓度的基础上进行微调。
离体抗病性鉴定体系成功的关键是离体叶片的保绿时间能满足病症的完全表现,本研究的结果显示离体叶片的病斑长度与田间接种的病级一致,说明离体叶片7 d的保绿时间可以满足水稻白叶枯病离体抗性鉴定。此外,与水稻的另外两大叶部病害相比,稻瘟病离体叶片抗病性鉴定需要4~5 d[8],细菌性条斑病离体叶片抗病性鉴定需要5~6 d[9],白叶枯病病斑稳定需要的时间是最长的,因此本研究建立的离体叶片体系应该也适合稻瘟病、细菌性条斑的离体鉴定。
本研究建立的水稻离体叶片抗病鉴定技术不受生育期及环境因素限制,在实验室就可完成全生长期叶片的抗病性鉴定,可以避免田间同一植株反复接菌所致的系统性免疫反应或菌株之间产生的交叉保护,因此水稻离体叶片抗病性鉴定技术不仅在水稻叶部病害精准鉴定方面发挥作用,也将在叶部病害防控农药药效精准评价方面发挥着重要作用。
Optimization of an in vitro identification system for rice resistance to bacterial blight
-
摘要: 为建立水稻白叶枯病离体抗病性鉴定的优化体系,本研究以不同质量的6−苄氨基腺嘌呤(6-Benzylaminopurine,6-BA)、激动素(Kinetin,KT)和噻苯隆(Thidiazuron,TDZ)处理不同长度水稻离体叶片,筛选出最优的离体叶片保绿剂,并在此基础上建立水稻白叶枯病离体抗病性鉴定体系。结果表明,无论何种激素作为保绿剂,保绿效果均与离体叶片长度密切相关,长度越短保绿效果越好;叶绿素含量相对值数据进一步表明各激素保绿效果最优的分别为0.28 mg·L−1的TDZ,4 mg·L−1的6-BA与 4 mg·L−1 的KT,其中0.28 mg·L−1的TDZ为最优的水稻离体叶片保绿剂,4 mg·L−1的6-BA与 4 mg·L−1的KT的效果相当。以0.28 mg·L−1的TDZ为保绿剂,通过“剪叶法”将水稻白叶枯病菌(Xanthomonas oryzae)接种5个田间抗性等级的水稻植株的离体叶片,7 d后的结果显示,离体叶片的病斑长度与田间接种病斑长度存在正相关,其回归方程为y=−0.62+1.32x (R2=0.98)。本研究的结果有助于水稻抗白叶枯病分子育种。Abstract: An attempt was made to establish an in vitro identification system for resistance of rice to bacterial blight. Detached rice leaves of varying lengths were treated with 6-Benzylaminopurine (6-BA), Kinetin (KT), and Thidiazuron (TDZ) at different concentrations to select an optimized system for maintaining leaf greenness in vitro, based on which in vitro identification systems for resistance of rice to bacterial blight were established. The results indicated that regardless of the type of hormone used as a greening agent, the efficacy of greening was closely correlated with the length of the detached leaves, with shorter leaves exhibiting better greening effects. Further analysis of the relative chlorophyll content data revealed that the optimal concentration for each hormone that yielded the best greening effects were 0.28 mg·L−1 for TDZ, 4 mg·L−1 for 6-BA, and 4 mg·L−1 for KT, with 0.28 mg·L−1 for TDZ being the most effective concentration for detached rice leaves, and 4 mg·L−1 for 6-BA and 4 mg·L−1 for KT being similarly effective. Using 0.28 mg·L−1 TDZ as the greening agent, the detached leaves from rice plants with five different levels of field disease resistance were inoculated with Xanthomonas oryzae via the "clipping method." The results demonstrated a positive correlation between the lesion lengths of the detached leaves and those from field inoculations after 7 days of inoculation, with the regression equation of y = −0.62 + 1.32x (R2 = 0.98). The findings of this study contribute to the molecular breeding efforts for rice resistance to bacterial blight.
-
图 2 不同激素不同的保绿效果
注: A. 6-BA不同的保鲜效果;B. KT不同的保鲜效果;C. TDZ不同的保鲜效果;D. 不同的6-BA保鲜7 d后的叶绿素含量相对值;E. 不同的KT保鲜7 d后的叶绿素含量相对值;F. 不同的TDZ保鲜7 d后的叶绿素含量相对值。
Fig. 2 The efficacy of greening at different concentrations of hormones
Note: A. Preservation effects at various concentrations of 6-BA; B. Preservation effects at various concentrations of KT;C. Preservation effects at various concentrations of TDZ; D. Relative chlorophyll content after 7 days of preservation with 6-BA at different concentrations; E. Relative chlorophyll content after 7 days of preservation with KT at different concentrations; F. Relative chlorophyll content after 7 days of preservation with TDZ at different concentrations.
表 1 不同抗性水稻品种病斑扩展情况
Table 1 Disease lesion expansion in rice varieties with resistance at different levels
品种
Variety等级
Scale离体叶片病斑长度/cm
Lesion length of detached leaf/cm田间接种病斑长度/cm
Lesion length of leaf inoculated in the field/cmZS261 HR 0.70 ± 0.05 0.40 ± 0.04 ZS061 R 1.50 ± 0.17 1.60 ± 0.12 ZS353 MR 2.90 ± 0.17 2.80 ± 0.14 ZS074 MS 3.33 ± 0.26 3.50 ± 0.24 ZS176 S 4.93 ± 0.53 6.20 ± 0.56 -
[1] 朱永生, 许惠滨, 郑燕梅, 等. 水稻白叶枯病的离体鉴定方法: 中国, 106212142A[P]. 2016-12-14. [2] HSU Y C, CHIU C H, YAP R, et al. Pyramiding bacterial blight resistance genes in Tainung82 for broad-spectrum resistance using marker-assisted selection[J]. International Journal of Molecular Sciences, 2020, 21(4): 1281. doi: 10.3390/ijms21041281 [3] 张静, 范芝兰, 潘大建, 等. 广东普通野生稻对水稻白叶枯病的抗性评价及分析[J]. 植物遗传资源学报, 2022, 23(2): 422 − 429. doi: 10.13430/j.cnki.jpgr.20210831003 [4] 何汉生, 吴如健, 王忠文. 水稻对白叶枯病抗性室内鉴定方法的初步研究—离体叶片段法[J]. 华南农业大学学报, 1985, 6(1): 81 − 83. [5] 游树鹏, 梁韶辉, 徐礼根, 等. TDZ对大麦离体叶片衰老及其某些生理过程的影响[J]. 杭州大学学报(自然科学版), 1992, 19(3): 352 − 353. [6] 张桂春, 李梦琏, 焦美俊, 等. 某些激素和药物对小麦叶片衰老的影响[J]. 内蒙古大学学报(自然科学版), 1985, 16(1): 87 − 93. [7] 李海青. 不同抗性水稻品种对稻瘟菌粗毒素防御性效应[D]. 绵阳: 西南科技大学, 2011. [8] 贺闽, 尹俊杰, 冯志明, 等. 水稻稻瘟病和纹枯病抗性鉴定方法[J]. 植物学报, 2020, 55(5): 577 − 587. doi: 10.11983/CBB20100 [9] 陆荣生, 韩美丽, 霍秀娟, 等. 水稻抗细菌性条斑病菌离体叶片检验法影响因素研究[J]. 江西农业学报, 2009, 21(3): 115 − 117. doi: 10.3969/j.issn.1001-8581.2009.03.037 -




 下载:
下载: