-
非洲菊(Gerbera hybrida)属菊科大丁草属多年生宿根草本花卉,别名扶郎花,可制作花篮、花束及其他花卉饰品[1],由于其色泽鲜艳、花色丰富,成为四季需求量大的切花。非洲菊基因型高度杂合[2-4],致使品种间杂交后代的性状分离广泛[5]。常规杂交方法通常需花费6~7年的时间才能获得纯合的自交系,通过单倍体培育途径可快速获得纯合二倍体,提高非洲菊自交系的选育效率[6-8]。在组培苗生产过程中,诱导培养、增殖培养、生根培养、炼苗和移栽是重要环节。云南省农业科学院花卉研究所自2007年起开展非洲菊单倍体培育研究,已培育出大量非洲菊单倍体植株[9]。通过研究比较非洲菊二倍体和单倍体植株的生长特性,发现同一生长条件下,单倍体和二倍体相比,单倍体的生长速度较慢[10],通过前期研究,生根率虽然有所提高[11],但用常规方法炼苗的炼苗成活率和移栽成活率都较低,阻碍了非洲菊单倍体在育种实践中的应用。因此,笔者以非洲菊单倍体为材料,在前期研究基础上,优化利于单倍体生根的方法,研究单倍体的炼苗条件,旨在提高非洲菊单倍体组培苗的生根率和移栽成活率,推进非洲菊单倍体的育种进程。
-
实验材料非洲菊单倍体‘qQ12’来自云南省农业科学院花卉研究所,通过诱导非洲菊‘秋日’品种的胚珠培育而成。
-
增殖和生根培养组合设计见表1,其中,MS 改良培养液为将MS 培养液中大量元素的浓度减半,盐酸硫胺素浓度改为 2 mg·L−1,盐酸吡哆醇浓度改为 1 mg·L−1。选取生长在MS+BA 0.8 mg·L−1+NAA 0.1 mg·L−1培养基中,长势一致的非洲菊单倍体‘qQ12’瓶苗,将其幼芽接种在表1所示的5种增殖培养基中,每个处理接种30瓶,每瓶接种5丛幼芽(每丛含高≥0.5 cm的芽苗3株)。增殖培养35 d后,再从繁殖瓶苗中,选择高2 cm以上的植株切成单株,转接到表1所示的S1和S2生根培养基中,每个处理接种15瓶,每瓶接种20个单株。所有培养基的pH5.5~5.8,均添加食用白糖30 g ·L−1,琼脂7 g·L−1。培养室的温度为(22±2)℃,光照强度为40~50 μmol·m−2·s−1,每天光照时间为10 h。
表 1 增殖培养和生根培养试验设计
Table 1. Experimental design of proliferation culture and rooting culture
培养基处理编号
Code for medium
treatment增殖培养基编号
Code for
proliferation medium增殖培养基配方
Formula of
proliferation medium生根培养基编号
Code for rooting
medium生根培养基配方
Formula of rooting
mediumP1 Z1 MS + 6-BA 2mg·L−1 +
NAA 0.1 mg·L−1S1 1/2MS + IBA 0.4mg·L−1+
NAA 0.3mg·L−1P2 Z1 MS + 6-BA 2mg·L−1 +
NAA 0.1 mg·L−1S2 1/2MS +IBA 0.6mg·L−1+
NAA 0.1mg·L−1P3 Z2 MS + 6-BA 0.8mg·L−1 +
NAA 0.1 mg·L−1S1 1/2MS + IBA 0.4mg·L−1+
NAA 0.3mg·L−1P4 Z2 MS + 6-BA 0.8mg·L−1 +
NAA 0.1 mg·L−1S2 1/2MS +IBA 0.6mg·L−1+
NAA 0.1mg·L−1P5 Z3 MS + 6-BA 0.15mg·L−1 +
NAA 0.1 mg·L−1S1 1/2MS + IBA 0.4mg·L−1+
NAA 0.3mg·L−1P6 Z3 MS + 6-BA 0.15mg·L−1 +
NAA 0.1 mg·L−1S2 1/2MS +IBA 0.6mg·L−1+
NAA 0.1mg·L−1P7 Z4 MS + KT 0.15 mg·L−1 S1 1/2MS + IBA 0.4mg·L−1+
NAA 0.3mg·L−1P8 Z4 MS + KT 0.15 mg·L−1 S2 1/2MS +IBA 0.6mg·L−1+
NAA 0.1mg·L−1P9 Z5 MS 改良培养液 +
KT 0.15 mg·L−1S1 1/2MS + IBA 0.4mg·L−1+
NAA 0.3mg·L−1P10 Z5 MS 改良培养液 +
KT 0.15 mg·L−1S2 1/2MS +IBA 0.6mg·L−1+
NAA 0.1mg·L−1 -
在室内培养20 d后,根据上述试验结果,挑选表1中繁殖和生根效果均较好的培养基处理,搬入盖有遮光率为70%遮阳网的大棚中,将其生根瓶苗均分为3份,分别在大棚摆放0,4,7 d,驯化炼苗后,去除未污染生根苗的培养基,选择生根条数达 4~12 条的小苗放入质量百分浓度为0.1%的多菌灵溶液中消毒 1~2 min,按炼苗处理号,将生根苗分别移栽至表2所示的3种混合基质育苗袋中,每个处理栽15苗(袋),设4次重复。幼苗生长 50 d后,分别按炼苗处理号,定植于花盆中(盆口直径28 cm,盆高30 cm,盆装基质为V红土︰V腐植土 =2︰1),株行距30 cm×35 cm,置于大棚离地苗床内。常规方法进行肥水管理,大棚的温度为22~28 ℃。
表 2 炼苗试验设计
Table 2. Experimental design of domesticated plants
炼苗处理号
Code for treatment of
domesticated plants炼苗天数/d
Days of domestication of
the tissue cultured plants混合基质编号
Code for mixed
substrates混合基质配方
Formula of mixed
substratesL1 0 J1 V蛭石∶V珍珠岩 = 1∶1 L2 0 J2 V腐植土∶V红土∶V珍珠岩= 2∶1∶0.5 L3 0 J3 V腐植土∶V红土∶V珍珠岩=4∶1∶0.5 L4 4 J1 V蛭石∶V珍珠岩 = 1∶1 L5 4 J2 V腐植土∶V红土∶V珍珠岩=2∶1∶0.5 L6 4 J3 V腐植土∶V红土∶V珍珠岩=4∶1∶0.5 L7 7 J1 V蛭石∶V珍珠岩 =1∶1 L8 7 J2 V腐植土∶V红土∶V珍珠岩=2∶1∶0.5 L9 7 J3 V腐植土∶V红土∶V珍珠岩=4∶1∶0.5 -
繁殖培养前,调查每瓶繁殖苗高0.5 cm 以上的植株数量,增殖培养35 d后,每种增殖培养基中随机抽取未污染的4瓶(4次重复)繁殖苗,调查每瓶苗高≥0.5 cm 的植株数量,计算每个增殖处理的繁殖系数。室内生根培养20 d后,每个处理随机抽取未污染的4瓶(4次重复)生根苗,调查每瓶苗的生根率,计算各生根处理的平均值。当生根瓶苗在大棚摆放0,4,7 d后,从挑选到的培养基处理中,随机抽取未污染的4瓶(4次重复)生根苗,调查每瓶苗的生根率和每株苗的根数,计算各炼苗处理测量参数的平均值。育苗袋移栽20 d后,调查各处理的炼苗成活率;花盆定植20 d后,调查移栽成活率。
繁殖系数 = 调查时苗高≥0.5 cm的植株数量/繁殖接种时苗高≥0.5 cm的植株数量;
生根率 =(生根株数/调查株数)×100;
炼苗成活率=(成活株数/移栽至育苗袋中的植株总数)×100;
移栽成活率=(成活株数/定植在花盆中的植株总数)×100。
试验数据采用Excel工作表和DPS软件统计分析,利用Duncan’ s新复极差法对各处理进行差异显著性检验。
-
从表3可知,增殖培养35 d后,处理间繁殖系数差异显著,不同增殖培养基对单倍体植株的繁殖能力产生了显著影响。5种增殖培养基中,Z2和Z5的繁殖系数最高,分别为6.3和6.2。将不同增殖培养基中生长的繁殖苗转接到生根培养基中,培养20 d后,生根培养基S2的生根率均比生根培养基S1的生根率高。并且,不同增殖培养基培养的非洲菊单倍体植株,在相同生根培养基中的生根率显著不同,培养基处理P2和培养基处理P10的生根培养基相同,但由于母瓶的增殖培养基不同,生根率存在差异显著(P<0.05),分别为70.0 %和91.3 %。实验结果表明,生根前的增殖培养基对后期的生根培养可产生显著影响。
表 3 不同培养基的增殖和生根效果
Table 3. Proliferation and rooting effects of different media
培养基处理编号
Code for medium
treatment繁殖系数
Reproduction
coefficient生根培养20 d的生根率/%
Rooting rate of rooting
culture for 20 days植株生长状况
Plant growthP1 4.5±0.3 c 65.0±4.1 g 生长一般,少量玻璃化,根系细弱。 P2 4.5±0.3 c 70.0±4.1 fg 生长一般,少量玻璃化,根系一般。 P3 6.3±0.3 a 72.5±2.9 ef 植株生长一般,根系细弱。 P4 6.3±0.3 a 77.5±2.9 de 植株生长一般,根系一般。 P5 3.9±0.2 d 80.0±4.1 bcd 植株生长一般,根系一般。 P6 3.9±0.2 d 83.8±4.8 bc 植株生长一般,根系一般。 P7 5.9±0.2 b 78.8±4.8 cd 植株生长一般,根系一般。 P8 5.9±0.2 b 83.8±2.5 bc 植株生长一般,根系粗壮。 P9 6.2±0.2 ab 85.0±4.1 b 植株生长健壮,根系一般。 P10 6.2±0.2 ab 91.3±2.5 a 植株生长健壮,根系粗壮。 注: 表中数据为平均值±标准差,同列不同字母表示处理间差异显著(P < 0.05),下同。
Note: The data in the table are mean ± standard deviation; different letters in the same column mean significant difference among treatments at 0.05 level. Similarly hereinafter.综合考虑增殖效果、生根效果和幼苗生长状况,筛选到最优增殖培养基和生根培养基组合,即用培养基处理P10方法培育生根苗的效率最高,幼苗生长健壮,根系粗壮。增殖培养基为MS 改良培养液 + KT 0.15 mg·L−1,生根培养基为1/2MS +IBA 0.6 mg·L−1+ NAA 0.1 mg·L−1是生根苗培育的最优培养基组合。
-
上述试验已筛选到的单倍体生根效率最高的培养基处理为表1中的P10方法,将培养基处理P10培育的生根瓶苗,在大棚驯化炼苗0,4,7 d,各炼苗处理的生根效果见表4。从表4可知,在室内生根培养20 d后,再在大棚炼苗,炼苗天数对生根率无显著影响。而在大棚炼苗4 d和7 d均能显著增加生根条数,但2个处理间的生根条数差异不显著,说明4 d是炼苗的最佳时间。
表 4 不同炼苗天数的生根效果
Table 4. Rooting effect of treatments under different domestication days
炼苗天数/d Days of domestication of plants 培养基处理P10的
生根率/%
Rooting rate of medium
treatment P10培养基处理P10的
生根数/条
Rooting number of medium
treatment P100 91.3 ± 2.5 a 9.3 ± 0.4 b 4 92.5 ± 2.9 a 10.4 ± 0.4 a 7 92.5 ± 2.9 a 10.6 ± 0.3 a -
从图1可知,相同炼苗时间、不同基质处理间的炼苗成活率差异显著,炼苗时间0 d的炼苗成活率在50.0 %~76.6 %之间;炼苗时间4 d的炼苗成活率在56.7%~91.7 %之间;炼苗时间7 d的炼苗成活率在53.3%~86.7 %之间。相同基质中,炼苗4 d和7 d比不炼苗(0 d)的处理炼苗成活率显著提高。炼苗4 d的成活率比炼苗7 d的成活率略高,两个处理间差异不显著。用表2中的各种方法炼苗,处理L6的炼苗成活率最高,达 91.7 %。结果表明,最佳炼苗时间为4 d,最佳混合基质的配方为V腐植土∶V红土∶V珍珠岩=4∶1∶0.5。
-
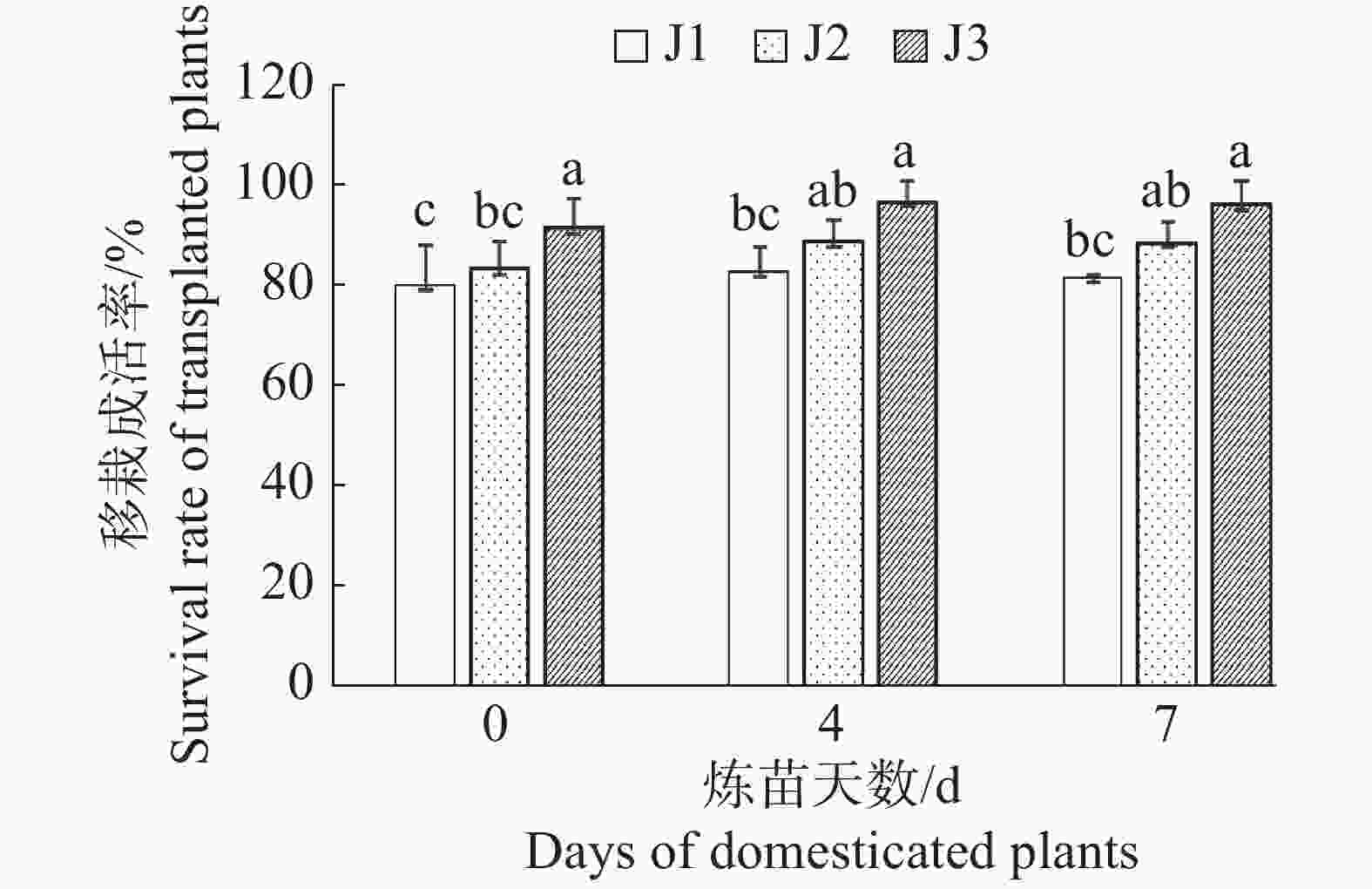
从图2可知,相同炼苗基质、不同炼苗时间处理间的幼苗移栽成活率差异不显著(P > 0.05),只是炼苗4 d的处理比炼苗0 d和7 d的处理移栽成活率略高。基质J1的移栽成活率在79.9 % ~ 82.7 %之间;基质J2的移栽成活率在83.0 % ~ 88.6 %之间;基质J3的移栽成活率在91.3 % ~96.5 %之间。而相同炼苗时间、不同炼苗基质处理的幼苗,移栽成活率存在显著差异(P < 0.05),炼苗0 d的移栽成活率在79.9 % ~ 91.3 %之间;炼苗4 d的移栽成活率在82.7 % ~ 96.5 %之间;炼苗7 d的移栽成活率在81.5% ~ 96.0 %之间。因此,用炼苗时间4 d,移栽基质为V腐植土∶V红土∶V珍珠岩=4∶1∶0.5的方法,即表2中的L6炼苗处理方法培育的幼苗移栽成活率最高(96.5%)。
-
非洲菊花型和花色都极为丰富,而花型和花色是园艺植物的重要观赏性状,单倍体育种中通常先把单倍体加倍成双单倍体,栽培成开花植株后,再评价和筛选具有育种目标性状的植株,但非洲菊单倍体加倍效率低[12],通过培育非洲菊单倍体开花植株,可尽早知道单倍体植株的观赏性状,便于后期单倍体育种中目标性状的筛选。非洲菊胚珠培养培育的单倍体数目变异明显,有单倍体(2n=x=25)、二倍体(2n=2x=50)和混倍体(单倍体和二倍体同时存在)[13]。形态学倍性鉴定方法,具有操作简便、快速、无需仪器设备和实用性强等优点。利用非洲菊单倍体株型较小的特征[10],采用形态学倍性鉴定方法,可对非洲菊的倍性进行验证,纯化和稳定非洲菊单倍体特性,排除非洲菊嵌合体的干扰。因此,提高非洲菊单倍体移栽苗的培育效率,对推动非洲菊单倍体育种研究具有重要意义。
笔者前期研究比较了非洲菊二倍体和单倍体的生根和生长情况,结果表明:在试验的4种生根培养基中,非洲菊单倍体生根率均比二倍体的生根率低,根系萌发所需时间也显著比二倍体的根系萌发时间长[11]。单倍体炼苗至开花所需天数比二倍体炼苗至开花所需天数也较长[10]。这些特性严重限制了单倍体在育种研究中的早期利用。笔者以前期筛选到的非洲菊单倍体生根培养基1/2MS + IBA0.4 mg·L−1 + NAA0.3 mg·L−1为对照,采用生根率较低的单倍体‘qQ12’为试验材料[11],进一步研究非洲菊单倍体生根培养基配方。同时,探究非洲菊生根前母瓶所用的增殖培养基是否对非洲菊单倍体生根产生影响。本研究结果表明:生根培养基1/2MS +IBA 0.6 mg·L−1+ NAA 0.1 mg·L−1比前期筛选到的生根培养基产生的生根效果好,生根前的增殖培养基对后期的生根培养可产生显著影响,最佳增殖培养基为MS 改良培养液 + KT 0.15 mg·L−1。育苗基质是提供根系正常生长发育的重要环境条件[14],选择适宜基质是培育非洲菊单倍体移栽苗的重要环节。前人的研究结果表明,不同基质对非洲菊组培苗炼苗成活率及生长影响较大[15]。本研究结果表明:炼苗4 d和7 d两个处理间的炼苗成活率和移栽成活率差异不显著,只是炼苗4 d处理的炼苗成活率和移栽成活率略高于炼苗7 d的处理。室内培养20 d后,移入大棚炼苗4 d,再在V腐植土∶V红土∶V珍珠岩=4∶1∶0.5的混合基质中培育的幼苗,其炼苗成活率和移栽成活率均最高。
植物生长调节剂的种类和浓度对增殖培养及生根培养均能产生显著影响,且增殖培养基对非洲菊单倍体生根效果存在显著影响,适宜的增殖培养基和生根培养基组合,二者协同作用才能达到非洲菊单倍体良好的生根效果。本试验首先筛选到单倍体生根效率最高的培养基处理方法,然后用筛选到的增殖培养基和生根培养基培育的幼苗作为后期的炼苗和移栽试验材料,由于本试验炼苗和移栽所用的试验材料为同一增殖培养基和同一生根培养基培育的幼苗,炼苗成活率和移栽成活率是否受增殖培养基和生根培养基的影响还有待进一步研究。
Propagation of Transplanted Haploid Plants of Gerbera hybrida via Tissue Culture
-
摘要: 以非洲菊(Gerbera hybrida)单倍体组培繁殖苗为材料,研究培养基、炼苗时间和基质对非洲菊单倍体生根和移栽的影响。结果表明: 生根前的增殖培养基对后期的生根培养影响显著,增殖培养基为MS 改良培养液 + KT 0.15 mg·L−1,生根培养基为1/2MS +IBA 0.6 mg·L−1 + NAA 0.1 mg·L−1,是生根苗培育的最佳培养基组合。室内培养20 d后,移入大棚炼苗4 d,再在V腐植土∶V红土∶V珍珠岩= 4∶1∶0.5的混合基质中培育的移栽苗,其炼苗成活率和移栽成活率最高。Abstract: Gerbera hybrida haploids were propagated via tissue culture to observe the effects of culture medium, domestication and substrates on their rooting and transplanting success. The results showed that proliferation medium before rooting of tissue cultured plants of G. hybrida haploid had a significant effect on rooting culture. The optimum combination of rooting medium was an improved MS medium +KT 0.15 mg·L−1 for proliferation medium followed by 1/2MS +IBA 0.6 mg·L−1+ NAA 0.1 mg·L−1 for rooting medium. After 20 days of indoor culture the rooted tissue cultured plants were transferred to the shed for domestication for 4 days and then transferred onto the mixed substrate of humus: laterite: perlite with a volume ratio of 4∶1∶0.5 for further hardening off, based on which the tissue cultured plants were the highest in domestication and transplanting survival rate.
-
Key words:
- Gerbera hybrida /
- haploid /
- rooting /
- tissue culture /
- substrate
-
表 1 增殖培养和生根培养试验设计
Table 1 Experimental design of proliferation culture and rooting culture
培养基处理编号
Code for medium
treatment增殖培养基编号
Code for
proliferation medium增殖培养基配方
Formula of
proliferation medium生根培养基编号
Code for rooting
medium生根培养基配方
Formula of rooting
mediumP1 Z1 MS + 6-BA 2mg·L−1 +
NAA 0.1 mg·L−1S1 1/2MS + IBA 0.4mg·L−1+
NAA 0.3mg·L−1P2 Z1 MS + 6-BA 2mg·L−1 +
NAA 0.1 mg·L−1S2 1/2MS +IBA 0.6mg·L−1+
NAA 0.1mg·L−1P3 Z2 MS + 6-BA 0.8mg·L−1 +
NAA 0.1 mg·L−1S1 1/2MS + IBA 0.4mg·L−1+
NAA 0.3mg·L−1P4 Z2 MS + 6-BA 0.8mg·L−1 +
NAA 0.1 mg·L−1S2 1/2MS +IBA 0.6mg·L−1+
NAA 0.1mg·L−1P5 Z3 MS + 6-BA 0.15mg·L−1 +
NAA 0.1 mg·L−1S1 1/2MS + IBA 0.4mg·L−1+
NAA 0.3mg·L−1P6 Z3 MS + 6-BA 0.15mg·L−1 +
NAA 0.1 mg·L−1S2 1/2MS +IBA 0.6mg·L−1+
NAA 0.1mg·L−1P7 Z4 MS + KT 0.15 mg·L−1 S1 1/2MS + IBA 0.4mg·L−1+
NAA 0.3mg·L−1P8 Z4 MS + KT 0.15 mg·L−1 S2 1/2MS +IBA 0.6mg·L−1+
NAA 0.1mg·L−1P9 Z5 MS 改良培养液 +
KT 0.15 mg·L−1S1 1/2MS + IBA 0.4mg·L−1+
NAA 0.3mg·L−1P10 Z5 MS 改良培养液 +
KT 0.15 mg·L−1S2 1/2MS +IBA 0.6mg·L−1+
NAA 0.1mg·L−1表 2 炼苗试验设计
Table 2 Experimental design of domesticated plants
炼苗处理号
Code for treatment of
domesticated plants炼苗天数/d
Days of domestication of
the tissue cultured plants混合基质编号
Code for mixed
substrates混合基质配方
Formula of mixed
substratesL1 0 J1 V蛭石∶V珍珠岩 = 1∶1 L2 0 J2 V腐植土∶V红土∶V珍珠岩= 2∶1∶0.5 L3 0 J3 V腐植土∶V红土∶V珍珠岩=4∶1∶0.5 L4 4 J1 V蛭石∶V珍珠岩 = 1∶1 L5 4 J2 V腐植土∶V红土∶V珍珠岩=2∶1∶0.5 L6 4 J3 V腐植土∶V红土∶V珍珠岩=4∶1∶0.5 L7 7 J1 V蛭石∶V珍珠岩 =1∶1 L8 7 J2 V腐植土∶V红土∶V珍珠岩=2∶1∶0.5 L9 7 J3 V腐植土∶V红土∶V珍珠岩=4∶1∶0.5 表 3 不同培养基的增殖和生根效果
Table 3 Proliferation and rooting effects of different media
培养基处理编号
Code for medium
treatment繁殖系数
Reproduction
coefficient生根培养20 d的生根率/%
Rooting rate of rooting
culture for 20 days植株生长状况
Plant growthP1 4.5±0.3 c 65.0±4.1 g 生长一般,少量玻璃化,根系细弱。 P2 4.5±0.3 c 70.0±4.1 fg 生长一般,少量玻璃化,根系一般。 P3 6.3±0.3 a 72.5±2.9 ef 植株生长一般,根系细弱。 P4 6.3±0.3 a 77.5±2.9 de 植株生长一般,根系一般。 P5 3.9±0.2 d 80.0±4.1 bcd 植株生长一般,根系一般。 P6 3.9±0.2 d 83.8±4.8 bc 植株生长一般,根系一般。 P7 5.9±0.2 b 78.8±4.8 cd 植株生长一般,根系一般。 P8 5.9±0.2 b 83.8±2.5 bc 植株生长一般,根系粗壮。 P9 6.2±0.2 ab 85.0±4.1 b 植株生长健壮,根系一般。 P10 6.2±0.2 ab 91.3±2.5 a 植株生长健壮,根系粗壮。 注: 表中数据为平均值±标准差,同列不同字母表示处理间差异显著(P < 0.05),下同。
Note: The data in the table are mean ± standard deviation; different letters in the same column mean significant difference among treatments at 0.05 level. Similarly hereinafter.表 4 不同炼苗天数的生根效果
Table 4 Rooting effect of treatments under different domestication days
炼苗天数/d Days of domestication of plants 培养基处理P10的
生根率/%
Rooting rate of medium
treatment P10培养基处理P10的
生根数/条
Rooting number of medium
treatment P100 91.3 ± 2.5 a 9.3 ± 0.4 b 4 92.5 ± 2.9 a 10.4 ± 0.4 a 7 92.5 ± 2.9 a 10.6 ± 0.3 a -
[1] 单芹丽, 吴丽芳. 非洲菊和满天星新品种选育及生产技术[M]. 昆明: 云南科技出版社, 2018:4 − 9. [2] LI F, LI S C, SHAN Q L. The effect of temperature on plant growth in four gerbera hybrida cultivasr [J]. HortScience, 2019, 54(7): 1164 − 1167. doi: 10.21273/HORTSCI13919-19 [3] SINGH S, DHYANI D, KARTHIGEYAN S. Characterization of variability in F1 progeny of intervarietal cross of gerbera (<italic>Gerbera jamesonii</italic> Bolus ex. Hooker F) [J]. Journal of Ornamental Horticulture, 2009, 12(4): 225 − 231. [4] LEFFRING L. Flower production in gerbera: correlation between shoot, leaf and flower formation in seedlings [J]. Scientia Horticulturea, 1973(1): 221 − 229. [5] 李绅崇, 李淑斌, 蒋亚莲, 等. 非洲菊品种间杂交主要观赏性状在Fl代的遗传表现[J]. 云南农业大学学报, 2007, 22(2): 197 − 201. [6] TOSCA A, ARCARA L, FRANGI P. Effect of genotype and season on gynogenesis efficiency in Gerbera [J]. Plant Cell Tissue & Organ Culture, 1999, 59: 77 − 80. [7] MIYOSHI K, ASAKURA N. Callus induction, regeneration of haploid plants and chromosome doubling in ovule cultures of pot gerbera (<italic>Gerbera jamesonii</italic>) [J]. Plant Cell Reports, 1996, 16: 1 − 5. doi: 10.1007/BF01275438 [8] 张献龙, 唐克轩. 植物生物技术[M].北京: 科学出版社, 2004:174 − 177. [9] 单芹丽, 王继华, 吴丽芳, 等. 不同供体材料对非洲菊胚珠离体培养的影响[J]. 植物生理学报, 2015, 51(7): 1151 − 1156. [10] 单芹丽, 阮继伟, 吴丽芳, 等. 非洲菊单倍体植株的生长特性初报[J]. 江西农业学报, 2016, 28(12): 13 − 17. [11] 单芹丽, 李绅崇, 吴丽芳, 等. 非洲菊单倍体植株生根研究[J]. 江西农业学报, 2019, 31(11): 29 − 33. [12] 单芹丽, 王继华, 李绅崇, 等. 秋水仙素对非洲菊单倍体加倍效果研究[J]. 西南农业学报, 2017, 30(10): 2230 − 2234. [13] 王丽花, 瞿素萍, 杨秀梅, 等. 非洲菊未授粉胚珠的离体诱导和植株再生[J]. 植物生理学通讯, 2007, 43(6): 1089 − 1092. [14] 郭世荣.无土栽培学[M]. 北京:中国农业出版社, 2009: 212 − 213 [15] 田生辉, 植爽, 曾桢迦, 等. 非洲菊组培苗炼苗技术优化[J]. 黑龙江农业科学, 2013(11): 75 − 77. doi: 10.3969/j.issn.1002-2767.2013.11.027 -




 下载:
下载:



