-
长心卡帕藻(Kappaphycus alvarezii,曾用名:异枝麒麟菜、长心麒麟菜)隶属于红藻门(Rhodophyta),真红藻纲(Florideophyceae)、杉藻目(Gigartinales)、红翎菜科(Solieriaceae)、卡帕藻属(Kappaphycus)[1],主要分布在热带和亚热带地区。长心卡帕藻是国际上主要的栽培经济红藻之一,具有生长速率快、产量高的特点,在一个月的时间内质量增加近15倍[2]。根据FAO(food and agriculture organization of the United Nations,联合国粮食及农业组织)统计,2020年全球长心卡帕藻(包括麒麟菜)养殖产量达1 000万t,是全球养殖产量最大的藻类[3]。长心卡帕藻也是提取重要的食品添加剂—κ型卡拉胶的主要原料藻[4 − 5],其在医学上也有较好的应用前景,具有较高的经济价值[6 − 7]。因此,国内外对长心卡帕藻的需求量日益增大。
受养殖模式单一、蓝子鱼害、海域限制和海区环境变化等因素限制,国内长心卡帕藻等麒麟菜的养殖规模已大不如前,热带海藻原料主要进口自东南亚国家[8 − 10]。麒麟菜的栽培主要采用自然海区营养繁殖的养殖方式,其生长过程受环境因子变化的影响较大。其中,温度和光照强度是影响海藻生长发育的重要环境因素[11]。陈心怡[12]研究发现光照强度和温度对大型绿藻礁膜藻体生长和光合生理影响较大,其生长适宜光照强度为3 500~5 000 lx、温度为15~25 ℃。王雨凡等[13]认为温度、光照和盐度对真江蓠四分孢子放散和发育具有显著影响。宋桂漾等[14]发现“黄官2号”海带孢子体的生长受光照、温度及二者交互作用影响显著,影响程度由大到小依次为温度、光照、二者交互作用。方哲等[15]认为,光照强度对琼枝麒麟菜(Betaphycus gelatinae)的生长率和色素含量有很大影响。藻类的光合作用色素分为叶绿素、类胡萝卜素和藻胆蛋白3大类,其含量反映光合作用能力,因此是大型海藻生长状态的重要评价指标[16]。其中,叶绿素和类胡萝卜素具有吸收和传递光能的作用,是藻类进行光合作用的基础色素[17],而藻胆蛋白是只存在于藻类的一类光合色素,在阴暗天气或深海中,藻胆蛋白能更有效地吸收蓝、绿光,并将捕获吸收的光能传递给叶绿素a[18]。
海藻的室内培养具有一定的稳定性,能在可控条件下进行苗种培育和筛选,帮助提升苗种基数,避免其生长受到海区恶劣环境的限制。为有效开发长心卡帕藻种质资源、实现稳定养殖,国内学者针对性开展了室内培养条件的探索与优化,包括温度、盐度、光照强度及氮浓度、氮磷比等[19 − 21]。但是,国内长心卡帕藻室内保种扩繁研究仍然较少,无法支撑长心卡帕藻的规模化养殖。为进一步完善长心卡帕藻室内人工养殖技术,本研究团队开展了温度和光照对长心卡帕藻的生长和色素含量的影响研究,以期为长心卡帕藻苗种工厂化扩繁及人工选育奠定基础。
-
本试验所用的长心卡帕藻材料为2024年5月采集于海南省陵水黎族自治县黎安潟湖,运至海南省海洋与渔业科学院琼海科研基地,在配套循环水设施的方形水泥池中暂养7 d,水泥池规格为10 m×1 m×1.5 m,日循环水量70%以上。暂养期间水温为27~29 ℃,盐度33,自然光照。挑选生长状态良好、藻体表面无损伤的健壮褐色藻株(图1)作为试验材料,冲洗、去除表面附着生物。
-
将长心卡帕藻株系切段,取长度为3 cm的藻株并放入500 mL锥形瓶中,每个锥形瓶放10株,加入500 mL的培养液并用封口膜封口,放入光照培养箱中进行培养。培养液为高温灭菌后的天然海水,添加NaNO3 24.3 mg·L−1和KH2PO4 1.75 mg·L−1作为营养盐补充。试验设置21、27 、33 ℃共3个不同温度处理组,每个处理组设3组平行(3个锥形瓶,下同),光照强度为4 000 lx,盐度为33,光周期L∶D=12 h∶12 h。每3 d更换一次培养液,共培养21 d。
-
利用光照培养箱分别设置光照强度为1 000、4 000、7 000、10 000 lx的处理组,每个处理组设3组平行。温度统一设为26 ℃,盐度为33,光周期L∶D=12 h∶12 h,培养液条件和培养藻株数量同1.2.1。每3 d更换一次培养液,共培养21 d。
-
生长指标以相对生长率(relative growth rate,RGR)和成活率进行评价;出芽情况以出芽数和出芽率进行评价。
$$ \mathrm{RGR({\text{%}} \cdot d}^{ \mathrm{-1}} \mathrm{)=(ln} \mathit{W} _{ \mathit{t} } \mathrm{-ln} \mathit{W} _{ {0} } \mathrm{)/} \mathit{t} \mathrm{\times 100\text{,}} $$ (1) $$ \mathrm{成活率({\text{%}} )=存活藻株总数/藻株总数\times 100\text{,}} $$ (2) $$ \mathrm{平均出芽数(个)=出芽总数/存活藻株总数\text{,}} $$ (3) $$ \mathrm{出芽率({\text{%}} )=出芽藻株数/存活藻株总数\times 100。} $$ (4) 式中,t为试验培养时间(d,本研究中t=21),W0为初始鲜质量(g),Wt为t天后的鲜质量(g)。
-
试验结束后,测量各组的叶绿素a(Chl a)、类胡萝卜素(Car)、藻红蛋白(R-PE)和藻蓝蛋白(R-PC)的含量。其中,Chl a和Car的含量采用无水甲醇提取测定,分别根据Porra[22]和Parsons等[23]计算含量;R-PE和R-PC的含量采用磷酸缓冲液提取测定,根据Beer等[24]计算含量。具体如下:
根据式(5)—(8)计算藻体的Chl a和Car含量:
$$ C_{\text{chl a}} = 16.29 \times (A_{665} - A_{750}) - 8.54 \times (A_{652} - A_{750}), $$ (5) $$ C_{\text{car}} = 7.6 \times [(A_{480} - A_{750}) - 1.49 \times (A_{510} - A_{750})] ,$$ (6) $$ 样品\text{Chl a}含量=( C_{\text{Chl a}}\times V)/W_{\text{FW}}, $$ (7) $$ 样品\text{Car}含量=( C_{\text{car}}\times V)/W_{\text{FW}} 。$$ (8) 式中,CChl a为提取液Chl a的质量浓度,单位(µg·mL−1);CCar为提取液Car的质量浓度,单位(µg·mL−1);V为样品提取液总体积(mL),实验中为5 mL;样品Chl a含量及样品Car含量单位(µg·g−1);WFW为样品鲜质量,单位g,实验中为0.1 g;A为上清液在相应波长下的吸光值。
根据式(9)—(12)计算藻体的藻胆蛋白含量:
$$ C_{\text{R-PE}} = [(A_{{564}} - A_{{592)}} - (A_{{455}} - A_{{592}}) \times 0.2] \times {{0.12}}, $$ (9) $$ C_{\text{R-PC}} = [(A_{{618}} - A_{{645)}} - (A_{{595}} - A_{{645}}) \times {{0.51] \times 0}}{{.15}}, $$ (10) $$ 样品\text{R}-\text{PE}含量=(C_{\text{R}-\text{PE}}\times V)/W_{\text{FW}}, $$ (11) $$ 样品\text{R}-\text{PC}含量=(C_{\text{R}-\text{PC}}\times V)/W_{\text{FW}} 。$$ (12) 式中,CR-PE为提取液R-PE的质量浓度,单位(µg·mL−1);CR-PC为提取液R-PC的质量浓度,单位(µg·mL−1);V为样品提取液总体积,单位mL,实验中为10 mL;样品R-PE含量及样品R-PC含量单位(µg·g−1);WFW为样品鲜质量,单位g,实验中为1 g;A为上清液在相应波长下的吸光值。
-
采用Excel 2019和SPSS 18.0 统计软件进行数据处理及统计分析。用One-way ANOVA(Tukey)进行显著性检验(P<0.05)。
-
经过21 d的室内培育试验,长心卡帕藻在不同温度和光照条件下,其生长和出芽均表现出差异。在同一光照水平下,3个温度试验组的长心卡帕藻枝段成活率均达到100%,在培养温度为27 ℃时,长心卡帕藻的RGR为(1.55±0.14 )(%·d−1),显著高于其余两组(P<0.05)。除了生长较快之外,27 ℃试验组的藻体枝段出芽率达到100%,而21 ℃和33 ℃试验组出芽率只有70%和90%。此外,27 ℃试验组的平均出芽数也高于其余两个温度试验组,平均出芽数达到(5.40±0.36)个(表1)。
表 1 不同温度下长心卡帕藻的生长和出芽情况
Table 1. The growth and germination of Kappaphycus alvarezii at different temperatures
温度/ ℃
Temperature成活率/%
Survival rate出芽率/%
Germination rate平均出芽数/个
Average number of seedlings germinatedRGR/(%·d−1) 21 100 70 (3.23±0.59)a (0.37±0.11)a 27 100 100 (5.40±0.36)b (1.55±0.14)b 33 100 90 (4.67±0.42)b (0.58±0.19)a 注:同一列不同肩标字母代表差异显著(P<0.05)。 Note: Values in the same column marked with different superscript letters indicated significant difference (P<0.05). 在光照试验中,当温度统一设定为26 ℃时,随着光照强度的升高,长心卡帕藻的RGR值呈先上升后下降的趋势,在4 000 lx时达到最高,4 000、7 000 lx两个光照强度试验组藻体的RGR值显著高于其余两组(P<0.05),分别为(1.58±0.22)和(1.44±0.18)(%·d−1)。
4000 和7000 lx两个试验组的平均出芽个数也具有显著优势,分别为(5.17±0.45)和(4.73±0.35)个,但两者之间差异不显著(P>0.05)。所设置各光照强度试验组的藻体成活率和出芽率均达到100%(表2)。表 2 不同光照强度下长心卡帕藻的生长和出芽情况
Table 2. The growth and germination of Kappaphycus alvarezii at different light intensities
光照强度/lx
Light intensity成活率/%
Survival rate出芽率/%
Germination rate平均出芽数/个
Average number of seedlings germinatedRGR/(%·d−1) 1 000 100 100 (2.23±0.23)a (0.58±0.31)a 4 000 100 100 (5.17±0.45)b (1.58±0.22)b 7 000 100 100 (4.73±0.35)b (1.44±0.18)b 10 000 100 100 (2.57±0.51)a (0.87±0.27)a 注:同一列不同肩标字母代表差异显著(P<0.05)。 Note: Values in the same column marked with different superscript letters indicated significant difference (P<0.05). -
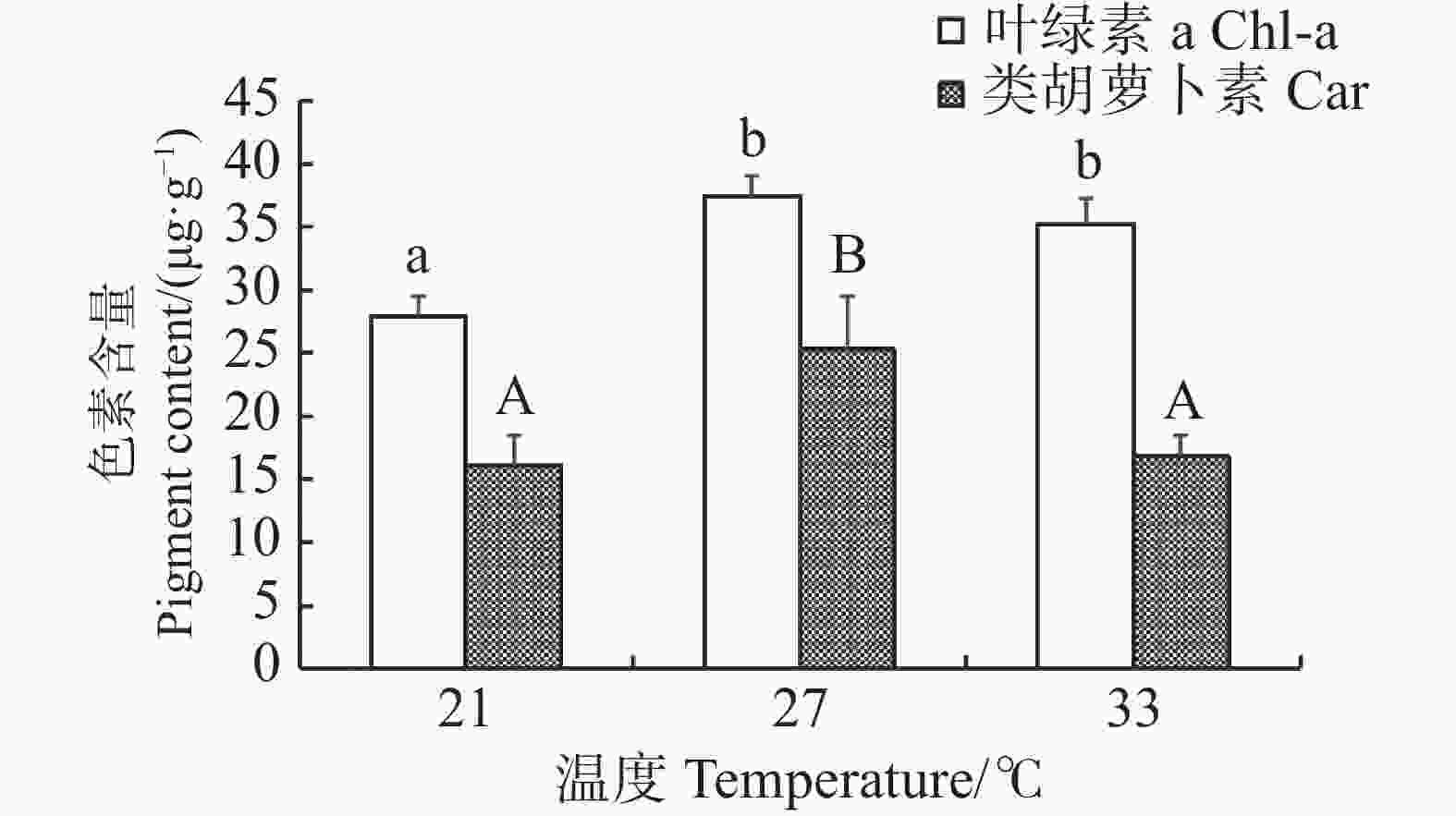
当光照强度统一设置为4 000 lx时,长心卡帕藻在不同温度条件下进行室内培养,随着温度的升高藻体叶绿素a和类胡萝卜素的含量均呈先上升后下降的变化(图2)。温度为21 ℃的试验组藻体的叶绿素a含量显著低于其他两组(P<0.05),为(27.86±1.66)μg·g−1;在温度为27 ℃时,长心卡帕藻的叶绿素a和类胡萝卜素含量均达到最高值,类胡萝卜素的含量显著高于其余两组(P<0.05),含量为(25.28±4.22)μg·g−1,但27 ℃和33 ℃两个试验组叶绿素a的含量之间差异不显著(P>0.05)。
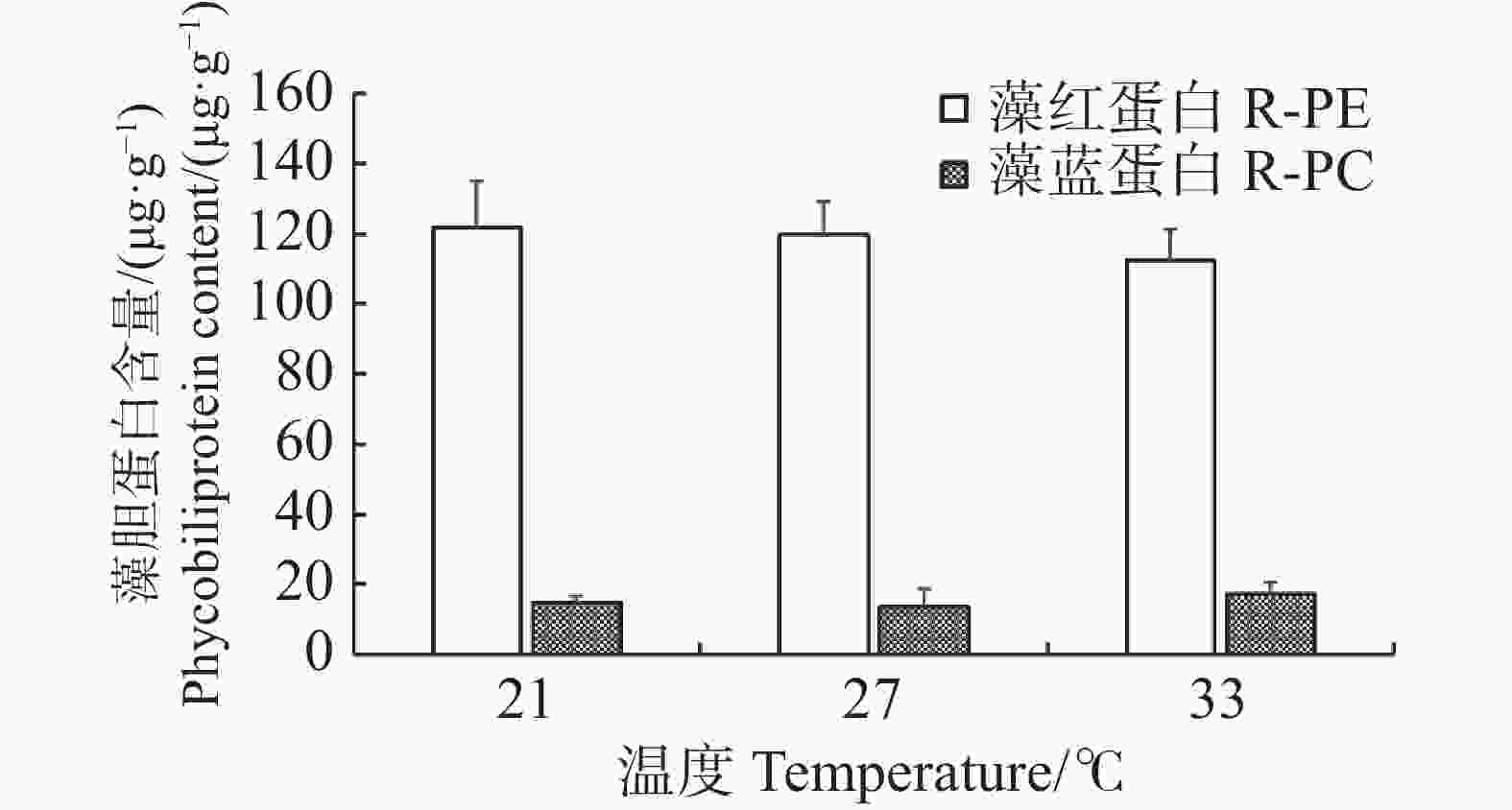
随着温度的变化,长心卡帕藻藻体的藻红蛋白和藻蓝蛋白含量变化幅度并不大,在21、27、33 ℃的藻红蛋白含量分别为(121.68±13.58)、(119.88±9.33)、(112.56±17.36)μg·g−1,藻蓝蛋白的含量分别为(14.93±1.91)、(13.61±5.32)、(17.36±3.22)μg·g−1,相互间并无显著差异(P>0.05)(图3)。各温度处理组中藻体的藻红蛋白含量均高于藻蓝蛋白含量,且藻红蛋白的含量随着温度升高略有降低。
-
在不同光照条件下进行室内培育21 d后,长心卡帕藻藻体的叶绿素a和类胡萝卜素含量也呈现出差异性。当光照为1 000 lx时,长心卡帕藻的外植体枝段的叶绿素a含量为(57.11±5.40)μg·g−1,显著高于其他光照组(P<0.05),但类胡萝卜素的含量为(6.43±2.31)μg·g−1,显著低于其余组(P<0.05)。在光照强度为4 000~10 000 lx 时,藻体叶绿素a和类胡萝卜素的含量呈小幅下降的趋势,光照强度升高反而抑制色素的积累,但它们之间差异并不显著(图4)。
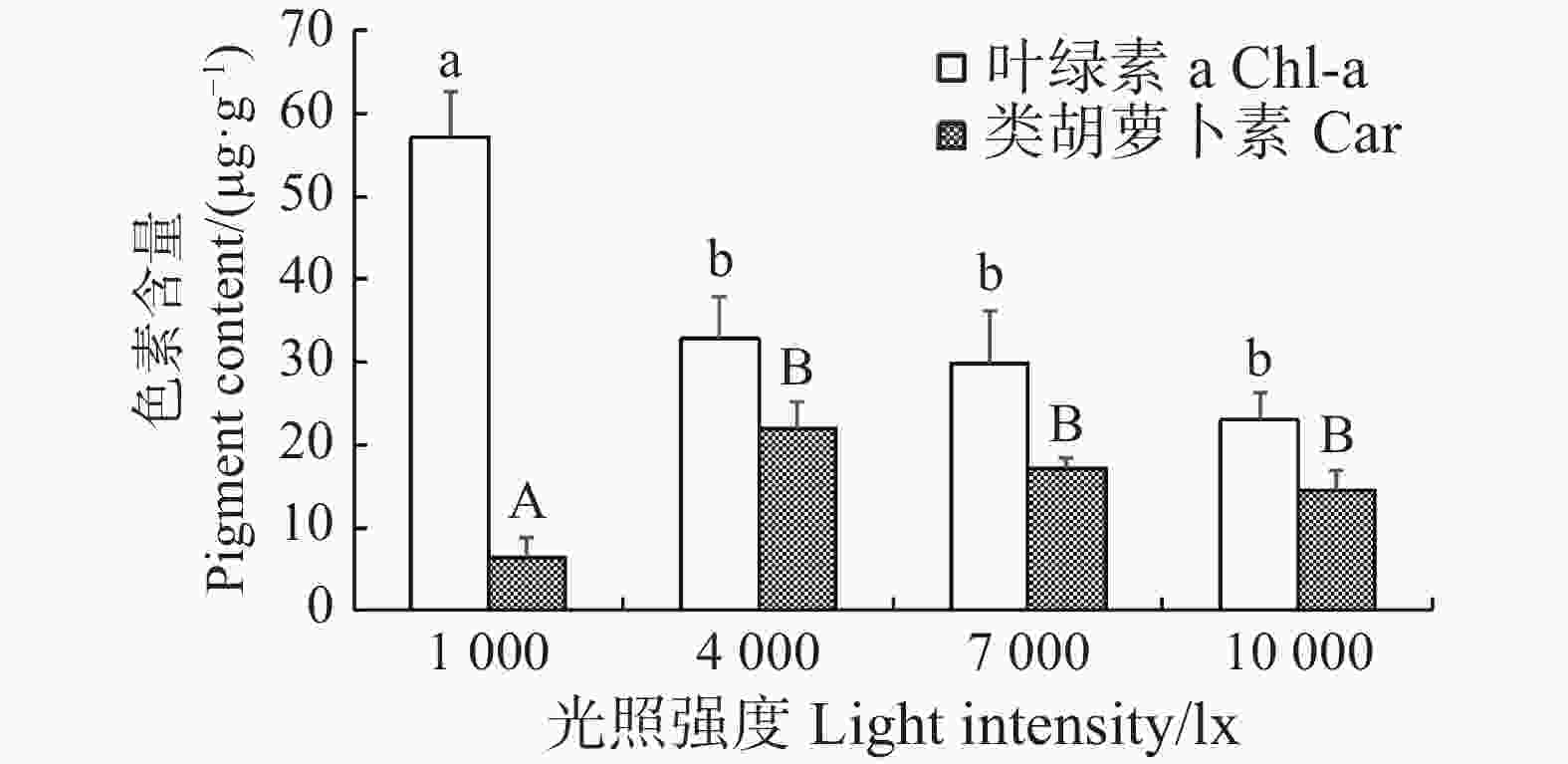
图 4 不同光照强度下长心卡帕藻色素含量
Figure 4. Pigment content of Kappaphycus alvarezii at different light intensities
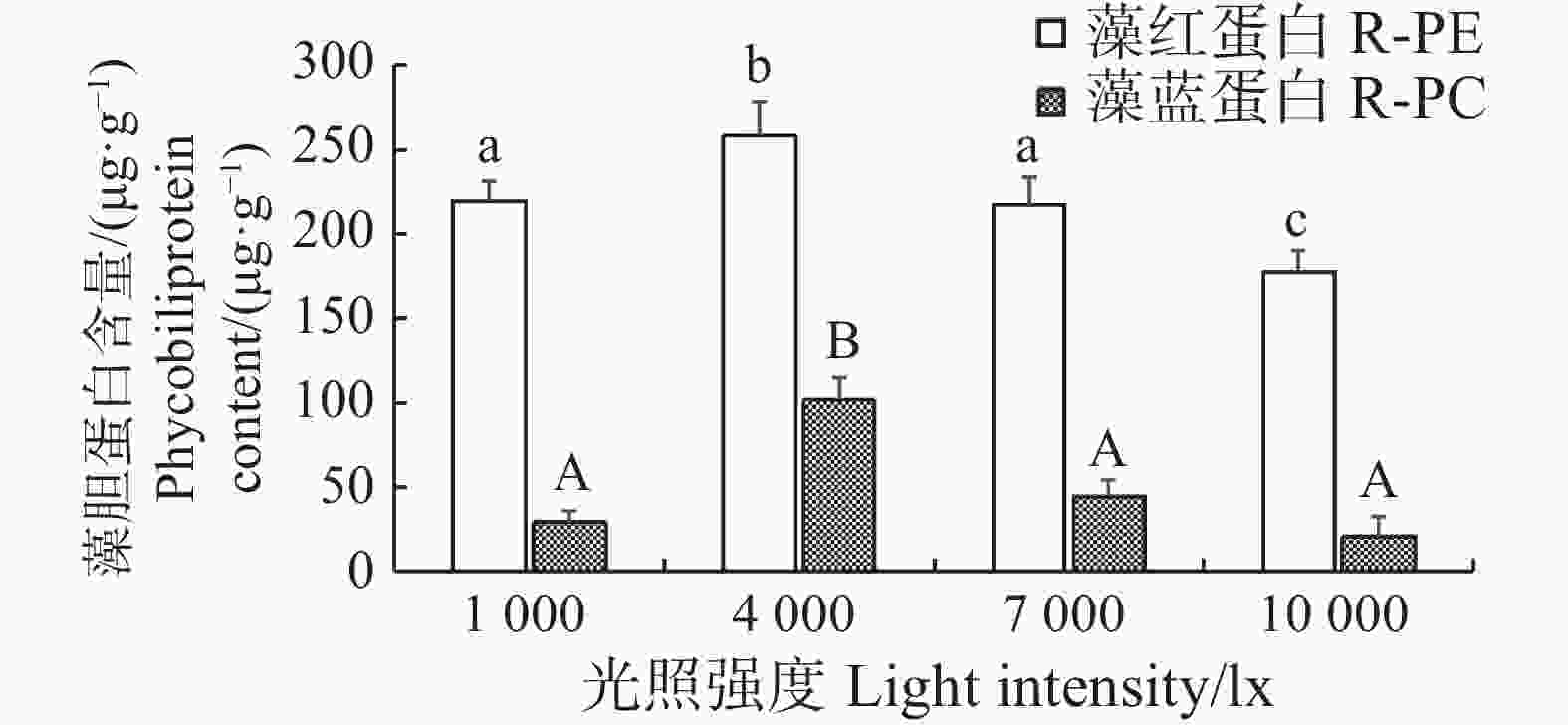
随着光照强度的变化,长心卡帕藻藻体的藻胆蛋白含量也出现了变动。由结果可知,各试验组的藻胆蛋白变化幅度并不大,光照为4 000 lx的试验组的藻红蛋白和藻蓝蛋白含量分别为(257.87±21.45)、(101.33±13.91)μg·g−1,均显著高于其余组(P<0.05)。光照强度为1 000 lx和7 000 lx的试验组藻红蛋白和藻蓝蛋白含量并无显著差异,而光照强度为10 000 lx的试验组藻红蛋白的含量为(177.21±12.83)μg·g−1,显著低于其余组(P<0.05)。在温度为26 ℃时,长心卡帕藻的藻红蛋白和藻蓝蛋白均随着光照的增强呈先上升后下降的趋势,在4 000 lx时达到最高(图5)。
-
温度是影响海藻生长和代谢的核心环境因子,主要通过控制藻体内的生化反应(如光合作用速率等)来影响藻类的生长和繁殖[25]。在本研究中,长心卡帕藻室内培养的RGR和平均出芽数随着温度升高呈先升高后下降趋势,在27 ℃时均达到最高值,且培养藻株全部发芽,而当温度降低至21 ℃或升高至33 ℃时RGR显著下降,藻株的出芽数量和出芽率也出现向下波动。Shalvina等[26]研究同样发现,在低于30 ℃时,越高的温度使得长心卡帕藻的日生长率越高。Terada等[27]研究也表明长心卡帕藻在实验室下培育时,28和32 ℃时其相对生长率较高,当温度升高至36 ℃长心卡帕藻的死亡率达100%。这与本试验结果十分相似,可以表明温度变化显著影响着长心卡帕藻生长和出芽效率,在室内培养时过高或过低的温度均不利于长心卡帕藻的枝段分生。温度的改变同样影响着海藻藻体的色素积累,本研究发现,长心卡帕藻的Chl-a和Car随着温度的升高呈先上升后下降的变化,在27和33 ℃时藻体的Chl-a含量显著提高,表明温度升高可阶段性增强光合色素合成,从而支持藻体增殖。此结果与赵素芬和何培民[28]的研究结论互为印证。而Car主要起捕捉传递光能和逆境保护等作用,在本研究中温度为27 ℃时藻体的Car含量达到最大值。随着温度变化长心卡帕藻藻体的藻胆蛋白含量未表现明显波动(P>0.05),R-PE含量随温度升高略微下降,这表明对长心卡帕藻的藻胆蛋白含量产生显著影响的阈值可能在21~33 ℃范围之外。陈伟洲等[29]研究发现,皱紫菜的藻胆蛋白含量在20 ℃以上时随着温度升高呈上升趋势,在26 ℃时其含量显著升高(P<0.01)。笔者认为,温度对藻体藻胆蛋白积累的影响具有种属差异性。因此,在室内环境培养海藻时,温度调控需匹配物种生理特性,摸清适宜的环境促生长条件,从而实现高效培养。
-
光照与海藻生长繁殖密切相关,是海藻在生长过程中进行光合作用的基础条件[30]。本研究结果表明,在1 000~10 000 lx的光照强度范围内长心卡帕藻的藻株均全部存活并分生出芽,其RGR和平均出芽数随着光照强度的增强呈先上升后下降趋势,在4 000~7 000 lx内有利于长心卡帕藻生长和出芽,当光照强度达到10 000 lx 时RGR和出芽数显著降低,表现出明显的高光抑制现象。赵素芬等[19]研究同样发现,光照强度为1 700 lx时长心卡帕藻褐色株系的日生长率达到最高,随着光照强度升高长心卡帕藻的生长受到抑制。这与本研究结果十分接近,但本试验中长心卡帕藻的RGR达到最高值时光照强度为4 000 lx,笔者认为出现这一区别可能的原因是温度、盐度和营养液等条件选择不同。光照强度的变化能导致海藻的光合作用效率不同,从而表现出藻体色素蛋白的合成有所差异。本研究中,长心卡帕藻的Chl-a含量在1 000 lx时显著高于其他光照组,这可能是低光照导致光反应中光能捕获不足,海藻通过增加光合色素的合成量以增强对有效光能的吸收效率。但其他色素在低光照时的积累并未表现出优势,说明长心卡帕藻在遇到低光时通过色素含量的动态调节来维持光合作用效率。张建伟等[31]研究同样发现,低光照时瓦氏马尾藻光合色素显著较高。在本试验中,低光照虽促使长心卡帕藻Chl-a含量提升,但藻体的生长率和出芽数量显著较低,这表现出光合色素补偿机制(如光捕获能力增强)与生长脱钩的特征。Aguirre-von-Wobeser等[32]研究同样发现色素过度积累并不一定会提高长心卡帕藻的光合作用效率和生长速率。本研究中当光照强度为4 000 lx时长心卡帕藻体中R-PE和R-PC均显著升高,但光照强度升高至10 000 lx时,藻体的R-PE含量则显著降低,说明高光会出现抑制长心卡帕藻的R-PE合成。这与张文文[33]的研究结果一致,证实光抑制效应可能导致蛋白的加速降解。由本研究结果可以得知,当光照强度波动时,长心卡帕藻的生长变化与色素蛋白积累的关联性更强,表明光照更能诱导长心卡帕藻体内色素蛋白的生成代谢,从而提高光合作用效率,但光照超阈值会引起光合色素的代谢紊乱。
-
本研究表明,通过精确调控温度与光照参数,可实现长心卡帕藻室内高效培育,在培养温度为27 ℃、光照强度为4 000 lx时,藻体成活率较高。本文研究结果能够为长心卡帕藻的规模化苗种繁育提供关键参数支撑。此外,营养盐动态消耗规律及光谱特性对藻体代谢的影响可作为长心卡帕藻人工培育的未来探究方向,从而构建光—温—营养耦合调控模型,以完善室内扩繁工艺,推动产业化应用。
温度、光照对长心卡帕藻生长及色素水平的影响
DOI: 10.15886/j.cnki.rdswxb.20250050
 CSTR: 32425.14.j.cnki.rdswxb.20250050
CSTR: 32425.14.j.cnki.rdswxb.20250050
Effects of temperature and light on the growth and pigment levels of Kappaphycus alvarezii
-
摘要: 为进一步优化长心卡帕藻(Kappaphycus alvarezii)室内人工扩繁技术,通过开展控制试验,分别探究温度和光照对长心卡帕藻生长、色素和藻胆蛋白含量的影响。结果表明,温度为27 ℃时,长心卡帕藻相对生长率显著高于其他温度试验组(P<0.05),藻体的叶绿素a和类胡萝卜素含量也较高,说明温度适度升高会提升藻体色素含量的积累水平,但培养温度差异对藻胆蛋白含量的影响较小,各组藻胆蛋白含量差异不显著。在同一温度下,长心卡帕藻的相对生长率随光照强度变化呈先升后降的趋势,光照强度在4 000~7 000 lx时藻体能保持较快的生长;藻体叶绿素a含量在光照强度为1 000 lx时显著高于其余光照组,说明适宜的低光照会促进长心卡帕藻合成更多的叶绿素a;光照强度为4 000 lx时,藻体的藻胆蛋白含量明显高于其他光照组,光照强度的变化能引起长心卡帕藻的藻胆蛋白含量波动。Abstract: An attempt was made to further optimize the indoor artificial propagation technology of Kappaphycus alvarezii. The effects of temperature and light on the growth, pigment and phycobiliprotein content of K. alvarezii were determined by conducting control experiments. The results showed that when the temperature was 27 ℃, the relative growth rate was significantly higher than that of other temperature test groups (P < 0.05), and that the contents of chlorophyll a and carotenoids in the algae were also higher, indicating that an appropriate increase of temperature would increase the accumulation level of pigment content in the algae, but the difference in culture temperature had little effect on the content of phycobiliprotein, and there was no significant difference in the content of phycobiliprotein in each group. At the same temperature, the relative growth rate of K. alvarezii increased first and then decreased with the change of light intensity. When the light intensity was
4000 lx to7000 lx, the algae grew faster, and the content of chlorophyll a in the algae was significantly higher than that in the other light groups when the light was1000 lx, indicating that the appropriate low light intensity would promote the synthesis of more chlorophyll a in K. alvarezii. When the light intensity was4000 lx, the phycobiliprotein content of the algae was significantly higher than that of the other light groups, and the change of light intensity could cause the fluctuation of the phycobiliprotein content of K. alvarezii.-
Key words:
- Kappaphycus alvarezii /
- temperature /
- light intensity /
- growth /
- pigment
-
表 1 不同温度下长心卡帕藻的生长和出芽情况
Table 1 The growth and germination of Kappaphycus alvarezii at different temperatures
温度/ ℃
Temperature成活率/%
Survival rate出芽率/%
Germination rate平均出芽数/个
Average number of seedlings germinatedRGR/(%·d−1) 21 100 70 (3.23±0.59)a (0.37±0.11)a 27 100 100 (5.40±0.36)b (1.55±0.14)b 33 100 90 (4.67±0.42)b (0.58±0.19)a 注:同一列不同肩标字母代表差异显著(P<0.05)。 Note: Values in the same column marked with different superscript letters indicated significant difference (P<0.05). 表 2 不同光照强度下长心卡帕藻的生长和出芽情况
Table 2 The growth and germination of Kappaphycus alvarezii at different light intensities
光照强度/lx
Light intensity成活率/%
Survival rate出芽率/%
Germination rate平均出芽数/个
Average number of seedlings germinatedRGR/(%·d−1) 1 000 100 100 (2.23±0.23)a (0.58±0.31)a 4 000 100 100 (5.17±0.45)b (1.58±0.22)b 7 000 100 100 (4.73±0.35)b (1.44±0.18)b 10 000 100 100 (2.57±0.51)a (0.87±0.27)a 注:同一列不同肩标字母代表差异显著(P<0.05)。 Note: Values in the same column marked with different superscript letters indicated significant difference (P<0.05). -
[1] 匡梅, 曾呈奎, 夏邦美. 中国麒麟菜族的分类研究[J]. 海洋科学集刊, 1999(41): 168 − 189. [2] 吴超元, 李家俊, 夏恩湛, 等. 异枝麒麟菜的移植和人工栽培[J]. 海洋与湖沼, 1988, 19(5): 410 − 418. [3] 联合国粮食及农业组织. 2020年世界渔业和水产养殖状况: 可持续发展在行动[M]. 罗马: 联合国粮食及农业组织, 2020: 31 − 32. [4] NARVARTE B C V, HINALOC L A R, GENOVIA T G T, et al. Physiological and biochemical characterization of new wild strains of Kappaphycus alvarezii (Gigartinales, Rhodophyta) cultivated under land-based hatchery conditions[J]. Aquatic Botany, 2022, 183: 103567. doi: 10.1016/j.aquabot.2022.103567 [5] 谢立梅, 陈静, 郑慧新, 等. 超声波辅助复合酶法提取Iota卡拉胶工艺优化[J]. 食品与机械, 2023, 39(12): 171 − 178. doi: 10.13652/j.spjx.1003.5788.2023.80242 [6] 罗翌元. 卡拉胶寡糖和硒化寡糖的制备及对宫颈癌细胞的抑制作用研究[D]. 舟山: 浙江海洋大学, 2024. doi: 10.27747/D.CNKI.GZJHY.2024.000099 [7] 李团章, 权维燕, 李乐凡. 卡拉胶的提取工艺及其在医药领域的应用研究进展[J]. 山东化工, 2023, 52(5): 94 − 96. doi: 10.3969/J.ISSN.1008-021X.2023.05.025 [8] LIU C L, HUANG X H, LIU J G. Assessment of introduced Kappaphycus (Solieriaceae, Rhodophyta) species relationships in China with molecular markers[J]. Acta Oceanologica Sinica, 2013, 32(2): 59 − 65. doi: 10.1007/s13131-013-0277-5 [9] 刘建国, 庞通, 王莉, 等. 导致热带产卡拉胶海藻大规模死亡原因分析与藻株抗病差异性比较[J]. 海洋与湖沼, 2009, 40(2): 235 − 241. doi: 10.3321/j.issn:0029-814X.2009.02.020 [10] 邢诒炫, 曾俊, 吴翔宇, 等. 三种热带经济海藻养殖现状与应用前景[J]. 海洋湖沼通报, 2019(6): 112 − 120. doi: 10.13984/j.cnki.cn37-1141.2019.06.014 [11] 王潇, 刘福利, 梁洲瑞, 等. 环境因子对掌状海带有性生殖过程的影响[J]. 海洋湖沼通报, 2022, 44(2): 49 − 56. doi: 10.13984/j.cnki.cn37-1141.2022.02.007 [12] 陈心怡. 光照强度、温度和盐度对大型绿藻礁膜配子体生长、光合生理及生化的影响[D]. 湛江: 广东海洋大学, 2023. doi: 10.27788/d.cnki.ggdhy.2023.000375. [13] 王雨凡, 王津果, 王静文, 等. 不同环境因子对真江蓠四分孢子放散和发育的影响[J]. 江苏农业科学, 2021, 49(14): 160 − 165. doi: 10.15889/j.issn.1002-1302.2021.14.030 [14] 宋桂漾, 梁洲瑞, 鲁晓萍, 等. 温度和光强对海带新品系“黄官2号”幼孢子体的生长和生理生化特性的影响[J]. 渔业科学进展, 2025, 46(1): 136 − 148. doi: 10.19663/j.issn2095-9869.20231220001 [15] 方哲, 刘敏, 梁磊, 等. 光照强度对琼枝麒麟菜生长及色素含量的影响[J]. 水产养殖, 2012, 33(10): 44 − 46. doi: 10.3969/j.issn.1004-2091.2012.10.010 [16] 柳杰. 不同环境条件对天鹅湖大叶藻生长及光合色素含量的影响[D]. 青岛: 中国海洋大学, 2011. [17] SIMKIN A J, KAPOOR L, DOSS C G P, et al. The role of photosynthesis related pigments in light harvesting, photoprotection and enhancement of photosynthetic yield in planta[J]. Photosynthesis Research, 2022, 152(1): 23 − 42. doi: 10.1007/s11120-021-00892-6 [18] 肖亚男, 马建飞, 游鑫, 等. 红藻藻胆体的结构及关键色素分析[J]. 自然杂志, 2021, 43(3): 176 − 188. doi: 10.3969/j.issn.0253-9608.2021.03.003 [19] 赵素芬, 何培民. 光照强度和盐度对长心卡帕藻生长的影响[J]. 热带海洋学报, 2009, 28(1): 74 − 79. doi: 10.3969/j.issn.1009-5470.2009.01.012 [20] 刘建国, 路克国, 林伟, 等. 温度、氮浓度和氮磷比对长心卡帕藻(Kappaphycus alvarezii)吸收氮速率的影响[J]. 海洋与湖沼, 2008, 39(5): 529 − 535. doi: 10.3321/j.issn:0029-814X.2008.05.016 [21] 黄园, 刘建国, 庞通, 等. 盐度降低对长心卡帕藻原初光化学反应的影响[J]. 海洋学报, 2010, 32(3): 146 − 152. [22] PORRA R J. The chequered history of the development and use of simultaneous equations for the accurate determination of chlorophylls a and b[J]. Photosynthesis Research, 2002, 73(1/3): 149 − 156. doi: 10.1023/A:1020470224740 [23] PARSONS T R, STRICKLAND J D H. Discussion of spectrophotometric determination of marine-plant pigments, with revised equations for ascertaining chlorophylls and carotenoids[J]. Journal of Marine Research, 1963, 21(3): 155 − 163. [24] BEER S, ESHEL A. Determining phycoerythrin and phycocyanin concentrations in aqueous crude extracts of red algae[J]. Marine and Freshwater Research, 1985, 36(6): 785 − 792. doi: 10.1071/MF9850785 [25] DAVISON I R. Environmental effects on algal photosynthesis: temperature[J]. Journal of Phycology, 1991, 27(1): 2 − 8. doi: 10.1111/j.0022-3646.1991.00002.x [26] SHALVINA A, DE RAMON N’YEURT A, LAKO J, et al. Effects of selected environmental conditions on growth and carrageenan quality of laboratory-cultured Kappaphycus alvarezii (Rhodophyta) in Fiji, South Pacific[J]. Journal of Applied Phycology, 2022, 34(2): 1033 − 1043. doi: 10.1007/s10811-022-02690-6 [27] TERADA R, VO T D, NISHIHARA G N, et al. The effect of irradiance and temperature on the photosynthesis and growth of a cultivated red alga Kappaphycus alvarezii (Solieriaceae) from Vietnam, based on in situ and in vitro measurements[J]. Journal of Applied Phycology, 2016, 28(1): 457 − 467. doi: 10.1007/s10811-015-0557-x [28] 赵素芬, 何培民. 高温对两种卡帕藻的酶活性、色素含量与叶绿素荧光的影响[J]. 生态学报, 2011, 31(22): 6845 − 6852. doi: 10.20103/j.stxb.2011.22.021 [29] 陈伟洲, 吴文婷, 许俊宾, 等. 不同生态因子对皱紫菜生长及生理组分的影响[J]. 南方水产科学, 2013, 9(2): 14 − 19. doi: 10.3969/j.issn.2095-0780.2013.02.003 [30] 武焕阳. 大型海藻生长和光合功能对不同光环境条件的响应研究[D]. 广州: 华南理工大学, 2016. [31] 张建伟, 刘媛媛, 吴海龙, 等. 环境因子对瓦氏马尾藻生长及光合作用的影响[J]. 中国水产科学, 2014, 21(6): 1227 − 1235. doi: 10.3724/SP.J.1118.2014.01227 [32] AGUIRRE-VON-WOBESER E, FIGUEROA F L, CABELLO-PASINI A. Photosynthesis and growth of red and green morphotypes of Kappaphycus alvarezii (Rhodophyta) from the Philippines[J]. Marine Biology, 2001, 138(4): 679 − 686. doi: 10.1007/s002270000506 [33] 张文文. 光照、营养盐对海萝生长发育及藻体光合色素的影响[D]. 上海: 上海海洋大学, 2016. -




 下载:
下载: