-
诺丽(Morinda citrifolia Linn.)原产于南太平洋群岛,在我国主要分布于海南岛、台湾岛、西沙群岛和西双版纳等地[1]。在传统医学中,诺丽植物的不同部位,如果实、叶子和根,被用来治疗肠道不正常、经期抽筋和尿路感染[2],还被用来治疗感冒和流感。诺丽植物提取物被证明具有清除自由基、抗菌、抗分解、抗癌、抗突变和抗炎的作用,并具有抑制低密度脂蛋白氧化、刺激免疫、净化血液、调节胆固醇和调节细胞功能的能力[3-6]。1956年Atkinson等[7]报道了诺丽叶能有效抑制沙门氏菌、伤寒沙门菌、金黄色葡萄球菌、草分枝杆菌等细菌的生长,并指出可能是诺丽中一些酚类物质(如:珊瑚木苷、L-天门冬氨酸、茜素和莨菪亭)和其他蒽醌类化合物在起作用,这些成分对细菌引起的皮肤感染、感冒、发热等疾病具有显著疗效。West B J等[8]发现大溪地诺丽果的甲醇和正丁醇提取物对大肠杆菌、白色念珠菌和金黄色葡萄球菌均有抑制作用,抑制效果与大溪地诺丽果果内的环烯醚萜含量有关,特别是与去乙酚基车叶草甙酸和车叶草甙酸有关[8]。
自然状态下,植物与其内生真菌长期的协同进化,可能导致内生真菌与寄主植物有基因和信息的交流,致使内生真菌产生与寄主植物相同或类似的代谢途径,也可能会产生与寄主植物相同或类似的具有生物活性的次生代谢产物[9-10],因此,利用植物内生真菌发酵可能会得到具有药理作用的化合物。此途径可避免直接从植物提取药用化学成分,起到保护植物资源和提升经济效益的作用。因此,本实验室在研究前期对诺丽内生真菌多样性和抑菌性展开探索,筛选出1株具有较强抑菌性的内生真菌M2,初步鉴定为棘孢曲霉(Aspergillus aculeatus)。诺丽果汁的发酵与其内生真菌有极大的关联性。内生真菌在发酵过程中,不同的营养物质和发酵条件可影响其代谢产物的产出。在诺丽果汁的发酵生产中不仅要考虑菌丝体增殖条件,还要考虑原料的成本,以及是否有利于代谢产物的积累,本研究中部分氮源就极大地抑制内生真菌M2的生长和减弱其抑菌性。真菌在发酵过程中,生长量与具有生物活性的代谢产物并不成正相关,在发酵过程中,若菌丝体过多会造成营养物质消耗过快,造成菌株的衰弱;菌株营养生长过快时会抑制代谢产物的生成。发酵条件对菌株M2的生长和具有生物活性的代谢产物的产出起关键作用,优化发酵条件可为提高诺丽发酵果汁的生产效率提供理论基础。
-
诺丽内生真菌M2保存于海南大学园艺学院药用植物团队实验室。病原细菌:金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli)、沙门氏菌(Salmonella spp.)和枯草芽孢杆菌(Bacillus subtilis),购自中国农业微生物菌种保藏管理中心。马铃薯葡萄糖琼脂(PDA)固体培养基、营养琼脂(NA)固体培养基、马铃薯葡萄糖肉汤(PDB)液体培养基、真菌基因组DNA提取试剂盒、PCR相关试剂,均购自北京索莱宝Solarbio科技有限公司。PCR引物序列由海南光威科技有限公司合成。
-
用接种环挑取内生真菌M2的菌丝于载玻片上,棉蓝染色剂制成玻片,光学显微镜观察菌丝和孢子。根据真菌鉴定手册,从形态上初步鉴定该内生真菌的所属种类[11]。根据Solarbio真菌基因组DNA提取试剂盒方法提取内生真菌M2的DNA,以其DNA作为反应的模板,基于核糖体ITS区域的序列ITS1f(ITS1f:5′-CTTGGTCATTTAGAGGA AGTAA-3′)和ITS4(ITS4:5′-TCCTCCGCTTATTGATATGC-3′)作为引物进行PCR扩增。PCR扩增体系(25 μL):ddH2O 9.5 μL、Premix Taq 12.5 μL、引物各1.0 μL,DNA模板1.0 μL。PCR反应程序:94 ℃预变性5 min,94 ℃变性40 s,55 ℃退火40 s,72 ℃延伸55 s,共35个循环,最后72 ℃延伸10 min,于4 ℃冰箱保存,将PCR扩增产物在1.2%琼脂糖凝胶上进行电泳。将PCR扩增产物送到北京六合华大基因科技有限公司广州分公司进行测序,测得的序列在NCBI数据库中进行Blast比对,确定种属关系,选取相似性较高的序列,用MEGA5.0软件构建系统进化树。
-
将病原细菌配成106 cfu·mL−1的菌悬液。吸取106 cfu·mL−1菌悬液0.1 mL于NA平板上涂匀,即得含供试病原细菌平板。把内生真菌M2发酵液减压抽滤,得菌丝与菌液。菌液用等体积乙酸乙酯萃取3次,得菌液乙酸乙酯萃取液。菌丝用2倍体积的乙酸乙酯超声提取30 min,过滤得滤液。合并萃取液和滤液,减压浓缩,水域温度为45 ℃,得到浸膏。分析天平定量分析,配成20 g·L−1二甲基亚砜溶液。抑菌性测定处理:在直径6 mm滤纸片上加20 μL内生真菌次生代谢产物二甲基亚砜溶液,放入含供试病原细菌平板中,做3个重复。空白对照:在直径6 mm滤纸片加20 μL二甲基亚砜,放入含供试病原细菌平板中,做3个重复。处理和对照于37 ℃恒温培养箱中培养1 d,观测抑菌圈的大小。
-
将发酵完成的内生真菌M2的菌丝进行减压抽滤,将菌丝于45 ℃烘箱烘干至恒重,用分析天平进行定量分析。
-
内生真菌M2发酵条件优化以PDB为基础培养基,培养条件为发酵条件,150 mL锥形瓶装液50 mL、温度25 ℃、培养基初始pH值自然、转速150 r·min−1、发酵5 d。优化结果主要以发酵液和菌丝乙酸乙酯粗提物抑菌性为主要依据,菌丝质量为次要依据。
-
供试碳源:葡萄糖、蔗糖、麦芽糖、果糖、半乳糖、可溶性淀粉和玉米粉。每千克培养基添加20 g供试碳源,每处理3次重复,试验值取3次平均值。
-
供试氮源:氯化铵、硝酸钠、尿素、牛肉膏、蛋白胨、大豆蛋白胨、胰蛋白胨、酵母提取物、鱼粉和豆饼粉。每千克培养基氮源的添加量见表1,每处理3次重复,试验值取3次平均值。
表 1 每千克培养基氮源的添加量
Table 1. Medium supplemented with nitrogen source per kg
氮源
Nitrogen含氮量/%
Nitrogen content添加量/g
Supplement氮源
Nitrogen source含氮量/%
Nitrogen content添加量/g
Supplement尿素 Carbamide 46.67 3.26 酵母提取物 Yeast Extract 9.00 16.9 硝酸钠 NaNO3 16.5 9.22 大豆蛋白胨 Soya Peptone 9.00 16.9 氯化铵 NH4Cl 26.67 5.7 牛肉浸膏 Beef Extract 12.00 12.68 硝酸铵 NH4NO3 16.47 9.23 豆粕粉 Mora Meal 5.23 29.07 胰蛋白胨 Tryptone 12.00 12.68 鱼粉 Fishmeal 8.59 17.71 -
供试无机盐:磷酸氢二钾、磷酸二氢钾、氯化钾、七水合硫酸镁和七水合硫酸亚铁。每千克培养基添加1 g,每个处理3次重复,试验值取3次平均值。
-
根据单因素试验结果,选择最佳碳源(葡萄糖)、氮源(硝酸钠)、无机盐(七水合硫酸镁、磷酸二氢钾)共3个因素,设置3个水平,进行正交试验(表2,3)。每个处理进行3次重复,试验值取3次平均值。
表 2 营养元素正交设计
Table 2. Orthogonal design of nutrient elements
水平 Level 葡萄糖 Glucose 硝酸钠 NaNO3 无机盐 Inorganic salt 七水合硫酸镁 MgSO4·7H2O 磷酸二氢钾 KH2PO4 1 2% 0.50% 0.02% 0.02% 2 3% 1.00% 0.06% 0.06% 3 4% 1.50% 0.10% 0.10% 表 3 营养元素浓度配比
Table 3. Ratio of nutrient concentration
试验号 Code 葡萄糖 Glucose 硝酸钠 NaNO3 无机盐 Inorganic salt 七水合硫酸镁 MgSO4·7H2O 磷酸二氢钾 KH2PO4 1 1(2%) 1(0.50%) 1(0.02%) 1(0.02%) 2 1(2%) 2(1.00%) 2(0.06%) 2(0.06%) 3 1(2%) 3(1.50%) 3(0.10%) 3(0.10%) 4 2(3%) 1(0.50%) 2(0.06%) 3(0.10%) 5 2(3%) 2(1.00%) 3(0.10%) 1(0.02%) 6 2(3%) 3(1.50%) 1(0.02%) 2(0.06%) 7 3(4%) 1(0.50%) 3(0.10%) 2(0.06%) 8 3(4%) 2(1.00%) 1(0.02%) 3(0.10%) 9 3(4%) 3(1.50%) 2(0.06%) 1(0.02%) -
以筛选出来的碳源(葡萄糖)、氮源(硝酸钠)、无机盐(七水合硫酸镁和磷酸二氢钾)为基础,分别以装液量40,50,60,70,80,90 mL进行发酵培养,每个处理3次重复,试验值取3次平均值。
-
以筛选出来的碳源(葡萄糖)、氮源(硝酸钠)、无机盐(七水合硫酸镁和磷酸二氢钾)和装液量为基础,分别以温度23,25,27,29,31 ℃进行发酵培养,每个处理3次重复,试验值取3次平均值。
-
以筛选出来的碳源(葡萄糖)、氮源(硝酸钠)、无机盐(七水合硫酸镁和磷酸二氢钾)、装液量和温度为基础,将培养基的初始pH值为5.0,6.0,7.0,8.0,9.0。每个处理进行3次重复,试验值取3次平均值。
-
在筛选出来的碳源(葡萄糖)、氮源(硝酸钠)、无机盐(七水合硫酸镁和磷酸二氢钾)、装液量、温度和pH值为基础,将摇床的转速调为90,110,130,150,170,190 r·min−1,每个处理3次重复,试验值取3次平均值。
-
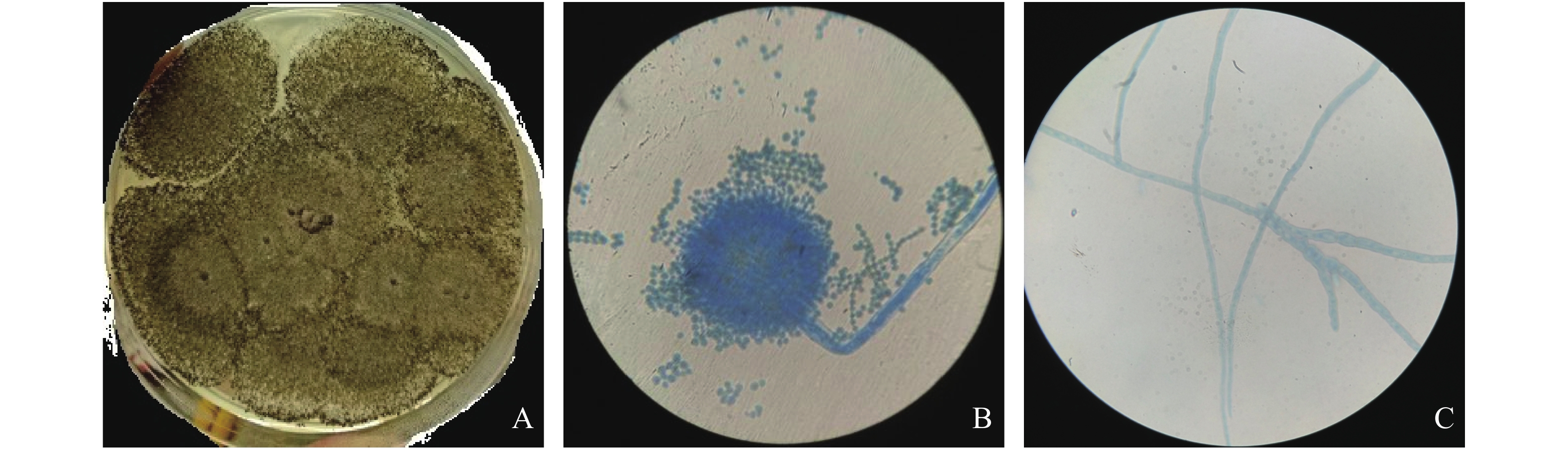
在PDA培养基接种内生真菌M2后,其生长迅速,只需3 d左右菌落就能铺满平板(图1-A)。内生真菌M2在培养基表面凸起,背面有褶皱,菌丝为白色,孢子为褐色(图1-B)。通过显微镜观察内生真菌M2菌丝为有隔菌丝,在菌丝顶端有特化厚壁的足细胞和分生孢子梗,上端形成膨大的孕性顶囊,顶囊表面有分生孢子(图1-C)。观察到孢子梗无横隔、光滑,在顶部膨大形成球形的可孕性的顶囊,顶囊表面产生小梗,小梗在顶囊全部表面呈辐射状向四周展开。分生孢子串生于小梗顶端呈柱形。笔者将其鉴定为曲霉属。
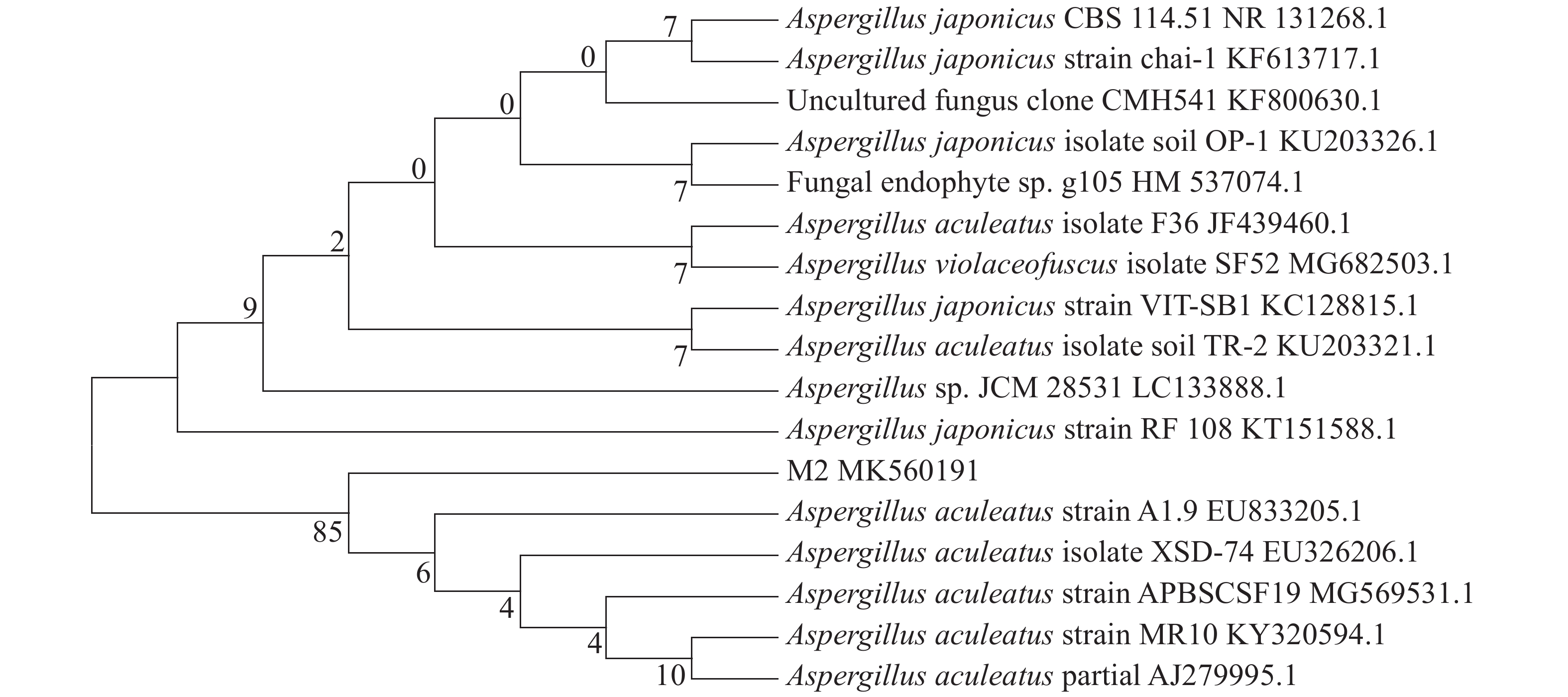
从诺丽提取出的内生真菌M2,以其DNA为模板,在特异性引物的引导下,PCR产物扩增出ITS区域序列测序,将M2的ITS rDNA基因序列上传于GenBank数据库,登录号为MK560191。将得到的扩增片段519 bp序列在NCBI数据库中进行Blast比对,用MEGA5.0软件构建系统进化树(图2),初步将其鉴定为棘孢曲霉(Aspergillus aculeatus)。
-
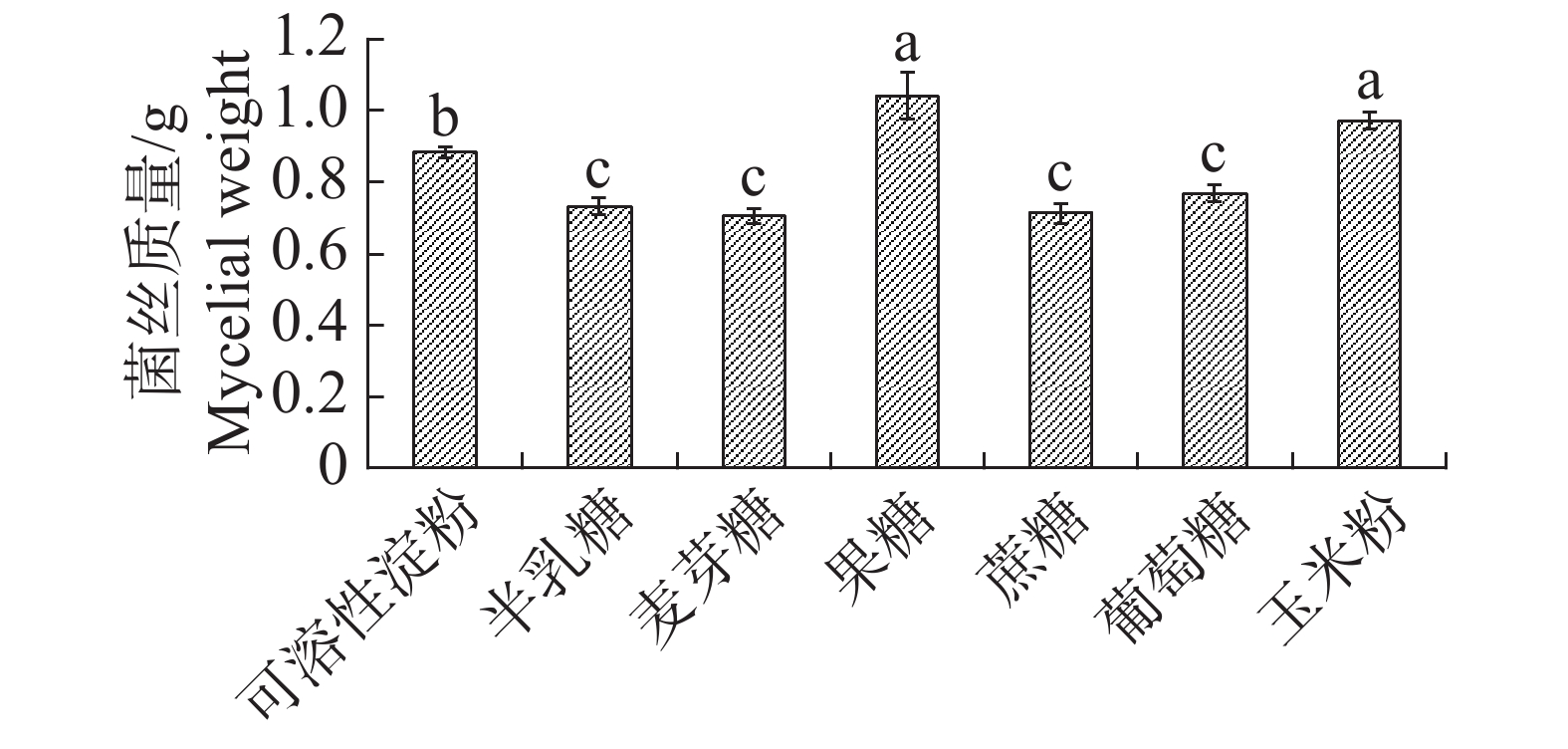
根据单因素试验发现果糖与玉米粉作为碳源时内生真菌M2的生物量显著高于其他碳源;果糖对应内生真菌M2菌丝干质量为1.0423 g,显著高于其他碳源(图3),为此,碳源中果糖最适合内生真菌M2的生长。果糖、蔗糖和葡萄糖作为碳源时,内生真菌M2抑菌效果较好,其中葡萄糖的效果最佳,故选择葡萄糖作为基础碳源(图4)。
-
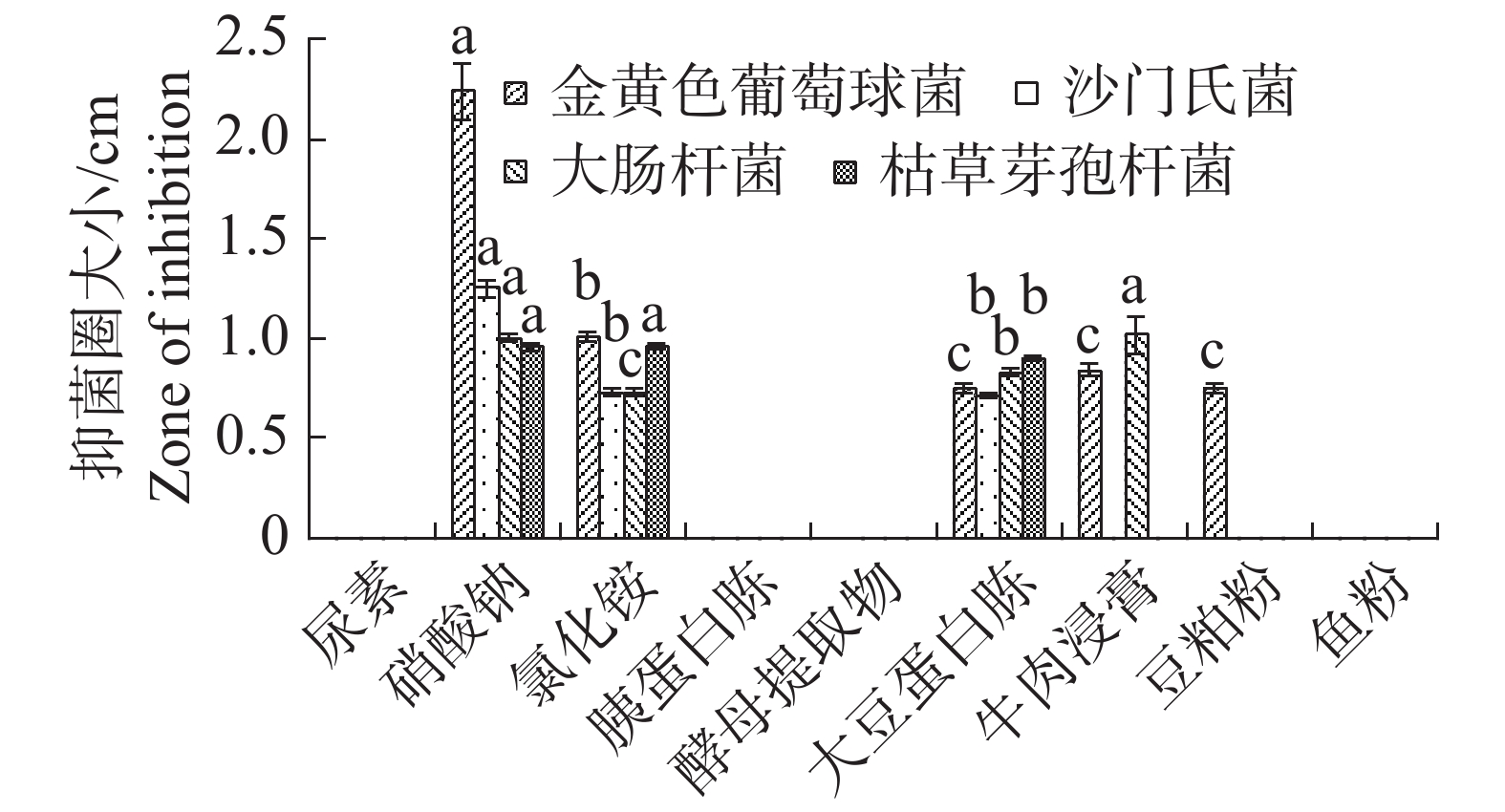
根据单因素试验,氮源中大豆蛋白胨最适内生真菌M2生长,尿素和胰蛋白胨显著地抑制了内生真菌M2的生长发育(图5)。不同氮源对内生真菌M2的抑菌性影响极为显著(图6),其中尿素、胰蛋白胨、酵母提取物和鱼粉作为氮源时抑制了内生真菌M2抑菌物质的分泌,导致内生真菌M2对4种病原细菌均没有抑制;硝酸钠、氯化铵和大豆蛋白胨作为氮源时,内生真菌M2对4种病原细菌均有抑制。综合比较对4种病原细菌的抑制性,以硝酸钠效果最佳,故选择硝酸钠作为内生真菌M2的氮源。
-
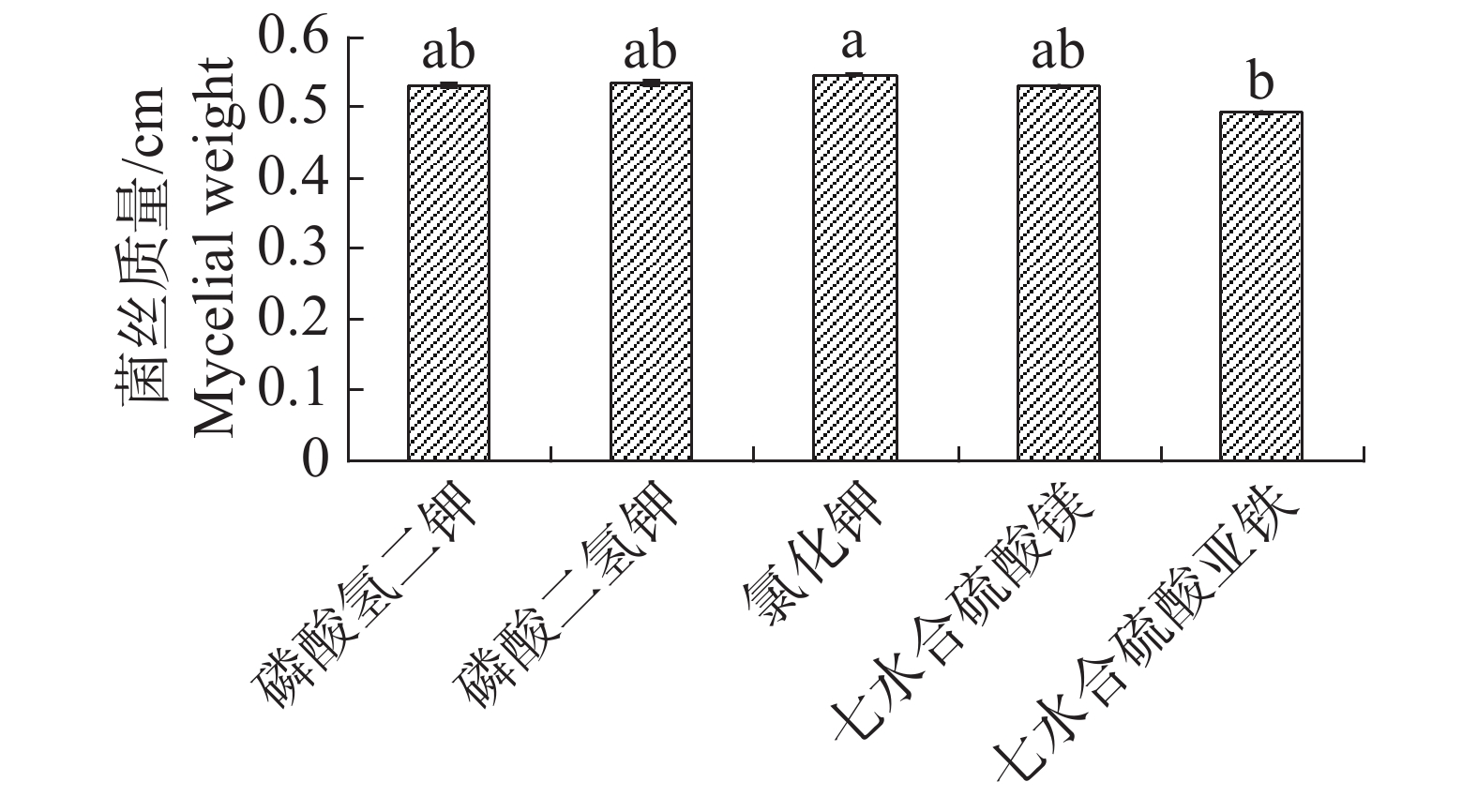
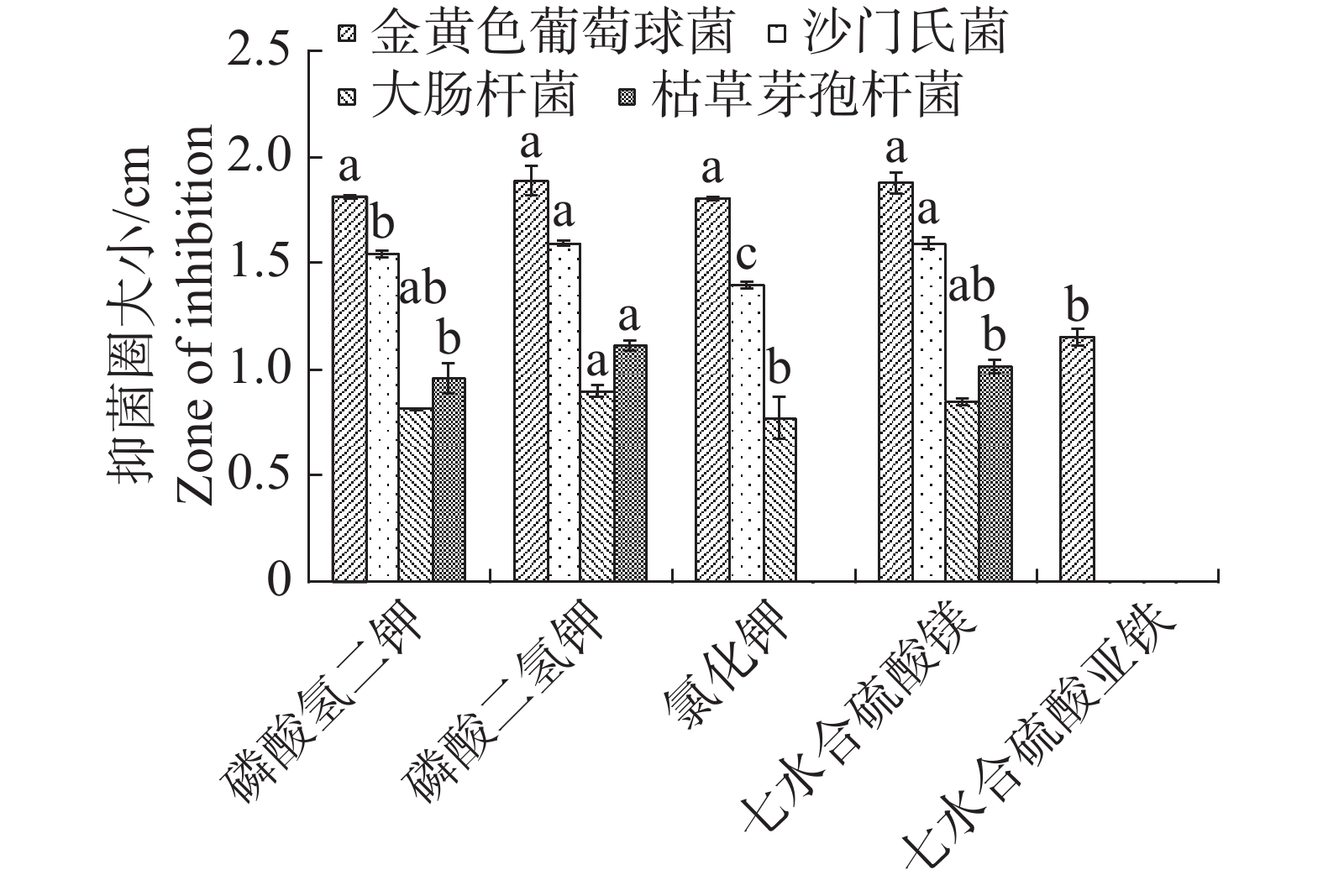
根据单因素试验,5种无机盐对内生真菌的生长影响差异不大,七水合硫酸亚铁作为无机盐时,内生真菌M2菌丝质量均显著低于氯化钾,其他4种无机盐均差异不显著,但以氯化钾效果最佳(图7)。不同无机盐内生真菌M2的抑菌性影响不显著(图8)。根据其对4种病原细菌的抑制效果,选择磷酸二氢钾和七水合硫酸镁作为无机盐。
-
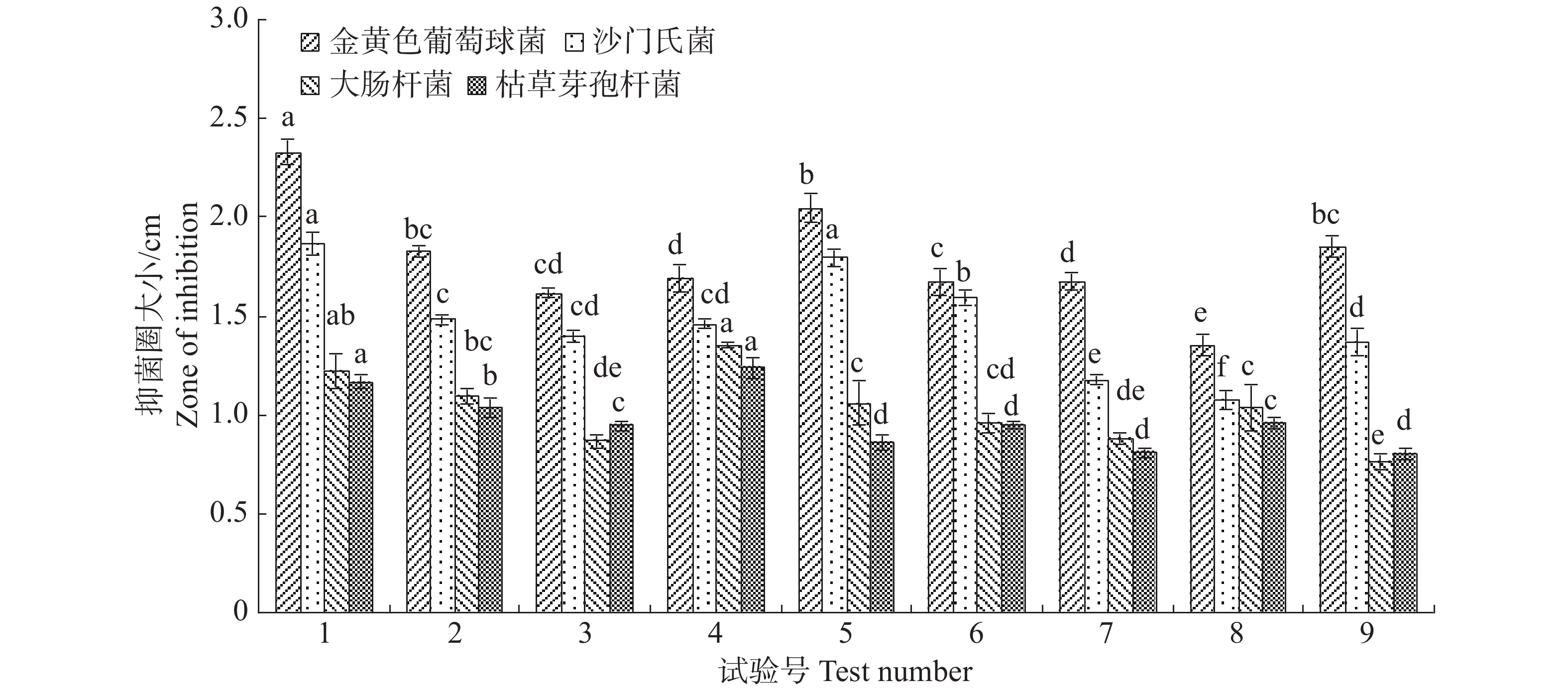
正交设计选出对内生真菌M2生长最适合的碳源、氮源和无机盐的浓度配比。不同浓度配比差异显著,结果8号处理下内生真菌M2菌丝质量2.1491 g,显著高于其他处理(图9)。从其结果可以发现,内生真菌M2营养生长越良好,反而抑制了其分泌抑菌物质。1号与4号处理,内生真菌M2菌丝质量较低,但它们的抑菌效果最突出。7号与8号处理,内生真菌M2菌丝质量最大,但他们抑菌效果明显低于其他处理(图10)。根据这些处理下内生真菌M2对4种病原细菌的抑制效果,选择处理1对应的碳源、氮源和无机盐浓度配比。
-
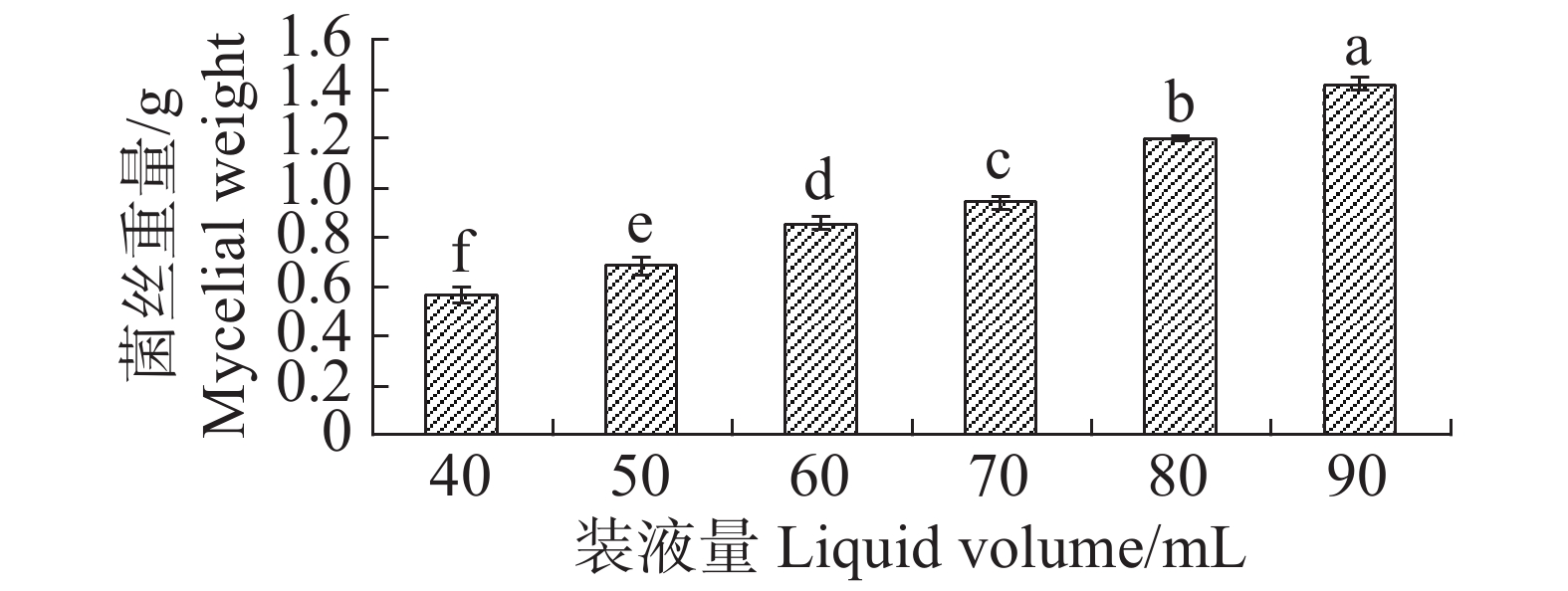
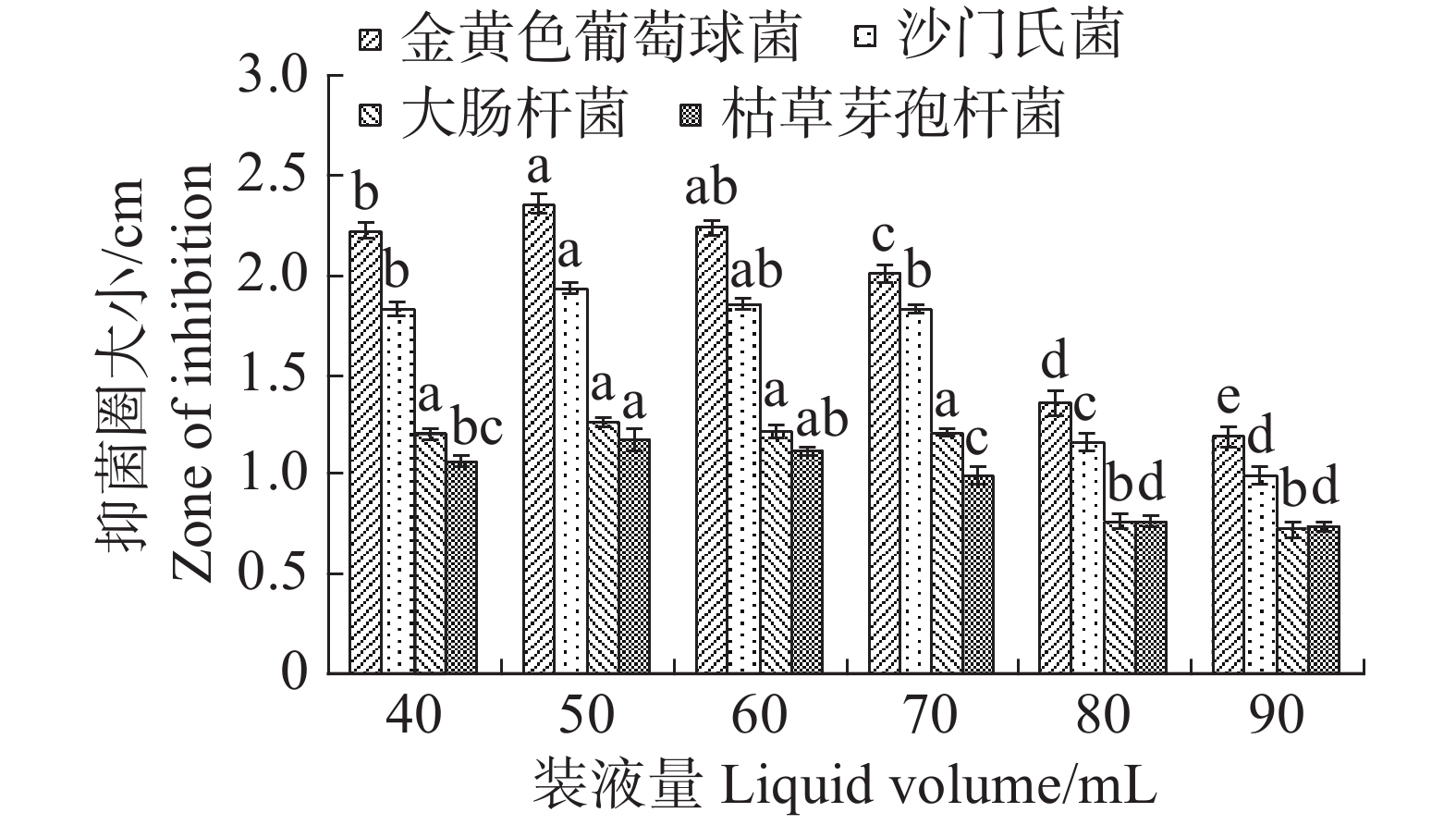
根据单因素试验,装液量对内生真菌M2的生物量增长有显著影响(图11),装液量每增加10 mL,内生真菌M2菌丝质量就显著高于前一个处理。装液量增加导致的直接结果是营养物质的增加,所以内生真菌M2菌丝质量呈现增加。在抑菌试验中,装液量为50 mL时,内生真菌M2对4种病原细菌抑制效果最好,装液量为90 mL时,内生真菌M2对4种病原细菌抑制效果最差(图12)。装液量为90 mL时,内生真菌M2对金黄色葡萄球菌和沙门氏菌的抑菌圈显著低于其他装液量;内生真菌M2对于大肠杆菌和枯草芽孢杆菌的抑制圈显著低于装液量为40,50,60,70 mL,与装液量80 mL时的差异不显著。根据上述结果,笔者选择装液量50 mL作为内生真菌M2发酵装液量。
-
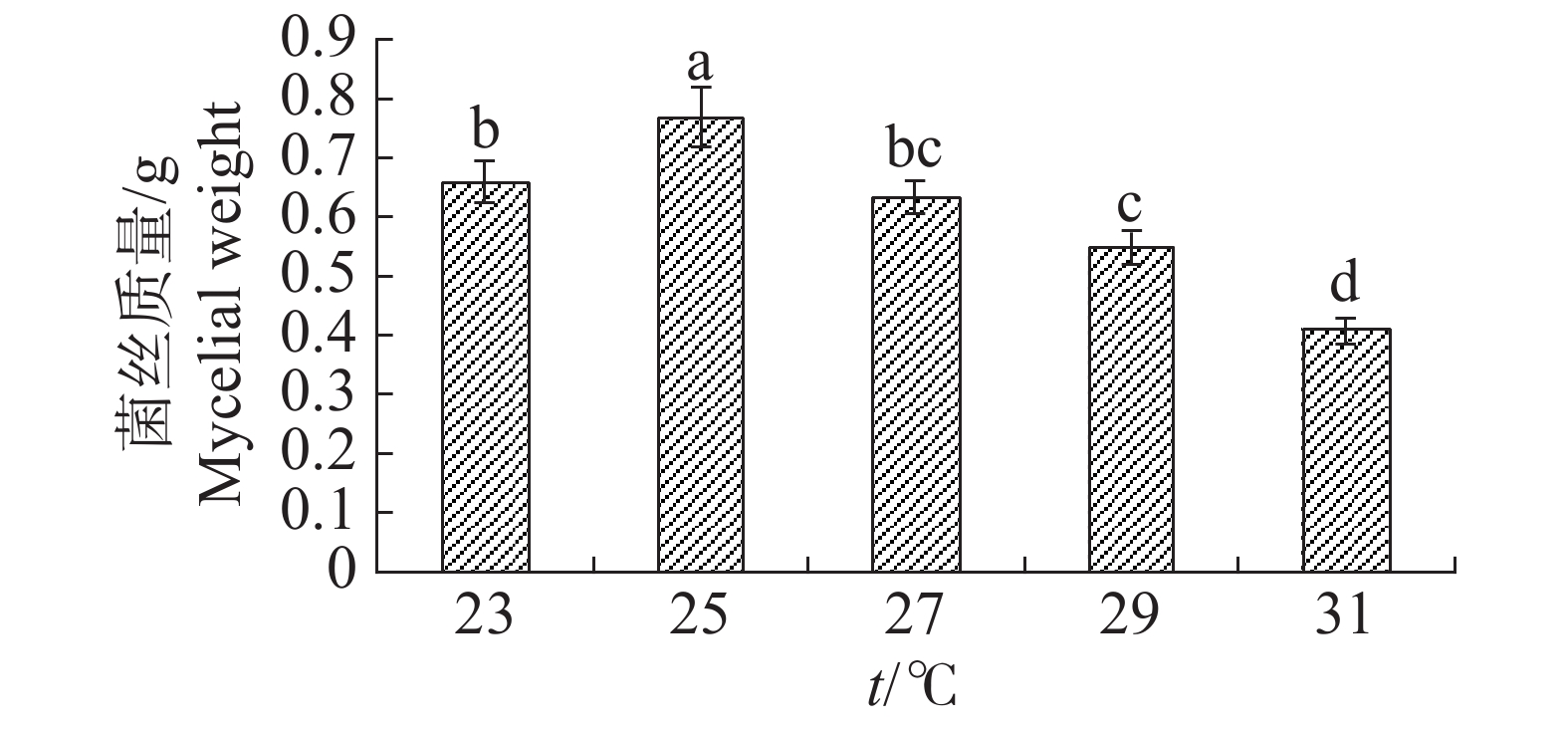
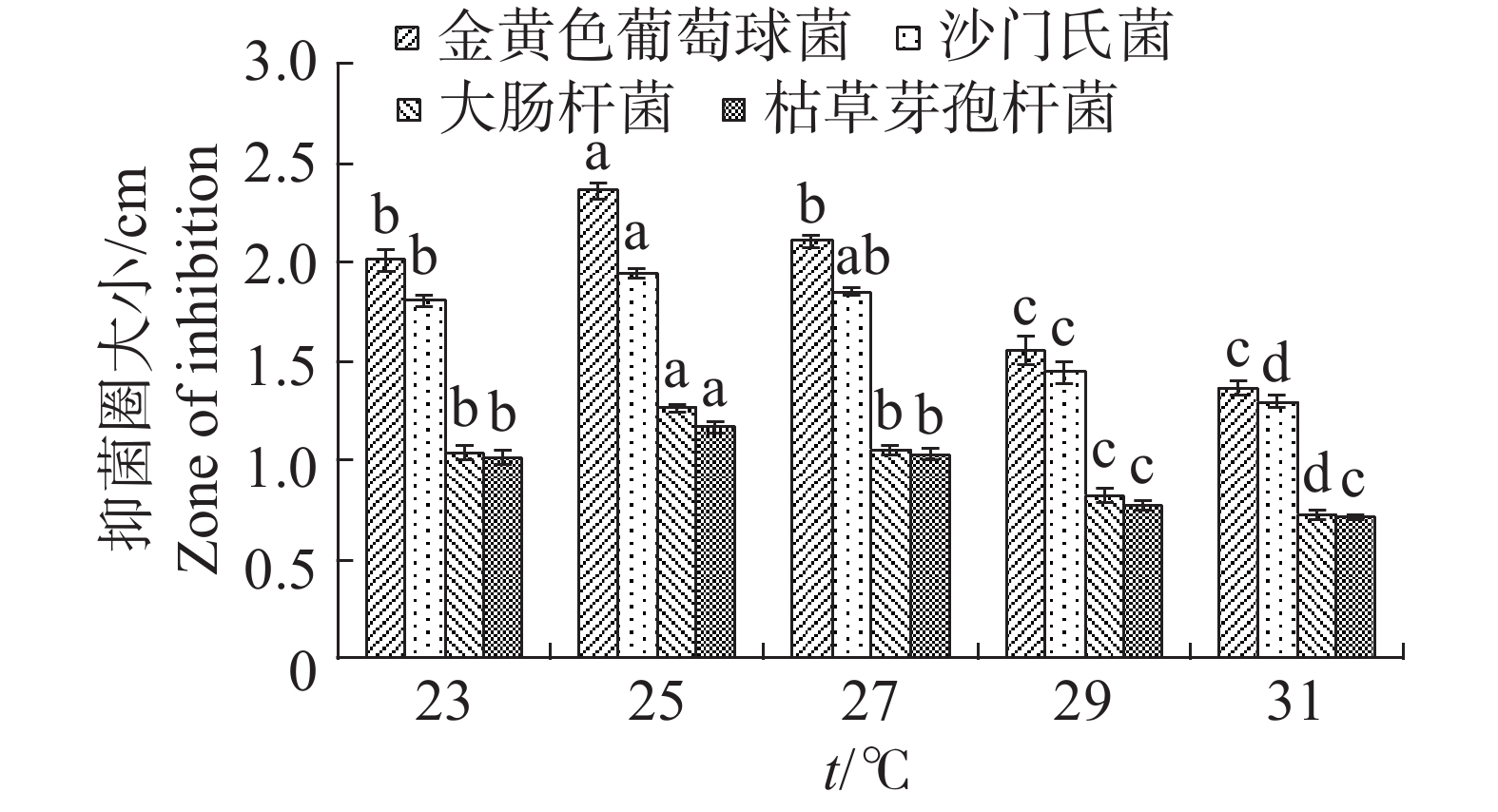
温度对于内生真菌M2影响较大,高温会抑制生长(图13)。如当摇床温度为31 ℃时,可明显观察到内生真菌M2菌丝量较为稀少,菌丝质量显著低于其他温度;温度25 ℃最适合生长,菌丝质量显著高于其他温度。温度对于4种病原细菌的抑制作用有较显著的差异(图14)。温度为25 ℃时,内生真菌对4种病原细菌的抑制作用最佳,温度为31 ℃时,内生真菌对4种病原细菌的抑制作用最差。根据上述结果,笔者选择温度为25 ℃作为内生真菌M2发酵温度。
-
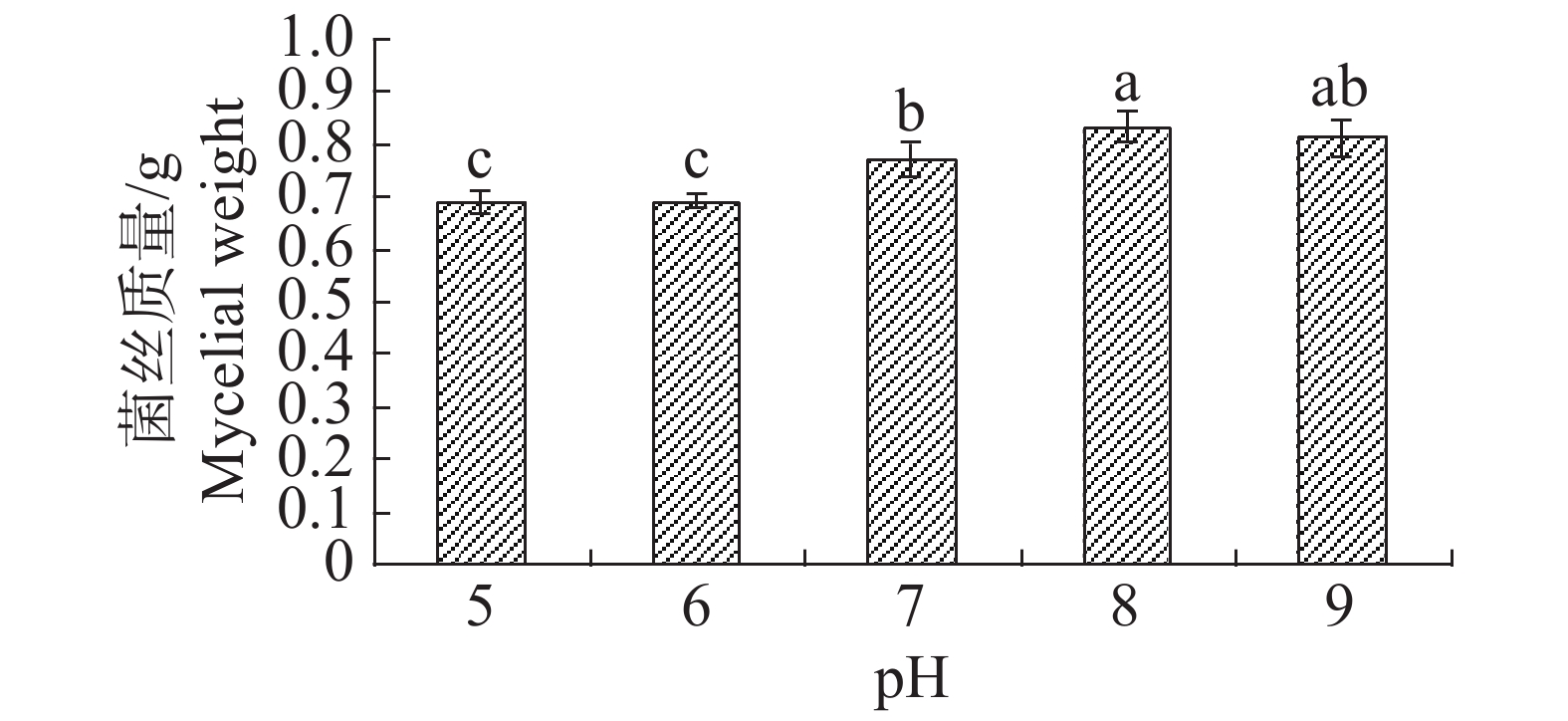
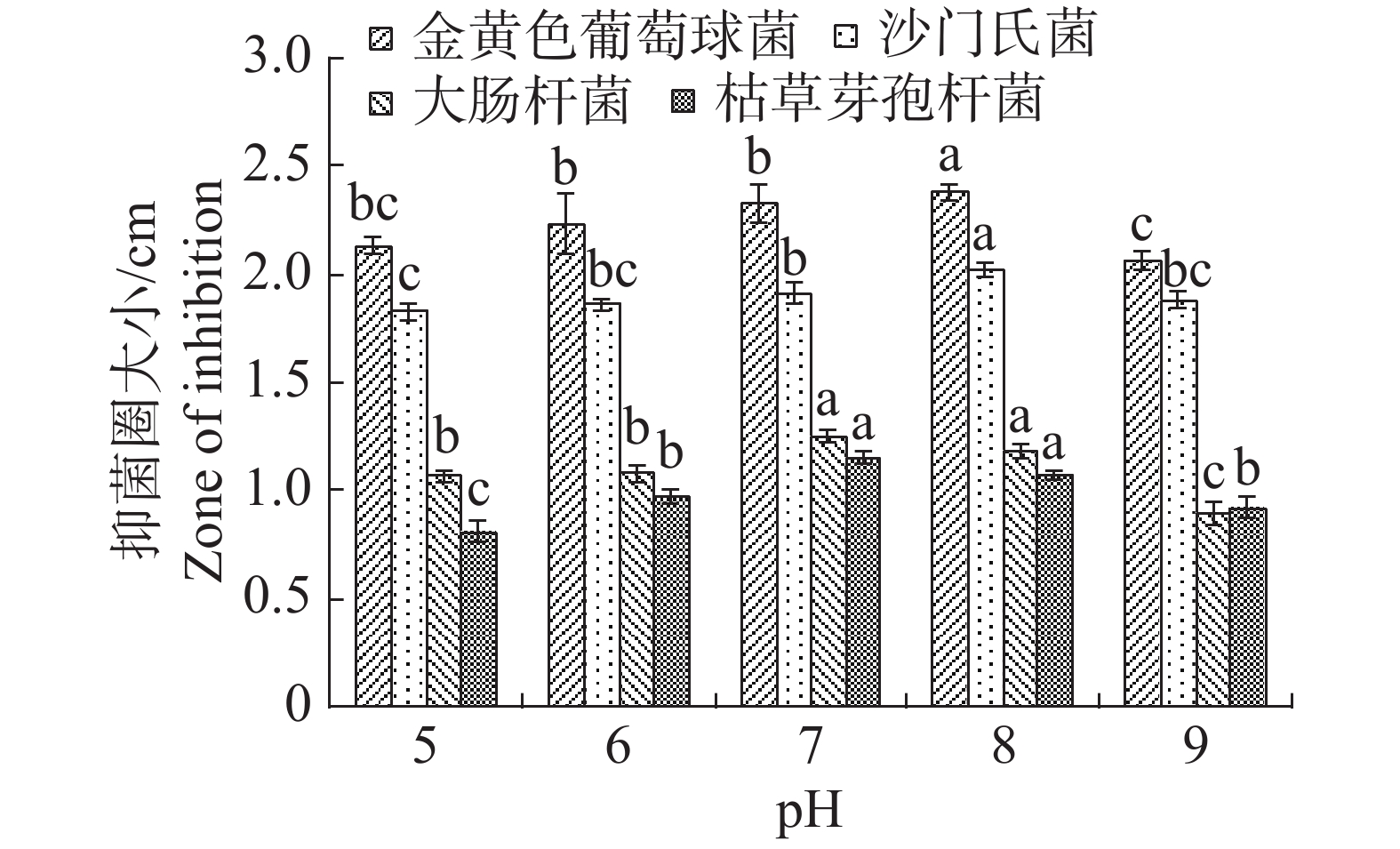
pH值对内生真菌M2生长影响也较为突出。培养基pH值过高或过低都不利于内生真菌M2的生长,pH值为8时最适合M2生长,菌丝质量为0.8334 g(图15)。培养基pH值为8时,内生真菌M2对金黄色葡萄球菌和沙门氏菌的抑制作用最佳,培养基pH值为7时,内生真菌M2对大肠杆菌和枯草芽孢杆菌的抑制作用最好(图16)。根据上述结果选择pH值为8作为内生真菌M2发酵的pH值。
-
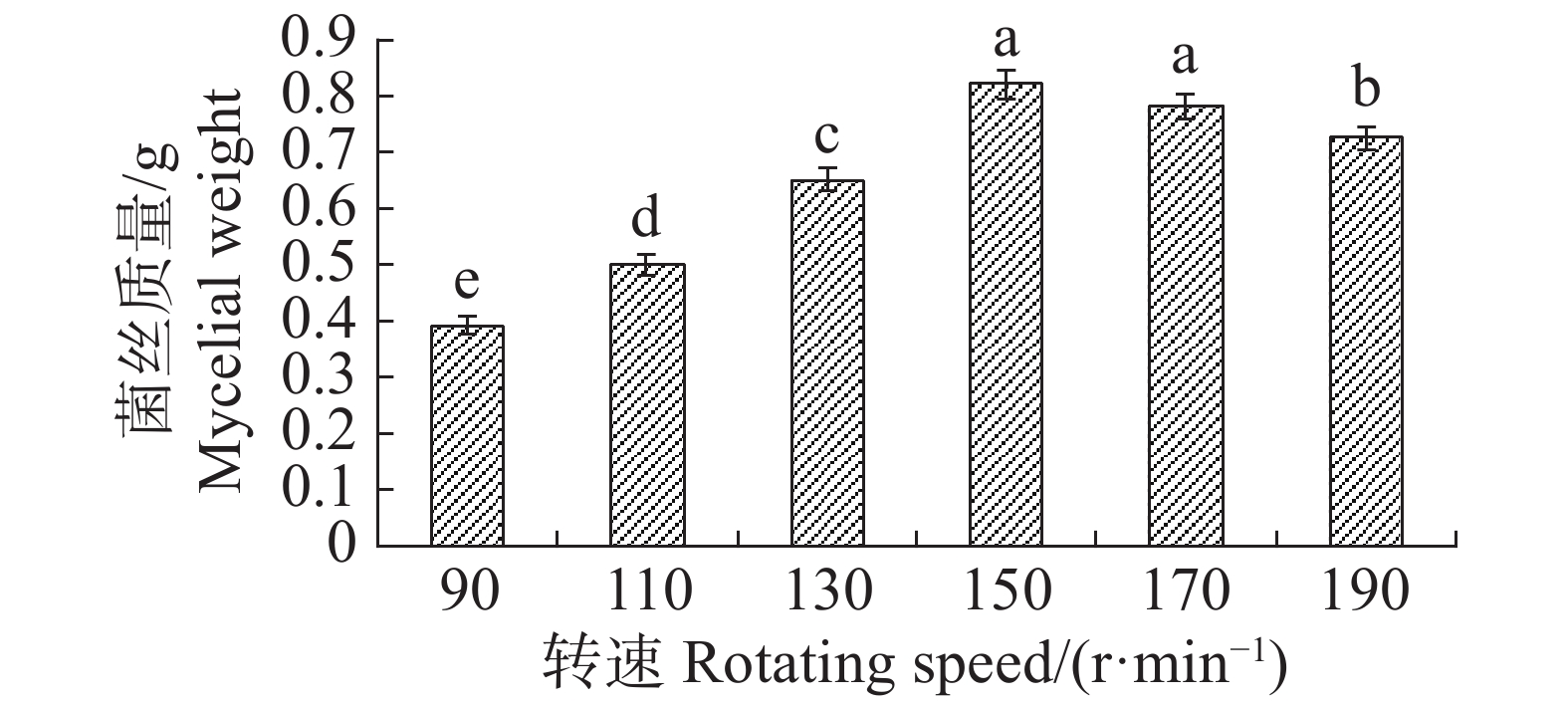
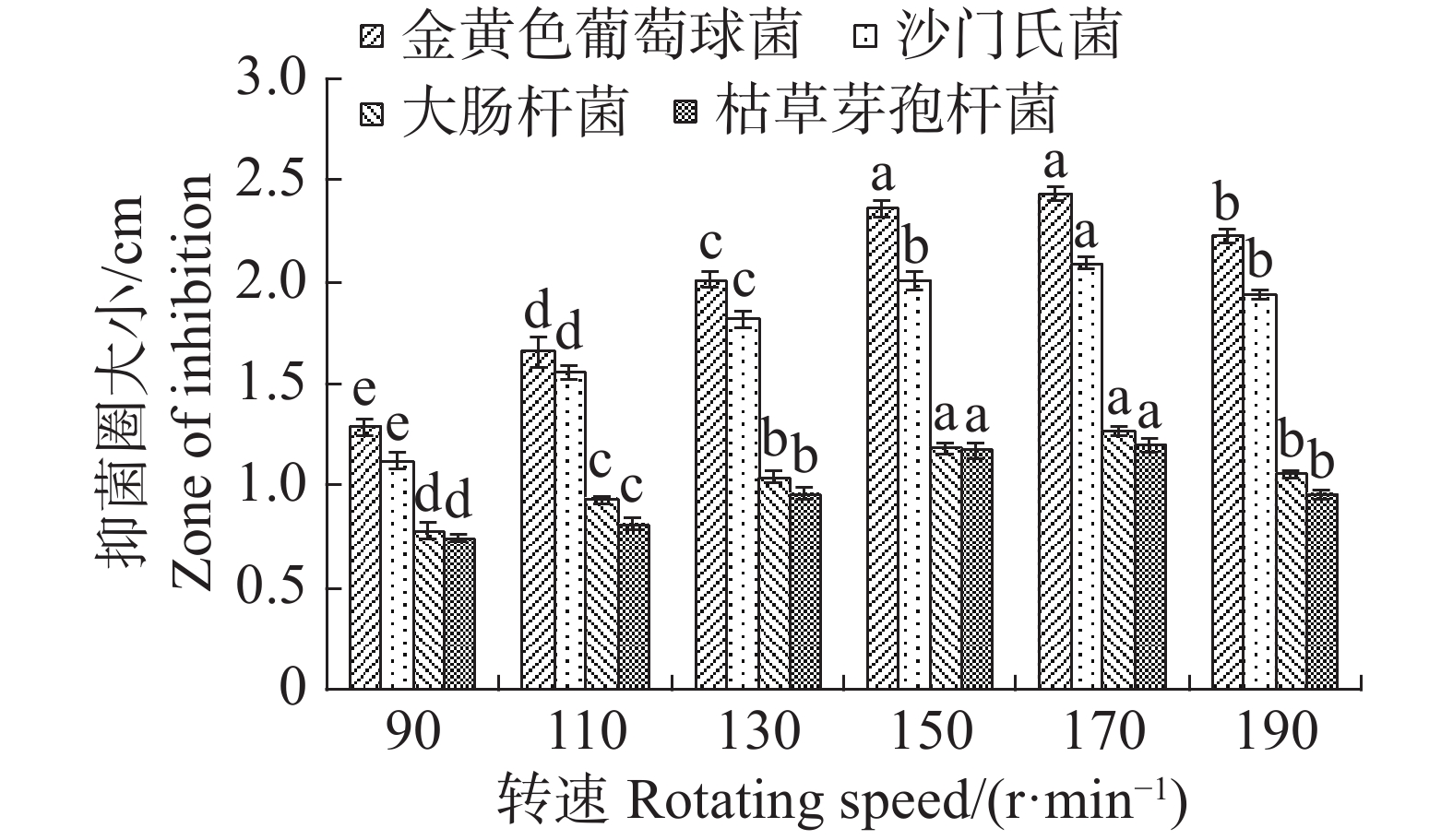
转速为150 r·min−1时,最适合内生真菌M2,菌丝质量为0.821 4 g,与转速为170 r·min−1时的菌丝质量差异不显著,但显著高于其他转速下对应的菌丝质量;转速为90 r·min−1,内生真菌M2菌丝质量最低,菌丝质量为0.3927 g,显著低于其他转速下对应的菌丝质量(图17)。摇床转速为170 r·min−1时,内生真菌对4种病原细菌抑制效果最好;转速为90 r·min−1,内生真菌对4种病原细菌抑制效果最差(图18)。根据上述结果,笔者选择转速为170 r·min−1作为内生真菌M2发酵的转速。
-
在自然状态下植物与其内生真菌长期的协同进化,可能会发生内生真菌与寄主植物有基因和信息交流,使内生真菌产生与寄主植物相同或类似的代谢途径,可能会产生与寄主植物相同或类似的具有生物活性的次生代谢产物[9-10]。这为在植物内生真菌中寻找与其寄主相同或类似的生物活性的化合物提供了理论基础。本研究结果表明,诺丽内生真菌具有抑菌活性。诺丽发酵果汁也被证明有抑菌作用[12],这可能与诺丽果实在发酵过程中内生真菌产生抑菌物质有关。在液体发酵中,营养元素会直接影响真菌的生长和代谢产物的产出。某些碳源就是一些抗生素的前体物质,选择合适的碳源可提高具有抑菌活性代谢产物的产出。有研究表明,葡萄糖是大多数真菌最适合的碳源[13-15]。本实验中葡萄糖和果糖作为碳源时抑菌圈最大,果糖最适合内生真菌M2菌丝的生长;果糖、蔗糖和葡萄糖作为碳源时,内生真菌M2抑菌效果较好,其中葡萄糖的效果最佳,故选择葡萄糖作为基础碳源。张方方等[16]发现以硫酸铵和硝酸钠为氮源时,炭团菌(Hypoxylon investiens)NX9菌株发酵液中的石杉碱甲含量显著提高。本实验中,尿素和胰蛋白胨等氮源显著抑制内生真菌M2的生长发育,还影响其代谢产物的产出,导致内生真菌M2没有抑菌性;氮源硝酸钠显著提高内生真菌M2的抑菌性。所以,选择合适的氮源非常重要。对于非营养条件的装液量、温度、pH值和转速对真菌发酵也有较大影响,如温度过高过低都不利于微生物发酵,温度过低会抑制其生长发育,还会抑制酶的活性;pH值也是发酵条件非常重要的因素,每种微生物都有最适合自身生长发育的pH值,其某些活性代谢产物只有在特定的pH值范围才能稳定存在。在本实验中,内生真菌M2优化后的培养基方案:200 g土豆煮沸30 min浸出液、葡萄糖20 g、硝酸钠5 g、磷酸二氢钾0.2 g、七水合硫酸镁0.2 g、1000 mL双蒸水;发酵条件:150 mL锥形瓶装液量50 mL、温度25 ℃、培养基初始pH为8、转速170 r·min−1。内生真菌在经过发酵优化后,对病原细菌的抑菌性显著提升。本研究发现,内生真菌M2菌丝质量与其次生代谢产物的抑菌性并不是一直呈正相关,在菌丝质量超过一定数值后,内生真菌M2的抑菌性会下降,这可能与菌丝体大量进行营养生长,进而抑制了次生代谢产物的分泌有关。本实验结果表明,装液量50 mL,内生真菌M2菌丝质量在0.8 g时,抑菌效果最好。
Identification of Bacteriostatic Activity of Noni Endophytic Fungus M2 and Optimization of Its Fermentation Conditions
-
摘要: 为了研究发酵条件对诺丽内生真菌M2抑菌性的影响,笔者采用传统方法和ITS rDNA测序方法相结合,将本实验室筛选出的抑菌效果突出的诺丽内生真菌M2初步鉴定为棘孢曲霉(Aspergillus aculeatus),在NCBI数据库中登录号为MK560191。通过单因素试验和正交设计对内生真菌M2进行发酵优化,筛选出最优发酵条件:(1)内生真菌M2优化后的培养基方案为200 g土豆煮沸30 min浸出液、葡萄糖20 g、硝酸钠5 g、磷酸二氢钾0.2 g、七水合硫酸镁0.2 g、1 000 mL双蒸水;(2)发酵条件为150 mL锥形瓶装液50 mL、温度25 ℃、培养基初始pH8、转速170 r·min−1。Abstract: An attempt was made to study the effect of fermentation conditions on the bacteriostasis of endophytic fungus M2 extracted from Noni (Morinda citrifolia Linn.). A combination of traditional methods and ITS rDNA sequencing was used to identify the Noni endophytic fungus M2 with outstanding bacteriostatic effect. The endophytic fungus M2 was cultured and fermented under different conditions by using single factor experiment and orthogonal design to optimize its fermentation conditions. The Noni endophytic fungus M2 was initially identified as Aspergillus aculeatus, and its accession number was MK560191 in the NCBI database. The optimum medium for the endophytic fungus M2 was potato infusion 200 g from potato boiled for 30 min, glucose 20 g, sodium nitrate 5 g, potassium dihydrogen phosphate 0.2 g, magnesium sulfate heptahydrate 0.2 g, 1000 mL double distilled water. The optimum fermentation conditions were solution 60 mL in a 150 mL conical flask, temperature 25 ℃, initial culture medium pH 8 and rotation speed 170 r·min−1.
-
Key words:
- Noni /
- endophytic fungi /
- bacteriostatic effect /
- fermentation
-
诺丽(Morinda citrifolia Linn.)原产于南太平洋群岛,在我国主要分布于海南岛、台湾岛、西沙群岛和西双版纳等地[1]。在传统医学中,诺丽植物的不同部位,如果实、叶子和根,被用来治疗肠道不正常、经期抽筋和尿路感染[2],还被用来治疗感冒和流感。诺丽植物提取物被证明具有清除自由基、抗菌、抗分解、抗癌、抗突变和抗炎的作用,并具有抑制低密度脂蛋白氧化、刺激免疫、净化血液、调节胆固醇和调节细胞功能的能力[3-6]。1956年Atkinson等[7]报道了诺丽叶能有效抑制沙门氏菌、伤寒沙门菌、金黄色葡萄球菌、草分枝杆菌等细菌的生长,并指出可能是诺丽中一些酚类物质(如:珊瑚木苷、L-天门冬氨酸、茜素和莨菪亭)和其他蒽醌类化合物在起作用,这些成分对细菌引起的皮肤感染、感冒、发热等疾病具有显著疗效。West B J等[8]发现大溪地诺丽果的甲醇和正丁醇提取物对大肠杆菌、白色念珠菌和金黄色葡萄球菌均有抑制作用,抑制效果与大溪地诺丽果果内的环烯醚萜含量有关,特别是与去乙酚基车叶草甙酸和车叶草甙酸有关[8]。
自然状态下,植物与其内生真菌长期的协同进化,可能导致内生真菌与寄主植物有基因和信息的交流,致使内生真菌产生与寄主植物相同或类似的代谢途径,也可能会产生与寄主植物相同或类似的具有生物活性的次生代谢产物[9-10],因此,利用植物内生真菌发酵可能会得到具有药理作用的化合物。此途径可避免直接从植物提取药用化学成分,起到保护植物资源和提升经济效益的作用。因此,本实验室在研究前期对诺丽内生真菌多样性和抑菌性展开探索,筛选出1株具有较强抑菌性的内生真菌M2,初步鉴定为棘孢曲霉(Aspergillus aculeatus)。诺丽果汁的发酵与其内生真菌有极大的关联性。内生真菌在发酵过程中,不同的营养物质和发酵条件可影响其代谢产物的产出。在诺丽果汁的发酵生产中不仅要考虑菌丝体增殖条件,还要考虑原料的成本,以及是否有利于代谢产物的积累,本研究中部分氮源就极大地抑制内生真菌M2的生长和减弱其抑菌性。真菌在发酵过程中,生长量与具有生物活性的代谢产物并不成正相关,在发酵过程中,若菌丝体过多会造成营养物质消耗过快,造成菌株的衰弱;菌株营养生长过快时会抑制代谢产物的生成。发酵条件对菌株M2的生长和具有生物活性的代谢产物的产出起关键作用,优化发酵条件可为提高诺丽发酵果汁的生产效率提供理论基础。
1. 材料与方法
1.1 材料
诺丽内生真菌M2保存于海南大学园艺学院药用植物团队实验室。病原细菌:金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli)、沙门氏菌(Salmonella spp.)和枯草芽孢杆菌(Bacillus subtilis),购自中国农业微生物菌种保藏管理中心。马铃薯葡萄糖琼脂(PDA)固体培养基、营养琼脂(NA)固体培养基、马铃薯葡萄糖肉汤(PDB)液体培养基、真菌基因组DNA提取试剂盒、PCR相关试剂,均购自北京索莱宝Solarbio科技有限公司。PCR引物序列由海南光威科技有限公司合成。
1.2 内生真菌M2的鉴定
用接种环挑取内生真菌M2的菌丝于载玻片上,棉蓝染色剂制成玻片,光学显微镜观察菌丝和孢子。根据真菌鉴定手册,从形态上初步鉴定该内生真菌的所属种类[11]。根据Solarbio真菌基因组DNA提取试剂盒方法提取内生真菌M2的DNA,以其DNA作为反应的模板,基于核糖体ITS区域的序列ITS1f(ITS1f:5′-CTTGGTCATTTAGAGGA AGTAA-3′)和ITS4(ITS4:5′-TCCTCCGCTTATTGATATGC-3′)作为引物进行PCR扩增。PCR扩增体系(25 μL):ddH2O 9.5 μL、Premix Taq 12.5 μL、引物各1.0 μL,DNA模板1.0 μL。PCR反应程序:94 ℃预变性5 min,94 ℃变性40 s,55 ℃退火40 s,72 ℃延伸55 s,共35个循环,最后72 ℃延伸10 min,于4 ℃冰箱保存,将PCR扩增产物在1.2%琼脂糖凝胶上进行电泳。将PCR扩增产物送到北京六合华大基因科技有限公司广州分公司进行测序,测得的序列在NCBI数据库中进行Blast比对,确定种属关系,选取相似性较高的序列,用MEGA5.0软件构建系统进化树。
1.3 内生真菌M2对病原细菌的抑菌性测定
将病原细菌配成106 cfu·mL−1的菌悬液。吸取106 cfu·mL−1菌悬液0.1 mL于NA平板上涂匀,即得含供试病原细菌平板。把内生真菌M2发酵液减压抽滤,得菌丝与菌液。菌液用等体积乙酸乙酯萃取3次,得菌液乙酸乙酯萃取液。菌丝用2倍体积的乙酸乙酯超声提取30 min,过滤得滤液。合并萃取液和滤液,减压浓缩,水域温度为45 ℃,得到浸膏。分析天平定量分析,配成20 g·L−1二甲基亚砜溶液。抑菌性测定处理:在直径6 mm滤纸片上加20 μL内生真菌次生代谢产物二甲基亚砜溶液,放入含供试病原细菌平板中,做3个重复。空白对照:在直径6 mm滤纸片加20 μL二甲基亚砜,放入含供试病原细菌平板中,做3个重复。处理和对照于37 ℃恒温培养箱中培养1 d,观测抑菌圈的大小。
1.4 菌丝生长量的测定
将发酵完成的内生真菌M2的菌丝进行减压抽滤,将菌丝于45 ℃烘箱烘干至恒重,用分析天平进行定量分析。
1.5 内生真菌M2发酵条件的优化
内生真菌M2发酵条件优化以PDB为基础培养基,培养条件为发酵条件,150 mL锥形瓶装液50 mL、温度25 ℃、培养基初始pH值自然、转速150 r·min−1、发酵5 d。优化结果主要以发酵液和菌丝乙酸乙酯粗提物抑菌性为主要依据,菌丝质量为次要依据。
1.5.1 碳源的选择
供试碳源:葡萄糖、蔗糖、麦芽糖、果糖、半乳糖、可溶性淀粉和玉米粉。每千克培养基添加20 g供试碳源,每处理3次重复,试验值取3次平均值。
1.5.2 氮源的选择
供试氮源:氯化铵、硝酸钠、尿素、牛肉膏、蛋白胨、大豆蛋白胨、胰蛋白胨、酵母提取物、鱼粉和豆饼粉。每千克培养基氮源的添加量见表1,每处理3次重复,试验值取3次平均值。
表 1 每千克培养基氮源的添加量Tab. 1 Medium supplemented with nitrogen source per kg氮源
Nitrogen含氮量/%
Nitrogen content添加量/g
Supplement氮源
Nitrogen source含氮量/%
Nitrogen content添加量/g
Supplement尿素 Carbamide 46.67 3.26 酵母提取物 Yeast Extract 9.00 16.9 硝酸钠 NaNO3 16.5 9.22 大豆蛋白胨 Soya Peptone 9.00 16.9 氯化铵 NH4Cl 26.67 5.7 牛肉浸膏 Beef Extract 12.00 12.68 硝酸铵 NH4NO3 16.47 9.23 豆粕粉 Mora Meal 5.23 29.07 胰蛋白胨 Tryptone 12.00 12.68 鱼粉 Fishmeal 8.59 17.71 1.5.3 无机盐的选择
供试无机盐:磷酸氢二钾、磷酸二氢钾、氯化钾、七水合硫酸镁和七水合硫酸亚铁。每千克培养基添加1 g,每个处理3次重复,试验值取3次平均值。
1.5.4 营养元素正交设计
根据单因素试验结果,选择最佳碳源(葡萄糖)、氮源(硝酸钠)、无机盐(七水合硫酸镁、磷酸二氢钾)共3个因素,设置3个水平,进行正交试验(表2,3)。每个处理进行3次重复,试验值取3次平均值。
表 2 营养元素正交设计Tab. 2 Orthogonal design of nutrient elements水平 Level 葡萄糖 Glucose 硝酸钠 NaNO3 无机盐 Inorganic salt 七水合硫酸镁 MgSO4·7H2O 磷酸二氢钾 KH2PO4 1 2% 0.50% 0.02% 0.02% 2 3% 1.00% 0.06% 0.06% 3 4% 1.50% 0.10% 0.10% 表 3 营养元素浓度配比Tab. 3 Ratio of nutrient concentration试验号 Code 葡萄糖 Glucose 硝酸钠 NaNO3 无机盐 Inorganic salt 七水合硫酸镁 MgSO4·7H2O 磷酸二氢钾 KH2PO4 1 1(2%) 1(0.50%) 1(0.02%) 1(0.02%) 2 1(2%) 2(1.00%) 2(0.06%) 2(0.06%) 3 1(2%) 3(1.50%) 3(0.10%) 3(0.10%) 4 2(3%) 1(0.50%) 2(0.06%) 3(0.10%) 5 2(3%) 2(1.00%) 3(0.10%) 1(0.02%) 6 2(3%) 3(1.50%) 1(0.02%) 2(0.06%) 7 3(4%) 1(0.50%) 3(0.10%) 2(0.06%) 8 3(4%) 2(1.00%) 1(0.02%) 3(0.10%) 9 3(4%) 3(1.50%) 2(0.06%) 1(0.02%) 1.5.5 装液量对内生真菌M2发酵产物的影响
以筛选出来的碳源(葡萄糖)、氮源(硝酸钠)、无机盐(七水合硫酸镁和磷酸二氢钾)为基础,分别以装液量40,50,60,70,80,90 mL进行发酵培养,每个处理3次重复,试验值取3次平均值。
1.5.6 温度对内生真菌M2发酵产物的影响
以筛选出来的碳源(葡萄糖)、氮源(硝酸钠)、无机盐(七水合硫酸镁和磷酸二氢钾)和装液量为基础,分别以温度23,25,27,29,31 ℃进行发酵培养,每个处理3次重复,试验值取3次平均值。
1.5.7 pH值对内生真菌M2发酵产物的影响
以筛选出来的碳源(葡萄糖)、氮源(硝酸钠)、无机盐(七水合硫酸镁和磷酸二氢钾)、装液量和温度为基础,将培养基的初始pH值为5.0,6.0,7.0,8.0,9.0。每个处理进行3次重复,试验值取3次平均值。
1.5.8 转速对内生真菌M2发酵产物的影响
在筛选出来的碳源(葡萄糖)、氮源(硝酸钠)、无机盐(七水合硫酸镁和磷酸二氢钾)、装液量、温度和pH值为基础,将摇床的转速调为90,110,130,150,170,190 r·min−1,每个处理3次重复,试验值取3次平均值。
2. 结果与分析
2.1 内生真菌M2鉴定结果
在PDA培养基接种内生真菌M2后,其生长迅速,只需3 d左右菌落就能铺满平板(图1-A)。内生真菌M2在培养基表面凸起,背面有褶皱,菌丝为白色,孢子为褐色(图1-B)。通过显微镜观察内生真菌M2菌丝为有隔菌丝,在菌丝顶端有特化厚壁的足细胞和分生孢子梗,上端形成膨大的孕性顶囊,顶囊表面有分生孢子(图1-C)。观察到孢子梗无横隔、光滑,在顶部膨大形成球形的可孕性的顶囊,顶囊表面产生小梗,小梗在顶囊全部表面呈辐射状向四周展开。分生孢子串生于小梗顶端呈柱形。笔者将其鉴定为曲霉属。
从诺丽提取出的内生真菌M2,以其DNA为模板,在特异性引物的引导下,PCR产物扩增出ITS区域序列测序,将M2的ITS rDNA基因序列上传于GenBank数据库,登录号为MK560191。将得到的扩增片段519 bp序列在NCBI数据库中进行Blast比对,用MEGA5.0软件构建系统进化树(图2),初步将其鉴定为棘孢曲霉(Aspergillus aculeatus)。
2.2 内生真菌M2发酵条件优化结果
2.2.1 内生真菌M2碳源优化结果
根据单因素试验发现果糖与玉米粉作为碳源时内生真菌M2的生物量显著高于其他碳源;果糖对应内生真菌M2菌丝干质量为1.0423 g,显著高于其他碳源(图3),为此,碳源中果糖最适合内生真菌M2的生长。果糖、蔗糖和葡萄糖作为碳源时,内生真菌M2抑菌效果较好,其中葡萄糖的效果最佳,故选择葡萄糖作为基础碳源(图4)。
2.2.2 内生真菌M2氮源的筛选
根据单因素试验,氮源中大豆蛋白胨最适内生真菌M2生长,尿素和胰蛋白胨显著地抑制了内生真菌M2的生长发育(图5)。不同氮源对内生真菌M2的抑菌性影响极为显著(图6),其中尿素、胰蛋白胨、酵母提取物和鱼粉作为氮源时抑制了内生真菌M2抑菌物质的分泌,导致内生真菌M2对4种病原细菌均没有抑制;硝酸钠、氯化铵和大豆蛋白胨作为氮源时,内生真菌M2对4种病原细菌均有抑制。综合比较对4种病原细菌的抑制性,以硝酸钠效果最佳,故选择硝酸钠作为内生真菌M2的氮源。
2.2.3 内生真菌M2无机盐的筛选
根据单因素试验,5种无机盐对内生真菌的生长影响差异不大,七水合硫酸亚铁作为无机盐时,内生真菌M2菌丝质量均显著低于氯化钾,其他4种无机盐均差异不显著,但以氯化钾效果最佳(图7)。不同无机盐内生真菌M2的抑菌性影响不显著(图8)。根据其对4种病原细菌的抑制效果,选择磷酸二氢钾和七水合硫酸镁作为无机盐。
2.2.4 正交设计结果
正交设计选出对内生真菌M2生长最适合的碳源、氮源和无机盐的浓度配比。不同浓度配比差异显著,结果8号处理下内生真菌M2菌丝质量2.1491 g,显著高于其他处理(图9)。从其结果可以发现,内生真菌M2营养生长越良好,反而抑制了其分泌抑菌物质。1号与4号处理,内生真菌M2菌丝质量较低,但它们的抑菌效果最突出。7号与8号处理,内生真菌M2菌丝质量最大,但他们抑菌效果明显低于其他处理(图10)。根据这些处理下内生真菌M2对4种病原细菌的抑制效果,选择处理1对应的碳源、氮源和无机盐浓度配比。
2.2.5 装液量筛选结果
根据单因素试验,装液量对内生真菌M2的生物量增长有显著影响(图11),装液量每增加10 mL,内生真菌M2菌丝质量就显著高于前一个处理。装液量增加导致的直接结果是营养物质的增加,所以内生真菌M2菌丝质量呈现增加。在抑菌试验中,装液量为50 mL时,内生真菌M2对4种病原细菌抑制效果最好,装液量为90 mL时,内生真菌M2对4种病原细菌抑制效果最差(图12)。装液量为90 mL时,内生真菌M2对金黄色葡萄球菌和沙门氏菌的抑菌圈显著低于其他装液量;内生真菌M2对于大肠杆菌和枯草芽孢杆菌的抑制圈显著低于装液量为40,50,60,70 mL,与装液量80 mL时的差异不显著。根据上述结果,笔者选择装液量50 mL作为内生真菌M2发酵装液量。
2.2.6 温度筛选结果
温度对于内生真菌M2影响较大,高温会抑制生长(图13)。如当摇床温度为31 ℃时,可明显观察到内生真菌M2菌丝量较为稀少,菌丝质量显著低于其他温度;温度25 ℃最适合生长,菌丝质量显著高于其他温度。温度对于4种病原细菌的抑制作用有较显著的差异(图14)。温度为25 ℃时,内生真菌对4种病原细菌的抑制作用最佳,温度为31 ℃时,内生真菌对4种病原细菌的抑制作用最差。根据上述结果,笔者选择温度为25 ℃作为内生真菌M2发酵温度。
2.2.7 pH值的筛选结果
pH值对内生真菌M2生长影响也较为突出。培养基pH值过高或过低都不利于内生真菌M2的生长,pH值为8时最适合M2生长,菌丝质量为0.8334 g(图15)。培养基pH值为8时,内生真菌M2对金黄色葡萄球菌和沙门氏菌的抑制作用最佳,培养基pH值为7时,内生真菌M2对大肠杆菌和枯草芽孢杆菌的抑制作用最好(图16)。根据上述结果选择pH值为8作为内生真菌M2发酵的pH值。
2.2.8 转速的筛选
转速为150 r·min−1时,最适合内生真菌M2,菌丝质量为0.821 4 g,与转速为170 r·min−1时的菌丝质量差异不显著,但显著高于其他转速下对应的菌丝质量;转速为90 r·min−1,内生真菌M2菌丝质量最低,菌丝质量为0.3927 g,显著低于其他转速下对应的菌丝质量(图17)。摇床转速为170 r·min−1时,内生真菌对4种病原细菌抑制效果最好;转速为90 r·min−1,内生真菌对4种病原细菌抑制效果最差(图18)。根据上述结果,笔者选择转速为170 r·min−1作为内生真菌M2发酵的转速。
3. 讨 论
在自然状态下植物与其内生真菌长期的协同进化,可能会发生内生真菌与寄主植物有基因和信息交流,使内生真菌产生与寄主植物相同或类似的代谢途径,可能会产生与寄主植物相同或类似的具有生物活性的次生代谢产物[9-10]。这为在植物内生真菌中寻找与其寄主相同或类似的生物活性的化合物提供了理论基础。本研究结果表明,诺丽内生真菌具有抑菌活性。诺丽发酵果汁也被证明有抑菌作用[12],这可能与诺丽果实在发酵过程中内生真菌产生抑菌物质有关。在液体发酵中,营养元素会直接影响真菌的生长和代谢产物的产出。某些碳源就是一些抗生素的前体物质,选择合适的碳源可提高具有抑菌活性代谢产物的产出。有研究表明,葡萄糖是大多数真菌最适合的碳源[13-15]。本实验中葡萄糖和果糖作为碳源时抑菌圈最大,果糖最适合内生真菌M2菌丝的生长;果糖、蔗糖和葡萄糖作为碳源时,内生真菌M2抑菌效果较好,其中葡萄糖的效果最佳,故选择葡萄糖作为基础碳源。张方方等[16]发现以硫酸铵和硝酸钠为氮源时,炭团菌(Hypoxylon investiens)NX9菌株发酵液中的石杉碱甲含量显著提高。本实验中,尿素和胰蛋白胨等氮源显著抑制内生真菌M2的生长发育,还影响其代谢产物的产出,导致内生真菌M2没有抑菌性;氮源硝酸钠显著提高内生真菌M2的抑菌性。所以,选择合适的氮源非常重要。对于非营养条件的装液量、温度、pH值和转速对真菌发酵也有较大影响,如温度过高过低都不利于微生物发酵,温度过低会抑制其生长发育,还会抑制酶的活性;pH值也是发酵条件非常重要的因素,每种微生物都有最适合自身生长发育的pH值,其某些活性代谢产物只有在特定的pH值范围才能稳定存在。在本实验中,内生真菌M2优化后的培养基方案:200 g土豆煮沸30 min浸出液、葡萄糖20 g、硝酸钠5 g、磷酸二氢钾0.2 g、七水合硫酸镁0.2 g、1000 mL双蒸水;发酵条件:150 mL锥形瓶装液量50 mL、温度25 ℃、培养基初始pH为8、转速170 r·min−1。内生真菌在经过发酵优化后,对病原细菌的抑菌性显著提升。本研究发现,内生真菌M2菌丝质量与其次生代谢产物的抑菌性并不是一直呈正相关,在菌丝质量超过一定数值后,内生真菌M2的抑菌性会下降,这可能与菌丝体大量进行营养生长,进而抑制了次生代谢产物的分泌有关。本实验结果表明,装液量50 mL,内生真菌M2菌丝质量在0.8 g时,抑菌效果最好。
-
表 1 每千克培养基氮源的添加量
Table 1 Medium supplemented with nitrogen source per kg
氮源
Nitrogen含氮量/%
Nitrogen content添加量/g
Supplement氮源
Nitrogen source含氮量/%
Nitrogen content添加量/g
Supplement尿素 Carbamide 46.67 3.26 酵母提取物 Yeast Extract 9.00 16.9 硝酸钠 NaNO3 16.5 9.22 大豆蛋白胨 Soya Peptone 9.00 16.9 氯化铵 NH4Cl 26.67 5.7 牛肉浸膏 Beef Extract 12.00 12.68 硝酸铵 NH4NO3 16.47 9.23 豆粕粉 Mora Meal 5.23 29.07 胰蛋白胨 Tryptone 12.00 12.68 鱼粉 Fishmeal 8.59 17.71 表 2 营养元素正交设计
Table 2 Orthogonal design of nutrient elements
水平 Level 葡萄糖 Glucose 硝酸钠 NaNO3 无机盐 Inorganic salt 七水合硫酸镁 MgSO4·7H2O 磷酸二氢钾 KH2PO4 1 2% 0.50% 0.02% 0.02% 2 3% 1.00% 0.06% 0.06% 3 4% 1.50% 0.10% 0.10% 表 3 营养元素浓度配比
Table 3 Ratio of nutrient concentration
试验号 Code 葡萄糖 Glucose 硝酸钠 NaNO3 无机盐 Inorganic salt 七水合硫酸镁 MgSO4·7H2O 磷酸二氢钾 KH2PO4 1 1(2%) 1(0.50%) 1(0.02%) 1(0.02%) 2 1(2%) 2(1.00%) 2(0.06%) 2(0.06%) 3 1(2%) 3(1.50%) 3(0.10%) 3(0.10%) 4 2(3%) 1(0.50%) 2(0.06%) 3(0.10%) 5 2(3%) 2(1.00%) 3(0.10%) 1(0.02%) 6 2(3%) 3(1.50%) 1(0.02%) 2(0.06%) 7 3(4%) 1(0.50%) 3(0.10%) 2(0.06%) 8 3(4%) 2(1.00%) 1(0.02%) 3(0.10%) 9 3(4%) 3(1.50%) 2(0.06%) 1(0.02%) -
[1] 广东省植物研究所. 海南植物志(第三卷)[M]. 北京: 科学出版社, 1974: 330 − 331. [2] GOODYEAR-SMITH F. JPHC achieves MEDLINE status [J]. Journal of Primary Health Care, 2010, 2(3): 178 − 179. doi: 10.1071/HC10178 [3] SALUDES J P, GARSON M J, FRANZBLAU S G, et al. Antitubercular constituents from the hexane fraction of Morinda citrifolia Linn. (Rubiaceae) [J]. Phytotherapy Research, 2002, 16(7): 683 − 685. doi: 10.1002/ptr.1003 [4] YAMAGUCHI S, OHNISHI J, SOGAWA M, et al. Inhibition of angiotensin I converting enzyme by Noni (Morinda citrifolia) juice [J]. Journal of the Japanese Society for Food Science and Technology, 2002, 49(9): 624 − 627. doi: 10.3136/nskkk.49.624 [5] FURUSAWA E, HIRAZUMI A, STORY S, et al. Antitumour potential of a polysaccharide-rich substance from the fruit juice of Morinda citrifolia (Noni) on sarcoma 180 ascites tumour in mice [J]. Phytotherapy Research, 2010, 17(10): 1158 − 1164. [6] HORNICK C A, MYERS A, SADOWSKA-KROWICKA H, et al. Inhibition of angiogenic initiation and disruption of newly established human vascular networks by juice from Morinda citrifolia(noni) [J]. Angiogenesis, 2003, 6(2): 143 − 149. doi: 10.1023/B:AGEN.0000011800.04507.4b [7] ATKINSON N. Antibacterial activity of dried Australian plants by rapid direct plate test [J]. Aust J Exp Bio Med Sci, 1956, 34(1): 17 − 26. doi: 10.1038/icb.1956.2 [8] WEST B J, PALMER S K, DENG S, et al. Antimicrobial activity of an iridoid rich extract from Morinda citrifolia fruit [J]. Current Research Journal of Biological Sciences, 2012, 4(1): 52 − 54. [9] RODRIGUEZ R J, JR W J, ARNOLD A E, et al. Fungal endophytes: diversity and functional roles [J]. New Phytologist, 2009, 182(2): 314 − 330. doi: 10.1111/j.1469-8137.2009.02773.x [10] 郑红梅, 叶耀辉, 王婷, 等. 药用植物内生真菌及其代谢产物活性的研究概况[J]. 江西中医药, 2016, 47(4): 71 − 73. [11] 魏景超. 真菌鉴定手册[M]. 上海: 上海科学技术出版社, 1979. [12] 龚敏, 苏奎, 邓世明. 诺丽鲜果与诺丽发酵汁的抗氧化及抑菌活性的对比研究[J]. 食品科技, 2010, 35(10): 92 − 94. [13] 龚倩. 银杏内生真菌抗菌、抑菌活性的初步研究[D]. 芜湖: 安徽工程大学, 2015. [14] 文欣. 蝉花真菌的筛选及其液态发酵工艺的优化[D]. 长沙: 湖南农业大学, 2013. [15] 占宝林. 杀线虫真菌的筛选及菌株DF09002的鉴定、发酵优化与产酶特性研究[D]. 海口: 海南大学, 2010. [16] 张方方, 王明兹, 刘海元, 等. 闽浙马尾杉内生真菌炭团菌NX9产石杉碱甲的发酵条件优化[J]. 中国医药工业杂志, 2015, 46(8): 827 − 832. 期刊类型引用(2)
1. 张海婷,叶建蓉,许秉智,曾铄程,符慧娟,李星月,李其勇,张鸿,易军. 越西县苹果黑星病菌鉴定、生物学特性及田间防效研究. 中国农学通报. 2025(07): 115-120 .  百度学术
百度学术2. 刘仙喜,吴夫,蒋启程,刘邦,陈帅,周海龙. 诺丽对海南黑山羊生长和免疫性能的影响. 广东农业科学. 2022(10): 127-134 .  百度学术
百度学术其他类型引用(2)
-





 下载:
下载:



 下载:
下载:

