-
木薯(Manihot esculenta)是大戟科木薯属植物,广泛种植于非洲、美洲和亚洲等100多个国家和地区,是世界三大薯类作物之一,具有适应能力强,耐干旱、耐贫瘠和产量高等特点[1-2]。不同木薯品种间对不同氮素的利用效率差异显著,氮利用效率的差异包括低氮信号响应、氮吸收能力及氮的同化能力等,分析木薯不同氮利用效率的生理特点,对挖掘木薯氮高效基因、氮利用效率的遗传改良、指导氮肥管理等都具有重要的理论意义和实际应用价值。硝态氮和铵态氮是植物利用氮素的2种主要形态[3],它们的丰度随土壤通气状况、降水多少等气候的不同而不同。在通气良好、中性至高pH值的土壤中,硝酸盐是最丰富的氮素来源,而在水渍或低pH值的土壤中,铵是主要的N形态。在日常生产中,将尿素施入土壤中,在脲酶作用下转化成NH4 +,NH4+在硝化细菌作用下可转化成NO3−,土壤中 NO3−和NH4+2种形态的时空分布不均一是植物面临的生长常态[4]。植物通过根系形态及生理生化方面的改变,来适应不断变化的养分环境 [5],如作物在氮(N)缺乏的条件下或者硝酸盐不足时,地下部会形成细而长的侧根,而在NH4+处理下,则会产生短而分枝性强的侧根。当同一株植物一侧根系接触不同浓度的氮或不同形态氮素时,根系的适应性调控机制尚待探究。木薯是一种低投入、高产出的农作物,一般施肥方式较为粗放,这就造成了在长期栽培过程中根系周围的养分浓度差异较大,氮含量和氮形态在时空上高度异质化[6]。木薯是一种耐贫瘠作物,能够在贫瘠土壤上获得相对可观的生物量或产量,相比其他作物,其根系能够更加敏感地感知土壤中的低氮胁迫信号,并调动自身的生理代谢来促进有氮侧侧根的形态发育,使其具备更好的氮素吸收和利用能力,适应养分不均一的环境[7]。目前,大多数木薯氮素高效利用的研究是在均质条件下使用单一氮素形态进行的,不能很好地反映木薯生长环境中养分差异化,因此,本研究通过异质分根处理模拟根际土壤氮素分布不均一的环境,分析不同品种木薯对2种形态氮素减氮分根处理后生理特性的变化,探索单侧减氮对木薯氮高效利用的贡献,旨在为木薯施肥提供指导和后续氮高效相关基因的挖掘奠定基础。
-
试验位于海南省海口市海南大学海甸校区农科试验基地,试验始于2022年,该地区气候类型为热带季风性气候,年均气温24.4 ℃,最高平均气温约28 ℃,年平均日照时数超过2 000 h,年均降水量1 700 mm。
-
以我国目前的主栽品种‘华南205号’ (‘SC205’)、高产品种‘华南16号’(‘SC16’)为试验材料,种茎截成10~12 cm的茎段,初步育苗生根的基质为:不含有可溶性养分的椰糠(V粗椰糠∶V细椰糠土= 1∶10);分根试验所用的基质为:洗净风干的椰糠与低营养土按照1∶1.5体积比例混合(V椰糠∶V低营养土= 1∶1.5)。
-
为了模拟田间土壤氮素分布不均一的情况,采用土培分根的方式设置4种氮处理:硝酸盐均质(两侧都加5 mmol·L−1硝酸盐)、硝酸盐异质(一侧无氮,一侧加5 mmol·L−1硝酸盐)、铵盐均质(两侧都加5 mmol·L−1铵盐)、铵盐异质一侧无氮,一侧加5 mmol·L−1铵盐),每个营养钵各浇100 mL的营养液,每种氮处理各重复5次。试验流程如图1所示。容器规格为两两一组9 cm×9 cm×32 cm的自制连体营养钵(图2)。茎秆在椰糠内进行初步育根2~3周,拔出根系剪齐3~5 cm,将茎端置于分根装置的坐垫上,根系平均分置于两侧营养钵内。均质分根处理即两侧营养钵内浇相同氮素的营养液,异质分根处理即一侧施加无氮营养液,另一侧施加硝态氮或铵态氮营养液,浇灌时用0.5 倍的稀释液,每7天浇灌1次,培养液至刚刚有营养液从营养钵底部流出,期间视天气情况及时补水,培养30 d后取样测定表型和生理性状。
营养液配方为:NaNO3和NH4Cl(5 mmol·L−1),营养液除氮以外其余元素的组成成分及浓度如下:NaH2PO4(2 mmol·L−1),K2SO4(2 mmol·L−1),MgSO4(500 μmol·L−1),CaCl2 (1 mmol·L−1),H3BO3(10 μmol·L−1),MnSO4(0.5 μmol·L−1)),ZnSO4(0.5 μmol·L−1),CuSO4(0.1 μmol·L−1),(NH4)6Mo7O24(0.1 μmol·L−1),和Fe-EDTA(25 μmol·L−1)。
-
刻度尺测量株高、称植株的生物量,分根、茎、叶取样,105 ℃杀青30 min,然后80 ℃烘至恒重。
-
木薯根系用去离子水清理干净后,用EPSON Expression 12000XL(USB)根系扫描仪扫描木薯根系,运用根系图像分析软件WinRHIZO Pro分析各个处理的根长、根面积、根体积及根平均直径。
-
称取杀青后的木薯根、茎、叶各部位样品0.1 g,采用浓H2SO4-H2O2消煮纳氏试剂比色法测量氮素含量。
-
冠根比=地下部分干质量/地上部分干质量;生物量=各部分的干总质量;氮积累量=氮含量×干物质量;氮素积累总量 = 根中氮素累积量+茎秆氮素积累量 + 叶片氮素积累量 ;氮转运系数=地上氮含量/地下氮含量;氮素生理利用效率 = 干物质量/ 氮积累量 。
-
采用Excel 2020进行数据处理,用SPSS Statistics 26软件进行方差分析、利用LSD法分析2种氮素处理后表型及生理性状指标差异显著性,P<0.05为显著性差异,P<0.01为极显著差异。
-
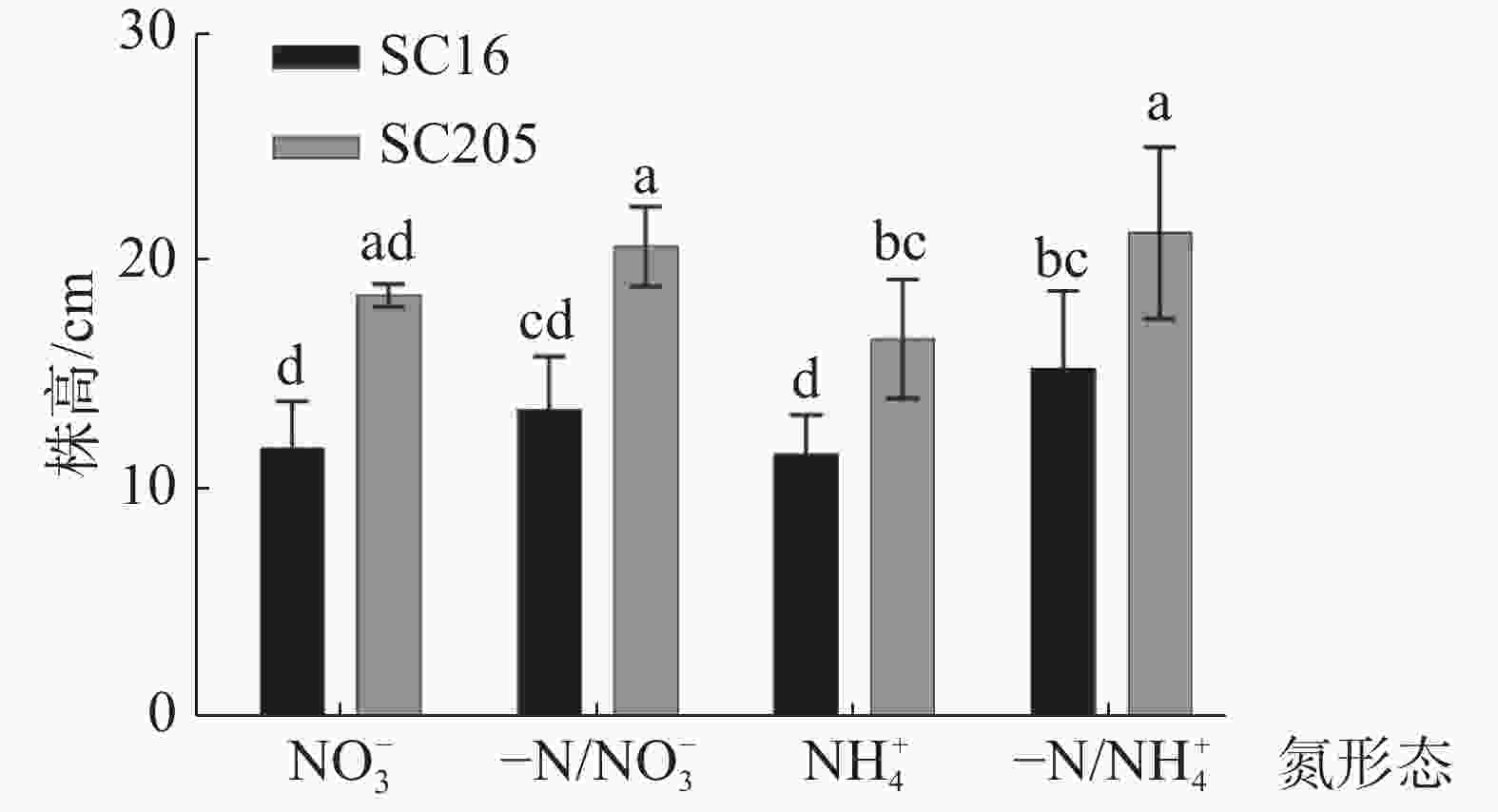
通过LSD方差检验,分析‘SC16’、‘SC205’在硝态氮(NO3−)和铵态氮(NH4+)分根处理后株高差异。从图3可知,与NO3−均质处理相比,-N/NO3−异质处理能使‘SC16’和‘SC205’株高增加22%,但增加幅度无显著差异。对比NH4+均质处理,-N/NH4+异质处理后,2个株系株高均有显著增加(P<0.05)。研究结果表明,异质分根处理,氮投入量减少一半,可以促进木薯株高的生长,另外受基因型的影响在2种形态氮素的异质分根处理后,‘SC205’的株高均显著高于‘SC16’(P<0.05)。
-
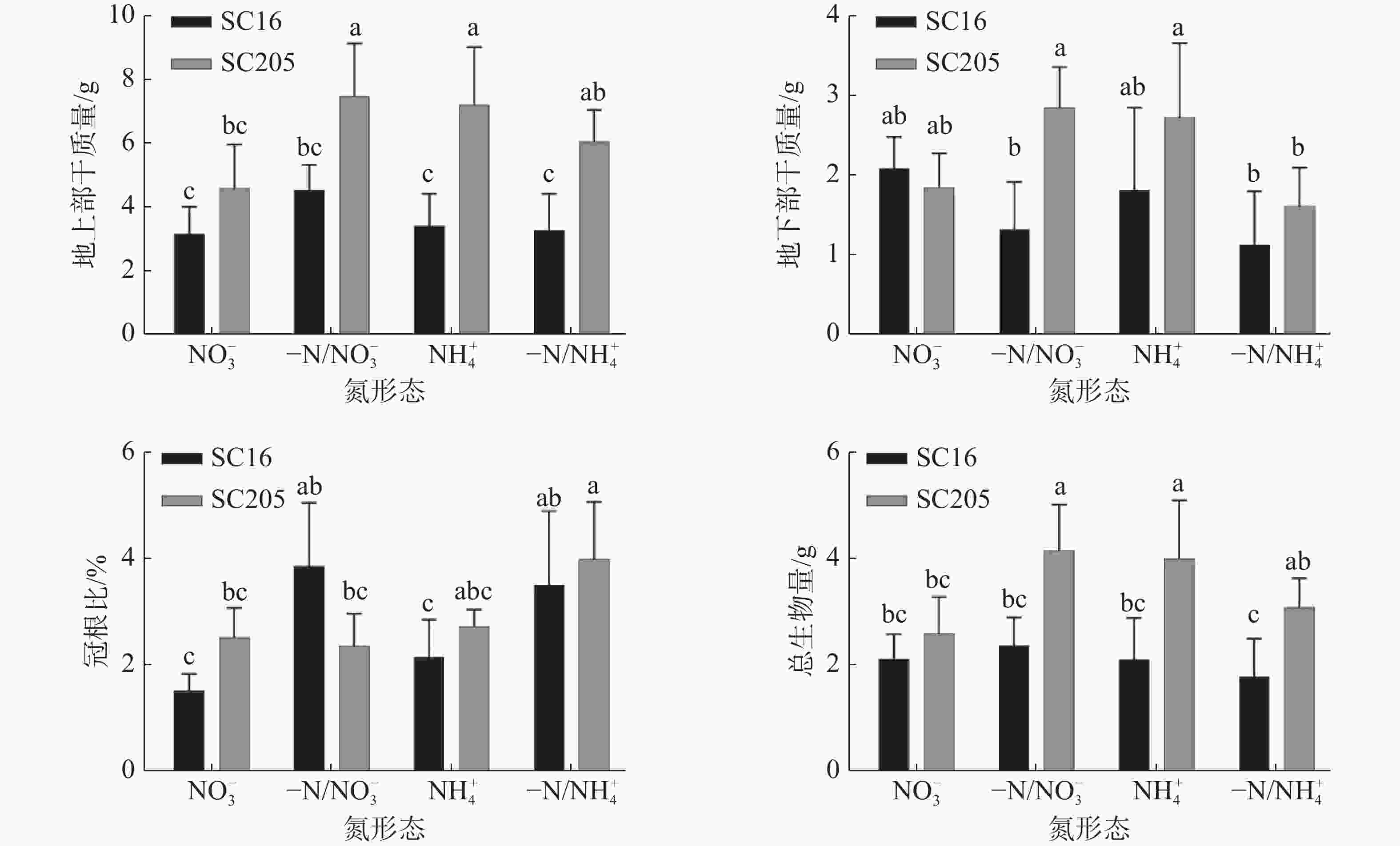
如图4所示,相比NO3−均质处理,-N/ NO3−分根处理后‘SC205’地上部干重和总生物量显著增加,‘SC16’根冠比显著提升。相比NH4+均质处理,-N/NH4+分根处理后‘SC16’冠根比显著增加,‘SC205’冠根比、地上部、植株总干质量无显著差异(P>0.05),根系干重显著下降。整体而言,‘SC205’地上部、地下部和总生物量在4种素处理下均优于‘SC16’,可能预示着‘SC205’具有良好的适应性。
-
氮累积量的高低代表了植物对氮素的吸收及同化能力。结果如表1所示,与NO3−均质处理相比,‘SC16’经过-N/NO3−异质处理后,地上部氮累积量增加59%,全株氮积累量增加41%,而‘SC205’在-N/ NO3−异质处理后,地上部和全株氮积累量都提升了33%。这2个品种在-N/ NO3−异质处理后,全株氮效率差异均达到极显著水平(P<0.01)。相反,与NH4+均质处理相比,-N/NH4+异质处理后,‘SC205’地上部分氮积累量增加了5%(P<0.05),但全株氮积累量与‘SC16’相同,无显著变化。上述结果表明木薯对硝酸盐具有偏好性。同时也说明异质分根处理时,无氮一侧根系感知低氮信号时,会促进地上部氮的吸收能力。受基因型的影响,‘SC205’在-N/ NO3−或-N/NH4+异质处理下全株氮积累量及各组织氮累积量均显著高于‘SC16’(P<0.05),这也说明‘SC205’对氮的响应更强烈。
表 1 分根培养下2种形态氮素对不同品种木薯幼苗氮积累量的影响
品种
氮形态 氮积累量/(mg·g−1) 地上部 根 全株 ‘SC16’ NO3− 101.43±0.73e 27.02±1.05b 128.45±1.74c -N/NO3− 161.49±0.41c 20.08±0.20c 181.57±0.30b NH4+ 86.73±1.44f 14.19±0.44d 100.92±1.87d -N/NH4+ 85.16±0.84f 13.71±0.12d 98.87±0.87d ‘SC205’ NO3− 147.51±1.56d 28.1±0.16b 175.61±1.44b -N/NO3− 196.80±2.44b 37.61±0.53a 234.41±2.45a NH4+ 200.79±2.19b 28.81±1.41b 229.60±2.74a -N/NH4+ 210.61±7.79a 20.97±0.33c 231.58±7.47a 注:不同小写字母代表处理存在显著性差异(P<0.05),下同。 -
由表2可知,相比均质分根处理,‘SC16’和‘SC205’在-N/NO3−和-N/NH4+异质分根处理后,全株氮含量整体上升,减氮分根使得转运系数减少了55%,地下部氮含量增多。
表 2 分根培养下2种形态氮素对不同品种木薯幼苗氮含量及转运系数的影响
品种 氮形态 氮含量/% 转运系数 地上部 根 总氮 ‘SC16’ NO3− 52.58±0.56c 12.98±0.50e 65.55±1.05cd 4.06±0.11b -N/NO3− 56.86±0.25b 31.68±0.31a 88.54±0.21a 1.8±0.02de NH4+ 42.62±0.65de 9.78±0.30f 52.4±0.94e 4.36±0.07b -N/NH4+ 44.55±0.35d 24.44±0.22c 68.99±0.57b 1.82±0.01de ‘SC205’ NO3− 51.7±0.28c 15.3±0.09d 66.99±0.28bc 3.38±0.03c -N/NO3− 41.31±0.23e 25.37±0.30c 66.68±0.42bc 1.63±0.02e NH4+ 52.9±0.36c 10.58±0.52f 63.48±0.57d 5.02±0.27a -N/NH4+ 59.79±2.05a 29.43±0.36b 89.22±1.72a 2.03±0.09d 对同一木薯种质通过2种氮形态异质分根处理后,‘SC16’经-N/NO3−处理后各组织氮含量要显著高于-N/ NH4+异质分根处理,但‘SC16’转运系数没有显著差异;而‘SC205’虽然在-N/NO3−分根处理后各组织氮含量低于-N/NH4+分根处理,但根系截留氮的能力却得以增强。
同一氮素分根处理对不同品种的影响,‘SC16’在-N/NO3−分根处理下,各组织(地上部、根、全株)氮含量显著高于‘SC205’;‘SC16’在-N/NH4+分根处理后,地上部和总氮含量要显著低于‘SC205’,说明‘SC16’和‘SC205’对2种氮素分根处理后的响应方式不同。
-
以氮生理利用效率表征植株对已累积氮的利用能力,也就是植物体内每单位氮累积量下所产生的干物质量。如表3所示,从中可以看出,2种形态氮素的异质分根均会显著促进木薯根部氮生理利用效率,相比NO3−均质处理,-N/NO3−异质处理后‘SC16’地下部分NPUE(氮生理利用效率)增加100%,‘SC205’增加了140%;相比NH4+均质处理,-N/ NH4+异质处理后‘SC16’和‘SC205’地下部NPUE分别增加了60%和46%(P<0.05),该结果也说明,2种氮素异质减氮分根处理能够显著促进木薯根部氮生理利用效率。尽管‘SC16’在-N/NH4+处理时,根氮生理效率最高,但减氮异质分根处理时,根系一侧存在硝酸盐时更能促进木薯根部氮素转化为干物质的能力。同样,相比-N/NH4+异质处理,‘SC205’ -N/NO3−异质处理后,氮素转化为干物质能力大幅度提升,同时全株及各组织部位氮生理利用效率最为显著。总之,当木薯根系感知氮胁迫信号时,不同品种对不同氮源作出不同的调整,异质分根处理时一侧根系为硝酸盐时,地下部氮的生理效率会得到极大提升。
表 3 分根培养下2种形态氮素对不同品种木薯氮生理利用效率(NPUE)间的影响
品种
氮形态 氮生理利用效率/% 地上部 根 全株 ‘SC16’ NO3− 31.04±0.22e 77.27±2.88f 40.73±0.54b -N/NO3− 28.08±0.07f 151.85±2.42b 32.16±0.05d NH4+ 35.07±0.58c 102.49±3.17d 44.54±0.83a -N/NH4+ 38.4±0.37a 163.75±1.54a 44.41±0.39a ‘SC205’ NO3− 31.03±0.32e 65.37±0.38e 36.52±0.3c -N/NO3− 37.5±0.47ab 157.77±1.87ab 44.21±0.47a NH4+ 35.91±0.39bc 94.95±4.87d 43.26±0.51a -N/NH4+ 33.35±1.19d 139.33±2.64c 36.65±1.15c -
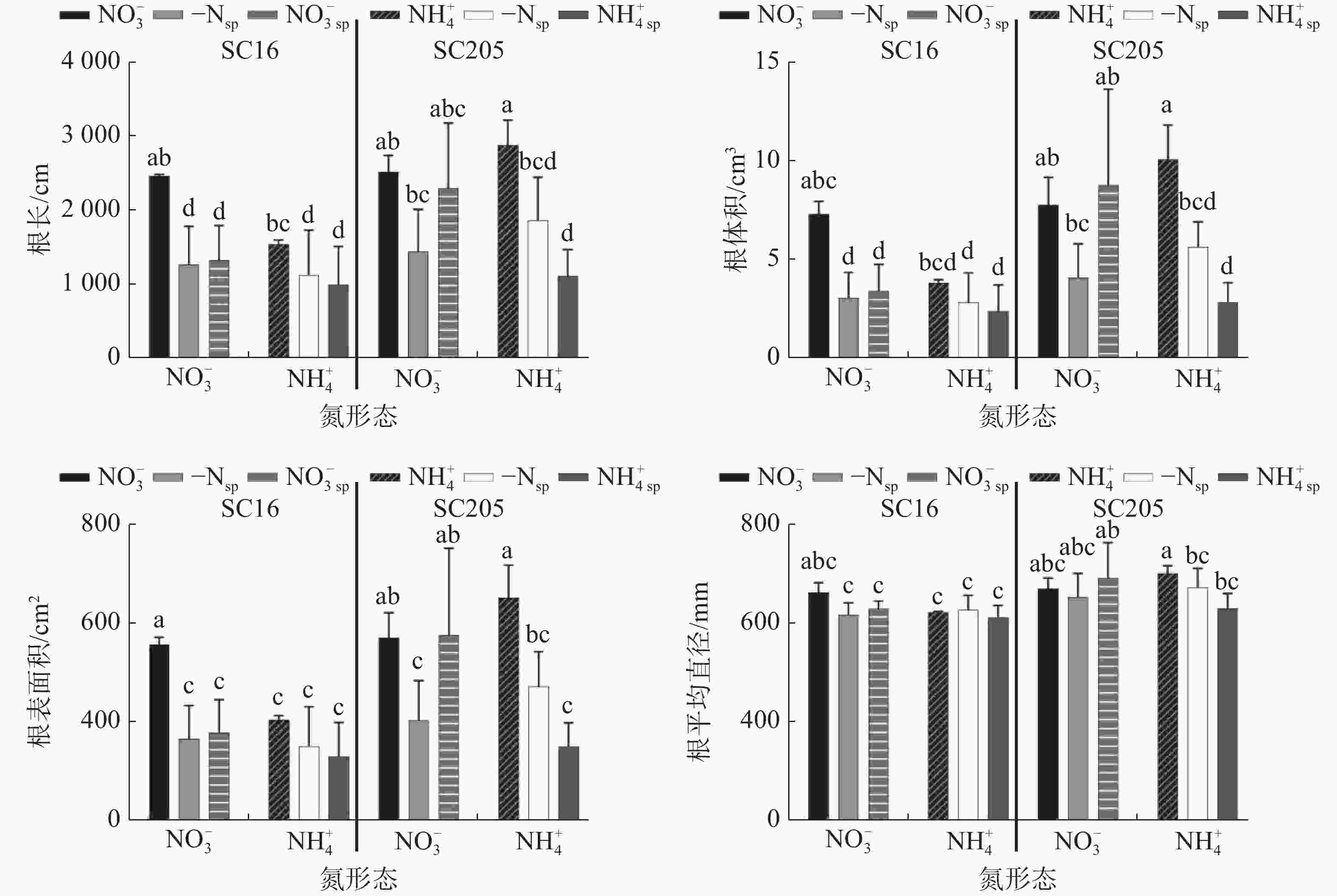
由图5可知,相较于NO3−均质的处理,-N/NO3−异质处理下‘SC16’两侧根系总根长、根面积、根体积均显著下降(P<0.05),‘SC205’均差异不显著。此外在-N/NO3−异质处理下,‘SC16’和‘SC205’(NO3−SP)硝根侧根系比(-NSP)无氮侧发育更好,且‘SC205’中差异更为显著(P<0.05)。相比NH4+均质处理,-N/ NH4+异质处理后‘SC16’两侧根形态无显著差异,而‘SC205’显著降低(P<0.05)。-N/ NH4+组中,2个木薯品种无氮侧(-NSP)均比铵根(NH4+SP)一侧发育更好,但差异均不显著(P>0.05)。
NO3−代表了硝根均质处理,NH4+代表了铵根均质处理,-Nsp代表-N/NO3−异质组中-N侧,NO3− sp代表了-N/NO3−异质组中NO3−侧,-N/ NH4+异质组中的SP表示意思同上。
通过分析异质分根条件下‘SC16’和‘SC205’根系性状可知,‘SC205’在-N/NO3−分根处理时NO3−侧根长、根面积、根体积、根平均直径都显著高于‘SC16’(P<0.05)。同样‘SC205’ -N/ NH4+分根处理后根形态发育优于‘SC16’,但2个品种间差异不显著。该结果说明在2种氮源异质的土壤环境中,‘SC205’根系觅食能力更强。
-
前期的研究表明,-N/NO3−异质分根处理后(NO3 −为5 mmol·L−1 NaNO3−)能显著提高木薯对氮的利用效率,表现为株高和生物量的增加[7]。木薯正常生长发育所需铵盐为4 mmol·L−1[8],本试验在此浓度基础上开展研究,结果表明,与均质处理(NO3−、NH4+)相比,木薯品种‘SC16’、‘SC205’通过异质分根的方式减少1/2氮肥施用量(-N/NO3−、-N/ NH4+)后,其株高、地上部氮累积量、氮截留能力和生理利用效率显著提升,全株生物量、冠根比、氮含量及氮积累量并未降低。Leal-Ayala 等[9]采用分根技术,发现相比于NH4+全根培养,NH4+减氮异质分根处理,使得蓝莓氮素利用效率提高了一倍,产量与NH4+均质处理时相同。在对拟南芥的研究中发现,当植物的氮含量较低时,侧根的发育和伸长受植物内部硝酸盐浓度影响[10-11]。Boukcim等 [12]的研究结果表明,2种氮素的异质分根均可以显著促进雪松地下部富氮区根系的生长及地上部生物量的增加。由此推测,当木薯根系感知低氮信号时,叶片同化能力增强,地上部同化产物增多通过韧皮部传递到地下,促进根形态的建成[13]。
-
本研究发现,木薯对硝酸盐具有一定的偏好性。相比-N/NH4+异质处理,‘SC16’ 和‘SC205’进行-N/NO3−异质处理后,地上部氮积累量、根氮生理利用效率提升更为显著。韩丽丽等[14]发现,局部硝酸盐可以刺激玉米侧根伸长,局部供应相同浓度的铵均未显著促进侧根伸长。卢颖林等[15]发现番茄供NO3−侧(H2O/ NO3−)和混合营养侧(H2O/ NO3−+NH4+)根系的总长均明显长于供NH4+侧根系(H2O/ NH4+),该试验说明硝酸盐会促进根系伸长,而铵盐可能对根系伸长具有抑制作用。本研究中异质分根试验也表明,一侧无氮,一侧为硝根时,硝根侧根系长势更好;当一侧是铵盐处理时,铵根侧根系长势不佳,无氮侧根系长势良好。
此外,经 -N/ NO3−处理后,‘SC205’的生物量、氮效率(氮累积量、氮含量、氮生理利用效率)均显著高于‘SC16’,说明在苗期生长期时,‘SC205’比‘SC16’氮效率更高,在有硝酸盐的条件下,‘SC205’能够通过提升氮的吸收、转运和利用效率来实现木薯氮高效。
Ohkubo等[16]的试验结果表明,根系一侧感知氮饥饿信号时,根系会合成信号肽,小肽通过木质部传递到地上部激活氮响应基因表达并合成相应蛋白,随后蛋白通过韧皮部转运至根系,并在富硝酸盐侧根系激活高亲和力转运蛋白的表达,促进了有氮侧根系对硝酸盐的转运能力。在该机制的背景下,笔者推断由于异质分根处理使得土壤中游离的氮素被大量地吸收到根系中,从而影响根系维管组织中pH值。有研究表明,氮素的形态和存在方式决定了生长素在根维管组织中积累程度[17]。硝酸盐会导致根系碱化,而铵盐会导致根系酸化,吲哚-3-乙酸(IAA)是植物生长素的主要生理活性形式,是一种弱酸(pKa 4.75),其膜渗透性取决于 pH 值。质子化形式的 IAAH 可以通过扩散穿过细胞膜。局部铵供应导致质外体酸化并刺激生长素径向扩散到细胞外层,而 N 缺乏或局部硝酸盐供应产生中性至碱性环境允许生长素保留在维管系统中,抑制生长素径向流动,从而促进根系的伸长。最大限度地利用有限的养分资源,去应对环境的挑战。另外不排除该浓度下的铵盐是否对木薯根系有毒害作用及在一侧根系感知缺氮信号的同时,另一侧根系是否会受到铵盐信号本身的抑制,后续还需从分子水平上,进一步解析异质分根对不同品种木薯氮效率的影响。
2种氮素的分根处理对木薯幼苗生长发育和氮效率的影响
DOI: 10.15886/j.cnki.rdswxb.20230008
 CSTR: 32425.14.j.cnki.rdswxb.20230008
CSTR: 32425.14.j.cnki.rdswxb.20230008
Effects of root-split treatments with two forms of nitrogen on the growth and nitrogen use efficiency of cassava seedlings
-
摘要: 为了解氮源分根处理对木薯(Manihot esculenta)氮利用的影响,通过土培盆栽试验,以单侧加氮(-N /+N)与两侧加氮(+N/+N)的方式对2个木薯品种(‘华南16号’和‘华南205号’)根系进行分根处理,1个月后,比较‘华南16号’和‘华南205号’在不同氮源(NO3−、NH4+)下农艺性状(生物量、株高、根长等)及氮生理指标(氮含量、氮积累量、氮生理利用率)的差异。结果表明:总施氮量减少1/2(-N /+N),并不会影响冠根比及全株干物质的积累,反而会促进木薯株高的增长,同时地上部氮累积量、地下部截留氮的能力及根的氮利用效率显著增加。-N/NH4+处理后,有氮侧的根系发育受到抑制;与之相比,-N/NO3−分根处理后,有氮一侧的根形态更好,同时还提升植株地上部氮积累量、根系氮利用效率。在同氮源异质分根条件下,‘华南205号’的株高、地上和地下部生物量、氮积累量、根形态均优于‘华南16号’;-N/NO3−分根处理后,‘华南205号’地上部和地下部氮利用效率高于‘华南16号’,而在-N/NH4+分根处理后‘华南16号’的氮利用效率更高。本研究结果显示,2种氮形态的减氮分根处理均能提高2个木薯品种的氮利用效率,硝态氮异质分根处理更有利于苗期‘华南16号’、‘华南205号’的生长,后者的氮效率更高生长更旺盛。Abstract: An attempt was made to analyze the impact of a split root treatment using two forms of nitrogen on efficiency of two varieties of cassava ('SC16' and 'SC205') in using nitrogen. Cassava roots were treated unilaterally with nitrogen (-N/+N) or bilaterally with nitrogen (+N/+N), and the differences in agronomic traits (biomass, plant height, root length, etc.) and nitrogen physiological indicators (nitrogen content, nitrogen accumulation, and nitrogen physiological use efficiency) between the cassava varieties SC16 and SC205 under different nitrogen sources (NO3−, NH4+) after one month of split root treatment were compared to find out the effect of split root treatment with two N forms on nitrogen use efficiency of the two cassava varieties. The results showed that the reduced total N application to cassava by half (-N /+N) did not affect the shoot/root ratio and whole plant weight, but promoted cassava plant height and at the same time increased obviously the root nitrogen accumulation, the ratio of nitrogen to root and the nitrogen use efficiency. The root development of the cassava on the N-added side was inhibited in the -N/NH4+ treatment. Conversely, the –N/NO3− root-split treatment resulted in better root morphology on the NO3−-side, and it also increased shoot N accumulation and root N use efficiency. Under the unilateral root-split treatment with the same nitrogen source, the plant height, the biomass of shoot and root, the nitrogen accumulation of root and shoot, and root morphology of SC205 were better than those of SC16. The nitrogen use efficiency of the -N/NO3− treated SC205 was higher than that of SC16 in the shoot and root, while the nitrogen use efficiency of the -N/NH4+-treated SC205 was lower than that of SC16. All these results showed that unilateral root-split treatment with two forms of nitrogen at a half-reduced rate could improve the N use efficiency of the two varieties of cassava. The unilateral split root treatment with nitrate nitrogen was more conducive to the growth of SC16 and SC205 at the seedling stage, and SC205 under this treatment had higher nitrogen efficiency and better growth compared to SC16.
-
Key words:
- cassava /
- bilateral /
- unilateral /
- split root /
- germplasm difference /
- nitrogen use efficiency /
- phenotypic traits
-
表 1 分根培养下2种形态氮素对不同品种木薯幼苗氮积累量的影响
品种
氮形态 氮积累量/(mg·g−1) 地上部 根 全株 ‘SC16’ NO3− 101.43±0.73e 27.02±1.05b 128.45±1.74c -N/NO3− 161.49±0.41c 20.08±0.20c 181.57±0.30b NH4+ 86.73±1.44f 14.19±0.44d 100.92±1.87d -N/NH4+ 85.16±0.84f 13.71±0.12d 98.87±0.87d ‘SC205’ NO3− 147.51±1.56d 28.1±0.16b 175.61±1.44b -N/NO3− 196.80±2.44b 37.61±0.53a 234.41±2.45a NH4+ 200.79±2.19b 28.81±1.41b 229.60±2.74a -N/NH4+ 210.61±7.79a 20.97±0.33c 231.58±7.47a 注:不同小写字母代表处理存在显著性差异(P<0.05),下同。 表 2 分根培养下2种形态氮素对不同品种木薯幼苗氮含量及转运系数的影响
品种 氮形态 氮含量/% 转运系数 地上部 根 总氮 ‘SC16’ NO3− 52.58±0.56c 12.98±0.50e 65.55±1.05cd 4.06±0.11b -N/NO3− 56.86±0.25b 31.68±0.31a 88.54±0.21a 1.8±0.02de NH4+ 42.62±0.65de 9.78±0.30f 52.4±0.94e 4.36±0.07b -N/NH4+ 44.55±0.35d 24.44±0.22c 68.99±0.57b 1.82±0.01de ‘SC205’ NO3− 51.7±0.28c 15.3±0.09d 66.99±0.28bc 3.38±0.03c -N/NO3− 41.31±0.23e 25.37±0.30c 66.68±0.42bc 1.63±0.02e NH4+ 52.9±0.36c 10.58±0.52f 63.48±0.57d 5.02±0.27a -N/NH4+ 59.79±2.05a 29.43±0.36b 89.22±1.72a 2.03±0.09d 表 3 分根培养下2种形态氮素对不同品种木薯氮生理利用效率(NPUE)间的影响
品种
氮形态 氮生理利用效率/% 地上部 根 全株 ‘SC16’ NO3− 31.04±0.22e 77.27±2.88f 40.73±0.54b -N/NO3− 28.08±0.07f 151.85±2.42b 32.16±0.05d NH4+ 35.07±0.58c 102.49±3.17d 44.54±0.83a -N/NH4+ 38.4±0.37a 163.75±1.54a 44.41±0.39a ‘SC205’ NO3− 31.03±0.32e 65.37±0.38e 36.52±0.3c -N/NO3− 37.5±0.47ab 157.77±1.87ab 44.21±0.47a NH4+ 35.91±0.39bc 94.95±4.87d 43.26±0.51a -N/NH4+ 33.35±1.19d 139.33±2.64c 36.65±1.15c -
[1] 方佳, 濮文辉, 张慧坚. 国内外木薯产业发展近况[J]. 中国农学通报, 2010, 26(16): 353 − 361. [2] EL-SHARKAWY M A. Cassava biology and physiology [J]. Plant Molecular Biology, 2004, 56(4): 481 − 501. doi: 10.1007/s11103-005-2270-7 [3] 李玉静, 冯雨晴, 赵园园, 等. 不同形态氮素吸收利用及其对植物生理代谢影响的综述[J]. 中国农业科技导报, (2022-11-24)[2023-02-01]: 1-12 . DOI: 10.13304/j.nykjdb.2021.0909 [4] GRANATO T C, RAPER C D. Proliferation of maize (Zea mays L. ) roots in response to localized supply of nitrate [J]. Journal of Experimental Botany, 1989(40): 263 − 275. [5] GIEHL R F, GRUBER B D, VON WIRÉN N. It’s time to make changes: modulation of root system architecture by nutrient signals [J]. Journal of Experimental Botany, 2014, 65(3): 769 − 778. doi: 10.1093/jxb/ert421 [6] 韦云东, 周时艺, 郑华, 等. 化肥减施对土壤肥力、木薯产量及种植效益的影响[J]. 农业研究与应用, 2021, 34(3): 9 − 15. doi: 10.3969/j.issn.2095-0764.2021.03.002 [7] 黄晋霞, 赵金铃, 王修宁, 等. 分根处理促进木薯氮的高效利用[J]. 分子植物育种, (2022-05-31)[2023-02-01]. http://kns.cnki.net/Kcs/detail/46.1068.S.20220530.1921.012.html. [8] 肖急祥, 曾长英, 彭明. 低氮条件下木薯谷氨酰胺合成酶(GS)酶活及GS家族基因表达分析[J]. 分子植物育种, 2016, 14(1): 21 − 25. doi: 10.13271/j.mpb.014.000021 [9] LEAL-AYALA O G, SANDOVAL-VILLA M, TREJO-TLLEZ L I, et al. Nitrogen form and root division modifies the nutrimental and biomolecules concentration in blueberry (Vaccinium corymbosum L.) [J]. Notulae Botanicae Horti Agrobotanici Cluj-Napoca, 2021, 49(1): 11998. doi: 10.15835/nbha49111998 [10] ZHANG H, JENNINGS A, BARLOW P W, et al. Dual pathways for regulation of root branching by nitrate [J]. Proc Natl Acad Sci U S A, 1999(11): 6529 − 6534. [11] WANG W, HU B, LI A. et al. NRT1.1s in plants: functions beyond nitrate transport [J]. Journal of Experimental Botany, 2020, 71(15): 4373 − 4379. doi: 10.1093/jxb/erz554 [12] BOUKCIM H, PAGÈS L, MOUSAIN D. Local NO3− or NH4+ supply modifies the root system architecture of Cedrus atlantica seedlings grown in a split-root device [J]. Journal of Plant Physiology, 2006, 163(12): 1293 − 1304. doi: 10.1016/j.jplph.2005.08.011 [13] SATTELMACHER B, GERENDA S J, THOM S K, et al. Interaction between root growth and mineral nutrition [J]. Environmental and Experimental Botany, 1993, 33(1): 63 − 73. doi: 10.1016/0098-8472(93)90056-L [14] 韩丽丽, 陈范骏, 吴冬梅, 等. 不同pH下局部供应硝酸盐和铵对玉米侧根生长的影响[J]. 玉米科学, 2009, 17(1): 99 − 101. doi: 10.13597/j.cnki.maize.science.2009.01.027 [15] 卢颖林, 李庆余, 徐新娟, 等. 全根和分根培养条件下番茄幼苗对不同形态氮素的响应[J]. 南京农业大学学报, 2010, 33(6): 43 − 49. [16] OHKUBO Y, TANAKA M, TABATA R, et al. Shoot-to-root mobile polypeptides involved in systemic regulation of nitrogen acquisition [J]. Nature Plants, 2017, 3(4): 17029. doi: 10.1038/nplants.2017.29 [17] MEIER M, LIU Y, LAY-PRUITT K S, et al. Auxin-mediated root branching is determined by the form of available nitrogen [J]. Nature Plants, 2020(6): 1136 − 1145. -





 下载:
下载: