-
我国是天然橡胶消费大国。天然橡胶90%以上的产量都是产自于橡胶树(Hevea brasiliensis)。该树是重要的经济作物,在我国云南、广东和海南均有大面积种植,在东南亚和南美等地区也广泛种植。在全球的植胶区,白粉病是危害橡胶树较严重的一个病害[1]。橡胶树白粉菌(Erysiphe quercicola)是橡胶树白粉病的病原物,在分类上属于子囊菌门白粉菌目(Erysiphes),白粉病发病初期在幼嫩组织以及叶表面会产生由菌丝产生的白色粉状物,粉状物下的叶片会有病斑出现。发病严重时会导致橡胶树的花序和叶片畸形,叶片大量脱落[2]。每年橡胶树白粉病都造成天然橡胶严重的损失[3]。对植物免疫系统的研究有助于人类利用该机制来对抗植物病害。植物免疫系统产生的防卫反应包括活性氧水平提高、胼胝质积累和超敏反应(一种植物组织上局部发生的细胞程序性死亡)等。这些防卫反应可被植物识别到病原相关分子模式(Pathogen-associated molecular patterns, PAMPs)或病原效应子(effectors)而激发。目前,可激发植物防卫反应的病原因子有细菌鞭毛蛋白的flg22(flagellin domain of a synthetic 22-amino-acid peptide)、几丁质(chitin)和卵菌激发素INF1等[4]。蛋白MLO(Mildew resistance locus o)在大麦(Hordeum vulgare)上被用作对抗白粉菌等子囊菌侵染的武器[5]。MLO基因被缺失突变后,大麦获得了广谱的白粉菌抗性,表明MLO是一类感病蛋白[5]。BI-1(BAX INHIBITOR-1)和LFG(LIFEGUARD)也被认为属于感病蛋白,具有类似MLO的作用。敲除突变BI-1基因抑制了白粉菌的侵染,而过表达BI-1能加速侵染[6]。在哺乳动物和植物中,LFG蛋白也被称为GAAP蛋白(Golgi antiapoptotic proteins),属于BI-1蛋白亚家族,含有BI-1蛋白功能域。大麦和拟南芥(Arabidopsis thaliana)中各含有5个LFG。已证明大麦的LFG蛋白HvLFGa和拟南芥的2个LFG蛋白AtLFG1和AtLFG2都参与了影响植物和白粉菌的互作,具有负调控植物抗白粉病的作用[7]。对于这些LFG蛋白编码基因,过表达会促进白粉菌侵染,而沉默会抑制白粉菌侵染。BI-1具有抗细胞凋亡活性,而LFG和BI-1之间可能发生互作,具有协同抗凋亡活性[8]。AtLBI-1和AtLFG2在拟南芥中可发生共表达[7],为此可以推测BI-1和LFG蛋白可能共同调节细胞死亡信号通路。
在橡胶树中,前期已通过生物信息学方法,鉴定了2个LFG,包括HbLFG1和HbLFG2[9]。这2个LFG蛋白编码基因HbLFG1和HbLFG2的转录水平在白粉菌侵染前期发生明显上调,尤其HbLFG1上调更显著,并且这2个LFG基因转录水平与病害发生程度呈正相关。在本氏烟草(Nicotiana benthamiana)表达HbLFG1可抑制疫霉激发子INF1和内质网胁迫药剂DTT、TM诱导细胞坏死,但不能像BI-1一样抑制细胞坏死诱导蛋白(Bax)诱导的细胞坏死[10]。在拟南芥Col-0表达HbLFG1可抑制几丁质(chitin)和细菌flg22诱导的植物免疫反应,并促进橡胶树白粉菌侵染拟南芥Col-0,而野生型的Col-0是不能被该菌侵染的[10]。以上结果表明,HbLFG1在橡胶树中是潜在的感病蛋白,影响了植物免疫的激发水平,但是,目前对HbLFG2仍缺乏研究和了解。
本研究利用本氏烟瞬时转染和拟南芥转化系统,探究HbLFG2在植物免疫中的作用,以增加对感病蛋白影响橡胶树白粉病抗性的认识,进一步了解橡胶树LFG蛋白调控的植物免疫机制,为橡胶树的抗白粉病育种和白粉病新农药研发靶点提供理论基础。
-
实验使用大肠杆菌(Escherichia coli)DH5α来进行实验载体的构建,使用根癌农杆菌(Agrobacterium tumefaciens)GV3101作为转化介导体。载体pCAMBIA-35S-FLAG,携带INF1基因、Bax基因、pBIN空载体(可表达GFP基因)的根癌农杆菌均由笔者所在的实验室提供;含pBIN空载体的拟南芥转化子为实验室原有植物材料。
-
实验中的植物为本氏烟草和Col-0野生型拟南芥。植物养育条件:温度24 ℃,光照16 h/黑暗8 h。
-
限制性内切酶 BamHI(南京,Vazyme); DNA片段回收试剂盒(上海,TaKaRa);质粒小量提取试剂盒(美国,Omega);RNA提取试剂盒(北京,Solarbio)。
-
LB培养基:Tryptone 10 g·L−1、Yeast extract 5 g·L−1、NaCl 10 g·L−1,调pH为7(制备固体培养基需要另外加入Agar 15 g·L−1)。0.5 g庆大霉素硫酸盐,5 mL去离子水(已除菌),振荡混匀制成庆大霉素溶液,将该溶液进行过滤除菌,储存于−20 ℃。0.25 g卡那霉素,5 mL去离子水(已除菌),振荡混匀制成卡那霉素溶液,将该溶液进行过滤除菌,储存于−20 ℃。0.5 g利福平,5 mL DMSO(二甲基亚砜),振荡混匀制成利福平溶液,将该溶液进行过滤除菌,遮光,储存于−20 ℃中。拟南芥转化悬浮液:蔗糖2.5 g、Silwet L-77 12.5 mL、ddH20 50 mL。脱色液:3∶1体积比例的无水乙醇和冰醋酸混液。苯胺蓝染色液:0.1 g水溶性苯胺蓝、0.1 mol·L−1 K2HPO4 10 mL。DAB染液:吐温−20 25 mL、NaHPO4 0.2 g、ddH2O 50 mL、DAB(diaminobezidin-3,3-二氨基联苯胺) 0.05 g。20×10−6 mol·L−1 flg22:0.000 45 g flg22、10 mL ddH2O。
-
以橡胶树总RNA为模板,用反转录试剂盒进行反转录合成橡胶树的cDNA序列,并以此为模板,用引物对cDNA进行HbLFG2基因PCR扩增。反应程序:95 ℃预变性5 min,95 ℃变性30 , 56 ℃退火30 s,72 ℃延伸40 s(30个循环),4 ℃,冷却10 min。将PCR扩增得到的DNA片段进行试剂盒回收,随后,用BamHI将载体pCAMBIA-35S-FLAG切开,再将片段和切开的载体进行连接。37 ℃反应30 min,再将连接好的质粒进行大肠杆菌质粒转化,涂板点板验证菌落。最后用相同的引物对菌落进行PCR扩增和琼脂糖凝胶电泳来验证是否转化成功。同理,使用同样的方法,将烟草坏死实验对照基因HbLFG1进行克隆和载体构建。本实验所用的引物见表1。
表 1 本实验所用引物
引物名称 引物序列(5′−3′) GFP-F/R F ATGGTGAGCAAGGGCGAGGAG
R TCAAAGATCTACCATGTACAGCTCGTAtAct2-F/R F ACTACGAGCAGGAGATGGAA;
R TTAATCTTCATGCTGCTTGGHbLFG2-FLAG-F/R F: gctcggtacccggggatcc-ATGTGGGGTCAGCCGTACAG;
R: atagtcgtcgactctagagg-GGTATCAGCAGCCCTGAAGAHbLFG1-FLAG-F/R F: gctcggtacccggggatcc-ATGTGGGGCCAACCGTACCG;
R: atagtcgtcgactctagagg-GCTATCAGCAGCCCTGAAGAC -
将含有HbLFG2-FLAG质粒的大肠杆菌进行扩增培养,用试剂盒提取质粒,进行GV3101农杆菌转化,得到含有HbLFG2-FLAG质粒的农杆菌。把庆大霉素、卡那霉素、利福平这3种抗生素加到用于培养农杆菌的液体LB培养基中,备用。将含有目的基因的农杆菌,加入5 mL 的含3种抗生素的 LB 培养基进行扩增,将扩增的菌液转到2 mL离心管中,4 700 r·min−1离心2 min,弃上清,用移 液枪取2 mL 0.01 mol·L−1氯化镁对农杆菌进行吸打悬浮,4 700 r·min−1离心2 min,保留菌块。再次悬浮农杆菌,稀释菌液到OD600=0.6。向本氏烟的 叶片中注射稀释后的农杆菌缓冲液,标记注射区域,遮光处理48 h,随后进行蛋白表达验证或进行形态观察[10]。
-
将含有目的基因的农杆菌注射到烟草叶片上之后,用马克笔对注射区域进行标记。遮光过后,剪下标记区域进行蛋白提取。将剪下的叶片组织用液氮进行研磨。研磨成粉后,加入到含有植物裂解液的1.5 mL离心管中,在30 min内对样品进行多次振荡混匀,随后4 ℃,11 000 r·min−1离心5 min,将上清收集到新的离心管中,再次低温离心,然后再次收集上清。将100 μL的植物蛋白上清加入蛋白上样液20 μL,100 ℃处理10 min,此时的蛋白样品可以进行SDS-PAGE凝胶电泳。将处理好的蛋白样加入到SDS-PAGE凝胶电泳的胶孔中,电泳完成后切下蛋白胶,蛋白胶经过转膜后,获得含有目的蛋白条带的PVDF膜。然后对该膜依次进行封闭牛奶,一抗,二抗处理。处理完成后用扫膜仪器进行扫描,观察扫膜结果。
-
将含有目的基因的农杆菌保菌液加到含3种抗性的LB培养基扩增。4 700 r·min−1离心10 min富集菌体。将富集好的菌体使用转化悬浮液重悬,并稀释到OD600=0.8。4周龄的拟南芥需要将果荚去除干净,再将花浸泡在菌悬液处理20 s~30 s,随后进行保湿遮光处理24 h。直至培养处理过的拟南芥长出叶片,待苗长出叶片后提取RNA,通过RT-PCR得到cDNA,再用引物进行转化子的PCR验证,标记PCR验证结果为阳性的拟南芥转化子植株。对转化成功的拟南芥进行标记,等到其果荚成熟,获得拟南芥转化子T1代的种子。再将收集到的种子催化成苗,待苗长出叶片后提取RNA,再次进行引物验证,并对验证得到的拟南芥做标记,收集果荚成熟后的种子T2代。此时的拟南芥转化子种子经过了2代的筛选,能稳定遗传,可以开展相关实验[10]。
-
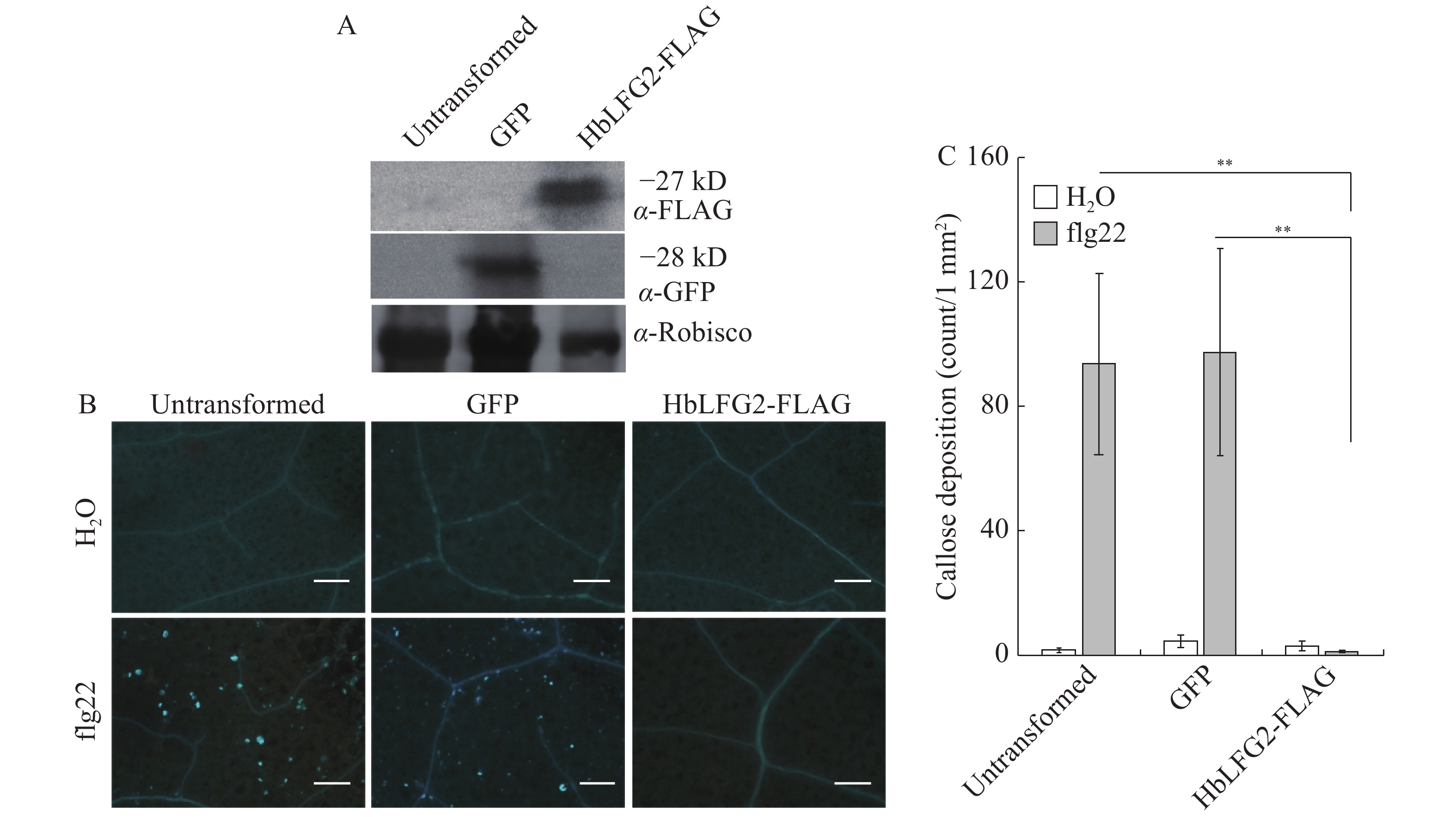
苯胺蓝荧光染料可标记病原菌PAMPs诱导而积累的胼胝质,使其在植物中能被清晰地观察到。在本氏烟的实验中,注射pbin-GFP、HbLFG2-FLAG农杆菌于叶片,标记好区域,遮光处理24 h,然后用20×10−6 mol·L−1flg22处理叶片。flg22处理叶片36 h后,先用脱色液对对照及处理的叶片进行8 h脱色,接着用苯胺蓝溶液染色8 h染色。把染好色的叶片放在荧光显微镜(OLYMPUS CX21,发射波长:461 nm)下观察,选择DAPI滤光片拍照。照片用 ImageJ软件来测定胼胝质积累量。每个处理使用至少3片叶,并从每个叶片上随机选取3个区域进行拍照,统计照片中每1 mm2面积胼胝质累积个数。在拟南芥的实验中,先用20×10−6 mol·L−1flg22处理4周龄的拟南芥植株叶片36 h[10],然后用乙醇乙酸脱色液对拟南芥叶片进行脱色,再将拟南芥叶片放入苯胺蓝溶液中进行8 h染色。荧光显微镜下观察,选择DAPI滤光片,拍照[11-12]。最后用ImageJ软件测定胼胝质累积量。每个处理使用至少3片叶,并从每个叶片上随机选取3个区域进行拍照,统计照片中1 mm2面积胼胝质累积个数。
-
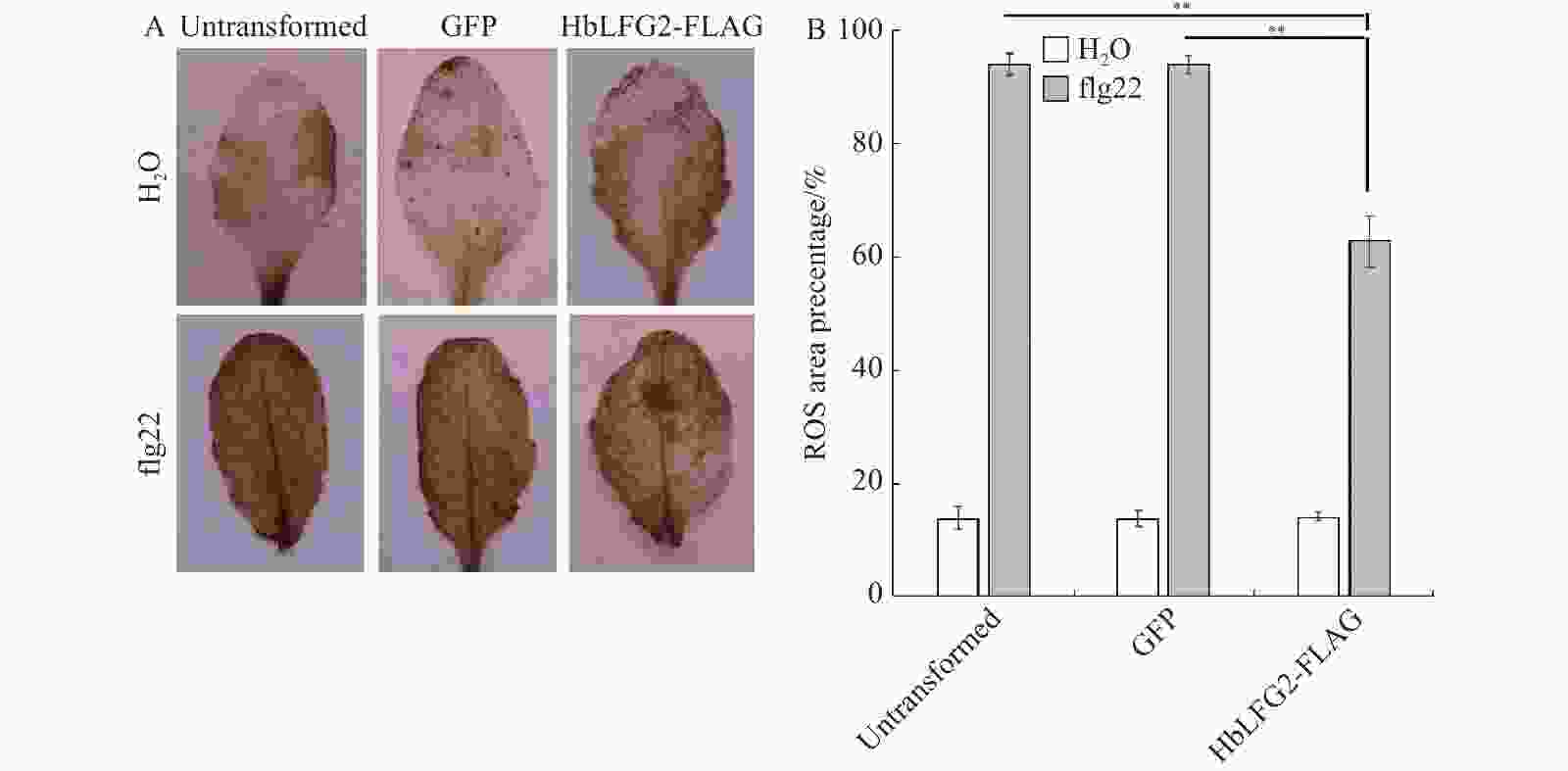
DAB能与叶片中含有的过氧化氢反应,表现为棕色,观察到的棕色小块即积累的活性氧。用水和20×10−6 mol·L−1flg22分别处理Col-0野生型拟南芥、GFP拟南芥转化子和HbLFG2拟南芥转化子的叶片表面36 h,2 d后取下叶片放于DAB溶液中避光处理10 h进行染色。配置乙醇乙酸脱色液,常温脱色2 h,再对样品进行拍照,用ImageJ 软件计算照片中活性氧积累面积。样本重复叶片数为9,统计照片中每片叶子活性氧面积占比。
-
对4周龄的本氏烟叶片的表皮用注射器针头划出小伤后,用去除针头的注射器在叶片伤口处注入农杆菌稀释液或者药液,遮光处理24~72 h,观察叶片坏死情况并进行明场和紫外光下拍照。药物DTT的共注射处理是在注射完农杆菌48 h后进行药剂注射[10]。
-
western blot结果显示,HbLFG2,GFP蛋白在烟草上均有表达(图1-A)。之后,为测定HbLFG2是否能影响flg22诱导的植物免疫。用水和flg22分别处理空白对照烟草组织、表达绿色荧光蛋白(GFP)的组织和表达HbLFG2-FLAG的烟草组织。水处理组为阴性对照;flg22处理空白对照烟草组织和表达GFP的组织为阳性对照。结果(图1-B,1-C)显示,在阳性对照的叶片组织中出现大量的胼胝质积累,而HbLFG2-FLAG表达能显著降低本氏烟上胼胝质积累量。说明HbLFG2能抑制烟草中flg22诱导的胼胝质产生。
-
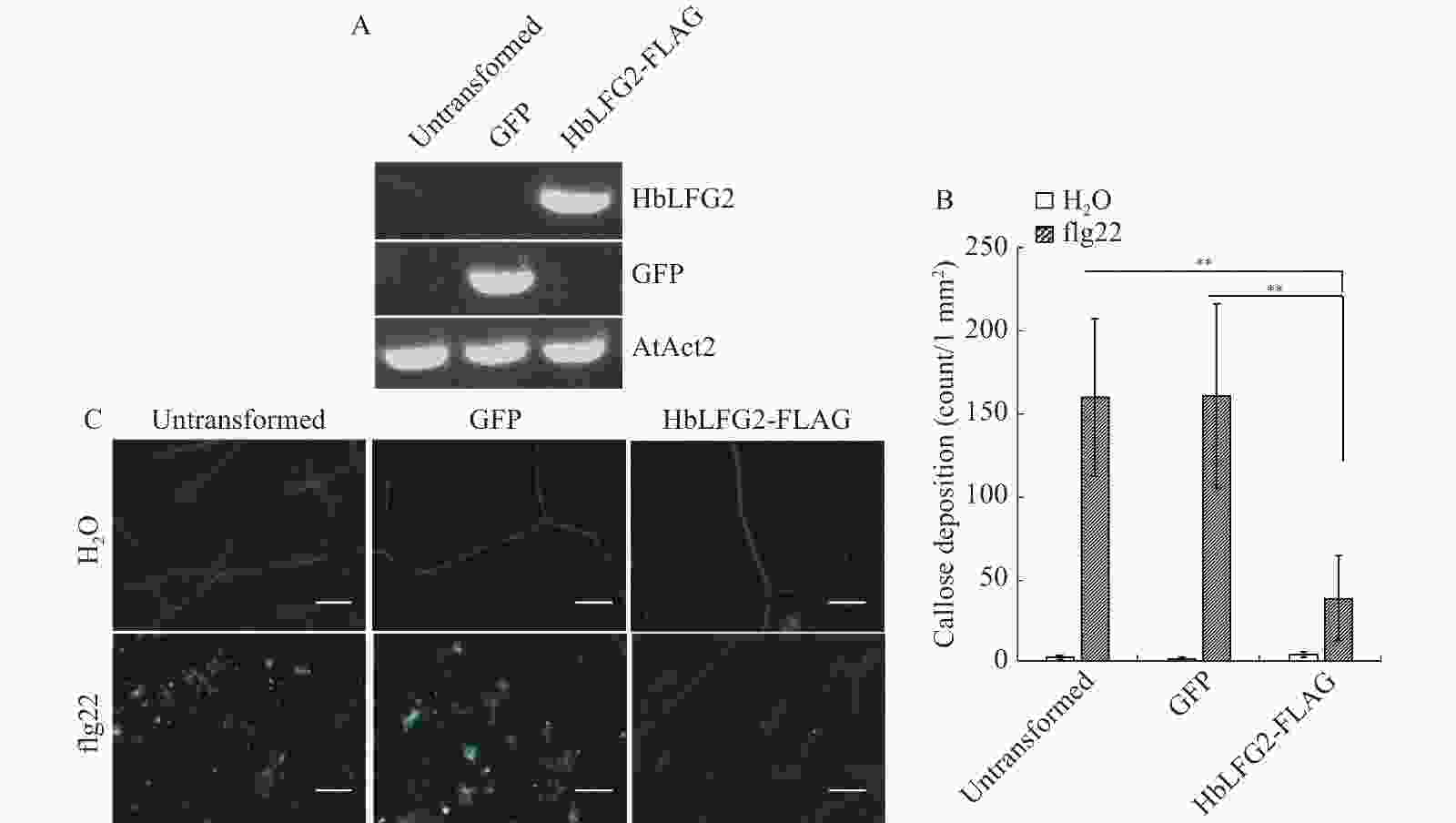
图2-A的结果显示HbLFG2拟南芥转化子T2代的基因组中存在HbLFG2,说明HbLFG2拟南芥转化子制备成功。对野生型拟南芥、GFP拟南芥转化子、HbLFG2-FLAG拟南芥转化子进行水处理为阴性对照。flg22处理下,阳性对照Col-0拟南芥和GFP拟南芥转化子的叶片激发出了大量胼胝质。在flg22处理下的HbLFG2-FLAG拟南芥转化子叶片中则只有少量的胼胝质积累(图2-B)。在flg22处理下的胼胝质积累量(图2-C)表明,HbLFG2-FLAG拟南芥转化子与Col-0拟南芥、GFP拟南芥转化子存在显著差异。这表明HbLFG2可抑制拟南芥中激发的胼胝质产生。
-
对Col-0野生型拟南芥、GFP拟南芥转化子和验证过的HbLFG2转化子进行水处理为对照。经过活性氧染色可知,作为阴性对照的水处理,该处理下的野生型拟南芥、GFP转化子和HbLFG2转化子叶片有少量的活性氧积累。作为阳性对照的flg22处理下的未经过转化的拟南芥和GFP转化子叶片,有大面积的活性氧被激发,而flg22处理下,HbLFG2转化子活性氧积累面积与前两者相比较小(图3-A)。由统计数据可知,在flg22处理组中,野生型拟南芥和GFP转化子活性氧积累面积占比情况,与HbLFG2-FLAG转化子相比存在显著差异,这表明HbLFG2减弱了拟南芥中flg22诱导产生的活性氧积累(图3-B)。
-
疫霉激发素INF1,细胞坏死诱导蛋白Bax和内质网胁迫剂DTT能在植物上造成细胞程序性死亡[13-15]。在本氏烟草上,测试HbLFG2对这些因子诱导的细胞死亡是否具有抑制作用。
对HbLFG1,HbLFG2,GFP蛋白进行western blot表达验证,发现HbLFG1,HbLFG2,GFP蛋白在烟草上发生了表达(图4-A)。作为单独注射对照,在烟草叶片上单独注射表达INF1,Bax基因的农杆菌位点以及药物DTT均发生了坏死,单独注射表达GFP,HbLFG1,HbLFG2基因的农杆菌位点没有发生坏死,说明对照处理正常(图4-B,表2)。
表 2 坏死发生情况统计
处理 坏死叶片数 总处理注射位点数 INF1 12 12 Bax 12 12 DTT 12 12 GFP 0 12 HbLFG2-FLAG 0 12 HbLFG1--FLAG 0 12 GFP + INF1 12 12 HbLFG1-FLAG + INF1 2 12 HbLFG2-FLAG + INF1 10 12 GFP + Bax 12 12 HbLFG1-FLAG + Bax 10 12 HbLFG2-FLAG + Bax 2 12 GFP + DTT 12 12 HbLFG1-FLAG + DTT 1 12 HbLFG2-FLAG + DTT 12 12 注:总处理注射位点数是指对应处理下的叶片总数。 在INF1的共注射实验中,作为INF1的共注射对照,将含有GFP基因的农杆菌与含INF1基因的农杆菌共注射,注射位点均坏死,这说明载体并不会影响INF1诱导的细胞坏死;INF1与HbLFG1基因共表达时,发现HbLFG1能够抑制INF1导致的细胞坏死,这与Li等[10]的报道结果相同。而HbLFG2与INF1基因共表达则不能抑制INF1诱导的细胞坏死(图4-B,表2)。
在Bax的共注射实验中,作为Bax的共注射对照,将含有空载pBIN载体的农杆菌与含Bax基因的农杆菌共注射,注射位点均坏死,说明载体并不会影响Bax诱导的细胞坏死;Bax与HbLFG1基因共表达时,发现HbLFG1不能够抑制Bax导致的细胞坏死,与Li等[10]的报道结果一致;但HbLFG2与Bax基因共表达,细胞坏死受到抑制(图4-B,表2)。
在药物DTT的共注射实验中,作为DTT的共注射对照,将含有空载pBIN载体的农杆菌间隔48 h后与药物DTT共注射,注射位点均坏死,说明载体并不会影响DTT诱导的细胞坏死;DTT与HbLFG1基因共表达时,发现HbLFG1可以抑制DTT导致的细胞坏死这与Li等[10]的报道结果相吻合;但HbLFG2与药物DTT共注射的位点坏死不受抑制(图4-B,表2)。
-
橡胶树中存在2个预测的LFG蛋白HbLFG1和HbLFG2,2021年文献[10]报道,HbLFG1在本氏烟草和拟南芥的表达可以抑制植物的防卫反应和内质网胁迫引起的细胞死亡。在本研究中,HbLFG2表现出具有类似HbLFG1的功能,可以抑制植物的防卫反应,因此该蛋白可能促进植物的感病性,是潜在的感病蛋白。
类似HbLFG1[10],在烟草或拟南芥中过表达HbLFG2可以抑制flg22激发的胼胝质,减少了活性氧的产生。植物感知flg22的是激酶类受体FLS2和BAK1[16],并且flg22可以诱导植物中免疫信号分子水杨酸的积累[17],胼胝质的积累发生在细胞壁,水杨酸能够进一步诱导胼胝质的积累并增强活性氧爆发[12,18]。而拟南芥LFG/GAAP蛋白在内质网胁迫条件下可以抑制水杨酸产生[18],植物BI-1也能抑制水杨酸诱导的细胞坏死[19]。据此,笔者推测HbLFG2或HbLFG1蛋白的积累可能干扰了flg22诱导的水杨酸途径,从而产生抑制防卫反应的效果。
在植物中,Bax、DTT和INF1造成细胞坏死的原因不完全相同。Bax能引起活性氧积累,进一步引起细胞离子渗漏、细胞色素c释放和脂质氧化反应[19],DTT会造成过度的内质网胁迫[20],而INF1会激活丝裂原蛋白激酶通路和诱导活性氧迸发[21]。植物BI-1可能主要通过降低改变细胞钙离子流、抑制细胞色素c的释放和脂质氧化反应来抑制细胞坏死[19]。植物BI-1定位于内质网,因此,还可能通过降低对内质网胁迫的敏感度来干扰Bax诱导的细胞坏死,鉴于细胞会在内质网胁迫条件下启动自动死亡程序[22-23]。类似的,拟南芥LFG蛋白LFG1/GAAP1和LFG3/GAAP3也定位在内质网等细胞器,可以在内质网胁迫条件下抑制细胞坏死[23],而且拟南芥LFG通过与内质网受体IRE1互作,负调控IRE1途径来影响对内质网胁迫的敏感度,借此发挥调节细胞坏死的作用[24]。
本研究发现HbLFG2可以抑制Bax诱导的细胞坏死,但不能抑制DTT和INF1诱导的细胞坏死。相比之下,HbLFG1不能抑制Bax诱导的细胞坏死,却能抑制DTT和INF1诱导的细胞坏死。这些结果表明2个橡胶树LFG蛋白虽然都具有抑制植物细胞坏死的功能,但二者作用的方式不太相同。二者在功能上可能互相补充,共同调节植物免疫。
Rubber tree LFG protein HbLFG2 negatively regulates plant immunity responses
-
摘要: 为探究HbLFG2基因对免疫反应的功能,增强感病蛋白对橡胶树白粉菌( Erysiphe quercicola )抗性影响的认识,以进一步了解橡胶树( Hevea brasiliensis )LFG(LIFEGUARD)蛋白调控的植物免疫机制,将含有HbLFG2基因的质粒转化到农杆菌中,利用农杆菌分别在烟草和拟南芥中进行瞬时转染和永久转染。结果表明,在拟南芥(Arabidopsis thaliana)和本氏烟草( Nicotiana benthamiana)上组成型表达HbLFG2抑制了细菌flg22(flagellin domain of a synthetic 22-amino-acid peptide)诱导的活性氧迸发和胼胝质积累等免疫反应,作用类似HbLFG1基因。但与HbLFG1不同的是,HbLFG2不能抑制疫霉激发子INF1和药物DTT (dithiothreitol)激发的过敏性反应,却能抑制细胞坏死诱导蛋白(Bax)激发的过敏性反应。综上,基因HbLFG1和HbLFG2都具有负调控植物免疫防卫反应的功能,但两者作用的机理不完全一致。Abstract: The rubber tree (Hevea brasiliensis) infected with powdery mildew fungus Erysiphe quercicola will have a significant loss in natural rubber yield. Previous studies suggest that LFG proteins confer susceptibility to plants, and that the mutations on LFGs can inhibit invasions of powdery mildew fungi in barley (Hordeum vulgare) and Arabidopsis thaliana. In H. brasiliensis, gene expressions of two putative LFG proteins including HbLFG1 and HbLFG2 respond to the pathogenic development of the powdery mildew. HbLFG1 negatively regulates plant immunity. However, the function of HbLFG2 was not known. In this context the function of HbLFG2 in plant immunity was investigated by using Agrobacterium mediated transformation in A. thaliana and Nicotiana tabacum. The results showed that constitutive expressions of HbLFG2 in A. thaliana and N. benthamiana inhibited reactive oxygen burst and callose deposition induced by bacteria flg22 (flagellin domain of a synthetic 22-amino-acid peptide). This function of HbLFG2 was similar to that of HbLFG1. Moreover, HbLFG2 could not inhibit the hypersensitive response induced by phytophthora elicitor INF1 or DTT (Dithiothreitol) but by Bax. It was different from HbLFG1. These results suggest that both HbLFG1 and HbLFG2 can inhibit plant immunity responses, but have different mechanisms for their functions.
-
Key words:
- Hevea brasiliensis /
- powdery mildew /
- plant immunity system /
- LFG proteins
-
表 1 本实验所用引物
引物名称 引物序列(5′−3′) GFP-F/R F ATGGTGAGCAAGGGCGAGGAG
R TCAAAGATCTACCATGTACAGCTCGTAtAct2-F/R F ACTACGAGCAGGAGATGGAA;
R TTAATCTTCATGCTGCTTGGHbLFG2-FLAG-F/R F: gctcggtacccggggatcc-ATGTGGGGTCAGCCGTACAG;
R: atagtcgtcgactctagagg-GGTATCAGCAGCCCTGAAGAHbLFG1-FLAG-F/R F: gctcggtacccggggatcc-ATGTGGGGCCAACCGTACCG;
R: atagtcgtcgactctagagg-GCTATCAGCAGCCCTGAAGAC表 2 坏死发生情况统计
处理 坏死叶片数 总处理注射位点数 INF1 12 12 Bax 12 12 DTT 12 12 GFP 0 12 HbLFG2-FLAG 0 12 HbLFG1--FLAG 0 12 GFP + INF1 12 12 HbLFG1-FLAG + INF1 2 12 HbLFG2-FLAG + INF1 10 12 GFP + Bax 12 12 HbLFG1-FLAG + Bax 10 12 HbLFG2-FLAG + Bax 2 12 GFP + DTT 12 12 HbLFG1-FLAG + DTT 1 12 HbLFG2-FLAG + DTT 12 12 注:总处理注射位点数是指对应处理下的叶片总数。 -
[1] 张宇, 王萌, 杨叶, 等. 防治橡胶树白粉病15%乙嘧酚磺酸酯热雾剂的研制[J]. 中国热带农业, 2011(4): 45 − 47. doi: 10.3969/j.issn.1673-0658.2011.04.019 [2] WU H, PAN Y, DI R, et al. Molecular identification of the powdery mildew fungus infecting rubber trees in China [J]. Forest Pathology, 2019, 49(5): e12519. doi: 10.1111/efp.12519 [3] 郑服丛. 我国橡胶植保科技的现状与展望[J]. 中国热带农业, 2011(4): 37 − 40. doi: 10.3969/j.issn.1673-0658.2011.04.016 [4] SAIJO Y, LOO E P I, YASUDA S. Pattern recognition receptors and signaling in plant-microbe interactions [J]. The Plant Journal, 2018, 93(4): 592 − 613. doi: 10.1111/tpj.13808 [5] KUSCH S, PANSTRUGA R. mlo-based resistance: an apparently universal "weapon" to defeat powdery mildew disease [J]. Molecular Plant-Microbe Interactions®, 2017, 30(3): 179 − 189. doi: 10.1094/MPMI-12-16-0255-CR [6] EICHMANN R, DECHERT C, KOGEL K H, et al. Transient over-expression of barley BAX inhibitor-1 weakens oxidative defense and MLA12-mediated resistance to Blumeria graminis f. sp. hordei [J]. Molecular Plant Pathology, 2006, 7(6): 543 − 552. [7] WEIS C, HÜCKELHOVEN R, EICHMANN R. LIFEGUARD proteins support plant colonization by biotrophic powdery mildew fungi [J]. Journal of Experimental Botany, 2013, 64(12): 3855 − 3867. doi: 10.1093/jxb/ert217 [8] ROJAS-RIVERA D, ARMISÉN R, COLOMBO A, et al. TMBIM3/GRINA is a novel unfolded protein response (UPR) target gene that controls apoptosis through the modulation of ER calcium homeostasis [J]. Cell Death & Differentiation, 2012, 19(6): 1013 − 1026. doi: 10.1038/cdd.2011.189 [9] 李书缘, 刘承圆, 梁鹏, 等. 橡胶树感白粉病基因LFG1和LFG2的克隆及表达分析[J]. 分子植物育种, 2019, 17(3): 754 − 761. [10] LI X, LI S P, LIU Y H et al. HbLFG1, a rubber tree (Hevea brasiliensis) lifeguard protein, can facilitate powdery mildew infection by suppressing plant immunity [J]. Phytopathology, 2021, 111(9): 1648 − 1659. doi: 10.1094/PHYTO-08-20-0362-R [11] LI X, LIU Y, HE Q, et al. A candidate secreted effector protein of rubber tree powdery mildew fungus contributes to infection by regulating plant ABA biosynthesis [J]. Frontiers in Microbiology, 2020, 11: 591387. [12] YAMADA K, YAMAGUCHI K, SHIRAKAWA T, et al. The Arabidopsis CERK1-associated kinase PBL27 connects chitin perception to MAPK activation [J]. The EMBO Journal, 2016, 35(22): 2468 − 2483. [13] LIU Y, BASSHAM D C. Degradation of the endoplasmic reticulum by autophagy in plants [J]. Autophagy, 2013, 9(4): 622 − 623. doi: 10.4161/auto.23559 [14] KAWAI-YAMADA M, JIN L, YOSHINAGA K, et al. Mammalian Bax-induced plant cell death can be down-regulated by overexpression of Arabidopsis Bax inhibitor-1 (AtBI-1) [J]. Proceedings of the National Academy of Sciences of the United States of America, 2001, 98(21): 12295 − 12300. doi: 10.1073/pnas.211423998 [15] KANZAKI H, SAITOH H, TAKAHASHI Y, et al. NbLRK1, a lectin-like receptor kinase protein of Nicotiana benthamiana, interacts with Phytophthora infestans INF1 elicitin and mediates INF1-induced cell death [J]. Planta, 2008, 228(6): 977 − 987. doi: 10.1007/s00425-008-0797-y [16] MACHO A P, ZIPFEL C. Plant PRRs and the activation of innate immune signaling [J]. Molecular Cell, 2014, 54(2): 263 − 272. doi: 10.1016/j.molcel.2014.03.028 [17] TATEDA C, ZHANG Z, SHRESTHA J, et al. Salicylic acid regulates Arabidopsis microbial pattern receptor kinase levels and signaling [J]. The Plant Cell, 2014, 26: 4171 − 4187. doi: 10.1105/tpc.114.131938 [18] WANG W, LI X, ZHU M, et al. Arabidopsis GAAP1 to GAAP3 Play redundant role in cell death inhibition by suppressing the upregulation of salicylic acid pathway under endoplasmic reticulum stress [J]. Frontiers in Plant Science, 2019, 10: 1032. doi: 10.3389/fpls.2019.01032 [19] KAWAI-YAMADA M, OHORI Y, UCHIMIYA H. Dissection of Arabidopsis Bax inhibitor-1 suppressing Bax-, hydrogen peroxide-, and salicylic acid-induced cell death [J]. The Plant Cell, 2004, 16: 21 − 32. doi: 10.1105/tpc.014613 [20] YANG X, SRIVASTAVA R, HOWELL S H, et al . Activation of autophagy by unfolded proteins during endoplasmic reticulum stress [J]. The Plant Journal, 2016, 85(1): 83 − 95. doi: 10.1111/tpj.13091 [21] ASAI S, OHTA K, YOSHIOKA H. MAPK signaling regulates nitric oxide and NADPH oxidase-dependent oxidative bursts in Nicotiana benthamiana [J]. The Plant Cell, 2008, 20: 1390 − 1406. doi: 10.1105/tpc.107.055855 [22] CHAE H J, KIM H R, XU C, et al. BI-1 regulates an apoptosis pathway linked to endoplasmic reticulum stress [J]. Molecular Cell, 2004, 15(3): 355 − 366. doi: 10.1016/j.molcel.2004.06.038 [23] WATANABE N, LAM E. Bax inhibitor-1, a conserved cell death suppressor, is a key molecular switch downstream from a variety of biotic and abiotic stress signals in plants [J]. International Journal of Molecular Sciences, 2009, 10(7): 3149 − 3167. doi: 10.3390/ijms10073149 [24] GUO K, WANG W, FAN W,et al. Arabidopsis GAAP1 and GAAP3 modulate the unfolded protein response and the onset of cell death in response to ER stress [J]. Frontiers in Plant Science, 2018(9): 348. -




 下载:
下载: