-
棕榈科槟榔属植物槟榔(Areca catechu),具有极高的药用价值。我国的四大南药之首——榔玉,即为其成熟的种子经炮制处理后形成的。目前,槟榔在国内主要种植于海南、云南、福建、广西和台湾等地,为海南省支柱性商业作物[1, 2]。槟榔中蕴含着丰富的天然活性物质,如脂肪酸、多酚、鞣质、氨基酸、生物碱、多糖、槟榔红色素以及皂苷等,其中,脂肪酸(14%~18%)和鞣质(13%~27%)的含量较多,其次为生物碱(0.3%~0.6%)[3]。槟榔中最少含有6种生物碱,其中槟榔碱的含量最多,具有一定的药用价值。槟榔碱可通过作用于下丘脑− 垂体− 肾上腺轴从而影响内分泌系统[4],有研究发现,槟榔碱可兴奋胆碱M受体,使人唾液分泌增加、出汗、亢奋等,利于人体消化[5]。但是也有研究表明,咀嚼食用槟榔与患有口腔癌具有极大相关性[6],体外实验也表明,槟榔提取液可引起局部肿瘤变化。槟榔碱是槟榔的主要活性物质,具有极强的拟副交感神经毒理作用、细胞毒活性等几种毒理作用[7],槟榔碱还可引起口腔黏膜角质细胞凋亡,并显著增加口腔黏膜成纤维细胞中S100A4蛋白的表达,进而可能导致口腔黏膜下纤维性变(oral submucous fibrosis,OSF),是导致口腔黏膜细胞癌变的主因[8]。此外,槟榔碱不但会致癌,还会使整个机体的免疫功能下降,增加患癌风险[9]。槟榔碱对生殖系统具有一定毒理作用,研究指出,槟榔碱可导致男性精子数目下降,且表现出对槟榔碱的剂量依赖性[10]。槟榔树木高大、生长年限较长,且都生长于室外受外界环境影响,对其进行研究无法直观检测,因此,大部分关于槟榔碱的研究都是在其果实中进行。愈伤组织具有多种用途,一方面可研究植物生长发育及分化的机制、遗传变异规律,对植物遗传育种具有特殊意义;另一方面可用于大规模工厂化生产有用化合物,或用于细胞培养筛选工业、农业、医药生产上有用的无性系,或用于原生质体培养中的原生质体来源等[11]。愈伤组织的获取来源广泛,可以从植物的花、叶片、茎和种子等进行诱导获得,且诱导的愈伤组织量较大,可以对植物进行更多方向的研究。
槟榔碱含量的准确测量对于研究槟榔愈伤中槟榔碱的变化十分重要。目前,槟榔碱的提取方法主要有加热回流提取法、超声波提取法、亚临界水提法、超临界流体萃取等方法;分析方法有滴定法、分光光度法、高效液相色谱法以及液相色谱质谱联用技术等方法[12]。现有的槟榔碱提取方法均存在材料用量多、提取时间长以及步骤繁琐等缺点;而关于槟榔愈伤组织的研究内容较少,加上目前槟榔愈伤组织材料数量有限,因此,本研究拟以槟榔愈伤为材料,采用超声波提取方法,选择料液比、提取时间、提取温度、提取次数4个因素,在单因素实验的基础上,进行L9(34)正交实验,根据单因素实验和正交实验的结果进行验证实验,研究槟榔愈伤中槟榔碱的提取体系,以期建立一种简便、快速并且样品用量少的测定槟榔愈伤中槟榔碱含量的方法。
-
选择2种实验材料,一种是在海口街头采买的新鲜槟榔果,另一种是由海南大学热带棕榈植物实验室以槟榔叶片诱导分化得到的槟榔胚性愈伤组织。选择的槟榔愈伤组织直径约1 cm、外形呈乳白色、质地与生花生类似(图1)。将果和愈伤组织进行冻干,粉碎后过0.25 mm筛后备用。因为粉碎粒过0.25 mm筛后,槟榔碱的含量最高[13]。
-
1)确定最大吸收波长 使用85%的乙醇将槟榔碱标准品配制为1.0 g·L−1氢溴酸槟榔碱的标准液,然后将85%的乙醇作为空白对照,使用紫外可见分光光度计对1.0 mg·mL−1槟榔碱的标准液进行全波长扫描,发现氢溴酸槟榔碱的最大吸收峰在233 nm处。
2)绘制标准曲线 以85%的乙醇为溶剂将氢溴酸槟榔碱标准品分别配制成0.02、0.06、0.10、0.20、0.40、0.60、0.80、1.0 mg·mL−1的标准液,然后以85%的乙醇为空白对照,在233 nm处对所有梯度浓度的标准液进行扫描,得出其吸光度值。然后将氢溴酸槟榔碱的质量浓度设置为自变量(X),吸光度值A设置为因变量(Y),使用origin软件对不同浓度氢溴酸槟榔碱的标准液的吸光度值进行分析,得到标准曲线和回归方程。
-
槟榔碱提取和检测方法较多,考虑笔者所在的实验室现有的技术以及后续对槟榔愈伤所进行的其他实验,因此利用超声波提取的方式进行槟榔碱提取,使用紫外分光光度法进行含量检测。
取0.1 g样品于2 mL离心管中,加入100 µL氨水浸润2 min。然后,使用移液枪在离心管内加入一定量的85%的乙醇,在超声功率为300 W、超声频率40 kHz的情况下,控制水浴温度、超声时间、超声次数进行超声波提取。最后收集提取液并使用过滤柱头过滤,使用HBr将滤液pH调至3~4,得待测液。然后以85%的乙醇为空白对照,在233 nm处对所得待测液进行测量,测量其吸光度值。
-
在综合考虑料液比、提取时间、提取温度和提取次数对槟榔愈伤中槟榔碱含量影响的基础上,设计单因素实验,每组设置3个重复。
-
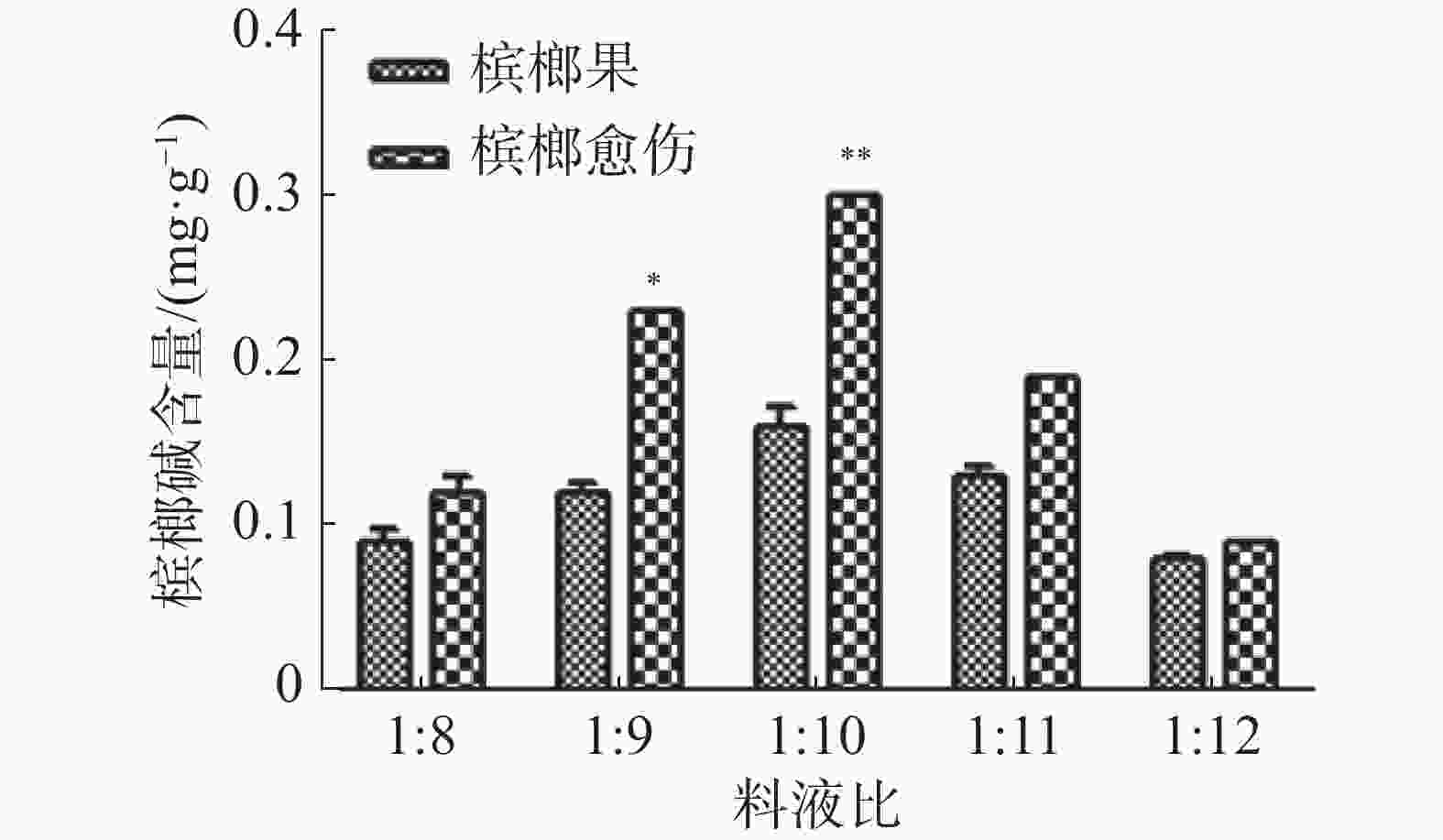
称取粉碎粒度0.25 mm的槟榔愈伤组织和槟榔果粉末0.1 g于2 mL离心管中,分别按照料液比(m槟榔愈伤-槟榔果︰V乙醇)为1∶8、1∶9、1∶10、1∶11、1∶12的比例加入800、900、1 000、1 100、1 200 µL体积的85%的乙醇,在65 ℃水浴中超声波提取20 min,共提取3次,紫外分光光度法测量槟榔碱含量。
-
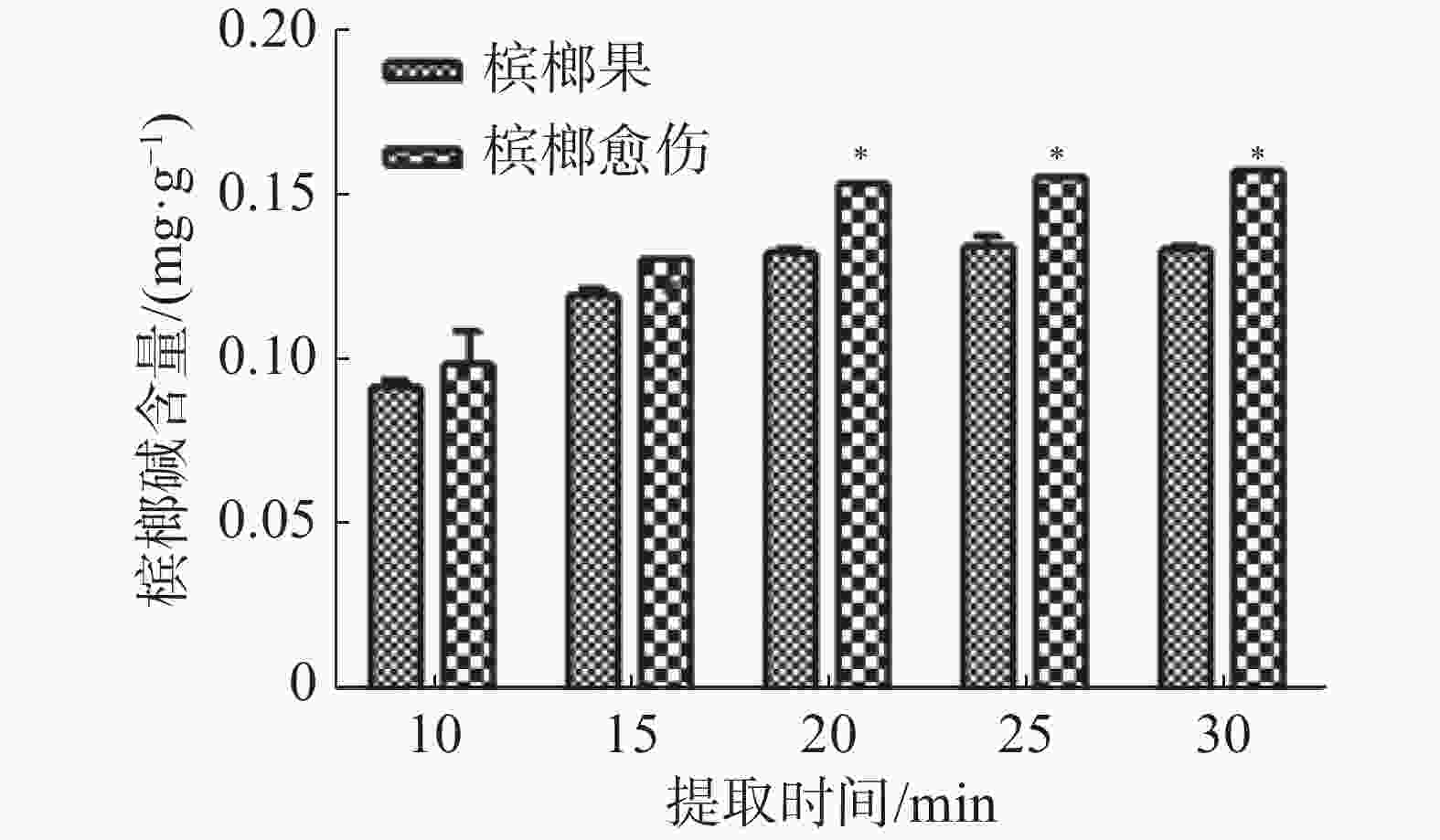
将0.1 g槟榔愈伤组织和槟榔果粉末加入2 mL的离心管中,按照1∶10的料液比加入1 000 µL85%乙醇,在65 ℃水浴中分别按超声波10、15、20、25、30 min的分组进行提取,每组提取3次,用紫外分光光度法测量槟榔碱含量。
-
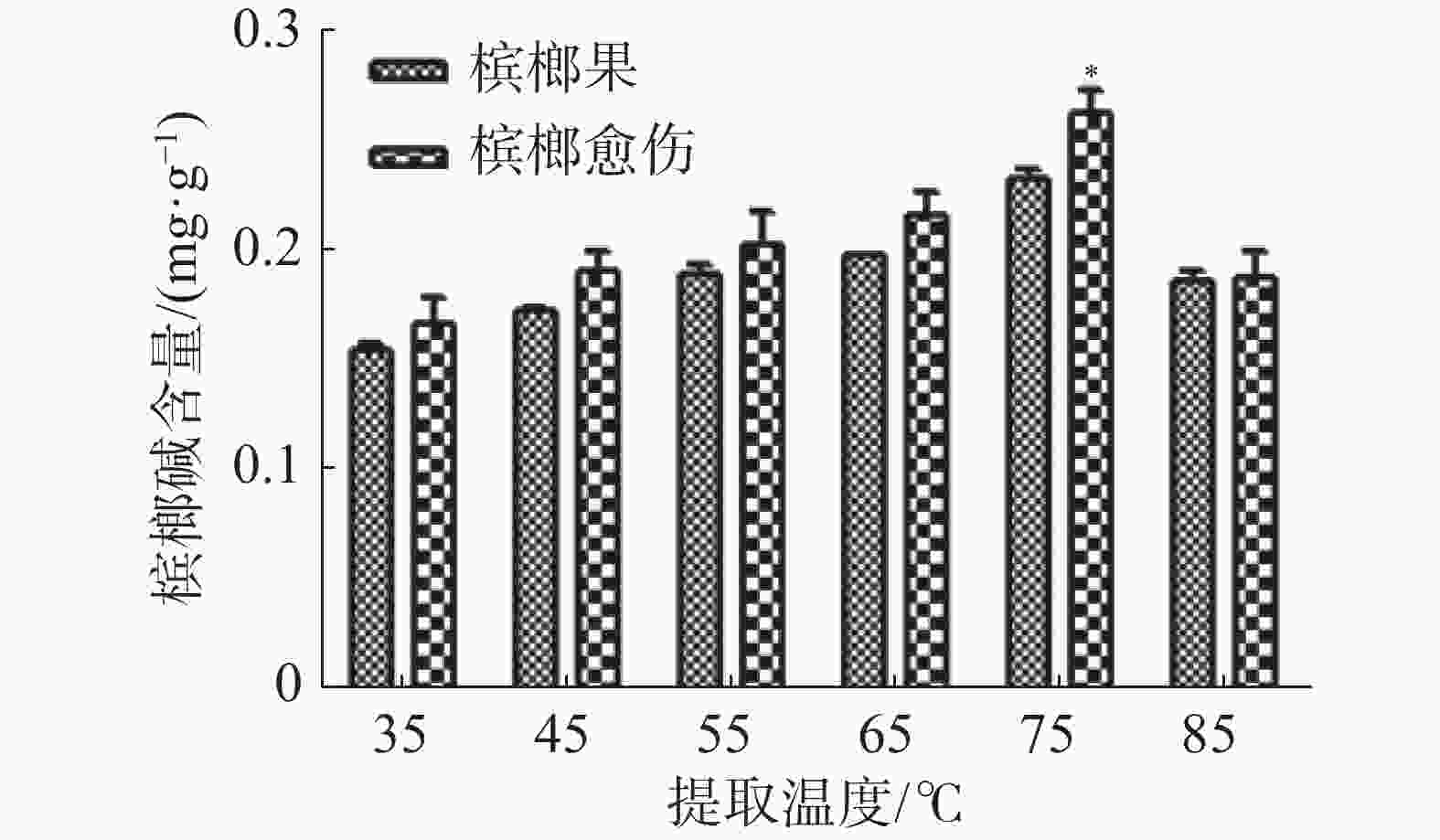
将0.1g槟榔愈伤组织和槟榔果粉末加入2 mL的离心管中,按照1∶10的料液比加入1 000 µL85%乙醇,分别在35、45、55、65、75、85 ℃的水浴锅中超声提取20 min,共提取3次,用紫外分光光度法测量槟榔碱含量。
-
将0.1 g槟榔愈伤组织和槟榔果粉末及1 000 µL 85%的乙醇加入2 mL的离心管中充分混匀。然后,于75 ℃中超声提取20 min,分别重复提取0、1、2、3、4次,每组重复3次。用紫外分光光度法测量槟榔碱含量。
-
本实验室目前具有成熟的槟榔愈伤组织的诱导体系,但是数目上还存在一定的限制,无法进行大批量的槟榔碱提取。通过单因素槟榔果和槟榔愈伤中槟榔碱的变化趋势,发现两者存在一致性,因此,选择使用槟榔果进行正交实验,得到槟榔碱提取的最佳方式。根据单因素实验的结果,分别选择料液比(A)、提取时间(B)、提取温度(C)、提取次数(D)4个因素的3个水平(表1)按照L9(34)正交设计表(表2)进行实验。
表 1 因素水平表
因素 水平 A(料液
比)B(提取
时间)/minC(提取
温度)/℃D(提取
次数)/次1 1∶9 20 55 2 2 1∶10 25 65 3 3 1∶11 30 75 4 表 2 正交实验设计表
组合 因素 A B C D 1 3 2 3 1 2 2 3 2 1 3 2 2 1 3 4 1 2 2 2 5 2 1 3 2 6 1 3 3 3 7 3 3 1 2 8 3 1 2 3 9 1 1 1 1 -
对槟榔果中槟榔碱的提取进行正交实验,由于正交实验结果中的最佳提取工艺与单因素实验得到的最佳提取条件不一致,所以进行验证实验。分别称取槟榔果壳粉末和槟榔愈伤粉末0.1 g于2 mL离心管中,然后按照A1B3C3D3 和A2B2C3D2两个条件组合进行3次平行实验。
-
每个样品选取3个生物学重复,使用SPSS软件对所得数据进行统计分析,用t测验进行数据之间的比较,*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。用GraphPad和Excel软件作图。
-
使用origin软件对测量结果进行分析,以槟榔碱的标准液浓度为X轴坐标,吸光度为Y轴坐标,进行线性拟合,绘制标准曲线(图2),得出回归方程为Y=0.0347+4.1046X,R2=0.999,线性范围为0.02~0.4 mg·mL−1。
-
从图3可知,随着料液比的不断增大,槟榔碱的提取效率越高,当料液比达到 1∶10时,槟榔碱含量最多,而当料液比大于1∶10时,随着85%乙醇剂量的增多,槟榔碱的含量反而逐渐下降,而且槟榔愈伤中槟榔碱的含量高于槟榔果中的含量。原因可能是当槟榔愈伤和果的量一定时,溶剂的量越多,溶剂与待萃取物的接触越充分,溶解在萃取液中的槟榔碱含量越多,当溶剂的体积达到1 000 µL时,槟榔材料中的槟榔碱被充分提取。当溶剂的体积大于1 000 µL时,由于槟榔碱的含量一定,而溶剂的总体积增加,槟榔碱的浓度被稀释,所以随着料液比的不断增加,槟榔碱的含量逐渐减小。因此,选择料液比为1∶10进行槟榔碱的提取较为合适。
-
由图4可知,随着提取时间的延长,槟榔碱在溶剂中的溶解度越来越高,在25 min时槟榔碱含量最高,但是当提取时间大于20 min时,槟榔碱完全溶解在液体中,含量不会随着时间的增加而大量增加。考虑到实验的时间成本,选择20 min作为槟榔碱的提取时间。
-
由图5可知,温度的提高有助于增大扩散系数,有利于槟榔碱溶解在溶剂中,因而随着温度的不断提高,槟榔碱的含量也在不断提升。但是当温度过高时槟榔碱的含量反而下降,可能的原因有:1)过高的温度引起溶剂的挥发,使得槟榔碱的提取率下降;2)乙醇与水之间的互溶度随温度升高而增大,使提取效果下降;3)温度过高导致槟榔碱的分子被破坏,从而使得提取率下降。分析后选择75 ℃进行后续实验。
-
由图6可知,随着提取次数的增加槟榔碱的含量不断增加,当提取次数达到3次及以上时,所提取出的槟榔碱的含量基本不变,这时候槟榔碱的含量已达到最大值,说明3次已基本提取完全。综合考虑,槟榔碱提取4次为最佳条件。
-
正交实验(表3)表明,4个因素对槟榔碱提取的影响顺序为料液比、提取时间、提取次数、提取温度,以槟榔碱含量为指标的槟榔碱的最佳提取工艺A1B3C3D3,即料液比1∶9、提取时间30 min,提取温度75 ℃、提取次数4次。此外,将极差最小的C项作为误差项对正交结果进行方差分析(表4)。由结果可知,料液比、提取时间对槟榔碱提取有显著影响,而提取次数影响不显著。
表 3 正交实验结果
水平 因素 含量mg.g−1 A B C D 1 3 2 3 1 0.191372 2 2 3 2 1 0.216167 3 2 2 1 3 0.207233 4 1 2 2 2 0.225600 5 2 1 3 2 0.209531 6 1 3 3 3 0.239400 7 3 3 1 2 0.221467 8 3 1 2 3 0.185733 9 1 1 1 1 0.207767 K1 0.672767 0.603031 0.636467 0.615306 K2 0.632931 0.624205 0.645404 0.656598 K3 0.598572 0.677034 0.640303 0.632366 k1 0.224256 0.20101 0.212156 0.205102 k2 0.210977 0.208068 0.215135 0.218866 k3 0.199524 0.225678 0.213434 0.210789 R 0.024732 0.024668 0.002979 0.013764 表 4 正交实验结果方差分析
主体间效应的检验 源 Ⅲ 型平方和 df 均方 F Sig. 校正模型 0.002a 6 0 25.185 0.039 截距 0.403 1 0.403 27997.692 0 A 0.001 2 0 31.935 0.030 B 0.001 2 0 33.646 0.029 D 0 2 0 9.972 0.091 误差 2.878E-005 2 1.439E-005 总计 0.405 9 校正的总计 0.002 8 注:a. R 2 = 0.987(调整 R 2 = 0.948)。 -
由图7可知,正交实验得出的最佳工艺的提取效果最好,并且对于槟榔愈伤的槟榔碱提取效果更佳。
-
本研究通过单因素实验分析槟榔愈伤组织和槟榔果中槟榔碱的含量变化,有研究结果显示,在槟榔下脚料中槟榔碱的提取中,综合考虑6种单因素对槟榔碱含量的影响[13],相比来说本研究选择的单因素较少,不具备全面性,无法准确地指出现在得到的槟榔碱的提取方式是否已经是最优的提取条件,后续可以增加单因素研究。且本研究中,正交实验是利用槟榔果进行的,虽然进行了验证实验证明了槟榔愈伤中槟榔碱的含量高于槟榔果,但是数据不够全面,待后续槟榔愈伤组织大量繁殖之后进行合适的正交实验。
高效的提取方式是槟榔碱提取过程中最有效的手段,笔者在综合考虑本实验室所拥有技术的基础上选择超声波提取和紫外分光光度法进行检测。超声波提取可通过传质,加热和空化作用来提高提取率并缩短提取时间[14],超声波独有的物理特性可破坏植物细胞,从而使得其中的活性成分提取更充分,显著提高提取率、缩短提取时间。超声波提取还具有操作简便、运行成本低的优点,因而被广泛应用于药用植物中有效成分的提取。紫外分光光度法操作简便,仪器成本较低,但是无法满足槟榔碱的痕量检测。本研究中槟榔碱的提取和检测方式不够新颖,检测时液体中含有的杂质对实验结果造成一定的影响,之后可以使用更加精准的检测方式得到槟榔碱的含量。
愈伤组织是根癌农杆菌遗传转化的最佳受体材料,因此关于槟榔愈伤组织材料的研究对槟榔未来各种研究是非常重要的。本研究是利用槟榔愈伤组织进行槟榔碱的提取,目前关于槟榔愈伤的研究较少,因此本研究所选择的材料新颖,具有创新性。槟榔愈伤组织繁殖速度快,未来可以对槟榔中生物碱含量进行分析,对于研究槟榔中分子代谢机制是非常合适的研究材料。
本实验通过对槟榔果和槟榔愈伤进行单因素和正交实验分析,建立了一个简便、快速、样品用量少,并且可大批量进行实验的,提取检测槟榔愈伤中槟榔碱的体系,结果显示,提取槟榔碱的最优条件为:75 ℃的提取温度,每0.1 g原料添加900 µL 85%乙醇,每次提取30 min,共提取4次。用该提取条件分别提取槟榔愈伤和槟榔果壳中的槟榔碱,发现愈伤中的槟榔碱含量高于果壳,该提取方法可保证在小剂量使用槟榔愈伤、减少材料消耗的情况下,又可快速检测槟榔碱含量。目前,本研究获得了现今最优的槟榔愈伤中槟榔碱提取方式,本实验室后续进行的研究是关于外来施加胁迫对槟榔愈伤中槟榔碱的影响,该提取方式为后续实验打下良好基础,也为未来槟榔分子方向的研究提供了新思路。
Analysis of extraction method of arecoline from areca callus
-
摘要: 为了建立一种简便、快速并且样品用量少的测定槟榔愈伤中槟榔碱含量的方法,以槟榔 (Areca catechu)愈伤为研究对象,采用超声波提取方法,选取料液比、提取时间、提取温度、提取次数4个因素,在单因素实验的基础上,进行L9(34)正交实验,根据单因素实验和正交实验的结果进行验证实验,研究了槟榔愈伤中槟榔碱的提取体系。结果表明:料液比1∶9、提取时间30 min、提取温度75 ℃、提取次数4次是最佳的槟榔碱提取体系。Abstract: In order to establish a simple, rapid and less sample method for the determination of arecoline in Areca catechu callus, an ultrasonic extraction method was used to extract arecoline from A.catechu calli, and four factors including solid-liquid ratio, extraction time, extraction temperature and extraction times were selected. On the basis of single factor experiment an orthogonal L9(34) experiment was performed to optimize the extraction system for arecoline from A. catechu calli. The results showed that the optimum extraction system for arecoline included the solid-liquid ratio of 1∶9, extraction time of 30 min, extraction temperature of 75 ℃ and 4 extraction times.
-
Key words:
- arecoline /
- areca callus /
- ultrasonic extraction /
- single factor experiment /
- orthogonal experiment
-
表 1 因素水平表
因素 水平 A(料液
比)B(提取
时间)/minC(提取
温度)/℃D(提取
次数)/次1 1∶9 20 55 2 2 1∶10 25 65 3 3 1∶11 30 75 4 表 2 正交实验设计表
组合 因素 A B C D 1 3 2 3 1 2 2 3 2 1 3 2 2 1 3 4 1 2 2 2 5 2 1 3 2 6 1 3 3 3 7 3 3 1 2 8 3 1 2 3 9 1 1 1 1 表 3 正交实验结果
水平 因素 含量mg.g−1 A B C D 1 3 2 3 1 0.191372 2 2 3 2 1 0.216167 3 2 2 1 3 0.207233 4 1 2 2 2 0.225600 5 2 1 3 2 0.209531 6 1 3 3 3 0.239400 7 3 3 1 2 0.221467 8 3 1 2 3 0.185733 9 1 1 1 1 0.207767 K1 0.672767 0.603031 0.636467 0.615306 K2 0.632931 0.624205 0.645404 0.656598 K3 0.598572 0.677034 0.640303 0.632366 k1 0.224256 0.20101 0.212156 0.205102 k2 0.210977 0.208068 0.215135 0.218866 k3 0.199524 0.225678 0.213434 0.210789 R 0.024732 0.024668 0.002979 0.013764 表 4 正交实验结果方差分析
主体间效应的检验 源 Ⅲ 型平方和 df 均方 F Sig. 校正模型 0.002a 6 0 25.185 0.039 截距 0.403 1 0.403 27997.692 0 A 0.001 2 0 31.935 0.030 B 0.001 2 0 33.646 0.029 D 0 2 0 9.972 0.091 误差 2.878E-005 2 1.439E-005 总计 0.405 9 校正的总计 0.002 8 注:a. R 2 = 0.987(调整 R 2 = 0.948)。 -
[1] 陈洪, 罗光远, 陈夏雨, 等. 槟榔中槟榔碱的药理研究进展[J]. 桂林师范高等专科学校学报, 2017, 31(2): 116 − 120. [2] 杨雅蛟, 孔维军, 孙兰, 等. 槟榔化学成分和药理作用及临床应用研究进展[J]. 世界科学技术-中医药现代化, 2019, 21(12): 2583 − 2591. [3] 张橡楠. 槟榔化学成分和药理作用研究进展[J]. 生物技术世界, 2012, 10(7): 9 − 10. [4] DASGUPTA R, SAHA I, MAITY A et al. Arecoline ameliorates hyperthyroid condition in mice under cold stress[J]. Archives of Physiology and Biochemistry, 2018, 124(5): 436 − 441. [5] 熊雄, 李珂, 易书瀚, 等. 食用槟榔中槟榔碱毒性及生理活性研究进展[J]. 食品工业科技, 2017, 38(20): 328 − 335. doi: 10.13386/j.issn1002-0306.2017.20.060 [6] CHEN P T, KUAN F C, HUANG C E et al. Incidence and patterns of second primary malignancies following oral cavity cancers in a prevalent area of betel-nut chewing: a population-based cohort of 26, 166 patients in Taiwan[J]. Japanese Journal of Clinical Oncology, 2011, 41(12): 1336 − 1343. doi: 10.1093/jjco/hyr152 [7] SENN M, BAIWOG F, WINMAI J et al. Betel nut chewing during pregnancy, Madang province, Papua New Guinea[J]. Drug and Alcohol Dependence, 2009, 105(1/2): 126 − 131. [8] YU C-C, TSAI C-H, HSU H-I, et al. Elevation of S100A4 expression in buccal mucosal fibroblasts by arecoline: Involvement in the pathogenesis of oral submucous fibrosis[J]. Plos One, 2013, 8(1): e55122. doi: 10.1371/journal.pone.0055122 [9] CHATTERJEE A, DEB S. Genotoxic effect of arecoline given either by the peritoneal or oral route in murine bone marrow cells and the influence of N-acetylcysteine[J]. Cancer Letters, 1999, 139(1): 23 − 31. doi: 10.1016/S0304-3835(98)00364-4 [10] AKHTAR S, SHEIKH A A, QURESHI H U. Chewing areca nut, betel quid, oral snuff, cigarette smoking and the risk of esophageal squamous-cell carcinoma in South Asians: a multicentre case-control study[J]. European Journal of Cancer, 2012, 48(5): 655 − 661. doi: 10.1016/j.ejca.2011.06.008 [11] EFFERTH T. Biotechnology Applications of Plant Callus Cultures[J]. Engineering, 2019, 5(1): 50 − 59. [12] 潘虹. 槟榔碱提取及分析方法研究进展[J]. 亚太传统医药, 2019, 15(4): 188 − 191. [13] 陈娟, 卢克强, 朱门君, 等. 槟榔下脚料中槟榔碱的提取工艺及应用研究[J]. 食品与机械, 2021, 37(1): 180 − 185. [14] CUOCO G, MATHE C, ARCHIER P et al. A multivariate study of the performance of an ultrasound-assisted madder dyes extraction and characterization by liquid chromatography-photodiode array detection[J]. Ultrasonics Sonochemistry, 2009, 16(1): 75 − 82. doi: 10.1016/j.ultsonch.2008.05.014 -





 下载:
下载: