-
血叶兰[Ludisia discolor(Ker-Gawl.)A.Rich.]为兰科(Orchidaceae)血叶兰属(Ludisia)的多年生常绿草本植物,常见于山坡或沟谷阴凉湿润处。血叶兰植株形态优美,具有较好的观赏价值。此外,血叶兰全株均可入药,具有滋阴润肺、安神健脾等功效,也可用于治疗食欲不振、神经衰弱等。血叶兰作为观赏和药用两用植物,目前主要分布在中国的海南、福建、广东、广西等地区[1 − 2]。兰花茎腐病为兰花主要病害之一,是一种致病力较强的土传性病害,兰花染病后茎基部产生水渍状病斑,伴随茎部凹陷和坏死,随着病情发展会导致茎基部大面积腐烂,影响植株对水分和养分的吸收,引起叶片逐渐萎蔫,整株植株倒伏死亡[3 − 4]。目前兰花病害防治多以栽培措施管理、化学防治、选育优良品种等方面进行。对兰花茎腐病目前主要以预防和化学防治为主,但长期使用化学农药会导致病原菌产生抗药性,且栽培管理措施也耗费大量的人力物力,从而增加生产成本[4 − 5]。
生物防治可利用生防菌的特性,生防菌通过产生代谢产物抑制病原菌生长并进一步降解病原菌,从而达到防治效果。木霉菌为一种重要的生防真菌,广泛存在于土壤中,其生长迅速,适应性强,对多种病原菌具有较好的防治效果[6]。目前的研究结果表明,木霉菌有效防治灰霉菌、镰刀菌和白绢菌等病原微生物,此外,木霉菌还能促进植物种子萌发率、促进根系生长和叶片发育等[7 − 10]。叶炜等[11]发现3株木霉对金线兰茎腐病病原菌尖孢镰刀菌具有较强的抑制效果,并且还能促进金线兰的生长和多糖的含量。陈俊生等[12]表明施加木霉菌剂能够有效抑制蝴蝶兰白绢病菌生长。魏林等[13]的研究结果表明,哈茨木霉T2-16的固态制剂可有效降低建兰茎腐病和白绢病的发病程度;哈茨木霉T2-16的液态制剂能促进花枝数的增加及延长花期。此外,一些木霉菌如棘孢木霉、绿色木霉等能够促进兰花植株生长和种子萌发,提高植株生物量[14]。杨泽秀等[15]将分离纯化的血叶兰组培苗内生真菌与血叶兰进行为期3个月的共培养,结果表明与木霉菌共培养能有效促进植株鲜质量和生根数。从石斛兰和蕙兰中分离的内生真菌可用于拮抗病原真菌,其分离菌株中发现的木霉菌能寄生病原菌,并在被寄生的木霉菌中检测到广谱抑菌活性的化合物,并发现这些化合物可发挥拮抗作用[16 − 17]。
木霉菌通过竞争、寄生、抗生和诱导植物抗性等多种机制抑制病原菌的繁殖和扩散,从而达到生物防治的目的[18]。木霉菌在与病原菌拮抗的过程中通过分泌多种细胞壁降解酶裂解病原菌的细胞壁,使病原菌菌丝断裂死亡,同时合成具有广谱抑菌活性的次生代谢产物,包括抗生素类物质(如胶霉毒素)、挥发性有机化合物(如 6-戊基-α-吡喃酮)以及非挥发性化合物等[19]。曹秋林等[20]发现木霉菌的非挥发性代谢产物能够抑制花生白绢菌菌丝生长,还能促进花生植株的生长。Oszako等[21]认为棘孢木霉多种拮抗代谢物的分泌能抑制栎树白粉病的发生。产生的细胞壁降解酶(如几丁质酶、纤维素酶、蛋白酶和β-1-3葡聚糖酶)在抑制真菌病原体和诱导寄主植物的抗性方面发挥着重要作用[22]。Tseng等[23]的研究结果表明,在重寄生过程中木霉菌产生大量的几丁质酶、葡聚糖酶和蛋白酶等降解病原菌细胞壁,最终导致病原菌死亡。木霉菌几丁质酶对胶孢炭疽菌和白绢菌具有拮抗活性,几丁质酶浓度为60 U·mL-1时几乎完全抑制胶孢炭疽菌和白绢菌的生长[24]。
目前对血叶兰的研究主要集中在育种、生活习性和化学成分分析,对其病害的生物防治研究较少。因此,本研究分离鉴定血叶兰茎腐病病原,根据木霉菌的特性采用对峙培养、非挥发代谢产物对病原菌的抑制及几丁质酶和葡聚糖酶活性检测,探究木霉菌对血叶兰茎腐病病原的抑菌效果,为进一步开发复合木霉菌制剂防治血叶兰茎腐病提供理论依据。
-
病原菌从热带特色林木遗传与种质创新教育部重点实验室血叶兰病株上分离获得。木霉菌株由本课题组前期分离保存。木霉菌、病原菌于26 ℃恒温培养,血叶兰植株大棚内遮荫培养。
-
收集血叶兰腐烂的茎部组织,用无菌的刀片切下病健交界处0.6 cm×0.6 cm的组织块,无菌水清洗组织后,用75%的乙醇消毒3 min,无菌水冲洗过后用4%的次氯酸钠(4% NaClO)消毒1 min,再用无菌水清洗5次,将经过表面消毒的组织转至灭菌后的滤纸上吸干表面水分;待表面干燥后将组织转移到马铃薯葡萄糖琼脂培养基(PDA)平板上于26 ℃条件下培养2~3 d,待长出菌落后挑取边缘菌丝转至新的PDA板上,重复转板纯化5次,直至菌落形态一致。此次分离纯化出9株病原菌,命名为X.1~X.9,将这些病原菌保存至含有1 mL 50%甘油和1 mL 马铃薯葡萄糖液体培养基(PD)的冻存管中,−20 ℃保存。
-
取培育时间一致且长势相近的血叶兰植株,用灭菌手术刀对其茎基部进行刺伤处理,在伤口处接种上述纯化后的X.1~X.9病原菌菌饼(d=0.5 cm),以空白PDA菌饼接种伤口处作为对照,在大棚内遮荫培养10 d后观察其发病症状。对照组和实验组均设置3次重复。
-
将X.9菌饼(d=0.5 cm)接至PDA板中央,在26 ℃光照培养箱培养5 d,观察菌落生长状态和菌丝形态,在平板上取样制片显微观察分生孢子。菌板培养5 d后,采用CTAB法提取病原菌DNA,用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)与ITS4(5′-TCCTCCGCTTATTGATATGC-3′),EF1-728F(5′-CATCGAGAAGTTCGAGAAGG-3′)与EF1-986R(5′-TACTTGAAGGAACCCTTAC-C-3′)进行PCR扩增[25 − 27]。扩增总体系50 μL,其中模板DNA 3 μL,上、下游引物各2 μL,Green Mix 25 μL,ddH2O 18 μL;扩增程序为95 ℃预变性3 min,(95 ℃变性15 s,58 ℃退火15 s,72 ℃延伸30 s)×35个循环,72 ℃最后延伸10 min,PCR扩增产物进行琼脂糖凝胶电泳验证,目的条带大小一致,送擎科生物技术有限公司完成测序。ITS、EF-1α基因片段序列通过NCBI的BLAST工具进行相似性序列比对,下载对应的同源基因序列,利用MEGA7.0软件Clustal W进行多重比对,除去两端未比对的序列,通过Neighbor-Joining法构建系统发育树,将bootstrap设置为1 000次重复构建系统发育树。
-
取活化培养后的木霉菌和病原菌用打孔器从菌落边缘打菌饼(d=0.5 cm),分别接种在PDA平板的两侧,菌饼距离平板边缘约1 cm,以只接种病原菌作为对照,26 ℃恒温培养,每个处理5个重复。培养7 d后测量病原菌菌落半径,计算木霉菌对病原菌的抑菌率。参照陈书华等[28]的方法使用覆盖度表示对病原菌的寄生能力,采用分级标准为Ⅰ 级:木霉菌完全覆盖病原菌;Ⅱ 级:木霉菌覆盖全皿的2/3以上;Ⅲ 级:木霉菌占全皿1/3~2/3;Ⅳ 级:病原菌占全皿2/3以上;Ⅴ 级:病菌长覆盖全皿[29]。
抑菌率(%)=(对照组病原菌菌落半径-处理组菌落半径)/对照组菌落半径×100
-
在直径为9 cm的PDA平板上,铺上直径约为10 cm的无菌玻璃纸,在平板中央接种活化2 d的木霉菌饼(d=0.5 cm),26 ℃恒温培养。培养2 d后将玻璃纸和菌饼揭开除去,在平板中央接入病原菌,26 ℃恒温培养。每个处理重复3次,以空白的PDA平板做对照,接种5 d后用十字交叉法测量菌落直径,计算抑菌率[20,30]。
抑制率(%)=(对照病原菌菌落直径-处理病原菌菌落直径)/对照病原菌菌落直径×100
-
将筛选出的拮抗效果好的木霉菌株菌饼(d=0.5 cm)接到PDA、CMD、SNA板中央,在26 ℃恒温培养箱中培养 5 d, 观察菌落的形态特征。待菌落长满整个培养皿时,取样制片观察分生孢子梗和分生孢子簇的特征,菌株的形态学鉴定参照杨合同[31]的方法。分子鉴定参照1.2.3病原菌的鉴定方法。
-
将木霉菌与病原菌菌饼(d=0.5 cm)对峙接在平板上培养5 d,以单接木霉菌为对照进行取样。每个处理3次重复,采用几丁质酶和β-1,3葡聚糖酶活性检测试剂盒(索莱宝)进行酶活测定。几丁质酶活性定义为37 ℃下,每g组织每小时分解几丁质产生1 μmol N-乙酰氨基葡萄糖的酶量为一个酶活性单位;β-1,3葡聚糖酶活性定义为每g组织每小时产生1 mg还原糖为一个酶活性单位。
-
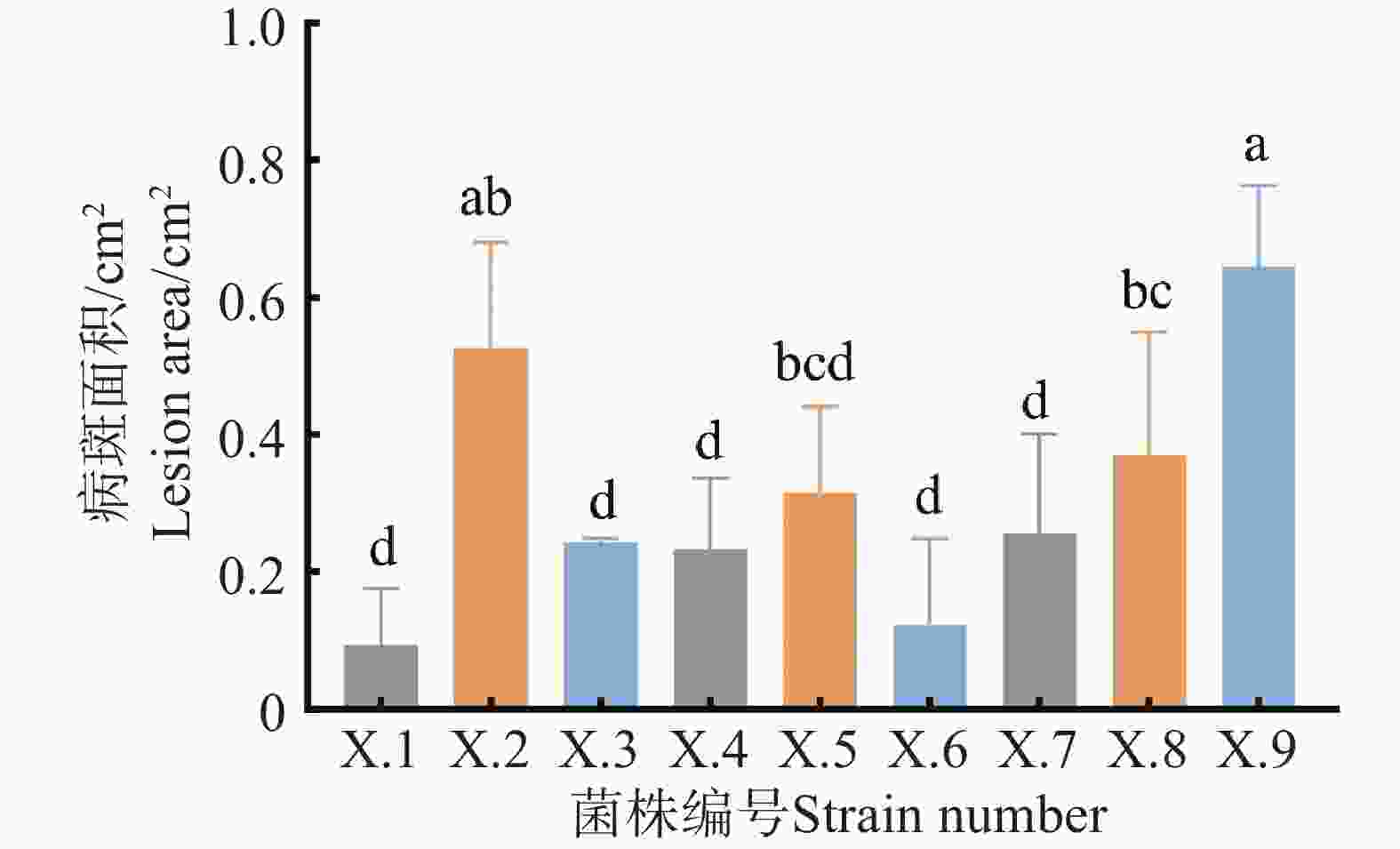
将分离纯化获得X.1~X.9菌株的菌饼分别接种在血叶兰茎基部处理10 d后,小心取出植株观察其发病状况,结果(图1)表明,9株病原菌株均能导致血叶兰茎基部发病,血叶兰接种处呈现出腐烂状态;X.1~X.9的病斑面积分别为0.09 、0.53 、0.24 、0.23 、0.32 、0.12、0.26 、0.37 、0.65 cm2,其中X.9的致病效果最强。将接种发病后的茎基部取回,小心冲洗除去茎基部表面土壤,切取病健交界处进行表面消毒后接至PDA板上培养,菌落边缘挑取菌丝纯化培养,菌落和孢子形态与原接种菌株一致,符合柯赫氏法则。
-
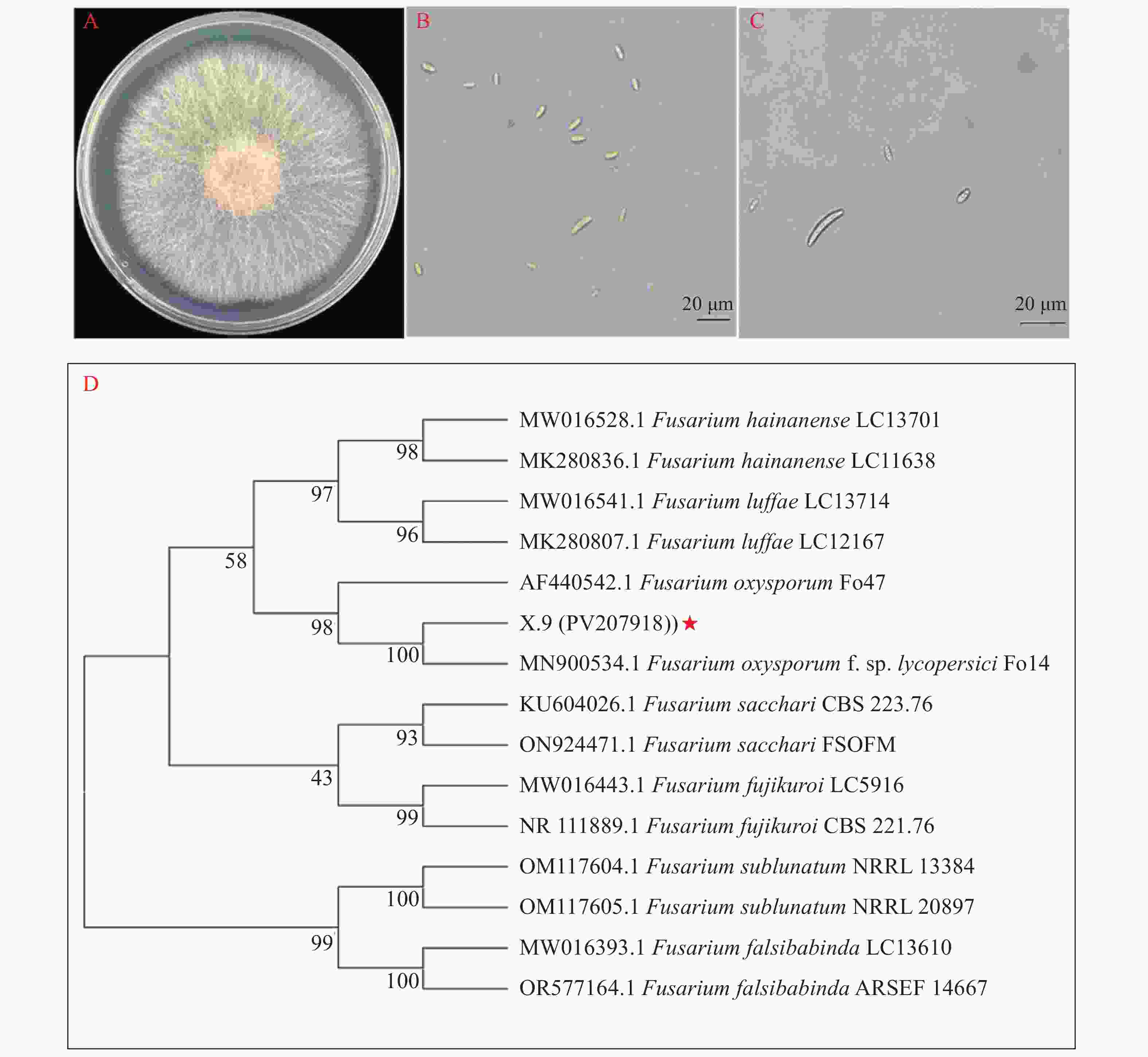
病原菌前期菌落为白色,随着培养时间的延长,会逐渐产生粉色或紫色色素。PDA平板培养菌落中间菌丝茂密,边缘稀疏,菌丝呈现粉白色交接(图2-A)。制片显微观察发现小分生孢子丰富,呈椭圆形,大分生孢子呈镰刀状,整体细长而两端渐尖(图2-B、C),参照《常见镰刀菌鉴定指南》初步鉴定为镰刀菌[32]。
将测序结果在NCBI进行比对,结果表明病原菌X.9的内转录间隔区序列(ITS)与尖孢镰刀菌(MN900534.1、AF440542.1)具有100%的一致性;延伸因子序列(EF-1α)只有尖孢镰刀菌Fol4(MN900534.1)与X.9具有100%一致性。下载比对结果中同时提交ITS、EF-1α片段序列的镰刀菌菌株序列,与X.9序列构建基于ITS和EF-1α片段串联的双基因系统发育树,结果表明X.9与尖孢镰刀菌番茄专化型(MN900534.1)遗传距离最近,并且与尖孢镰刀菌Fo47菌株(AF440542.1)聚在同一分支(图2-D)。根据系统发育树结合形态学分析鉴定X.9(PV207918)为尖孢镰刀菌。
-
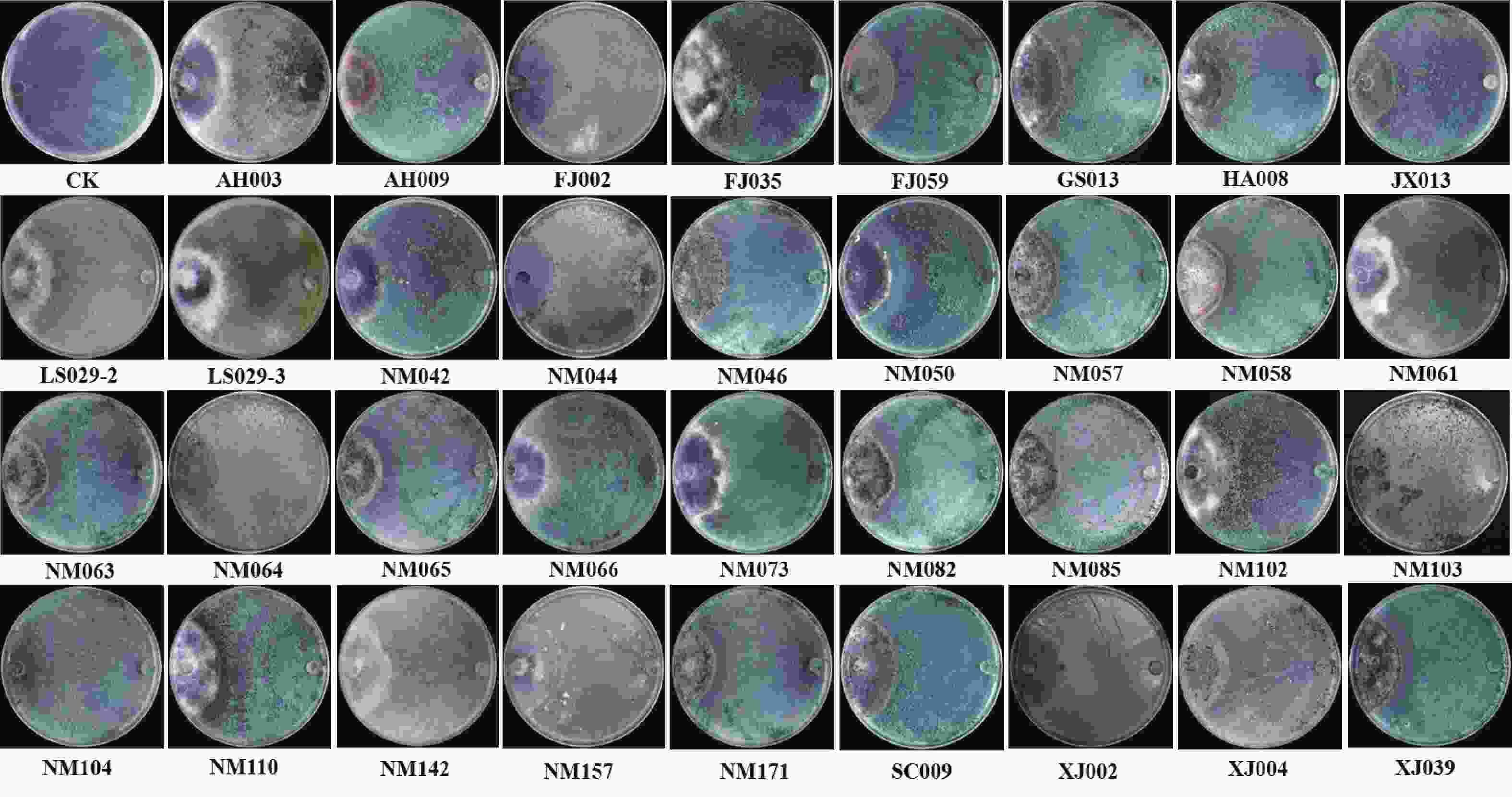
将活化后的35株木霉菌与病原菌X.9接至PDA平板上对峙培养7 d后,测量木霉菌对病原菌的抑制作用。结果(表1)表明,35株木霉菌对病原菌的抑制率在60.00%以上;LS029-3菌株抑制效果较差,抑菌率只有67.78%;17株木霉菌FJ059、GS013、HA008、JX013、NM046、NM057、NM063、NM064、NM065、NM082、NM085、NM103、NM104、NM171、SC009、XJ004、XJ039能完全覆盖(覆盖度等级为Ⅰ)病原菌菌丝,且抑菌率均在75.00%以上,这说明17株木霉菌对病原菌有较强的拮抗作用。
表 1 35株木霉菌株对病原菌X.9的拮抗作用
Table 1. Antagonistic effect of 35 strains of Trichoderma against pathogen X.9
菌株编号
Strain number抑菌率/%
Inhibition rate/%覆盖度
Degree of coverage菌株编号
Strain number抑菌率/%
Inhibition rate/%覆盖度
Degree of coverageAH003 71.51±4.48gh Ⅱ NM064 77.14±0.73abcdefg Ⅰ AH009 81.29±4.81abc Ⅱ NM065 80.75±0.51abcd Ⅰ FJ002 72.00±1.79fgh Ⅱ NM066 78.39±3.11abcdefg Ⅱ FJ035 76.63±4.70abcdefg Ⅱ NM073 71.24±5.63bc Ⅱ FJ059 76.13±1.08bcdefg Ⅰ NM082 77.48±0.39abcdefg Ⅰ GS013 76.55±0.39abcdefg Ⅰ NM085 77.25±0.67abcdefg Ⅰ HA008 81.04±1.21abc Ⅰ NM102 75.88±5.00bcdefg Ⅱ JX013 80.41±0.49abcd Ⅰ NM103 79.45±0.45abcde Ⅰ LS029-2 75.3±3.86abcdefg Ⅲ NM104 80.54±0.57abcd Ⅰ LS029-3 67.78±4.69h Ⅲ NM110 79.26±5.46abcdef Ⅱ NM042 79.32±3.79abcdef Ⅱ NM142 72.52±2.50cdefgh Ⅲ NM044 82.41±3.08ab Ⅱ NM157 74.28±6.35cdefgh Ⅲ NM046 78.39±0.12abcdefg Ⅰ NM171 82.57±0.44ab Ⅰ NM050 79.77±5.08abcde Ⅱ SC009 75.81±1.16bcdefg Ⅰ NM057 79.14±0.58abcdef Ⅰ XJ002 74.08±1.76bc Ⅲ NM058 83.95±4.71a Ⅱ XJ004 81.06±0.58abc Ⅰ NM061 73.29±2.78cdefgh Ⅲ XJ039 79.9±0.98abcd Ⅰ NM063 80.02±0.67abcd Ⅰ 注:上标中的不同字母在处理之间差异显著(p<0.05)。
Note: Different superscript letters mean significant difference between treatments(p<0.05). -
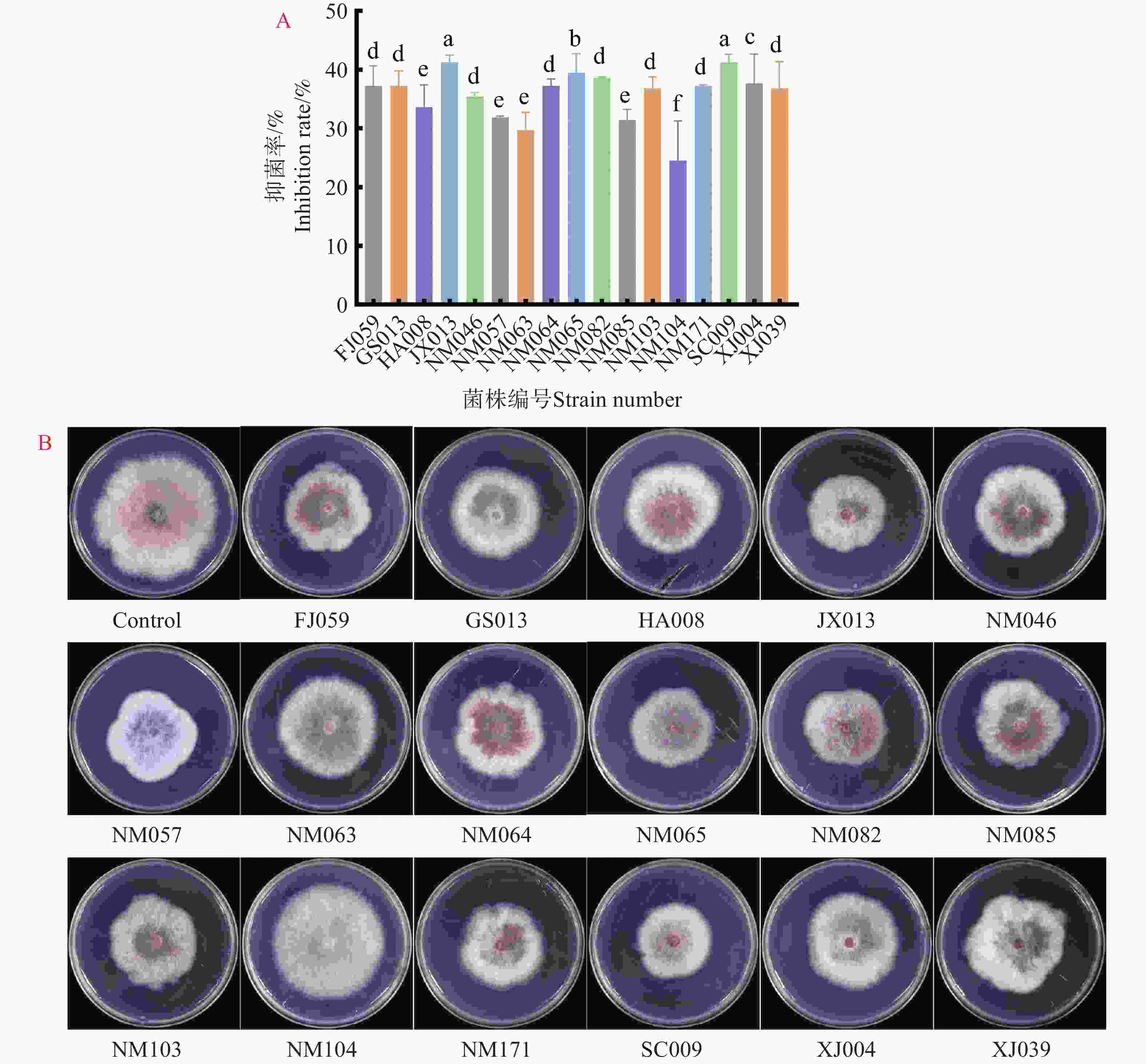
进一步确认17株木霉菌对病原菌的抑制作用,在含有非挥发性代谢产物平板中央接病原菌,培养5 d测量病原菌菌落直径。结果表明17株木霉菌非挥发性代谢产物对病原菌的生长均有抑制作用,JX013和SC009对病原菌的抑制效果最为显著,抑菌率分别为41.27%和41.26%,NM104效果最差仅有24.48%(图4-A)。实验观察到非挥发性代谢产物除了能抑制病原菌缓慢生长外,部分平板病原菌菌丝塌陷,表明木霉菌的非挥发性物质能有效抑制病原菌X.9的生长(图4-B)。
-
PDA平板上JX013菌株菌落呈同心环,菌丝茂密且产生大量分生孢子(图5-A);CMD平板上菌丝稀疏,无气生菌丝,在平板边缘产生少量孢子(图5-B);SNA平板培养菌丝稀疏,菌落边缘产生大量孢子,菌落中央也分散产孢(图5-C)。显微观察分生孢子梗形成半球形丛树,分枝对生生长,顶端有2个或2个以上的瓶梗,孢子簇则呈棉絮状(图5-D、E)。菌株SC009的形态特征与菌株JX013几乎一致(图5-F--J)。JX013和SC009形态特征与棘孢木霉基本一致,参照杨合同[31]方法初步鉴定为棘孢木霉。
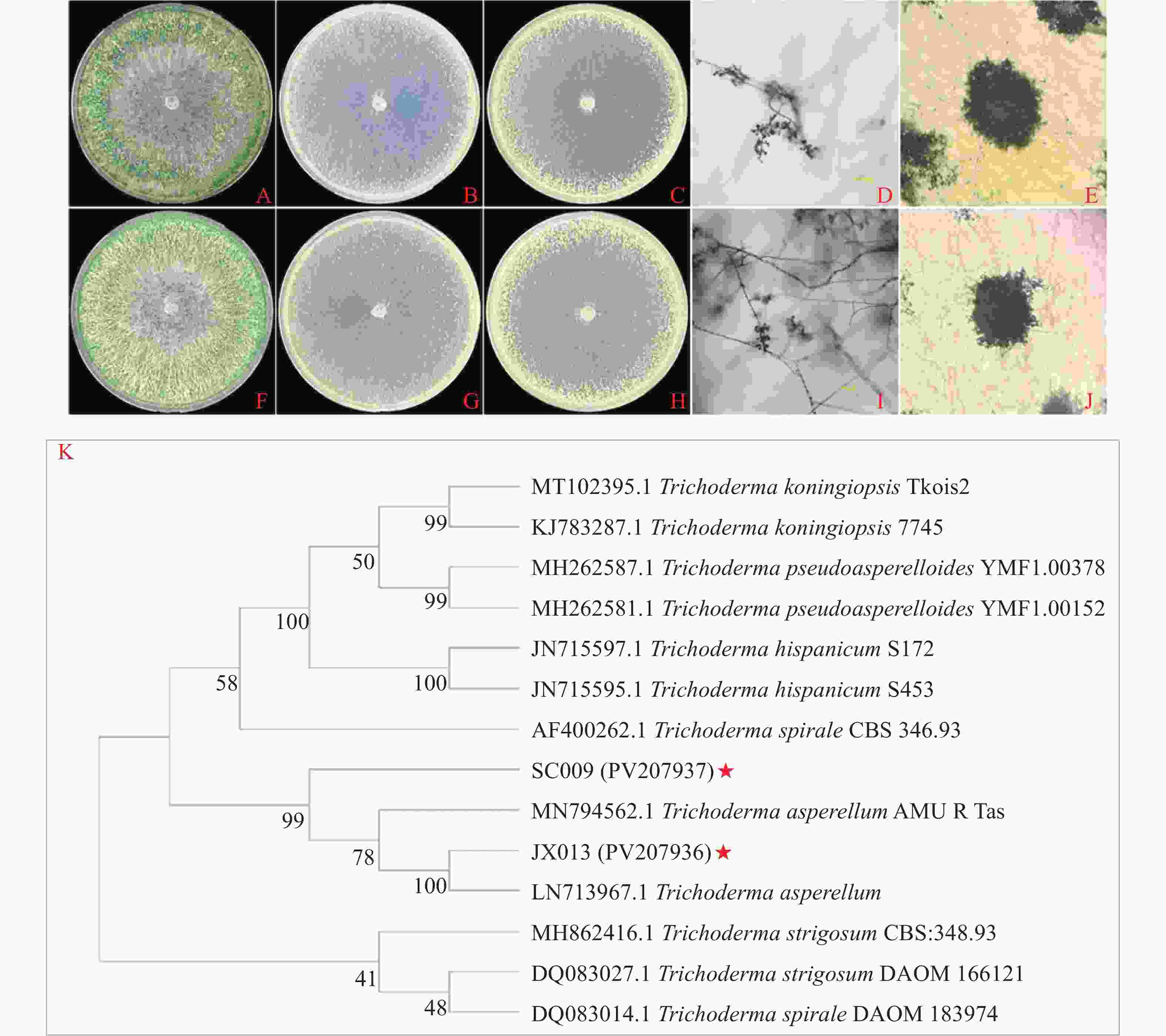
图 5 木霉菌在不同培养基上的形态特征及分子鉴定
Figure 5. Morphological characteristics and molecular identification of Trichoderma on different media
将测序结果在NCBI进行BLAST,结果显示JX013的内转录间隔区序列(ITS)和延伸因子序列(EF-1α)与棘孢木霉(LN713967.1、MN794562.1)具有100%的相似度,从NCBI数据库下载同时具有ITS、EF-1α片段序列的木霉菌序列;SC009的ITS和EF-1α序列与棘孢木霉(MN794562.1)具有100%的相似度,从比对结果中下载同时具有ITS、EF-1α片段序列的木霉菌序列;将获得序列整合构建基于ITS、EF-1α双基因系统发育树,结果表明JX013与棘孢木霉(LN713967.1)菌株聚在同一分枝,与棘孢木霉AMU R Tas(MN794562.1)聚在同一枝上,SC009与棘孢木霉AMU R Tas(MN794562.1)、棘孢木霉(LN713967.1)和JX013菌株聚在同一分枝(图5-K)。通过形态学和系统发育树分析鉴定JX013(PV207936)和SC009(PV207937)均为棘孢木霉。
-
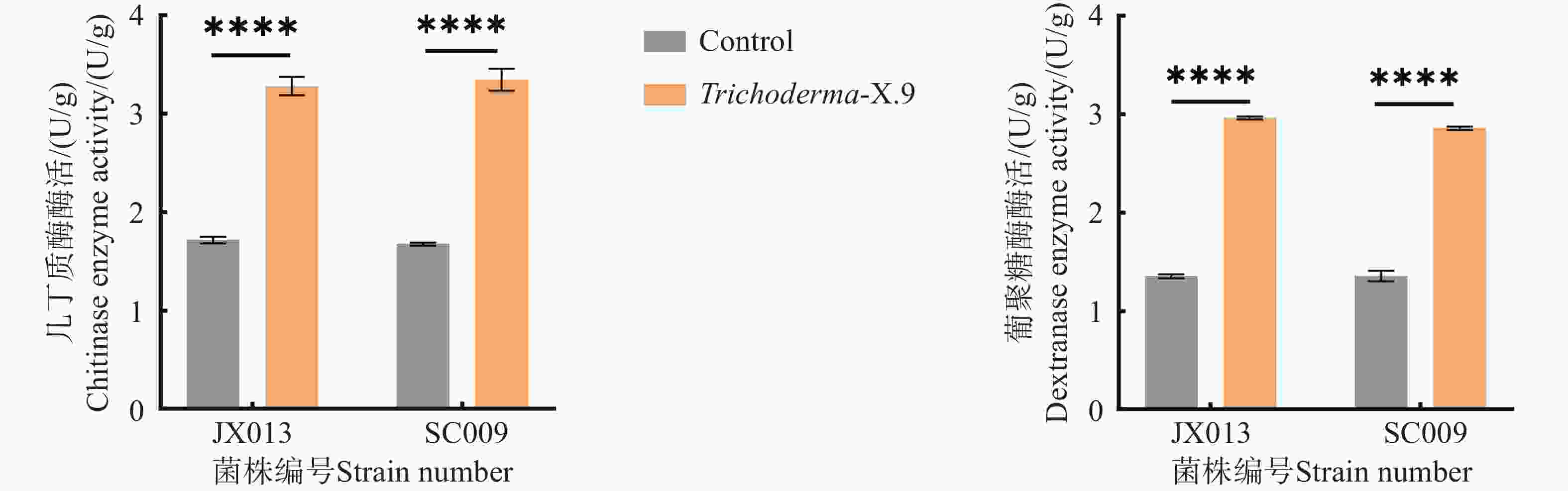
本研究通过分光光度法测定棘孢木霉JX013和SC009菌株分泌的几丁质酶及葡聚糖活性水平,分析其拮抗病原菌过程中的表达情况。如图6所示,1)未处理的JX013菌株葡聚糖酶活力低于JX013与病原菌作用的酶活;2)SC009菌株与病原菌作用后葡聚糖酶酶活力比未处理较高; 3)两者均存在显著差异。在与病原菌作用的情况下,JX013菌株和SC009菌株产几丁质酶的能力高于未做处理的单菌株酶活。这表明木霉菌在拮抗病原菌过程中会产生更多的细胞壁降解酶抑制病原菌生长。
-
目前国内外对血叶兰的研究主要集中在化学成分、新品种的培育和药用价值研究,对病害防治的研究较少[2,33 − 35]。木霉菌作为重要的生防真菌,能够通过重寄生作用、拮抗作用等机制减少病害的发生[36]。哈茨木霉通过抑制病原菌生长和诱导植物抗病生理指标活性来防治黄芪根腐病[37]。长枝木霉菌拮抗立枯丝核菌具有显著的抑制效果,主要通过对病原菌重寄生和其代谢产物发挥拮抗作用[38]。棘孢木霉的生防机制与其次生代谢产物密切相关,例如棘孢木霉产生的次级代谢物苯乙醇对尖孢镰刀菌具有明显抑制作用[39]。此外,木霉菌在产生拮抗物质的同时也产生各种降解细胞壁的胞外酶来抑制土传植物病原菌的生长和萌发[40]。木霉菌与病原菌拮抗过程中能产生乙烯、酮类等挥发性代谢物和几丁质酶、β-1,3-葡聚糖酶等非挥发性代谢产物[41 − 42]。Howell等[43]研究表明哈茨木霉分泌的胶霉毒素与几丁质酶协同作用能很好抑制病原菌孢子萌发。
本研究分离获得致病效果较强的病原菌X.9,该病原菌会导致血叶兰茎基部腐烂,经鉴定确认该病原菌X.9为尖孢镰刀菌。为了探究生防木霉菌对X.9尖孢镰刀菌的生防效果,选取35株木霉菌与X.9菌株平板对峙,17株木霉菌对X.9菌株的抑菌率在75%以上,并且能完全覆盖病原菌菌落。17株木霉菌中JX013和SC009菌株非挥发性代谢物对病原菌有显著的抑制效果,而挥发性代谢物抑菌效果较差;除去该部分实验结果,说明JX013和SC009菌株这两株木霉菌的非代谢产物有效抑制X.9菌株菌丝生长,但具体的代谢化合物成分还需要进一步探究。经鉴定确认JX013和SC009均为棘孢木霉。JX013和SC009寄生病原菌过程中可能会释放一定的细胞壁降解酶降解病原菌菌丝;棘孢木霉JX013和SC009与X.9菌株对峙过程中几丁质酶和β-1,3-葡聚糖酶的酶活力显著提高,这说明在木霉菌与病原菌作用过程中,除了非挥发性代谢物起到一定抑菌作用外,病原菌也通过刺激木霉菌分泌更多的细胞壁降解酶降解病原菌菌丝,从而有效抑制病原菌的生长,具体应用生防效果还需设置田间试验进一步探究。综上所述,本研究团队发现棘孢木霉JX013和SC009对血叶兰茎腐病病原尖孢镰刀菌X.9菌株具有显著的抑制效果,通过棘孢木霉的代谢产物和细胞壁降解酶抑制尖孢镰刀菌X.9生长。这为后续研究血叶兰茎腐病的防治提供理论基础。
Screening of antagonistic Trichoderma against stem rot pathogen in Ludisia discolor(Ker-Gawl.)A.Rich and evaluation of its biocontrol potential
-
摘要: 茎腐病会导致血叶兰植株的茎基部大面积腐烂,影响植株对营养物质的吸收。已有研究结果表明,木霉菌能有效抑制多种病原菌,是一种重要的生防真菌。本研究从血叶兰茎基部发病组织中分离得到1株致病效果较强的病原菌X.9,经形态学和分子生物学鉴定为尖孢镰刀菌。木霉菌与尖孢镰刀菌X.9平板对峙的结果表明,17株木霉菌能完全覆盖尖孢镰刀菌X.9且抑制率均达75%以上;进一步观察17株木霉菌非挥发代谢产物对X.9的抑菌作用,木霉菌株 JX013和SC009抑菌效果较好,抑菌率分别为41.27%和41.26%,经形态学和分子生物学鉴定JX013和SC009均为棘孢木霉。JX013和SC009与X.9作用后几丁质酶和葡聚糖酶都显著提高,表明木霉菌与病原菌作用时会分泌更多的细胞壁降解酶降解病原菌菌丝,从而抑制病原菌的生长。Abstract: Stem rot causes extensive rotting at the base of the stems of bloodleaf orchid plants, affecting nutrient uptake. Studies have shown that Trichoderma can effectively inhibit a wide range of pathogenic bacteria and is an important biocontrol fungus. A strain of pathogen X.9 with the strongest pathogenic effect was isolated from the diseased tissues at the stem base of Ludisia discolor(Ker-Gawl.)A.Rich, which was identified as Fusarium oxysporum by morphology and molecular biology. The plate confrontation assay between Trichoderma strains and the F. oxysporum X.9 showed that 17 Trichoderma strains could completely cover F. oxysporum X.9 an inhibition rate of more than 75%. Further observation of the inhibition effect of 17 strains of Trichoderma non-volatile metabolites on X.9 showed that JX013 and SC009 had better inhibition effect, with their inhibition rates being 41.27% and 41.26%, respectively. Through morphological and molecular biological identification, both JX013 and SC009 were confirmed to be Trichoderma asperellum. Both JX013 and SC009 showed a significant increase in chitinase and glucanase after interacted with X.9, indicating that Trichoderma secretes more cell wall degrading enzymes to degrade the pathogenic mycelium when interacted with pathogenic bacteria, thus inhibiting the growth of pathogenic bacteria.
-
Key words:
- Ludisia discolor (Ker-Gawl.)A.Rich /
- stem rot /
- Fusarium oxysporum /
- Trichoderma /
- biological control
-
图 2 血叶兰茎腐病病原菌鉴定
A.病原菌X.9在PDA平板上培养5 d菌落形态;B~C. 病原菌X.9小分生孢子和大分生孢子;D. 基于ITS、EF-1α构建的系统发育树
Fig. 2 Identification of stem rot pathogens of L. discolor
A: Colony morphology of pathogen X.9 cultured on PDA plates for 5 d; B~C: Small and large conidia of pathogen X.9; D: phylogenetic tree constructed based on ITS, EF-1α
图 4 非挥发性代谢产物对病原菌X.9的抑制作用
A.非挥发性代谢产物对病原菌X.9的抑制率;B.非挥发性代谢产物对病原菌X.9生长抑制平板结果。不同小写字母表示差异显著(P<0.05)
Fig. 4 Inhibition of pathogenic bacteria X.9 by non-volatile metabolites
A: Inhibition rate of non-volatile metabolites against pathogen X.9; B: Plate results of growth inhibition of pathogen X.9 by non-volatile metabolites. Different lowercase letters indicate significant differences(P<0.05)
图 5 木霉菌在不同培养基上的形态特征及分子鉴定
A~C. JX013在PDA、CMD及SNA平板上培养5 d菌落形态;D~E. JX013分生孢子梗和分生孢子簇;F~H. SC009在PDA、CMD及SNA平板上培养5 d菌落形态;I~J. SC009分生孢子梗和孢子簇;K. JX013和SC009基于ITS和EF-1α建构系统发育树
Fig. 5 Morphological characteristics and molecular identification of Trichoderma on different media
A~C: JX013 colony morphology on PDA, CMD and SNA plates for 5 d; D~E: JX013 conidiophores and cluster of conidia; F~H: SC009 colony morphology on PDA, CMD and SNA plates for 5 d; I~J: SC009 conidiophores and cluster of conidia; K: JX013 and SC009 phylogenetic trees constructed based on ITS and EF-1α.
表 1 35株木霉菌株对病原菌X.9的拮抗作用
Table 1 Antagonistic effect of 35 strains of Trichoderma against pathogen X.9
菌株编号
Strain number抑菌率/%
Inhibition rate/%覆盖度
Degree of coverage菌株编号
Strain number抑菌率/%
Inhibition rate/%覆盖度
Degree of coverageAH003 71.51±4.48gh Ⅱ NM064 77.14±0.73abcdefg Ⅰ AH009 81.29±4.81abc Ⅱ NM065 80.75±0.51abcd Ⅰ FJ002 72.00±1.79fgh Ⅱ NM066 78.39±3.11abcdefg Ⅱ FJ035 76.63±4.70abcdefg Ⅱ NM073 71.24±5.63bc Ⅱ FJ059 76.13±1.08bcdefg Ⅰ NM082 77.48±0.39abcdefg Ⅰ GS013 76.55±0.39abcdefg Ⅰ NM085 77.25±0.67abcdefg Ⅰ HA008 81.04±1.21abc Ⅰ NM102 75.88±5.00bcdefg Ⅱ JX013 80.41±0.49abcd Ⅰ NM103 79.45±0.45abcde Ⅰ LS029-2 75.3±3.86abcdefg Ⅲ NM104 80.54±0.57abcd Ⅰ LS029-3 67.78±4.69h Ⅲ NM110 79.26±5.46abcdef Ⅱ NM042 79.32±3.79abcdef Ⅱ NM142 72.52±2.50cdefgh Ⅲ NM044 82.41±3.08ab Ⅱ NM157 74.28±6.35cdefgh Ⅲ NM046 78.39±0.12abcdefg Ⅰ NM171 82.57±0.44ab Ⅰ NM050 79.77±5.08abcde Ⅱ SC009 75.81±1.16bcdefg Ⅰ NM057 79.14±0.58abcdef Ⅰ XJ002 74.08±1.76bc Ⅲ NM058 83.95±4.71a Ⅱ XJ004 81.06±0.58abc Ⅰ NM061 73.29±2.78cdefgh Ⅲ XJ039 79.9±0.98abcd Ⅰ NM063 80.02±0.67abcd Ⅰ 注:上标中的不同字母在处理之间差异显著(p<0.05)。
Note: Different superscript letters mean significant difference between treatments(p<0.05). -
[1] 南京中医药大学. 中药大辞典(上册)[M]. 上海: 上海科学技术出版社, 2006: 1281-1282. [2] 王云云, 陈兰, 黄梦利, 等. 血叶兰药材质量标准研究[J]. 生物资源, 2021, 43(4): 413 − 418. doi: 10.14188/j.ajsh.2021.04.014 [3] 王泽华, 方香玲. 尖孢镰刀菌遗传多样性研究进展[J]. 中国草地学报, 2021, 43(5): 106 − 114. doi: 10.16742/j.zgcdxb.20200275 [4] 林辉锋, 许克正, 曹奕鸯, 等. 兰花根腐病病原菌分离鉴定及室内药剂筛选[J]. 东南园艺, 2024, 12(5): 350 − 357. doi: 10.20023/j.cnki.2095-5774.2024.05.002 [5] 柳嘉慧, 刘文钰. 兰花茎腐病的发生与防治[J]. 上海蔬菜, 2022(5): 68 − 69. doi: 10.3969/j.issn.1002-1469.2022.05.026 [6] ZIN N A, BADALUDDIN N A. Biological functions of Trichoderma spp. for agriculture applications[J]. Annals of Agricultural Sciences, 2020, 65(2): 168 − 178. doi: 10.1016/j.aoas.2020.09.003 [7] MOHIDDIN F A, KHAN M R, KHAN S M, et al. Why Trichoderma is considered super hero (super fungus) against the evil parasites?[J]. Plant Pathology Journal, 2010, 9(3): 92 − 102. doi: 10.3923/ppj.2010.92.102 [8] SHARMA A, SALWAN R, KAUR R, et al. Characterization and evaluation of bioformulation from antagonistic and flower inducing Trichoderma asperellum isolate UCRD5[J]. Biocatalysis and Agricultural Biotechnology, 2022, 43: 102437. doi: 10.1016/j.bcab.2022.102437 [9] OLOWE O M, NICOLA L, ASEMOLOYE M D, et al. Trichoderma: potential bio-resource for the management of tomato root rot diseases in Africa[J]. Microbiological Research, 2022, 257: 126978. doi: 10.1016/j.micres.2022.126978 [10] YUAN M, ZUO C L, XU W, et al. Transcriptome analysis deciphers Trichoderma koningiopsis C5-9 strategies against plant pathogen Botrytis cinerea[J]. Microbiology Research, 2023, 14(3): 977 − 992. doi: 10.3390/microbiolres14030067 [11] 叶炜, 颜沛沛, 王培育, 等. 金线兰茎腐病拮抗木霉菌鉴定及抑菌和促生效果评价[J]. 福建农业学报, 2024, 39(11): 1256 − 1264. doi: 10.19303/j.issn.1008-0384.2024.11.007 [12] 陈俊生, 汤楷, 刘燕榕, 等. 利用木霉菌对蝴蝶兰白绢病生物防治的初探[J]. 种子科技, 2024, 42(16): 15 − 17. doi: 10.19904/j.cnki.cn14-1160/s.2024.16.005 [13] 魏林, 梁志怀, 吕刚, 等. 哈茨木霉T2-16菌剂对建兰防病及促生长效果的研究[J]. 中国园艺文摘, 2017, 33(2): 45 − 48. doi: 10.3969/j.issn.1672-0873.2017.02.018 [14] ALOMÍA Y A, OTERO J T, JERSÁKOVÁ J, et al. Cultivable fungal community associated with the tropical orchid Dichaea andina[J]. Fungal Ecology, 2022, 57-58: 101158. doi: 10.1016/j.funeco.2022.101158 [15] 杨泽秀, 陈英转, 吴文碟, 等. 血叶兰组培苗与内生真菌共生培养的生长效应研究[J]. 热带林业, 2023, 51(2): 24 − 28. doi: 10.3969/j.issn.1672-0938.2023.02.006 [16] CHUA R W, SONG K P, TING A S Y. Antimicrobial activities and phytochemical screening of endophytic fungi isolated from Cymbidium and Dendrobium orchids[J]. South African Journal of Botany, 2022, 151: 909 − 918. doi: 10.1016/j.sajb.2022.11.015 [17] LEYLAIE S, ZAFARI D. Antiproliferative and antimicrobial activities of secondary metabolites and phylogenetic study of endophytic Trichoderma species from Vinca plants[J]. Frontiers in Microbiology, 2018, 9: 1484. doi: 10.3389/fmicb.2018.01484 [18] 陶新, 夏世斌, 刘秋梅, 等. 甘蔗黑穗病的微生物防治研究进展[J]. 应用生态学报, 2023, 34(3): 846 − 852. doi: 10.13287/j.1001-9332.202303.029 [19] HARMAN G E, HOWELL C R, VITERBO A, et al. Trichoderma species—opportunistic, avirulent plant symbionts[J]. Nature Reviews Microbiology, 2004, 2(1): 43 − 56. doi: 10.1038/nrmicro797 [20] 曹秋林, 李菁菁, 廉华, 等. 防治花生白绢病木霉菌的筛选及生防特性研究[J/OL]. 中国油料作物学报, (2024-12-16)[2025-04-30]. https://doi.org/10.19802/j.issn.1007-9084.2024175. [21] OSZAKO T, VOITKA D, STOCKI M, et al. Trichoderma asperellum efficiently protects Quercus robur leaves against Erysiphe alphitoides[J]. European Journal of Plant Pathology, 2021, 159(2): 295 − 308. doi: 10.1007/s10658-020-02162-y [22] GAJERA H P, BAMBHAROLIA R P, PATEL S V, et al. Antagonism of Trichoderma spp. against Macrophomina phaseolina: evaluation of coiling and cell wall degrading enzymatic activities[J]. Journal of Plant Pathology & Microbiology, 2012, 3(7): 1000149. doi: 10.4172/2157-7471.1000149 [23] TSENG S C, LIU S Y, YANG H H, et al. Proteomic study of biocontrol mechanisms of Trichoderma harzianum ETS 323 in response to Rhizoctonia solani[J]. Journal of Agricultural and Food Chemistry, 2008, 56(16): 6914 − 6922. doi: 10.1021/jf703626j [24] LOC N H, HUY N D, QUANG H T, et al. Characterisation and antifungal activity of extracellular chitinase from a biocontrol fungus, Trichoderma asperellum PQ34[J]. Mycology, 2020, 11(1): 38 − 48. doi: 10.1080/21501203.2019.1703839 [25] WHITE T J, BRUNS T, LEE S, et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[M]//INNIS M A, GELFAND D H, SNINSKY J J, et al. PCR protocols: a guide to methods and applications. San Diego: Academic Press, 1990: 315 − 322. [26] XIA J W, SANDOVAL-DENIS M, CROUS P W, et al. Numbers to names-restyling the Fusarium incarnatum-equiseti species complex[J]. Persoonia-Molecular Phylogeny and Evolution of Fungi, 2019, 43(1): 186 − 221. doi: 10.3767/persoonia.2019.43.05 [27] 索欣, 牛启尘, 郭铖, 等. 新型苜蓿镰刀菌根腐病病原菌FIESC分离及菌株生物学特性测定[J]. 草地学报, 2024, 32(5): 1327 − 1338. doi: 10.11733/j.issn.1007-0435.2024.05.003 [28] 陈书华, 李梅, 蒋细良, 等. 防治人参锈腐病木霉菌的筛选及防治效果[J]. 中国生物防治学报, 2016, 32(2): 265 − 269. doi: 10.16409/j.cnki.2095-039x.2016.02.019 [29] 危潇, 黎妍妍, 姚经武, 等. 哈茨木霉WF2菌株鉴定及对烟草黑胫病的防效[J]. 中南农业科技, 2023, 44(11): 12 − 15. doi: 10.3969/j.issn.1007-273X.2023.11.003 [30] 战鑫, 台莲梅, 刘铜, 等. 2种木霉菌对寒地水稻立枯病病原菌的拮抗作用研究[J]. 中国稻米, 2020, 26(4): 96 − 99. doi: 10.3969/j.issn.1006-8082.2020.04.022 [31] 杨合同. 木霉分类与鉴定[M]. 北京: 中国大地出版社, 2009: 65. [32] 王拱辰, 郑重, 叶琪明, 等. 常见镰刀菌鉴定指南[M]. 北京: 中国农业科技出版社, 1996: 1 − 45. [33] 沈颖, 陈惠琴, 吴妃, 等. 血叶兰化学成分及其生物活性研究[J]. 广西植物, 2024, 44(12): 2279 − 2290. doi: 10.11931/guihaia.gxzw202308056 [34] 邓美红, 谢利, 杨镇明, 等. 血叶兰新品种‘金银脉’[J]. 园艺学报, 2024, 51(S1): 169 − 170. doi: 10.16420/j.issn.0513-353x.2023-1006 [35] 张汝国, 王小果. 血叶兰的开发利用研究概况[J]. 中国民族民间医药, 2018, 27(16): 44 − 46. doi: 10.3969/j.issn.1007-8517.2018.16.zgmzmjyyzz201816015 [36] 阮盈盈, 刘峰. 木霉菌生物防治作用机制与应用研究进展[J]. 浙江农业科学, 2020, 61(11): 2290 − 2294. doi: 10.16178/j.issn.0528-9017.20201130 [37] 牛景萍, 燕翔, 白雨果, 等. 哈茨木霉T9131鉴定及其拮抗病原菌和诱导黄芪抗病的作用分析[J/OL]. 广西植物, (2025-02-20)[2025-04-30]. http://kns.cnki.net/kcms/detail/45.1134.Q.20250219.1528.008.html. [38] 薛德星, 李美, 高兴祥, 等. 生防菌棘孢木霉的分离鉴定及生物学特性研究[J]. 山东农业科学, 2023, 55(10): 118 − 123. doi: 10.14083/j.issn.1001-4942.2023.10.016 [39] TOMAH A A, ABD ALAMER I S, LI B, et al. A new species of Trichoderma and gliotoxin role: a new observation in enhancing biocontrol potential of T. virens against Phytophthora capsici on chili pepper[J]. Biological Control, 2020, 145: 104261. doi: 10.1016/j.biocontrol.2020.104261 [40] 梁志怀, 魏林, 罗赫荣, 等. 哈茨木霉发酵产物对豇豆萌发及苗期生长的影响[J]. 湖南农业科学, 2004(1): 18 − 20. doi: 10.3969/j.issn.1006-060X.2004.01.007 [41] HARMAN G E, KUBICEK C P. Secondary metabolism in Trichoderma and Gliocladium[M]//HARMAN G E, KUBICEK C P. Trichoderma and gliocladium. Volume 1: Basic biology, taxonomy and genetics. London: CRC Press, 1998: 139 − 191. [42] LE DOAN T, EL HAJJI M, REBUFFAT S, et al. Fluorescence studies of the interaction of trichorzianine A IIIc with model membranes[J]. Biochimica et Biophysica Acta (BBA)-Biomembranes, 1986, 858(1): 1 − 5. doi: 10.1016/0005-2736(86)90284-1 [43] HOWELL C R. Mechanisms employed by Trichoderma species in the biological control of plant diseases: the history and evolution of current concepts[J]. Plant Disease, 2003, 87(1): 4 − 10. doi: 10.1094/PDIS.2003.87.1.4 -

 点击查看大图
点击查看大图
计量
- 文章访问数: 636
- HTML全文浏览量: 423
- 被引次数: 0



 下载:
下载: