-
调查结果表明,我国农业土壤的镉(Cd)含量在过去一段时间内呈急剧增加态势[1-2]。由于镉的不可降解性,土壤镉污染已成为严重的农业污染问题,并威胁着人们的身体健康,急需高效的修复措施[3]。在土壤重金属污染修复策略中,生物修复被广泛关注。其中,微生物修复通过土壤中重金属的吸附富集,溶解沉淀以及氧化还原等机理,降低或去除土壤中过量的重金属[4]。不同的微生物可以通过不同的机制来修复土壤镉污染,如吸收和螯合[5]、胞内积累[6]以及矿化[7]等。能修复镉污染的微生物主要包括细菌、真菌与藻类。土壤细菌也可以通过改变土壤环境条件,产生促进植物生长物质等多种方式以提高土壤重金属迁移率和生物利用度[8]。在高镉的环境中,通过加入可高抗镉并具有镉吸附能力的细菌可修复土壤的镉污染[9]。因此,获得高抗镉菌是利用细菌修复镉污染土壤的前提。但大多已报道的抗性菌株并没有表现出特别高的镉抵抗能力[10-11]。此外,多数菌株只对少数重金属具有抗性[10],而土壤重金属污染多为多金属污染[12],这导致细菌在重金属环境中难以生存或繁殖,因此很难达到理想的修复效果。笔者所在实验室前期也从海南昌江矿区分离获得抗镉、铜、锌、锰、钴等多种重金属的阴沟肠杆菌Cu6[13],并通过驯化获得了其他重金属抗性未发生显著变化而抗镉能力显著增强的菌株LPY6[14]。本研究以粮食作物小麦(Triticum aestivum )为植物材料,拟分析LPY6能否缓解镉对小麦生长的抑制作用以及可能的机制,旨在为进一步开发镉污染修复工程菌提供依据。
-
供试菌株为笔者所在实验室前期从海南昌江石碌矿区分离出的阴沟肠杆菌Cu6 [13]以及驯化后得到的高抗镉菌株LPY6[14]。
-
盐酸(HCl,优级纯)、硝酸(HNO3,优级纯)、水合氯化镉(CdCl2·2.5H2O)、硫酸铜(CuSO4)、硫酸铅(PbSO4)和氯化锰(MnCl2)、过氧化氢(H2O2)、二乙三胺五乙酸(DTPA)、三乙醇胺(TEA)和氯化钙(CaCl2)。所使用试剂均购自广州化学试剂公司。
-
Luria-Bertani (LB)培养基(液体): 10 g Tryptone ,10 g NaCl ,5 g Yeast Extract,蒸馏水1 L。LB固体培养基: 液体LB+1.5%琼脂。含金属离子的LB培养基加相应浓度的各种金属。MS培养基为实验室购买的粉末状成品,使用时可以直接溶于超纯水中,本实验使用1/4含量的MS液体培养基。
-
供试植株为小麦(T. aestivum ),品种为‘铜麦6号’,购于陕西大唐种业股份有限公司。
-
细菌镉最低抑制浓度(抑制细菌生长的最低镉浓度)和最大耐受浓度(仍有部分细菌生长的最大镉浓度)的测定。Cd2+、Pb2+、Cu2+和Mn2+的质量浓度均设置为0、300、500、1 000、2 000、3 000、5 000 mg·L−1,然后将LPY6菌株分别接种到含各浓度不同金属的LB液体(30 ℃,180 r·min−1)和LB固体培养基(30 ℃)中,每组处理设置3个重复,观察并记录菌株生长情况。
-
将滤纸放置在培养皿中,添加20 mL含不同浓度(0、50、100、200、300、500 mg·L−1)CdCl2·2.5H2O溶液到培养皿中,待滤纸完全浸湿后,选取较为饱满且大小较一致的小麦种子放置于滤纸上(每皿放12粒)。盖上盖子,在光照培养箱里静置3~5 d (28 ℃,16 h光照、8 h黑暗,80%湿度),以伸出种皮的胚根等于或长于种子长度为标准,确定计算种子发芽率。然后,以显著抑制种子萌发的镉浓度来处理种子,分析LPY6是否有缓解镉对种子萌发的影响,设置4个处理(每处理3个重复):CK(对照:1/4 MS培养基)、Cd、Cd+Cu6、Cd+LPY6(CdCl2·2.5H2O:500 mg·L−1,菌液浓度:OD600=0.1),进行萌发率统计(种子发芽率=种子发芽数/种子总数×100%)。
-
首先检测小麦种子在土壤中的耐镉能力。采用营养土与红土混合土壤(V营养土︰V红土= 1︰2),干燥一段时间(室温、通风、30 d)待土壤平衡稳定后,分装至聚乙烯塑料盆(7 cm×7 cm×8 cm),每盆约110 g,设置土壤镉含量为0、360、720、1 000、1 500、1 800、2 200、2 500 mg·kg−1 ,每处理3个重复。挑取颗粒饱满小麦种子进行育苗,4 d后移栽长势一致的小麦幼苗于处理后的土壤中,每盆6棵(14 h光照、8 h黑暗,26 ℃)。每4天观察记录植物苗的生长状况,直至16 d。小麦生长在含有不同镉含量的土壤中。然后以此镉含量(1 000、1 500 mg·kg−1)来分析LPY6是否有缓解镉对小麦的毒害作用,设置9个处理(每处理3个重复):镉和细菌2个因素,每个因素3个水平(镉浓度:0、1 000、1 500 mg·kg−1;细菌:不加菌、加Cu6、加LPY6),完全随机设计。菌液终浓度OD600=0.1。观察并统计小麦生长状况。
-
按步骤1.7处理,待小麦生长至14 d后,小心分别取出各处理的小麦苗,将其根部冲洗干净,然后擦拭干净,进行称重、记录鲜质量。测量株高,根长以及根毛数并记录。然后将小麦苗整株放入65 ℃烘箱,3 d后取出(此时已完全烘干),记录其干质量。
-
采用原子吸收光谱法测定[15]。将上述烘干的小麦苗充分研磨粉碎,每个处理称取0.1 g置于试管中,分别加入1 mL HNO3和0.5 mL的H2O2,设空白对照。用安东帕Multiwave 7000 超级微波消解系统消解(海南大学分析测试中心)。消解样品转入15 mL离心管,分别加超纯水定容至10 mL,使用原子吸收光谱仪(海南大学分析测试中心)测定镉含量。
-
LPY6单菌落接种到LB液体培养基培养(30 ℃,180 r·min−1),16 h后按1∶1 000(体积比)的比例转接于新鲜预热的LB培养基中,培养至对数生长期(OD600=0.8),制备OD600=2.0的菌悬液。以2 %的接种量将LPY6菌液接种到含不同质量浓度镉(0、150、250、500、1 250、1 500 mg·L−1)的液体培养基中,30 ℃、180 r·min−1培养48 h,以不接菌空白培养基为对照,每组处理3个重复,每隔12 h取菌液,菌液先测OD600值,然后进行离心(10 000 r·min−1, 5 min),使用原子吸收光谱仪对上清液中的镉含量进行测定。计算LPY6菌降低游离镉的能力:
$$ q=(C_{1}-C_{2})/ C_{1}×100 \text{%}\text{,} $$ 式中:q 为吸附率;C1为空白对照组上清液中镉的浓度;C2菌处理组上清液中镉的浓度;单位:mg·L−1。
-
采取DTPA作提取剂用原子吸收光谱法测定土壤中有效态镉[15]。设置土壤镉含量为0、360、720、1 000、1 500 mg·kg−1。设置4个处理:CK(对照,不含镉),只有镉,镉加Cu6,镉加LPY6分别处理土壤。每个处理设置3个重复。17 d后,将处理的土壤风干后过筛(2 mm)。1 g土壤加入25 mL DTPA提取剂,放入培养箱(25 ℃,180 r·min−1), 2 h后取样,上清液过滤(0.22 μm)后,加1% HCl定容至10 mL,火焰法测得样品的镉含量。以DTPA为对照,土壤中有效态镉含量以质量分数w表示:
$$ w=\left(C-C_0\right) \times V_2 \times V / m \times V_1, $$ 式中:C为镉校准曲线上查的质量浓度(mg·L−1);C0为空白对照浓度;V2为定容体积(mL);V为样品所使用的提取液体积;V1为提取液体积; m:为试样质量(g)。
-
采用 GraphPad Prism 9进行数据分析与作图,实验重复3次,计算平均值±标准差。
-
镉(CdCl2·2.5H2O)、铜(CuSO4)、铅(PbSO4)和锰(MnCl2)的抗性实验表明,菌株LPY6对4种金属均具有较强抗性(耐性)。LPY6对 Cd2+的最小抑制质量浓度为2 500 mg·L−1,Cu2+为400 mg·L−1,Mn2+为500 mg·L−1。LPY6对Cd2+的最大耐受质量浓度为3 000 mg·L−1,Cu2+为 450 mg·L−1,Mn2+为2 000 mg·L−1。实验中发现,质量浓度高于1 000 mg·L−1的含铅培养液容易生成白色沉淀,所以无法确定Pb2+对LPY6的最小抑制浓度以及LPY6对Pb2+的最大耐受浓度,但菌株LPY6对铅有较高抗性(>1 000 mg·L−1)。
-
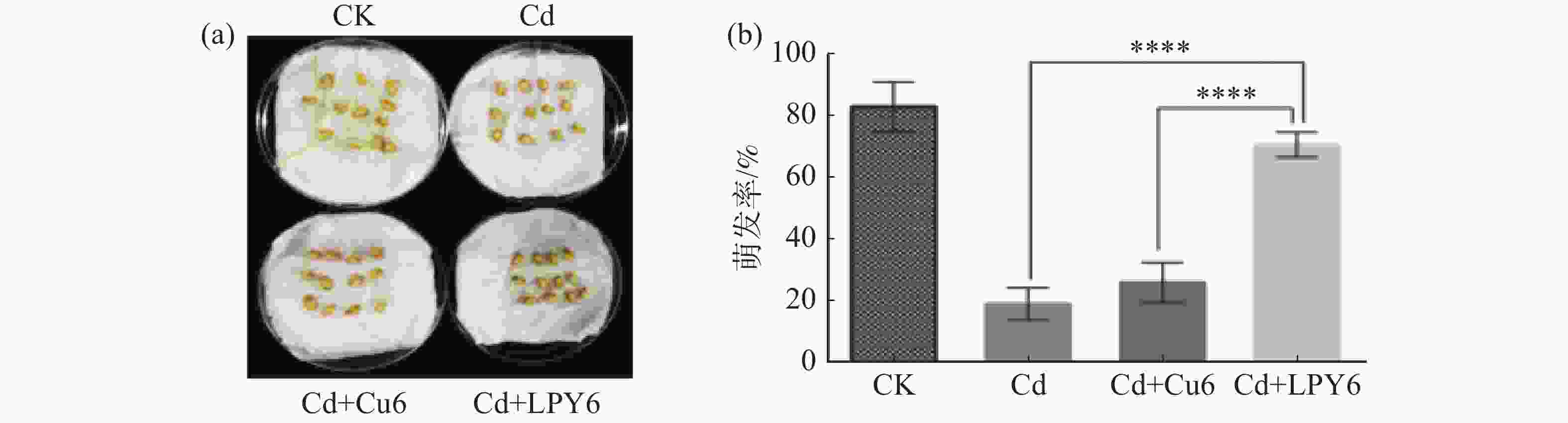
为分析LPY6是否具有缓解镉污染的潜力,首先找出抑制小麦种子发芽的临界CdCl2·2.5H2O质量浓度为500 mg·L−1后,选用此浓度进行种子萌发实验。如图1所示,小麦种子在无镉条件下,其萌发率约为80%;单独添加500 mg·L−1 CdCl2·2.5H2O时,种子萌发率显著被抑制;加镉同时添加Cu6时,萌发率没有明显提高;但同时添加LPY6和镉时,萌发率恢复到65%左右,只是萌发速度比对照要慢,结果说明,LPY6具有一定的缓解镉抑制小麦种子萌发的能力。
-
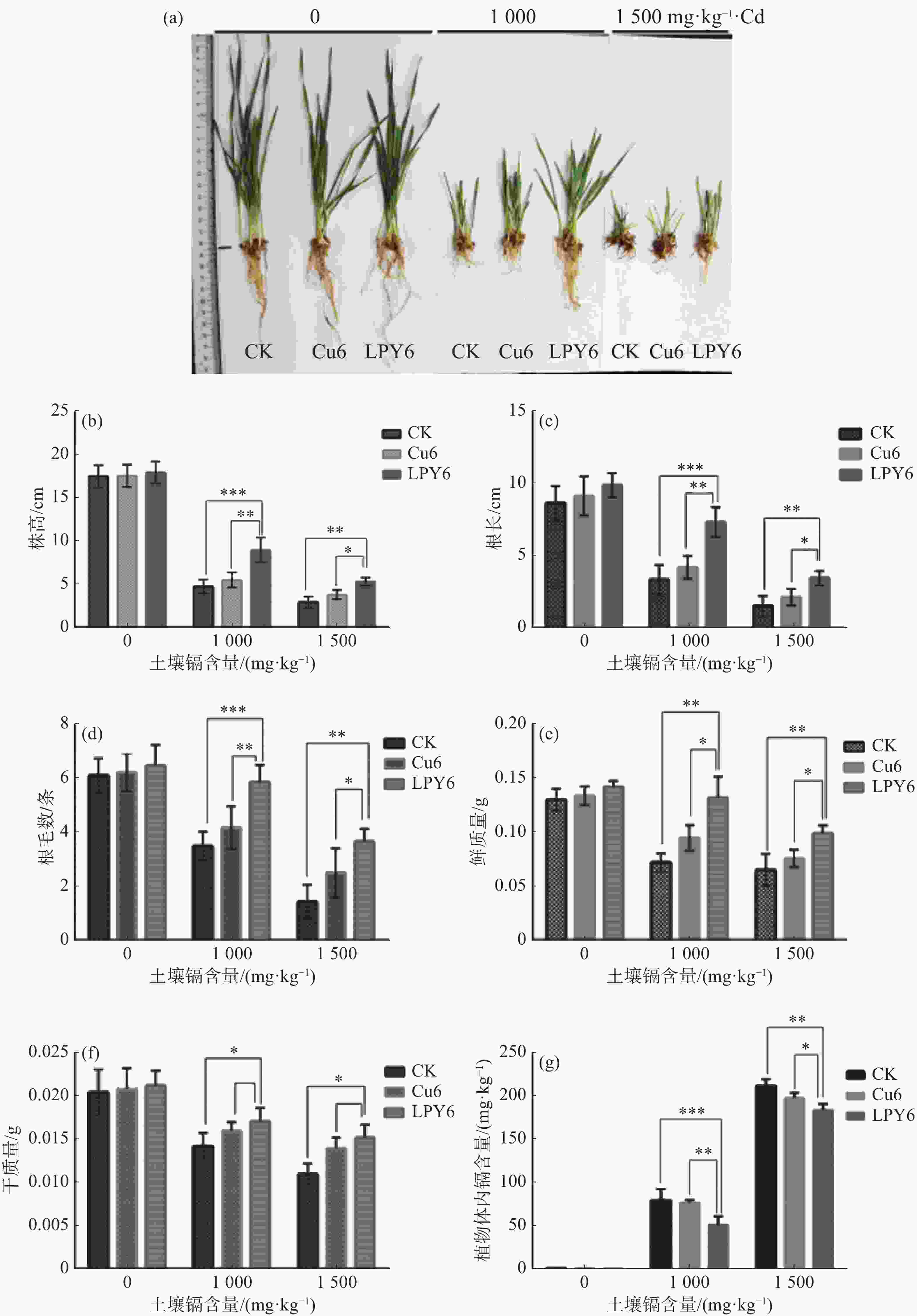
用盆栽实验来分析LPY6缓解镉毒害小麦的作用。同萌发实验一样,首先测定盆栽条件下显著抑制小麦生长(株高、叶长和叶色)的土壤镉含量为1 000 mg·kg−1,导致小麦枯黄死亡的土壤镉含量为1 500 mg·kg−1。因此选择1 000和1 500 mg·kg−1作为后续实验。如图2所示,镉处理土壤中小麦幼苗的生长明显受到抑制,LPY6缓解了镉对小麦幼苗生长的抑制作用。当土壤镉含量为1 000 mg·kg−1时,解毒效果较好,但Cu6没有明显降低镉对小麦幼苗生长抑制的作用(图2-a)。当土壤镉含量为1 000和1 500 mg·kg−1时,LPY6对小麦的减毒效果如下:(1) LPY6增加了小麦株高(图2-b),根长(图2-c)以及根毛数(图2-d),且当土壤镉含量为1 000 mg·kg−1时,效果比较明显。(2)LPY6明显增加了小麦的鲜质量(图2-e)与干质量(图2-f),且在土壤镉含量为1 000 mg·kg−1时效果较好。(3)LPY6降低了小麦幼苗的镉含量(图2-g),当土壤镉含量为1 000 mg·kg−1时,对小麦的减毒效果较好。
-
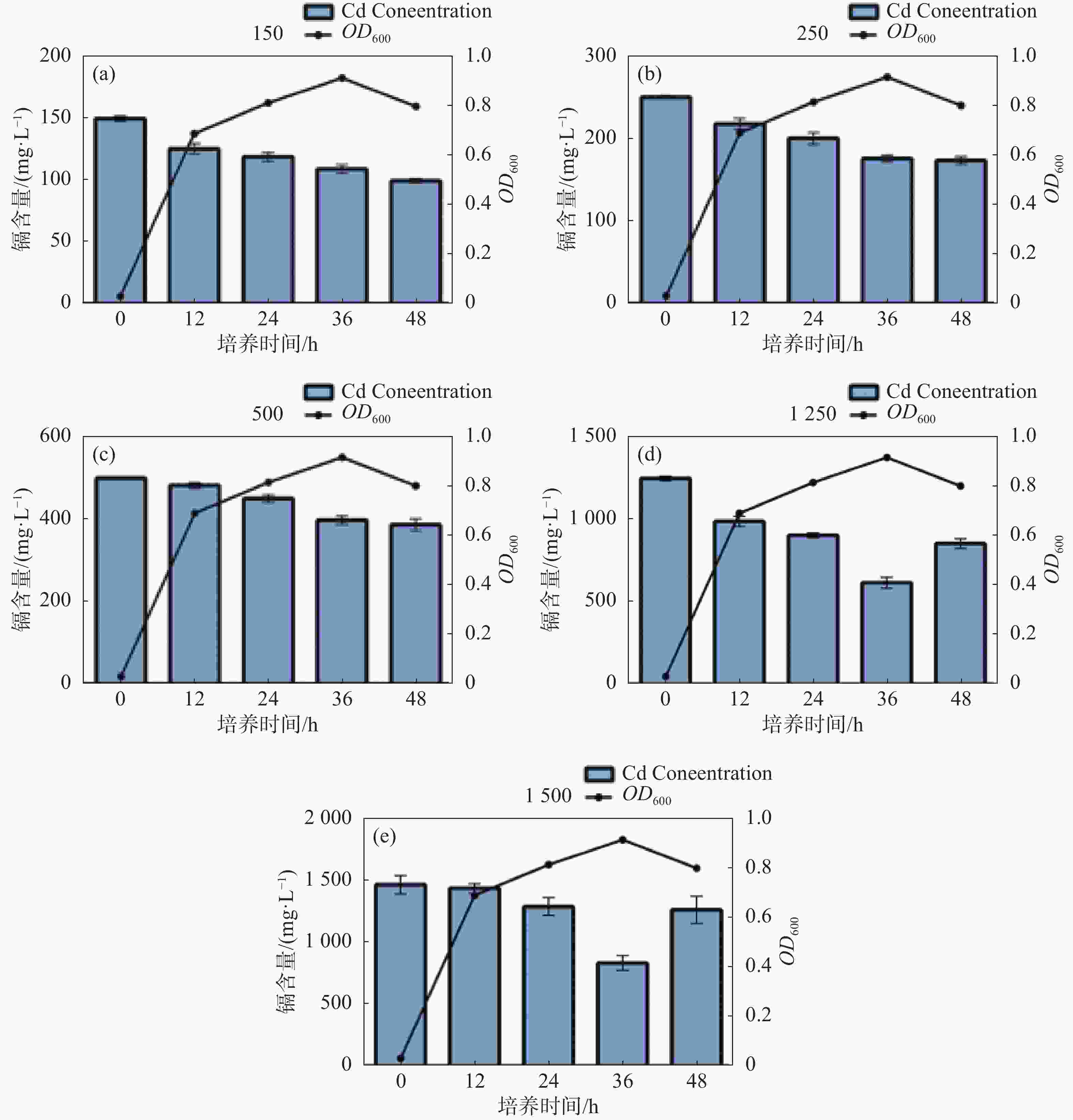
具重金属抗性的微生物一般对此金属有吸附能力,能够通过细胞膜官能团将重金属离子吸附在细胞表面或通过一系列生命活动将重金属离子富集在细胞内[16]。如图3所示,具有高镉抗性的LPY6能降低培养基中游离镉的浓度。在含150 mg·L−1 镉的LB培养液中,镉对LPY6生长抑制作用弱,LPY6生长良好,在48 h时,LPY6生长处于稳定期,培养液中镉含量降至100 mg·L−1,降低率为33%(图3 -a)。在含250 mg·L−1 镉的LB培养液中,LPY6生长依旧没有受到显著抑制,生长良好;在48 h时,LPY6生长处于稳定期,培养液中镉含量降至180 mg·L−1,降低率为28%(图3-b)。在含500 mg·L−1镉的LB培养液中,镉对LPY6的生长表现出抑制作用,在48 h时,LPY6生长处于稳定期,培养液中镉含量降至385 mg·L−1,降低率为23%(图3-c)。在含1 250 mg·L−1镉的LB培养液中,镉对LPY6生长有抑制作用,在36 h时OD值最大,培养液中镉含量降低至633 mg·L−1,降低率为49%(图3-d)。在含1 500 mg·L−1 镉的LB培养液中,镉对LPY6的生长抑制作用比较明显,在36 h时OD值最大,培养液中镉含量降低至930 mg·L−1,降低率为38%(图3-e)。这说明LPY6可以减少培养基中游离镉的含量。
-
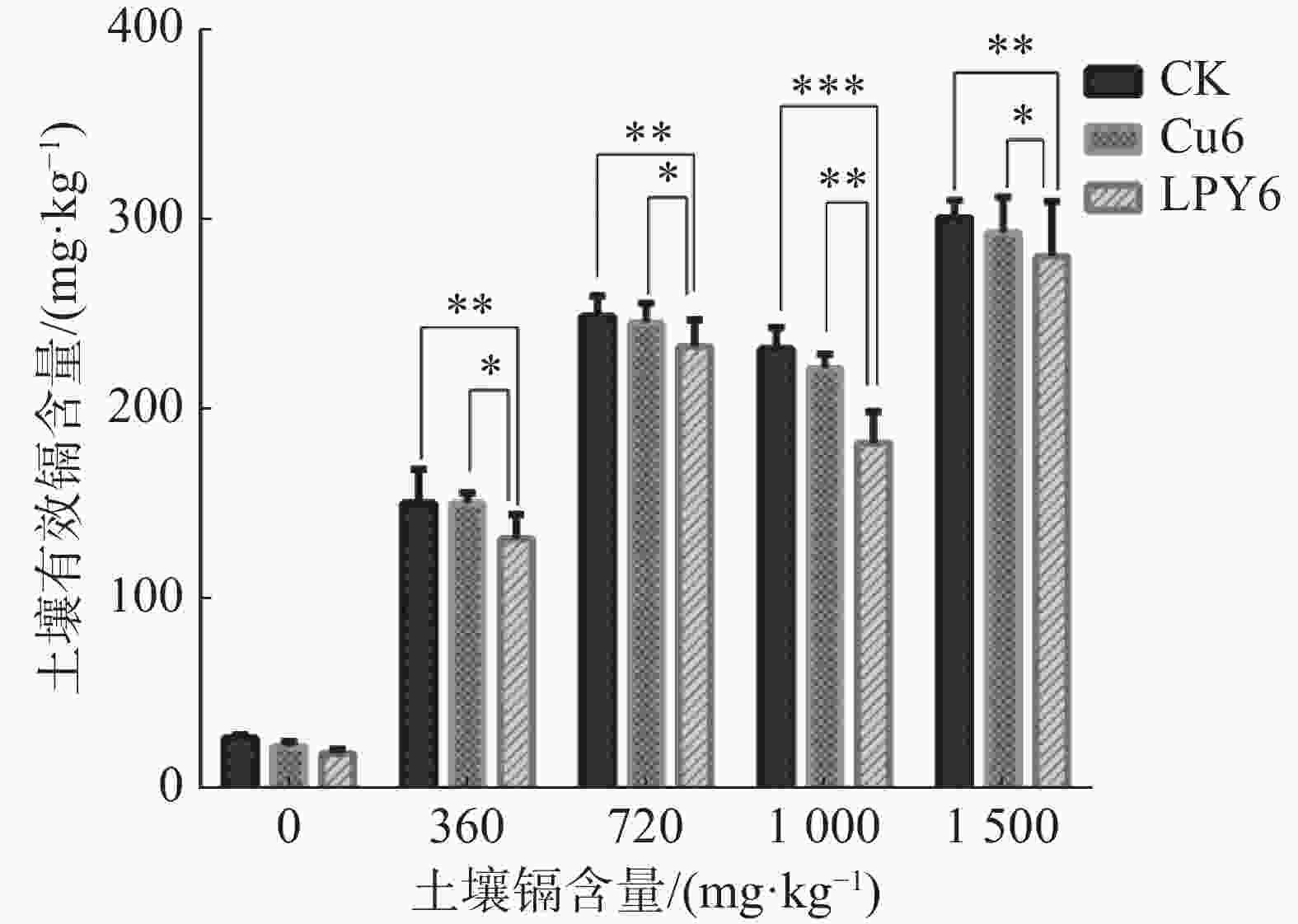
小麦盆栽实验测定小麦种子在土壤中的耐镉能力为1 000 mg·kg−1。因此笔者分析了土壤镉含量为360 、720、1 000和1 500 mg·kg−1时LPY6对土壤中有效镉的影响。如图4所示,在以上镉含量的土壤中,外施LPY6均可以使土壤中有效镉含量减少,但Cu6几乎没有降低土壤有效镉的能力。
-
本研究分析了LPY6在小麦上的作用,发现其具有缓解镉对小麦萌发和生长抑制作用的能力,不仅可以增加镉环境中小麦的株高、鲜质量和干质量,还能增加根长和根的数目。更重要的是,LPY6能降低植物体内镉的含量,说明LPY6具有直接或间接抑制镉进入植物体内的作用。产生这种作用的原因可能是LPY6降低了土壤中可利用的镉含量或降低了植物吸收镉的能力。为此笔者分析了LPY6是否对其生存环境中自由镉(可利用镉)的含量有影响。在液体培养基中,LPY6能够显著降低游离镉的浓度,表明其可能具有高效的镉吸附、沉淀或吸收转运能力。在土壤中,LPY6同样可以显著减少有效镉的含量。这可能是LPY6缓解镉毒害作用的原因。但LPY6是通过吸附、沉淀还是吸收作用来降低环境中有效镉的浓度还不清楚。在实验过程中,没有发现LPY6有促进明显可见的沉淀形成的能力,通过沉淀作用来降低环境有效镉浓度的可能性不大。在环境中溶液只有水时,菌株LPY6也能缓解镉对小麦种子萌发的抑制作用。因此,LPY6也可能通过改变根际环境来降低植物吸收镉的能力[17]。
综上所述,菌株LPY6很有可能通过吸附或内吸作用降低环境中可利用镉的含量来缓解镉对植物生长的毒害作用,也可能通过改变植物根际环境来降低其镉吸收能力,保护植物在高镉环境中的生长,但具体机制还需要进一步研究。虽然LPY6离应用还有很多问题要解决,但是本研究发现其具有在土壤中缓解镉对植物的毒害作用,表明其可能具有镉污染修复的潜力,为进一步开发高效的修复工程菌奠定了基础。
Effect of Enterobacter Cloacae LPY6 on alleviation of the toxicity of cadmium to wheat growth
-
摘要: 为了分析从阴沟肠杆菌Cu6驯化获得的高镉抗性菌株LPY6在镉(Cd)修复中的潜力和机制,为镉污染修复工程菌的开发提供依据,以小麦(Triticum aestivum )为材料,进行了种子萌发和盆栽实验,结果显示,LPY6可缓解镉对小麦生长的抑制作用。Cd2+吸附特征实验表明,LPY6可以降低培养液中游离镉的浓度。此外,LPY6还可以降低土壤有效镉浓度和小麦幼苗中镉的积累。研究结果表明,LPY6可能通过吸附或内吸镉作用,降低土壤中有效镉的浓度,进而降低镉离子进入植物的可能性,提高植物在高镉环境中的生存能力。Abstract: Soil cadmium pollution has attracted more attention in China, and calls for safe and effective remediation. Previously, we obtained a high cadmium-resistant strain Enterobacter cloacae LPY6 by domesticating E. cloacae Cu6. The strain LPY6 was used to treat seeds and plants of wheat (Triticum aestivum L.) in seed germination and pot experiments to analyze its potential and mechanism in alleviating the toxicity of cadmium to wheat growth. The seed germination and pot experiments found that LPY6 could reduce the toxic effects of cadmium on wheat seed germination and seedling growth, and decrease the cadmium levels in plants. In addition, LPY6 can also reduce the free cadmium contents in liquid media and in soils, suggesting LPY6 can adsorb or uptake cadmium from the soils and reduce the adsorption of available cadmium by plants. This indicates that LPY6 may be a potential strain for bioremediation of cadmium pollution.
-
Key words:
- Enterobacter cloacae /
- LPY6 /
- soil cadmium pollution /
- wheat /
- remediation potential
-
-
[1] RIZWAN M, ALI S, RIZVI H, et al. Phytomanagement of heavy metals in contaminated soils using sunflower: A review [J]. Critical Reviews in Environmental Science and Technology, 2016, 46(18): 1498 − 1528. doi: 10.1080/10643389.2016.1248199 [2] SHI T, ZHANG Y, GONGY, et al. Status of cadmium accumulation in agricultural soils across China (1975-2016): From temporal and spatial variations to risk assessment [J]. Chemosphere, 2019, 230: 136 − 143. doi: 10.1016/j.chemosphere.2019.04.208 [3] HIRZEL J, RETAMAL-SALGADO J, WALTER I, et al. Effect of soil cadmium concentration on three Chilean durum wheat cultivars in four environments [J]. Archives of Agronomy and Soil Science, 2018, 64(2): 162 − 172. doi: 10.1080/03650340.2017.1337892 [4] 常海伟, 刘代欢, 贺前锋. 重金属污染农田微生物修复机理研究进展[J]. 微生物学杂志, 2018, 38(2): 114 − 121. [5] AHEMAD M, KIBRET M. Recent trends in microbial biosorption of heavy metals: A review [J]. Biochemistry and Molecular Biology, 2013, 1(1): 19 − 26. doi: 10.12966/bmb.06.02.2013 [6] JIN Y, LUAN Y, NONG Y, et al. Effects and mechanisms of microbial remediation of heavy metals in soil: A critical review [J]. Applied Sciences-Basel, 2018, 8(8): 1336. doi: 10.3390/app8081336 [7] JIANG L, LIU X, YIN H, et al. The utilization of biomineralization technique based on microbial induced phosphate precipitation in remediation of potentially toxic ions contaminated soil: A mini review [J]. Ecotoxicology and Environmental Safety, 2020, 191(C): 110009. [8] 王艺皓. 秸秆生物炭及其复配材料对碱性土壤镉的钝化作用及机制[D]. 北京: 中国农业科学院, 2021. [9] BAGOT D, LEBEAU T, JEZEQUEL K. Microorganisms for remediation of cadmium-contaminated soils [J]. Environmental Chemistry Letters, 2006, 4(4): 207 − 211. doi: 10.1007/s10311-006-0047-0 [10] CHUANBOON K, NAKORN P N, PANNENGPETCH S, et al. Proteomics and bioinformatics analysis reveal potential roles of cadmium-binding proteins in cadmium tolerance and accumulation of Enterobacter cloacae [J]. Peerj, 2019(7): e6904. [11] XU C, HE S, LIUI Y, et al. Bioadsorption and biostabilization of cadmium by Enterobacter cloacae TU [J]. Chemosphere, 2017, 173: 622 − 629. doi: 10.1016/j.chemosphere.2017.01.005 [12] TIRRY N, TAHRI JOUTEY N, SAYEL H, et al. Screening of plant growth promoting traits in heavy metals resistant bacteria: Prospects in phytoremediation [J]. Journal, Genetic Engineering & Biotechnology, 2018, 16(2): 613 − 619. [13] 刘士尧, 刘珮熠, 徐羽丰, 等. 1株耐多种重金属菌株的分离鉴定[J]. 热带生物学报, 2019, 10(1): 41 − 46. [14] 夏影影, 徐羽丰, 于燕燕, 等. 高抗镉阴沟肠杆菌LPY6的驯化及其应用潜力的初步分析[J]. 海南大学学报(自然科学版), 2022, 40(4): 327 − 332. doi: 10.15886/j.cnki.hdxbzkb.2022.0039 [15] 刘铭, 刘凤枝, 刘保峰. 土壤中有效态铅和镉的测定[J]. 农业环境科学学报, 2007, 26(S1): 300 − 302. doi: 10.3321/j.issn:1672-2043.2007.z1.068 [16] 季秀玲, 魏云林, 林连兵. 细菌抗生素和重金属协同选择抗性机制研究进展[J]. 生物技术通报, 2010(5): 65 − 69. [17] 孙婕妤, 刘艳秋, 李佰林, 等. 植物对镉的耐性机制以及对镉污染土壤修复的研究进展[J]. 江苏农业科学, 2018, 46(7): 12 − 19. -




 下载:
下载: