-
乳酸菌是具有益生特性的革兰氏阳性菌,广泛应用于食品工业、制药工业以及医药工业。乳酸乳球菌(Lactococcus lactis)作为乳酸菌中一种重要的模式菌,已被认为是生产同源或异源蛋白的良好宿主菌[1]。由于其可在消化道中存活和定殖,以活载体的形式来递送疫苗和DNA是乳酸乳球菌的主要功能。随着对乳酸菌表达系统的研究,Barbosa等[2]开发了一套目前应用最广泛的Nisin控制的表达系统(Nisin controlled gene expression system,NICE)。该系统通过Nisin的强启动子Pnis诱导外源基因的表达,满足该系统的条件除了要有表达载体和诱导剂Nisin外,还必须有含nisR和nisK双组份系统的宿主菌。乳酸乳球菌NZ9000是该表达系统最常用的宿主菌,在基因工程中扮演重要角色,因此具有广阔的应用前景。但目前关于外源DNA如何高效率导入至乳酸乳球菌中仍然是一个难题。尽管革兰氏阳性菌细胞壁化学组成单一,但是因其具有高丰度的肽聚糖,导致其细胞壁较厚且机械强度大,利用常规的热激转化法无法将外源DNA导入至乳酸乳球菌中,因此,外源DNA如何高效率导入至乳酸乳球菌中仍是一个技术难题。目前,原生质体转化和电击转化都是将外源片段导入阳性菌的方法。基于原生质体制备步骤繁琐、转化效率低;而电击感受态细胞具有制备简便、省时的特点,故研究人员把电击转化作为主要的外源DNA导入方法,但是很多不确定因素会导致转化效率不稳定、重复性差等。因此,笔者从影响乳酸乳球菌电击转化效率的各因素入手,探究NICE表达系统中常用的表达体系pNZ8148/NZ9000的最优转化条件,旨在为基于乳酸菌NICE系统的深入研究奠定基础。
-
本实验使用的pNZ8148(P3829)载体和NZ9000(P1770)菌株均购自武汉淼灵质粒平台。
-
(1)GM17液体培养基:M17肉汤(胰酪蛋白胨、大豆蛋白胨、牛肉浸粉、酵母浸粉、抗坏血酸、硫酸镁、甘油磷酸钠、乳糖)中加0.5%葡萄糖。(2)GM17固体培养基:M17琼脂中加0.5%葡萄糖。(3)G/L-SGM17培养基:M17肉汤中加0.5 mol·L−1蔗糖、0.5%葡萄糖和甘氨酸;其中甘氨酸浓度按0.5%,1%,1.5%,2%,2.5%,3%分别加入至培养基中,配制不同浓度甘氨酸的感受态细胞培养基。(4)复苏培养基:M17肉汤中加入20 mmol·L−1 MgCl2和2 mmol·L−1 CaCl2。
-
本实验质粒提取试剂盒(AP-MN-P-50)购自美国Axygen公司,不同洗涤液配方见表1。
表 1 不同洗涤液配方
Table 1. Different formulations of liquid detergent
洗涤液I Liquid detergent I 洗涤液II Liquid detergent II 蔗糖/(mol·L−1) Sucrose 甘油/% Glycerol EDTA 蔗糖/(mol·L−1) Sucrose 甘油/% Glycerol EDTA/(mmol·L−1) 配方1 0.5 10 - 0.5 10 50 配方2 0.3 10 - 0.3 10 50 配方3 0.1 10 - 0.1 10 50 配方4 - 10 - - 10 50 配方5 0.5 10 - 0.5 10 - -
将乳酸乳球菌NZ9000单菌落培养至G/L-SGM17中,次日按1∶10比例接种到50 mL新鲜G/L-SGM17中,分别取OD600
值为0.2,0.3,0.4,0.5,0.6时的菌液制备感受态。利用小批量方法制备感受态细胞:先将菌液用2 mL离心管在6 000 g,4 ℃条件下离心10 min。用1 mL洗涤液I重悬细胞,相同条件离心10 min,用1 mL洗涤液II重悬细胞,冰浴15 min,相同条件离心10 min,再用1 mL洗涤液I重悬细胞,相同条件离心10 min。弃废液后,最后用40 μL洗涤液I重悬细胞,立即用该感受态进行电转。 -
将提取的质粒浓度调整到0.1 g·L−1后,分别在感受态细胞中加入1,2,3,4,5 μL质粒进行电转,用不同的电击杯规格(0.1,0.2 cm)在不同的电压条件下(1,1.5,2,2.5,3 kV)进行电击后,立即加入复苏培养基。冰浴5 min,转至1.5 mL离心管中进行复苏培养,同时在不同复苏时间(0.5,1,1.5,2,2.5 h)下比较电击转化效率。每个单因素实验重复3次,计算电击转化效率,计算公式如下:
电转化效率=稀释倍数×菌落总数/质粒浓度
-
在细胞洗涤液中加入蔗糖和甘油,既可洗去培养基中各种离子,又可给细胞提供高渗环境以保护细胞,从而增加转化效率[3]。本实验研究了细胞洗涤液的离子浓度和渗透压对电击转化效率的影响:在甘氨酸浓度为1%的条件下,用表1中的不同洗涤液配方制备OD600
值为0.4的感受态细胞,加入0.1 μg质粒,用2 kV电压进行电击转化,再用0.1 cm的电击杯电击过后复苏1 h。 -
乳酸乳球菌属于革兰氏阳性菌,其感受态细胞制备难度大于阴性菌,因具有较厚的细胞壁使得外源DNA难以进入细胞。若在培养基中添加甘氨酸则可削弱细胞壁的合成,但过低或过高的甘氨酸浓度又会影响电击转化效率[4]。本实验研究了不同浓度甘氨酸对电击转化效率的影响:用配方1制备感受态细胞,除了甘氨酸浓度外,其余条件如1.5.1中所述。
-
外界给细胞施予瞬时电压会使细胞膜形成凹孔,从而使质粒DNA进入感受态细胞内。过低的电压可能不足以让细胞膜形成凹孔,但过高的电压又会让细胞大量死亡[4]。因此,合适的电压是决定电击转化效率高低的关键。鉴于电压是电击转化效率的主要因素,本实验探究了不同电压对乳酸乳球菌电击转化效率的影响:当添加的甘氨酸浓度为2.5%时,用配方1制备感受态,其余条件如1.5.1,比较不同电压对电击转化效率的影响。
-
收集不同OD600值(0.2,0.3,0.4,0.5,0.6)的感受态细胞,确定甘氨酸、洗涤液配方、电压后,其余条件按照1.5.1进行。
-
控制甘氨酸浓度、洗涤液配方、电压、细胞生长阶段因素后,转入不同浓度的质粒,用0.1 cm电击杯电击细胞,复苏1 h,转入不同质粒浓度,研究质粒浓度对电击转化效率的影响。
-
控制甘氨酸浓度、洗涤液配方、电压、细胞生长阶段、质粒浓度因素后,用不同电击杯规格电击,复苏1 h。
-
控制以上所有条件,研究不同复苏时间对电击转化效率的影响。
-
实验结果表明,配方1、配方2、配方3、配方4、配方5转化效率(对数值)分别为5.5×106,1.8×106,1.5×106,0.4×106,2.3×106 CFU·μg−1,说明用配方1制备的感受态细胞转化效率最高。
-
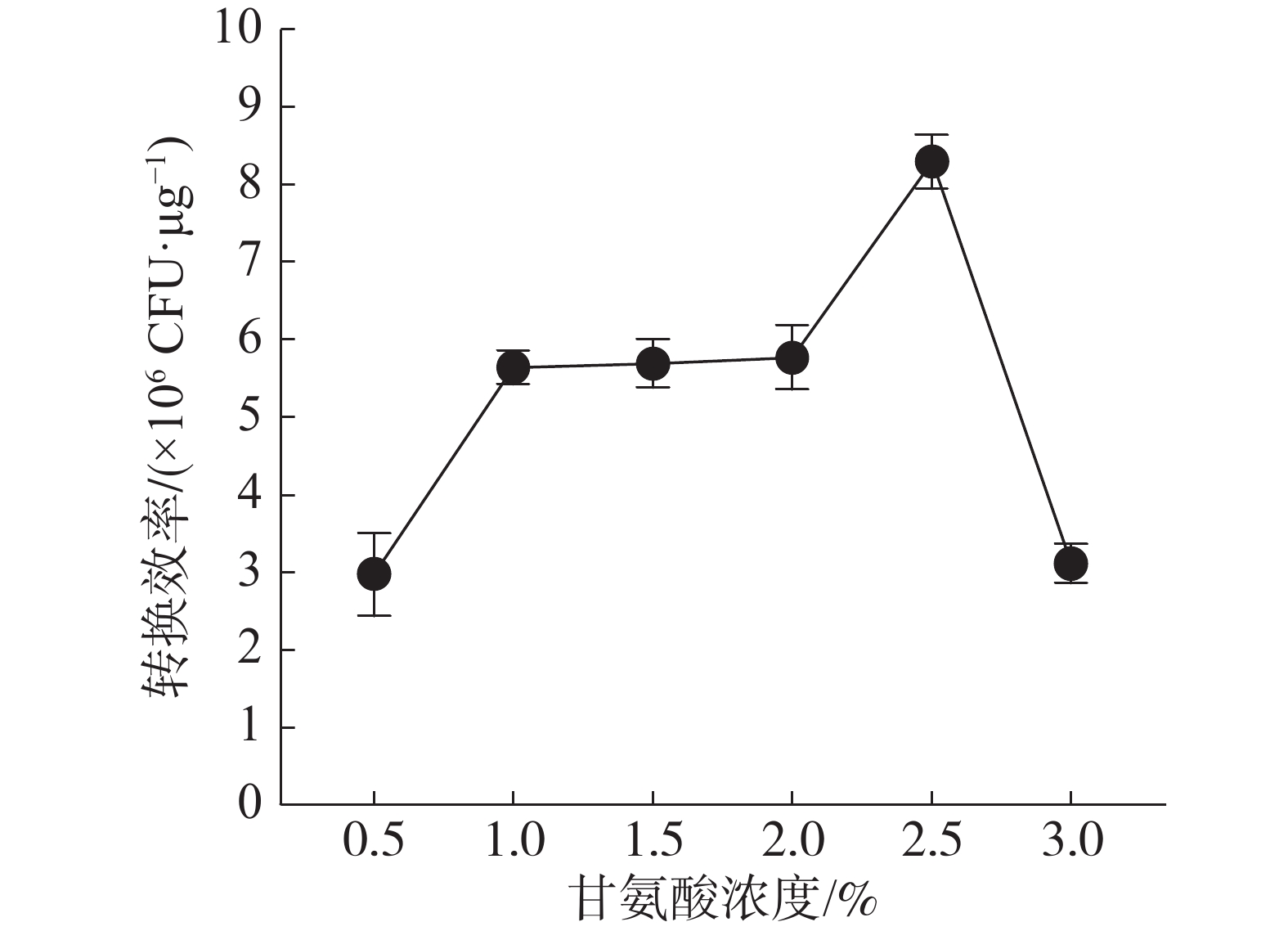
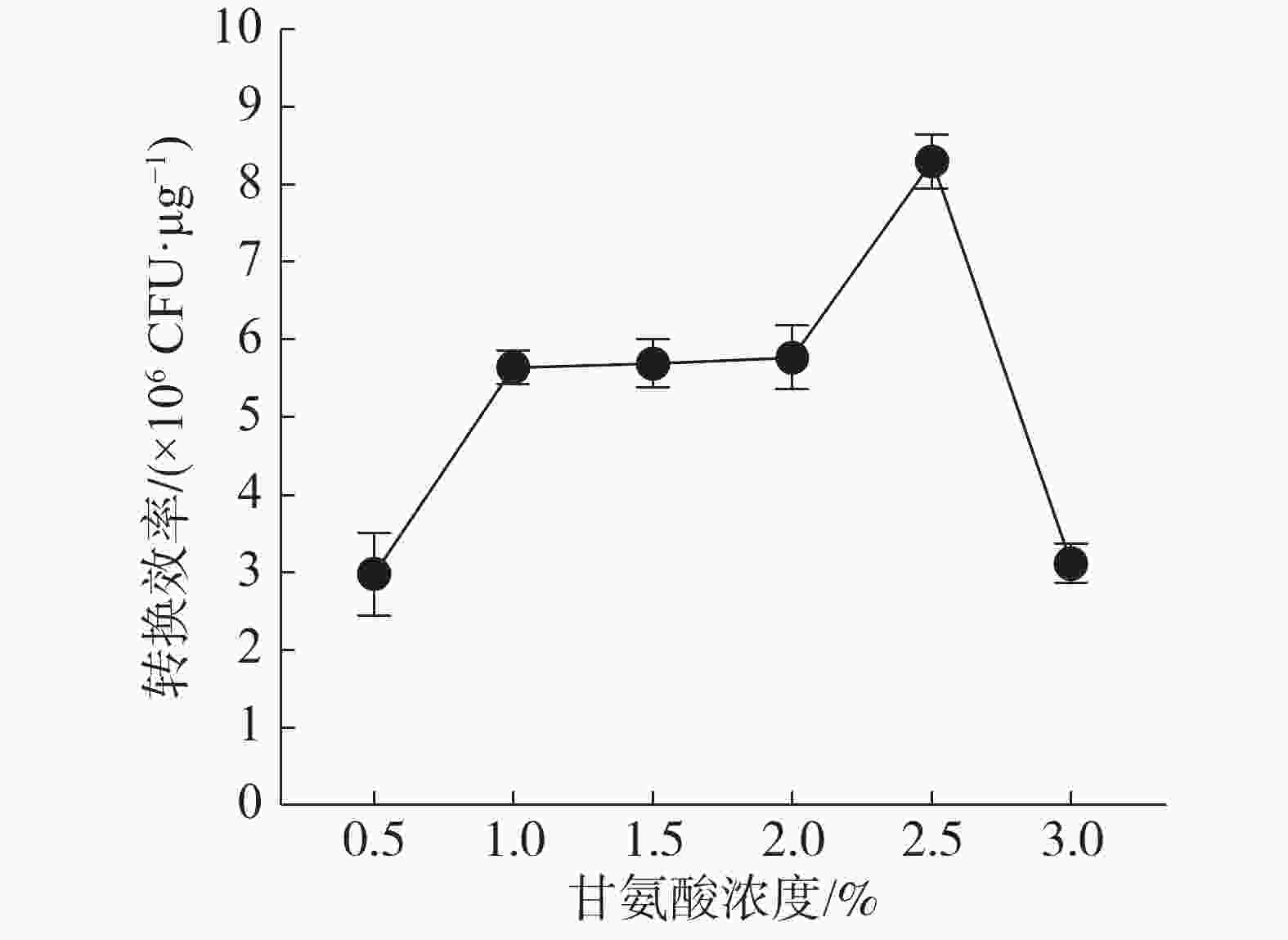
结果(图1)表明,随着培养基中甘氨酸浓度的增加,电转化效率也随之增大,当甘氨酸为2.5%时,电击转化效率最高,之后随甘氨酸浓度的升高而降低。
-
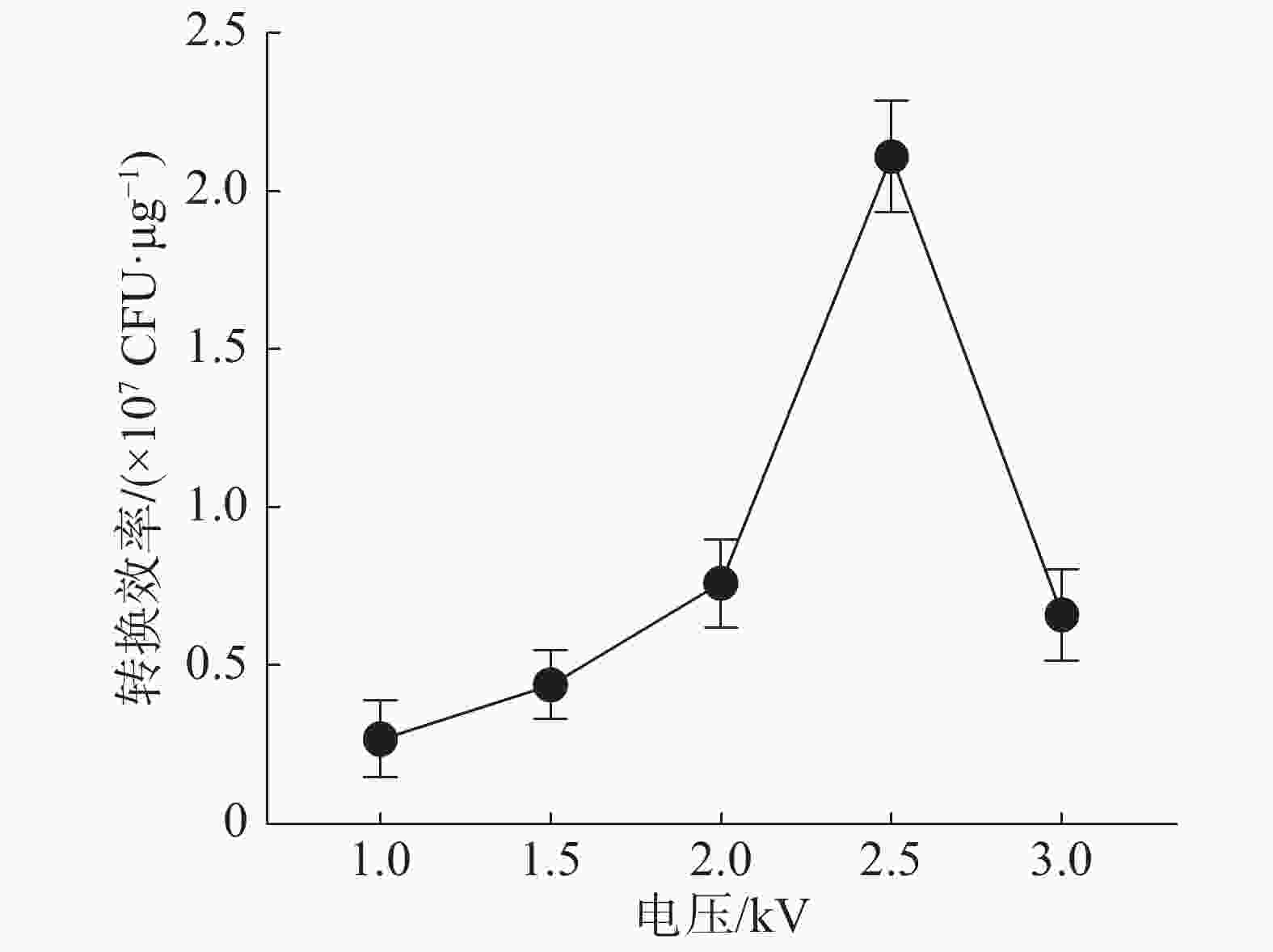
不同电压对电击转化效率的影响结果(图2)表明,在(1~2.5)kV的范围内,电击转化效率随电压的增大而增大,超过2.5 kV后则减小。当电压为2.5 kV时,转化效率最高。
-
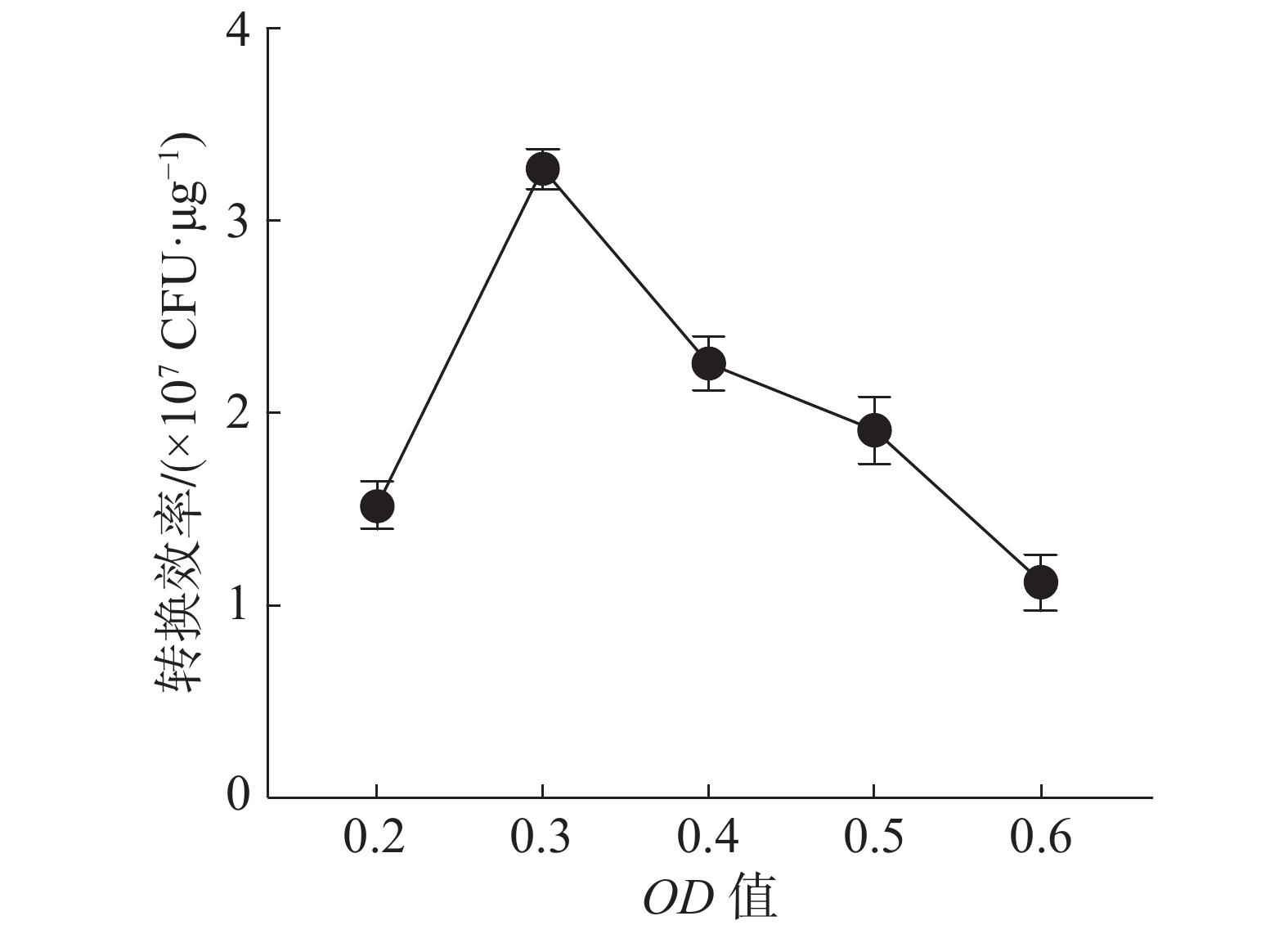
结果(图3)表明,用生长对数前期的细胞(OD600值为0.3)制备感受态,其电击转化效率高于其他生长阶段的细胞,之后随着细胞的生长,转化效率反而降低。
-
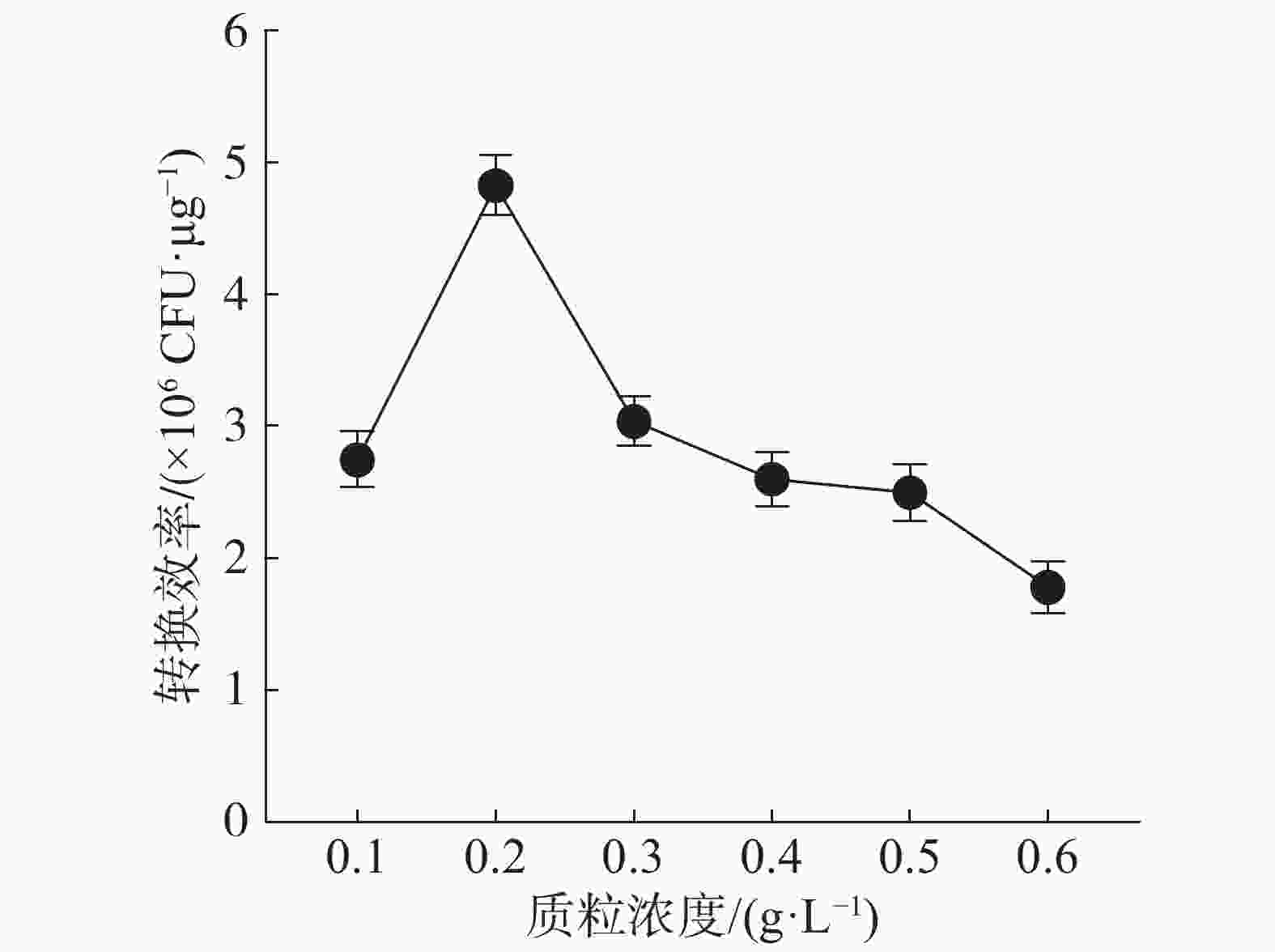
质粒浓度对电击转化效率的影响结果(图4)表明,随着质粒浓度的增加,电击转化效率先升高后下降,当加入2 μL浓度为0.1 g·L−1的质粒时,转化效率最高。
-
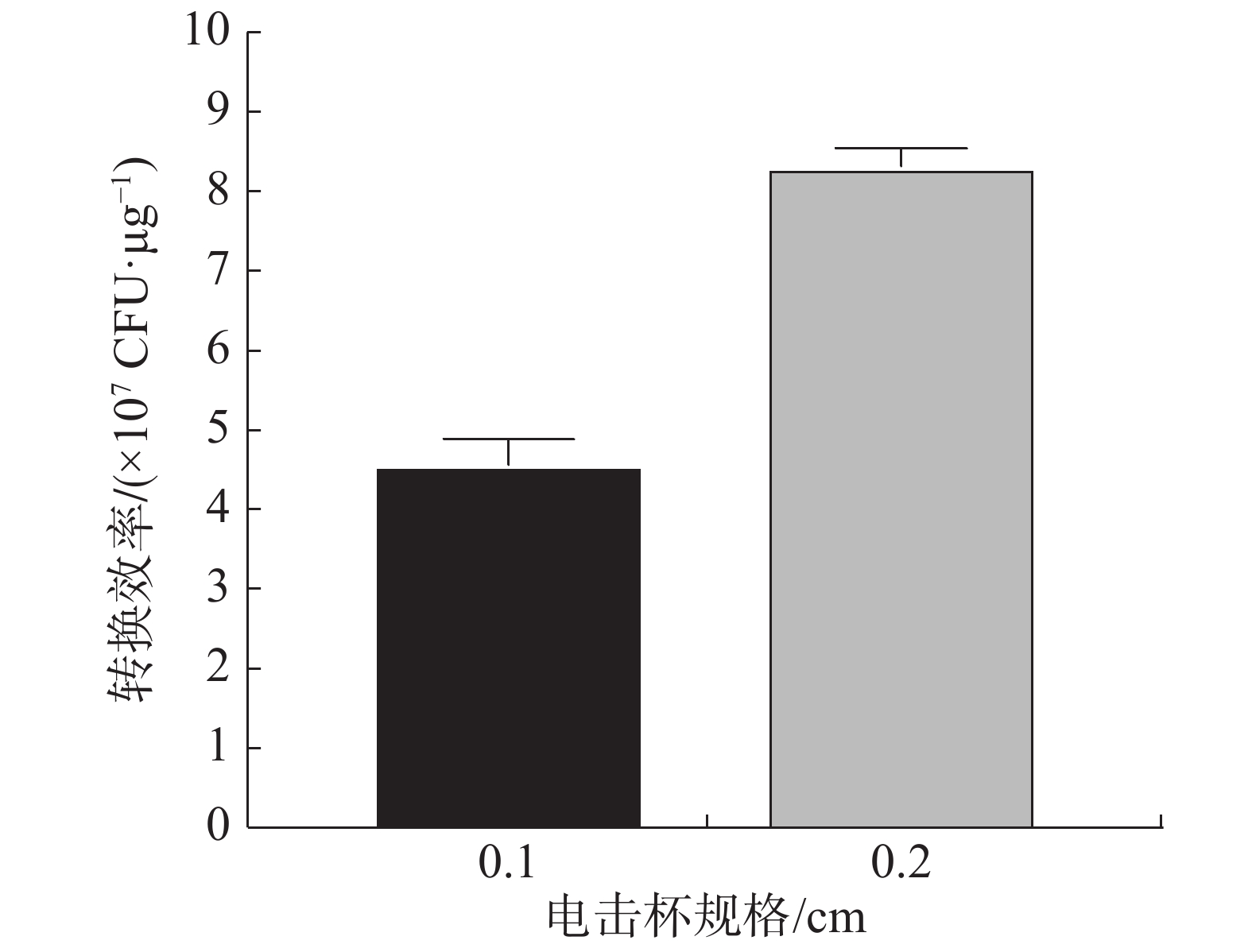
不同电击杯规格对电击转化效率的影响结果(图5)表明,用0.2 cm电击杯电击后的转化效率高于0.1 cm电击杯的转化效率,规格为0.2 cm的电击杯比0.1 cm电击杯电击效果好。
-
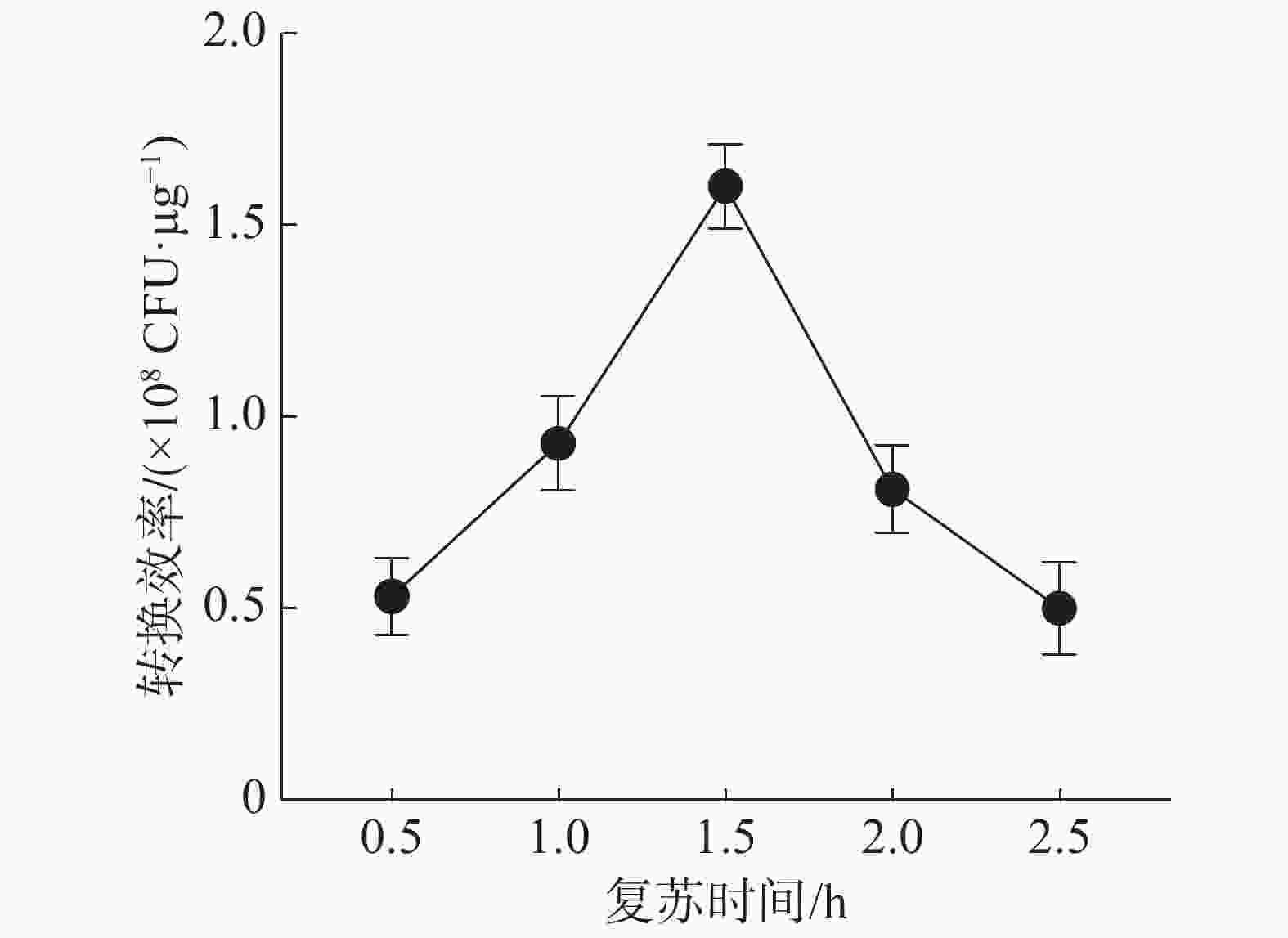
复苏时间对电击转化效率的影响结果(图6)表明,随着复苏时间的增加,电击转化效率也在增加,其中复苏时间为1.5 h时,转化效率最高。感受态细胞的正常繁殖生长和质粒抗性基因的表达依赖于之后的复苏培养,合适的复苏培养时间是提高电击转化效率的必要条件。实验结果表明,电击转化效率最优条件为:在培养基中加入2.5%甘氨酸、收集OD600值为0.3的细胞、用配方I洗涤细胞情况下,转入0.2 μg质粒,利用2.5 kV电压、0.2 cm电击杯进行电击转化,恢复培养1.5 h后转化效率最高,达1.6×108 CFU·μg−1。
-
本实验中的任何一个因素都对乳酸菌的电转化效率有影响,其中电压是一个较重要的因素,对于乳杆菌来说,任婧[5]指出电击转化干酪乳杆菌的最适电压是1 kV;白云等[6]利用2 kV电压将重组质粒导入嗜酸乳杆菌中;乳双歧杆菌可用2.5 kV的电压进行电击转化[7-8]。本实验得出乳酸乳球菌的最优电压条件是2.5V,其次,在选择乳酸乳球菌感受态细胞生长状态时,生长对数中期细胞分裂旺盛,与稳定期相比,细胞壁结构较疏散。因此感受态制备一般选用对数中期细胞,但在本实验中,结果却显示在对数中前期时(OD600值约0.3)收集细胞电击转化效率最高,可能是不同菌种间细胞壁结构存在差异。王洋等[9]指出干酪乳杆菌感受态制备最适时期是中后期(OD600值约0.3),与韦云莹[10]结论一致,乳酸乳球菌感受态制备最佳时期是中前期。本研究结果表明,电击杯的型号也会影响转化效率,而任大勇等[11]则是对电击杯使用次数与电击转化的关系进行研究。有研究表明,电击转化效率的高低不受外源质粒的影响[12],但本实验得到与之不同的结论:在其他条件不变的情况下,外源质粒浓度与电击转化效率呈线性关系。经过电击后的感受态细胞需要有合适的恢复培养时间,本实验经过1.5 h的恢复培养后有较高转化效率,有研究称感受态细胞需要培养2 h才能得到较高的转化效率,这可能是由于转入的质粒不同和表达的抗性基因不同造成的。
本实验首次以pNZ8148/NZ9000为研究对象来探究该组合最佳电击转化条件,通过使用最优化条件制备感受态以及电击转化,其转化效率为1.6×108 CFU·μg−1。孙大庆[13]得出质粒pNZ8148转入宿主乳酸乳球菌亚种ATCC19435中最优转化效率是2.18×105 CFU·μg−1;任大勇等[11]得出pNZ8149/NZ3900最高电击转化效率是2.6×104 CFU·μg−1;张小娟[14]得出pNZ8110/NZ3900最高电击转化效率是1.2×104 CFU·μg−1;韦云莹等[10]利用响应面法预测pNZ44/NZ9000的最佳转化效率达到3.76×107 CFU·μg−1,尽管该转化效率较高,但仍然稍逊于本实验转化效果。本实验对pNZ8148/NZ9000转化条件的优化,为乳酸乳球菌后续的深入研究奠定了基础。
此外,感受态制备的环境温度控制、外源DNA的大小及来源、培养基成分、抗生素浓度等都会制约着电转化效率的高低。有研究认为,用乙酸锂和二硫苏糖醇在电击之前处理细胞30 min,以及用多脉冲电击方法代替单脉冲电击方法,转化效率将会更高[15],这将会促使学者们对乳酸乳球菌的感受态潜力进行更深入地挖掘。
Optimization of Electrotransformation of Lactococcus lactis
-
摘要: 乳酸菌NICE系统是食品级表达系统,本实验以该系统的表达载体pNZ8148和宿主菌NZ9000为研究对象,对电击转化方法进行了优化。结果表明,在培养基中加入2.5%甘氨酸,收集OD600值为0.3的细胞、用配方I[(洗涤液I:蔗糖0.5 mol·L−1+甘油10%;洗涤液II:蔗糖0.5 mol·L−1+甘油10%+EDTA50 mmol·L−1)]洗涤细胞,再转入0.2 μg质粒,利用2.5 kV电压和0.2 cm电击杯进行电击转化,恢复培养1.5 h后转化效率最高,达1.6×108 CFU·μg−1。本实验为乳酸乳球菌NZ9000的电击转化参数提供了数据参考,为基于乳酸菌NICE系统的深入研究奠定了基础。Abstract: The nisin-controlled gene expression system (NICE) is a food-grade system used for gene expression in Lactococcus lactis. Electrotransformation was optimized via the NICE, consisting of an expression vector pNZ8148 and a host strain Lactococcus lactis NZ9000. The results showed that the electrotransformation of L. lactis NZ9000 with the expression vector pHZ8148 gave the highest efficiency (1.6 × 108 CFU μg−1) when L. lactis NZ9000 was cultured on the medium added with 2.5% of glycine, and its competent cells grown to 0.3 OD600 were prepared by washing with the liquid detergent formulation I (Sucrose 0.5 mol·L−1+glycerol 10%), transferred into with 0.2 μg plasmid of pNA8148, electrotranformed at 2.5 kV on a 0.2 cm gap cuvette, and mixed gently for 1.5 h before plating. This study provides optimum conditions for electrotransformation of L. lactis NZ9000 which are favorable for further study of L. lactis based on the NICE.
-
Key words:
- Lactococcus lactis /
- electroporation /
- optimization
-
表 1 不同洗涤液配方
Table 1 Different formulations of liquid detergent
洗涤液I Liquid detergent I 洗涤液II Liquid detergent II 蔗糖/(mol·L−1) Sucrose 甘油/% Glycerol EDTA 蔗糖/(mol·L−1) Sucrose 甘油/% Glycerol EDTA/(mmol·L−1) 配方1 0.5 10 - 0.5 10 50 配方2 0.3 10 - 0.3 10 50 配方3 0.1 10 - 0.1 10 50 配方4 - 10 - - 10 50 配方5 0.5 10 - 0.5 10 - -
[1] SONG ADELENE AI-LIAN, IN LIONEL L A, LIM SWEE HUA ERIN, et al. Erratum to: A review on Lactococcus lactis: from food to factory [J]. Microb. Cell Fact, 2017, 16: 139. doi: 10.1186/s12934-017-0754-1 [2] SIMÕES-BARBOSA A, ABREU H, SILVA NETO A, et al. A food-grade delivery system for Lactococcus lactis and evaluation of inducible gene expression [J]. Appl. Microbiol. Biotechnol., 2004, 65: 61 − 67. [3] GERBER SIMON D, SOLIOZ MARC. Efficient transformation of Lactococcus lactis IL1403 and generation of knock-out mutants by homologous recombination [J]. J. Basic Microbiol., 2007, 47: 281 − 286. [4] HOLO H, NES I F. High-Frequency Transformation, by Electroporation, of Lactococcus lactis subsp. cremoris Grown with Glycine in Osmotically Stabilized Media [J]. Appl. Environ. Microbiol., 1989, 55: 3119 − 3123. doi: 10.1128/AEM.55.12.3119-3123.1989 [5] 任婧, 李楠, 陈臣, 等. 干酪乳杆菌LC2W最优电击转化条件的建立[J]. 食品安全质量检测学报, 2014, 5(4): 1028 − 1032. [6] 白云, 韩博, 栗楠, 等. 表达鼠源GLP-2重组嗜酸乳杆菌的构建[J]. 中国兽医学报, 2015, 35(5): 727 − 730. [7] 张书献. GLP-1类似肽转化双歧杆菌降糖作用及多肽通过肠黏膜机制[D].广州: 南方医科大学, 2015. [8] 荀安营, 李娜, 邹兵, 等. 双歧杆菌感受态细胞的制备和电击转化条件的研究[J]. 中国微生态学杂志, 2013, 25(10): 1128 − 1130. [9] 王洋, 由田, 潘超, 等. 不同感受态细胞制备方法对副干酪乳杆菌转化效率的影响[J]. 中国食品学报, 2014, 14(9): 14 − 19. [10] 韦云莹, 王立峰, 熊智强, 等. 响应面法优化乳酸乳球菌电击转化效率研究[J]. 上海理工大学学报, 2018, 40(6): 566 − 571. [11] 任大勇, 李昌, 秦艳青, 等. 乳酸乳球菌高效电击转化方法的建立[J]. 中国兽药杂志, 2012, 15(1): 5 − 9. doi: 10.3969/j.issn.1002-1280.2012.01.002 [12] POWELL I B, ACHEN M G, HILLIER A J, et al. A simple and rapid method for genetic transformation of Lactic Streptococci by electroporation [J]. Appl. Environ. Microbiol., 1988, 54: 655 − 660. [13] 孙大庆, 姜毓君. 乳酸乳球菌高效电转化的方法[J]. 中国乳品工业, 2010, 38(7): 22 − 24. doi: 10.3969/j.issn.1001-2230.2010.07.006 [14] 张小娟, 张荣光, 段广才, 等. 乳酸乳球菌NZ3900电转化条件的优化[J]. 山东医药, 2010, 50(11): 53 − 55. doi: 10.3969/j.issn.1002-266X.2010.11.019 [15] WELKER DENNIS L, COBURN BRYAN M, MCCLATCHY JOHN H, et al. Multiple pulse electroporation of lactic acid bacteria Lactococcus lactis and Lactobacillus casei [J]. J. Microbiol. Methods, 2019, 166: 105741. doi: 10.1016/j.mimet.2019.105741 -




 下载:
下载: