-
海南风吹楠(Horsfieldia hainanensis Merr.)属肉豆蔻科(Myristicaceae),风吹楠属(Horsfieldia),俗称假玉果、海南荷斯菲木、海南霍而飞、水枇杷、咪桉,为常绿乔木,树高可达15 m,在我国主要分布于云南、广西和海南等地,平均海拔150~1 012 m的山谷、峰丛或丘陵荫湿的密林中[1-6]。它对研究热带雨林区系构成、地理分布和生态特征具有重要价值,是湿润热带雨林的标识性植物之一[7-8]。由于其分布区域狭小,雨林过度毁坏,数量极少,加之人为破坏和盗砍,天然更新极差等原因,濒临灭绝,于1999年被列为国家Ⅱ级重点保护野生植物[4-6]。海南风吹楠的应用比较广泛,有绿化、材料、添加剂和医用等价值[4]。我国对海南风吹楠的研究主要集中在林业的播种育苗技术[9]和施肥管理[10]、生物学的种群特征[4]和化学成分分析[2-3]等方面,而对于海南风吹楠的自然生境回归种植尚未见报道。对珍稀濒危植物的保护主要有就地保护、迁地保护和野外回归等方式[11]。回归自然是野生植物种群重建的重要途径,其保护效果超出了单纯的就地保护和单一的物种保护,能更有效地对珍稀濒危野生植物进行拯救和保护[11]。从世界范围看,植物回归的研究与实践主要发生在植物园,这是因为植物园可为植物回归提供全方位的知识、植物材料、技术支撑与人力资源。全世界珍稀濒危植物的回归研究主要集中在影响回归植株定居的因素、回归的遗传多样性、全球生境变化对回归的影响和成功回归的标准等4方面[12]。研究发现,繁殖体类型、材料来源、种源是直接野外收集还是贮藏、种源的数量及处理、不同种群与地点的适合度、回归地点、生境观测数据、生境的处理、种植时间等都对回归植物的成功定居有影响[13]。回归时会因居群的时空隔离而导致高的遗传分化和减少遗传多样性丧失风险,但增强型回归会导致亚种群间遗传同质化并降低遗传多样性[14-15]。在全球生境变化情况下,回归可增加1个物种的分布和多度,改进基因流,加强复合种群动态并降低种群灭绝的风险[16],但是,回归种群也面临着外来种入侵、生境破碎化、气候变化等影响。为了减少这些影响,拟回归物种的历史分布区不再是回归时的唯一考虑地点,可利用生境分布模型为拟回归的物种找到合适的地点开展异地回归。这类模型会考虑回归过程中的生态相似性、源种群的遗传性以及生境质量的影响3个重要因素[17]。关于成功回归的标准虽然还未形成共识,但一般会分为短期和长期成功。短期成功是指回归个体的成活、种群的建立和扩散,而长期成功是指回归种群能自我维持并在生态系统中发挥功能作用。最成功的回归包括产生二代个体,回归种群融入种群动态、种群遗传、个体行为、生态系统功能等生态系统过程[18]。因此,本研究通过不同海拔和郁闭度回归种植风吹楠,观测其生长指标、叶性和叶型的变化,旨在探究海南风吹楠自然回归种植的适应情况,为促进林业的可持续发展提供依据。
-
试验点位于海南省五指山区域,(109°19′~109°44′E、18°38′~19°02′N),平均海拔328.5 m,气候温和,热带山区气候,冬暖夏凉。年平均气温22.4 ℃左右,1月份平均气温17.0 ℃,7月份平均气温26.0 ℃,极端最高气温35.9 ℃。年平均降雨量为1 690.0 mm,极端最大年降雨量为2 810.4 mm,极端最少年降雨量为1 055.5 mm,年平均相对湿度为84%,年平均日照时数约2 000 h[19]。
-
供试的海南风吹楠(Horsfieldia hainanensis Merr.)幼苗为生长健壮、长势一致的3年生实生苗。
-
试验于2019年4月在海南五指山阿陀岭地势较平缓的地区进行,立地环境见表1。根据现有环境条件设置4个处理组:0~0.2郁闭度处理组;0.3~0.5郁闭度处理组;0.6~0.8郁闭度处理组;>0.8郁闭度处理组。每处理组3次重复,每个重复10株,并挂牌标记。同时,将3年生海南风吹楠回归种植在五指山市海拔分别为300、600、900 m的地区,开展不同海拔海南风吹楠回归种植试验,每个处理为1个种植小区,每个小区3次重复,每个重复10株幼苗。
表 1 试验地立地环境条件
Table 1. Site environmental conditions in the land under trial
立地环境
Site environment海拔 Altitude / m 300 600 900 经纬度 E:109°32′7.69″ E:109°30′39.66″~109.30′40.33″ E:109°35′26.34″ W:18°45′51.22″ W:18°49′34.64″~18°49′35.57″ W:18°48′33.17″ 坡向 南坡 东南坡 东南坡 坡度 陡坡 陡坡 陡坡 坡位 上坡 山谷 上坡 优势树种 花梨、凤凰木 马占相思 黄桐木、喜树 林分平均胸径/cm 12.326 22.353 8.358 平均株高/m 6.367 18.546 3.569 SOM/(g·kg−1) 13.903±9.314 32.287±17.104 54.787±6.557 pH值 5.213±0.577 5.523±0.473 4.750±0.453 AP/(mg·kg−1) 6.927±1.115 8.210±1.034 10.070±2.410 AK/(mg·kg−1) 87.130±5.117 53.403±8.208 68.220±3.296 AN/(mg·kg−1) 83.950±7.762 99.257±61.744 142.690±13.178 TK/(g·kg−1) 15.750±0.471 20.667±5.986 18.023±7.556 TN/(g·kg−1) 0.567±0.261 0.627±0.199 0.797±0.101 TP/(g·kg−1) 0.048±0.021 0.050±0.011 0.052±0.021 Wg/% 1.367±1.150 1.367±0.321 1.067±0.416 注:SOM. 土壤有机质;AP. 有效磷;AK. 速效钾;AN. 碱解氮;TK. 全钾;TN. 全氮;TP. 全磷;Wg. 含水量。
Notes: SOM. Soil organic matter; AP. Available phosphorous; AK. Available potassium; AN. Available nitrogen; TK. Total potassium; TN. Total nitrogen; TP. Total phosphorus; Wg: Water content. -
2019年5月,开始在每个重复中固定选取3株,每2个月采用卷尺和游标卡尺测定植株的株高(Tree Height,H)和地径(Diameter,D)。
-
试验结束后,于2020年11月每个重复选取3株,采用手持式叶面积仪(YMJ-B,浙江托普云农科技服份有限公司)测定海南风吹楠的叶长(Leaf long,LL)、叶宽(Leaf width,LW)、叶面积(Leaf area,LA)、长宽比(Aspect ratio,LB)。
同时,叶片含水量(Leaf water content,CLWC)采用烘干法测定,从每株幼苗上剪取功能叶片1片,每个重复取3株,先称量叶片鲜质量(Fresh weight,FW),置于烘箱中100 ℃杀青1 h,再把温度调到85 ℃,直至恒重,称量叶片干质量(Dry weight,DW),并计算含水量、比叶面积(Specific leaf area,SLAM)和比叶重(Specific leaf weight,mLMA)。
-
光合色素含量的测定参考GU等[20]和吴艳等[21]的方法,采用φ=95%乙醇法测定。从每株幼苗上剪取1片成熟的功能叶片,每个重复取3株,用分析天平称取0.200 g(FW),剪碎并浸没于φ=95%乙醇,常温暗处理72 h后,直至叶片绿色退去,用紫外可见分光光度计(UV-2400,上海舜宇恒平科学仪器有限公司)在3个波段测量吸光值(A),分别为470、649、665 nm。叶片光合色素含量的计算公式如下:
$$ \begin{split} {C_{\rm{a}}}&={\rm{13}}{\rm{.95 \times }}{A_{{\rm{665}}}}-{\rm{6}}{\rm{.88 \times }}{A_{{\rm{649}}}};\\ {C_{\rm{b}}}&={\rm{24}}{\rm{.96 \times }}{A_{{\rm{649}}}} - {\rm{7}}{\rm{.32 \times }}{A_{{\rm{665}}}};\\ {C_{{\rm{x + c}}}}&=\frac{{{\rm{1\;000 \times }}{A_{{\rm{470}}}} - {\rm{2}}{\rm{.05 \times }}{C_{\rm{a}}} - {\rm{114}}{\rm{.8 \times }}{C_{\rm{b}}}}}{{{\rm{245}}}};\\ Chl &= \frac{{\left( {{C_{\rm{a}}} + {C_{\rm{b}}}} \right) \times V \times n}}{{{F_W}}};\\ Chl{\rm{ a}} &= \frac{{{C_{\rm{a}}} \times V \times n}}{{{F_W}}};\\ Chl{\rm{ b}} &= \frac{{{C_{\rm{b}}} \times V \times n}}{{{F_W}}};\\ C{\rm{aro}} &= \frac{{{C_{{\rm{X}} + C}} \times V \times n}}{{{F_W}}}; \end{split} $$ 式中:Ca为叶绿素a浓度(mg·L−1);Cb为叶绿素b浓度(mg·L−1);Cx+c为类胡萝卜素浓度(mg·L−1);Chl为总叶绿素含量(mg·g−1);Chla为叶绿素a含量(mg·g−1);Chlb为叶绿素b含量(mg·g−1);Caro为类胡萝卜素含量(mg·g−1);V为提取液体积(mL);n为稀释倍数;FW为叶片取样鲜质量(g)。
-
采用Excel 2016 记录数据,采用IBM SPSS 26.0软件进行方差数据分析和邓肯显著性检验,用OriginPro 2021软件作图。所有试验数据均采用均值±标准差展示。
-
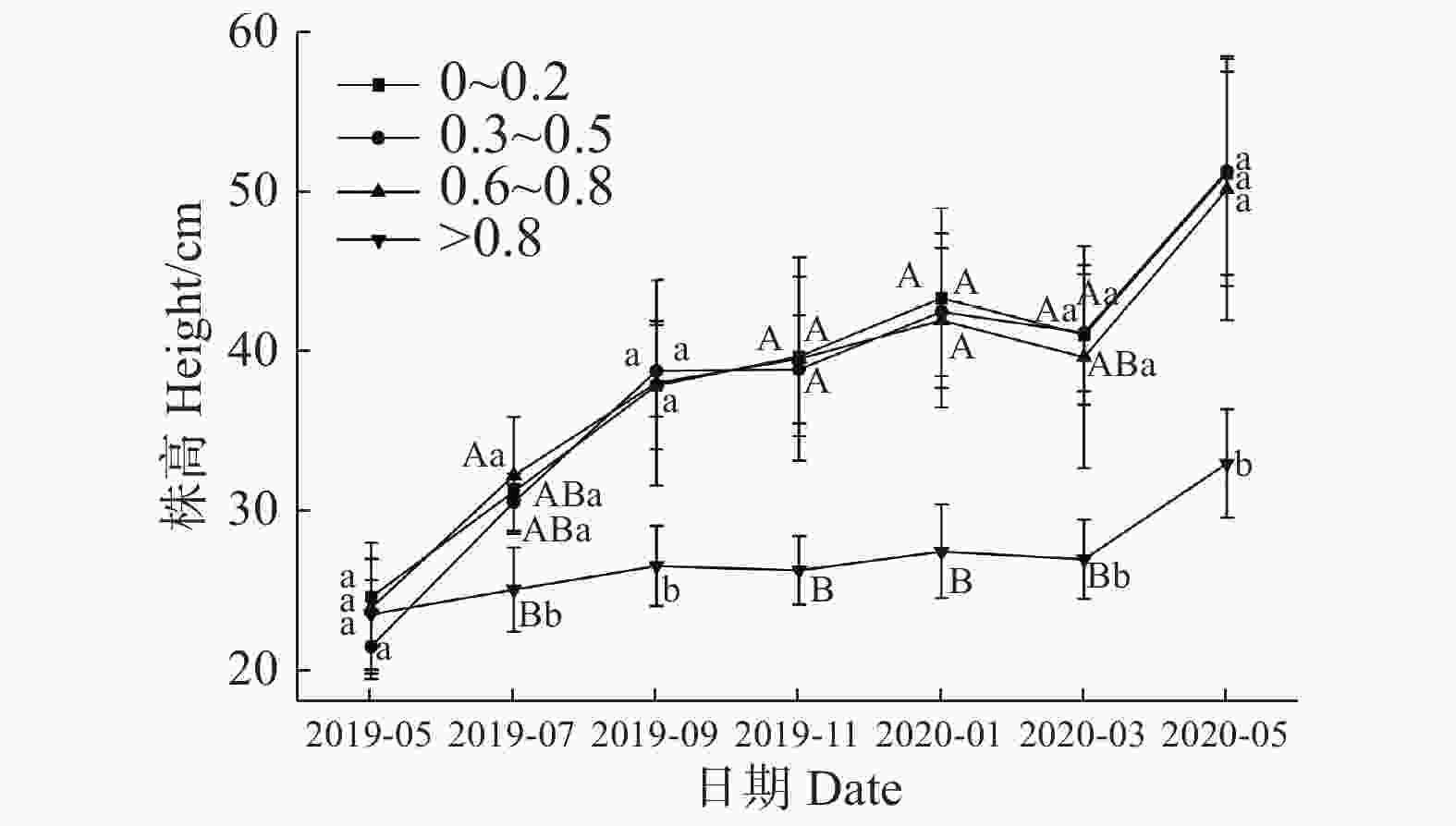
不同郁闭度对回归种植的3年生海南风吹楠株高的影响如图1所示,各处理组均表现出株高增加的趋势,各处理组之间在2019年5月海南风吹楠株高无显著性差异。在2019年5月份后,均表现出>0.8郁闭度处理组株高最小值,在2019年7月、9月、11月、翌年1月、3月、5月分别为25.003、26.513、26.233、27.433、26.933、32.933 cm,其他处理组株高分别比2019年7月份多24.528%、21.859%、28.550%,2019年9月,其他处理组分别是>0.8郁闭度处理组的1.427、1.461、1.433倍,2019年11月,其他处理组分别是>0.8郁闭度处理组株高的1.517、1.480、1.505倍,翌年1月,其他处理组分别是>0.8郁闭度处理组的1.578、1.547、1.527倍,翌年3月,其他处理组分别是>0.8郁闭度处理组的1.522、1.527、1.470倍,翌年5月,其他处理组分别是>0.8郁闭度处理组的1.552、1.556、1.521倍,在9月、11月、翌年1月均表现出极显著小于其他处理组,7月、翌年3月和5月,与其他处理组表现出显著性差异。说明较大(>0.8)郁闭度回归种植下对3年生海南风吹楠的株高增加不利。
-
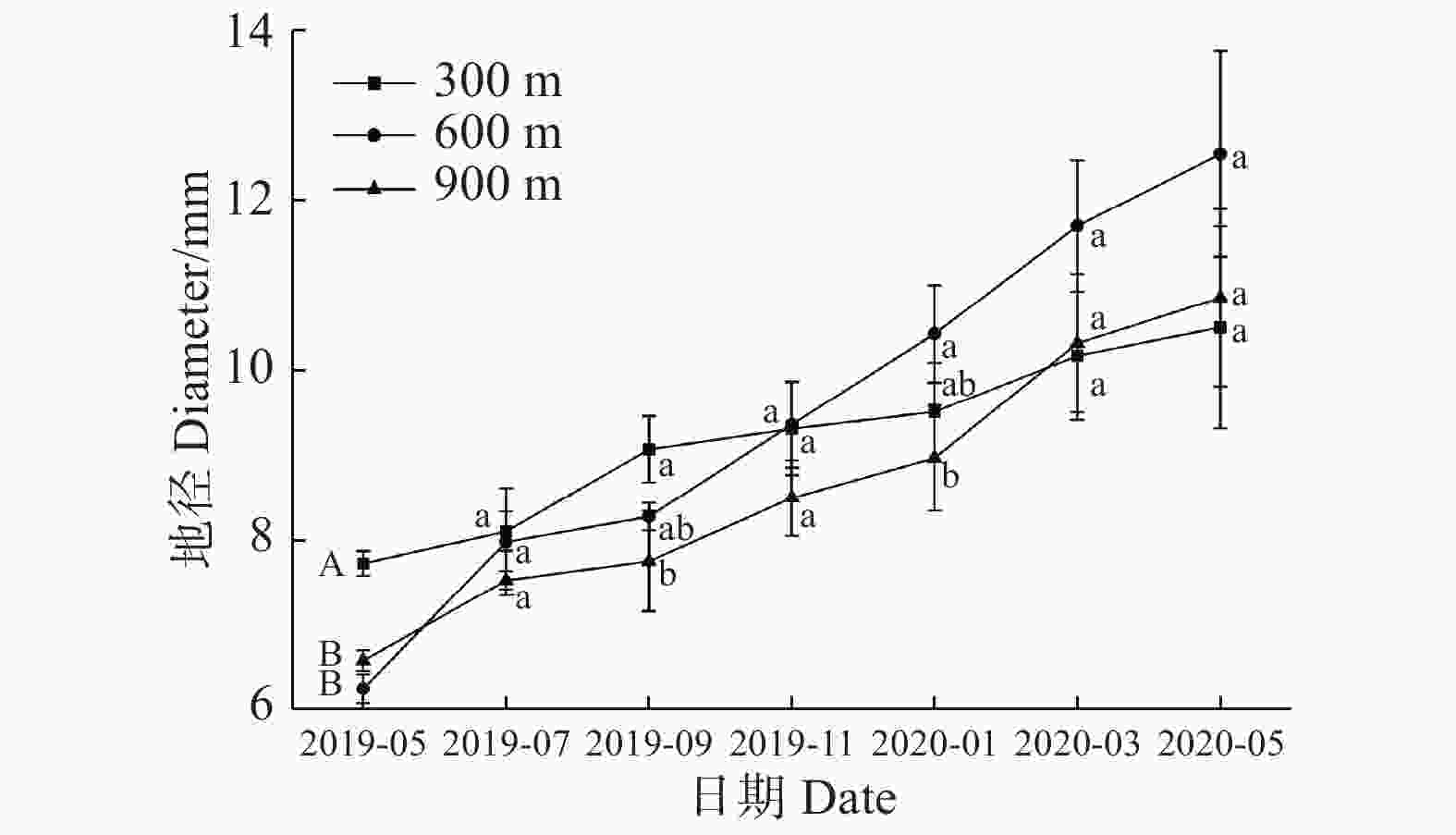
从图2可知,各处理组地径在一年中均呈现增长趋势,在2019年5、7月,各处理组之间无显著性差异。2019年9月,>0.8郁闭度处理组的地径达到最小值,为7.349 mm,0~0.2、0.3~0.5、0.6~0.8郁闭度处理组地径分别是>0.8郁闭度处理组的1.145、1.099、1.126倍,与>0.8郁闭度处理组相比较,表现出差异显著性。2019年11月份>0.8郁闭度处理组的地径达到最小值,为7.735 mm,0.6~0.8郁闭度处理组地径达到最大值(9.360 mm),是>0.8郁闭度处理组的1.210倍,并且两者之间表现出差异显著性。翌年1月,>0.8郁闭度处理组的地径是最小值(8.233 mm),0~0.2、0.3~0.5、0.6~0.8郁闭度处理组地径分别是>0.8郁闭度处理组的1.259、1.278、1.267倍,并都与>0.8郁闭度处理组表现出差异显著性,翌年3月,0~0.2郁闭度处理组达到最大值,为12.263 mm,是>0.8郁闭度处理组的1.247倍,两者之间表现出差异显著性。翌年5月,0~0.2、0.3~0.5、0.6~0.8郁闭度处理组地径达到最大值,分别为13.159、12.851、12.550 mm,是>0.8郁闭度处理组的1.357、1.325、1.294倍,存在差异显著性,说明较高(>0.8)郁闭度回归种植不利于3年生海南风吹楠地径的增加。
-
从表2可知,可知,不同林分郁闭度对3年生海南风吹楠叶片的LS、LW、CLWC、SLAM、mLMA均无显著性影响,>0.8郁闭度处理组的叶长最小,为265.877 cm,而0~0.8郁闭度处理组的叶长表现出较大值,分别为369.453、367.110、381.067 cm,是>0.8郁闭度处理组的1.390、1.381、1.433倍。>0.8郁闭度表现出显著小于其他处理组。长宽比的表现与叶长相似,>0.8郁闭度处理组极显著小于0~0.8郁闭度处理组,并且0~0.2、0.3~0.5、0.6~0.8郁闭度处理组是>0.8郁闭度处理组的1.184、1.227、1.227倍。表明高(>0.8)郁闭度回归种植能够显著降低叶长,极显著减小长宽比。
表 2 不同郁闭度对回归种植的海南风吹楠叶片性状和形状的影响
Table 2. Effects of different canopy closures on the leaf traits and shapes of H. hainanensis Merr. reintroduced
叶片形状与性状指标
Leaf shape and trait indicators郁闭度 Canopy closure 0~0.2 0.3~0.5 0.6~0.8 >0.8 叶面积(LS)/cm2 446.770±161.408 a 372.357±52.274 a 453.248±202.567 a 274.014±184.981 a 叶长(LL)/mm 369.453±44.521 a 367.110±19.620 a 381.067±57.445 a 265.877±71.885 b 叶宽(LW)/mm 163.647±33.243 a 155.560±14.519 a 166.910±33.531 a 137.603±34.802 a 长宽比(LB) 2.277±0.188 A 2.360±0.096 A 2.360±0.125 A 1.923±0.064 B 叶片含水量(CLWC)/% 83.467±4.867 a 78.797±0.254 a 80.347±0.672 a 79.420±4.421 a 比叶面积(SLAM)/(cm2·g−1) 176.039±55.072 a 139.765±17.650 a 153.537±3.543 a 161.911±43.276 a 比叶重(mLMA)/(g·m−2) 0.601±0.159 a 0.723±0.085 a 0.652±0.015 a 0.645±0.154 a -
从表3可知,不同郁闭度回归种植对3年生海南风吹楠Chl、Chla含量、Chlb含量以及Chla/b无显著性差异,只表现在不同郁闭度回归种植对3年生海南风吹楠Caro含量影响不同,表现为0.3~0.5郁闭度处理组的Caro含量是0~0.2郁闭度处理组的1.605倍,相比较两者之间表现出差异显著性。表明不同郁闭度对回归种植的3年生海南风吹楠的光合色素影响不大。
表 3 不同郁闭度对回归种植的海南风吹楠光合色素的影响
Table 3. Effects of different canopy densities on photosynthetic pigments of H. hainanensis Merr reintroduced
光合色素
Photosynthetic pigment郁闭度 Canopy closure 0~0.2 0.3~0.5 0.6~0.8 >0.8 总叶绿素(Chl)/(mg·g−1) 0.725±0.179 a 1.070±0.269 a 1.064±0.258 a 1.119±0.107 a 叶绿素a(Chla)/(mg·g−1) 0.410±0.079 a 0.677±0.220 a 0.617±0.158 a 0.648±0.095 a 叶绿素b(Chlb)/(mg·g−1) 0.315±0.101 a 0.393±0.086 a 0.448±0.101 a 0.471±0.065 a 叶绿素a/b(Chla/b) 1.355±0.230 a 1.747±0.470 a 1.371±0.065 a 1.402±0.329 a 类胡萝卜素(Caro)/(mg·g−1) 0.081±0.014 b 0.130±0.031 a 0.108±0.023 ab 0.108±0.017 ab -
从表4可知,各郁闭度处理组的SOM、AP、AN、TK、TN、TP、Wg无差异显著性,>0.8郁闭度处理组的pH值显著大于0~0.2郁闭度,但均在6.5以下,属于酸性土壤,AK表现出0~0.2、>0.8郁闭度处理组极显著大于其他处理组,说明各处理组之间的养分含量差异性不大。表明不同郁闭度处理组的土壤养分基本一致。
表 4 不同郁闭度试验土壤养分分析
Table 4. Analysis of soil nutrients of the land under trial at different canopy closures
土壤养分
Soil nutrients郁闭度 Canopy closure 0~0.2 0.3~0.5 0.6~0.8 >0.8 土壤有机质(SOM)/(g·kg)−1 27.200±4.572 a 25.748±1.003 a 32.289±17.103 a 24.665±9.407 a pH值 5.497±0.166 b 5.533±0.031 ab 5.523±0.473 ab 6.040±0.180 a 有效磷(AP)/(mg·kg−1) 8.299±2.841 a 7.219±0.947 a 8.208±1.034 a 7.621±2.840 a 速效钾(AK)/(mg·kg−1) 85.644±8.376 A 48.915±10.000 B 53.405±8.211 B 80.614±9.186 A 碱解氮(AN)/(mg·kg−1) 108.725±6.150 a 109.538±2.987 a 99.254±51.739 a 98.632±20.060 a 全钾(TK)/(g·kg−1) 20.945±1.174 a 21.841±3.518 a 20.669±5.986 a 23.633±6.766 a 全氮(TN)/(g·kg−1) 0.563±0.037 a 0.642±0.050 a 0.627±0.196 a 0.566±0.154 a 全磷(TP)/(g·kg−1) 0.048±0.002 a 0.050±0.001 a 0.050±0.001 a 0.051±0.005 a 含水量(Wg)/% 1.067±0.252 a 1.200±0.557 a 1.367±0.321 a 5.000±7.029 a -
在2019年7月,处理组表现出900 m海拔显著小于其他处理组,在翌年5月份,600 m海拔处的海南风吹楠苗高显著大于900 m处海南风吹楠苗高(图3)。说明经过长期适应后600 m处更适宜海南风吹楠苗高的增加。
-
从图4可知,各处理组地径在2019年5、7、9、11月和翌年1、3、5月均呈现增加的趋势。2019年5月,300 m海拔的海南风吹楠地径显著大于其他2个海拔,到2019年9月,只显著大于900 m处海南风吹楠地径,而与600 m处海南风吹楠无显著性差异,到翌年1月,600 m处理组的海南风吹楠地径显著大于900 m处理组,但两者与300 m处理组无显著性差异。说明不同海拔对回归种植的海南风吹楠的地径影响不明显。
-
从表5可知,600 m海拔的海南风吹楠叶长和长宽比达到最大值,分别为381.067 mm和2.360;900 m和300 m处理组的叶长显著小于600 m处理组,而300 m处理组的长宽比极显著小于600 m处理组,900 m处理组显著小于600 m处理组。300、600、900 m处理组间的海南风吹楠叶面积、叶宽未表现出差异显著性。不同海拔高度对海南风吹楠叶片性状的影响不同,600 m海拔处理组的叶片含水量、比叶面积达到最大值,分别为80.347%、153.537 cm2·g−1,并表现出极显著大于其他处理组,叶片含水量和比叶面积的变化均呈现出600 m>300 m>900 m,而900 m处理组的比叶面积达最大值,为111.329 g·m−2,且极显著大于其他处理组,600 m处理组显著小于300 m处理组,比叶重呈现出900 m>300 m>600 m的规律。由此可知,600 m海拔处理组有助于增加海南风吹楠叶片的含水量和比叶面积,900 m海拔处理有助于增加海南风吹楠的比叶重。
表 5 不同海拔对回归种植的海南风吹楠叶片形状和性状的影响
Table 5. Effects of different altitudes on the leaf shape and traits of H. hainanensis Merr. reintroduced
叶片形状与性状指标
Leaf shape and traits海拔 Altitudes/m 300 600 900 叶面积(LS)/cm2 31 488.955±8 340.246 a 45 324.803±20 256.727 a 26 909.088±15 545.533 a 叶长(LL)/mm 290.603±26.515 b 381.067±57.455 a 281.658±58.381 b 叶宽(LW)/mm 154.363±17.085 a 166.910±33.531 a 134.203±35.936 a 长宽比(LB) 1.883±0.046 Bc 2.360±0.125 Aa 2.118±0.127 ABb 叶片含水量(CLWC)/% 76.300±0.733 B 80.347±0.672 A 72.435±1.609 C 比叶面积(SLAM)/(cm2·g−1) 117.865±10.345 Bb 153.537±3.543 Aa 91.542±15.209 Bc 比叶重(mLMA)/(g·m−2) 85.310±7.096 ABb 65.154±1.484 Bc 111.329±16.870 Aa -
从表6可知,不同海拔高度对海南风吹楠的叶绿素、叶绿素 a和类胡萝卜素差异不显著,600 m处理组的海南风吹楠叶绿素 b达到最大值(0.448 mg·g−1),而叶绿素 a/b却达到最小值(1.371),600 m处理组叶绿素 b含量显著大于300 m处理组,极显著大于900 m处理组,900 m与300 m处理组之间无显著差异,600 m处理组的叶绿素 a/b值极显著小于900 、300 m处理组。由此可知,600 m处理可以增加叶绿素 b的含量,降低叶绿素 a/b的值。
表 6 不同海拔对回归种植的海南风吹楠叶片光合色素的影响
Table 6. Effects of different altitudes on photosynthetic pigments in the leaves of H. hainanensis Merr. reintroduced
光合色素
Photosynthetic pigment海拔 Altitudes/m 300 600 900 总叶绿素(Chl)/(mg·g−1) 0.794±0.444 a 1.065±0.258 a 0.585±0.149 a 叶绿素a(Chla)/(mg·g−1) 0.556±0.298 a 0.617±0.158 a 0.439±0.102 a 叶绿素b(Chlb)/(mg·g−1) 0.239±0.146 ABb 0.448±0.101 Aa 0.146±0.047 Bb 叶绿素a/b(Chla/b) 2.574±0.578 A 1.371±0.065 B 3.070±0.231 A 类胡萝卜素(Caro)/(mg·g−1) 0.111±0.046 a 0.108±0.023 a 0.116±0.026 a -
从表7可知,各海拔的pH值、AN、TK含量无差异显著性。900 m处理组的土壤SOM含量达到最大值,为54.787 g·kg−1,是300 m处理组的3.941倍,并且两者之间达到极显著差异。AK的含量表现为300 m处理组达到最大值(87.130 mg·kg−1),是600 m处理组(53.403 mg·kg−1)的1.632倍,是900 m处理组的1.277倍,并表现为300 m处理组极显著大于600 m和900 m处理组,900 m处理组AK含量是600 m处理组的1.277倍,两者之间表现出差异显著性,各处理组AK含量大小表现为300 m>900 m>600 m。表明各海拔处理试验的土壤养分基本一致。
表 7 不同海拔试验样地土壤养分分析
Table 7. Analysis of soil nutrients in the sampling plots at different altitudes
土壤养分
Soil nutrients海拔 Altitudes/m 300 600 900 土壤有机质(SOM)/g·kg−1 13.903±9.314 B 32.287±17.104 AB 54.787±6.557 A pH值 5.213±0.577 a 5.523±0.473 a 4.750±0.453 a 有效磷(AP)/(mg·kg−1) 6.927±1.115 a 8.210±1.034 a 10.070±2.410 a 速效钾(AK)/(mg·kg−1) 87.130±5.117 Aa 53.403±8.208 Bc 68.220±3.296 Bb 碱解氮(AN)/(mg·kg−1) 83.950±7.762 a 99.257±61.744 a 142.690±13.178 a 全钾(TK)/(g·kg−1) 15.750±0.471 a 20.667±5.986 a 18.023±7.556 a 全氮(TN)/(g·kg−1) 0.567±0.261 a 0.627±0.199 a 0.797±0.101 a 全磷(TP)/(g·kg−1) 0.048±0.021 a 0.050±0.011 a 0.052±0.021 a 含水量(Wg)/% 1.367±1.150 a 1.367±0.321 a 1.067±0.416 a -
株高和地径能直接体现植物生长速度的状况,也是植物适应环境的直观表现[22]。本研究结果显示,较高(>0.8)郁闭度回归种植不利于海南风吹楠株高和地径的增加。因为光照作为重要的外部环境影响因素之一,对植物的生长发育起着决定性作用[23]。在高郁闭度下,植物受到的光照强度较小,植物光合作用速率降低,从而植物积累有机物的量变少,导致海南风吹楠相对于其他低郁闭度处理组的株高和地径变小。韩春丽[24]、何小燕[25]、何晓童[26]通过对红芸豆、油茶、脐橙的研究表明,弱光会使植物的叶片出现发育缓慢、叶色变淡、叶面积变大、比叶面积增大、比叶重显著减小等现象。本研究发现,高郁闭度(>0.8)回归种植能够显著降低叶长,与其研究结果相似,但也有研究表明,弱光对桃树叶面积、干湿重影响不大,叶型对光照强度的响应情况可能与树种,环境的温湿度也具有较强的相关性[27]。SINGH等[28]的研究结果表明,弱光胁迫下植株功能叶片总叶绿素含量和类胡萝卜素含量均上升。叶绿素b和类胡萝卜素含量的增加有利于吸收漫射光中的蓝紫光,使处于弱光中的植株充分对光的利用,而叶绿素b的含量增加得更多,会使叶绿素a/b的比值下降,叶绿体对2,6−二氯酚靛酚的还原能力增加,叶绿体光合磷酸化活性增高,从而影响植物光合作用的进行[29-30]。而本研究发现,不同郁闭度对回归种植的3年生海南风吹楠的光合色素影响不大。虽然其中光是影响叶绿素形成的主要环境因子,而光照、水分、温度、氧气以及营养元素都是影响叶绿体形成环境因子,不能避免。从中可知,当海南风吹楠回归种植在0~0.8郁闭度将会提高其生长速度,能使海南风吹楠快速适应环境。
海拔作为一个重要地形因子,环境中各种生态因子,如温度、湿度、降雨量太阳光以及紫外线辐射强度等,随着海拔的变化均会发生不同程度的变化。大量研究显示:随着海拔的升高,大多数植物叶面积逐渐减小[31],但也会出现增大或先增大后减小的现象[32],而叶绿素含量则随海拔的升高呈现下降趋势[33],但也存有变化不明显的结果[34]。本研究发现,600 m海拔处理组能显著增加株高、叶片含水量、比叶面积、叶绿素b,对叶型指标无显著性差异,在300 m海南风吹楠的株高较小可能是由于氧气充足,雨量较少等自然原因造成的。而900 m处海南风吹楠的株高较低,但长势粗壮,原因可能是高海拔下低温,雨量充足,导致海南风吹楠长势粗壮抗逆能力比300 m的高。可知600 m海拔回归种植最适,能显著增加海南风吹楠的生长和叶型指标,使其快速适应环境。
速效钾含量是表征土壤钾素供应状况的重要指标之一。钾肥能促进植物进行光合作用,促进植物蛋白质的合成,使植物的枝叶更坚韧、厚实,还能提高植物抗病、抗寒、抗旱、抗倒伏、抗盐等抗逆性能,从而改善植物的质量,提高植物对氮元素的吸收[35]。在本研究中0~0.2郁闭度和>0.8郁闭度以及300 m海拔的AK值表现出较大值,但是>0.8郁闭度、300 m海拔的海南风吹楠长势并不理想。由此可见,AK相对于海拔和郁闭度,并不是主要影响因子。此外,不同海拔的SOM值不同,总体表现为900 m海拔SOM极显著大于300 m海拔处理组,300 m和900 m海拔的海南风吹楠长势并不好。由此可见,SOM相对于海拔因子不是主要影响因子。
综上可知,600 m海拔、低郁闭度(0.3~0.8)的环境有益于3年生海南风吹楠苗回归种植的生长。
Effects of Different Canopy Closures and Altitudes on the Leaves and Growth Indexes of Horsfieldia hainanensis Merr. reintroduced
-
摘要: 为探究不同回归方式对海南风吹楠(Horsfieldia hainanensis Merr.)生长的影响,通过不同海拔(300、600、900 m)和不同郁闭度(0~0.2、0.3~0.5、0.6~0.8、>0.8)对3年生海南风吹楠进行回归种植,观测其生长指标、叶性和叶型的变化。结果显示:(1)>0.8郁闭度回归种植能显著降低海南风吹楠株高、地径、叶长(LL)、叶宽(LB),对光合色素等指标无显著影响;(2)600 m海拔处理组能显著增加株高、叶片含水量(CLWC)、比叶面积(SLAM)、叶绿素b(Chl b),对叶型指标无显著性差异。试验结果表明,600 m海拔和低郁闭度(0.3~0.8)回归种植有益于3年生海南风吹楠的生长。Abstract: In order toTo explore the impact of different reintroduction methods on the growth of Horsfieldia. hainanensis Merr., three-year-old trees of H. hainanensis Merr. were reintroduced intoo the areas for planting at different altitudes (300, 600, 900 m) under different canopy closures (0~0.2, 0.3~0.5, 0.6~0.8, >0.8) to observe the changes in their growth indicators, leaf traits and leaf shape. The results showed that higher canopy closure (>0.8) significantly reduced the plant height, ground diameter, leaf length (LL) and leaf width (LB) of H. hainanensis Merr reintroduced, but had no significant effect on photosynthetic pigments and other indicators. The altitude of 600 m significantly increased the plant height, leaf water content (CLWC), specific leaf area (SLAM), chlorophyll b (Chl b) of H. hainanensis Merr. reintroduced, and there was no significant difference in leaf shape. It is concluded that the altitude of 600 m and the low canopy closure (0.3~0.8) is beneficial to the growth of the 3-year-old trees of H. hainanensis Merr. reintroduced, which provides a reference for the effective conservation and restoration of H. hainanensis Merr.
-
Key words:
- reintroduction /
- Horsfieldia hainanensis Merr. /
- endangered plants /
- growth /
- leaves
-
表 1 试验地立地环境条件
Table 1 Site environmental conditions in the land under trial
立地环境
Site environment海拔 Altitude / m 300 600 900 经纬度 E:109°32′7.69″ E:109°30′39.66″~109.30′40.33″ E:109°35′26.34″ W:18°45′51.22″ W:18°49′34.64″~18°49′35.57″ W:18°48′33.17″ 坡向 南坡 东南坡 东南坡 坡度 陡坡 陡坡 陡坡 坡位 上坡 山谷 上坡 优势树种 花梨、凤凰木 马占相思 黄桐木、喜树 林分平均胸径/cm 12.326 22.353 8.358 平均株高/m 6.367 18.546 3.569 SOM/(g·kg−1) 13.903±9.314 32.287±17.104 54.787±6.557 pH值 5.213±0.577 5.523±0.473 4.750±0.453 AP/(mg·kg−1) 6.927±1.115 8.210±1.034 10.070±2.410 AK/(mg·kg−1) 87.130±5.117 53.403±8.208 68.220±3.296 AN/(mg·kg−1) 83.950±7.762 99.257±61.744 142.690±13.178 TK/(g·kg−1) 15.750±0.471 20.667±5.986 18.023±7.556 TN/(g·kg−1) 0.567±0.261 0.627±0.199 0.797±0.101 TP/(g·kg−1) 0.048±0.021 0.050±0.011 0.052±0.021 Wg/% 1.367±1.150 1.367±0.321 1.067±0.416 注:SOM. 土壤有机质;AP. 有效磷;AK. 速效钾;AN. 碱解氮;TK. 全钾;TN. 全氮;TP. 全磷;Wg. 含水量。
Notes: SOM. Soil organic matter; AP. Available phosphorous; AK. Available potassium; AN. Available nitrogen; TK. Total potassium; TN. Total nitrogen; TP. Total phosphorus; Wg: Water content.表 2 不同郁闭度对回归种植的海南风吹楠叶片性状和形状的影响
Table 2 Effects of different canopy closures on the leaf traits and shapes of H. hainanensis Merr. reintroduced
叶片形状与性状指标
Leaf shape and trait indicators郁闭度 Canopy closure 0~0.2 0.3~0.5 0.6~0.8 >0.8 叶面积(LS)/cm2 446.770±161.408 a 372.357±52.274 a 453.248±202.567 a 274.014±184.981 a 叶长(LL)/mm 369.453±44.521 a 367.110±19.620 a 381.067±57.445 a 265.877±71.885 b 叶宽(LW)/mm 163.647±33.243 a 155.560±14.519 a 166.910±33.531 a 137.603±34.802 a 长宽比(LB) 2.277±0.188 A 2.360±0.096 A 2.360±0.125 A 1.923±0.064 B 叶片含水量(CLWC)/% 83.467±4.867 a 78.797±0.254 a 80.347±0.672 a 79.420±4.421 a 比叶面积(SLAM)/(cm2·g−1) 176.039±55.072 a 139.765±17.650 a 153.537±3.543 a 161.911±43.276 a 比叶重(mLMA)/(g·m−2) 0.601±0.159 a 0.723±0.085 a 0.652±0.015 a 0.645±0.154 a 表 3 不同郁闭度对回归种植的海南风吹楠光合色素的影响
Table 3 Effects of different canopy densities on photosynthetic pigments of H. hainanensis Merr reintroduced
光合色素
Photosynthetic pigment郁闭度 Canopy closure 0~0.2 0.3~0.5 0.6~0.8 >0.8 总叶绿素(Chl)/(mg·g−1) 0.725±0.179 a 1.070±0.269 a 1.064±0.258 a 1.119±0.107 a 叶绿素a(Chla)/(mg·g−1) 0.410±0.079 a 0.677±0.220 a 0.617±0.158 a 0.648±0.095 a 叶绿素b(Chlb)/(mg·g−1) 0.315±0.101 a 0.393±0.086 a 0.448±0.101 a 0.471±0.065 a 叶绿素a/b(Chla/b) 1.355±0.230 a 1.747±0.470 a 1.371±0.065 a 1.402±0.329 a 类胡萝卜素(Caro)/(mg·g−1) 0.081±0.014 b 0.130±0.031 a 0.108±0.023 ab 0.108±0.017 ab 表 4 不同郁闭度试验土壤养分分析
Table 4 Analysis of soil nutrients of the land under trial at different canopy closures
土壤养分
Soil nutrients郁闭度 Canopy closure 0~0.2 0.3~0.5 0.6~0.8 >0.8 土壤有机质(SOM)/(g·kg)−1 27.200±4.572 a 25.748±1.003 a 32.289±17.103 a 24.665±9.407 a pH值 5.497±0.166 b 5.533±0.031 ab 5.523±0.473 ab 6.040±0.180 a 有效磷(AP)/(mg·kg−1) 8.299±2.841 a 7.219±0.947 a 8.208±1.034 a 7.621±2.840 a 速效钾(AK)/(mg·kg−1) 85.644±8.376 A 48.915±10.000 B 53.405±8.211 B 80.614±9.186 A 碱解氮(AN)/(mg·kg−1) 108.725±6.150 a 109.538±2.987 a 99.254±51.739 a 98.632±20.060 a 全钾(TK)/(g·kg−1) 20.945±1.174 a 21.841±3.518 a 20.669±5.986 a 23.633±6.766 a 全氮(TN)/(g·kg−1) 0.563±0.037 a 0.642±0.050 a 0.627±0.196 a 0.566±0.154 a 全磷(TP)/(g·kg−1) 0.048±0.002 a 0.050±0.001 a 0.050±0.001 a 0.051±0.005 a 含水量(Wg)/% 1.067±0.252 a 1.200±0.557 a 1.367±0.321 a 5.000±7.029 a 表 5 不同海拔对回归种植的海南风吹楠叶片形状和性状的影响
Table 5 Effects of different altitudes on the leaf shape and traits of H. hainanensis Merr. reintroduced
叶片形状与性状指标
Leaf shape and traits海拔 Altitudes/m 300 600 900 叶面积(LS)/cm2 31 488.955±8 340.246 a 45 324.803±20 256.727 a 26 909.088±15 545.533 a 叶长(LL)/mm 290.603±26.515 b 381.067±57.455 a 281.658±58.381 b 叶宽(LW)/mm 154.363±17.085 a 166.910±33.531 a 134.203±35.936 a 长宽比(LB) 1.883±0.046 Bc 2.360±0.125 Aa 2.118±0.127 ABb 叶片含水量(CLWC)/% 76.300±0.733 B 80.347±0.672 A 72.435±1.609 C 比叶面积(SLAM)/(cm2·g−1) 117.865±10.345 Bb 153.537±3.543 Aa 91.542±15.209 Bc 比叶重(mLMA)/(g·m−2) 85.310±7.096 ABb 65.154±1.484 Bc 111.329±16.870 Aa 表 6 不同海拔对回归种植的海南风吹楠叶片光合色素的影响
Table 6 Effects of different altitudes on photosynthetic pigments in the leaves of H. hainanensis Merr. reintroduced
光合色素
Photosynthetic pigment海拔 Altitudes/m 300 600 900 总叶绿素(Chl)/(mg·g−1) 0.794±0.444 a 1.065±0.258 a 0.585±0.149 a 叶绿素a(Chla)/(mg·g−1) 0.556±0.298 a 0.617±0.158 a 0.439±0.102 a 叶绿素b(Chlb)/(mg·g−1) 0.239±0.146 ABb 0.448±0.101 Aa 0.146±0.047 Bb 叶绿素a/b(Chla/b) 2.574±0.578 A 1.371±0.065 B 3.070±0.231 A 类胡萝卜素(Caro)/(mg·g−1) 0.111±0.046 a 0.108±0.023 a 0.116±0.026 a 表 7 不同海拔试验样地土壤养分分析
Table 7 Analysis of soil nutrients in the sampling plots at different altitudes
土壤养分
Soil nutrients海拔 Altitudes/m 300 600 900 土壤有机质(SOM)/g·kg−1 13.903±9.314 B 32.287±17.104 AB 54.787±6.557 A pH值 5.213±0.577 a 5.523±0.473 a 4.750±0.453 a 有效磷(AP)/(mg·kg−1) 6.927±1.115 a 8.210±1.034 a 10.070±2.410 a 速效钾(AK)/(mg·kg−1) 87.130±5.117 Aa 53.403±8.208 Bc 68.220±3.296 Bb 碱解氮(AN)/(mg·kg−1) 83.950±7.762 a 99.257±61.744 a 142.690±13.178 a 全钾(TK)/(g·kg−1) 15.750±0.471 a 20.667±5.986 a 18.023±7.556 a 全氮(TN)/(g·kg−1) 0.567±0.261 a 0.627±0.199 a 0.797±0.101 a 全磷(TP)/(g·kg−1) 0.048±0.021 a 0.050±0.011 a 0.052±0.021 a 含水量(Wg)/% 1.367±1.150 a 1.367±0.321 a 1.067±0.416 a -
[1] 蒋迎红, 项文化, 何应会, 等. 极小种群海南风吹楠种群的数量特征及动态[J]. 中南林业科技大学学报, 2017, 37(8): 66 − 71. [2] 党金玲, 杨小波, 黄运峰, 等. 海南风吹楠皮挥发油化学成分GC-MS分析[J]. 中药材, 2009, 32(5): 714 − 716. doi: 10.3321/j.issn:1001-4454.2009.05.023 [3] 刘寿柏, 梅文莉, 曾艳波, 等. 黎药海南风吹楠脂溶性成分研究[J]. 中国民族民间医药, 2010, 19(20): 147 − 149. doi: 10.3969/j.issn.1007-8517.2010.20.145 [4] 蒋迎红, 项文化, 蒋燚, 等. 广西海南风吹楠群落区系组成、结构与特征[J]. 北京林业大学学报, 2016, 38(1): 74 − 82. [5] 钟圣赟, 陈国德, 邱明红, 等. 海南风吹楠在海南岛的地理分布与生境特征[J]. 福建林业科技, 2018, 45(1): 82 − 86. [6] 蒋迎红. 极小种群海南风吹楠生态学特性及濒危成因分析[D]. 长沙: 中南林业科技大学, 2018. [7] 中国科学院中国植物志编辑委员会. 中国植物志[M]. 北京: 科学出版社, 1977: 202 − 204. [8] 许玉兰, 蔡年辉, 吴裕, 等. 几种风吹楠属植物脂肪酸成分分析[J]. 中国油脂, 2012, 37(5): 80 − 82. doi: 10.3969/j.issn.1003-7969.2012.05.020 [9] 何贵整, 蔡林, 梁刚, 等. 海南风吹楠播种育苗技术[J]. 林业实用技术, 2013(6): 35 − 37. [10] 付晓凤, 王莉姗, 朱原, 等. 不同施肥处理对海南风吹楠幼苗生长及生理特性影响[J]. 植物科学学报, 2018, 36(2): 273 − 281. doi: 10.11913/PSJ.2095-0837.2018.20273 [11] 任海, 简曙光, 刘红晓, 等. 珍稀濒危植物的野外回归研究进展[J]. 中国科学: 生命科学, 2014, 44(3): 230 − 237. [12] 任海. 植物园与植物回归[J]. 生物多样性, 2017, 25(9): 945 − 950. doi: 10.17520/biods.2017181 [13] EOJR G, KAYE T N. Reintroduction of rare and endangered plants: common factors, questions and approaches [J]. Australian Journal of Botany, 2007, 55(3): 362 − 370. doi: 10.1071/BT06033 [14] REN H, MA G, ZHANG Q, et al. Moss is a key nurse plant for reintroduction of the endangered herb, Primulina tabacum Hance [J]. Plant Ecology, 2010, 209(2): 313 − 320. doi: 10.1007/s11258-010-9754-5 [15] WANG Z F, REN H, LI Z C, et al. Local genetic structure in the critically endangered, cave-associated perennial herb Primulina tabacum (Gesneriaceae) [J]. Biological Journal of the Linnean Society, 2013, 109(4): 747 − 756. doi: 10.1111/bij.12094 [16] RICHARDSON D M. Restoring diversity: strategies for reintroduction of endangered plants [J]. South African Journal of Botany, 1997, 63(5): 303. doi: 10.1016/S0254-6299(15)30775-4 [17] HAI R, JIAN S G, LIU H X, et al. Advances in the reintroduction of rare and endangered wild plant species [J]. Science China Life Sciences, 2014, 57(6): 603 − 609. doi: 10.1007/s11427-014-4658-6 [18] JELTE V A, JAMES A. Restoration Ecology: The New Frontier[M]. Hoboken: John Wiley & Sons Ltd: 2012. [19] 王威翔. 海南省五指山市土地适宜性评价[D]. 长沙: 中南林业科技大学, 2014. [20] GU Q, CHEN Z P, YU X L, et al. Melatonin confers plant tolerance against cadmium stress via the decrease of cadmium accumulation and reestablishment of microRNA-mediated redox homeostasis [J]. Plant science, 2017, 261(8): 28 − 37. [21] 吴艳, 荣熔, 陈放, 等. 光质对珙桐幼苗形态建成及光合特性的影响[J]. 四川大学学报(自然科学版), 2020, 57(4): 804 − 810. [22] 曾继娟, 朱强. 水分胁迫对3种扁桃的生长与耗水特征的影响[J]. 西北林学院学报, 2018, 33(4): 145 − 152. doi: 10.3969/j.issn.1001-7461.2018.04.24 [23] 刘波, 张庆费, 夏檑. 11种城市木本植物叶片生理物质对遮荫的响应[J]. 浙江林业科技, 2007(6): 15 − 18. doi: 10.3969/j.issn.1001-3776.2007.06.004 [24] 韩春丽. 弱光下纽荷尔脐橙光合生理特性研究[D]. 武汉: 华中农业大学, 2008. [25] 何小燕. 弱光胁迫对油茶幼林光合特性和生长的影响[D]. 长沙: 中南林业科技大学, 2012. [26] 何晓童. 低温弱光对红芸豆幼苗生理及叶片结构的影响[D]. 兰州: 甘肃农业大学, 2018. [27] 柳永强. 弱光对桃光合作用的影响及膜伤害机理研究[D]. 兰州: 甘肃农业大学, 2007. [28] SINGH V P AND DEY S K. Effect of low light stress on growth and yield of rice [J]. Indian Journal of Plant Physiology, 1988, 31(1): 84 − 91. [29] 王明, 蒋卫杰, 余宏军. 弱光逆境对植株生理特性的影响及其调控措施[J]. 内蒙古农业大学学报(自然科学版), 2007(3): 198 − 203. [30] 洪焕新. 浅谈弱光逆境对林木生长发育的影响[J]. 安徽农学通报, 2014, 20(15): 33 − 34. [31] JORDAN D N, SMITH W K. Radiation frost susceptibility and the association between sky exposure and leaf size [J]. Oecologia, 1995, 103(1): 43 − 48. doi: 10.1007/BF00328423 [32] 席本野, 王烨, 贾黎明, 等. 宽窄行栽植模式下三倍体毛白杨根系分布特征及其与根系吸水的关系[J]. 生态学报, 2011, 31(1): 47 − 57. [33] 韩发, 贲桂英, 师生波. 青藏高原不同海拔矮嵩草抗逆性的比较研究[J]. 生态学报, 1998, 18(6): 654 − 659. doi: 10.3321/j.issn:1000-0933.1998.06.014 [34] 祁建, 马克明, 张育新. 辽东栎 (Quercus liaotungensis) 叶特性沿海拔梯度的变化及其环境解释[J]. 生态学报, 2007, 27(3): 930 − 937. doi: 10.3321/j.issn:1000-0933.2007.03.013 [35] 陈相宇, 程凤科, 徐长亮, 等. 庐山土壤速效钾的垂直分布特征研究[J]. 安徽农学通报, 2012, 18(24): 98 − 101. doi: 10.3969/j.issn.1007-7731.2012.24.059 -





 下载:
下载: