-
干旱逐渐成为限制作物生长发育的主要灾害,它不仅导致土壤干燥、养分流失,还限制了作物的光合作用,严重时可导致作物减产甚至绝收,威胁粮食安全[1]。在干旱胁迫下,植物细胞内活性氧(reactive oxygen species,ROS)生成量超过正常水平[2],会导致细胞严重损伤,甚至引发死亡[3]。研究表明,NADPH氧化酶的信号传导通路、光合作用相关通路及FBAs家族基因中SlFBA4和SlFBA7对逆境的响应等均与ROS途径有关[4],然而其分子机制却鲜有报道。植物细胞维持ROS的稳态依赖于酶促反应和非酶促反应等保护机制[5],非酶促反应不依赖酶作为催化剂,反应的发生通常是由物理化学条件(如温度、压力和浓度等)和其他催化剂(如酸、碱、金属离子等)影响的;酶促脱毒系统包括抗坏血酸过氧化物酶(ascorbate peroxidase,APX)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、超氧化物歧化酶(superoxide dismutase,SOD)和过氧化物酶(peroxidase,POD)[6 − 7]。过氧化物酶家族(PODs)成员已被证明在植物生长发育和抗逆过程中发挥着重要的作用,根据过氧化物酶基因的蛋白结构可将该基因家族成员分为两大类,分别为血红素类PODs与非血红素PODs,在植物中非血红素PODs类成员还可分为Ⅰ类、Ⅱ类和Ⅲ类亚家族[8]。Ⅰ类过氧化物酶广泛存在于除动物以外的大多数生物体中,主要作用是清除多余的H2O2,防止细胞受到损伤[9]。Ⅱ类过氧化物酶存在于真菌中,参与木质素的降解[10]。Ⅲ类过氧化物酶作为一个多基因家族仅存于各种植物中,近年来,Ⅲ类过氧化物酶家族在许多物种中被广泛研究,如拟南芥(Arabidopsis thaliana)[11]、玉米(Zea mays)[12]、土豆(Solanum tuberosum)[13]、胡萝卜(Daucus carota)[14]和小麦(Triticum aestivum)[15],但大豆中的PODs基因家族成员及功能研究较少。
大豆(Glycine max)是人类蛋白质和食用油脂的重要来源,中国大豆进口量最高达10 032.7万t,而中国自产只有1 000多万t,超80%需进口国际市场中的转基因大豆,供需严重不足,极大地影响了中国的粮食安全。另外,大豆对水分亏缺十分敏感[16],当大豆生长过程中遭遇干旱胁迫,会使大豆单株减产40%,严重时可达到80%[17 − 18]。然而,关于大豆中POD基因响应干旱胁迫的研究相对较少。POD可通过清除活性氧(ROS)等自由基,保护细胞免受氧化损伤,从而提高植物的抗逆性,但目前关于大豆POD基因在干旱胁迫下的作用及其调控机制尚未得到充分的研究。因此,挖掘与大豆抗旱相关的关键候选基因,鉴定大豆POD基因在干旱胁迫中发挥的作用,对培育大豆抗旱新品种具有重要意义。
本研究通过对干旱胁迫下不同时间点的大豆进行转录组测序(实验室前期工作基础)[19],筛选到1个在干旱处理下表达量增多的Ⅲ类过氧化物酶家族基因GmPOD123,并利用拟南芥进行功能验证,结果显示,在干旱条件下,GmPOD123超表达株系相对WT株系长势较好,叶片呈现较深绿色,萎蔫现象较轻,株高显著升高。在此基础上,本研究通过大豆cDNA酵母文库筛选并利用酵母双杂交及萤光素酶蛋白互补(luciferase complementation assay,LCA)实验鉴定出GmPOD123与GmFBA2存在相互作用。本研究一方面为后续解析其分子调控机制奠定了基础,另一方面为培育抗旱大豆新品系(种)丰富了候选基因资源。
-
大豆材料为‘Williams 82’,对其进行模拟干旱胁迫(w=8% PEG8000的水培)处理,取0、3、6和12 h植株的叶片进行液氮磨样备用。拟南芥植物材料选择Col-0,烟草材料选择本氏烟草(Nicotiana benthamiana)。
-
利用Phytozome 13网站获得GmPOD123序列,设计RT-qPCR引物q-GmPOD123-F和q-GmPOD123-R(表1)。取干旱胁迫下不同时间点的‘Williams 82’大豆叶片进行充分研磨,利用RNAiso Plus试剂提取不同植株组织RNA,利用聚合美公司的反转录试剂盒(MF949-T)将RNA反转录为cDNA。以大豆GmEF1a作为内参基因[20],反应程序为95 ℃ 3 min;95 ℃ 5 s;60 ℃ 30 s;共40个循环;溶解曲线为95 ℃ 20 s;60 ℃ 30 s;95 ℃ 20 s。利用GraphPad Prism 8.0软件对定量结果进行作图。
表 1 引物信息
Table 1. Primer information
引物名称
Primer引物序列(5′−3′)
Primer sequences产物长度/bp
Length/bpGmPOD123-F ATGGGTCGGCTTAATCTCC 978 GmPOD123-R AAGAACAGAACAATCGGTACG pCAMBIA3301-GmPOD123-F ACACGGGGGACTCTTGACCATGGTAATGGGTCGGCTTAATCTCC 978 pCAMBIA3301-GmPOD123-R GTCATCCTTGTAATCACTAGTAAGAACAGAACAATCGGTACG AtEF1a-F CCAGGCTGATTGTGCTGTTC 269 AtEF1a-R ACCAAGGGTGAAAGCAAGAAA GmEF1a-F GCTCTTCTTGCTTTCACCCTT 111 GmEF1a-R TTCCTTCACAATTTCATCATACC q-GmPOD123-F ATTAACACTGTCCCTTTATT 181 q-GmPOD123-R CTGCACAAAGCAATCATGAA -
利用RNAiso Plus试剂提取‘Williams 82’叶片的RNA,利用聚合美公司的反转录试剂盒(MF949-T)将RNA反转录为cDNA。利用Phytozome网站获取GmPOD123的基因CDS序列,利用Primer Premier 5.0软件设计全长克隆引物GmPOD123-F和GmPOD123-R(表1),利用购买于TOYOBO公司的KOD酶完成克隆。PCR程序为98 ℃预变性2 min;98 ℃变性10 s;56 ℃退火5 s;68 ℃延伸6 s;68 ℃后延伸10 s。PCR程序结束后,将产物进行琼脂糖凝胶电泳鉴定,进一步利用诺唯赞公司的产物回收试剂盒(DC301-01)获得胶回收产物,连接克隆载体pEASY-T1生成pEASY-GmPOD123后进行测序。
-
使用pCAMBIA3301-Flag载体、引物pCAMBIA3301-GmPOD123-F和pCAMBIA3301-GmPOD123-R以及酶EcoR Ⅰ和Spe Ⅰ构建pCAMBIA3301-GmPOD123-Flag载体。使用花序侵染法[21]进行农杆菌介导的拟南芥转化,并通过草铵膦(Glufosinate ammonium)筛选和基因组PCR验证阳性苗。进一步,将转过氧化物酶GmPOD123基因的高表达T3代拟南芥(OE-lines)和野生型拟南芥(WT)种子播种在营养土中,在正常条件下(22 ℃,16 h/8 h昼夜,光照条件6 000 lx)培养28 d后,分别进行正常培养组(对照)和干旱胁迫组(不浇水),每组设置3次重复。
-
自激活分析:构建酵母表达载体pGBKT7-GmPOD123,转化到酵母Y2Hgold菌株上,挑选单克隆在SD/-Ade/-His/-Leu/-Trp/X-α-gal(SD-TLHA/X-α-gal)培养基上培养,利用X-α-gal显色确定是否具有自激活作用。
酵母文库筛选:将pGBKT7-GmPOD123诱饵质粒和大豆cDNA酵母文库菌液用Mating法筛选互作蛋白,利用SD-TLHA/X-α-gal培养基筛选,挑选蓝色单克隆摇菌提取酵母质粒测序。
-
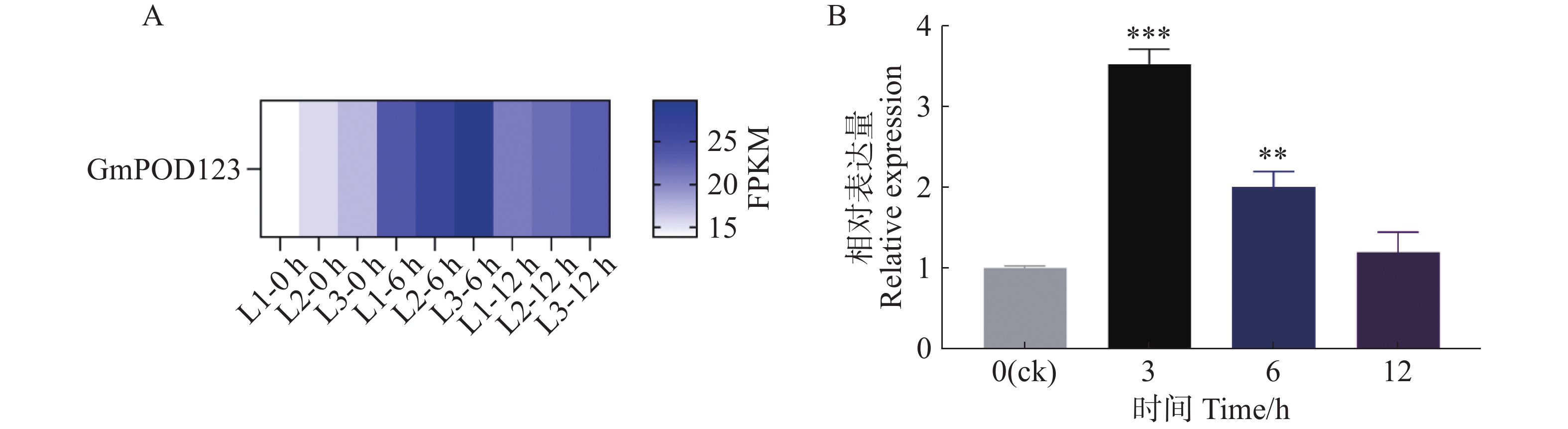
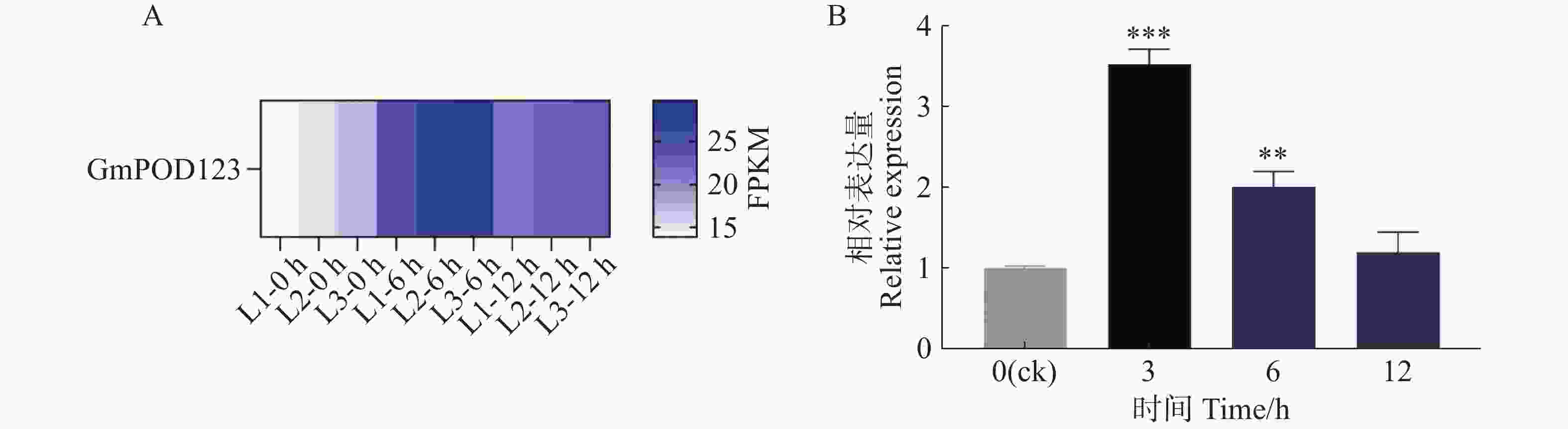
基于本实验室前期干旱胁迫下大豆的转录组测序分析结果发现,GmPOD123基因在干旱胁迫下被显著诱导表达(图1−A)。因此,为进一步明确GmPOD123基因是如何参与抵抗干旱胁迫的过程,本研究首先鉴定了其在干旱胁迫下的表达模式,将大豆植株进行模拟干旱胁迫(8% PEG8000,w/w)处理,于0、3、6 和12 h对大豆的叶片进行取样,液氮研磨后进行实时荧光定量PCR实验。结果显示,与对照组(0 h)相比,胁迫处理后GmPOD123基因的表达量显著高于0 h,且在3 h表达量最高,约为对照组的4倍(图1−B)。研究结果表明,GmPOD123基因显著受干旱胁迫诱导以参与调控大豆植物抗旱过程。
-
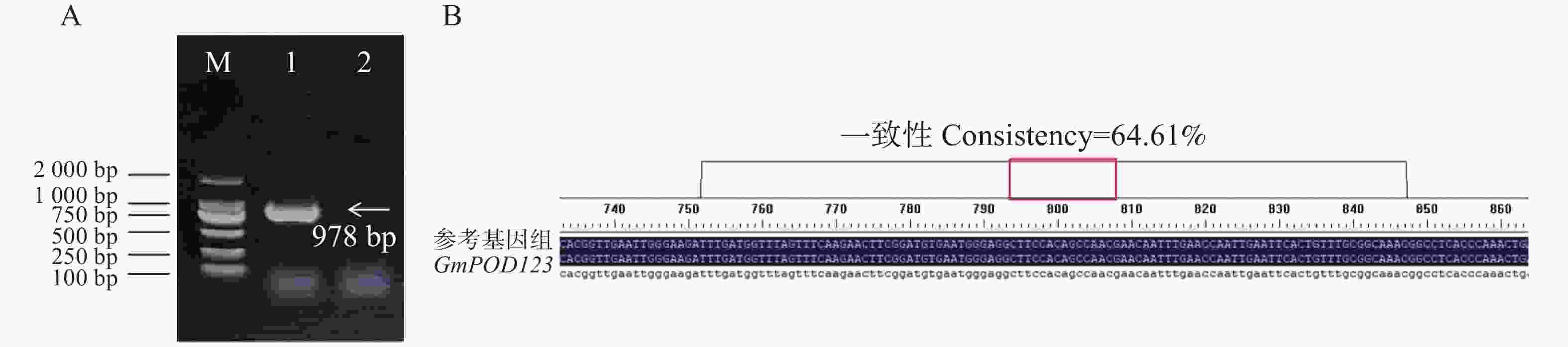
为了分析大豆过氧化物酶基因GmPOD123的生物学功能,本研究首先从phytozome13网站中获取GmPOD123基因的CDS序列,GmPOD123基因全长978 bp,编码168个氨基酸,进一步设计克隆引物GmPOD1233-F和GmPOD123-R,并以大豆‘Williams 82’的cDNA为模板进行基因克隆,电泳条带和测序结果正确,可以用于后续实验(图2)。
-
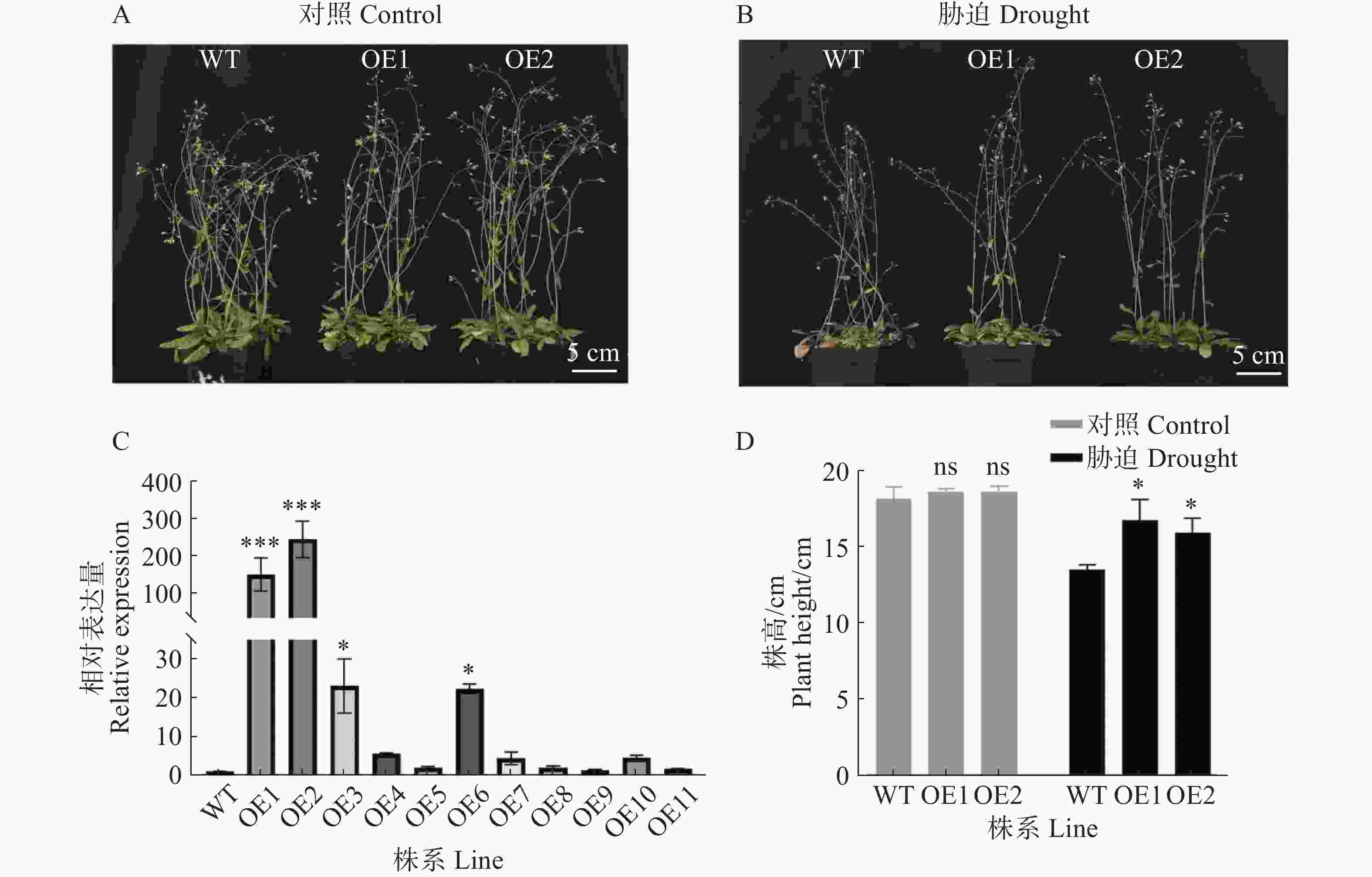
为了验证GmPOD123基因的抗旱性,将超表达过氧化物酶基因GmPOD123的T3代拟南芥与野生型拟南芥在人工气候室培养,生长28 d后对照组正常浇水,胁迫组进行干旱胁迫处理(不浇水),胁迫10 d后观察表型变化。从图3可知,相比对照株系(WT),2个超表达株系(OE1、OE2)在干旱处理后长势更好,株高显著升高,WT株系叶片出现明显萎蔫,说明超表达GmPOD123基因的拟南芥株系对干旱胁迫的耐受性增强。实验结果表明,GmPOD123基因在植株中具有抗旱功能。
-
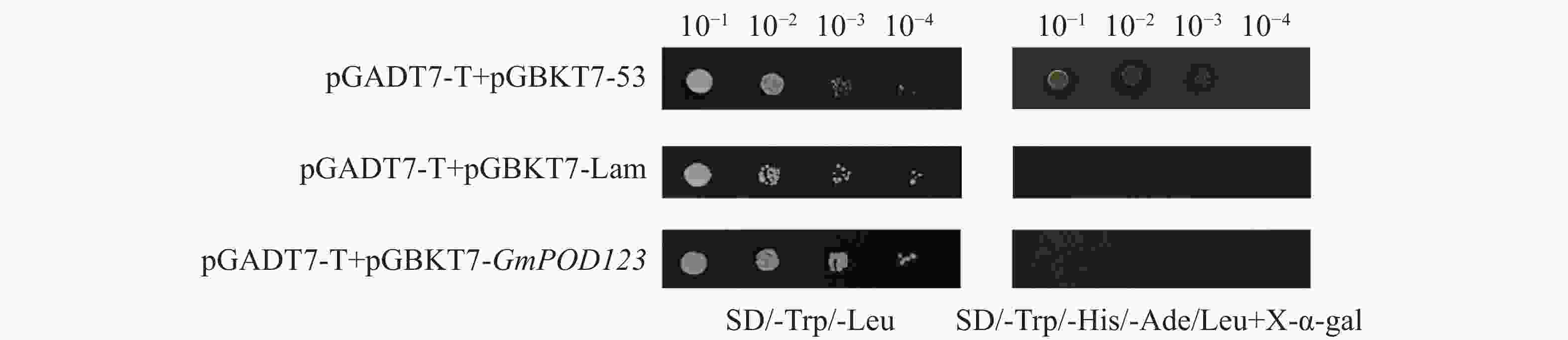
为了研究GmPOD123基因的抗旱机制,利用大豆cDNA酵母文库筛选可能与GmPOD123互作的蛋白,首先通过验证GmPOD123是否有自激活现象来证明后续实验的准确性。结果显示,对照菌株阴性对照pGADT7-T+pGBKT7-Lam在SD/-Trp/-Leu(SD-TH)平板上生长,在SD/-Trp/-His/-Ade/-Leu+X-α-gal(SD-TLHA/X-α-gal)平板上不能正常生长。自激活验证组pGADT7-T+pGBKT7-GmPOD123在SD-TLHA/X-α-gal不能正常生长,验证组与阴性对照组生长一致(图4)。因此,pGBKT7-GmPOD123没有自激活现象,可以进行后续酵母文库筛选实验。
-
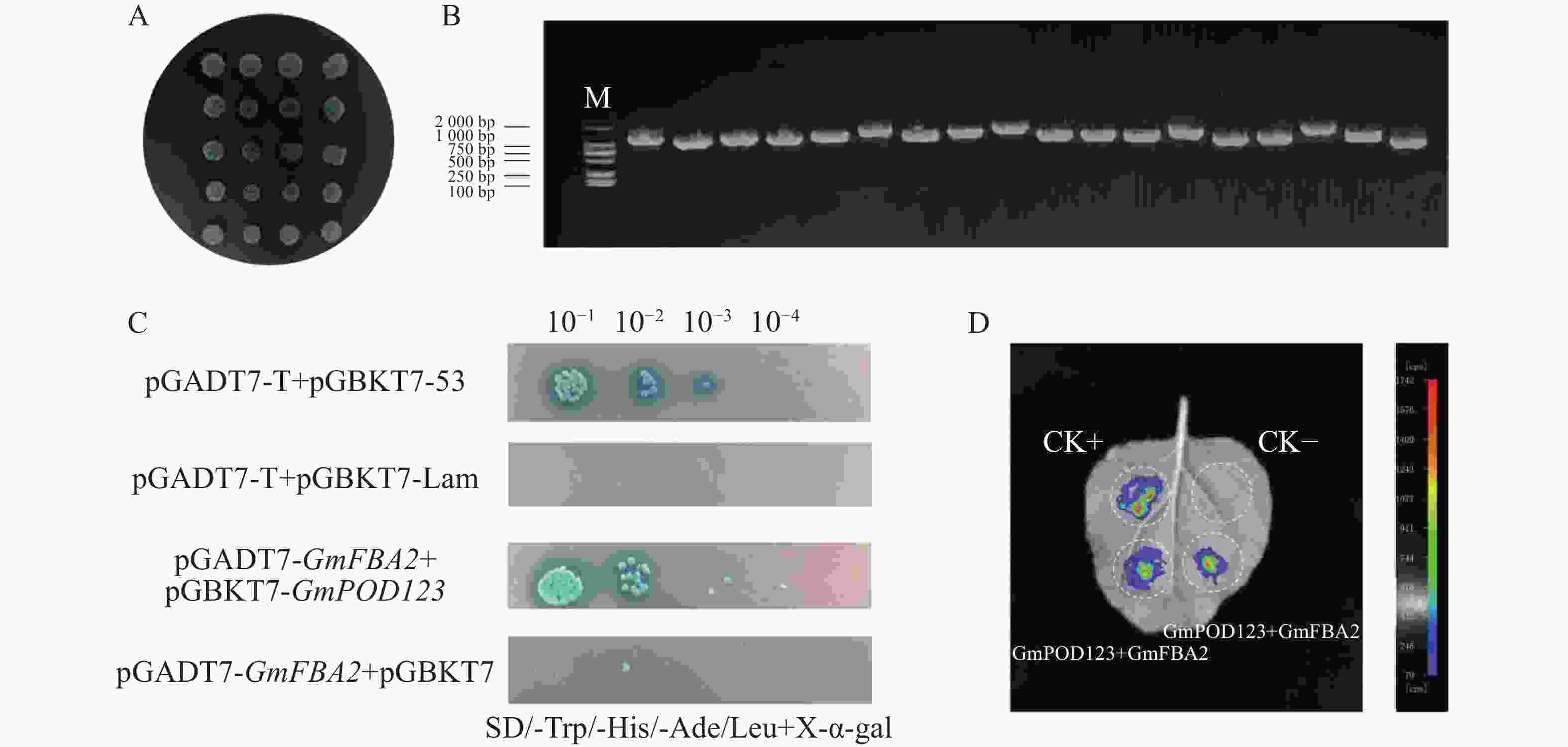
将pGBKT7-GmPOD123诱饵质粒和大豆cDNA酵母文库菌液用Mating法筛选互作蛋白,涂SD-TH筛选平板,挑取蓝色单克隆到SD-TLHA/X-α-gal平板上,从筛库的SD-TLHA/X-α-gal板上菌落中挑取了单克隆进行PCR验证(图5−A—B),经过BLAST比对,最终获得16个基因序列(表2),结果表明,GmPOD123与GmFBA2阳性克隆各3个,这些基因均编码果糖1,6−二磷酸醛缩酶(FBA,fructose-bisphosphate aldolase)。因此推测,GmPOD123与GmFBA2可能存在强互作。FBA家族基因,不仅是植物糖酵解、糖异生和卡尔文循环过程中的关键酶,也在生物和非生物胁迫中起着至关重要的作用[22]。除AtFBA3外,大部分AtFBA基因对根系干旱胁迫均有显著响应;桑树(Morus alba)中的MaFBA可与MaRACK1基因相互作用来调节干旱和盐胁迫耐受性[23]。因此,推测GmFBA2可能会通过与GmPOD123互作,从而调控大豆抗旱性的关键基因。为了证明GmPOD123与GmFBA2的相互作用,首先进行酵母双杂互作验证,结果显示,实验组pGADT7-GmFBA2+pGBKT7-GmPOD123在SD-TLHA/X-α-gal能正常生长且变蓝,表明GmPOD123与GmFBA2蛋白互作(图5−B)。为了进一步验证GmPOD123和GmFBA2存在互作关系,对GmFBA2和GmPOD123进行LCA互作验证,结果表明,GmPOD123和GmFBA2存在互作关系(图5−C)。因此,GmPOD123与GmFBA2之间存在相互作用关系,本实验结果为进一步研究GmPOD123基因在大豆抗旱调控中的作用夯实了理论基础。
表 2 酵母双杂交筛选pGBKT7-GmPOD123的相互作用蛋白
Table 2. Yeast two-hybrid screening of pGBKT7-GmPOD123 interaction proteins
编号
NO.Genebank登录号
GenBank accession number基因注释
Gene annotation1 KAG4988328.1 Fructose-bisphosphate aldolase, chloroplastic 2 NP_001347079.1 3 XP_003544567.1 4 NP_001239738.1 Eukaryotic translation initiation factor 3 subunit F-like 5 NP_001237820.2 Putative cysteine protease 6 XP_003530506.1 Transcription factor bHLH68 7 NP_001238359.2 Arginine decarboxylase/L-arginine carboxy-lyase 8 XP_003522659.1 COP9 signalosome complex subunit 5a COP9 9 XP_003526451.1 COP9 signalosome complex subunit 5b COP9 10 NP_001237784.2 Glutamine synthetase precursor 11 XP_006588591.1 ATP-binding cassette transporter,ABC 12 XP_003528556.1 Linoleate 13S-lipoxygenase 3-1 13 XP_003534305.1 Phosphoribulokinase 14 XP_003547867.1 Mitochondrial/chloroplast ribosomal protein 15 XP_003526673.1 Alcohol dehydrogenase 16 NP_001276147.1 Ribulose bisphosphate carboxylase/oxygenase activase -
植物PODs基因家族主要作为电子受体参与催化过氧化氢(H2O2)的氧化反应[24]。目前,研究者已围绕不同物种中的PODs家族成员展开了相关基础性研究工作,尤其是针对PODs基因家族成员的共同特征,如植物响应生物或非生物胁迫、参与木质素的形成及清除活性氧(ROS)等生物学功能[25],以减轻活性氧对植物造成的氧化损伤,提高植物对逆境胁迫的耐受性。为了深入解析GmPOD123基因的功能,本研究对GmPOD123基因干旱胁迫下的表达模式以及抗旱性进行了鉴定,结果均证实了GmPOD123基因显著受干旱胁迫诱导,且功能鉴定结果表明该基因参与了对大豆抗旱性的调控,为后续解析机制奠定了基础。
PODs基因家族在不同物种中发挥着不同的作用,主要集中在清除活性氧、提高对逆境胁迫的耐受性等生物学功能。过表达OsPRX38基因的水稻植株具有提高自身耐砷性的潜力[26];有研究通过对GmPrx16的超表达株系进行干旱胁迫下的表型鉴定,证明GmPrx16可提高对大豆的耐旱性[27];当橡胶树(Hevea brasiliensis)遭遇干旱胁迫后,会导致HbPOD42的活性与表达量增加,从而增强自身的抗旱性[28]。而在大豆中,GsPOD9已被证明可以被盐胁迫所诱导,进一步通过增加大豆体内的抗氧化反应、降低ROS积累,从而增强大豆耐盐性[29];ALEEM 等[30]对大豆中PODs的家族成员进行了基因家族分析,并验证了GsPOD40在大豆响应干旱胁迫中的生物学功能。本研究的结果表明,干旱胁迫下超表达GmPOD123拟南芥对比野生型拟南芥增强了植株的抗旱性,并推测其可能通过调节ROS通路正向调控植物抵御干旱的能力。
GhPrx14可与GhTrxo蛋白互作通过调控植物叶片活性氧水平来影响植物的防御反应[31];IbBBX24和IbTOE3分别与IbPRX17启动子结合来激活IbPRX17转录增强甘薯对盐和干旱胁迫的耐受性[32]。为了进一步解析GmPOD123基因调控植物抗旱作用的分子机制,本研究首先通过大豆cDNA酵母文库筛选到多个可能与其互作的蛋白,并采用酵母双杂交及萤光素酶蛋白互补方法证实了GmPOD123与果糖1,6−二磷酸醛缩酶(FBA)GmFBA2存在互作关系。近年的研究表明,FBAs家族成员在植物逆境响应中发挥重要作用。如番茄中的StFBAs基因表达水平受高低温胁迫的显著影响,低温胁迫下SlFBA4和SlFBA7过表达株系的ROS含量显著低于野生型[4];水稻中FBA的活性和表达在干旱胁迫下会发生显著变化,其活性随干旱胁迫程度的加剧而显著提高,同时可以通过协调糖代谢和淀粉代谢途径提高水稻的抗旱性[33];此外,桑树MaFBA基因在干旱及H2O2处理下均能上调表达,MaFBA通过与MaRACK1互作调控植物的耐旱性[23]。然而,植物FBAs是如何参与调控植物ROS的机制鲜有报道。因此,基于上述分析结果,本研究团队推测,GmFBA2可以通过与GmPOD123的互作参与维持植物ROS的稳态,从而提高植物的抗旱能力,为后续解析其机制奠定基础。
综上所述,本研究首先通过分析干旱胁迫下大豆中GmPOD123基因的表达模式及其抗旱表型,初步明确了该基因具有提高大豆抗旱性的功能。同时,结合该蛋白对大豆cDNA酵母文库的筛库结果,发掘并鉴定了GmPOD123与GmFBA2存在相互作用,并推测GmFBA2可能通过与GmPOD123的互作从而维持ROS稳态,进而调控大豆的抗旱能力。本研究成果一方面为解析GmPOD123基因是如何调控大豆抗旱性的分子机制奠定了理论基础,另一方面也为培育抗旱大豆新品系(种)提供候选基因资源。
大豆过氧化物酶基因GmPOD123的功能鉴定及互作蛋白的筛选
DOI: 10.15886/j.cnki.rdswxb.20250007
 CSTR: 32425.14.j.cnki.rdswxb.20250007
CSTR: 32425.14.j.cnki.rdswxb.20250007
Functional identification of soybean peroxidase GmPOD123 and screening of interacting proteins
-
摘要: 为深入挖掘调控大豆(Glycine max)抗旱性的关键基因,本研究基于前期干旱处理下大豆叶片转录组结果,筛选出受干旱胁迫显著诱导的过氧化物酶GmPOD123基因。首先,为了鉴定GmPOD123是否响应干旱胁迫,本研究对大豆叶片GmPOD123进行干旱胁迫下的表达分析,结果表明,其在3 h胁迫时被显著诱导。进一步,通过对转GmPOD123基因的拟南芥(Arabidopsis thaliana)进行干旱胁迫下的表型鉴定,明确了其具有提高植物抗旱性的功能。同时,为了解析GmPOD123调控抗旱的分子机制,利用大豆cDNA酵母文库筛选到互作蛋白果糖1,6−二磷酸醛缩酶(GmFBA2),并通过酵母双杂和双萤光素酶互补实验鉴定了其与GmPOD123互作。研究表明,GmFBA2可能通过与GmPOD123的互作参与调控大豆抗旱性的功能。
-
关键词:
- 干旱 /
- 大豆 /
- 过氧化物酶 /
- 果糖1,6−二磷酸醛缩酶
Abstract: To further explore the key genes regulating drought resistance in soybean, the peroxidase gene GmPOD123, which is significantly induced under drought stress, was screened based on previous transcriptomic analyses (RNA-Seq) of soybean leaves under drought stress. An expression analysis of the soybean GmPOD123 gene under drought stress was performed to identify whether GmPOD123 is involved in response to drought stress, and the results showed that GmPOD123 was significantly up-regulated after 3 h stress treatment. Moreover, phenotype identification of transgenic Arabidopsis plants of overexpressing GmPOD123 showed that overexpression of GmPOD123 in Arabidopsis could increase the drought tolerance, which was compared to wild type Arabidopsis. To further explore the drought-resistant molecular mechanism of GmPOD123, fructose-1,6-bisphosphate aldolase (GmFBA2), an interacting protein of GmPOD123, was screened from the soybean cDNA yeast library by Mating, and its interaction with GmPOD123 was identified by yeast two-hybrid system and luciferase complementation assay (LCA). In summary, GmFBA2 may influence ROS levels by interacting with GmPOD123, thereby regulating soybean drought resistance.-
Key words:
- drought /
- Glycine max /
- peroxidase /
- fructose-1, 6-bisphosphate aldolase
-
图 3 超表达GmPOD123拟南芥抗旱表型鉴定
A.正常培养下的拟南芥表型;B.干旱胁迫下的拟南芥表型;C.超表达拟南芥表达量鉴定;D.野生型WT和超表达GmPOD123拟南芥株高统计;WT.野生型株系,OE.超表达株系;*. P<0.05;ns.无显著差异。
Fig. 3 The phenotype identification of GmPOD123 overexpressing Arabidopsis under drought stress
A. Phenotype of Arabidopsis under normal cultivation; B.Phenotype of Arabidopsis under drought stress; C.Identification of the expression level of overexpressed Arabidopsis thaliana; D. Plant height analysis of WT and GmPOD123 overexpressing Arabidopsis; WT. Wild-type line, OE: Overexpression line; *. P<0.05, ns. No significant differences.
图 5 互作蛋白的筛选及互作验证
A.SD-TLHA/X-α-gal筛选结果;B.阳性克隆PCR产物琼脂糖凝胶电泳结果;C.酵母互作验证;D.LCA互作验证。
Fig. 5 Protein interaction screening and validation
A.SD-TLHA/X-α-gal screening results; B.Result of PCR products from partially positive clonal by agarose gel electrophoresis; C. Yeast interaction validation; D. LCA interaction verification.
表 1 引物信息
Table 1 Primer information
引物名称
Primer引物序列(5′−3′)
Primer sequences产物长度/bp
Length/bpGmPOD123-F ATGGGTCGGCTTAATCTCC 978 GmPOD123-R AAGAACAGAACAATCGGTACG pCAMBIA3301-GmPOD123-F ACACGGGGGACTCTTGACCATGGTAATGGGTCGGCTTAATCTCC 978 pCAMBIA3301-GmPOD123-R GTCATCCTTGTAATCACTAGTAAGAACAGAACAATCGGTACG AtEF1a-F CCAGGCTGATTGTGCTGTTC 269 AtEF1a-R ACCAAGGGTGAAAGCAAGAAA GmEF1a-F GCTCTTCTTGCTTTCACCCTT 111 GmEF1a-R TTCCTTCACAATTTCATCATACC q-GmPOD123-F ATTAACACTGTCCCTTTATT 181 q-GmPOD123-R CTGCACAAAGCAATCATGAA 表 2 酵母双杂交筛选pGBKT7-GmPOD123的相互作用蛋白
Table 2 Yeast two-hybrid screening of pGBKT7-GmPOD123 interaction proteins
编号
NO.Genebank登录号
GenBank accession number基因注释
Gene annotation1 KAG4988328.1 Fructose-bisphosphate aldolase, chloroplastic 2 NP_001347079.1 3 XP_003544567.1 4 NP_001239738.1 Eukaryotic translation initiation factor 3 subunit F-like 5 NP_001237820.2 Putative cysteine protease 6 XP_003530506.1 Transcription factor bHLH68 7 NP_001238359.2 Arginine decarboxylase/L-arginine carboxy-lyase 8 XP_003522659.1 COP9 signalosome complex subunit 5a COP9 9 XP_003526451.1 COP9 signalosome complex subunit 5b COP9 10 NP_001237784.2 Glutamine synthetase precursor 11 XP_006588591.1 ATP-binding cassette transporter,ABC 12 XP_003528556.1 Linoleate 13S-lipoxygenase 3-1 13 XP_003534305.1 Phosphoribulokinase 14 XP_003547867.1 Mitochondrial/chloroplast ribosomal protein 15 XP_003526673.1 Alcohol dehydrogenase 16 NP_001276147.1 Ribulose bisphosphate carboxylase/oxygenase activase -
[1] SALEKDEH G H, REYNOLDS M, BENNETT J, et al. Conceptual framework for drought phenotyping during molecular breeding[J]. Trends in Plant Science, 2009, 14(9): 488 − 496. doi: 10.1016/j.tplants.2009.07.007 [2] MØLLER I M, SWEETLOVE L J. ROS signalling-specificity is required[J]. Trends in Plant Science, 2010, 15(7): 370 − 374. doi: 10.1016/j.tplants.2010.04.008 [3] GILL S S, TUTEJA N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J]. Plant Physiology and Biochemistry, 2010, 48(12): 909 − 930. doi: 10.1016/j.plaphy.2010.08.016 [4] 蔡冰冰. 番茄果糖-1, 6-二磷酸醛缩酶基因表达特性及其对光合作用的调控[D]. 泰安: 山东农业大学, 2017. [5] COOKE M S, EVANS M D, DIZDAROGLU M, et al. Oxidative DNA damage: mechanisms, mutation, and disease[J]. The FASEB Journal, 2003, 17(10): 1195 − 1214. doi: 10.1096/fj.02-0752rev [6] NOCTOR G, FOYER C H. ASCORBATE AND GLUTATHIONE: keeping active oxygen under control[J]. Annual Review of Plant Biology, 1998, 49: 249 − 279. doi: 10.1146/annurev.arplant.49.1.249 [7] LIU C, LIN J Z, WANG Y, et al. The protein phosphatase PC1 dephosphorylates and deactivates CatC to negatively regulate H2O2 homeostasis and salt tolerance in rice[J]. The Plant Cell, 2023, 35(9): 3604 − 3625. doi: 10.1093/plcell/koad167 [8] 马鑫磊, 许瑞琪, 索晓曼, 等. 谷子Ⅲ型PRX基因家族全基因组鉴定及干旱胁迫下表达分析[J]. 作物学报, 2022, 48(10): 2517 − 2532. doi: 10.3724/SP.J.1006.2022.14185 [9] SHIGEOKA S, ISHIKAWA T, TAMOI M, et al. Regulation and function of ascorbate peroxidase isoenzymes[J]. Journal of Experimental Botany, 2002, 53(372): 1305 − 1319. doi: 10.1093/jexbot/53.372.1305 [10] PIONTEK K, SMITH A T, BLODIG W. Lignin peroxidase structure and function[J]. Biochemical Society Transactions, 2001, 29(Pt 2): 111−116. doi: 10.1042/0300-5127:0290111 [11] TOGNOLLI M, PENEL C, GREPPIN H, et al. Analysis and expression of the class Ⅲ peroxidase large gene family in Arabidopsis thaliana[J]. Gene, 2002, 288(1/2): 129 − 138. doi: 10.1016/S0378-1119(02)00465-1 [12] WANG Y, WANG Q Q, ZHAO Y, et al. Systematic analysis of maize class Ⅲ peroxidase gene family reveals a conserved subfamily involved in abiotic stress response[J]. Gene, 2015, 566(1): 95 − 108. doi: 10.1016/j.gene.2015.04.041 [13] YANG X S, YUAN J Z, LUO W B, et al. Genome-wide identification and expression analysis of the class Ⅲ peroxidase gene family in potato (Solanum tuberosum L. )[J]. Frontiers in Genetics, 2020, 11: 593577. doi: 10.3389/fgene.2020.593577 [14] YAN J, SU P S, LI W, et al. Genome-wide and evolutionary analysis of the class Ⅲ peroxidase gene family in wheat and Aegilops tauschii reveals that some members are involved in stress responses[J]. BMC Genomics, 2019, 20(1): 666. doi: 10.1186/s12864-019-6006-5 [15] MENG G, FAN W Y, RASMUSSEN S K. Characterisation of the class Ⅲ peroxidase gene family in carrot taproots and its role in anthocyanin and lignin accumulation[J]. Plant Physiology and Biochemistry, 2021, 167: 245 − 256. doi: 10.1016/j.plaphy.2021.08.004 [16] CONDON A G, RICHARDS R A, REBETZKE G J, et al. Breeding for high water-use efficiency[J]. Journal of Experimental Botany, 2004, 55(407): 2447 − 2460. doi: 10.1093/jxb/erh277 [17] SPECHT J E, CHASE K, MACRANDER M, et al. Soybean response to water: a QTL analysis of drought tolerance[J]. Crop Science, 2001, 41(2): 493 − 509. doi: 10.2135/cropsci2001.412493x [18] GUIMARÃES-DIAS F, NEVES-BORGES A C, VIANA A A B, et al. Expression analysis in response to drought stress in soybean: shedding light on the regulation of metabolic pathway genes[J]. Genetics and Molecular Biology, 2012, 35(S1): 222 − 232. doi: 10.1590/S1415-47572012000200004 [19] ZHOU Y G, LIU W C, LI X W, et al. Integration of sRNA, degradome, transcriptome analysis and functional investigation reveals gma-miR398c negatively regulates drought tolerance via GmCSDs and GmCCS in transgenic Arabidopsis and soybean[J]. BMC Plant Biology, 2020, 20(1): 190. doi: 10.1186/s12870-020-02370-y [20] 张引鹤, 周永刚, 高红桃, 等. 大豆(Glycine max)SUT4基因的克隆、表达及抗逆功能的鉴定[J]. 分子植物育种, 2022, 20(17): 5578 − 5587. doi: 10.13271/j.mpb.020.005578 [21] CLOUGH S J, BENT A F. Floral dip: a simplified method for Agrobacterium-mediated transformation of Arabidopsis thaliana[J]. The Plant Journal, 1998, 16(6): 735 − 743. doi: 10.1046/j.1365-313x.1998.00343.x [22] CAI B B, LI Q, XU Y C, et al. Genome-wide analysis of the fructose 1, 6-bisphosphate aldolase (FBA) gene family and functional characterization of FBA7 in tomato[J]. Plant Physiology and Biochemistry, 2016, 108: 251 − 265. doi: 10.1016/j.plaphy.2016.07.019 [23] LIU C Y, ZHU P P, FAN W, et al. Functional analysis of drought and salt tolerance mechanisms of mulberry RACK1 gene[J]. Tree Physiology, 2019, 39(12): 2055 − 2069. doi: 10.1093/treephys/tpz108 [24] M. -HAMVAS M, MÁTHÉ C, VASAS G, et al. Cylindrospermopsin and microcystin-LR alter the growth, development and peroxidase enzyme activity of white mustard (Sinapis alba L.) seedlings, a comparative analysis [J]. Acta Biologica Hungarica, 2010, 61(S1): 35−48. [25] WU C L, DING X P, DING Z H, et al. The class Ⅲ peroxidase (POD) gene family in cassava: identification, phylogeny, duplication, and expression[J]. International Journal of Molecular Sciences, 2019, 20(11): 2730. doi: 10.3390/ijms20112730 [26] KIDWAI M, DHAR Y V, GAUTAM N, et al. Oryza sativa class Ⅲ peroxidase (OsPRX38) overexpression in Arabidopsis thaliana reduces arsenic accumulation due to apoplastic lignification[J]. Journal of Hazardous Materials, 2019, 362: 383 − 393. doi: 10.1016/j.jhazmat.2018.09.029 [27] ZHANG Z F, MA J K, YANG X, et al. Natural allelic diversities of GmPrx16 confer drought tolerance in soybean[J]. Plant Biotechnology Journal, 2024, 22(3): 535 − 537. doi: 10.1111/pbi.14249 [28] WANG L F, WANG J K, AN F, et al. Molecular cloning and characterization of a stress responsive peroxidase gene HbPRX42 from rubber tree[J]. Brazilian Journal of Botany, 2016, 39(2): 475 − 483. doi: 10.1007/s40415-016-0263-1 [29] JIN T, SUN Y Y, ZHAO R R, et al. Overexpression of peroxidase gene GsPRX9 confers salt tolerance in soybean[J]. International Journal of Molecular Sciences, 2019, 20(15): 3745. doi: 10.3390/ijms20153745 [30] ALEEM M, RIAZ A, RAZA Q, et al. Genome-wide characterization and functional analysis of class Ⅲ peroxidase gene family in soybean reveal regulatory roles of GsPOD40 in drought tolerance[J]. Genomics, 2022, 114(1): 45 − 60. doi: 10.1016/j.ygeno.2021.11.016 [31] 张丽雅. 棉花黄萎病抗性相关基因GhPrx14的功能分析和棉花OFP家族的生物信息学分析[D]. 郑州: 郑州大学, 2022. [32] ZHANG H, WANG Z, LI X, et al. The IbBBX24–IbTOE3–IbPRX17 module enhances abiotic stress tolerance by scavenging reactive oxygen species in sweet potato[J]. New Phytologist, 2022, 233(3): 1133 − 1152. doi: 10.1111/nph.17860 [33] WANG X P, LIU H L, ZHANG D, et al. Photosynthetic carbon fixation and sucrose metabolism supplemented by weighted gene co-expression network analysis in response to water stress in rice with overlapping growth stages[J]. Frontiers in Plant Science, 2022, 13: 864605. doi: 10.3389/fpls.2022.864605 -




 下载:
下载: