-
山栏稻(Oryza sativa L.),又称山兰稻,是海南地区黎、苗等少数民族经过长期种植和选择培育出适合中部干旱地区种植的旱稻品种,是珍贵的旱稻种质资源[1-2]。山栏稻具有抗旱、耐热、抗病、抗虫等优良特性,食味品质性状优异,其米饭味香色美,有“一家煮饭全村香”的美誉[3]。大多数山栏稻品种属于热带粳稻型或偏粳稻型种质资源,籽粒饱满、颖壳颜色、糙米颜色、有无芒等特征性状均表现出山栏稻丰富的种质多样性[4]。充分挖掘山栏稻种质资源,解析其种子中代谢物的种类和含量,是揭示山栏稻种子中营养品质形成机理的前提,对培育优质健康的新品种具有重要意义。代谢组学是继基因组、转录组和蛋白组学之后发展起来的新兴组学技术,是系统生物学重要的组成部分[5]。随着质谱检测技术的不断发展,植物代谢组学的研究也进入快速发展阶段。近年来,水稻(Oryza sativa L.)、玉米(Zea mays L.)、番茄(Solanum lycopersicum)等主要作物的营养品质代谢数据库已经相继建成,并且系统研究了作物中各种营养成分的种类、含量差异以及代谢合成途径,这为深入研究作物营养品质代谢组的生化与遗传机制奠定了基础[6-8]。同时,王守创等[9]对柑橘、甜橙、柚子和柠檬等不同类型的木本科材料进行代谢谱分析,系统地研究了氨基酸等初生代谢物、类黄酮等次生代谢物的组织差异性和群体自然变异;陈伟等[10]发展了新的代谢检测方法,并建立了包含近1 000种营养物质的水稻代谢数据库。有研究表明,决定水稻种子颜色差异的代谢物主要是类黄酮物质,如红色稻米中富含原花青素类代谢物,而黑色和紫色稻米中主要包含糖基化的矢车菊素和芍药花青素[11-12]。目前,关于山栏稻的研究方向主要集中在优质种质资源的收集和耐旱机理的研究,其营养成分的定性和定量分析,以及不同品种代谢谱的自然变异尚未报道。因此,本研究利用超高效液相色谱−高分辨质谱联用技术建立了山栏稻种子代谢数据库,同时,还鉴定了一批用于筛选山栏稻优异种质资源的标记代谢物,旨在为山栏稻营养品质的改良提供优良亲本和丰富水稻育种的种质资源。
HTML
-
本研究选取的实验材料均由海南大学热带作物学院生物多样性与水稻种质创新实验室提供,包括10份山栏稻材料和5份普通水稻(表1)。样品采集:选取长势一致、成熟期一致的水稻植株进行收种,每份材料选取12株随机分为3个生物学重复。萌发试验:选取SR50和ZH11的种子进行萌发,待种子露白后开始计时,分别选取24、48、72 h的萌发种子进行代谢物检测分析。
编号 Code 名称 Name 品种来源 Sources of varieties 分类 Classification 亚种 subspecies SR31 19LD009 海南大学生物多样性与水稻种质创新实验室 地方品种 山栏稻 SR34 19LD036 海南大学生物多样性与水稻种质创新实验室 地方品种 山栏稻 SR36 19LD062 海南大学生物多样性与水稻种质创新实验室 地方品种 山栏稻 SR39 19LD091 海南大学生物多样性与水稻种质创新实验室 地方品种 山栏稻 SR43 19LD118 海南大学生物多样性与水稻种质创新实验室 地方品种 山栏稻 SR44 19LD136 海南大学生物多样性与水稻种质创新实验室 地方品种 山栏稻 SR45 19LD140 海南大学生物多样性与水稻种质创新实验室 地方品种 山栏稻 SR47 19LD142 海南大学生物多样性与水稻种质创新实验室 地方品种 山栏稻 SR49 19LD145 海南大学生物多样性与水稻种质创新实验室 地方品种 山栏稻 SR50 19LD131 海南大学生物多样性与水稻种质创新实验室 地方品种 山栏稻 DJ 东京 海南大学生物多样性与水稻种质创新实验室 常规品种 粳稻 HHZ 黄华占 海南大学生物多样性与水稻种质创新实验室 常规品种 籼稻 NIP 日本晴 海南大学生物多样性与水稻种质创新实验室 常规品种 粳稻 ZH11 中花11 海南大学生物多样性与水稻种质创新实验室 常规品种 粳稻 MH 明恢63 海南大学生物多样性与水稻种质创新实验室 常规品种 籼稻 Table 1. Rice varieties and sources
-
选取饱满的水稻种子进行脱壳,分别将糙米和颖壳研磨成粉末。称取0.1 g粉末样品,加入1.2 mL φ=70%的甲醇涡旋均匀,放到4 ℃环境条件下萃取12 h后进行离心(4 ℃,10 000 g,10 min)。吸取上清用0.22 μm的滤头过滤,滤液保存到进样瓶中待测。MIX样品:从每个提取样品溶液中吸取50 μL加入到进样瓶中,混合均匀作为质控样品,通过比较质控样品的稳定性来反映检测仪器的稳定性。
-
选取UPLC-Thermo Scientific Q EXACTIVE plus系统中Full MS/dd-MS2的模式进行代谢物检测。仪器:高效液相色谱(UltiMate 3000)−四级杆− Orbitrap(Q EXACTIVE plus)高分辨质谱(美国赛默飞世尔科技有限公司)。色谱条件:色谱柱为shim-pack VP-OSD(pore size 5.0 um)C18(日本岛津公司),流动相为水(含φ=0.04%乙酸)和乙腈(含φ=0.04%乙酸)。洗脱梯度:V水∶V乙腈= 95∶5,0 min;V水∶V乙腈= 5∶95,10.0 min;V水∶V乙腈= 5∶95,11.0 min;V水∶V乙腈= 95∶5,11.1 min;V水∶V乙腈= 95∶5,15.0 min。流速为0.4 mL·min−1;柱温为40 ℃;进样量为1 μL。质谱条件:HESI(可加热电喷雾离子源);正离子模式;鞘气辅助流速比例为40;辅助气流速比例为12;喷雾电压3 000 V;毛细管温度360 ℃;S-lens电压55.0 V;辅助气加热温度350 ℃;离子扫描范围m/z 50~1 500。
-
利用Compound discover(Compound Discover3.1.0.305,Thermo)软件对检测数据进行定量分析。首先,在软件中创建新的定量分析方法,导入原始的下机数据,根据样品类型对检测数据进行分类,最后,选择合适的工作流(workflow),调整相应参数进行定量和定性分析。主要参数设置如下:前体离子扫描范围0~5 000 Da,信噪比阈值大于1.5 S/N (signal to noise) Threshold >1.5, 质量公差(mass tolerance)5×10−6 最大转换时间(Maximum shift )2 min,最小峰强度(Min peak intensity)106,洗脱时间(RT)的误差范围在0.1 min。并且利用检测样品相对定量的原始数据进行主成分分析(principle component analysis, PCA)。利用SPSS软件对差异数据进行独立样本t检验分析。
1.1. 材料
1.2. 样品提取
1.3. 仪器检测条件
1.4. 数据处理
-
为了探究山栏稻和普通水稻种子间代谢物谱的差异,笔者利用超高效液相色谱−高分辨质谱联用技术对山栏稻和普通水稻种子的不同组织混合样品进行非靶向代谢组分析。首先,分别提取4个混合样品的总离子色谱图(TIC total ion chromatogram)进行比较分析,结果显示(图1),山栏稻和普通水稻的糙米代谢谱TIC图形相似,只有部分代谢信号的强度存在差异(图1-A);而颖壳间的代谢谱存在显著差异,部分代谢信号只有在山栏稻的颖壳组织中出现(图1-B)。结果表明,在糙米和颖壳2种组织中,山栏稻和普通水稻的代谢物种类和含量都存在显著差异,其中二者的颖壳代谢谱差异最显著。
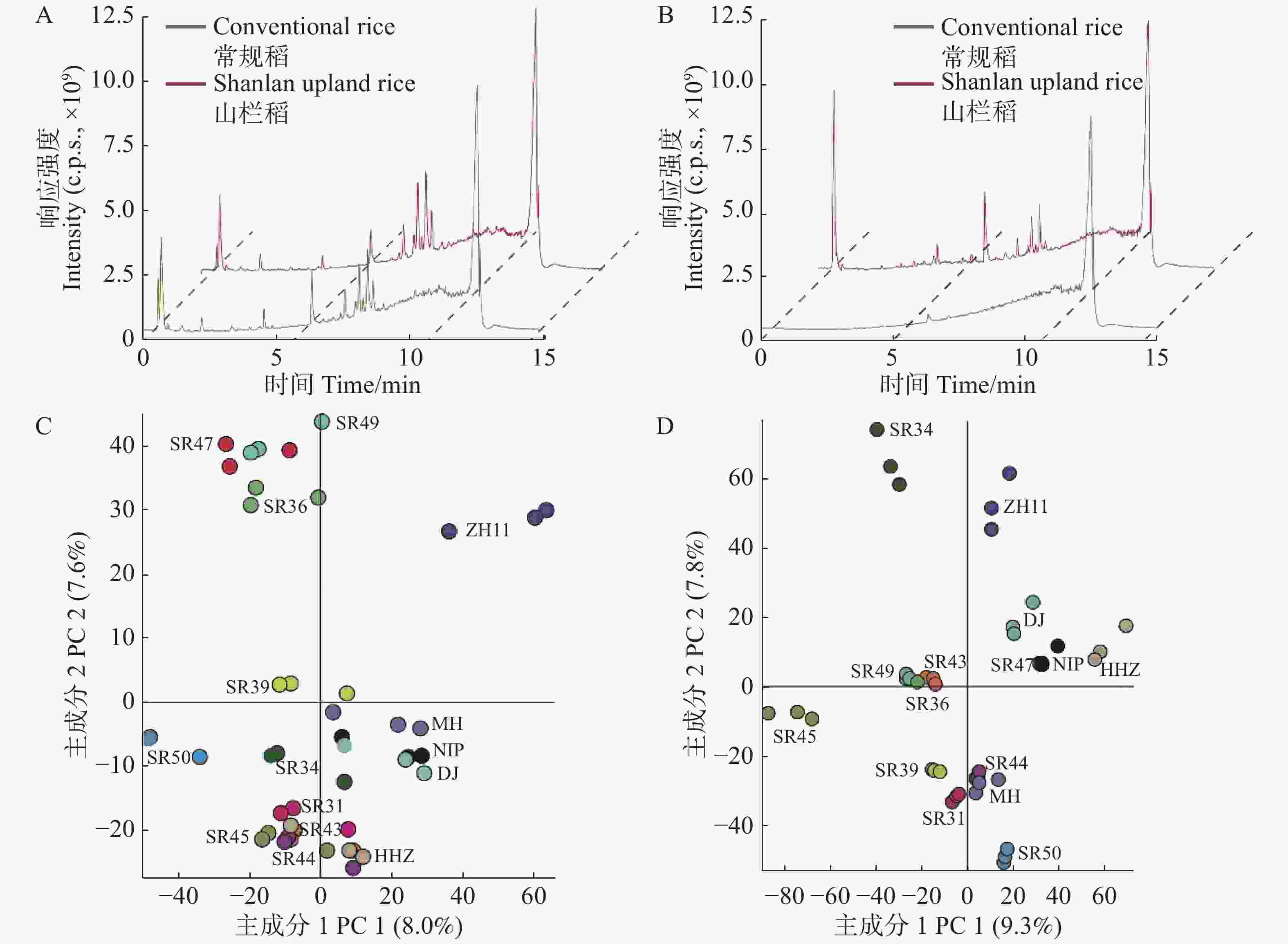
Figure 1. Comparative analysis of the metabolic profile of the seeds of Shanlan upland rice and conventional rice
为了解析山栏稻和普通水稻的代谢谱差异是由那些代谢物导致,笔者对10份山栏稻和5份普通水稻种子的糙米和颖壳进行非靶向代谢组分析,然后通过Compound discover软件对所检测的原始数据进行主成分分析(principal component analysis, PCA)。从图1-C可知,被检测的所有糙米样品明显的聚为2个分组,其中,第1主成分方向特征值占总方差值的8.0%,第2主成分方向特征值占总方差值的7.6%,说明山栏稻和普通水稻的糙米组织的代谢组存在显著差异。进一步分析所有代谢信号的贡献率,发现氨基酸、脂质和类黄酮等物质的贡献值较高(表2),这些代谢物决定了山栏稻和普通水稻的营养成分存在差异。在不同类型的颖壳样品中也得到了类似的结果,山栏稻和普通水稻可以分为2个明显的区域,其中,类黄酮和有机酸类物质贡献值比较高(表3),它们可能是影响山栏稻和普通水稻颖壳代谢差异的主要代谢物(图1-D)。水稻种子的非靶向代谢组结果表明,山栏稻和普通水稻种子的代谢组存在显著的差异,并且二者的营养成分也有明显的不同。
相对分子质量
Molecular mass主成分1
PCA 1主成分2
PCA 2化合物名称
Compound洗脱时间/min
Retention time354.276 43 0.034 378 9 0.000 918 437 1-Linoleoyl glycerol 9.701 302.042 38 0.028 997 9 0.010 197 6 Quercetin 3.976 519.332 24 0.028 574 7 −0.004 207 23 1-Linoleoyl-sn-glycero-3-phosphocholine 8.091 336.265 98 0.028 378 8 −0.004 709 19 1-Linoleoyl glycerol 7.886 517.316 27 0.028 177 8 0.002 056 97 LysoPC(18:3(9Z,12Z,15Z)) 6.647 306.255 39 0.027 342 1 0.019 024 1 Linolenic acid ethyl ester 9.523 175.095 66 0.027 040 7 0.009 328 32 DL-Citrulline 0.737 298.250 43 0.026 830 9 0.004 084 56 ricinelaidic acid 9.425 181.074 04 0.026 607 3 0.014 026 1 L-Tyrosine 0.952 Table 2. Contribution rate of some metabolites in the brown rice of Shanlan upland rice
相对分子质量
Molecular mass主成分1
PCA 1主成分2
PCA 2化合物名称
Compound洗脱时间/min
Retention time386.136 07 0.015 757 9 −0.004 902 46 4′-Hydroxychalcone 4′-glucoside 5.466 478.110 56 0.015 471 6 0.000 835 281 Isorhamnetin 3-O-galactoside 4.378 206.058 07 0.015 443 −0.008 363 35 Sinapinic acid 3.259 556.157 3 0.015 091 2 0.000 527 638 Epicatechin-5-O-glucopyranoside-3-benzoate 5.422 148.052 31 0.015 055 7 0.000 478 577 Cinnamic acid 6.361 402.131 11 0.013 031 7 0.008 570 33 7-Hydroxyflavanone-glucopyranoside 5.256 556.157 08 0.016 353 8 0.008 196 75 Epicatechin-5-O-glucopyranoside-3-benzoate 4.47 242.203 3 0.015 277 9 −0.000 825 511 10-Propoxydecanoic acid 8.974 302.078 91 0.015 036 1 0.000 469 467 Hesperetin 3.638 418.089 42 0.014 878 6 0.000 474 911 Luteolin 3'-xyloside 4.07 Table 3. Contribution rate of some metabolites in the glume shell of Shanlan upland rice
-
为了建立山栏稻种子代谢数据库,对山栏稻种子高分辨质谱数据进行提取,共获得6 809个原始质谱信号。经过冗余信号的去重、峰型筛选,最终获得1 058个高质量的代谢信号。首先,利用标准品比对的方法进行物质鉴定,采用相同检测条件获取标准品数据包括洗脱时间(retention time, RT)、[M+H]+精确荷质比(m/z)和二级质谱碎片信息。代谢信号(metabolite rice, mr)mr1008的质荷比为303.042 2,RT为5.20 min,与槲皮素的质荷比和RT一致。通过比较二者的二级质谱碎片信息,发现mr1 008包含285、257、229、153、137和121等碎片与槲皮素的碎片信息基本一致。其中特征碎片153和257的响应强度较高,分别为1.86×105和8.96×104,故鉴定该物质为槲皮素。在鉴定过程中发现mr690的质荷比为639.195 7与Tricin 7-O-neohesperidoside的质荷比639.191 9基本一致,RT均为4.28 min。mr690的母离子丢失2种类型的糖基碎片(五碳糖:146 Da,六碳糖:162 Da),形成493和331等特征碎片,其碎片强度分别2×106和7×106。由于mr690的m/z、RT以及质谱裂解规律与Tricin 7-O-neohesperidoside一致,故鉴定mr690为Tricin 7-O-neohesperidoside。本研究通过标准品比对的方法共鉴定到126个代谢物。
图2为亚麻酸乙酯的鉴定过程,在人工解谱的过程中,发现mr220的m/z为307.262 4,分子式为C20H34O2,与亚麻酸乙酯的m/z 307.263 1相近,RT为9.76 min,故推断该物质可能为亚麻酸类物质(图2-A)。在mr220的二级质谱碎片中包含261、243、123、95、67等碎片信息,其中,261碎片的产生说明mr220的结构式中包含酯键(图2-B),mr220物质的碎片信息与亚麻酸乙酯推断的断裂碎片相一致,故鉴定该物质为亚麻酸乙酯(图2-C)。通过人工解谱的方式,本研究共鉴定到519个代谢物。本研究成功构建了包含1 058个代谢信号的山栏稻种子代谢数据库,其中645个(61%)的代谢信号被注释,413个(39%)代谢信号未被注释,注释的代谢物中涵盖了氨基酸、脂质、有机酸、维生素和类黄酮等多种代谢物,其中,与营养品质相关的代谢物如氨基酸、脂质、类黄酮所占比例较高,分别为12%、6%和4%(图2-D)。
-
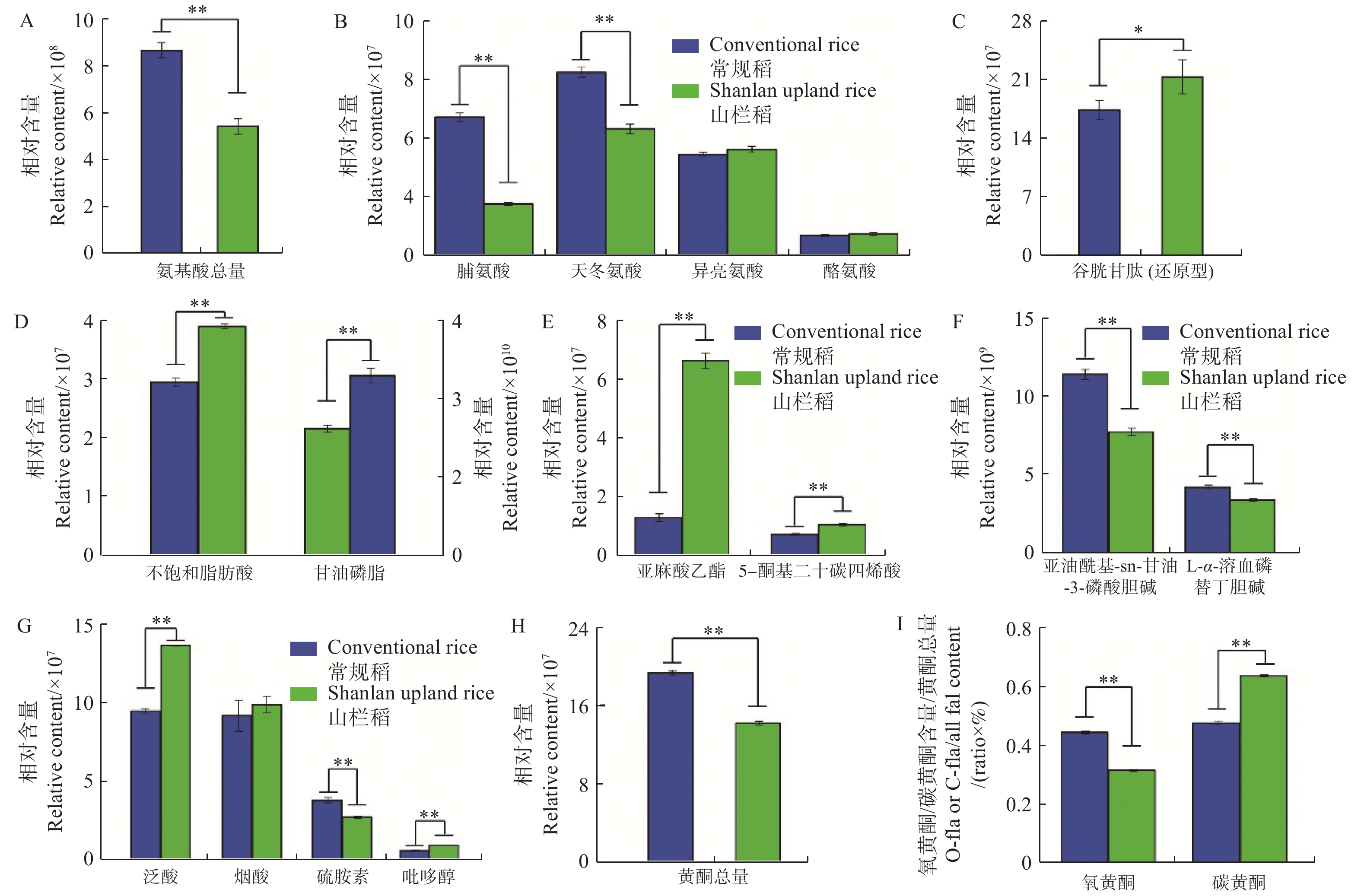
从图3可知:普通水稻与山栏稻种子间氨基酸总相对含量存在显著差异,普通水稻种子中氨基酸含量普遍高于山栏稻(图3-A),其中,脯氨酸和天冬氨酸的相对含量显著高于山栏稻,分别是山栏稻种子中含量的2.6倍和1.4倍;山栏稻种子中仅脯氨酸、酪氨酸和还原型谷胱甘肽的相对含量高于普通水稻,其中谷胱甘肽的相对含量是普通水稻种子中含量的1.2倍(图3-B,图3-C),说明山栏稻种子中仅部分氨基酸类物质含量高于普通水稻。
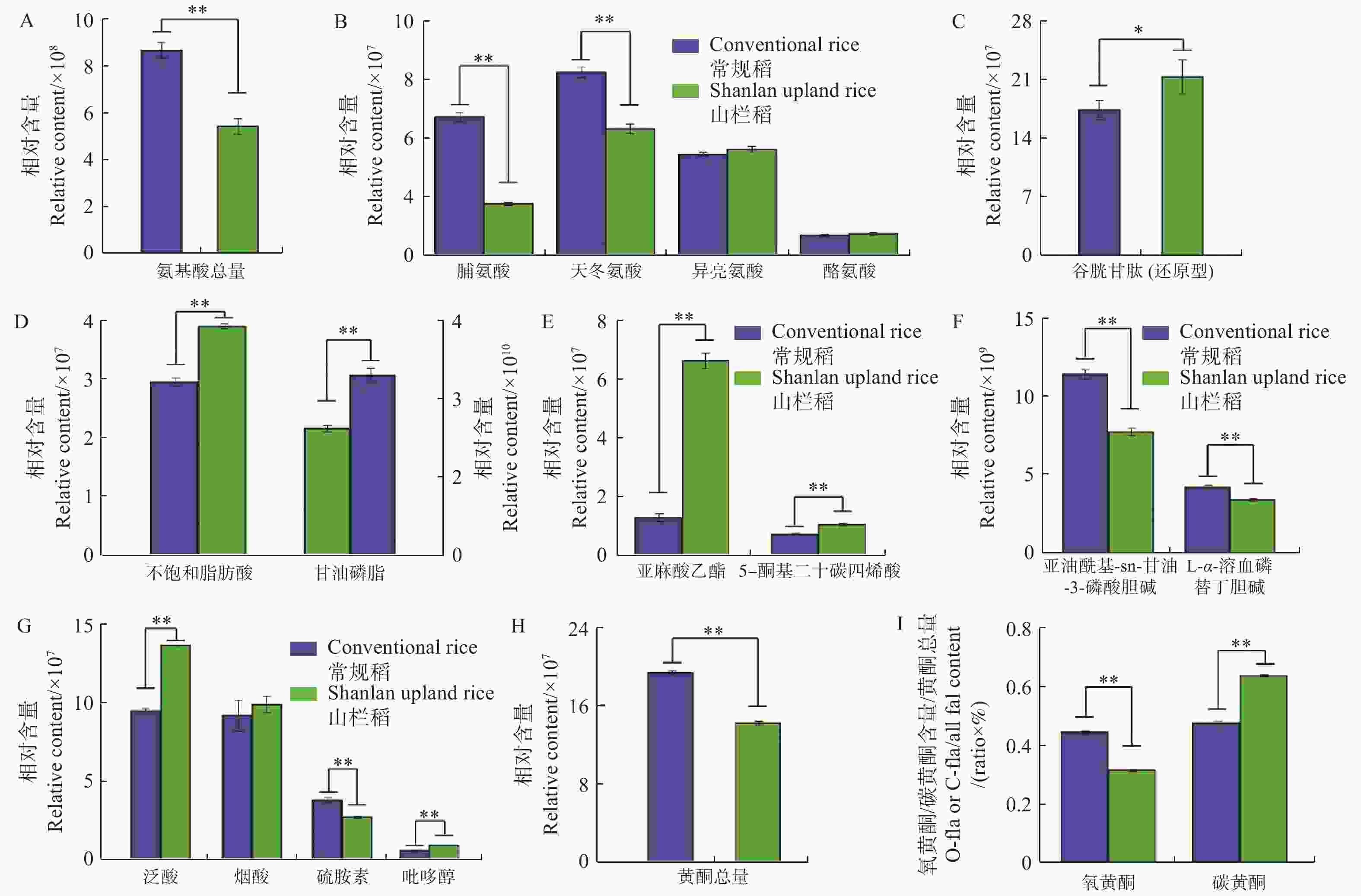
Figure 3. The difference in nutrient content between the seeds of Shanlan upland rice and conventional rice
本研究发现,山栏稻与普通水稻种子中脂类物质的积累存在显著差异,山栏稻种子中不饱和脂肪酸的相对总含量为4×107,显著高于普通水稻,其中,亚麻酸乙酯的相对含量是普通水稻的5.1倍;普通水稻种子中甘油磷脂的相对总含量是山栏稻的1.4倍,其中,1亚油酰基-sn-甘油-3-磷酸胆碱的相对含量是普通水稻的1.4倍(图3-D,图3-E,图3-F);说明山栏稻种子中不饱和脂肪酸的含量显著高于普通水稻,甘油磷脂的含量低于普通稻。比较山栏稻与普通水稻种子中维生素类物质的含量,发现山栏稻种子中大部分维生素类物质含量显著高于普通水稻(图3-G)。比较分析发现,普通水稻种子中黄酮类物质的相对总含量显著高于山栏稻,是山栏稻种子中含量的1.36倍(图3-H)。普通水稻种子中氧黄酮(氧黄酮,糖羟基与类黄酮的羟基脱水缩合,形成 C-O 糖苷键)和碳黄酮(碳黄酮,糖与类黄酮母核上直接脱水结合,形成 C-C)的总相对含量均高于山栏稻,说明普通水稻种子中黄酮类物质含量高于山栏稻,但山栏稻种子中碳黄酮所占比例(碳黄酮相对总含量(水稻种子中检测到的碳黄酮物质的总和)/黄酮总含量)为0.63,大于普通水稻的0.47,氧黄酮所占比例[氧黄酮相对总含量(水稻种子中检测到的氧黄酮物质的总和)/黄酮总含量]为0.31,低于普通水稻的0.44(图3-I)。说明山栏稻种子中碳黄酮所占比例高于普通水稻,氧黄酮所占比例低于普通水稻。
-
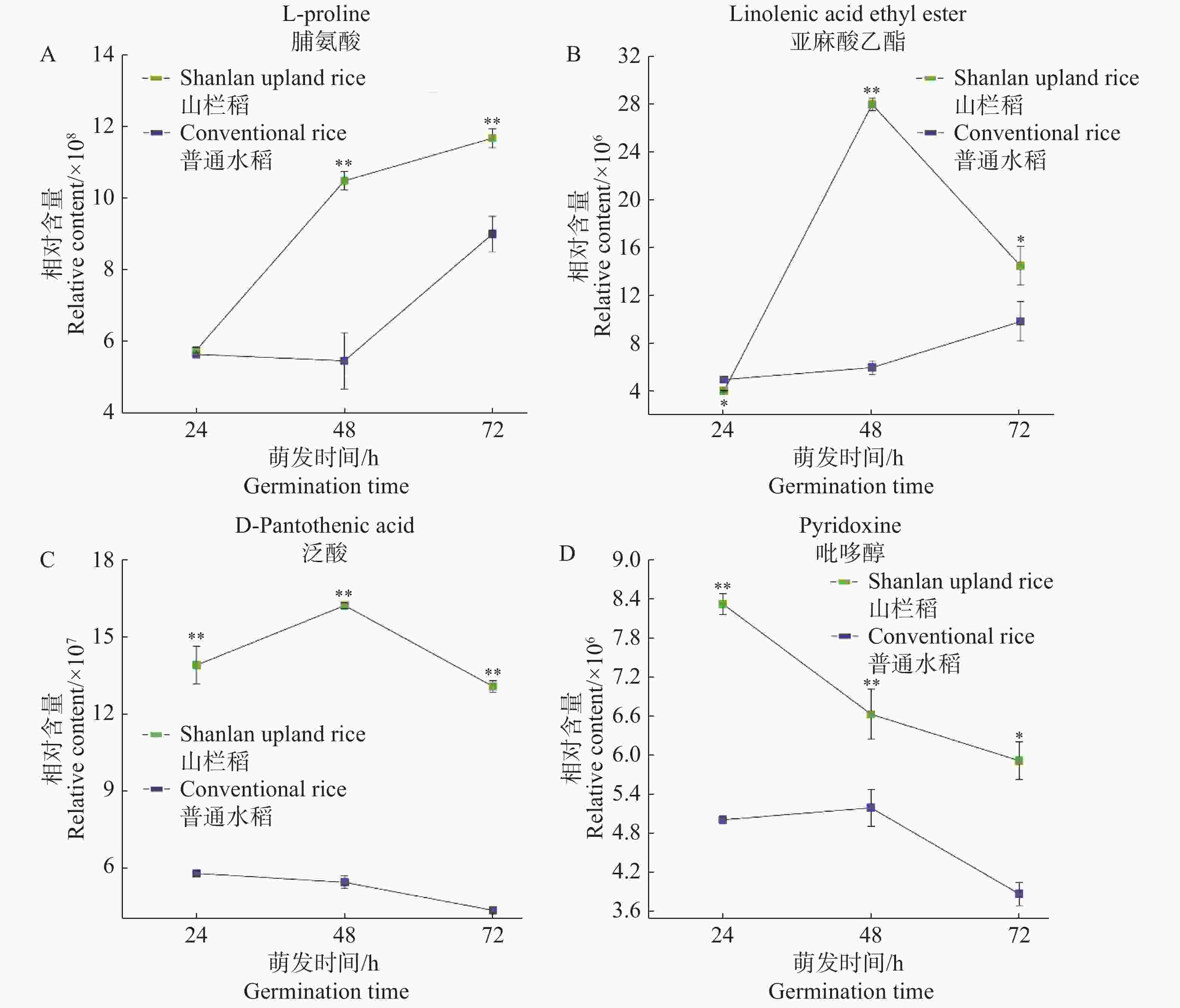
图4展示了山栏稻种子萌发过程中部分代谢物的含量变化趋势。通过比较分析发现,在种子萌发初期,山栏稻与普通水稻中脯氨酸的相对含量相近,无明显差异;在24~48 h阶段脯氨酸的相对含量达到1.05×109,远高于普通水稻;随后山栏稻种子中脯氨酸的积累速率下降,但脯氨酸的相对含量依然显著高于普通水稻(图4-A)。蔡能等[13]研究发现,植物体内游离脯氨酸含量越高抗逆能力越强,说明山栏稻种子萌发过程中的抗逆能力强于普通水稻。在种子萌发过程中亚麻酸乙酯也存在类似的积累模式,在萌发初期山栏稻种子中的亚麻酸乙酯含量低于普通水稻;在24~48 h阶段山栏稻种子中的亚麻酸乙酯快速积累;48 h时,其相对含量达到最高,为2.81×107,是普通水稻的4.66倍,然后其含量迅速下降(图4-B)。泛酸在种子萌发过程中的积累模式与亚麻酸乙酯类似均是先升高后降低,但在山栏稻萌发过程中泛酸含量始终显著高于普通水稻(图4-C)。在种子萌发过程中山栏稻种子中吡哆醇的积累模式与上述代谢物的积累存在明显差异。在山栏稻萌发过程中吡哆醇含量持续下降,在萌发初期山栏稻种子中吡哆醇的相对含量显著高于普通水稻;在24~48 h阶段山栏稻种子中的吡哆醇含量迅速下降,在48 h吡哆醇的相对含量仅为普通水稻中的1.28倍;后期吡哆醇的含量缓慢下降,但总体含量依然显著高于普通水稻(图4-D)。
2.1. 山栏稻与普通水稻种子的非靶向代谢组分析
2.2. 山栏稻种子代谢数据库的建立
2.3. 山栏稻和普通水稻种子中营养品质的代谢差异
2.4. 种子萌发过程中营养品质相关代谢物变化规律
-
山栏稻是海南地区特有的旱稻种质资源,但关于山栏稻种子代谢组学的研究还存在许多未知。本研究利用超高效液相色谱高分辨质谱联用技术,成功构建了山栏稻种子代谢数据库。通过比较山栏稻与普通水稻种子间的代谢差异,发现山栏稻与普通水稻间代谢物的积累存在差异,导致代谢差异的主要原因可能是遗传基础。在研究水稻进化和自然变异过程中,发现不同亚种间遗传信息的差异,导致代谢物的积累存在差异[14-15]。袁楠楠等[16]研究发现,山栏稻是不属于普通野生稻的栽培农家种,说明山栏稻具有独特的遗传基础。因此,导致山栏稻与普通水稻代谢差异的根本原因是遗传基础的差异。
本研究发现,山栏稻种子中谷胱甘肽、亚麻酸乙酯、泛酸和吡哆醇的含量均显著高于普通水稻,导致代谢差异的原因可能是栽培方式的不同。山栏稻主要以旱作栽培为主,普通水稻主要以水作栽培为主;与普通水稻相比山栏稻的生长环境更复杂,容易发生干旱、高温、冷害等非生物胁迫[17-18]。生长环境的不同,会导致植物体内代谢物的积累和合成途径发生改变。水稻在干旱、冷害等胁迫条件处理下,体内的谷胱甘肽、脂肪酸、吡哆醇含量会增加[19]。因此,栽培方式也会影响植物体内代谢物的积累。本研究发现,山栏稻种子中碳黄酮所占比例高于普通水稻,氧黄酮所占比例低于普通稻。研究发现,氧黄酮可以预防苗期根腐病,碳黄酮可以预防病虫害[20-21]。因为碳黄酮和氧黄酮生理功能的差异,所以栽培方式是引起山栏稻与普通水稻种子中黄酮比例差异的主要原因。
本研究发现,在种子萌发过程中,山栏稻种子中吡哆醇的含量逐渐下降,普通水稻种子中吡哆醇的含量逐渐升高。在种子萌发过程中,吡哆醇参与调节种子胚根的形成[22]。非生物胁迫条件下,也会影响植株的正常发育,从而导致生长周期的改变[23]。说明引起山栏稻和普通水稻萌发过程中代谢物积累差异的原因是种子萌发机理的不同。本研究构建的山栏稻种子代谢数据库,能为深入研究山栏稻种子营养品质提供依据。







 DownLoad:
DownLoad: