-
烟碱型乙酰胆碱受体(nicotinic acetylcholine receptors,nAChRs)属于配体门控阳离子通道蛋白成员之一,在哺乳动物体内广泛存在且具有重要生理功能和临床意义。nAChRs存在于整个中枢(CNS)和外周神经系统(PNS),以及血液和免疫细胞上[1-3]。这些离子通道蛋白主要位于突触前膜和突触后膜上,具有调节神经递质释放和介导快速突触传递的生理作用。按其分布主要分为神经型乙酰胆碱受体和肌肉型乙酰胆碱受体两大类。根据亚基组成的不同,nAChRs可以分为由5个相同亚基构成的同源五聚体(如α7)或者由至少两种亚基共同组成的异源五聚体(如α6β4,α3β4,α6β2等),其中α与β亚基的交界面是受体与配体相互作用的关键部位[4-5]。nAChRs不同亚型的结构非常相似,但它们的生理学和药理学功能却截然不同,它们是许多重大疾病的潜在药物靶点,如癫痫、尼古丁或酒精成瘾、慢性疼痛综合症、帕金森病、阿尔茨海默病和癌症等[6-7]。含α6亚基的乙酰胆碱受体亚型(α6* nAChRs),主要分布于儿茶酚胺能神经元、海马体、背根神经节和中脑多巴胺能区域,介导生物体的生理调节功能,如情绪、疼痛、抑郁等[1, 8-9]。其中,位于海马脑区中的α6β4* nAChRs可调节去甲肾上腺素的分泌,且与学习、记忆等生理活动密切相关。α6β4* nAChRs在控制人源肾上腺嗜铬细胞外分泌的过程中发挥了重要作用,主要控制肾上腺素向血液的释放,以及在交感神经的支配下负责机体对压力调控的应答[10-11]。α6β4* nAChRs也分布于背根神经节神经元上,共表达α6β4* nAChRs和P2X受体会导致延长P2X受体的脱敏时间,激动α6β4* nAChRs可通过抑制P2X受体而发挥镇痛作用[12-13]。天然的α6亚基与β4亚基组合形成的受体在体外很难表达、不稳定。α6亚基与其他亚基的组装形式复杂多变,且与α3亚基的跨膜区域和胞内区域同源性较高,为了增加其功能性表达,研究者利用α6/α3嵌合亚基代替α6亚基,即由α6亚基的N端胞外配体结合区域与α3亚基的跨膜区嵌合而成,与β4亚基共表达所形成的α6/α3β4受体与天然α6β4受体具有相似的结合活性,可以作为体外药物筛选的模型[14]。α6β4* nAChRs在大脑区域中常常以低水平表达,且α6β4* nAChRs的表达往往伴随α6β2*,α3β4 nAChRs等相似亚型的表达并被遮盖而很难区分,导致其结构和参与的生理功能难以研究,至今仍不清楚[1],如位于背根神经节上的α4β2,α7,α9α10,α6β4 nAChRs都与神经型疼痛和炎症相关,但各亚型起什么作用不得而知。若能发现专一地作用于α6β4 nAChR的新型配体,将有助于解析该受体亚型的结构、与配体之间的相互作用关系以及生理药理功能和开发分子探针进一步研究疼痛等相关疾病的病理分子机制,而这些研究的前提是需有效地表达出各种亚型,以此为模型去发现相应的配体。
非洲爪蟾卵母细胞作为分析膜蛋白功能的表达系统具有2大优势:第一,卵母细胞具有丰富的rRNA和tRNA,因此可以将外源引入的mRNA表达为功能受体蛋白;第二,卵母细胞具有多种内源性信号转导组件,如腺苷酸环化酶、phospholipace C,Ca2+激活的氯离子通道等。目前,卵母细胞表达体系广泛运用于离子通道学领域,由于其卵母细胞体积大(直径约为1 mm),通常以全细胞灌流方法给药研究配体与受体之间的相互作用关系。在卵母细胞膜上表达nAChRs、G蛋白偶联受体(G Protein-Coupled Receptors,GPCRs)、谷氨酸受体(Glutamate Receptor)、Na+,K+,Ca2+阳离子通道蛋白模型,对于研究阐明离子通道的功能多样性和构型提供理论基础[15]。因此,本研究针对难表达的α6/α3β4乙酰胆碱受体亚型,建立并优化了其在非洲爪蟾卵母细胞中的表达体系,旨在为α6β4* nAChRs的配体筛选提供实验模型和研究基础。
HTML
-
大鼠(rat,r)α6/α3、β4亚基cDNA的质粒均由美国犹他大学J. Michael McIntosh教授馈赠;DH5α、限制性内切酶(Sal I和Nhe I)、DNA纯化试剂盒(MiniBEST DNA Fragment Purification Kit Ver.4.0)均购于宝生物工程(大连)有限公司;质粒小量提取试剂盒购于美国OMEGA公司;体外转录试剂盒(mMESSAGE mMACHINE T7 Kit)、RNA纯化试剂盒(MEGA clear Kit)购于美国Thermo Fisher公司;成熟雌性非洲爪蟾(Xenopus laevis)购于美国eNaso公司;胶原酶A(Collagenase A)、阿托品(Atropine)、乙酰胆碱(Acetylcholine chloride, ACh)均购于美国Sigma公司;电生理OR2溶液(82.5 mmol·L−1 NaCl,2.0 mmol·L−1 KCl,1.0 mmol·L−1 MgCl2,5 mmol·L−1 HEPES,pH 7.1~7.5)和ND96溶液(96 mmol·L−1 NaCl,2.0 mmol·L−1 KCl,1.0 mmol·L−1 MgCl2·6H2O,1. 8 mmol·L−1 CaCl2·2H2O,5 mmol·L−1 HEPES,pH 7.1~7.5);其他化学试剂均为国产分析纯,购于广州化学剂厂。双电极电压膜片钳系统(Axon 900A信号放大器和Digidata 1550B数模转换器,Molecular Device,USA),微电极拉针仪(P-1000,Sutter),显微注射仪(Nanlliter 2000,Sutter),NanoDrop 2000超微量分光光度计(Thermo Fisher Scientific),凝胶成像系统(Alpha-2200,Protein Simple);恒温恒湿培养箱(KCL-2000A,EYELA)。
-
从−80 ℃冰箱中取出感受态细胞E.coli DH5α和质粒,通过转化实验将质粒转染到DH5α菌株中,37 ℃恒温恒湿扩大培养12~14 h,用质粒小量提取试剂盒提取质粒。向离心管中依次加入20 μL 10×H或10×M Buffer和115 μL ddH2O与50 μL质粒混合均匀,再加入15 μL相对应的限制性内切酶混匀封膜,37 ℃恒温水浴反应4 h。酶切完全后,利用DNA纯化试剂盒对酶切产物进行纯化。纯化后产物取2 μL用于Nanodrop定量测定浓度和琼脂糖凝胶电泳鉴定是否酶切完全,−20 ℃保存备用。
以上述得到的线性质粒DNA作为模板,使用T7体外转录试剂盒。向离心管中依次加入2 μL 10× Rxn Buffer、10 μL 2× NTP/CAP、4 μL线性DNA和2 μL Nuclease-free Water,混合均匀后,加入2 μL Enzyme Mix封膜,37 ℃恒温水浴反应4~6 h。转录完成后,加入2 μL TUBRO DNase,轻轻吹打混匀,封膜,离心1 min,37 ℃恒温水浴反应20 min,收集产物备用。利用RNA纯化试剂盒对上述产物进行纯化,收集RNA,取2 μL用于Nanodrop测定浓度和琼脂糖凝胶电泳鉴定纯度,分装于无RNA酶管中,−80 ℃保存。
-
选1只健康状态良好的性成熟非洲爪蟾,冰冻麻醉1 h,在无菌条件下解剖取出2~3叶卵母细胞于OR2溶液中,剪成小团块,用OR2溶液反复冲洗至澄清,加入0.8 g·L−1含胶原酶A的酶解液中,注意观察酶解过程中细胞团块的消化程度,避免酶解过度导致蛙卵易破裂。酶解约40 min直至分解成单个卵母细胞,用OR2溶液清洗至澄清,转移至含抗生素ND96溶液(青霉素10 mg·L−1,链霉素10 mg·L−1,庆大霉素100 mg·L−1)中,在显微镜下挑选黑白分明、不含血丝和粘膜、大小均匀的球状单个卵母细胞于培养皿中,17 ℃恒温培养12 h后备用。
-
将r α6/α3和r β4亚基的cRNA分别按10∶1,1∶1,1∶10的质量比例混合,使用Sutter P-1000拉针仪将硅酸盐玻璃针(内径0.69 mm,外径1.2 mm)拉制成注射针和电极针。每个卵母细胞的cRNA注射剂量不低于5 ng·个−1(注射体积为46 nL),设定注射量分别为5,10,15 ng。同时分别注射ddH2O,α6/α3 cRNA,β4 cRNA,以空白蛙卵作为对照。注射完后,将卵母细胞置于含抗生素的无菌ND96培养液中,17 ℃恒温恒湿培养。在注射完后的第2~5天内,每天检测受体表达情况,及时更换新鲜的含抗生素培养液。
-
准备好ND96灌流液,真空脱气20 min以上,配制含1 μmol·L−1阿托品和0.1 g·L−1 BSA的ND96缓冲液(阿托品可抑制卵母细胞本体mAChR的表达,排除干扰),用3 mol·L−1 KCl溶液灌注电极针,电阻在0.5~2 MΩ范围内。吸取单个卵母细胞固定于容积为50 μL的细胞槽中,将两端电极针倾斜45°进入细胞槽液面,调节放大器上的电压旋钮将两侧电压值调为零,然后调整电极针位置刺入卵母细胞,两侧电压值变为−10至−40 mV即可,切换放大器模式为Vm Clamp Slow模式,以初始漏电流不大于100 nA为宜。钳制电压−70 mV,filter 10 Hz,Gain 1000。在检测ACh激活nAChRs产生的功能性内向电流的过程中,设置1个检测程序:1 min内先给予卵母细胞2 s不同浓度的ACh脉冲刺激,58 s的ND96溶液灌流,重复3次,即分别用浓度为5,10,50,100,200,500,1 000 μmol·L−1的ACh激活通道开放,检测受体表达的电流大小。建立稳定的表达模型后,用α−芋螺毒素TxID验证表达受体的活性和敏感性。
-
用pClamp 10.2软件记录电流情况,采样频率slow 100 Hz,filter 10 Hz。取3~6个蛙卵所记录的电流大小为平均值,利用Graphpad Prism 6.0软件进行作图。检测敏感性时,以最高浓度1 000 μmol·L−1 ACh的激发电流为分母,计算不同ACh浓度激活通道开放的电流所对应的反应百分数。在验证受体的有效性时,用GraphPad Prism 6.0软件通过非线性拟合方程%Response=100/[1+([toxin]/IC50) nH]拟合分析数据( nH 代表 Hill系数)。
1.1. 实验材料、试剂与仪器
1.2. r α6/α3、r β4亚基cRNA的制备
1.3. 非洲爪蟾卵母细胞的分离与培养
1.4. cRNA显微注射
1.5. 电生理活性检测
1.6. 数据处理与分析
-
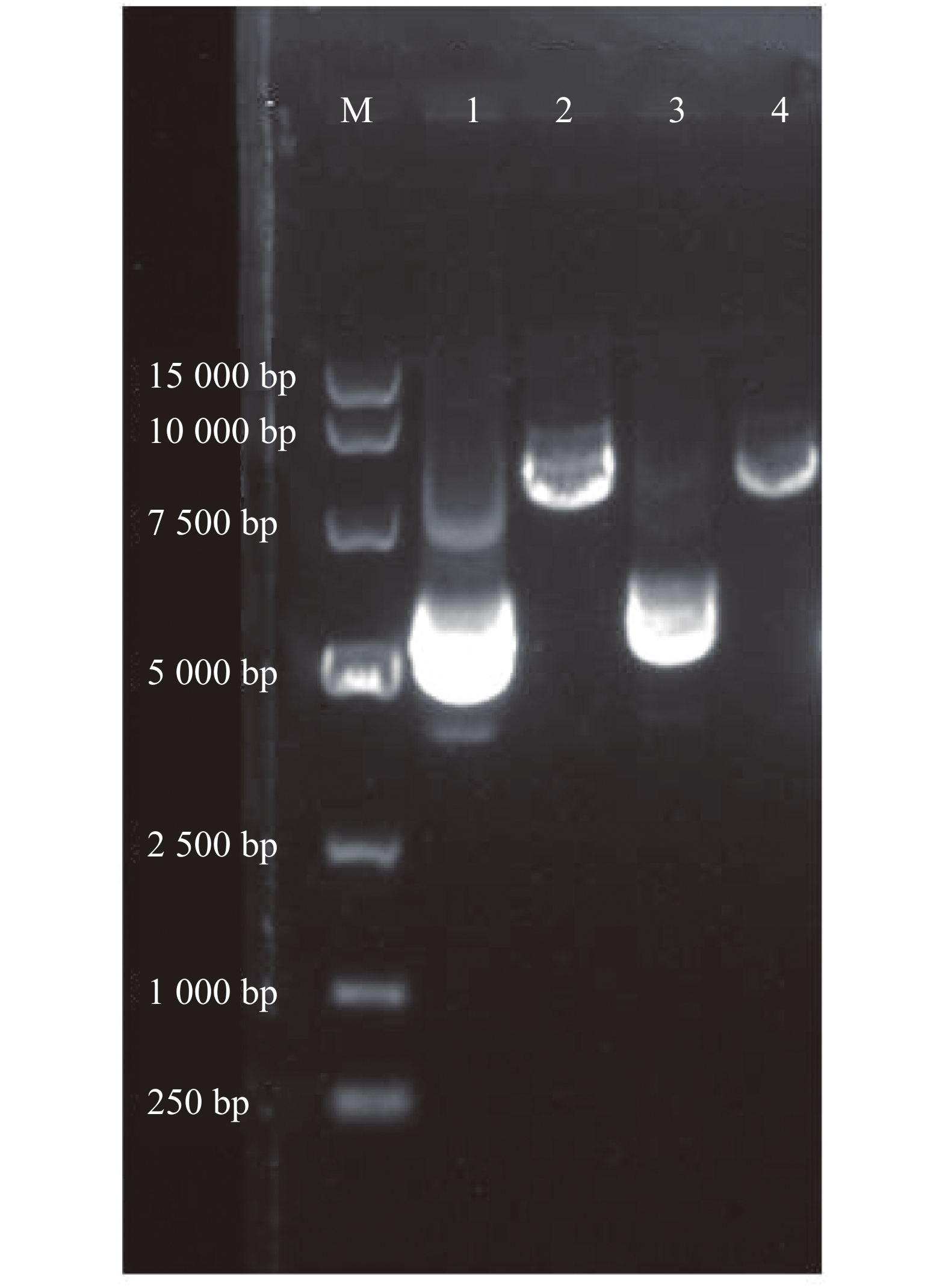
通过w=0.8%的琼脂糖凝胶电泳检测α6/α3、β4亚基基因质粒和酶切后的纯度。从图1可知,第1和第3泳道分别为α6/α3、β4亚基基因质粒,条带清晰明亮,完整性好,且质量浓度都高于0.5 g·L−1(表1),适合进一步进行酶切形成线性质粒。根据目的基因3′-非翻译区下游的酶切位点,用SalⅠ酶切α6/α3质粒、NheⅠ酶切β4质粒,形成线性化质粒,检测纯度。第2和第4泳道分别为α6/α3、β4亚基基因质粒的酶切产物(图1),环状质粒已完全线性化,DNA条带单一明亮,无明显杂质,且与环状质粒相比具有明显滞后性,线性化产物质量浓度约为0.5 g·L−1(表1)。
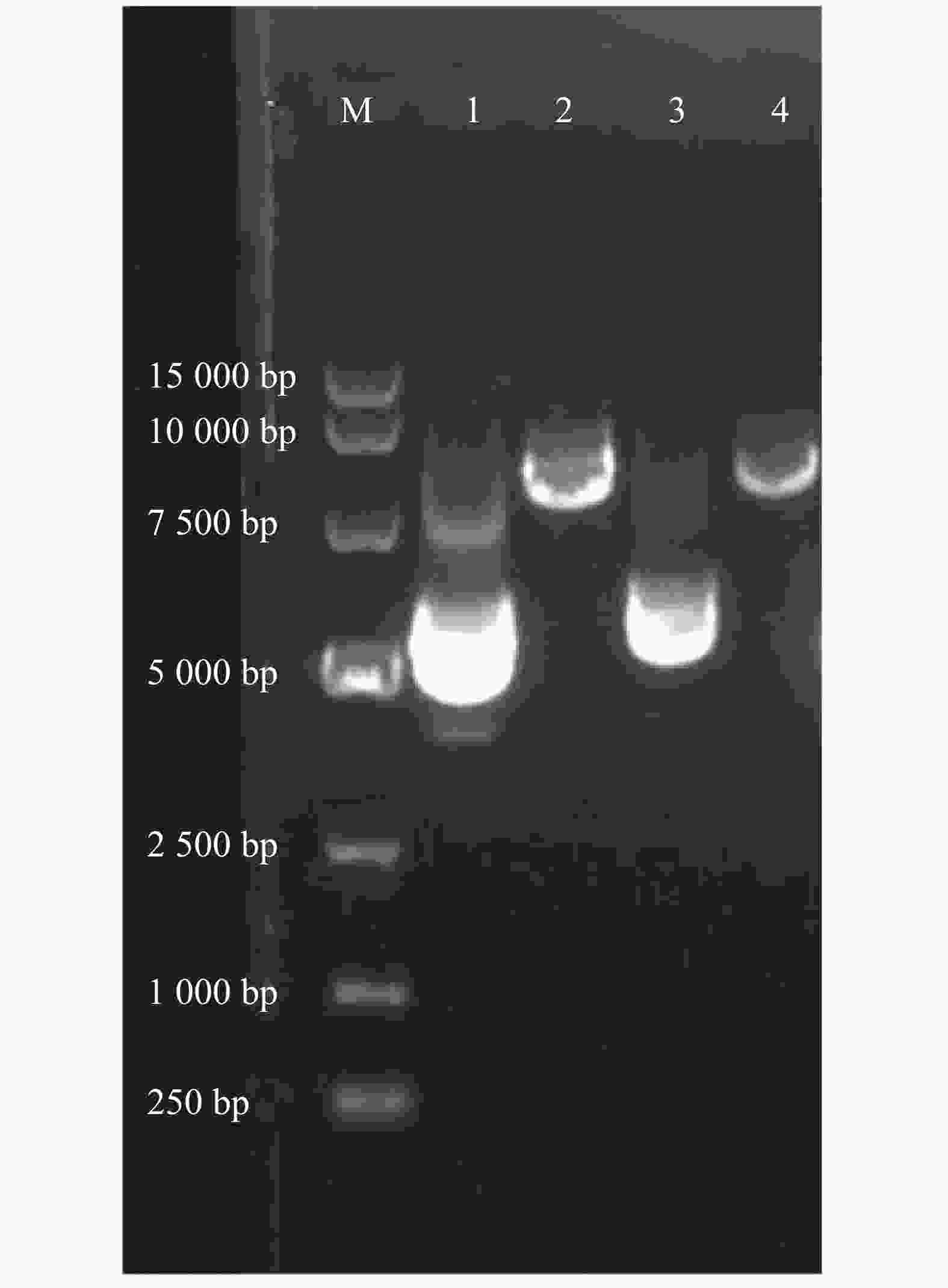
Figure 1. Agarose gel electrophoresis of plasmid and linearized DNA containing r α6/α3 or r β4 subunit gene
名称
Subunit质粒DNA/
(g·L−1)
Plasmid DNA线性DNA/
(g·L−1)
Linearized DNAcRNA/
(g·L−1)A260/
A280r α6/α3 0.68 0.46 0.62 2.11 r β4 0.79 0.51 0.58 2.12 Table 1. The concentrations of plasmid, linearized DNA and cRNA containing r α6/α3 or r β4 subunit gene
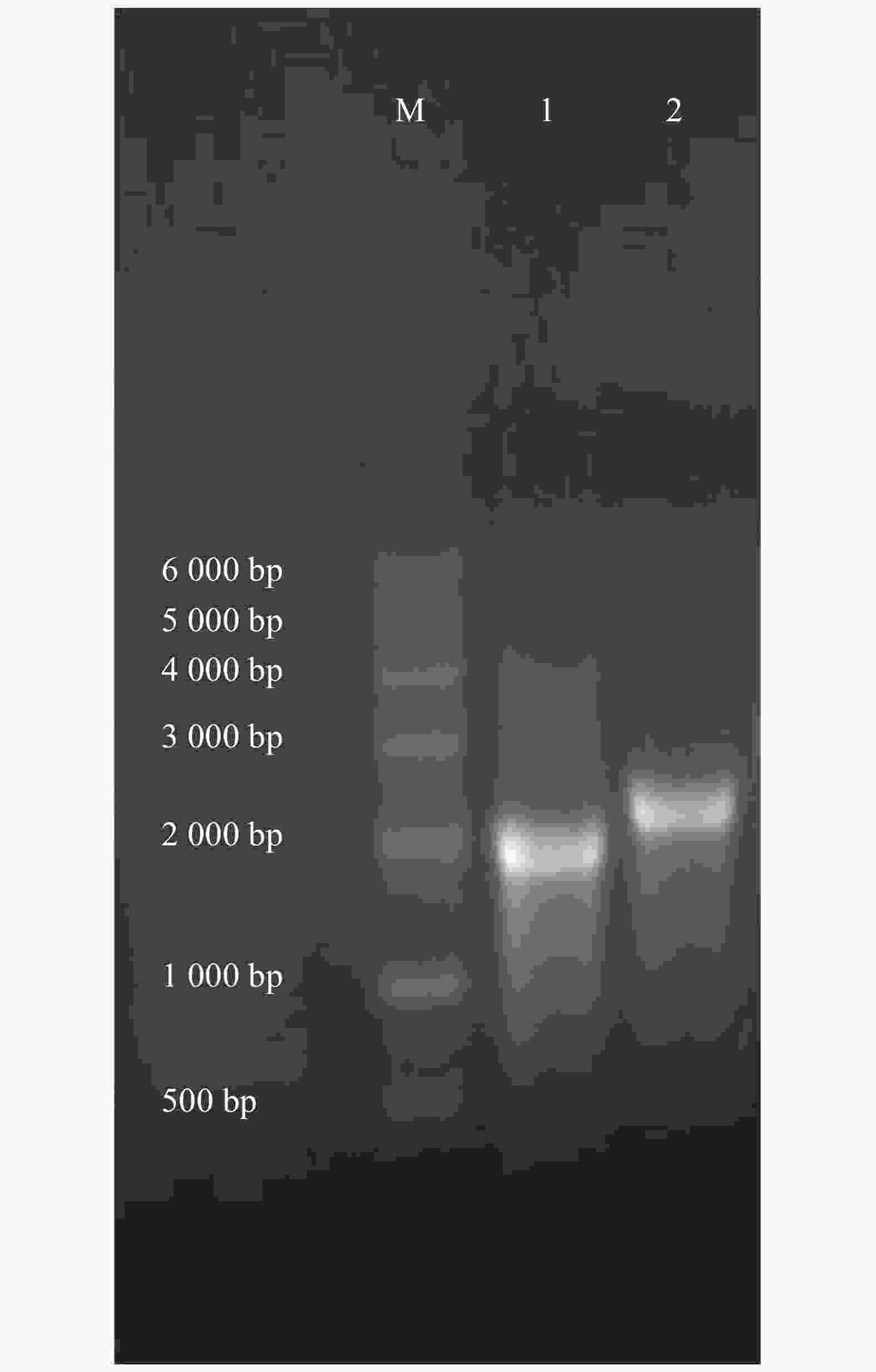
通过w=2%的琼脂糖凝胶电泳检测转录完后获得cRNA的纯度。第1和第2泳道分别为α6/α3,β4的cRNA(图2),条带单一明亮,测定α6/α3的质量浓度为0.62 g·L−1,β4为0.58 g·L−1,按需分装,−80 ℃保存备用。
-
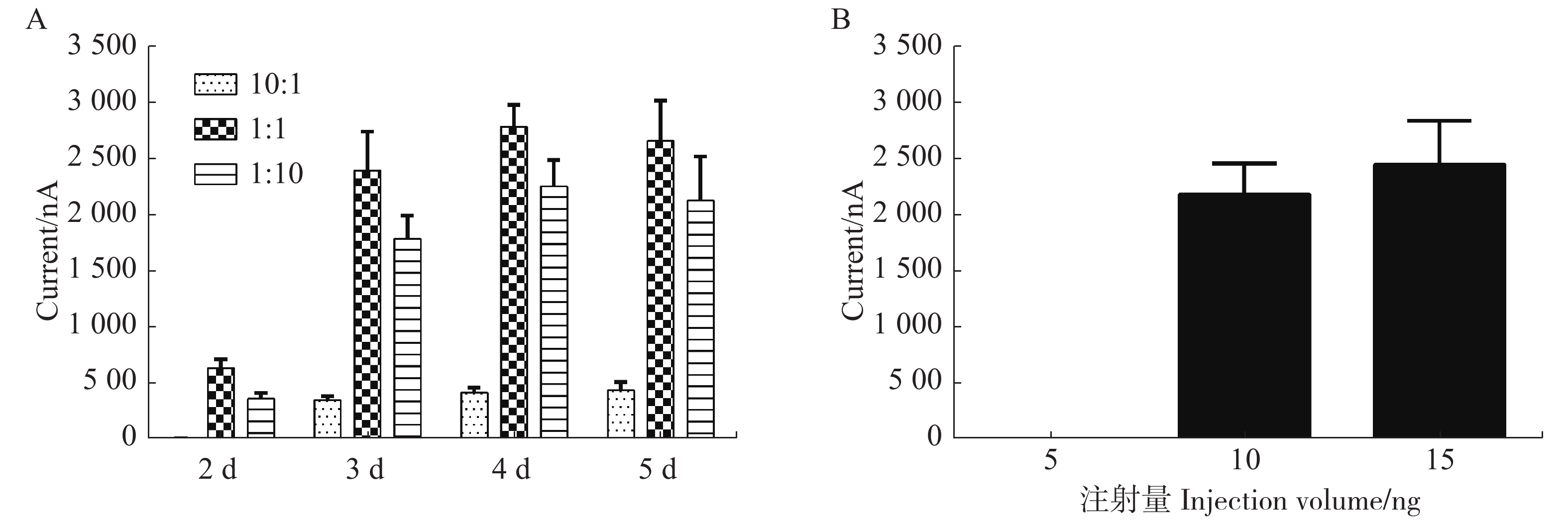
为了研究每个蛙卵cRNA的不同配比和培养时间对α6/α3β4 nAChR亚型表达的影响,用3~6个卵母细胞检测其电流大小取平均值进行比较,注射后第2天检测3种不用配比形成的α6/α3β4亚型均无明显大小的电流;在第3天检测10︰1,1︰1,1︰10形成的α6/α3β4亚型表达电流大小,取平均值分别对应359 nA,2421 nA,1 810 nA。1︰1和1︰10配比条件下形成的α6/α3β4亚型针对ACh诱导产生的电流差异无明显变化,与10︰1配比条件下形成的α6/α3β4亚型相比具有统计学显著性差异;第4天经过检测与第3天无明显差异;第5天检测3种不用配比形成的α6/α3β4亚型的电流比第4天稍许下降,可能由于蛙卵质量下降或敏感性减弱所致(图3A)。

Figure 3. Effect of different ratios and injection volume of cRNA on the expression of α6/α3β4 nAChR
从图3B中可知,当以1∶1配比的cRNA注射量为5 ng时,检测多个蛙卵均无明显电流,即蛙卵均不能表达受体;当注射量为10或15 ng时,均可检测到较大电流且稳定,说明表达受体的情况较佳。
在任何浓度ACh的刺激下,单独注射α6/α3 cRNA、β4 cRNA、ddH2O以及空白蛙卵都不能产生明显的电流,说明单独的α6/α3或β4亚基不能组装形成功能性α6/α3β4 nAChR,空白蛙卵细胞膜上不存在nAChRs。只有同时注射以一定比例混合的α6/α3和β4亚基cRNA才能形成功能受体并在ACh刺激下通道开放而产生内向电流,说明α6/α3和β4亚基以一定比例组合形成的功能受体是α6/α3β4 nAChR表达的必备条件。
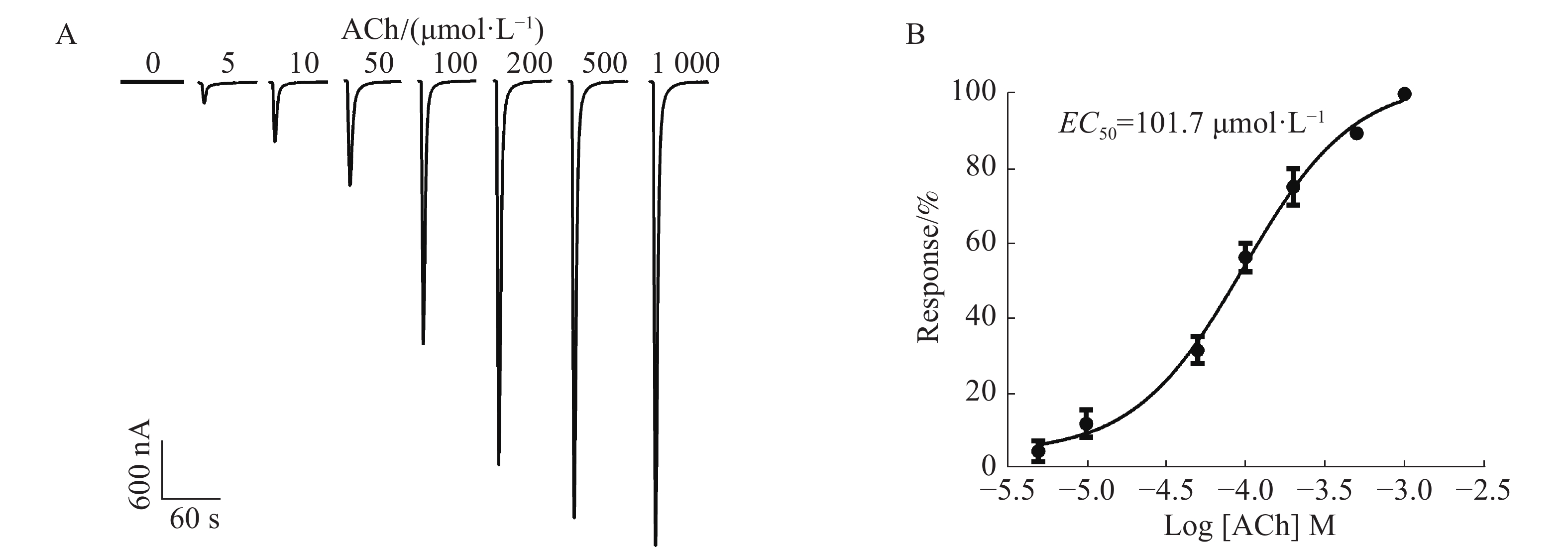
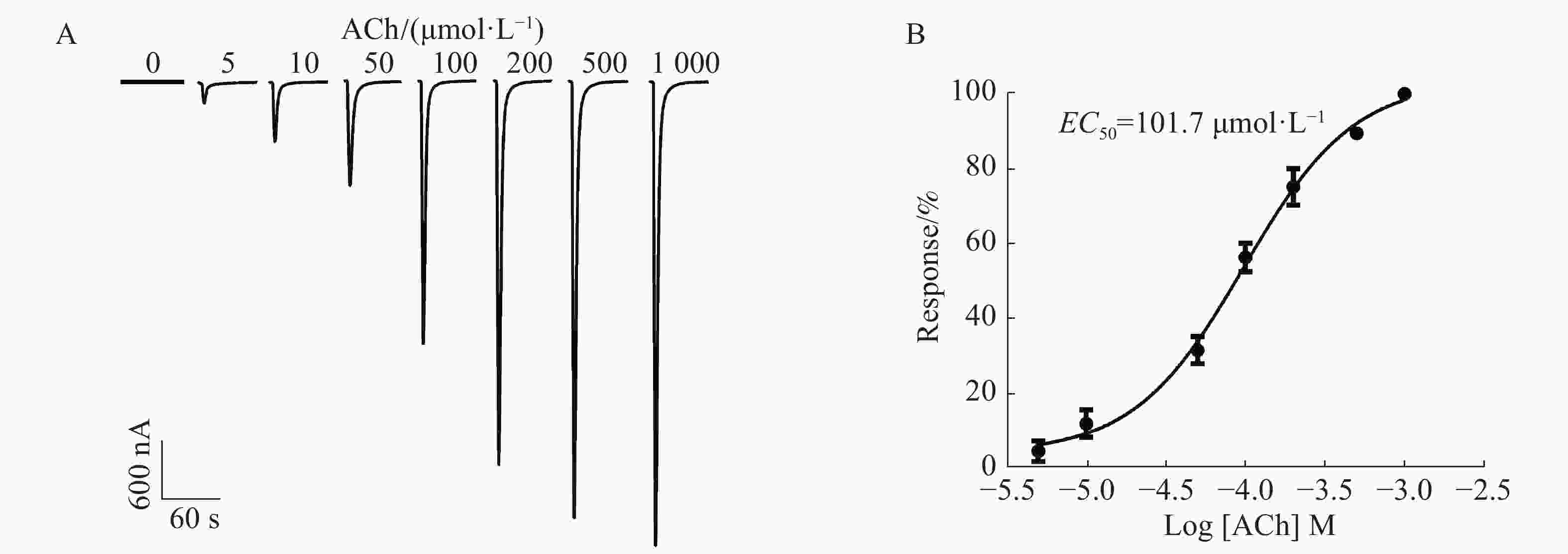
通过在不同浓度5,10,50,100,200,500,1 000 μmol·L−1的ACh刺激下,1︰1配比形成的α6/α3β4 nAChR通道开放产生的电流具有浓度依赖性,随着浓度的依次增加,电流持续增大。从图4A中可知,当ACh浓度为5 μmol·L−1时,能检测到微弱的电流,约200 nA;当ACh浓度高达1 000 μmol·L−1时,α6/α3β4 nAChR通道开放产生的电流达到最大,约4 800 nA;ACh的浓度与激发电流的大小呈非线性相关(图4B),ACh的半数有效浓度(concentration for 50% of maximal effect, EC50)为101.7 μmol·L−1。由于ACh浓度太高电流过大易导致受体过度开放而脱敏,ACh浓度太低电流过小易造成数据误差,而ACh的浓度在50~200 μmol·L−1的范围内较好,其电流较大且稳定。因此,选择ACh配体浓度为100 μmol·L−1时,α6/α3β4 nAChR通道开放可产生明显的电流。
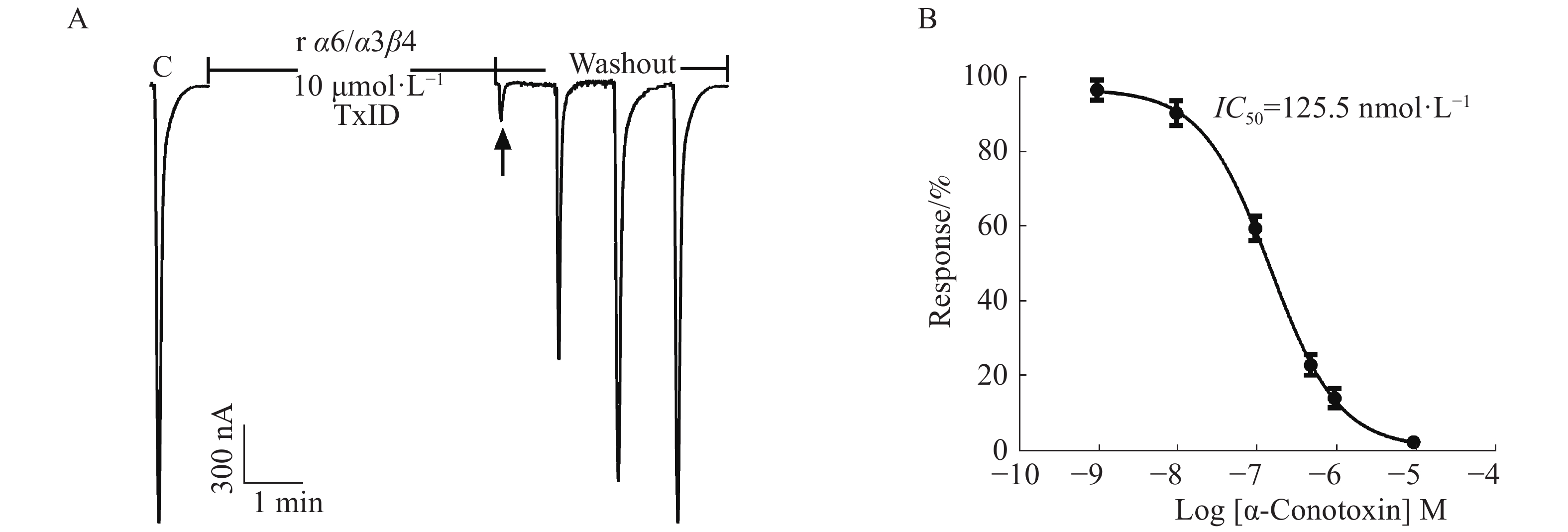
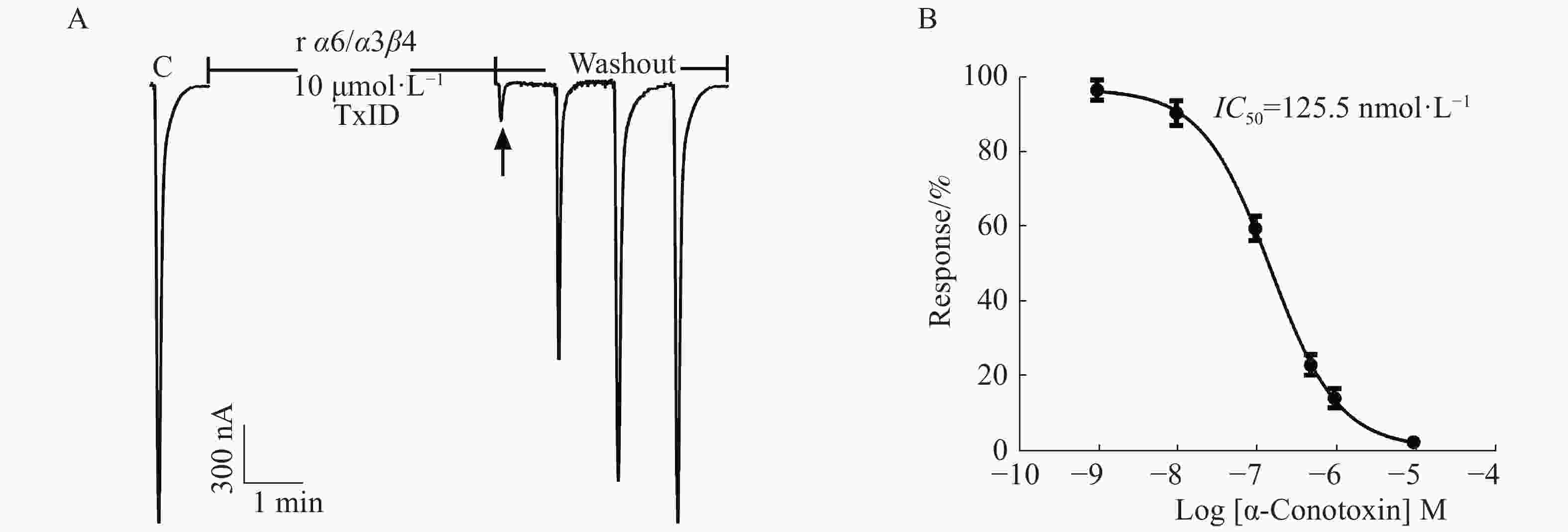
在ACh浓度为100 μmol·L−1、α6/α3和β4亚基以1∶1配比且注射量为10 ng·个−1的情况下,检测α6/α3β4 nAChR表达活性和敏感性。从图5中可知,10 μmol·L−1 α−芋螺毒素TxID几乎能完全阻断α6/α3β4 nAChR的电流,较易洗脱,其IC50值为125.5 nmol·L−1,与文献[16]的结果一致,说明受体具有良好的生理功能与敏感性。
2.1. cRNA的制备
2.2. α6/α3β4 nAChR亚型表达检测
-
非洲爪蟾卵母细胞已被广泛应用于表达各种外源受体蛋白和离子通道蛋白,为研究离子通道与配体之间的相互作用关系和其结构组成等提供了重要手段。利用双电极电压钳电生理学技术检测膜电流的变化,可有效地检测表达在非洲爪蟾卵母细胞膜上的受体和离子通道等的生物活性和生理功能。大鼠α3β2、α4β2和α3β4 nAChRs等多种乙酰胆碱受体亚型在非洲爪蟾卵母细胞膜上可稳定表达[17-19],但含有α6亚基的nAChRs,包括α6β4*与α6β2* nAChRs,在体外很难表达,常规表达方法常常表达不出来或者表达受体的电流非常小,不能用于药物筛选及其结构与功能的研究。本研究针对α6β4* nAChRs,采用α6/α3嵌合亚基、β4亚基高表达载体,优化关键表达因素,通过体外转录合成α6/α3与β4亚基的cRNA、显微注射和双电极电压钳技术,在非洲爪蟾卵母细胞膜上成功表达了α6/α3β4 nAChR。笔者重组表达的α6/α3β4 nAChR具有良好的乙酰胆碱配体门控特性,并用该受体的特异性阻断剂α−芋螺毒素TxID验证了其配体结合的敏感性和有效性。
虽有研究表明,α6亚基主要分布于中枢神经的儿茶酚胺能神经元上,也存在于视觉神经通路和外周神经等部位,但其真正的生理分布和功能尚不明晰[2, 20]。况且,α6/α3与β4 nAChR不同亚基数量的组成,也会影响受体的结构和功能,从而产生不同的生理效应。异源型乙酰胆碱受体的α亚基和β亚基,在某个亚基(限制性亚基)蛋白表达量不足时形成的异源五聚体受体分子中,往往只含有2个限制性亚基,另一个丰富表达的亚基则含有3个[21]。在体外重组表达时,若α3与β4亚基的cRNA分别以1∶10和10∶1的不同比例注射到非洲爪蟾卵母细胞中,将会组装成不同化学构型的异源五聚体受体,其构型分别为(α3)2(β4)3与(α3)3(β4)2;若以1∶1的比例进行注射,(α3)2(β4)3与(α3)3(β4)2这两种构型均会形成,但(α3)2(β4)3构型占主导作用[4]。这些不同化学构型的受体异构体,往往具有不同的生理意义和功能特征,有时对同一配体的结合活性还有差异。因而,这些不同构型的受体需要分别表达出来用于各项研究。
在实验中笔者发现,当α6/α3与β4亚基的cRNA的注射比例为1∶1和1∶10时,2个α亚基和3个β亚基可形成正常的功能性五聚体(α6/α3)2(β4)3 nAChR,对ACh的敏感性高,其门控特性相似;当注射比例为10∶1时,可形成(α6/α3)3(β4)2 nAChR,该构型对ACh的敏感度降低,再次证明α6和β4亚基数量组成改变后,可形成不同的α6/α3β4构型,包括(α6/α3)2(β4) 3和(α6/α3)3(β4)2[22]。ACh的活性结合位点位于α与β亚基的临界结合处,10∶1配比形成的α6/α3β4 nAChR结构可能导致α6和β4亚基的位置关系发生了变化,相邻亚基交界面的改变会影响配体与受体之间的结合活性,从而影响受体的功能。cRNA注射量的差异对受体表达的影响很明显,在保证cRNA注射量约10 ng,注射体积46~50 nL的条件下,α6/α3β4 nAChR的表达稳定,产生的电流较大。若注射体积过大(>100 nL),很容易使蛙卵被胀破而死亡。蛙卵的质量是直接影响受体表达的另一关键因素,需精心挑选不同批次的、发育良好的、健康的非洲爪蟾卵母细胞进行注射。因此,须挑选大小正常、动植物极分明、圆形饱满的蛙卵,α6/α3与β4 cRNA按1︰1进行显微注射,可获得稳定的α6/α3β4受体表达模型;该受体在ACh浓度为100 μmol·L-1的刺激下,其电流稳定在2 000~3 000 nA范围内,以此为实验模型,可开展针对α6/α3β4 nAChR的新药靶向筛选等研究。






 DownLoad:
DownLoad: