-
水产品是粮食供应的重要组成部分,也是人类获取蛋白质和微量元素的重要来源[1]。中国是世界上最大的水产养殖和水产品出口国,约占据全球市场份额的60%[2]。目前,中国淡水养殖以室外池塘养殖和工厂化流水养殖为主[3],养殖密度低,用水量高,占地面积大[4],且含有鱼类排泄物、残留饵料及药物的养殖尾水直接排放会造成严重的水环境污染[5]。由于自然选址的限制和节能减排等压力,水产养殖业的发展已经面临新的瓶颈。养殖规模不可能无序扩张,建立生态环境可持续的高密度循环水产养殖模式就是一种可行的解决方案[6]。
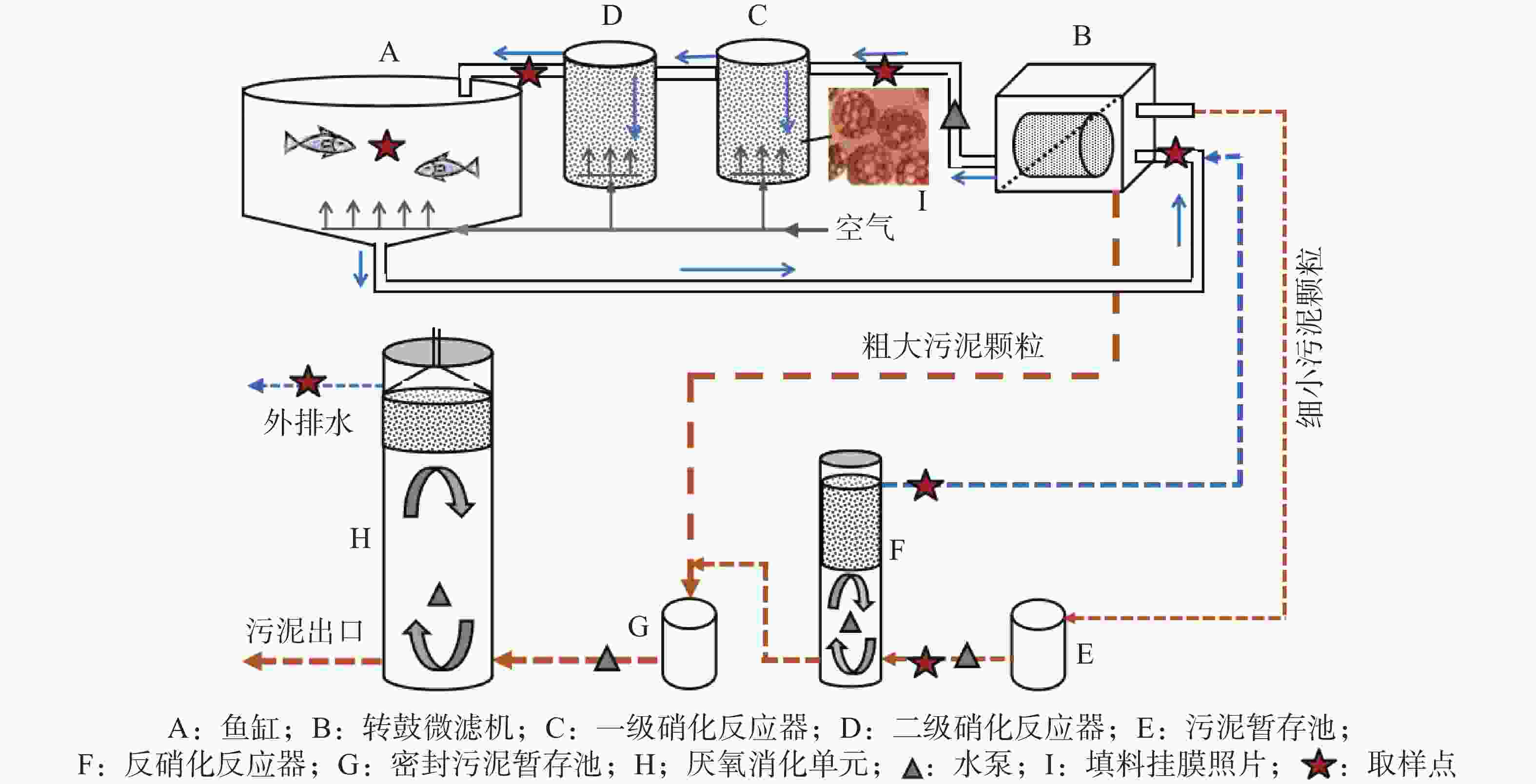
循环水养殖系统(Recirculating Aquaculture Systems,RAS)通过一系列的物理、生物处理单元将养殖水处理后进行循环利用[7],具有水资源利用率高、养殖密度大、占地小、养殖过程可控和生物安全等优势[8-9]。在RAS中,实现高效的固体和含氮污染物去除是降低系统对水、化学物质以及能源需求的关键[10]。精心设计的RAS可以实现每日90%~98%的水循环利用率[4],但传统的RAS一般为单回路循环,即通过物理沉淀或机械过滤去除饲料残留和鱼粪等固体物,再经过硝化作用去除对鱼有毒害作用的氨和亚硝酸盐[11],以保证鱼类正常生长。这种单回路RAS仅针对水进行处理,对系统中产生的鱼粪等固体物并未给予重视[5]。另一方面,硝化作用产生的硝酸盐积累到一定水平也会影响鱼类生长[12],因而需要通过20%~40%的换水率来维持安全的硝酸盐浓度水平(一般不超过500 mg NO3−-N)[4, 11, 13]。升级版的二回路式RAS增加了微生物反硝化单元,可将硝酸盐还原为氮气排出而控制硝酸盐的上升。但反硝化过程需要外加碳源,使运行过程变得复杂,且对鱼粪仍未进行处理[6, 10, 14]。有些研究收集RAS本身产生的有机废物进行水解发酵,产生容易被细菌利用的挥发性脂肪酸(VFAs)作为碳源使用,从而节省外加碳源的成本[14]。但是水解后的上清液中含有高浓度的氨氮(TAN,铵+氨),会增加硝化单元的负荷。在实际养殖罗非鱼(Oreochromis mossambicus)过程中,发现其鱼粪呈细长条且覆有包膜不易散开,因而容易沉积在微滤机的进水区底部,而微滤机反冲洗出来的水则含有大量细小的有机污泥,可以考虑作为碳源使用。为实现更高效的水循环和固体管理、提高RAS的可持续性,本研究拟在传统的单回路RAS基础上增加了反硝化和厌氧消化单元,构建一套由鱼缸、微滤机、好氧硝化、缺氧反硝化和厌氧消化组成的三回路式RAS,并探究以微滤机单元反冲洗的细小有机污泥作为反硝化碳源的可行性及NO3−-N的去除效果和探明系统各处理单元的性能表现。
-
该RAS系统安装在海南省文昌春来水产有限公司琼海种苗基地。由1个1m3的鱼缸和3个处理回路构成(图1)。第一回路包括鱼缸(养殖体积0.9 m3)、74 μm转鼓微滤机、2个流化床生物反应器,通过1个平均流量为2.3 m3·h−1 的水泵(酷鱼,佛山)实现水的循环(表1)。鱼缸底部略呈漏斗状;底部设有微孔曝气管提供不间断曝气;水面设有类似马桶的自动补水装置。微滤机通过定时控制运转,方便调节其他2个回路的水力停留时间(HRT)。2个流化床反应器组成一级(145 L)和二级(220 L)硝化过程,均填充有60%的K3聚乙烯填料供生物膜附着生长,填料尺寸Φ25 mm×9 mm,呈蜂窝状(图1),密度约0.96 g·cm−3,比表面积约500 m2·m−3,空隙率约88.6%;底部安装曝气管,驱动填料循环流动并为微生物生长提供氧气,同时可吹脱水中部分CO2。此外,硝化反应器底部放置有石灰石颗粒,可缓慢溶解补充部分碱度。在运行过程中根据pH下降情况外加石灰水补充碱度,以维持pH的稳定。
组件 工作水
体积/m3平均流量/
(m3·h−1)平均水力
停留时间/h鱼缸(A) 0.90 2.30 0.39 转鼓式微滤机(B) 0.16 2.30 0.07 硝化单元(C、D) 0.365/0.334 2.30 0.15 反硝化单元(F) 0.153/0.148 0.03 4.93 厌氧消化单元(H) 0.726/0.713 0.002 5 284.8 RAS总体积 2.304/2.255 第二回路主要由1个工作体积为153 L的反硝化单元组成,主要作用是利用微滤机反冲洗水含有的细小有机污泥作为反硝化碳源,去除系统中的硝酸盐。反硝化器上部放置约40 cm厚的悬浮填料,起到截留固体浮渣的作用并可作为微生物载体;填料下部空间配备水泵循环回路,以促进泥水混合。吸附在微滤机滤网上的颗粒通过定时反冲洗排入20 L的暂存池中,由浮球液位开关控制间歇泵入反硝化单元,平均流量约为0.03 m3·h−1(表1);上清液从填料表层溢流重新进入微滤机。底部的剩余污泥则定期泵入第三回路的厌氧消化单元作进一步处理。
第三回路主要由1个工作体积为726 L的厌氧消化单元组成,用于鱼粪污泥等颗粒物的厌氧消化,实现稳定化和减量化,并可回收沼气(本研究未进行监测)。单元上部有一个简易的锥形三相分离器,其下有约30 cm厚的悬浮填料层,起到截留固体浮渣作用;填料下部空间也配备水泵循环回路,以促进泥水混合。沉积在微滤机进水区底部的颗粒物通过管道排入20 L的密闭暂存池,然后定时泵送进入厌氧消化单元,平均流量约0.0025 m3·h−1(表1);上清液则溢流排出系统。本实验中平均每天尾水排放量约60 L,占系统总水量的2.60%,养殖水体的6.67%。
-
实验用水为当地的地下水。系统通过不断调试和改进,使各处理单元进入稳定工作状态。实验开始时,放养100条平均体质量为522 g的吉富罗非鱼(O. mossambicus),以便处理系统快速进入稳定负荷运行。实验过程中(2021−07−26—2021−11−23),每2周随机从鱼缸中捞取10条鱼称重,检查其生长情况。罗非鱼饲料购自海南省某公司,其蛋白质、脂肪和P的含量分别为29%、6%和0.8%。每日喂食量为鱼总生物量的1%~2%,分2次(8:30 am,17:30 pm)进行人工喂食,记录喂食量。实验持续121 d。
-
系统通过南京某智能水产养殖监测装置对鱼缸中溶解氧(DO)、温度(T)、pH以及反硝化单元中的氧化还原电位(ORP)进行实时在线监测。每日对鱼缸中的TAN和NO2−-N进行现场快速估测(数据未展示)。实验共设置7个取样点,包括鱼缸、微滤机进水口、硝化单元进水口和出水口、反硝化单元进水口和出水口、厌氧消化单元出水口(图1)。每周对各取样点取样分析,测定TAN、NO2−-N、NO3−-N、PO43−-P、TN、TP、化学需氧量(COD)、电导率(EC)、碱度(ALK)和浊度(Turbidity)。
EC通过梅特勒−托利多某电导率仪测定,TP和PO43−-P采用钒钼酸盐法测定,ALK采用盐酸滴定法测定,TN和NO3−-N采用二阶导数紫外光谱法测定,TAN采用纳氏试剂光度法测定,NO2−-N采用N-(1-萘基)-乙二胺光度法测定,COD采用重铬酸钾法测定[15]。
-
在试验结束时,分别采集硝化单元、反硝化单元和厌氧消化单元的微生物样品,委托上海美吉生物医药科技有限公司进行微生物高通量测序。采用E.Z.N.A.®土壤DNA试剂盒(Omega Bio-tek, US)提取微生物样品的总DNA,利用引物338F(ACTCCTACGGGAGGCAGCAG)和806R(GGACTACHVGGGTWTCTAAT)对提取的DNA进行PCR扩增和纯化,然后在Illumina MiSeq平台进行测序。
-
实验前期(第1~20天,2021−07−26—2021−08−14),该RAS中不存在硝酸盐积累现象,因此未对反硝化单元中的水质指标进行测定,仅检测了反硝化单元内氧化还原电位(ORP)和DO的变化情况;从第21天开始对反硝化单元的出水指标进行检测。为期121 d的实验过程中,系统发生了2次意外事件:第74天时,由于厌氧消化单元进水的单向阀损坏,导致反应器内富含TAN的水大量倒灌进入微滤机,造成微滤机进水中的TAN和NO2−-N急剧上升,但修复后在24 h内系统各水质指标又恢复至正常水平。第86天时,反硝化单元内产生大量浮泥,导致出水水质浑浊和微滤机频繁堵塞。为解决此问题,通过对反硝化单元的进水速率、水力停留时间和底部污泥停留时间进行了为期16 d的调试,使浮泥问题得到解决。
-
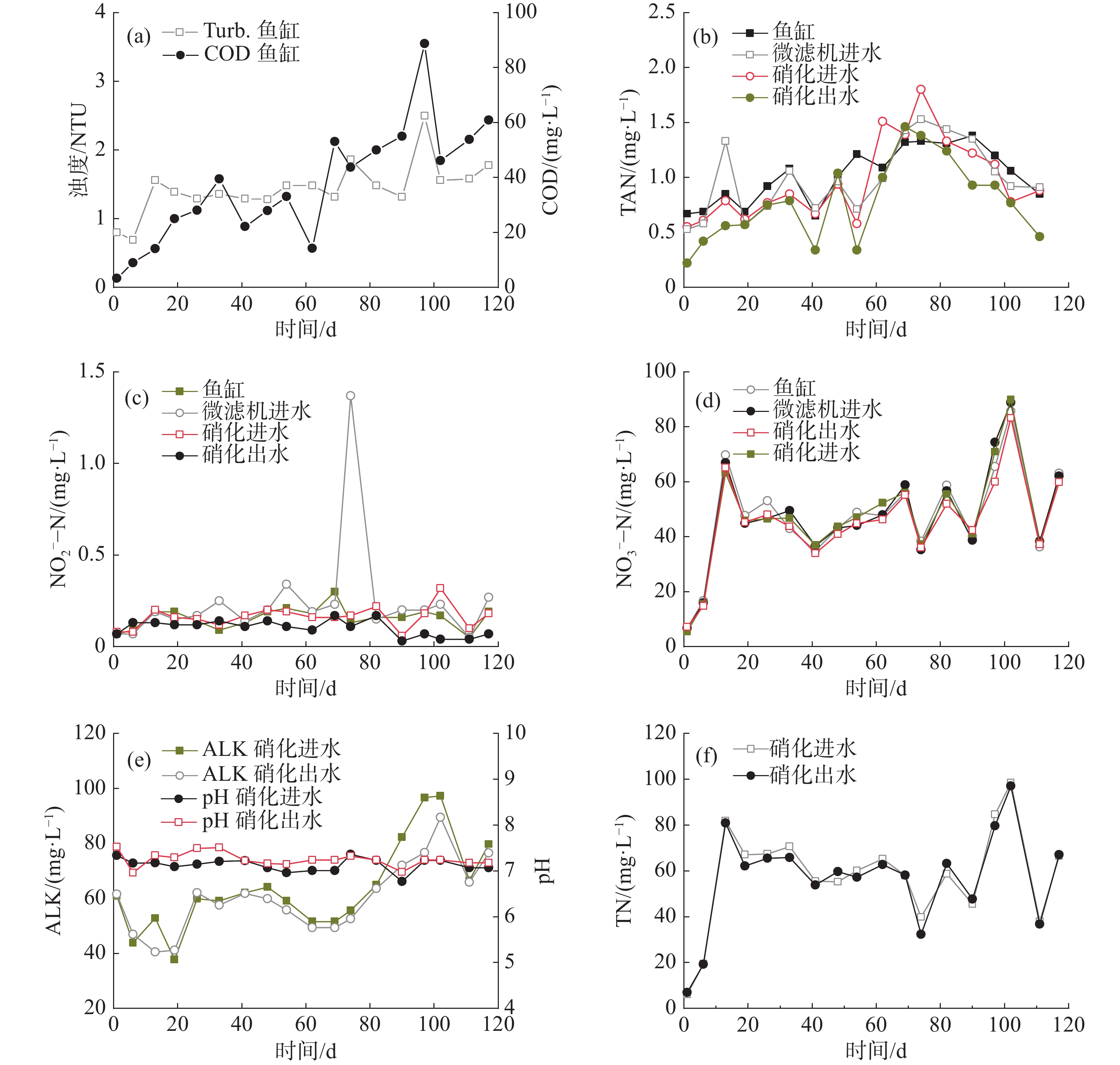
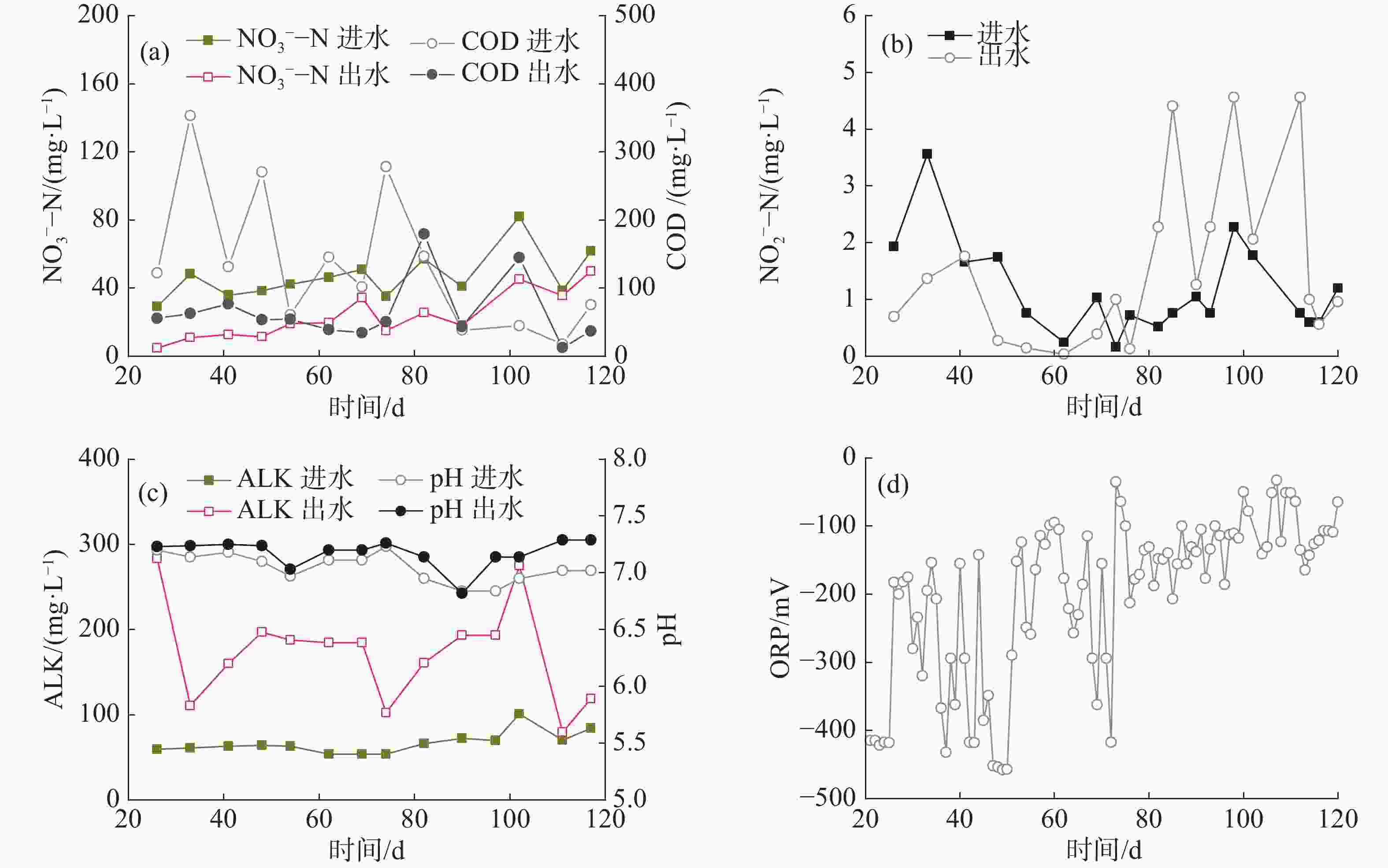
微滤机和硝化单元构成了系统的第一处理回路,鱼粪等颗粒物通过微滤机74 μm滤网过滤分离,鱼缸中水体浊度维持在2.30 NTU以下,平均1.45 NTU;COD在88.7 mg·L−1以下,平均37.10 mg·L−1(图2-a)。
微滤机出水泵入硝化单元,TAN在此转化为NO2−-N进而转化为NO3−-N。N以饲料投加的方式进入系统,随鱼类生长逐渐增加,平均每天有29.92 g N进入系统,后期达到53.59 g·d−1。如图2-b~d所示,二级硝化单元出水和鱼缸中的TAN和NO2−-N浓度并没有随着鱼缸的N负荷增加而显著升高,始终维持在较低的水平,其中TAN在0.22~1.38 mg·L−1范围内波动,平均0.78 mg·L−1和1.02 mg·L−1(图2-b);NO2−-N浓度在0.04~0.21 mg·L−1范围内波动,平均0.10 mg·L−1和0.16 mg·L−1(图2-c)。各单元中NO3−-N浓度变化比较一致,前18 d从6.84 mg·L−1持续上升到69.77 mg·L−1;随后由于反硝化过程的介入,在30~90 mg·L−1间变化(图2-d),平均50.80 mg·L−1。此外,2个硝化单元的pH维持在6.96~7.52,ALK在40.47~97.25 g ·L−1(图2-e),保证了良好的硝化效率。2个硝化单元的TAN平均去除速率为20.05 g ·d−1,最高达83.55 g ·d−1。即使在第74 d发生厌氧消化单元的进水单向阀损坏,微滤机进水TAN和NO2−-N急剧上升至1.80 mg·L−1和1.37 mg·L−1(图2-b~c),硝化单元出水和鱼缸水质仍然维持稳定,且运行很快恢复正常,表明本循环回路具有较好的抗冲击负荷能力。
-
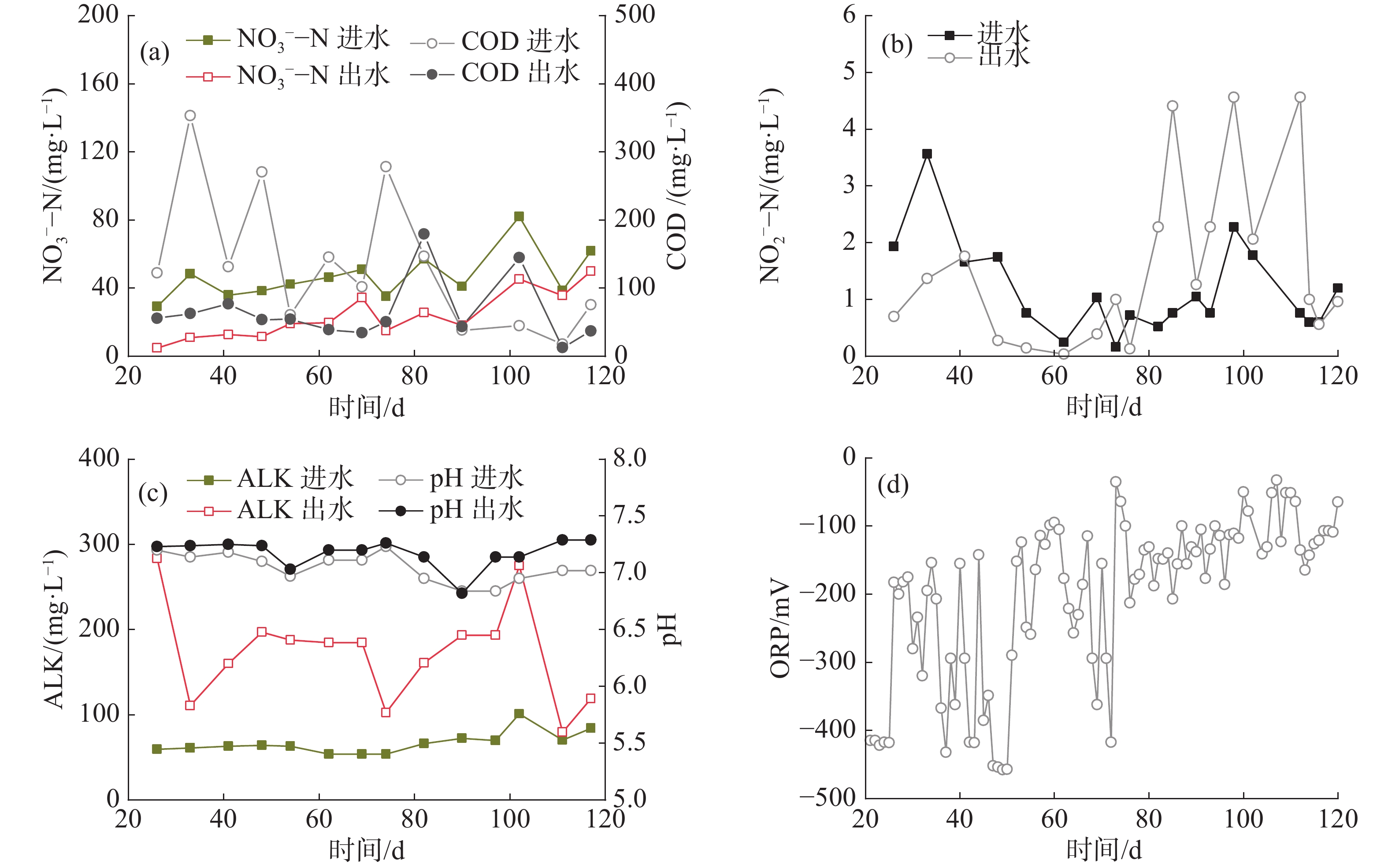
反硝化单元是第二处理回路的核心单元,以微滤机反冲洗产生的细小污泥作为碳源在缺氧条件下把NO3−-N转化为N2O和N2而除去。实验前期(第1~20 天)系统中硝酸盐水平低,反硝化过程未介入。第21~85天,反硝化单元的DO维持在0.27 mg·L−1以下,COD与NO3−-N的比值平均为7.9,NO2−-N在0.04~1.76 mg·L−1波动,无明显的亚硝酸盐积累(图3-a~b)。反硝化单元进、出水的平均ALK分别为66.84 和173.7 mg·L−1(图3-c)。计算得反硝化过程每天可为RAS补充49.61 mg·L−1的碱度。随着鱼长大和喂食量增加,进水中NO3−-N负荷由21.02 g·d−1逐渐增加到59.13 g·d−1,平均负荷30.76 g·d−1,平均浓度42.72 mg·L−1;而出水的NO3−-N仍维持在50 mg·L−1以下,平均浓度17.13 mg·L−1(图3-a)。因此,NO3−-N的平均去除率为59.9%,平均N去除速率为88.68 g ·(m3·d)−1,最高去除速率176.38 g ·(m3·d)−1。从86 d开始,由于系统调试,进水COD值显著降低,NO2−-N浓度则从0.13 mg·L−1上升到4.14 mg·L−1,且此后一直维持在1.26~4.45 mg·L−1的高水平,表明亚硝酸盐还原效率降低,反硝化不完全。第86天,反硝化单元内产生大量浮泥,导致出水浑浊和微滤机堵塞。浮泥的产生可能是由于混合不够均匀,水力停留时间过长,底部污泥堆积导致反硝化单元内N2带动污泥上浮。为此,做了以下调整:(1)将底部部分污泥排入厌氧消化单元;(2)将进水流量由0.27 m3·h−1降低至0.03 m3·h−1,延长进水时间,防止进水水流带动污泥上浮;(3)在满足缺氧条件下,增大微滤机的反冲洗频率、提高进水量,使反硝化单元的水力停留时间由8.76 h降低至4.93 h。经过为期16 d的运行调整,浮泥问题显著改善。然而,由于微滤机反冲洗频率增加,导致反冲洗水的污泥浓度降低,COD与NO3−-N比值低于3~6,不利于NO3−-N完全转化为N2[16]。
ORP是指示反硝化单元运行情况的重要参数之一,它反映了单元内的氧化物水平(如O2和NO3−),可用于判定反硝化进行的程度。当ORP在0~−200 mV内,表示发生一步反硝化,即NO3−-N→NO2−-N;当ORP<−200 mV时,发生完全反硝化,即NO2−-N→N2;当ORP<−400 mV时,则容易产生有毒的H2S[11]。第21~85天,ORP主要在−200~−450 mV波动(图3-d),表明反硝化单元内发生完全反硝化,脱氮效果稳定。第86~121天,ORP在−50~−200 mV波动(图3-d),表示反硝化单元为一步反硝化,出现亚硝酸盐积累现象,这与碳源供应不足有关。
-
第三回路通过厌氧消化过程实现颗粒物的稳定化和减量化,系统运行期间颗粒物全部进入消化单元,无污泥外排。消化单元每天约60 L上清液溢出(占系统总水量的2.66%),此为系统除蒸发和漏损之外的日水量损失。该上清液中TAN的平均浓度为7.84 mg·L−1,最高21.62 mg·L−1,TN为20.99 mg·L−1,TP为16.34 mg·L−1,COD为60.02 mg·L−1(表2)。试验结束后消化单元内仅有少量污泥残留,稳定化和减量化效果较好。
参数 0~30 d 31~60 d 61~90 d 91~121 d 0~121 d TAN 3.07 6.75 7.80 15.2 7.84 TN 27.06 16.86 15.06 23.01 20.99 TP 7.13 15.59 19.36 26.52 16.34 COD 34.96 50.96 78.73 88.63 60.02 -
本三回路式RAS主要评估系统的水质保障能力,故选择成年罗非鱼进行试验,养殖参数见表3。所放养的100尾罗非鱼初始平均质量522 g,每日饲料投喂量由实验初期鱼体质量的0.5%逐渐增加至鱼体质量的1%~2%。经过121 d的饲养后,罗非鱼平均体质量为970 g,养殖密度达到107.7 kg·m−3,存活率为100%,月平均饲料转化率(FCR)在1.2~1.99之间,平均值1.74(表3)。
参数名称 结果 初始平均鱼体质量/g 522 结束平均鱼体质量/g 970 最终养殖密度/(kg·m−3) 107.7 饲料转化率FCR/% 1.74 存活率/% 100 每日换水率/% <3 养殖耗水量/(L·kg−1) 162.1 水体交换速率/((L·kg−1 ) 92.9 -
本三回路式RAS的总水量为2.255 m3,其中鱼缸的养殖水量为0.9 m3。厌氧消化单元每日溢流水量约60 L·d−1,占系统总水量的2.66%,养殖水量的6.67%,加上蒸发、渗漏和鱼类捕捞等造成的水量损失,每日换水率约为系统总水量的3%。该系统的养殖耗水量(以生产1 kg鱼所需的耗水量计算)为162.1 L·kg−1(表3),水体交换速率(以投加1 kg饲料所需的耗水量计算)为92.9 L·kg−1(表3)。
-
实验期间,鱼缸的水温在21.5~31.7 ℃之间波动,pH维持在6.92~7.39,DO在4.00 mg·L−1以上;TAN和NO2−-N的平均浓度分别为1.05 mg·L−1和0.16 mg·L−1,最高浓度分别为1.60 mg·L−1和0.30 mg·L−1(表4),满足水产养殖水质要求[17]。NO3−-N浓度在前20 d内呈现缓慢上升趋势,之后稳定在55 mg·L−1左右(图2-d),其浓度远低于淡水鱼类的耐受阈值(96 h LC50s>1 000 mg·L−1)和养殖水质控制要求的500 mg·L−1[4, 18]。磷酸盐浓度呈缓慢增加趋势,由1.21 mg·L−1到17.12 mg·L−1(表4)。
参数 TAN
/(mg·L−1 )NO2−-N
/(mg·L−1)NO3−-N
/(mg·L−1)pH T
/℃EC
/(mS·cm−1)DO
/(mg·L−1)PO43--P
/(mg·L−1)最小值 0.65 0.05 6.84 6.92 21.5 0.37 4.00 1.21 最大值 1.60 0.30 85.66 7.39 31.7 1.12 7.08 17.12 平均值 1.05 0.16 47.51 7.17 28.5 0.77 5.32 9.91 -
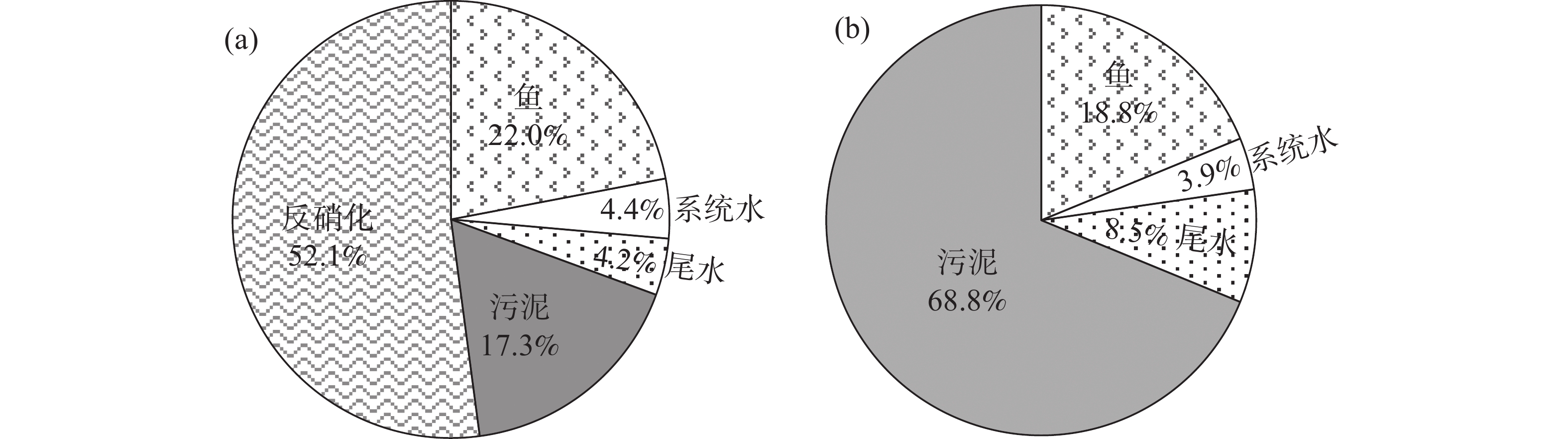
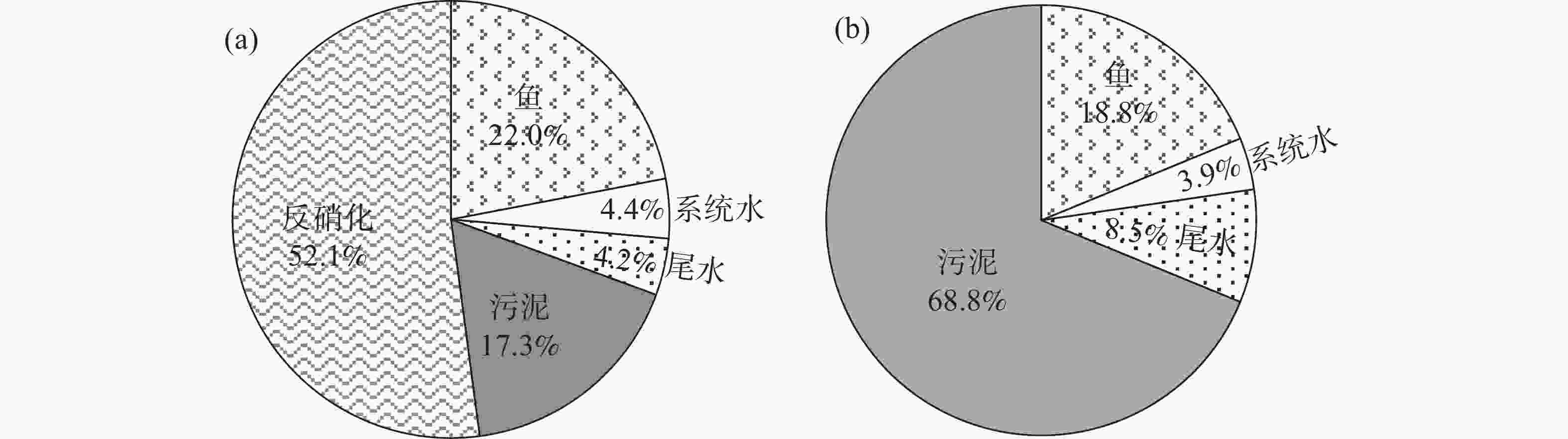
N、P质量平衡计算和分析结果如图4所示。饲料是RAS中N和P的唯一来源。试验过程共投入77.91 kg饲料,其中,含有 3.62 kg N和 1.40 kg P。
根据文献资料计算得到,通过饲料进入系统的3.62 kg N中,约22%(0.80 kg)被鱼同化[19],4.4%(0.16 kg)以无机氮的形式(如NO3−-N、TAN)残留在水体中,4.2%(0.15 kg)主要以TAN的形式从厌氧消化单元排出,17.3%(0.63 kg)保留在污泥中,剩余52.1%(1.89 kg)的N则通过反硝化以N2形式排出系统外(图4-a)。进入系统的P为1.40 kg,约18.8%(0.26 kg)被鱼转化利用[19],3.9%(0.05 kg)以磷酸盐的形式残留在水体中,68.8%(0.96 kg)的P以污泥的形式存在于消化单元中,剩余8.5%(0.12 kg)的P通过溢流从消化单元排出系统(图4-b)。
-
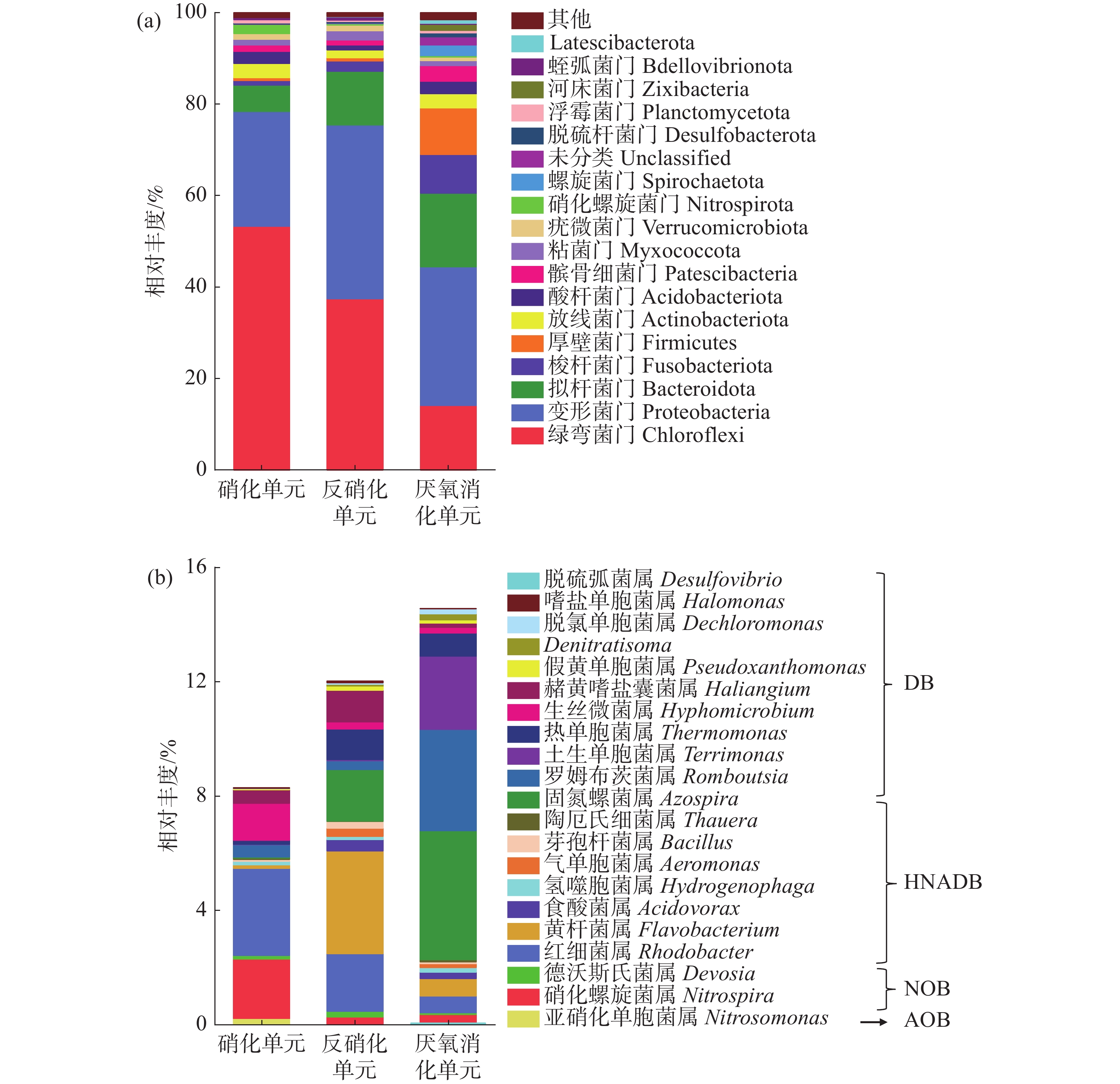
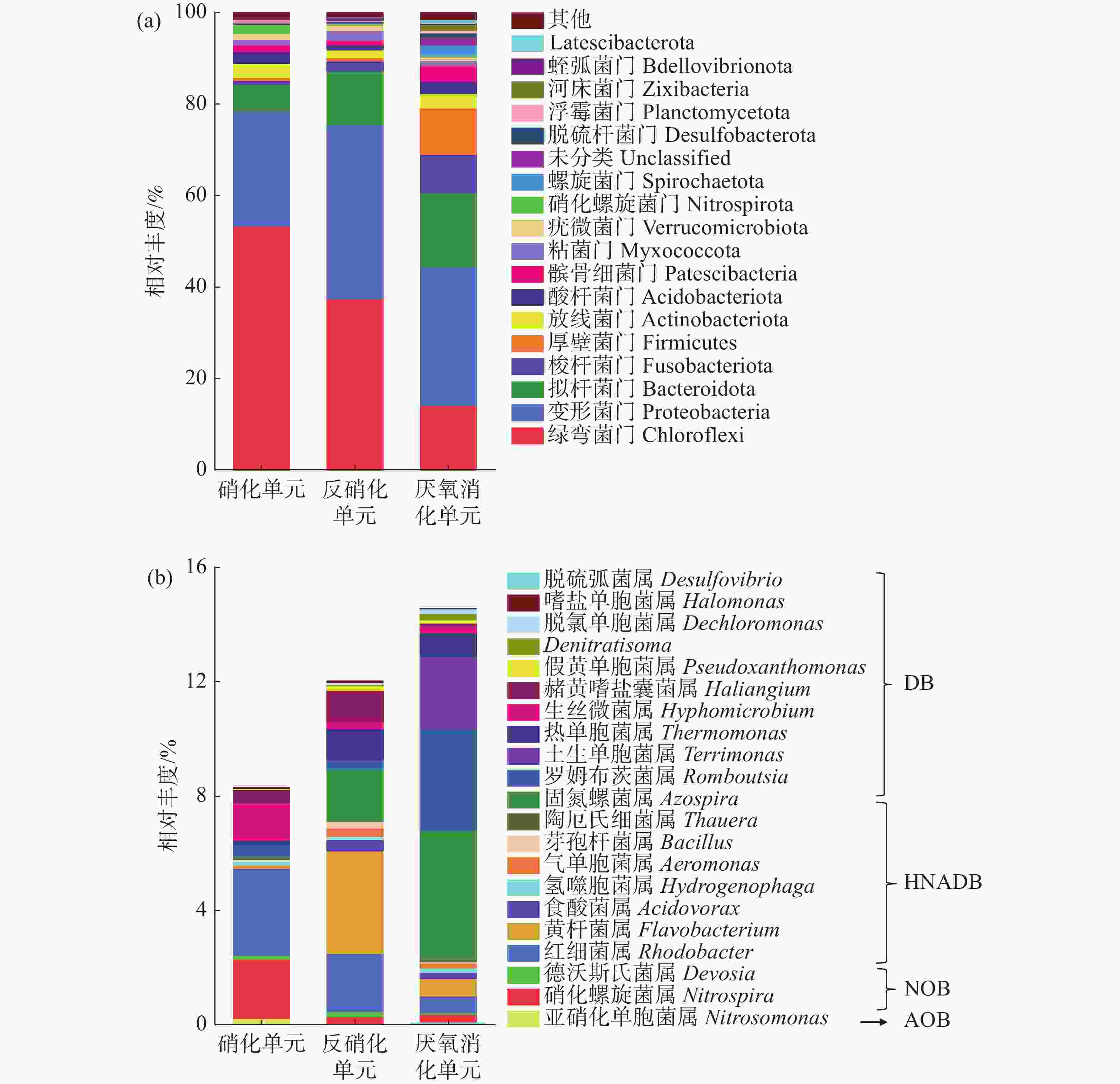
通过高通量测序进行微生物群落分析,在门水平上的细菌群落结构分布如图5-a,其中相对丰度小于0.5%的菌群被归为“其他”。变形菌门和拟杆菌门是反硝化的主要门,包含许多与反硝化过程相关的细菌[20],其他门包括绿弯菌门(Chloroflex)、梭杆菌门(Fusobacteriota)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteriota)、酸杆菌门(Acidobacteriota)等参与了硝化、反硝化和厌氧消化过程。结果表明,绿弯菌门(Chloroflex)、变形菌门(Proteobacteria)和拟杆菌门(Bacteroidota)为硝化单元、反硝化单元和厌氧消化单元中的优势门,相对丰度分别为5.81%~53.24%、11.72%~37.45%和14.10%~30.32%。而硝化螺旋菌门(Nitrospirota)仅在硝化单元出现,相对丰度为2.07%。
各处理单元中,与氮代谢相关的功能菌属的结构分布如图5-b所示,其中硝化螺旋菌参与硝化作用;红细菌属为异养硝化好氧反硝化菌(HNADB),可参与异养硝化和好氧反硝化作用[21];黄杆菌属和固氮菌属是经典的反硝化细菌,可促进高效反硝化体系的形成[22]。在硝化单元、反硝化单元和厌氧消化单元中,分别有8.29%、12.02%和14.62%的菌属与氮代谢相关。在硝化单元中,与氮代谢相关的菌属有硝化螺旋菌属(Nitrospira)、德沃斯氏菌属(Devosia)、亚硝化单胞菌属(Nitrosomonadaceae)、红细菌属(Rhodobacte)、黄杆菌属(Flavobacterium)和氢噬胞菌属(Hydrogenophaga)等,其中硝化螺旋菌属、红细菌属和生丝微菌属(Hyphomicrobium)为优势菌属,相对丰度分别为2.07%、3.04%和1.30%。反硝化单元中与氮代谢相关的优势菌属分别为黄杆菌属、红细菌属和固氮螺菌属(Azospira),相对丰度分别为3.60%、2.01%和1.80%。厌氧消化单元中与氮代谢相关的优势菌属分别为固氮螺菌属、罗姆布茨菌属(Romboutsia)和土生单胞菌属(Terrimonas),相对丰度分别为4.52%、3.54%和2.56%。罗姆布茨菌属和土生单胞菌属同样参与了反硝化过程。此外,罗姆布茨菌属和土生单胞菌属可分别将单糖和淀粉进一步水解为VFAs,为反硝化微生物提供容易利用的碳源[22]。
-
罗非鱼是海南最主要的淡水养殖鱼类(约占90%),在传统大塘养殖模式下,养殖密度仅约4.5 kg·m−3,占地面积大,生长过程不可控,尾水排放对周边水环境影响严重,产业发展受到制约。与Shnel等[23]提出的最大养殖密度为61.8 kg·m−3的新型RAS相比,本三回路式RAS技术实现了107.7 kg·m−3的养殖密度,鱼的存活率为100%,FCR为1.74。试验后期较高的FCR(1.99)可能与罗非鱼在此体质量时的生长特性有关[24-25]。Oliveira等[25]绘制的罗非鱼生长曲线表明,罗非鱼体质量超过200~300 g后,生长呈稳定状态,并不随喂食量的增加而明显增加。同时,Martins等[24-25]的研究表明,在低换水速率的RAS中,个体较大的罗非鱼(体质量200~300 g)会出现生长迟缓的趋势,表现出低生长速率和高饲料转化率(FCR高达2.12),而个体较小的罗非鱼[(81.4±21.0)g]生长得更好[25]。本研究中的罗非鱼个体更大,但FCR值反而低于其他研究结果,说明系统具有较高的养殖效率。
-
该三回路式RAS在传统的单回路RAS基础上增加了反硝化和厌氧消化单元,从而实现高效水循环和鱼粪污泥处理。在水产养殖中,鱼粪和悬浮固体(SS)的高效分离是RAS中的关键环节,可大大减轻鱼缸和硝化单元中的碳(C)、N负荷,降低系统的需氧量,还可为养殖生物提供优越的水体环境。根据文献数据,养殖系统中TAN和NO2−-N的浓度宜控制在5.0(pH<8.0时)和0.3 mg·L−1以下[18, 26]。传统RAS中的硝化单元一般采用一级流化床反应器,填料填充率小于36%[17],单位体积TAN去除率为70~270 g·(m3·d)−1[17]。在本RAS中,硝化单元中填料的单位体积TAN去除率达381 g·(m3·d)−1,其良好的硝化效率可归因于硝化单元中流化床反应器的二级设计、较高的填料填充率(60%)、充足的曝气(DO>5 mg·L−1)、合适的pH和ALK控制。试验过程中,硝化单元进水的TN和NO3−-N总是略高于硝化单元出水,可能是由于硝化单元内发生了脱氮作用,而硝化单元中含有好氧反硝化细菌的微生物群落分析结果证实了这一猜测。
第二处理回路的反硝化过程可减少为维持NO3−-N水平而需要的水体交换量,产生的OH−还可为系统补充碱度[16, 27]。但反硝化过程需要外加碳源如甲醇、醋酸钠或糖蜜等,导致运行成本增加[28]。本研究以微滤机反冲洗产生的细小污泥作为碳源取得了成效,通过资源化利用降低系统的C排放并节约运行成本[29-30]。在相似的COD与NO3−-N比值条件下,Suhr等[31]利用淡水虹鳟鱼商业RAS水解污泥的上清液作为反硝化碳源,其脱氮速率为124.8 g ·(m3·d)−1。本研究中污泥未经过水解过程直接使用,而硝酸盐的去除速率与之相当。因此,合理调控污泥进入反硝化单元和排入厌氧消化单元的比例,维持合适的COD与NO3−-N的比值是系统实现高效、稳定反硝化脱氮的关键。反硝化过程产生的ALK与石灰石一起有效弥补了硝化作用和鱼呼吸作用所造成的ALK损失和pH下降,减少了外加碱性化学品的用量和成本,为RAS的稳定运行提供了有力保障。
第三处理回路的厌氧消化过程可实现鱼粪污泥的稳定化和减量化,实验结束后消化单元残留的少量污泥具有较高N、P含量,且常含磷灰石和鸟粪石等矿物质,大规模生产时有望作为缓释肥被回收利用[32]。该RAS每天仅有约7%的尾水从厌氧消化单元溢出,大大减轻了尾水处理的压力和对周边水环境的影响。而溢出的尾水含有植物生长所需的N、P等营养物质和多种微量元素,可作为水培蔬菜的营养液被进一步利用。
-
本三回路式RAS具有更低的N残留,且以水体交换形式产生的N排放量(1.94 g·kg−1饲料)比传统的RAS低21倍[13, 26]。反硝化去除52.1%的N则略低于文献[10-11]的报道(60%~70%)。上述结果与反硝化单元可处理的水量有关,而试验后期(86~102 d)反硝化单元发生污泥上浮现象对此有较大影响。如正常运行,则可实现59.7%的N去除。
据报道,饲料中只有15%~40%的P被鱼类同化[19],剩下的则被排到水体中。虽然较高浓度的磷酸盐并不对鱼类造成伤害,但排放到环境中会造成水体富营养化等问题。本研究中,经厌氧消化处理后,约8.5%的P通过溢流排出系统,低于文献报道的22.9%[23];剩余68.8%的P以污泥的形式存在于消化单元中。此外,该三回路式RAS的水体交换速率为92.9 L·kg−1,远小于流水式养殖、半封闭养殖的水体交换速率(v)(流水式养殖v>50 m3·kg−1,半封闭养殖v为1~50 m3·kg−1) [5],也低于常规RAS(0.1~1 m3·kg−1)和实验室规模RAS(生产1 kg鱼需要数百到数千升水) [5,19],显示出优越的水资源利用效率。
-
在硝化单元、反硝化单元和厌氧消化中,共检测到21个与氮代谢相关的菌属(相对丰度大于0.05%),包括自养硝化菌属(AOB和NOB),异养硝化好氧反硝化菌属和反硝化菌属(DB);AOB和NOB主要富集在硝化单元中;HNADB具有异养硝化好氧反硝化的能力[21],主要包括红细菌属、黄杆菌属、氢噬胞菌属和食酸菌属(Acidovorax)等,该类菌属在硝化单元、反硝化单元和厌氧消化3个处理单元中均有富集。表明硝化单元中TAN和NO2−-N的高效去除是AOB、NOB和HNADB共同作用的结果。同时,各处理单元中的脱氮作用也与HNADB密切相关。在脱氮过程中,DB也发挥着重要作用,主要包括罗姆布茨菌属、土生单胞菌属和热单胞菌属(Thermomonas)等,该类菌属主要富集在反硝化单元和厌氧消化单元中。值得关注的是,硝化单元中同样存在着DB,相对丰度为2.43%,因此,存在弱脱氮效果。
-
(1)本研究通过引入反硝化单元和厌氧消化单元组成三回路式RAS,达到养殖水循环利用、鱼粪污泥减量化、稳定化和控制NO3−-N的目的,实现每日约93%的养殖水体循环率。
(2)利用微滤机反冲洗的细小污泥作为反硝化碳源可行,反硝化运行相对稳定,有效控制NO3−-N水平,节约运行成本。
(3)共21个菌属参与了N代谢,包括红细菌属、黄杆菌属和固氮螺旋菌属等。其中红细菌属和黄杆菌属等异养硝化好氧反硝化菌属HNADB在硝化单元被发现,表明硝化单元中存在弱脱氮作用。
(4)饲料中的N、P仅有不到40%被鱼同化,其余作为污染物被去除,是巨大的资源浪费。因此,C、N、P资源回收利用途径研究具有重要意义。
Development and application of a three-loop recirculating freshwater aquaculture system
DOI: 10.15886/j.cnki.rdswxb.20230007
- Received Date: 2023-01-28
- Accepted Date: 2023-03-15
- Rev Recd Date: 2023-03-12
- Available Online: 2023-05-06
- Publish Date: 2024-01-16
-
Key words:
- recirculating aquaculture system /
- three-loop treatment /
- denitrification /
- carbon source /
- anaerobic digestion
Abstract: In order to meet the increasing demand for high-quality fish protein and environmental protection requirements, a pilot intensive three-loop recirculating freshwater aquaculture system (RAS) was developed in Qionghai, Hainan province, China. Backwashing water from a microfilter is used as the carbon source for the denitrification process, and an operation mode is established to ensure the treatment of water quality and fish sludge to comply with the requirements for fish growth and pollution control. Tilapia (Oreochromis mossambicus) was cultured in the pilot three-loop freshwater RAS for 121 days in an aquaculture experiment, and the fish growth, water quality and microbial communities in the system were observed and analyzed. The results showed that the tilapia had a survival rate of 100%, with the stocking density and the feed conversion ratio (FCR) being 107.7 kg·m−3 and 1.74, respectively. The average concentrations of total ammonia (TAN), nitrite (NO2−-N) and nitrate (NO3−-N) were 0.95, 0.15 and 43.01 mg·L−1 respectively. The volume for daily water drainage was 2.66% of the total water volume in the system, and 6.67% of the water volume in the fish tank. No fish sludge was discharged throughout the experiment, and only a small amount of sludge existed in the anaerobic digestion unit by the end of the experiment. Microbial community analysis showed that a total of 21 genera of microorganism were involved in nitrogen metabolism, including Rhodobacte, Flavobacterium and Azospira. These results implicated that the recirculating aquaculture system provides a potentially sustainable and ecological aquaculture mode for freshwater fish such as tilapia.
| Citation: | PAN Guoying, WEN Chang, HUANG Weiwei, YAO Xuemei, DONG Lili, ZHOU Meiyang, YANG Fei. Development and application of a three-loop recirculating freshwater aquaculture system[J]. Journal of Tropical Biology, 2024, 15(1): 122-132. doi: 10.15886/j.cnki.rdswxb.20230007 |








 DownLoad:
DownLoad: