-
抗原呈递细胞(Antigen presenting cell,APC)如树突状细胞、巨噬细胞以及B细胞等是免疫系统中完成捕获与传递抗原信号、激活免疫应答的重要组成部分。APC分泌的外体可通过传递膜结合分子、细胞因子以及微RNA等组分参与调控免疫应答。巨噬细胞在免疫系统中发挥着重要作用,主要有吞噬、抗原呈递和分泌炎症相关细胞因子等[1]。巨噬细胞具有可塑性,表现出不同的表型和功能。其中,脂多糖(Lipopolysaccharide,LPS)常用于诱导巨噬细胞的活化。LPS是革兰氏阴性细菌细胞壁外壁的组成成分,是由脂质和多糖构成的细菌内毒素。在免疫系统中,巨噬细胞通过Toll样受体4(Toll-like receptor 4,TLR4)识别革兰氏阴性菌的脂多糖,激活细胞内途径,如核因子κB途径,诱导促炎细胞因子的表达,促进抗原呈递以及炎性反应。有研究结果[2-4]表明,在细菌感染情况下的巨噬细胞会释放携带病原体相关分子模式(PAMP)的外体,并通过Toll样受体激活巨噬细胞分泌细胞因子,进一步诱导记忆CD4+T和CD8+T细胞的成熟。
外体是由细胞分泌的含有多种生物活性物质,主要由蛋白质、核苷酸和脂类等组成的具有膜结构的微小囊泡。作为天然纳米结构,外体的直径为30 ~150 nm,是参与细胞间通信的重要物质。免疫细胞分泌的外体可以通过传递膜结合分子和miRNAs等来实现调节免疫功能。LPS刺激的巨噬细胞所分泌的外体参与调节免疫反应[5-6]。此类外体具有免疫佐剂的潜能。据报道,LPS诱导的小鼠巨噬细胞系分泌的外体可诱导小鼠体内产生大量的IFN-γ,促进Th1型细胞免疫[7]。并且,LPS刺激的鸡巨噬细胞(HD11)所分泌的外体通过MyD88/NF-κB信号通路促进免疫应答[8]。目前,对脂多糖刺激鸡巨噬细胞产生的外体对免疫应答的影响并不完全清楚。成熟的树突状细胞能有效激活幼稚T细胞,也可以直接激活CD4+T和CD8+T 细胞,处于启动、调控、并维持免疫应答的中心环节[9]。因此,作为重要的抗原呈递细胞,禽类树突状细胞能否被LPS诱导的HD11源外体活化是决定此类外体能否作为免疫佐剂用于家禽的疫病防控的关键因素。
家禽品种多且MHC分子等基因具有多态性,免疫性状及免疫相关分子应答亦有一定差异,因此不同品种的鸡对HD11源外体的免疫应答调控可能也存在差异。海南地方优良肉鸡品种文昌鸡(Gallus domesticus)与其他鸡种间存在较大差异的免疫性状,特别是在抗禽流感和新城疫病毒感染过程中,文昌鸡免疫性状明显优于国外引进鸡种[10]。文昌鸡与其他种鸡之间MHC分子抗原呈递结构也存在差异[11]。由于HD11细胞并不来源于文昌鸡,而外体的功能与外体来源及其作用的靶细胞息息相关。据此,本研究以文昌鸡骨髓源树突状细胞作为研究对象,探究LPS刺激的HD11源外体对其活化作用,为后期以LPS诱导的HD11源外体作为免疫佐剂用于文昌鸡疫病防控提供理论依据。
-
鸡源巨噬细胞系(HD11细胞),文昌鸡骨髓源树突状细胞。
-
14日龄文昌鸡,用于提取骨髓源树突状细胞。
-
超净工作台(苏州净化),高速离心机(力康发展有限公司),各个规格移液枪(Eppendorf),超速离心机Optima L-100XP(Beckman Coulter),全波长酶标仪Infinite M200 PRO[瑞士TECAN勒菲生物科技(上海)有限公司],荧光显微镜BX51(OLYMPUS公司),荧光定量PCR仪Q2000B(杭州朗基科学仪器有限公司),PCR仪S100TMThermal Cycler(美国 Bio-Rad)。
-
脂多糖、淋巴细胞分离液购自索莱宝生物科技有限公司;RIPA裂解液购自博士德生物公司;BCA蛋白浓度测定试剂盒购自上海生工生物工程有限公司;PKH67染料试剂盒、高糖培养基购自HyClone;胎牛血清购自Gibco;无外体血清购自SBI;鸡脂多糖ELISA检测试剂盒购自上海酶联生物科技有限公司。重组鸡 GM-CSF、IL-4 细胞因子购于 Abcam 公司;总RNA提取试剂盒、FastKing一步法除基因组cDNA第一链合成预混试剂和SuperReal荧光定量预混试剂购于天根生化科技有限公司;上下游引物由生工生物合成。
-
用含有10%胎牛血清的培养基于培养箱(37 ℃,含5% CO2)中培养生长状态良好的HD11细胞,并在无菌条件下进行传代等操作。待细胞密度达70%~80%时,进行细胞传代操作,将HD11细胞分别按照 5×106 个·mL−1细胞密度 5×106 个·mL−1接种于T25细胞培养瓶中,并更换细胞培养液中的血清,配制2%含有无外体血清的培养液继续培养细胞,并将细胞分为试验组(脂多糖组)与对照组。试验组的细胞培养液中加入终浓度为20 μg·mL−1的脂多糖刺激细胞,继续培养24 h。
-
将未加脂多糖刺激的HD11细胞和加入脂多糖刺激的HD11细胞分别按照 5×106个·mL−1细胞密度接种于T25细胞培养瓶中,以 2% 无外体胎牛血清进行培养 24 h后,每种细胞收集 100 mL细胞培养上清。在 4 ℃,2 000×g 离心 30 min 条件下离心去除杂质,保留上清。将上清液移至新的离心管中,10 000 × g,4 ℃离心 45 min去除较大的囊泡或细胞碎片,然后经无菌 0.45 μm 滤膜过滤,收集过滤产物。将上述滤液加入100 kDa的超滤管中,于 4 ℃进行离心浓缩,将 100 mL细胞上清总体积浓缩至 5 mL,经无菌 0.45 μm滤膜过滤,收集过滤液。将过滤液移至超速离心管中,4 ℃,100 000 × g 离心70 min,去除上清,用 10 mL预冷的 1×PBS 重悬后,再次以 4 ℃, 100 000 ×g 条件,超速离心70 min后,收集沉淀即得到外体。收集全程均在超净台中完成,整个过程中使用的相关耗材及试剂均需高压灭菌或使用商品化无菌一次性材料。
-
收集超速离心洗涤外体的PBS上清液,用于检测其中的脂多糖残留量。配制脂多糖标准品溶液,并根据试剂盒说明书进行后续加样、洗板等操作。随后使用酶标仪在450 nm波长处测定各孔的OD值。绘制标准曲线,并根据所得标准曲线计算洗涤外体后PBS上清液中的脂多糖含量。
-
外体的透射电镜鉴定用 150 μL 预冷的 1×PBS(经 0.22 μm)均匀重悬外体,吸取样品 10 μL 滴加于铜网上沉淀 1 min,滤纸吸去浮液。然后用磷钨酸 10 μL 滴加于铜网上沉淀 1 min,滤纸吸去浮液。常温干燥数分钟后,以 100 kv 进行电镜检测成像,获得透射电镜成像结果。外体的粒径分析与纳米颗粒浓度测定取 10 µL外体样本于 25 ℃水浴解冻,用 PBS 进行稀释(V∶V=1∶1),直接用于粒径大小检测(Flow NanoAnalyzer),剩余外体于−80 ℃保存。
-
梯度稀释牛血清白蛋白(BSA)标准品,制备 BCA 工作液(具体操作按说明书进行)。将各个稀释浓度的蛋白质标准品和待测蛋白质样品加入酶标板中,分别加入 200 μL BCA 工作液混匀。37 ℃ 孵育30 min。测定品在 562 nm波长的吸光值。制作标准曲线,并计算出外体样品的蛋白浓度。
-
取无菌 1.5 mL离心管,加入稀释液C以及 PKH67 染料 (PKH67 Green Fluorescent Cell Linker Mini Kit, MERCK),配制成染料工作液。在无菌条件下,向每管分别加入稀释液C至总体积为 250 μL。用枪轻柔吹打混匀30次,再振荡15 s。快速将250 μL外体稀释液加入到250 μL PKH67(MINI67,购于 Sigma-Aldrich)染料工作液中,立即用枪轻柔吹打混匀30次。混合液孵育3 min 后,每管加入500 μL无外体血清并吹打混匀30次,终止反应后并再次使用超速离心分离纯化外体,以去除残留的染料。
-
将在隔离器中饲养的 14 日龄文昌鸡麻醉处死后,从其胫骨骨髓中分离得到骨髓,制成骨髓细胞悬液备用。将骨髓细胞悬液 1500 r·min−1 离心 10 min,弃上清,收集细胞沉淀,加入 PBS 缓冲液离心洗涤 2~3次,弃上清后重悬,制备单细胞悬液。然后,加入与单细胞悬液等量的鸡骨髓淋巴细胞分离液(购自索莱宝),按说明书操作提取骨髓细胞后,于10%胎牛血清 FBS,RM1640 培养基培养(均购自 Gibco),培养24 h后,加入含细胞因子重组鸡 GM-CSF、IL-4 细胞因子(25 μg ·mL−1,购于 Abcam 公司)培养液,持续培养作用 7 d ~ 10 d,前3 d每天换1次培养液,之后可2 d换1次培养液。
-
用50 ng·mL-1终浓度的Nor-Exo、LPS-Exo刺激树突状细胞,在刺激24 h 后通过荧光显微镜观察LPS-Exo、Nor-Exo是否被树突状细胞摄取以及摄取后发生的形态变化。
-
分别收集无外体刺激的树突状细胞(Ctrl组)以及经外体Nor-Exo、LPS-Exo作用后的树突状细胞,提取细胞总RNA后反转录为cDNA,用于荧光定量PCR。根据试剂盒说明书配制反应体系,通过荧光定量PCR,以β-actin为内参,检测细胞因子IFN-γ、IL-12p40表达。IFN-γ、IL-12p40、β-actin引物序列见表1。
样本名称 Forward Reverse IFN-γ ATCATACTGAGCCAGATTGTTTCG TCTTTCACCTTCTTCACGCCAT IL-12p40 ACTTTCCTTTGCTGCCCTTCTGG GCTGGTGTCTCATCGTTCCACTC IL-4 TCCCTCAAGGTAAGGCTCTGT GGCTGTGTGAGAGGAGAACG β-actin ACGTCGCACTGGATTTCGAG TGTCAGCAATGCCAGGGTAC -
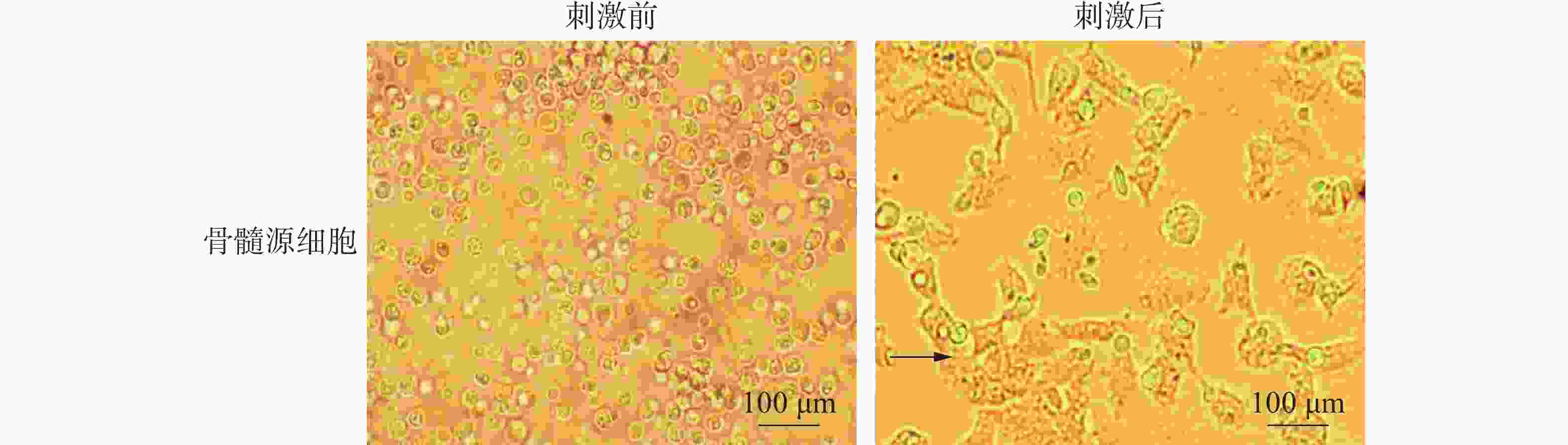
生长状态良好的HD11细胞在更换培养液培养24 h后,在倒置显微镜下观察其生长状态,可见经脂多糖刺激后的HD11细胞形态与刺激前相比发生了明显的变化。对照组HD11细胞并未发生明显的活化,而脂多糖组HD11细胞大量活化(图1)。
-
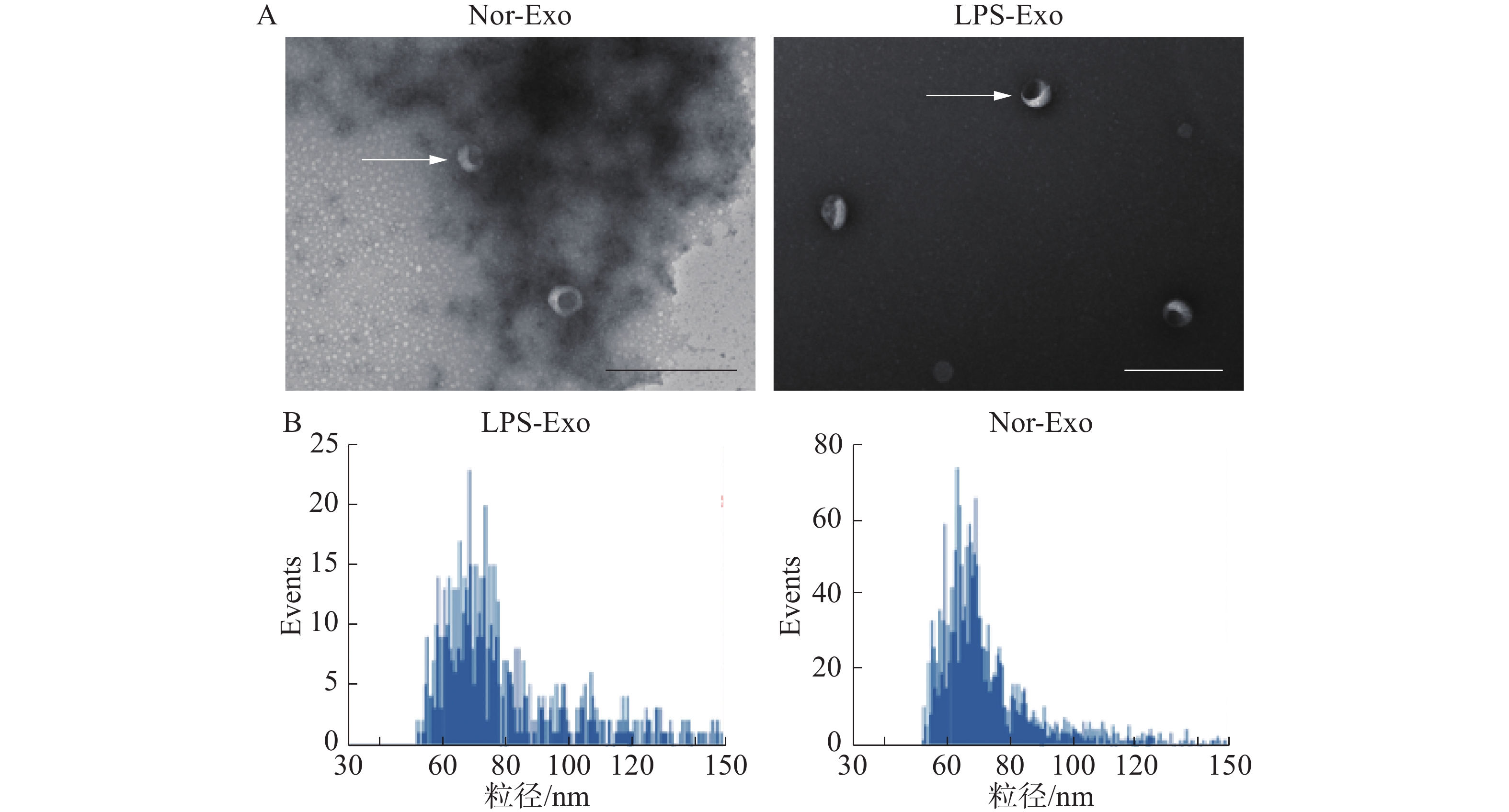
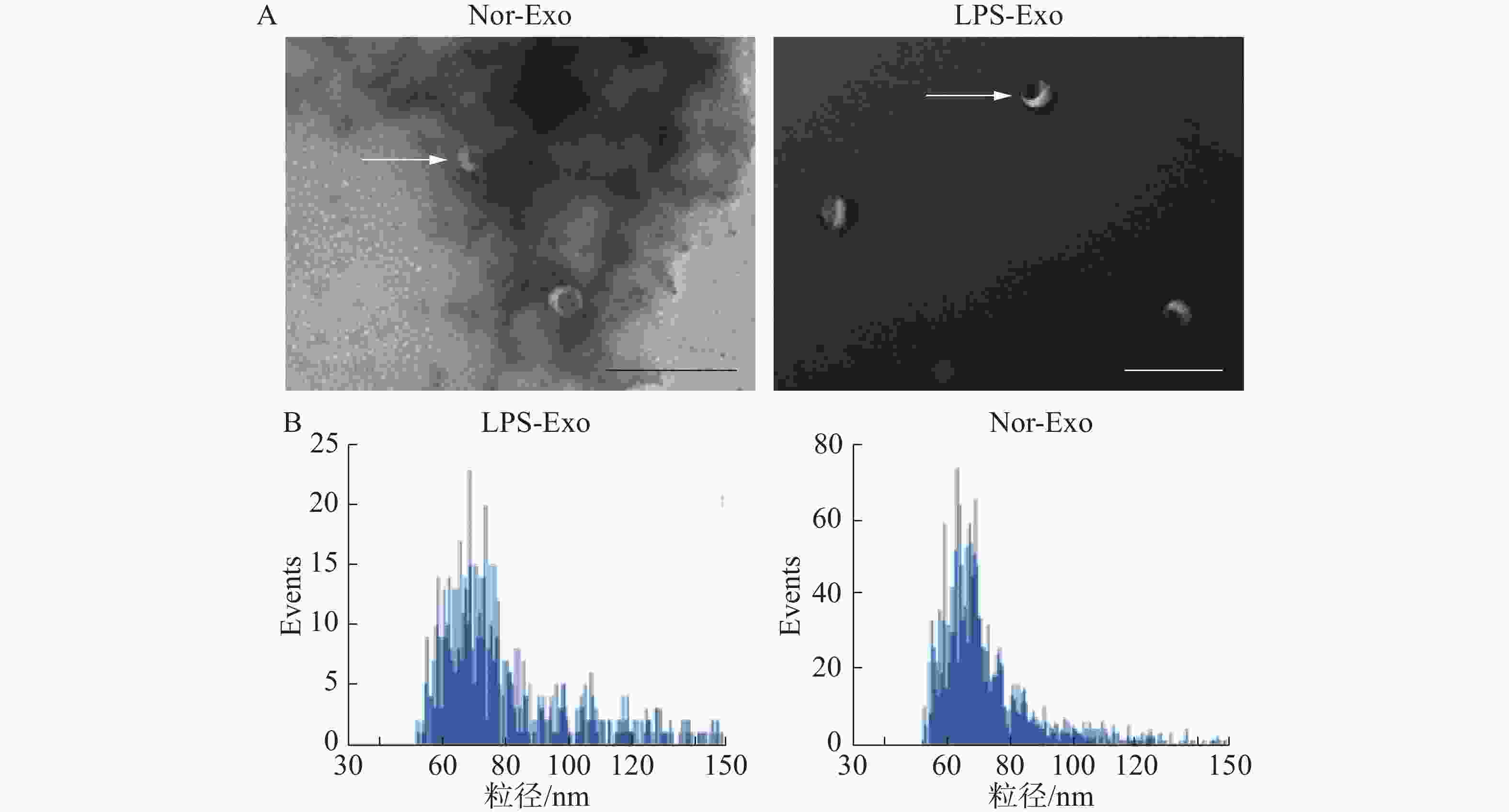
将已经制备好的脂多糖组(LPS-Exo)以及对照组(Nor-Exo)外体样本,用于透射电镜以及粒径分析。通过透射电镜观察外体形态、粒径大小(图2)。在透射电镜中观察到2组样本的形态(图中白色箭头所指)均为一侧凹陷的半球型(图2-A)。此外,通过粒径分析(图2-B),样本中的颗粒均符合外体粒径范围(30~150 nm)(图2-B)。综上所述,2组样本的外体的形态与粒径大小均符合外体的描述,由此可以证明通过超速离心法分离得到了外体。
-
脂多糖残留的检测根据试剂盒说明书进行操作,随后用酶标仪测定各孔在450 nm波长的OD值。依据OD值绘制标准曲线,根据标准曲线计算出Nor-Exo组、LPS-Exo组外体经过洗涤后PBS上清中的脂多糖残留量。经过1次洗涤后,若洗涤外体的PBS中无脂多糖残留,则可以证明提取到的外体中无脂多糖残留。结果显示,Nor-Exo组上清中脂多糖含量为0.011 8 EU·mL−1,LPS-Exo组上清中脂多糖含量为0.012 8 EU·mL−1(EU为内毒素单位),2组外体中脂多糖含量相近。由于Nor-Exo组在实验过程中并未加入脂多糖,且2组脂多糖残留浓度无明显差异,通过对比2组外体洗涤后PBS上清中LPS含量可知LPS-Exo组的LPS含量属于正常范围。能够激活免疫细胞的LPS最小剂量为0.2 EU·mL−1,而本试验中检测到的脂多糖残留量不足以刺激细胞使其生理状态发生改变。综上所述,LPS-Exo组中所添加的脂多糖已基本去除,且其残留量对后续试验结果没有影响。
-
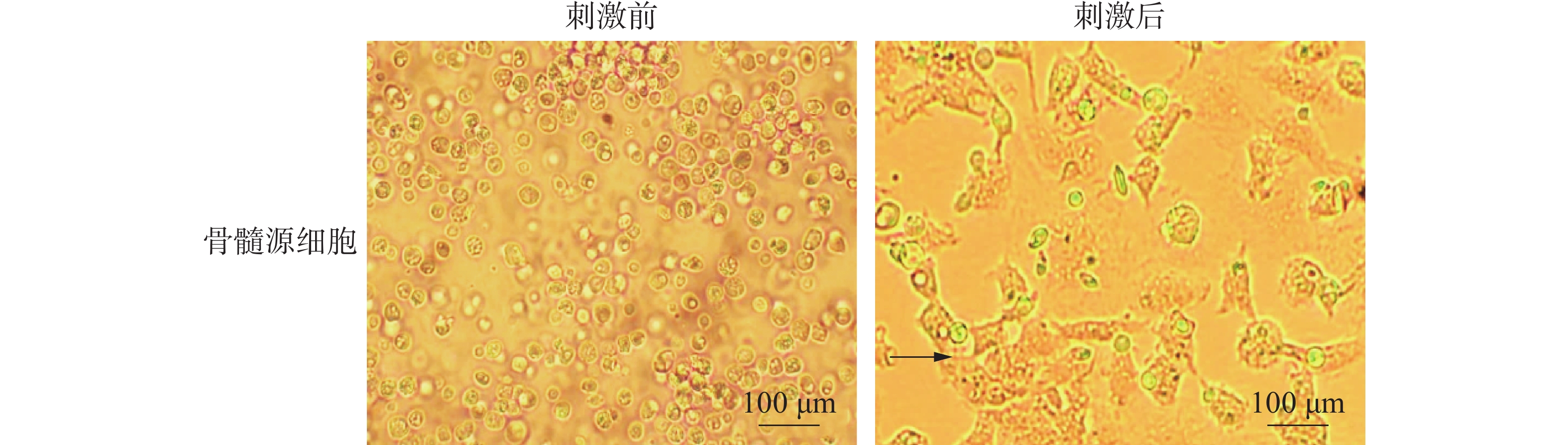
提取文昌鸡骨髓源细胞,并且加入细胞因子(GM-CSF、IL-4)刺激诱导其分化,悬浮的骨髓源细胞经过刺激7 d后出现贴壁的情况,有明显的细胞集落形成(图3中黑色箭头所指)。
-
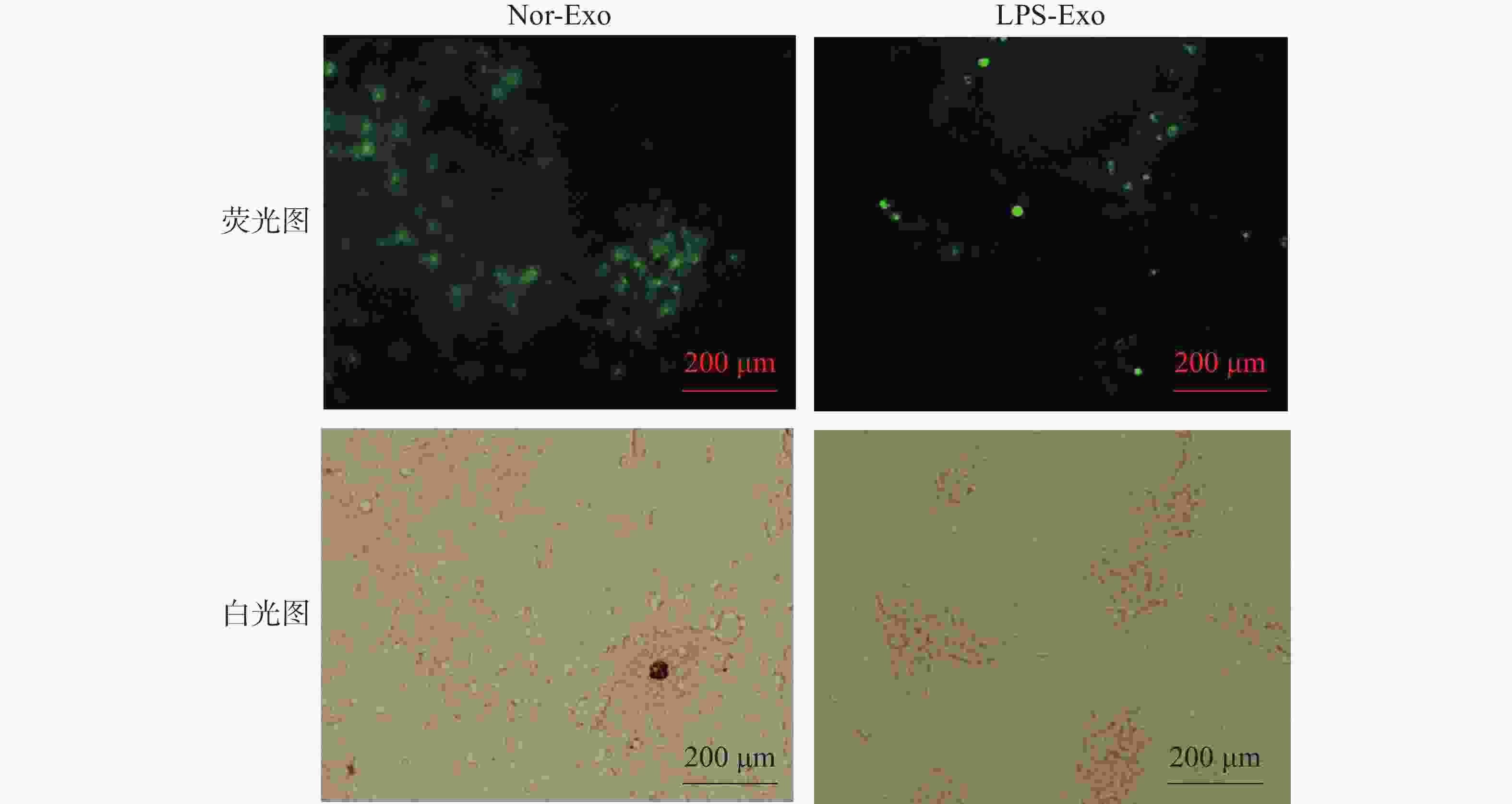
PKH67是一种膜染料,可对细胞膜进行染色,使被染色的膜结构带有绿色荧光。外体经PKH67染色后,再次通过超速离心法去除游离的染料分子,将制备好的外体经PKH67染色后按照50 ng·mL−1的终浓度刺激树突状细胞。通过荧光显微镜观察树突状细胞对这两种外体的摄取情况(图4)。存在树突状细胞的位置,在荧光视野下可以检测到由PKH67标记外体的绿色荧光信号,由此可以证明2组外体均被树突状细胞摄取,并且,LPS-Exo刺激的树突状细胞伪足形成明显强于Nor-exo处理组,说明LPS-Exo处理的树突状细胞活化水平较高。
-
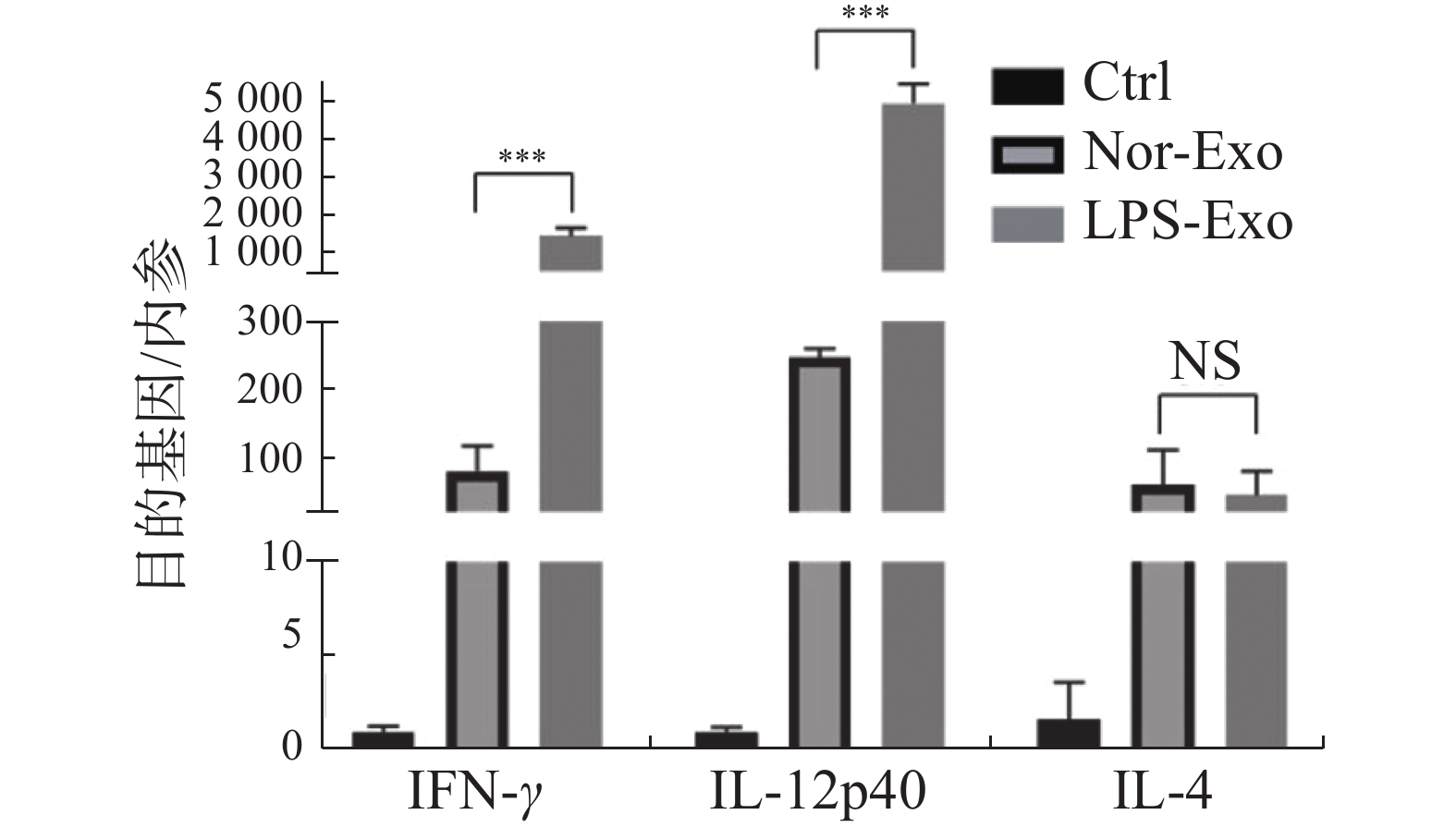
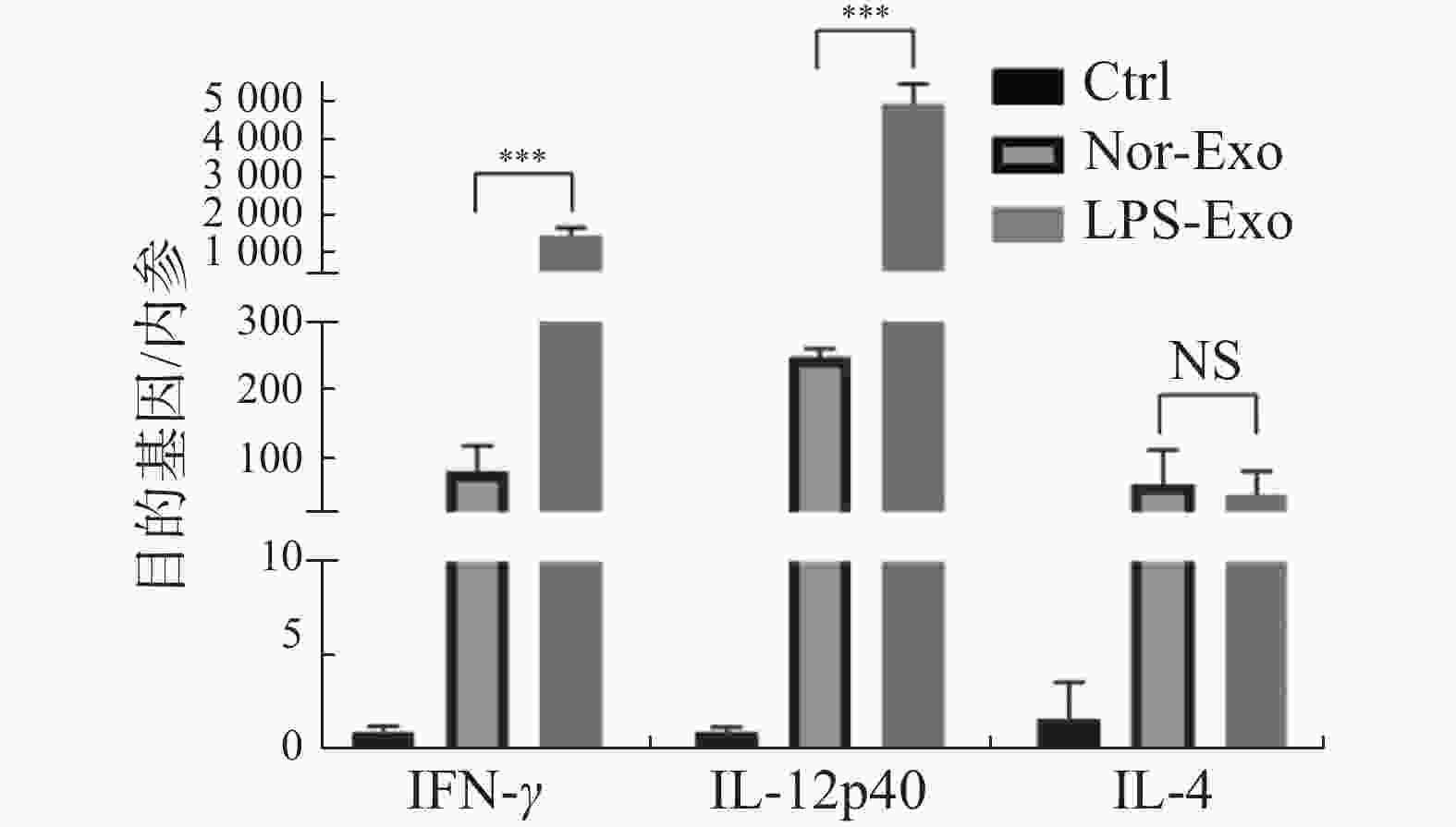
通过荧光定量PCR检测树突状细胞活化后产生诱导辅助型T淋巴细胞分型的相关细胞因子IFN-γ、IL-12p40和IL-4的表达水平(图5)。与Nor-Exo组对比,经LPS-Exo刺激后,活化的树突状细胞产生诱导辅助型T细胞向Th1型分化的细胞因子IFN-γ、IL-12p40表达量均上调,而Th2型细胞因子IL-4的表达量无明显差异。该结果表明,LPS诱导鸡巨噬细胞的外体可体外诱导文昌鸡树突状细胞活化产生分泌Th1型细胞因子,促进细胞免疫应答。
-
本研究通过体外实验探究LPS刺激的鸡巨噬细胞的外体对文昌鸡骨髓树突状细胞活化的影响,结果表明,LPS刺激鸡巨噬细胞产生的外体可被文昌鸡树突状细胞摄取并诱导树突状细胞活化,同时分泌大量的Th1型细胞因子以促进细胞免疫应答。本研究结果为开发脂多糖刺激巨噬细胞源外体(作为一种新型疫苗佐剂)用于文昌鸡的疫病防控提供了理论基础。
鸡的树突状细胞与哺乳动物类似,也具有主导辅助型T细胞向Th1型和Th2型分化的功能[12]。其中,Th1型细胞促进炎症反应以及活化巨噬细胞、NK细胞和细胞毒性T淋巴细胞,产生针对内源性抗原如病毒、胞内寄生菌和原虫感染的免疫应答。Th2型细胞主要介导针对外源性抗原如胞外寄生虫、细菌、过敏原和毒素的体液免疫应答,产生大量抗体以及抗体介导的免疫反应的活化。Th2型细胞在一定程度上抑制Th1型细胞的功能,以维持一定的炎症以及细胞损伤稳态。IFN-γ、IL-12p40均为Th1型细胞因子,可诱导T细胞向Th1型活化;而IL-4为Th2型细胞因子,可诱导T细胞向Th2型活化;其中IL-12p40可诱导自然杀伤细胞的增殖以及IFN-γ的产生,增强CD8+T细胞的作用[13];IFN-γ可增强MHC-Ⅱ类分子的作用,可拮抗IL-4,抑制Th2增殖[14];IL-4可以下调IL-12的水平而抑制Th1型分化[15]。
有学者利用鸡重组GM-CSF、IL-4细胞因子实现了鸡骨髓源树突状细胞的体外构建,并用LPS诱导该类树突状细胞活化后检测到IFN-γ、IL-12p40等Th1型细胞因子的表达上调以及Th2型细胞因子IL-4的下调表达,并通过淋巴细胞混合实验证实经LPS激活的树突状细胞具有提高T淋巴细胞增殖能力的功能 [16]。与上述研究结果相似,本研究通过荧光定量PCR分析mRNA水平的数据显示,与未加入外体刺激的树突状细胞相比,外体作用条件下,无论Nor-Exo或LPS-Exo均能诱导树突状细胞Th1型细胞因子IFN-γ、IL-12p40的表达增多,而IL-4表达量无明显差异。Nor-Exo对树突状细胞的活化作用可能由于其本身来源于非文昌鸡细胞,因此某些差异蛋白可能作为抗原被文昌鸡骨髓源树突状细胞识别而活化并发生抗原呈递反应。但LPS-Exo刺激树突状细胞活化产生的细胞因子水平要显著高于Nor-Exo,这也与本研究在光镜下观察到LPS-Exo诱导的树突状细胞伪足形成较多的结果相符。由于已排除残留LPS的干扰,因此,本研究表明LPS诱导鸡巨噬细胞源外体与LPS有相同的作用,可体外诱导文昌鸡树突状细胞活化并促进下游Th1免疫应答。由于LPS具有一定的毒性,使其作为佐剂使用受到限制。而外体的生物相容性好,所以LPS-Exo有望成为有效替代LPS的新型佐剂。
已有研究表明,被病原体感染的巨噬细胞会释放更多的外体,而携带MHC-Ⅰ、MHC-Ⅱ复合物等分子的这些巨噬细胞源外体特别是在存在树突状细胞的情况下,可以刺激T细胞使其活化[2,17-18]。另一方面,有学者对LPS诱导小鼠巨噬细胞RAW264.7的外体进行了蛋白组学的分析,结果显示其中含有大量促炎因子,并且该外体参与了多种炎症信号通路的激活[19]。据此,LPS刺激的鸡巨噬细胞源外体也可能由其携带的促炎因子或膜表面免疫复合物介导的树突状细胞活化,诱导产生Th1型细胞因子以促进清除病原感染细胞的免疫应答反应。后续需进一步探究鸡巨噬细胞源外体在免疫应答反应中参与的分子事件以及相关机制。
综上所述,脂多糖刺激鸡巨噬细胞释放的外体可被文昌鸡树突状细胞摄取,并且可以诱导文昌鸡树突状细胞活化,该外体具有作为免疫佐剂的潜在功能,有着良好的应用前景。
Exosomes derived from lipopolysaccharide-activated macrophage cell line HD 11 cell induce the activation of dendritic cells from Wenchang chicken in vitro
doi: 10.15886/j.cnki.rdswxb.2023.04.011
- Received Date: 2022-02-25
- Accepted Date: 2022-05-16
- Rev Recd Date: 2022-05-10
- Available Online: 2022-09-06
- Publish Date: 2023-07-25
-
Key words:
- exosome /
- macrophage /
- dendritic cell /
- Wenchang chicken /
- lipopolysaccharide
Abstract: It has been demonstrated that exosomes derived from macrophages can be used as adjuvants to enhance cellular immune response. An attempt was made to explore whether exosomes derived from lipopolysaccharide-activated chicken macrophages could be used as immune adjuvants for the potential prevention and control of epidemic diseases in Wenchang chicken. The exosomes were extracted by ultracentrifugation and identified by transmission electron microscopy and particle size analysis. Subsequently, the exosomes were labeled with PKH67 dye and co-incubated with bone marrow-derived dendritic cells from Wenchang chicken. The uptake and activation of the exosomes by the dendritic cells were observed under a fluorescence microscope. The results showed that the exosomes derived from chicken macrophage HD 11 cells stimulated with lipopolysaccharides were ingested by amphioxus-derived dendritic cells and promoted the activation of dendritic cells.
| Citation: | XING Niwen, XIE Yan, QIN Yao. Exosomes derived from lipopolysaccharide-activated macrophage cell line HD 11 cell induce the activation of dendritic cells from Wenchang chicken in vitro[J]. Journal of Tropical Biology, 2023, 14(4): 433-440. doi: 10.15886/j.cnki.rdswxb.2023.04.011 |








 DownLoad:
DownLoad: