-
丛枝菌根真菌(Arbuscular mycorrhizal fungi,AMF)是一类共生微生物,广泛存在自然界中,能够与大多数的陆生植物形成菌根共生体[1],因其在植物根系中产生丛枝结构而得名,故称其为AMF[2]。AMF需要植物供应光合产物来生长,同时AMF通过参与植物生理代谢,扩大植物根系的吸收面积,促进植物生长,与植物形成互惠共生关系[3]。因此,AMF对作物生长和生态环境有重要影响[4-5]。有研究表明,AMF通过与植物根系形成共生体,改善植物对氮磷钾等矿质营养的吸收,提高作物产量以及增强作物的抗逆性[6-9],且AMF与宿主植物是专性营养共生关系[10]。同一种植物接种不同的AMF,它们的共生效应不同[11-13]。当AMF侵染宿主植物后,宿主植物的根尖表皮加厚,细胞层数增加,更加有利于植物根系的生长、分枝以及形态结构的改变,扩大植物的吸收面积,从而促进植物对矿质养分的吸收和利用,进而促进植物生长[14-15]。
甜玉米(Zea mays var. rugose Bonaf.)又被称为水果玉米、蔬菜玉米,是我国重要的特种经济作物[16]。甜玉米的营养丰富,口感甜、鲜、脆、嫩,深受人们喜爱[17]。磷是植物体内核酸、蛋白质、多种酶的主要成分[18],玉米对磷的反应比较敏感,因此,磷的水平对玉米产量有很大的影响[19]。海南属热带地区,土壤缺磷现象严重[20],这严重制约了农业的发展。氮素是作物生长发育所必需的大量营养元素之一,是作物生长发育和作物产量最重要的限制因素[21]。有研究表明,接种AMF能显著提高植物对氮磷养分的吸收利用[22]。如接种摩西斗管囊霉(Funneliformis mosseae)、球状巨孢囊霉(Gigaspora margarita)、细凹无梗囊霉(Acaulospora scrobiculata)、扭形伞房球囊霉(Corymbiglomus tortuosum)、地表多样孢囊霉(Diversispora epigaea)和根内根孢囊霉(Rhizophagus intraradices)能显著提高大豆的地上部生物量和氮磷积累量[23]。目前,关于AMF与玉米共生关系研究主要集中在摩西球囊霉(Glomus mosseae)上,而其他菌种对玉米生长影响的研究较少,而甜玉米尚未见这方面的报道。因此,本研究选取6种不同AMF菌种接种甜玉米,分析不同菌种对甜玉米吸收氮磷效率及生长的影响,旨在筛选出促进甜玉米生长的AMF高效菌株。
-
供试菌种为摩西斗管囊霉(Funneliformis mosseae, Fm)、球状巨孢囊霉(Gigaspora margarita, Gm)、细凹无梗囊霉(Acaulospora scrobiculata, As)、扭形伞房球囊霉(Corymbiglomus tortuosum, Ct)、地表多样孢囊霉(Diversispora epigaea, De)和根内根孢囊霉(Rhizophagus intraradices, Ri),共6种,菌源由中国农业科学院所提供,从农田土壤中筛选出。供试甜玉米(Zea mays var. rugose Bonaf.)的品种为‘广良甜27号’,由广东省良种引进服务公司提供。基质的配方为V蛭石∶V草炭∶V河砂= 4∶1∶1。
-
盆栽试验于2021年12月6日到2022年2月23日在海南大学儋州校区(19°52'11″N,109°58′11″E)进行。每盆装3 kg灭菌后的基质,花盆的规格为:顶部直径20.9 cm、底部直径18 cm、深14 cm。采用完全随机设计,设置6个菌种处理,分别为Fm、Gm、As、Ct、De和Ri,每处理接种20 g的菌沙(孢子数34.0个·g−1),3次重复,每盆种植1株甜玉米,共18盆。播种甜玉米后30 d内,甜玉米植株处于幼苗期时,每周浇1次50%的Hoagland’s营养液,成苗后,每周浇1次100% Hoagland’s营养液。根据天气情况调整浇水量。
-
播种11周后,用卷尺测量植株株高,用直尺测量根长,用游标卡尺测量茎粗(地上部5 cm位置);以及测量地上部鲜质量,然后将地上部甜玉米植株于105 ℃杀青30 min,65 ℃烘干至恒重测定其地上部生物量。样品称重后粉碎,用于测定甜玉米地上部的全磷和全氮含量,采用硫酸消煮−水杨酸钠法测定全氮,硫酸消煮-钼锑抗法测定全磷,全氮和全磷的测定均采用全自动间断化学分析仪(DeChem-Tech, Hamburg, Germany)。
-
采用Microsoft Excel 2016进行数据处理,通过DPS 9.01统计软件进行数据统计和方差分析,不同处理间差异显著性采用LSD法进行多重比较,利用Origin pro 2021软件作图。
-
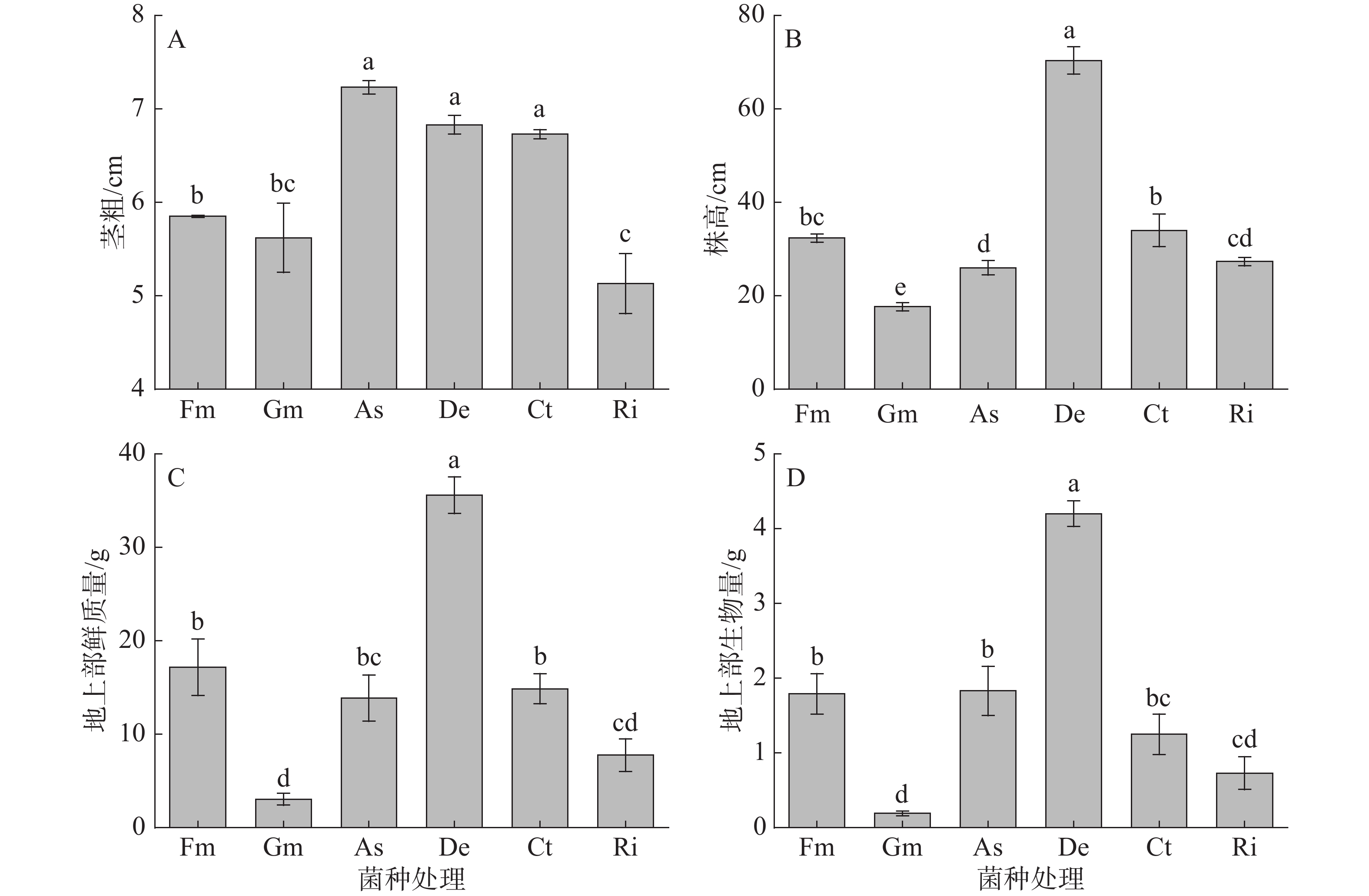
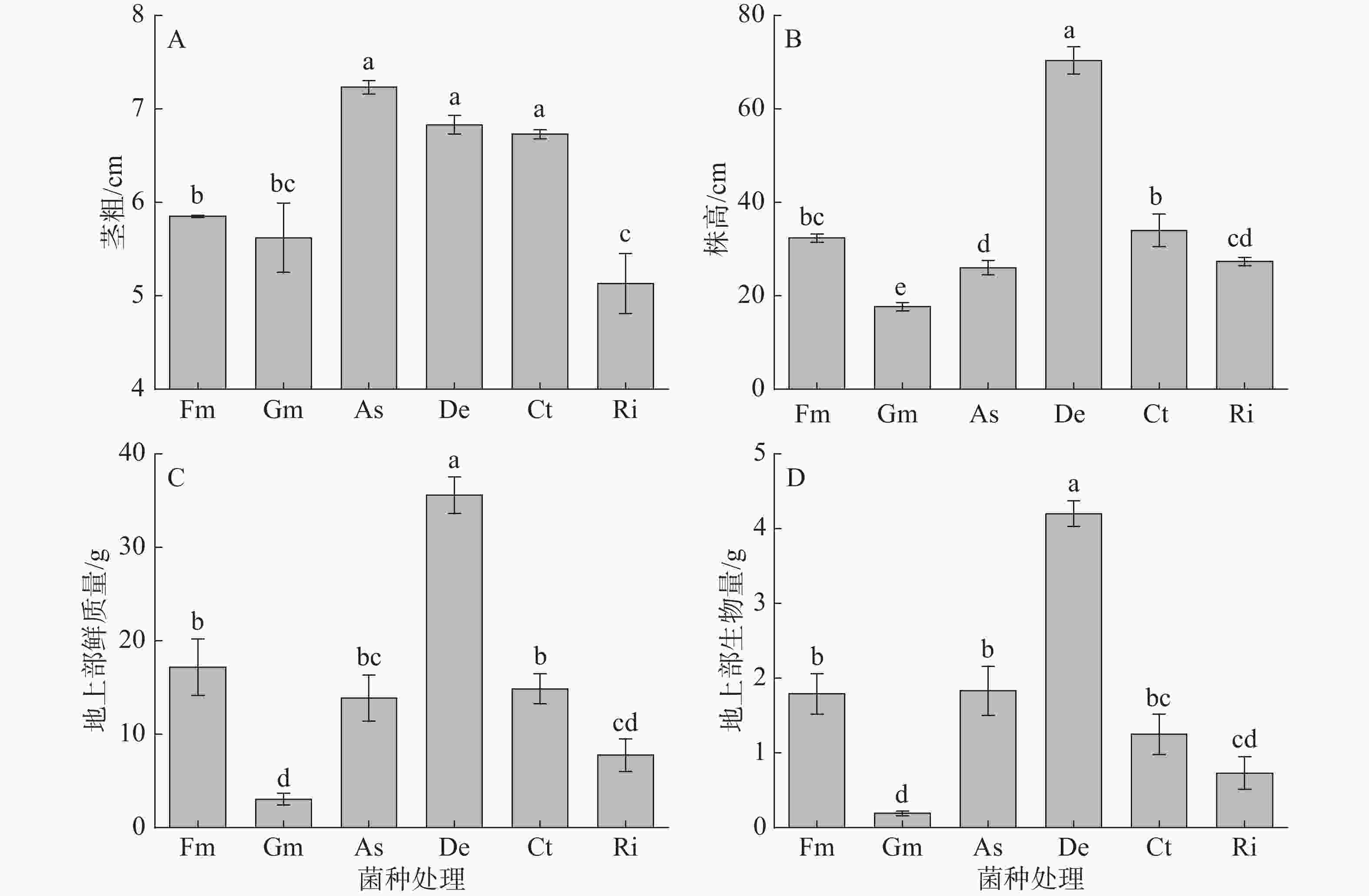
由图1可知,接种不同AMF菌种对甜玉米茎粗、株高、地上部鲜质量和生物量有极显著影响(P<0.001)。接种As、De和Ct处理的茎粗显著高于接种Fm、Gm和Ri处理,接种As、De和Ct处理间无显著差异;其中,接种As处理的茎粗较高,较接种Fm、Gm和Ri处理分别显著提高了23.6%、28.6%和40.8%;接种Fm处理的茎粗较接种Ri处理分别显著提高了14.0%(图1-A)。接种De处理的株高最高,较接种Fm、Gm、As、Ct和Ri处理分别显著提高了117.5%、298.1%、170.5%、106.9%和157.3%;接种Fm、As、Ct和Ri处理的株高较接种Gm处理分别显著提高了83.0%、47.2%、92.5%和54.7%(图1-B)。接种De处理的甜玉米植株地上部鲜质量最高,较接种Fm、Gm、As、Ct和Ri处理分别显著高了107.2%、1 066.7%、156.5%、139.2%和358.0%(图1-C)。接种De处理的甜玉米地上部生物量最高,较接种Fm、Gm、As、Ct和Ri处理分别显著高了134.8%、2151.8%、129.7%、235.4%和473.2%;接种Fm和As处理显著高于接种Gm和Ri处理的甜玉米地上部生物量(图1-D)。可见,从甜玉米生长量情况来看,与其他菌种相比,接种De菌种的甜玉米地上部生物量表现较好。
-
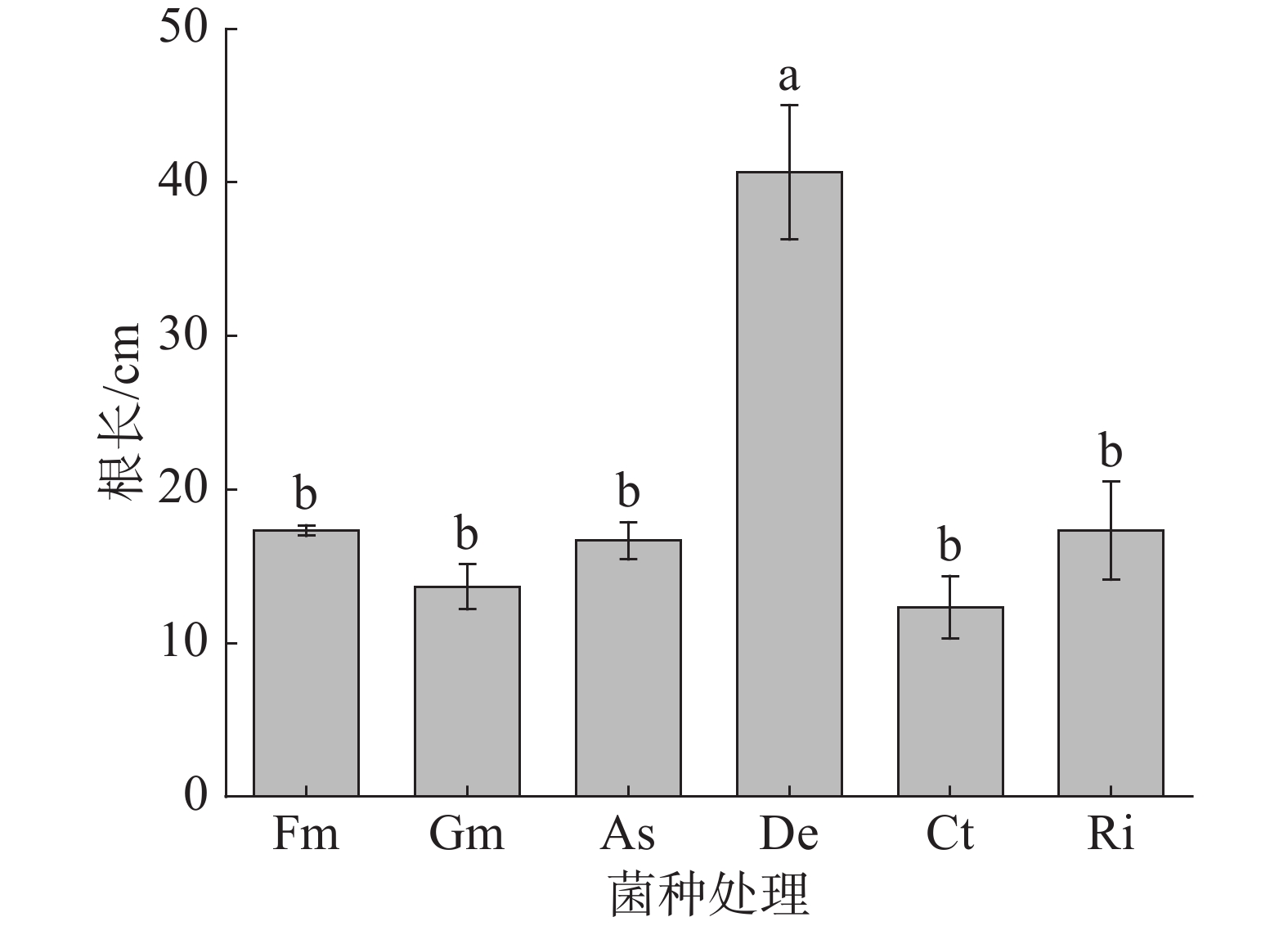
由图2可知,接种De菌种的甜玉米根长显著高于其他菌种,与Fm、Gm、As、Ct和Ri相比,接种De菌种的甜玉米根长分别显著增加了134.6%、197.6%、144.0%、229.7%和134.6%。
-
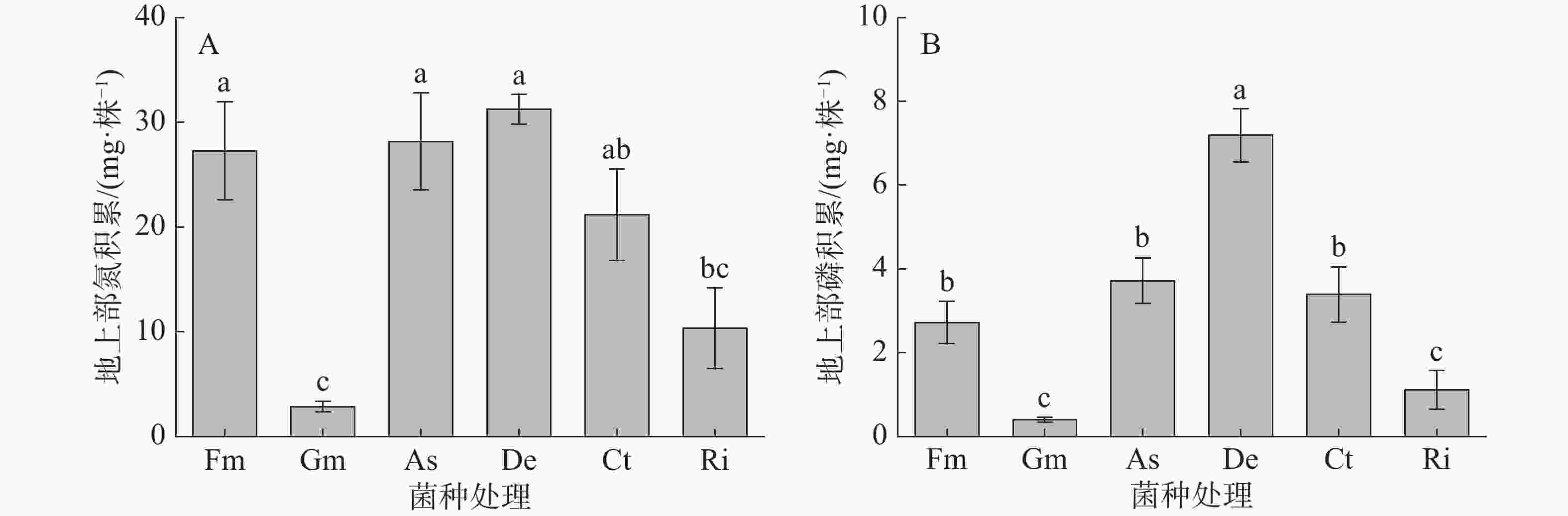
从图3可知,接种不同AMF菌种对甜玉米地上部氮磷养分吸收有极显著影响(P<0.01)。在不同AMF接种处理下,接种De处理的甜玉米地上部氮积累量最高,较接种Gm和Ri处理分别显著高了999.9%和202.4%,与接种Fm、As和Ct处理无显著差异(图3-A)。接种De处理的甜玉米地上部磷积累量最高,较接种Fm、Gm、As、Ct和Ri处理分别显著高了164.3%、1700.7%、93.1%、111.9%和548.0%(图3-B)。
-
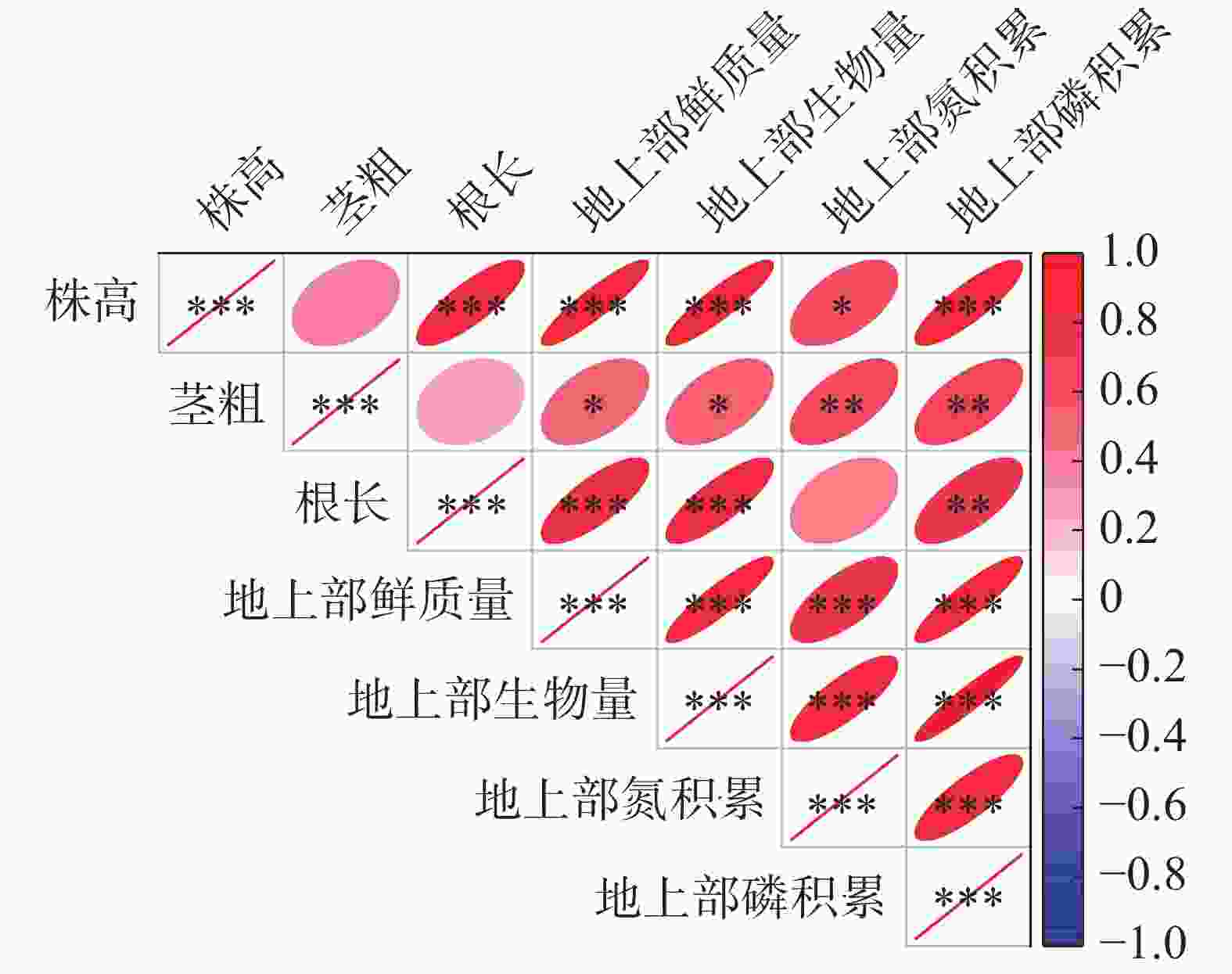
为了探索甜玉米大田试验中各项指标间的潜在关系,采用Person分析方法进行相关性分析。从图4可知,甜玉米株高与根长、地上部鲜质量、地上部生物量及氮磷积累量呈显著或极显著正相关。茎粗与甜玉米地上部鲜质量、地上部生物量及氮磷积累量呈显著或极显著正相关。甜玉米根长与地上部鲜质量、地上部生物量及磷积累量呈极显著正相关。甜玉米地上部鲜质量与地上部生物量及氮磷积累量间呈极显著正相关。
-
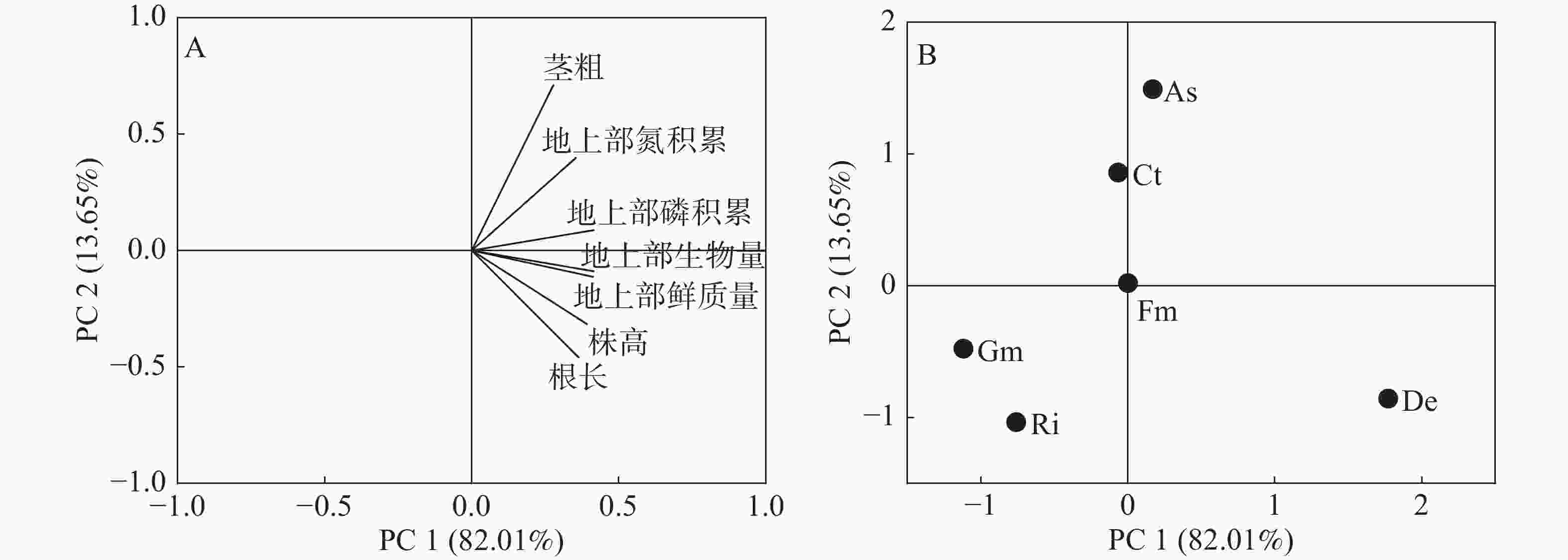
进行主成分分析后,第一主成分占比82.01%,第二主成分占比13.65%,前2个主成分占比95.66%,大于90%。因此,选取前2个主成分构建2维PCA图。第一主成分主要反映甜玉米茎粗、地上部氮磷积累量、地上部生物量、地上部鲜质量、株高及根长,这说明第一主成分基本反映了甜玉米生长和地上部氮磷积累量的情况;第二主成分主要反映甜玉米茎粗和地上部氮积累量(图5-A)。
De菌种和As菌种在PC 1上为正值,表明这2个处理在第一主成分上各种指标均有较好的表现;As菌种和Ct菌种在PC 2上为正值,表明这2个处理在第二主成分上各项指标也均有较好的表现(图5-B)。综上,De菌种和As菌种均位于第一主成分的正值上,De菌种在第一主成分的正值远大于As菌种且第一主成分占比远大于第二主成分,说明De菌种综合表现最好,甜玉米接种De菌种更有利于甜玉米的生长和地上部氮磷养分积累,其次是接种As菌种。
-
氮磷元素是植物生长发育必需的大量营养元素之一,是构成植物体内重要化合物的重要组成成分[24]。有研究认为,AMF与宿主植物形成共生体,能够促进宿主植物根系对营养元素的吸收[25-26],从而改善宿主植物的生长。本研究表明,接种De处理的甜玉米地上部磷积累量最高,较接种Fm、Gm、As、Ct和Ri处理分别显著高了164.3%、1700.7%、93.1%、111.9%和548.0%。这可能是由于De菌种与甜玉米宿主植物形成共生体,从而扩大了甜玉米根系有效吸收磷养分空间的作用,增加了甜玉米对磷养分的吸收面积,进而促进甜玉米对磷养分的吸收,使甜玉米地上部磷积累量能达到较高水平。本研究表明,接种De处理的甜玉米地上部氮积累量最高,较接种Gm和Ri处理分别显著高了999.9%和202.4%,与接种Fm、As和Ct处理无显著差异。可见,De、Fm、As和Ct菌种接种甜玉米,甜玉米地上部氮积累量能达到较高水平。综上,接种De菌种,甜玉米地上部氮磷营养达到较高水平,可能是因为AMF侵染甜玉米根系,从而扩大甜玉米根系对氮磷养分的吸收面积,起到较好的吸收作用,促进了甜玉米植株对氮磷的吸收,进而改善植株氮磷营养状况。
生育期内生物量的积累量是作物产量形成的关键[27]。有研究表明,接种AMF能显著提高植物的生物量[23, 28]。AMF能通过提高宿主植物根系对氮磷养分的吸收,进而提高植株的生物量[29]。本研究发现,接种De处理的甜玉米株高、根长、鲜质量和地上部生物量最高,并显著高于其他接种处理。与前人研究结果类同[30],但前人研究结果只是说明了接种AMF能够促进玉米的生长,提高玉米植株地上部生物量,而对株高、根长及地上部鲜质量没有进行深入的研究。可见甜玉米接种De菌种,甜玉米能达到较高水平的地上部生物量。甜玉米株高与根长、鲜质量、地上部生物量及氮磷积累量呈显著或极显著正相关。甜玉米根长与鲜质量、地上部生物量及磷积累量呈极显著正相关。甜玉米鲜质量与地上部生物量及氮磷积累量间呈极显著正相关。这说明甜玉米植株地上部氮磷营养的改善可能是AMF侵染促进甜玉米植株生长的主要机制之一。本研究主成分分析结果表明,甜玉米接种De菌种综合得分最高,说明甜玉米接种De菌种更利于甜玉米生长和地上部氮磷养分积累。
综上所述,接种不同AMF对甜玉米根系的菌根侵染率和生长的影响存在一定的差异。其中,接种De菌种,甜玉米根长、株高、鲜质量、地上部生物量及磷积累量显著高于其他菌种,且甜玉米茎粗和地上部氮积累量也达到较高的水平。因此推荐甜玉米接种De菌种,以促进甜玉米生长和氮磷养分积累。
Effects of different arbuscular mycorrhizal fungi on the growth and the nitrogen and phosphorus absorption of sweet corn seedlings
doi: 10.15886/j.cnki.rdswxb.2023.02.005
- Received Date: 2022-04-19
- Accepted Date: 2022-09-21
- Rev Recd Date: 2022-09-19
- Available Online: 2022-09-28
- Publish Date: 2023-03-25
-
Key words:
- arbuscular mycorrhizal fungi /
- sweet corn /
- biomass /
- nitrogen and phosphorus uptake
Abstract: A microcosm experiment was conducted to study the effects of different arbuscular mycorrhizal fungi (AMF) on the growth and the nitrogen and phosphorus absorption of sweet corn seedlings to provide reference for the development of AMF. Sweet corn seedlings (Zea mays var. rugose Bonaf) were inoculated with 6 AMF species, Funneliformis mosseae (Fm), Gigaspora margarita (Gm), Acaulospora scrobiculata (As), Corymbiglomus tortuosum (Ct), Diversispora epigaea (De) and Rhizophagus intraradices (Ri), and their growth and uptake of nitrogen and phosphorus were observed. The results showed that the plant height, root length, aboveground fresh quality, aboveground biomass and phosphorus accumulation of sweet corn seedlings inoculated with De were the highest and significantly higher than those of other treatments, and that the stem diameter and aboveground nitrogen accumulation of sweet corn seedlings inoculated with De also reached a higher level. The principal component analysis showed that the comprehensive performance of sweet corn seedlings inoculated with De was the best. Therefore, when sweet corn is planted in the field, it is recommended to inoculate sweet corn with De, which is more conducive to the growth of sweet corn and the accumulation of nitrogen and phosphorus nutrients in sweet corn.
| Citation: | WU Xiaojun, LI Zhengfei, GUO Peipei, ZHANG Li. Effects of different arbuscular mycorrhizal fungi on the growth and the nitrogen and phosphorus absorption of sweet corn seedlings[J]. Journal of Tropical Biology, 2023, 14(2): 167-172. doi: 10.15886/j.cnki.rdswxb.2023.02.005 |







 DownLoad:
DownLoad: