-
辣椒(Capsicum annuum L.)原产于中南美洲热带雨林地区的墨西哥、秘鲁等地,是茄科辣椒属一年或多年生草本植物,辣椒亦称番椒、茄椒或海椒。培育辣椒壮苗是实现辣椒优质高产高效栽培的前提条件,直接关系到菜农的经济收入,对辣椒种植具有重要意义[1]。然而,冬季低温弱光,夏季高温高湿,很容易造成幼苗徒长,主要表现为茎细弱、节间长、根系不发达、抗逆性差等[2],使辣椒幼苗的商品性大大降低,同时也影响辣椒幼苗移栽后的田间生长和辣椒产量。链霉菌属(Streptomyces)是放线菌中最大的一类成员,也是产抗生素最多的放线菌菌属[3]。大部分链霉菌对植物具有促进生长、增强营养吸收、提高抵御生物与非生物逆境等作用[4]。研究表明,链霉菌主要通过分泌植物生长调节剂如IAA、嗜铁素等发挥促进植物生长[5],在农业生产中具有重要应用价值[6]。链霉菌30702,从笔者所在的实验室热带药用植物粗框根际土壤中分离得到。接种链霉菌30702的拟南芥表现为根增长,根毛数目增多,叶片厚而发绿,植株生长茂盛[7]。壳寡糖(Chitosan oligosaccharide)一般是指2~10个氨基葡萄糖以β-1,4糖苷键连接组成的低分子量壳聚糖。壳寡糖具有低粘度、高水溶性、高生物相容性及可生物降解等性质,目前已被广泛应用于食品加工、农业生产、畜牧养殖等领域,是一种新型植物生长调节剂[8]。在植物遭遇逆境时低分子量的壳聚糖能发挥积极作用,提高净光合作用速率,抵抗渗透物质的合成,提高植物体抗氧化酶活性,增强清除自由基的能力,保护膜系统,增强植物体的自身抗性,促进植物生长[9]。链霉菌30702复合壳寡糖对辣椒幼苗生理指标影响的研究较少,笔者利用链霉菌30702和壳寡糖对辣椒种子进行浸种,用出苗率、株高、茎粗、叶面积、壮苗指数、根长等指标阐明其作用,旨在探讨其对辣椒幼苗生长发育的影响,为链霉菌和壳寡糖在辣椒绿色高效栽培上的研究和生产提供理论依据。
-
本试验使用的辣椒种子为“辣丰五十三号”(深圳市永利种业有限公司生产),链霉菌30702为笔者所在课题组提供,壳寡糖98%原粉(连云港福隆农业发展有限公司生产),其他实验试剂均为分析纯。
-
2020年11月,在海南省海口市海南大学海甸校区校内实践教学基地开始进行试验。使用50穴的育苗盘,共6个处理,每个处理3次重复,1个重复1个育苗盘,每个处理150株辣椒幼苗。试验设计为壳寡糖2水平(0、100 g·L−1);链霉菌浓度3水平(0、1.2×106 cfu·mL−1、1.2×107 cfu·mL−1),完全设计(表1)。土壤为自制营养土(V生土∶V有机肥∶V椰糠=1∶1∶1)。辣椒种子浸种10 h后播种,进行苗期试验。
处理 链霉菌30702/cfu·mL−1 壳寡糖/mg·L−1 CK 0 0 LM1 1.2×106 LM2 1.2×107 COS 0 100 LM1+COS 1.2×106 LM2+COS 1.2×107 -
播种后每天观察出苗的情况,直到出苗的数量不再变化,统计整齐度、出苗率。于播种第15 、25 、35 、45 天取样,每个处理取15株。使用直尺测量株高、茎粗、根长,计算叶面积;使用分析天平测质量;于120 ℃杀青30 min后,用烘箱在80 ℃条件下烘48 h后测量其干质量。计算壮苗指数、生长速率。
叶面积测定:在辣椒幼苗播种后的第35天,用直尺测量其叶长、叶宽[11],如公式2计算叶面积。
式中,N叶片、N叶宽为第N片叶的长和宽,N为叶片数,0.573 8为辣椒叶片叶面积计算公式的矫正系数。
壮苗指数计算:在出苗后的第35天,如公式(3)计算其壮苗指数[12]。
相对生长速率计算:在低温期(移栽后的25~35 d)计算各处理的株高、茎粗、根长、干质量的相对生长速率[13]。
式中,W1、W2为相隔一段时间的株高或茎粗等;t1、t2为相隔的一段时间。
-
低温期(移栽后的25~35 d),分别观测植株的萎蔫级数,计算萎焉指数[14]。萎蔫症状的分级标准如下:0正常;1 轻微冷害/干旱,萎蔫叶片不超过1/3;2 中等冷害/干旱,萎蔫叶片一半左右;3 严重冷害/干旱,叶片全部或近乎萎蔫。
-
于45 d取样,使用考马斯亮蓝染色法测定可溶性蛋白,使用蒽酮比色法测定可溶性糖[15]。叶绿素等的测量[16]乙醇浸泡0.1 g鲜叶48 h,以乙醇作为对照,分别在665、649和470 nm处测量其吸光度,叶绿素a(Ca)/(mg·L−1)=13.95A665−6.88A649,叶绿素b(Cb)/(mg·L−1)=24.96A649−7.32A665,类胡萝卜素(Cx)(mg·L−1)=(1 000A470−2.05叶绿素a−114.8叶绿素b)/245,含量/(mg·g−1)=计算值×乙醇体积/(鲜质量×1 000)。
-
数据分析使用Excel 2007和DPS 9.01,作图使用GraphPad Prism 8.0.2。
-
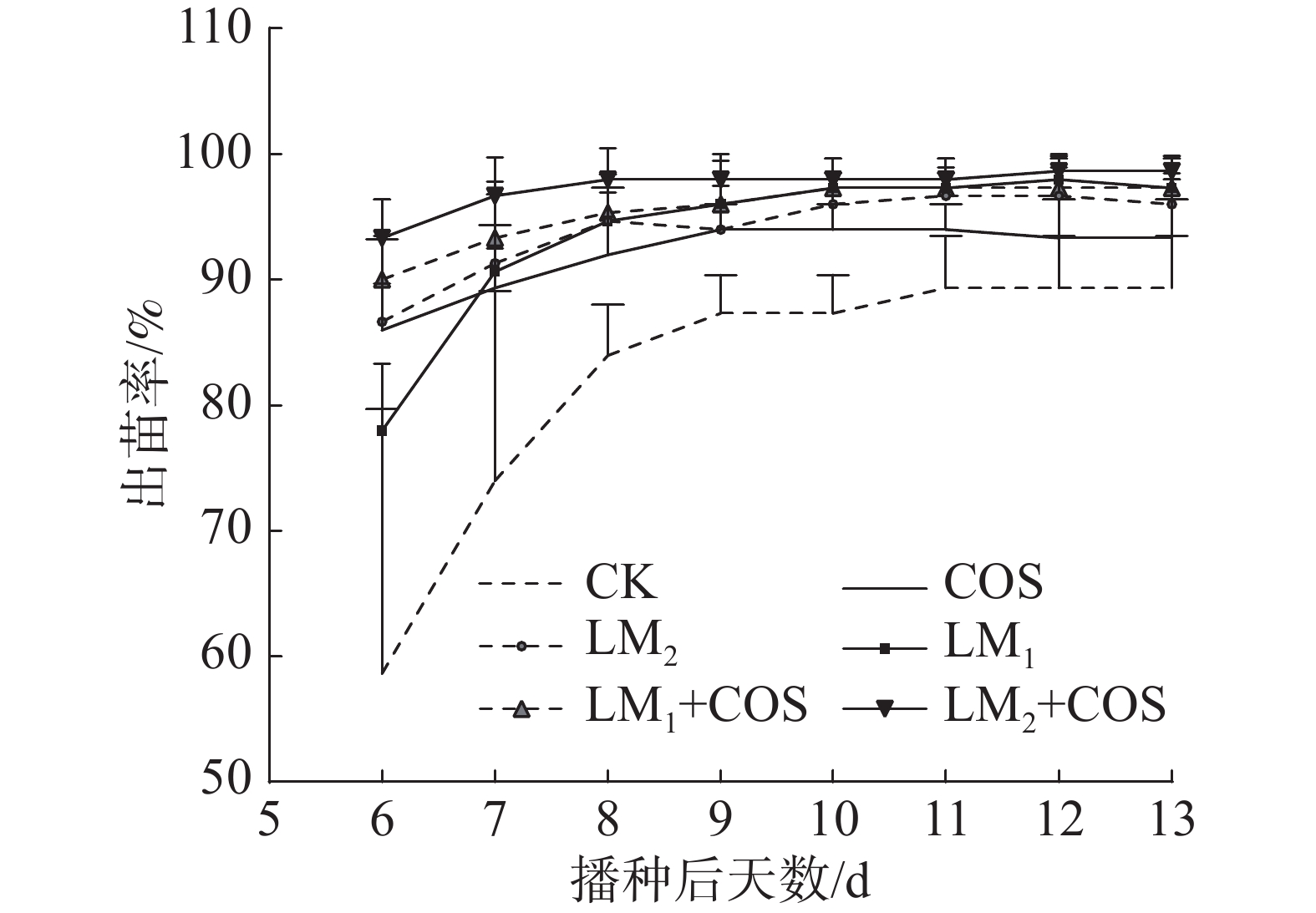
种子播种后的6~13 d内测量其出苗率,结果见图1。由图1可见,除COS和CK外,第6 天的出苗率达85%以上,出苗率最高处理是LM2+COS,在15 d达到了93.3%。结果表明,壳寡糖和链霉菌能够促进辣椒种子的出苗率。
-
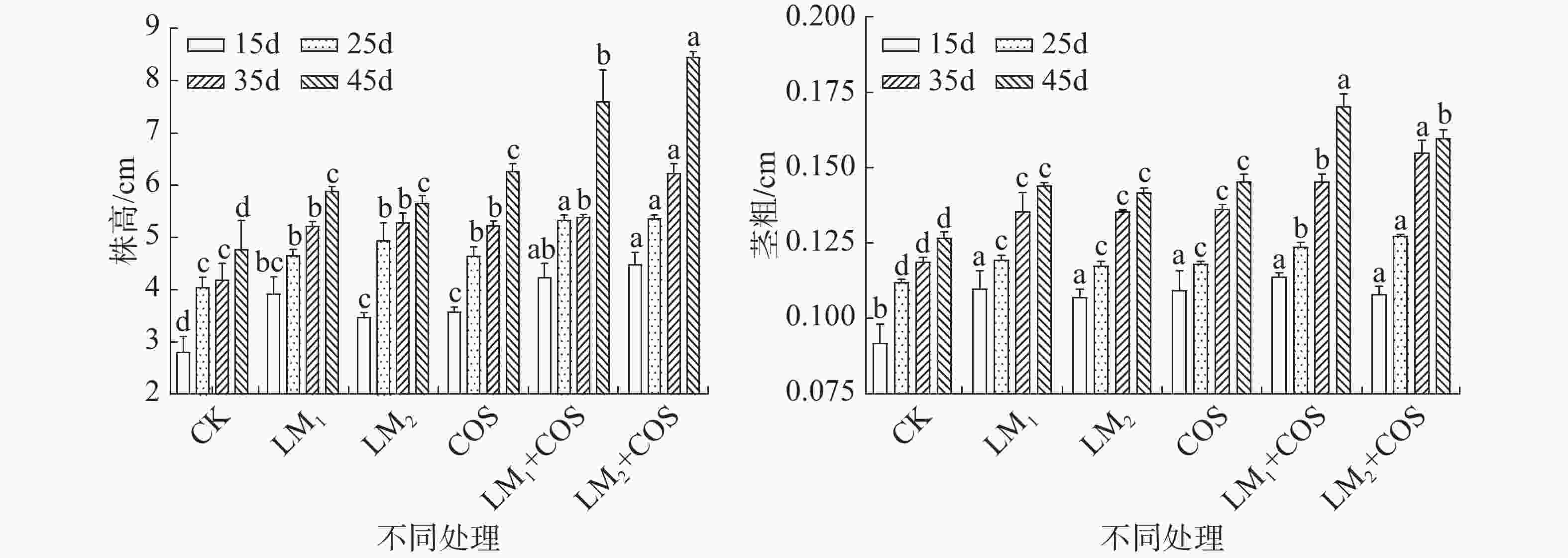
由图2可知,LM2+COS处理的茎粗显著高于CK。在25~35 d,经历了低温期,6个不同处理的株高的相对生长速率为0.36%、1.14%、0.69%、1.18%、0.12%、1.49%;茎粗的相对生长速率为0.58%、1.26%、1.43%、1.44%、1.61%、1.97%。LM2+COS处理的辣椒在处于低温期时,株高、茎粗较CK高出了1.13%和1.39%。说明在形态指标上表现出一定的抗冷害的效果。在45 d,LM2+COS处理的株高、茎粗、根长、叶面积显著高于CK处理。
由表2可知,根长中LM1+COS的数值最大为15.41 cm,LM2+COS显著高出CK 68.78%;叶面积中LM2+COS显著高于其他处理;不同处理的地下部干质量没有显著差异,地上部干质量是LM2+COS处理显著高于CK。
处理 根长/cm 叶面积/cm2 鲜质量/g 干质量/g CK 9.13±0.11d 2.25±0.11c 1.90±0.27c 0.22±0.03c LM1 9.79±0.63cd 2.16±0.07c 2.08±0.58bc 0.24±0.07bc LM2 10.13±0.77cd 2.39±0.14c 1.93±0.19c 0.23±0.02c COS 10.64±0.61c 2.43±0.24c 2.43±0.14abc 0.28±0.02abc LM1+COS 15.41±0.41a 3.27±0.08b 2.84±0.43ab 0.33±0.05ab LM2+COS 12.99±0.67b 3.59±0.27a 3.02±0.59a 0.35±0.06a -
如表3可知,在移栽后的35 d测量其叶绿素a、叶绿素b、类胡萝卜素、可溶性糖和可溶性蛋白。 在叶绿素a中除LM1外,其余4个处理的含量均显著CK,分别较CK高出了20.97%、30.64%、80.64%、90.32%;在叶绿素b中,只有LM1+COS、LM2+COS显著高于CK,分别较CK高出了100%、84.37%;在类胡萝卜素中,除LM1外,其余4个处理的含量均显著CK,分别较CK高出了100%、57.14%、114.28%和114.28%。在可溶性糖中,除CK外的5个处理均显著高于CK;在可溶性蛋白中,只有LM1、LM2、LM2+COS显著高于CK,分别较CK高出了30.53%、35.11%、30.53%。
不同处理 叶绿素a/
(mg·g−1)叶绿素b/
(mg·g−1)类胡萝卜素/
(mg·g−1)可溶性糖/
(mg·g−1)可溶性蛋白/
(mg·g−1)萎蔫率/% 壮苗指数/
(×10−2)CK 0.62±0.03c 0.32±0.04cd 0.07±0.02c 15.81±0.61d 1.31±0.02b 64.77±0.53b 7.79±0.79b LM1 0.60±0.02c 0.30±0.03d 0.07±0.01c 23.22±2.22c 1.71±0.04a 86.90±2.07a 9.42±3.29b LM2 0.75±0.03b 0.37±0.03c 0.14±0.02ab 23.02±0.41c 1.77±0.11a 8.38±0.54e 9.79±2.37b COS 0.81±0.05b 0.35±0.03cd 0.11±0.02b 24.74±0.34c 1.33±0.02b 22.06±0.35d 9.55±2.52b LM1+COS 1.12±0.04a 0.64±0.02a 0.15±0.03a 27.89±0.76b 1.43±0.04b 35.16±4.39c 9.59±3.20b LM2+COS 1.18±0.07a 0.59±0.02f 0.15±0.01a 29.88±0.96a 1.71±0.14a 1.27±0.14f 15.83±1.29a 在移栽后的45 d,计算其萎蔫指数、壮苗指数。在低温期,CK的萎蔫指数达64.77%,而LM2+COS处理的萎蔫指数为1.27%,说明处理后的辣椒种子能够提高其抗寒能力。LM2+COS处理的壮苗指数也与CK具有显著差异。
-
不同处理方式对辣椒幼苗生长发育的影响的双因素方差分析结果表明(表4),LM单因素除总干质量外对其余指标均也具有显著影响的效果,COS单因素除总干质量外对其余指标均具有显著影响的效果。COS复合LM除总干质量和壮苗指数外对其他指标具有显著影响的效果。研究结果表明链霉菌和壳寡糖有较好的交互作用,对辣椒幼苗生长有较好的影响,且LM×COS在P<0.001水平下的有叶面积、叶绿素a、叶绿素b及萎蔫指数;P<0.01水平下只有根长一个指标;P<0.05水平下的有株高、茎粗、类胡萝卜素、可溶性糖、可溶性蛋白。
因素 株高/
cm茎粗/
cm根长/
cm叶面
积/cm2总干
质量/g壮苗
指数/%叶绿素a/
(mg·g−1)叶绿素b/
(mg·g−1)类胡萝卜素/
(mg·g−1)可溶性糖/
(mg·g−1)可溶性蛋白/
(mg·g−1)萎蔫
率/%LM× *** *** *** *** ns * *** *** ** *** *** *** COS× *** *** *** *** ns * *** *** *** *** * *** LM×COS * * ** *** ns ns *** *** * * * *** 注:*表示在0.05水平下显著,**表示在0.01水平下显著,***表示0.001水平下显著。 -
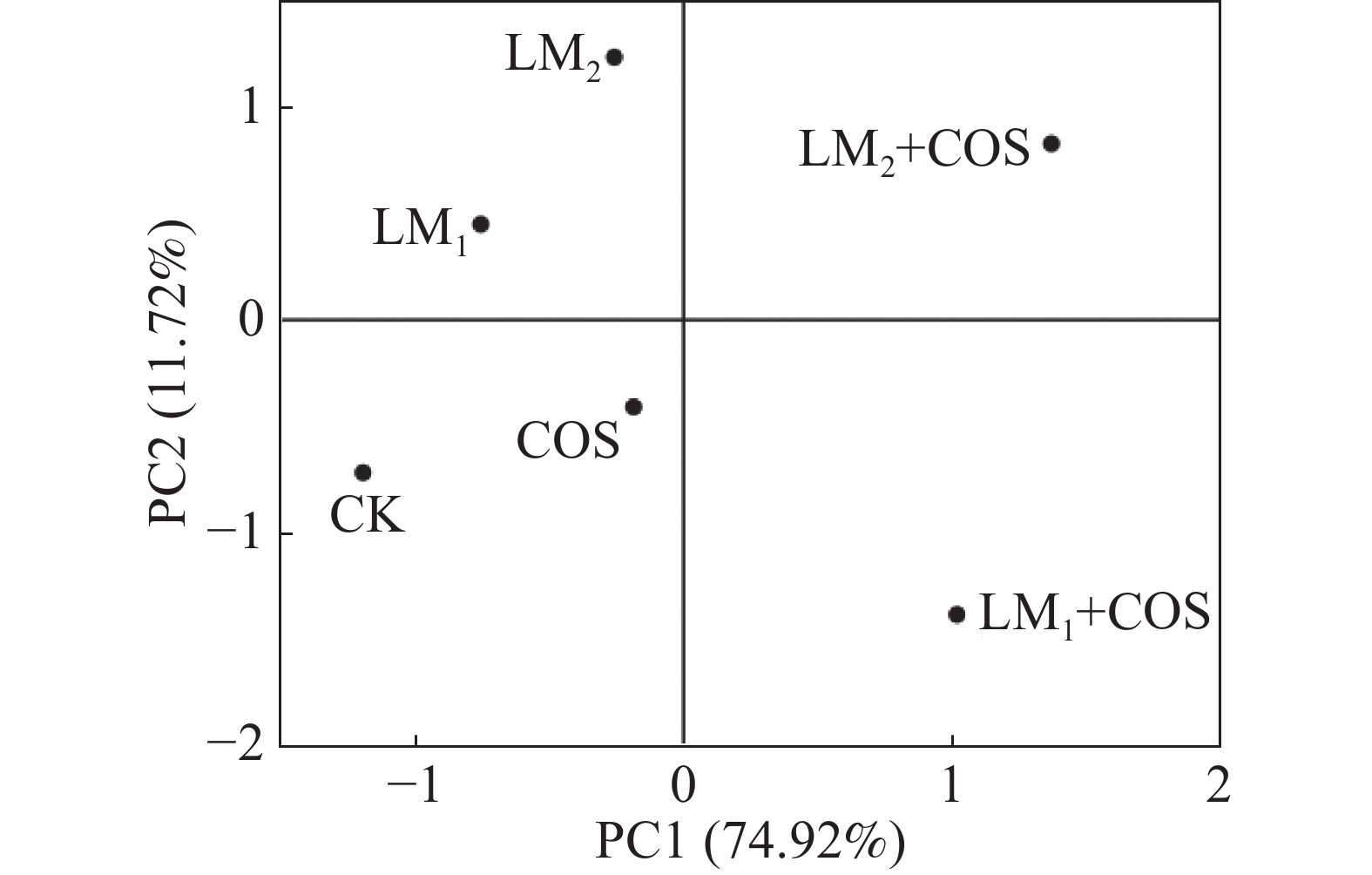
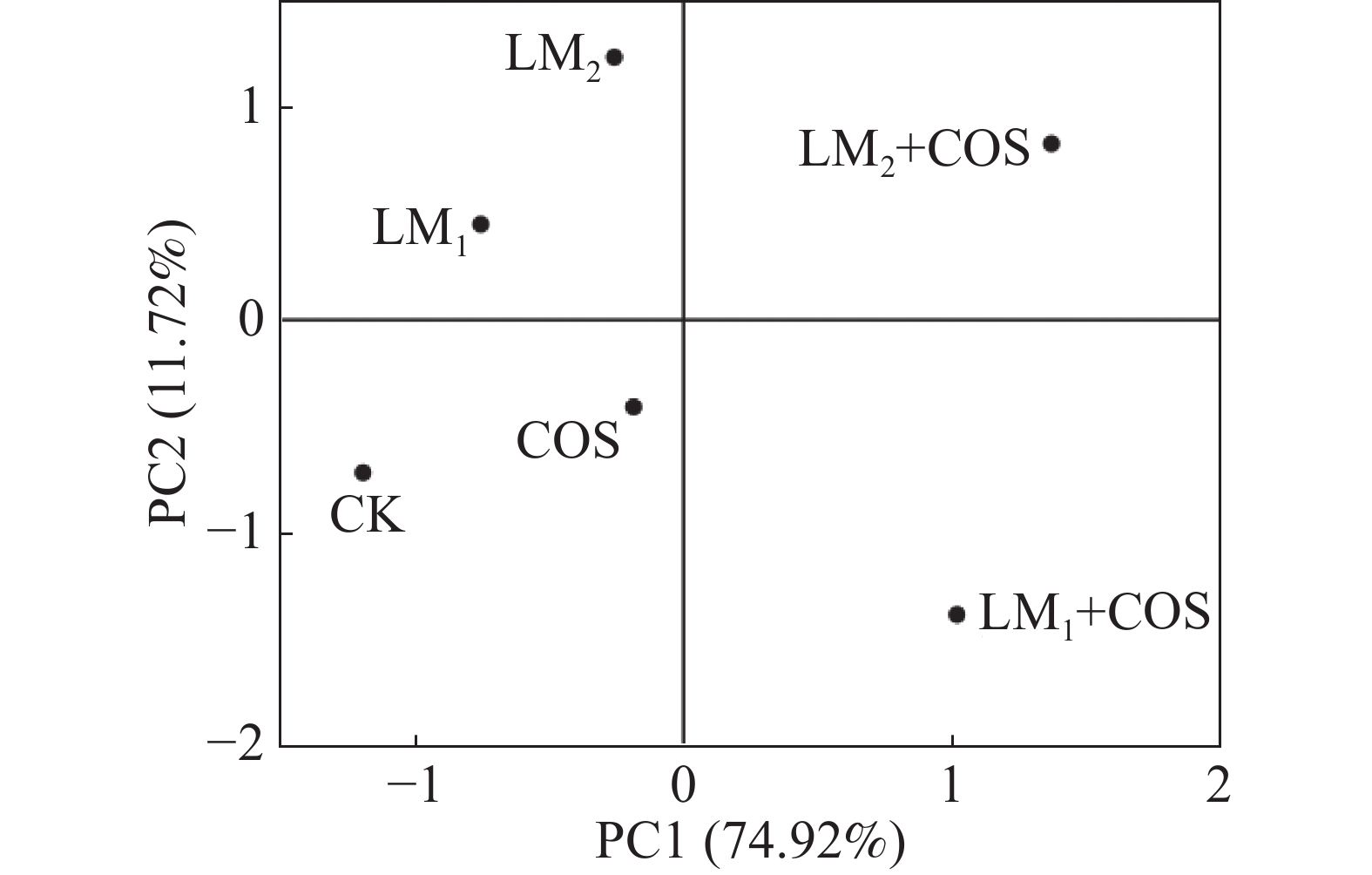
由图3可知,进行主成分分析后,第一主成分占比74.92%,第二主成分占比11.72%,前2个主成分占比86.64%,大于80%,因此选取前2个主成分构建2维PCA图;LM2+COS和LM1+COS在PC 1上为正值,其余均为负值,表明这两个处理的各种指标均有较好的表现;LM2、LM2和LM2+COS在PC 2上为正值,表明3个处理在第二主成分上各种指标有较好的变现。综合判断,LM2+COS在2个主成分上均为正值,说明该处理综合变现最好,LM2+COS浸种辣椒种子对辣椒幼苗的生长最好。
-
链霉菌在农业生产中的应用十分广泛。本实验利用链霉菌菌悬液对辣椒种子进行浸种后,与对照组相比其出苗率、株高、叶绿素、可溶性糖、可溶性蛋白等显著提升,这与付学鹏[17]和CHEN [18]的研究结果基本相似。壳寡糖可促进植株的生长发育。利用壳寡糖对辣椒种子进行浸种处理后,与对照组相比其出苗率、株高、茎粗、叶绿素、可溶性糖、可溶性蛋白等得到了显著提升,这与扈学文[19]和匡银近[20]的研究结果基本相符。利用链霉菌30702和壳寡糖对辣椒种子进行浸种,目的是探讨其两者对辣椒幼苗生长发育的共同影响。研究结果表明,链霉菌和壳寡糖浸种后,辣椒的出苗率、株高、茎粗、根长、叶面积、壮苗指数、总干质量、可溶性糖、可溶性蛋白等含量显著提高,而萎蔫指数显著降低。促生长效果随链霉菌浓度的增加而增大,链霉菌30702的浓度为1.2×107 cfu·mL−1和壳寡糖100 mg. mL−1的复合处理的生长发育最佳,萎蔫指数最低;经主成分分析后,该复合处理的综合得分最高;经交互作用分析得出,除总干质量和壮苗指数外,链霉菌和壳寡糖均有显著的交互作用。链霉菌与壳寡糖在农业应用上都有较大的潜力,最适宜的链霉菌使用方法还有待进一步探索。
Effects of Streptomyces 30702 and chitososaccharides on growth and development of seedlings in Pepper
doi: 10.15886/j.cnki.rdswxb.2022.05.012
- Received Date: 2021-08-31
- Accepted Date: 2022-04-29
- Rev Recd Date: 2022-01-25
- Available Online: 2022-07-12
- Publish Date: 2022-09-21
-
Key words:
- Capsicum annuum L. /
- chitosan oligosaccharide /
- Streptomyces 30702 /
- germination /
- growth and development
Abstract: To explore the effect of Streptomyces 30702 and chitososaccharides on seed germination and seedling growth in Pepper, 3 concentration levels of Streptomyces and 2 concentration levels of chitooligosaccharides were conducted to soak seeds and then cultivate seedlings in hole tray and study seedling quality and physiology. The result showed that after treatment with Streptomyces and chitooligosaccharides, emergence rate , plant height, stem thickness, root length, leaf area, seedling strongness index, total dry weight, soluble sugar and soluble protein were significantly improved, while wilting index was significantly reduced, the extent of influence increased as the using concentration of Streptomyces , Among them compound treatment of Streptomyces 1.2 × 107 cfu·mL−1 and chitosaccharide 100 g·L−1 grew best, wilting index lowest. After the principal component analysis, the compound treatment had the highest comprehensive score. Through interaction analysis, Streptomyces and chitooligosaccharides interacted significantly, except for the total dry weight and seedling strongness index. In a word, Streptomyces 30702 promotes seed to germinate and grow stronger than chitooligosaccharides, interact with chitooligosaccharides in pepper.
| Citation: | ZHU Qing, FAN Heling, SUN Xuebing, WANG Wei, HUANG Xiaolong, LI Changjiang, ZHANG Rongping. Effects of Streptomyces 30702 and chitososaccharides on growth and development of seedlings in Pepper[J]. Journal of Tropical Biology, 2022, 13(5): 509-513. doi: 10.15886/j.cnki.rdswxb.2022.05.012 |






 DownLoad:
DownLoad: