-
橡胶树(Hevea brasiliensis)是大戟科橡胶树属高大乔木,原产于降水丰沛且分布均匀的亚马逊河流域热带雨林地区,喜高温高湿环境。我国橡胶树种植区地处热带北缘次适宜区,每年均会遭受不同程度的寒害、台风和季节性旱害,严重影响橡胶树产量[1]。渗透调节与植物生长、产量、抗逆性和韧皮部光合产物运输密切相关[2-3],它可以使植物在干旱土壤中存活更久并保持新陈代谢过程。在小麦、玉米、高粱、豌豆等农作物中,渗透调节能力与干旱胁迫下植物的生长、产量呈正相关[4]。另外,渗透调节物质的存在是植物细胞膨压产生的基础,而根据植物韧皮部物质运输的“压力流动学说”,渗透调节驱动的膨压是光合产物从“源”端到“库”端运输的驱动力[5-7]。不同植物、甚至同一植物不同生长阶段和不同器官的主要渗透调节物质存在差异[8]:K+和氨基酸是小麦水分胁迫下的主要渗透调节物质[9];枸杞幼苗叶片在水分胁迫下,K+、Cl−、Na+起主要渗透调节作用[10];核桃树中山梨醇和草酸盐是主要渗透调节物质[11]。而在盐胁迫下,葡萄砧木叶片和根系的渗透调节物质含量均升高,可溶性糖是主要渗透调节物质,贡献均为96%以上[12]。不同浓度NaHCO3溶液处理的碱胁迫下对新疆枸杞和枸杞幼苗根部渗透调节相对贡献由大到小的物质依次是Na+、有机酸、可溶性糖,其中Na+的平均贡献率分别为17.44%、11.66%,有机酸的贡献率分别为10.72%、9.97%[13]。张宜辉[14]对红树科植物木榄的研究结果表明,成熟胎生繁殖体以无机离子Ca2+、Mg2+、K+、Na+、Cl−作为主要渗透调节物质。蔡昆争等[15]研究发现,不同生育期水稻渗透调节能力存在差异,由强到弱依次是:抽穗期、幼穗分化期、结实期、分蘖期。符云鹏等[16]研究结果表明,不同生育期香料烟在水分胁迫下,渗透调节物质增加幅度不同,对渗透调节的贡献也不一样,其中K+、可溶性糖、Ca2+对渗透调节的相对贡献较大。王瑞[17]研究发现,处于干旱处理的前中期的棉花叶片渗透调节主要物质是K+;处理后期,K+含量减少,叶片渗透调节能力明显降低,此时氨基酸成为渗透调节的主要贡献者。蔡昆争等[15]研究结果表明,对于同一小麦品种,叶片中渗透调节物质贡献由大到小依次是K+、可溶性糖、游离氨基酸、Ca2+、Mg2+、脯氨酸,而根系中K+虽然也是渗透调节的主要物质,但Ca2+对根系渗透调节的贡献也值得关注。王酉石[18]研究发现,干旱胁迫下红砂的叶和茎中K+和Na+大量积累,而根中其含量变化不大。李莉莎等[19]研究结果表明,高山蒿草返青期根和叶中可溶性糖含量一样,随着高山蒿草的生长,叶片中可溶性糖显著积累,根部含量比较稳定只有在枯黄期才显著增加,作为冬季的物质基础。王瑞[17]通过研究花铃期干旱对棉花产量品质的影响,发现干旱不影响棉株碳代谢变化,但显著抑制上部果枝叶片的同化作用,同时促进碳水化合物向下部果枝大龄棉铃的运转;研究还发现叶片中主要碳水化合物的含量变化不受叶龄和叶位的影响而受到棉株的统一调控[17]。符云鹏等[16]研究结果表明,不同植物主要渗透调节物质不同可能与其生长环境及适应不同环境的机制有关,而同一植物不同器官渗透调节物质相对贡献存在差异可能与其生育期、胁迫强度、同化物质运输等有关。
橡胶树在一天的生长过程中以及割胶过程中水分条件变化剧烈,不同器官中渗透调节物质含量及其变化与生长状况和物质运输是否存在一定联系尚不清楚。本研究以橡胶树品种‘热研73397’袋装组培苗为研究对象,测定橡胶苗正常水分条件下根和叶渗透势及可溶性糖、游离氨基酸、有机酸、Ca2+、Mg2+、K+、Na+、NO3−、Cl−、P、S等渗透调节物质的含量,以研究橡胶苗根和叶渗透调节物质组成及其对渗透势的贡献,进而阐明其变化规律,旨在为进一步研究橡胶树不同器官渗透调节过程与光合作用、木质部—韧皮部水分平衡、胶乳产量等之间的关系提供依据。
-
选取两蓬叶、顶蓬叶稳定、无病虫害且生长一致的‘热研7-33-97’袋育橡胶树组培苗(高80~100 cm)15株。将橡胶苗置于试验大棚内,每天下午6点向育苗袋中浇水,直至袋中土壤完全湿润,使橡胶苗处于充分供水、无水分胁迫生长环境下。培养5~7 d,采集嫩根、完全展开的功能叶,洗净,擦干,用于生理生化指标的测定。
-
相对含水量的测定:随机选取3株橡胶苗,摘取3片叶片,将塑料袋沿缝线剖开,整株取出,立即带回实验室用去离子水冲洗干净根和叶并用滤纸吸干即为鲜样,称鲜质量(FW),置烘箱中105 ℃杀青15 min, 80 ℃烘至恒质量,得到干样,称干质量(DW)。
用植物水势压力室(3005型、美国SoilMoisture Equipment Corp.)测定叶水势[20]。用冰点渗透压仪(OM807、德国VOGEL公司)测定不同组织渗透势:将洗净、擦干后的根、叶新鲜组织迅速放入液氮中冷冻,15 min后取出,置于装有0.22 µm针式过滤器的注射器中,室温下消融30 min后压出汁液用以测定。
-
无机离子质量摩尔浓度(mmol·g−1 DW)的测定如下:Na+、K+质量摩尔浓度的测定采用火焰光度计法[21];Ca2+、Mg2+质量摩尔浓度的测定采用原子吸收光谱法[22-23];全P质量摩尔浓度的测定采用钼锑抗显色法[24-25];S、Cl−质量摩尔浓度的测定采用比浊法[26-27];NO3−、可溶性糖、游离氨基酸的质量摩尔浓度的测定采用比色法[28];有机酸质量摩尔浓度的测定采用酸碱滴定法[29]。
-
各渗透物质组分对渗透势贡献率的计算参考周强[29]的方法利用公式ψ=−icRT计算,式中ψ为渗透势,i为溶液中溶质的活度系数,c为溶质的摩尔浓度(mol·L−1),R为气体常数(R=0.008 314 3 L·MPa·mol−1·K−1),测定温度为25℃ (即T=298.15 K)。各渗透物质组分对渗透势的贡献通过为单一溶质占总渗透调节物质含量的比例及测定的渗透势计算。
-
每个指标重复3次。应用统计分析软件SPSS 26.0对试验数据进行独立样本t检验(P<0.05为显著,用*表示;P<0.01为极显著,用**表示),应用统计分析软件Origin 2018绘图。
-
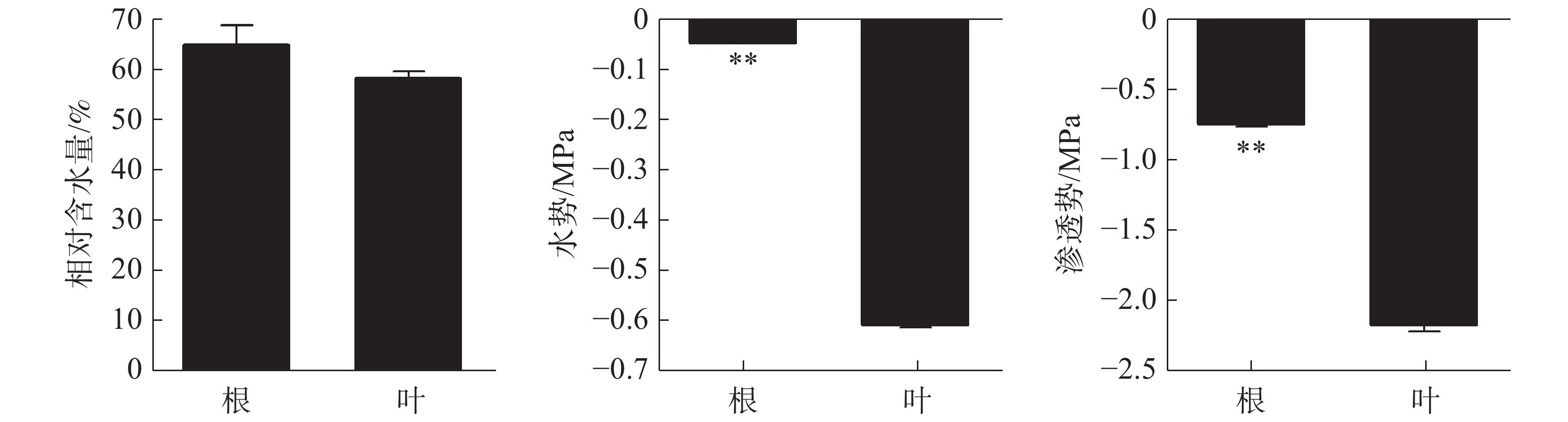
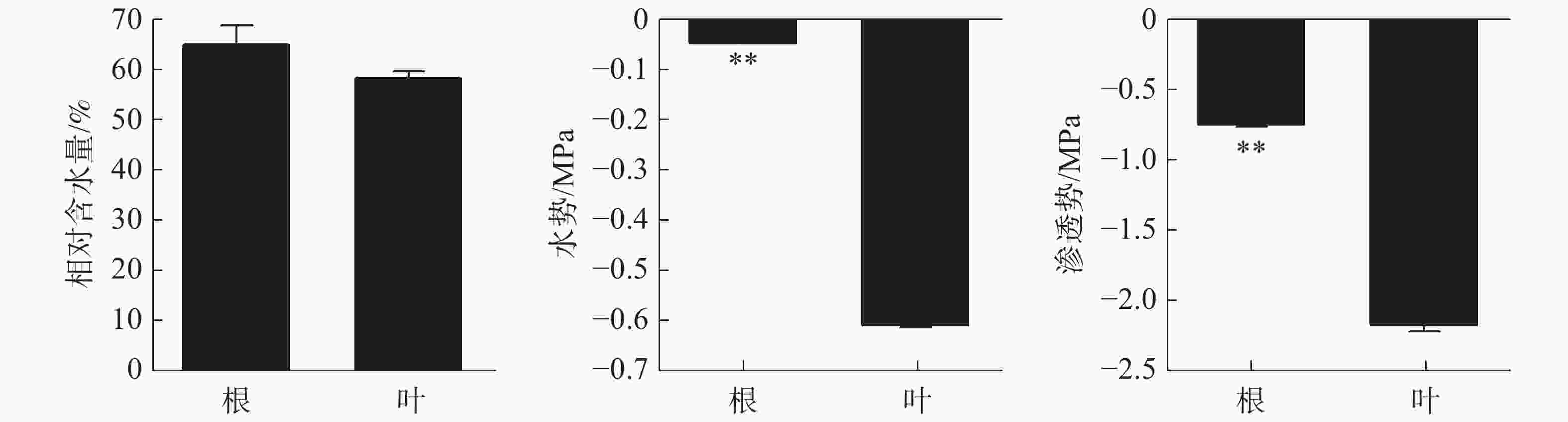
正常生长状态下橡胶苗根和叶的相对含水量无显著差异,分别为64.79%和58.2%(图1)。根、叶水势分别为−0.051 Mpa和−0.60 Mpa,根水势极显著高于叶水势。根、叶渗透势分别为−0.75 Mpa和−2.15 Mpa,根渗透势极显著高于叶渗透势。
-
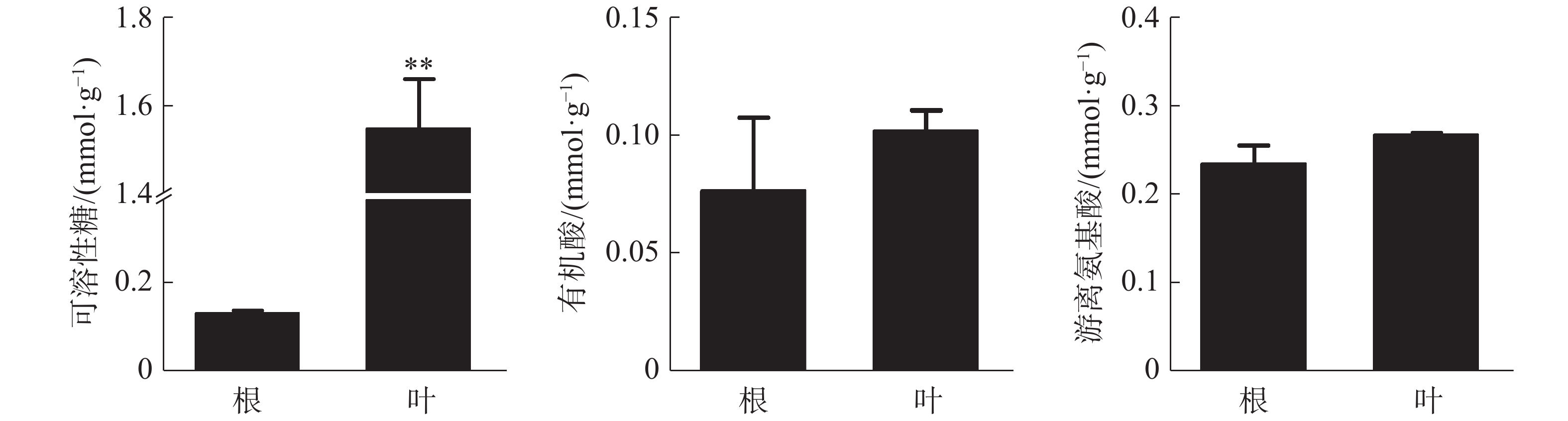
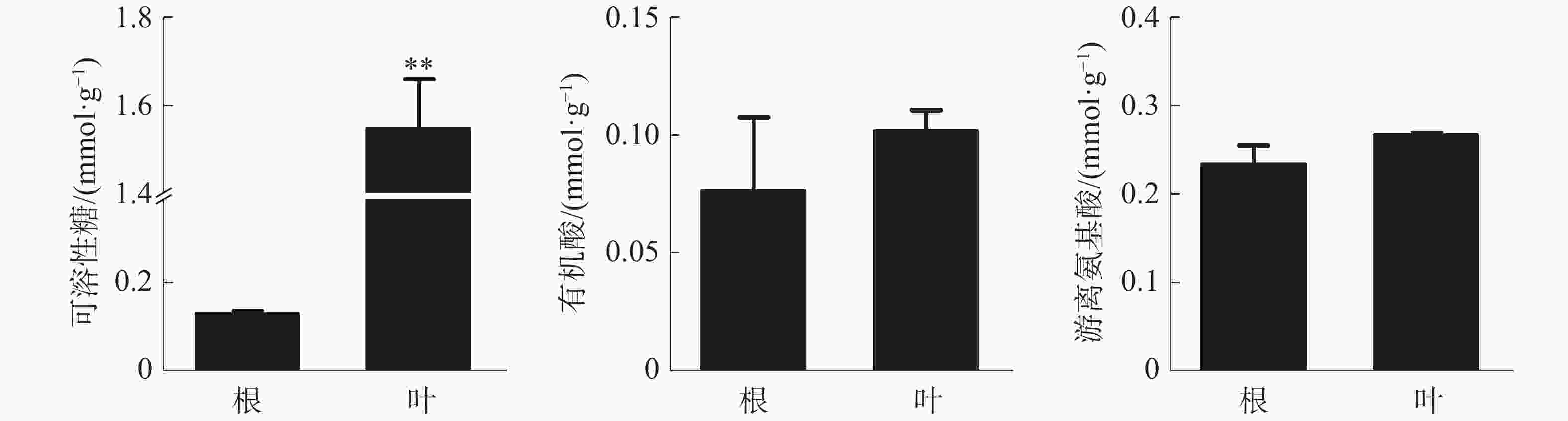
叶中可溶性糖含量为1.55 mmol·g−1(DW),极显著高于根,根和叶中有机酸和游离氨基酸含量没有显著差异(图2)。可溶性糖和游离氨基酸在各器官中的含量均较高,而有机酸含量相对较少。
-
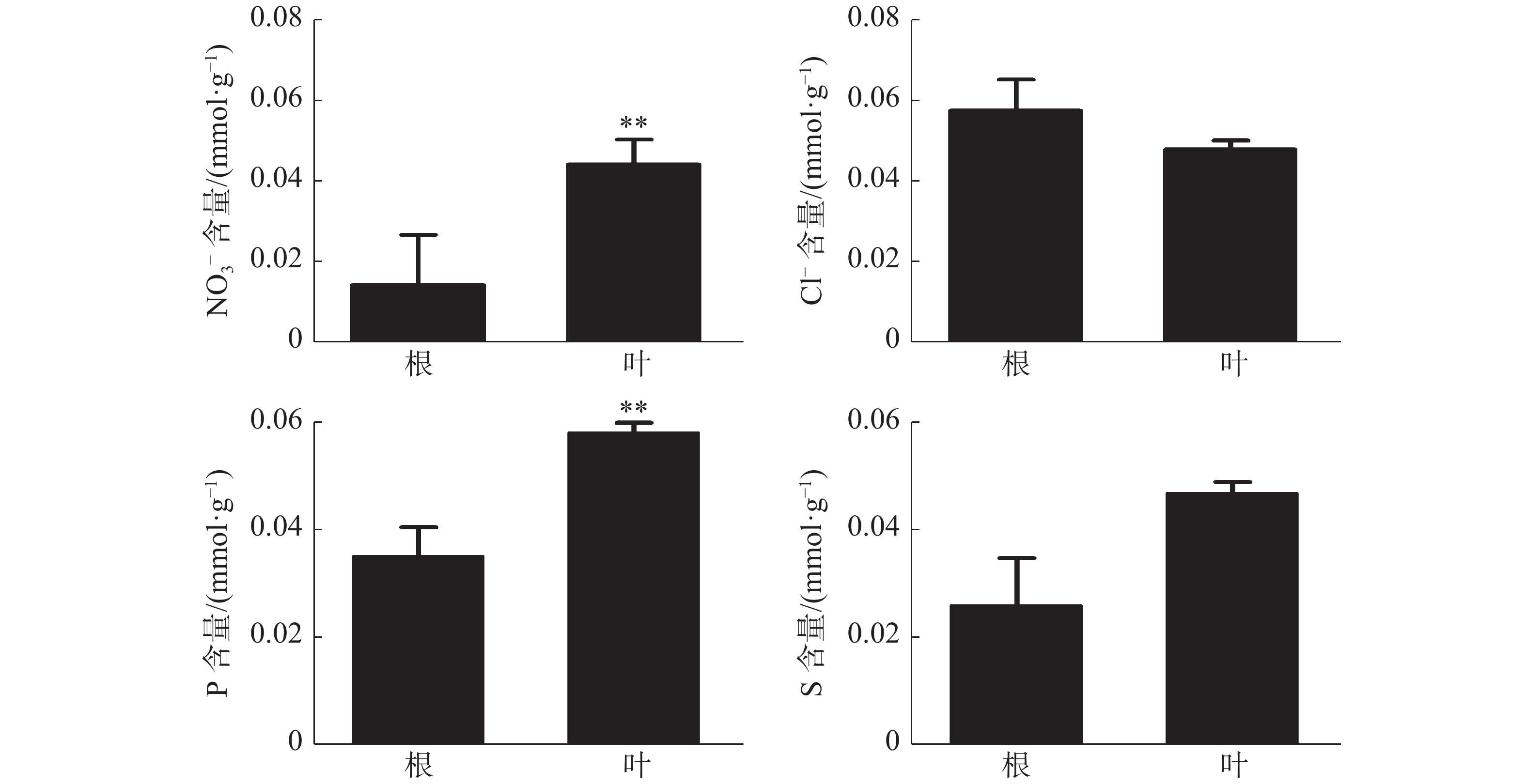
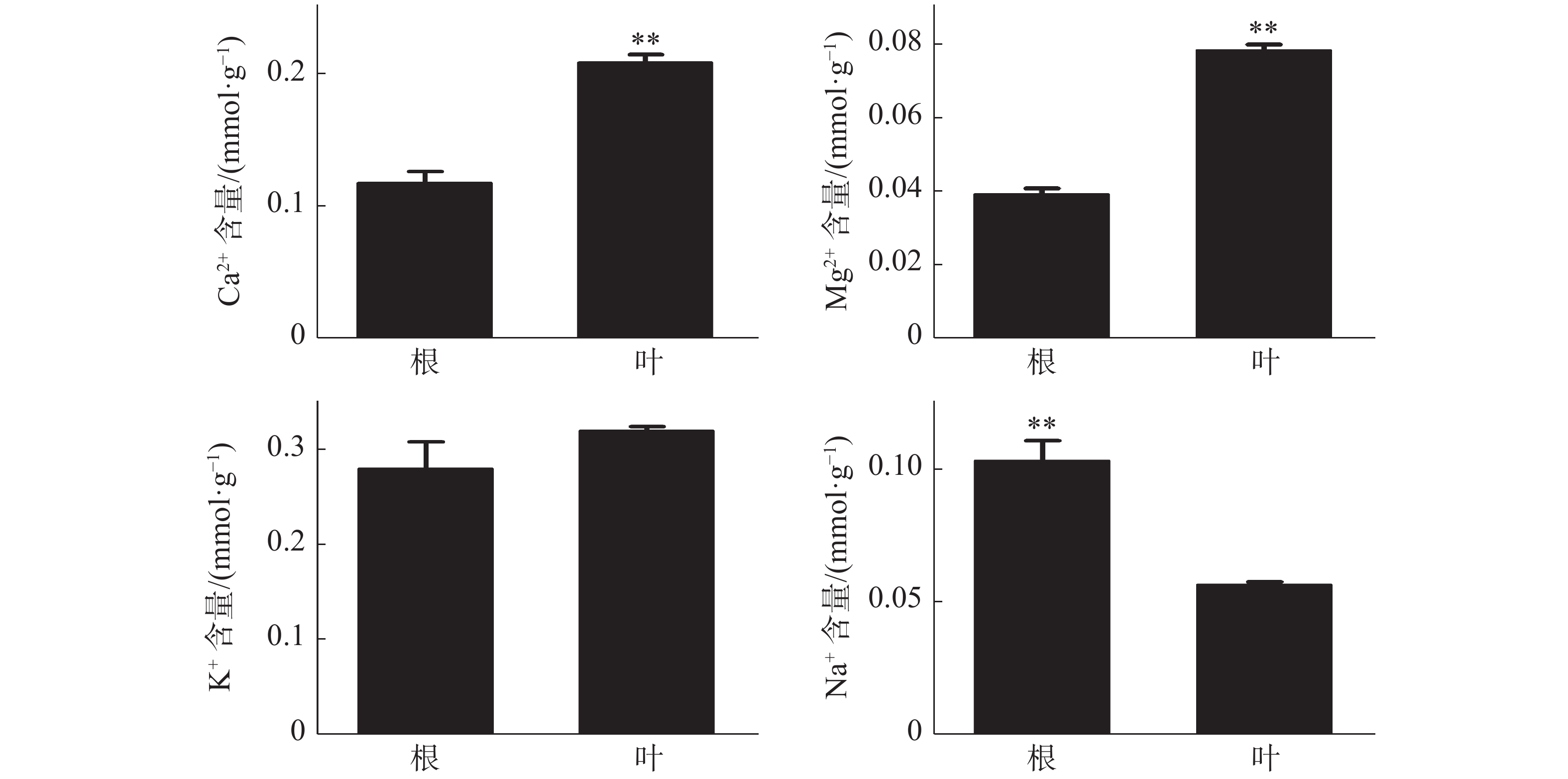
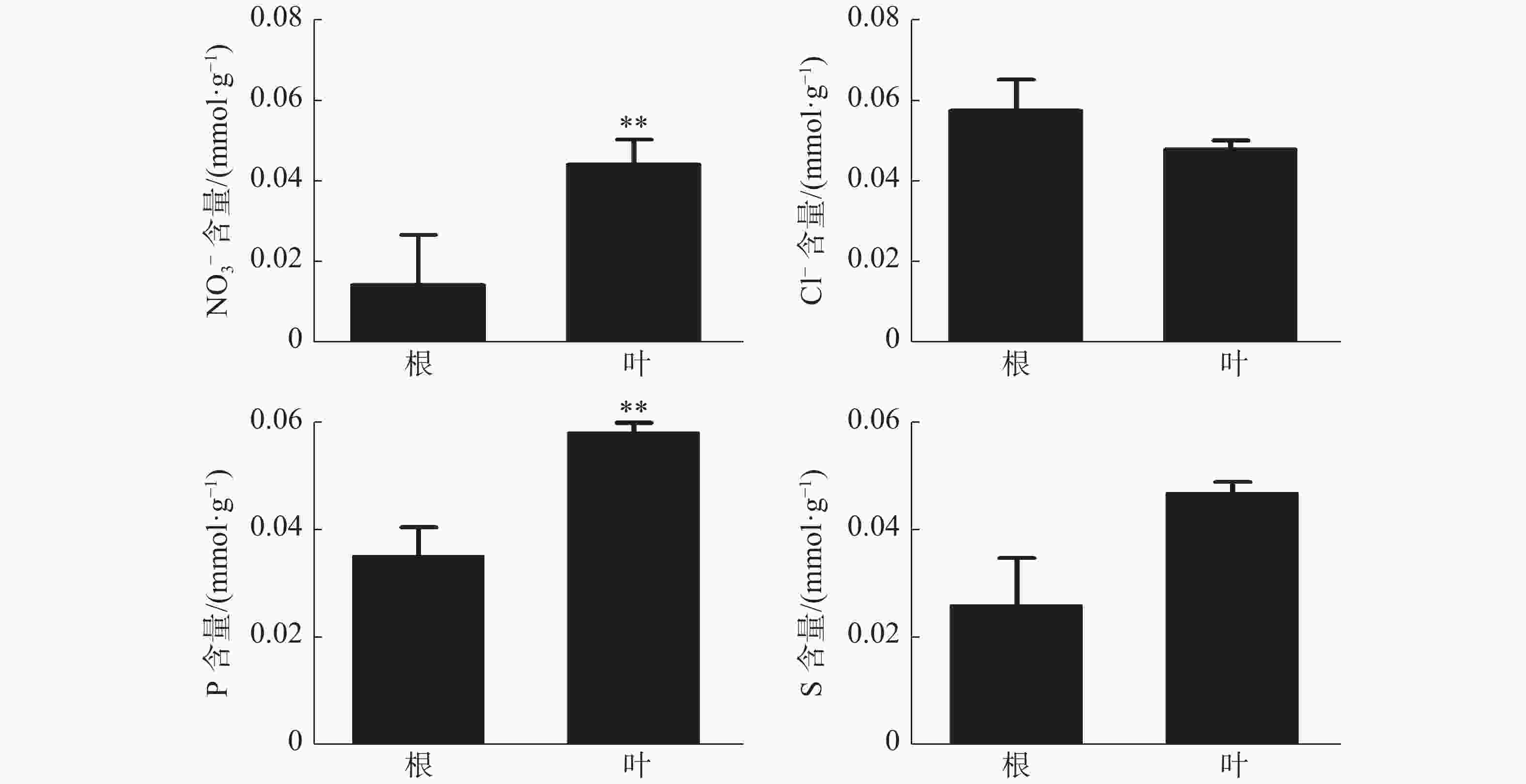
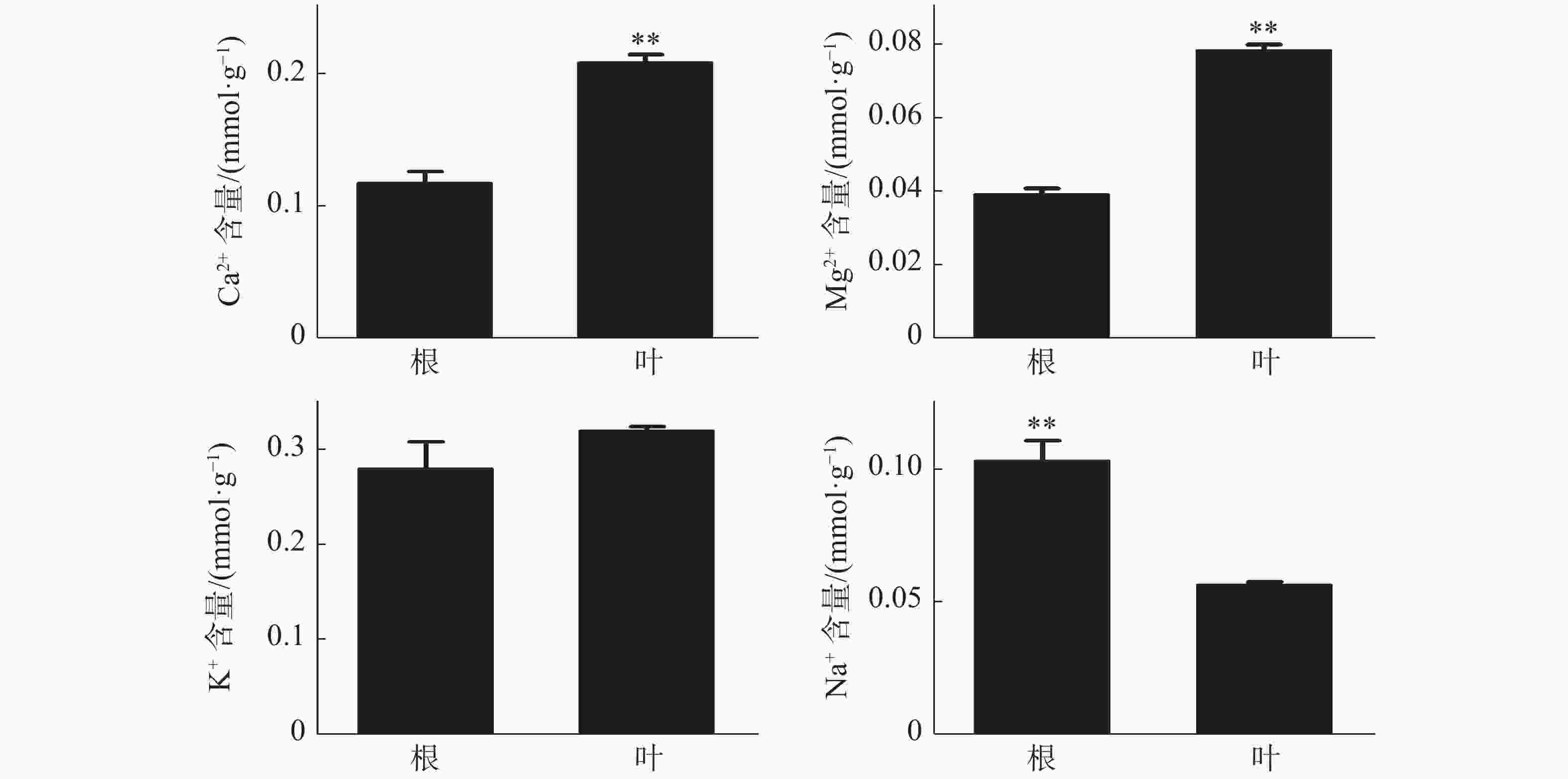
橡胶树叶片中S的含量显著高于根,NO3−和P的含量极显著高于根(图3);Ca2+、Mg2+的含量分别为0.21、0.078 mmol·g−1 (DW),也极显著高于根(图4)。根和叶中Cl−、K+含量无显著差异。根中Na+含量极显著高于叶(图4)。除Cl−、K+和Na+外,其他无机离子在叶片中的含量均高于根,其中大多数具有显著或极显著差异。
-
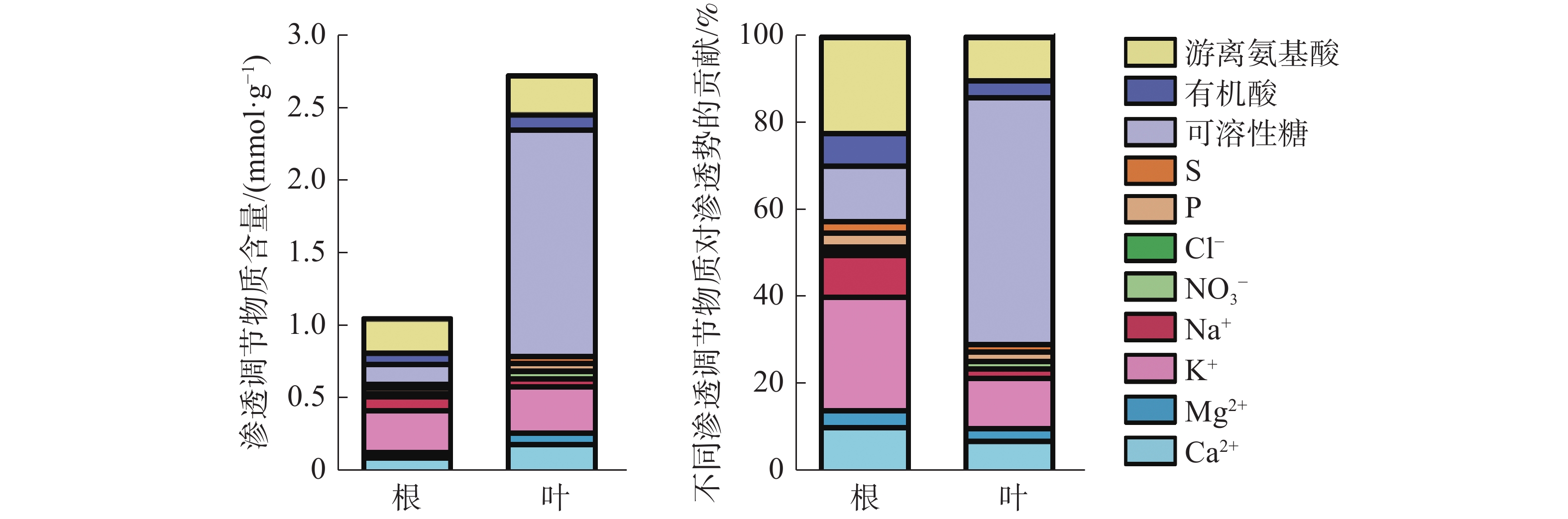
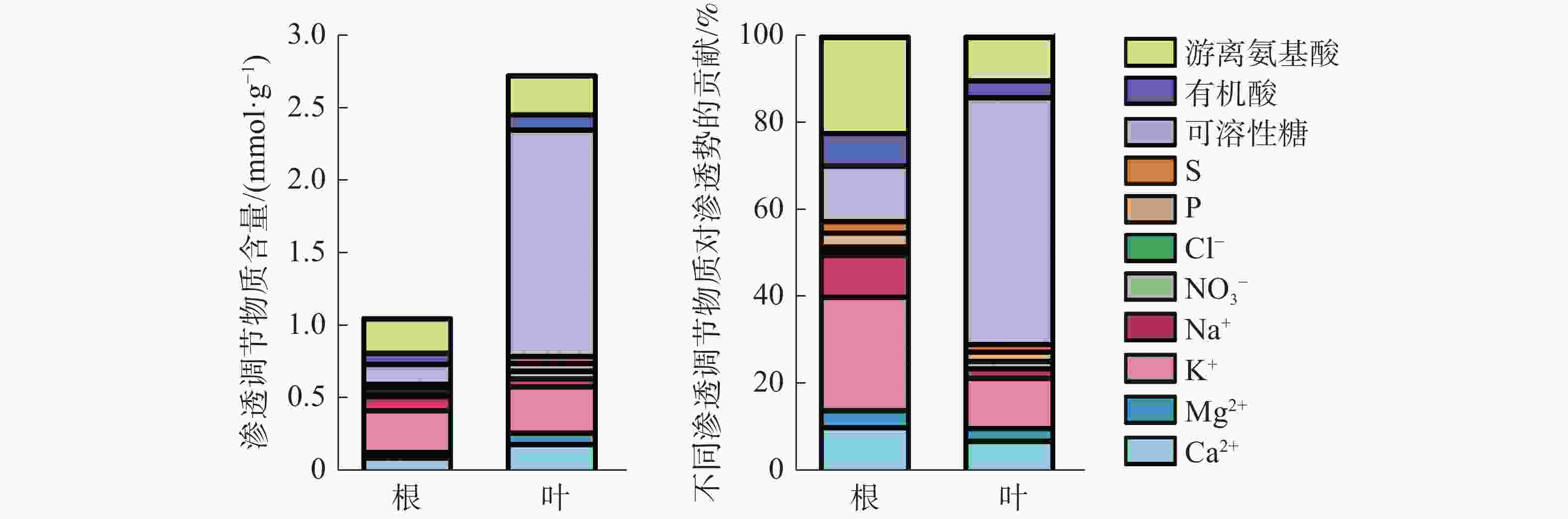
叶片中渗透调节物质总含量是根中总含量的2.54倍(图5)。叶片中有机物含量远高于无机物,以可溶性糖含量占比最高;而在根中渗透调节物质主要由无机物组成,以K+含量所占比例最高。根中无机物和有机物对渗透势的贡献分别为57.78%和42.22%,各渗透物质对根渗透势的贡献度大小依次为:K+(25.97%)>游离氨基酸(22.13%)>可溶性糖(12.94%)>Ca2+(10.94%)>Na+(9.59%)>有机酸(7.15%)>Mg2+(3.66%)>P(3.28%)>S(2.44%)>NO3−(1.37%)>Cl−(0.54%);而在叶片中有机物贡献率达70.15%,无机物贡献率仅为29.85%,其中可溶性糖贡献率最大,占56.55%,叶片各渗透调节物质对叶片渗透势的贡献度大小依次为:可溶性糖(56.55%)>K+(11.66%)>游离氨基酸(9.86%)>Ca2+(7.61%)>有机酸(3.74%)>Mg2+(2.85%)>P(2.13%)>Na+(2.07%)>S(1.72%)>NO3−(1.63%)>Cl−(0.18%)。结果表明,橡胶苗根和叶中的主要渗透调节物质是:K+、游离氨基酸、可溶性糖和Ca2+。
-
本研究结果表明,橡胶苗根中各渗透调节物质的贡献从大到小依次为K+、游离氨基酸、可溶性糖、Ca2+、Na+、有机酸、Mg2+、P、S、NO3−、Cl−,叶片中各渗透调节物质贡献从大到小依次为可溶性糖、K+、游离氨基酸、Ca2+、有机酸、Mg2+、P、Na+、S、NO3−、Cl−。可溶性糖对叶片渗透势的贡献大于根系,K+对根系渗透势的贡献大于叶片,这与王玮等[30]研究不同玉米品种根和叶中渗透调节能力的结果一致。水稻叶片和根系中对渗透调节贡献最大的是K+,其次是Ca2+、Mg2+[15]。水分胁迫下玉米根和叶中的渗透调节物质主要是可溶性糖和K+[30]。小麦叶片中的主要渗透调节物质依次是K+、可溶性糖、游离氨基酸[31]。由此可见,各物质在不同器官中对渗透调节的贡献随物种不同而异,但K+、Ca2+、Mg2+、可溶性糖和游离氨基酸都在渗透调节过程中发挥着重要作用,本研究结果与此一致。橡胶苗叶中渗透调节物质总量是根的2.54倍,而渗透物质含量高低与其渗透势高低一致。高山蒿草[19]和玉米[30] 中根系渗透调节物质的含量及渗透调节过程中的增加量均小于叶片,根系渗透调节能力低于叶片。橡胶苗根和叶渗透调节能力的差异可能与其光合产物积累和运输相关,可溶性糖可能是橡胶树渗透调节驱动的物质运输的关键。
橡胶苗根和叶中渗透调节物质的含量和组成不同。叶片中渗透调节物质总含量高,且主要由有机物组成。根中渗透调节物质主要是无机物。不同器官中各物质对渗透势的贡献不同,但主要渗透调节物质均为可溶性糖、游离氨基酸、K+、Ca2+。本研究尚未做胁迫处理,只是初步阐明了橡胶苗不同器官渗透调节物质的组成和贡献。因此,建议后续可以加入干旱胁迫实验,以深入了解橡胶树在干旱期间通过渗透调节调控生理过程的机制,也可以与不同部位光合产物的含量变化、水通道蛋白和蔗糖转运蛋白的表达等多方面指标结合,进一步探讨渗透调节物质变化与光合产物运输、木质部—韧皮部水分平衡等的关系,对橡胶树抗逆栽培技术的研发提供指导。
Composition of osmotica in different organs of rubber seedlings and their contributions to osmotic potential
doi: 10.15886/j.cnki.rdswxb.2022.01.002
- Received Date: 2021-06-01
- Accepted Date: 2022-01-05
- Rev Recd Date: 2021-06-25
- Available Online: 2022-02-14
- Publish Date: 2022-01-31
-
Key words:
- Hevea brasiliensis /
- osmotic regulator /
- osmoregulation /
- transport of substance
Abstract: Osmotic regulation plays an important role in maintaining plant turgor, protecting cell function, regulating water relationship and coping with environmental stresses. However, the osmotic regulators and their contribution to osmotic potential are different in different plant organs. Polybag tissue cultured rubber plants of clone Reyan 73397 were selected to determine the contents of osmatic regulators such as soluble sugar, free amino acid, organic acid, Ca2+, Mg2+, K+, Na+, NO3−, Cl−, P and S in the roots and leaves to analyze the contribution of the osmotic regulators to osmotic regulation. The results showed that osmotic regulators in the roots were mainly composed of inorganic substances, while osmatic regulators in the leaves were mainly composed of organic substances, the total content of which was much higher than those in the roots. The contents of soluble sugar, free amino acids, K+ and Ca2+ in the roots and leaves contributed differently to the osmatic potential, but they were the main osmotic regulators.
| Citation: | CHENG Yuwan, AN Feng, SHI Jingru, XIE Guishui, CAI Jing. Composition of osmotica in different organs of rubber seedlings and their contributions to osmotic potential[J]. Journal of Tropical Biology, 2022, 13(1): 7-12. doi: 10.15886/j.cnki.rdswxb.2022.01.002 |






 DownLoad:
DownLoad: