-
植物病害严重威胁农业健康发展和粮食安全问题,全世界每年因植物病害造成的粮食损失已达11%[1-3]。我国棉花受病害的影响,每年造成12%的经济损失;1990年我国小麦条锈病大流行,减产25亿kg;1993年,我国南方水稻种植区域稻瘟病大流行,水稻减产150亿kg[4-5]。化学杀菌剂的滥用,加剧植物病原菌对杀菌剂抗药性的发展速度,并严重威胁环境安全和人类健康[6-7]。因此,研究与开发高效、低毒、低残留的新型农药,已成为目前农药创制的首要目标[6-8]。特比萘酚(Terbinafine)和盐酸特比萘酚(Terbinafine hydrochloride)为烯丙胺类广谱抗真菌药,商品名为疗霉舒(Lamisil),由诺华公司(瑞士)人工合成,具有杀菌及抑菌双重作用[9];其具有高度疏水性,因此,倾向在头发、皮肤、指甲和脂肪组织累积。特比萘酚位列于世界卫生组织基本药物标准清单中,是基础医疗体系的必备药物之一,适用于浅表真菌引起的皮肤和指甲感染,如各种体癣、手足癣以及皮肤白色假丝酵母菌感染[10]。特比萘酚对高等动物低毒已经在医药研究和使用的实践中得到了验证[11]。目前,这2种药物对植物病害的防治效果尚未见报道。本实验通过病原真菌离体培养和盆栽活体实验相结合的方式,研究特比萘酚和盐酸特比萘酚对多种植物病原真菌病害的影响,旨在寻找这2种药物在农作物病害防治领域的潜在应用价值。
HTML
-
本实验的溶剂均来自广东西陇科技股份有限公司;特比萘酚(浓度为>98%,Damas-beta)、盐酸特比萘酚(浓度为>98%,Damas-beta)及丙环唑(浓度为97%,Aladdin)等原药均购自北京伊诺凯科技有限公司,并可直接使用;寄主植物种子(黄瓜:Cucumis sativus., 津研4号小麦:Triticum aestivum L., 豫麦8号;番茄:Lycopersicon esculentum Mill., 浙粉202;水稻:Oryza sativa L., 南京46;豇豆:Vigna unguiculata(Linn.) Walp., 帮达2号;玉米:Zea mays L., 郑单958;大豆:Glycine max (Linn.) Merr., 中黄57)播种于装满灭菌土的花盆中,在温室(24±1) ℃,相对湿度80%下培养至2叶期备用;盆栽的土壤来自海南大学植物保护学院教学基地,土壤经干热灭菌(120 ℃,50 min)。
-
本实验供试菌种见表1。
序号 Code. 供试菌种 Fungal strains 保存地 Storage location 实验项目 Test activity 1 山茶灰斑病菌(Pestalotipsis guepinii) 海南大学植物保护学院 病原菌抑菌活性测定 2 小麦赤霉病菌(Fusarium graminearum) 海南大学植物保护学院 病原菌抑菌活性测定 3 玉蜀黍赤霉病菌(Gibberella zeae) 海南大学植物保护学院 病原菌抑菌活性测定 4 茄链格孢病菌(Alternaria solani) 海南大学植物保护学院 病原菌抑菌活性测定 5 稻瘟病病菌(Magnaporthe oryzae) 海南大学植物保护学院 病原菌抑菌活性测定 6 水稻纹枯病菌(Rhizoctonia solani) 沈阳化工研究院生测中心 盆栽试验 7 小麦纹枯病菌(Rhizoctonia cerealis) 海南大学植物保护学院 病原菌抑菌活性测定 8 火龙果溃疡病菌(Neoscytalidium dimidiatum) 海南大学植物保护学院 病原菌抑菌活性测定 9 香蕉枯萎病菌(Fusarium oxysporum f. sp. cubense, Foc) 海南大学植物保护学院 病原菌抑菌活性测定 10 芒果蒂腐病菌(Botryodiplodia theobromae) 海南大学植物保护学院 病原菌抑菌活性测定 11 香蕉炭疽病菌(Colletotrichum musae) 海南大学植物保护学院 病原菌抑菌活性测定 12 橡胶炭疽病菌(Colletotrichum siamense) 海南大学植物保护学院 病原菌抑菌活性测定 13 串珠镰孢病菌(Fusarium moniliforme) 海南大学植物保护学院 病原菌抑菌活性测定 14 冬瓜炭疽病菌(Colletotrichum orbiculare) 海南大学植物保护学院 病原菌抑菌活性测定 15 油菜菌核病菌(Sclerotinia sclerotiorum) 海南大学植物保护学院 病原菌抑菌活性测定 16 芒果炭疽病菌(Colletotrichum gloeosporioide) 海南大学植物保护学院 病原菌抑菌活性测定 17 黄瓜灰霉病菌(Botrytis cinerea) 海南大学植物保护学院 病原菌抑菌活性测定 18 黄瓜靶斑病菌(Corynespora cassiicola) 沈阳化工研究院生测中心 盆栽试验 19 小麦白粉病(Blumeria graminis) 沈阳化工研究院生测中心 盆栽试验 20 黄瓜白粉病菌(Erysiphe cichoracearum) 沈阳化工研究院生测中心 盆栽试验 21 大豆锈病病菌(Phakopsora pachyrhizi) 沈阳化工研究院生测中心 盆栽试验 22 王米小斑病菌(Bipolaris maydis) 沈阳化工研究院生测中心 盆栽试验 23 玉米大斑病菌(Setosphaeria turcica) 沈阳化工研究院生测中心 盆栽试验 24 番茄灰霉病菌(Botrytis cinerea) 沈阳化工研究院生测中心 盆栽试验 25 豇豆白粉病菌(Podosphaera xanthii) 海南大学植物保护学院 盆栽试验 Table 1. All fungal strains under test
-
分别将1 g 特比萘酚、1 g盐酸特比萘芬和1 g丙环唑溶于20 mL乙酸乙酯溶液和20 mL乙醇溶液中,超声5 min,再加入20 mL农药乳化剂1601# 和1 mL乙二醇,最后加入39 mL水,用磁力搅拌器搅拌30 min(28 ℃,200 r·min−1),配制成稳定的1%特比萘酚、盐酸特比萘芬和丙环唑微乳剂。
-
采用菌丝生长速率抑制法检测体外菌丝抑制率[12-13]。将特比萘酚和盐酸特比萘芬溶解于N,N-二甲基甲酰胺(v/v=0.5% DMF )中,与PDA培养基混合至终浓度。以不含化合物的0.5% DMF作为空白对照,以嘧菌酯和烯唑醇为阳性对照。用灭过菌的打孔器(直径0.5 cm)将病原菌(已活化)打成菌饼。将带菌丝的菌饼接入无菌的PDA平板中心。将处理和对照置于培养箱中(27±1)℃黑暗培养2~6 d,待对照组病原菌长至菌落直径5.5 cm以上结束实验。所有处理均重复3次。使用标准刻度尺,用十字交叉法测量抑菌圈直径(cm),取平均值。
菌丝生长抑制率=(对照组菌落直径−处理组菌落直径)/(对照菌落直径−0.5)×100%。
-
大豆锈病和白粉病孢子悬浮液配制,剪取长满孢子的植物叶片(温室中自然发病的植物叶片),加入含有表面活性剂的去离子水,用毛笔将病叶上的孢子洗下,经2层纱布过滤,制成孢子悬浮液,采用血细胞计算器计数,计算出该溶液中孢子浓度,经过无菌水稀释成5×106 CFU·mL−1的孢子悬浮液,待用。
玉米大小斑病、黄瓜靶斑病和灰霉病孢子悬浮液配制,在已长满孢子的培养皿中加入无菌水,轻轻刮取表面孢子,经2层纱布过滤,制成孢子悬浮液,采用血细胞计算器计数,计算出该溶液中孢子浓度,经过无菌水稀释成5×106 CFU·mL−1的孢子悬浮液,待用。
-
本实验在海南大学温室中完成。参考《农药生物活性测试标准操作规范》测定各药剂对作物的保护作用[12]。1%特比萘酚和盐酸特比萘酚微乳剂用水稀释至100、25、12.5 mg·L−1实验溶液,丙环唑微乳剂用水稀释至50、25、12.5 mg·L−1实验溶液,然后用喷雾器将实验溶液喷雾到2叶期豇豆植株上(喷雾压力为1.5 kg·cm−2,药液量约为675 L·hm−2),直到液体均匀布满叶片。24 h后,将孢子悬浮液(5 × 106 CFU·mL−1)喷施于豇豆叶片上。处理后的植株均置于温室(24±1) ℃,相对湿度80%条件下培养。每处理重复3次。以丙环唑为阳性对照,以不含特比萘酚和盐酸特比萘酚的微乳剂作为空白对照。14 d后按病情分级标准调查发病情况,并计算防治效果。
病情分级标准如下:
0级: 无病;
1级: 病变面积占整个叶面积的<5%;
3级: 病变面积占整个叶面积的≥5%~<10%;
5级: 病变面积占整个叶面积的≥10%~<20%;
7级: 病变面积占整个叶面积的≥20%~<40%;
9级: 病变面积占整个叶面积的≥40%以上。
-
本实验在沈阳化工研究院完成。参考《农药生物活性测试标准操作规范》测定各药剂对作物的保护作用[12]。将特比萘酚和盐酸特比萘酚(8 mg)溶于丙酮(1 mL)中,并用含有0.5%(v/v)Tween 80的无菌水(19 mL)稀释至400、100、25 mg·L−1溶液。然后用喷雾器将实验溶液喷雾到寄主植株上(喷雾压力为1.5 kg·cm−2,药液量约为675 L·hm−2),直到液体均匀布满叶片,并以等量溶剂的吐温水作为空白对照,嘧菌酯、乙霉威、乙醚酚、咪鲜胺和啶酰菌胺作为阳性对照,自然风干24 h后接种病原菌。将配置好的实验溶液[小麦白粉病(5×106 CFU·mL−1)、大豆锈病病菌(5×106 CFU·mL−1)、王米小斑病菌(5×106 CFU·mL−1)、黄瓜靶斑病菌(5×106 CFU ·mL−1)、黄瓜白粉病菌(5×106 CFU·mL−1)、玉米大斑病菌(5×106 CFU·mL−1)、番茄灰霉病菌(5×106 CFU·mL−1)]喷雾于2叶期寄主植株上,将水稻纹枯病菌的菌饼(直径0.5 cm)夹在水稻幼苗底部,然后把植物移入温室中培养[(24±1) ℃,湿度RH>80]。5~7 d后按病情分级标准调查发病情况,并计算防治效果。每个实验重复3次。病情分级标准和防治效果计算公式见1.5.2。
-
统计过程均用Excel 2019和SPSS 26.0完成。几率值法建立毒力回归方程及计算EC50,显著性检验则是单因素方差分析后Duncan法比较均值间的差异显著性,显著水平设定为P<0.05。
1.1. 实验材料
1.2. 供试菌种
1.3. 特比萘酚、盐酸特比萘酚和丙环唑微乳剂的配制
1.4. 离体抗真菌活性测定
1.5. 盆栽抑菌实验
1.5.1. 孢子悬浮液的配制方法
1.5.2. 特比萘酚和盐酸特比萘酚微乳剂对豇豆白粉病盆栽防效试验方法
1.5.3. 对8种植物病害的室内盆栽防效试验方法
1.6. 数据处理
-
采用生长速率法测定特比萘酚和盐酸特比萘酚在不同浓度下对16种植物病原真菌的抑菌活性,结果见表2。实验结果表明,特比萘酚和盐酸特比萘酚对16种植物病原真菌都表现出良好的抑菌效果(EC50为0.03~1.22 mg·L−1),其中特比萘酚和盐酸特比萘酚对9种植物病原真菌(山茶灰斑病菌、小麦赤霉病菌、玉蜀黍赤霉病菌、芒果蒂腐病菌、橡胶炭疽病菌、串珠镰孢病菌、油菜菌核病菌、芒果炭疽病菌和黄瓜灰霉病菌等)的抑制效果均显著高于商品化杀菌剂嘧菌酯和三唑类杀菌剂烯唑醇。特比萘酚对8种真菌(山茶灰斑病菌、小麦赤霉病菌、玉蜀黍赤霉病菌、茄链格孢病菌、火龙果溃疡病菌、香蕉炭疽病菌、橡胶炭疽病菌和冬瓜炭疽病菌等)的抑制活性较强,其EC50分别为0.10、0.03、0.09、0.07、0.24、0.21、0.11、0.07 mg·L−1,盐酸特比萘酚对5种真菌(山茶灰斑病菌、小麦赤霉病菌、玉蜀黍赤霉病菌、茄链格孢病菌和火龙果溃疡病菌等)的抑制活性较强,其EC50分别为0.09、0.03、0.10、0.07、0.22 mg·L−1。植物病原菌抑菌活性测定结果说明,特比萘酚和盐酸特比萘酚对农业病菌表现出显著的抑制活性。
编号
No.供试菌种
Fungal strainsEC50/(mg·L−1) 特比萘酚
Terbinafine特比萘酚盐酸盐
Terbinafine hydrochloride嘧菌酯
Azoxystrobin烯唑醇
Diniconazole1 山茶灰斑病菌 0.10±0.04a 0.09±0.01a 0.36±0.07b 3.37±0.75c 2 小麦赤霉病菌 0.03±0.01a 0.03±0.01a 5.27±0.34c 1.14±0.03b 3 玉蜀黍赤霉病菌 0.09±0.04a 0.10±0.02a 14.15±0.75c 0.76±0.13b 4 茄链格孢病菌 0.07±0.01b 0.07±0.01b >0.01a 1.32±0.11c 5 稻瘟病菌病菌 0.34±0.01a 0.37±0.03a 17.90±0.75c 0.95±0.39b 7 小麦纹枯病菌 1.06±0.05c 1.22±0.12d 0.32±0.04b 0.10±0.03a 8 火龙果溃疡病菌 0.24±0.09b 0.22±0.05b 18.95±0.51c 0.03±0.01a 9 香蕉枯萎病菌 0.45±0.04b 0.41±0.06b 11.83±0.93c 0.24±0.04a 10 芒果蒂腐病菌 0.36±0.07a 0.42±0.10b 70.03±0.70d 1.88±0.32c 11 香蕉炭疽病菌 0.21±0.03b 0.39±0.01c 52.51±0.83d 0.12±0.07a 12 橡胶炭疽病菌 0.11±0.04a 0.26±0.07b 10.45±1.20d 0.34±0.06c 13 串珠镰孢病菌 0.29±0.06b 0.25±0.06a 12.85±0.45d 0.49±0.02c 14 冬瓜炭疽病菌 0.07±0.01b 0.25±0.04c 0.01±0.01a 1.60±0.12d 15 油菜菌核病菌 0.31±0.07a 0.33±0.06a 11.50±0.54c 0.64±0.05b 16 芒果炭疽病菌 0.45±0.10b 0.30±0.03a 22.40±0.07d 1.46±0.21c 17 黄瓜灰霉病菌 0.68±0.12a 0.80±0.12b 102.73±1.50d 1.65±0.34c 注:同行不同小写字母表示差异显著(P<0.05),下同。
Note: Different lowercase letters in the same line indicate significant differences at P < 0.05. similarly hereinafter.Table 2. Antifungal activities of terbinafine and terbinafine hydrochloride against 16 species of plant pathogenic fungi
-
豇豆白粉病盆栽喷雾法表明,特比萘酚和盐酸特比萘芬微乳剂对豇豆白粉病均起到良好的抑制效果(图1,表3)。在浓度为100 mg·L−1时,特比萘酚和盐酸特比萘酚微乳剂完全抑制了白粉病病原菌的侵染,防治效果与注册杀菌剂丙环唑(50 mg·L−1)的防效相似。随着药剂浓度的降低,防治效果呈现不同程度的降低,在25、12.5 mg·L−1时,特比萘酚和盐酸特比萘酚微乳剂防效分别为88.68%、36.97%和94.42%、68.14%,而丙环唑微乳剂的防效分别为89.70%和57.16%。实验结果表明,在高浓度(100 mg·L−1)时,特比萘酚和盐酸特比萘芬微乳剂的防效与注册杀菌剂丙环唑的防效相似,低浓度(25、12.5 mg·L−1)时,特比萘酚和盐酸特比萘芬微乳剂的防效较差。
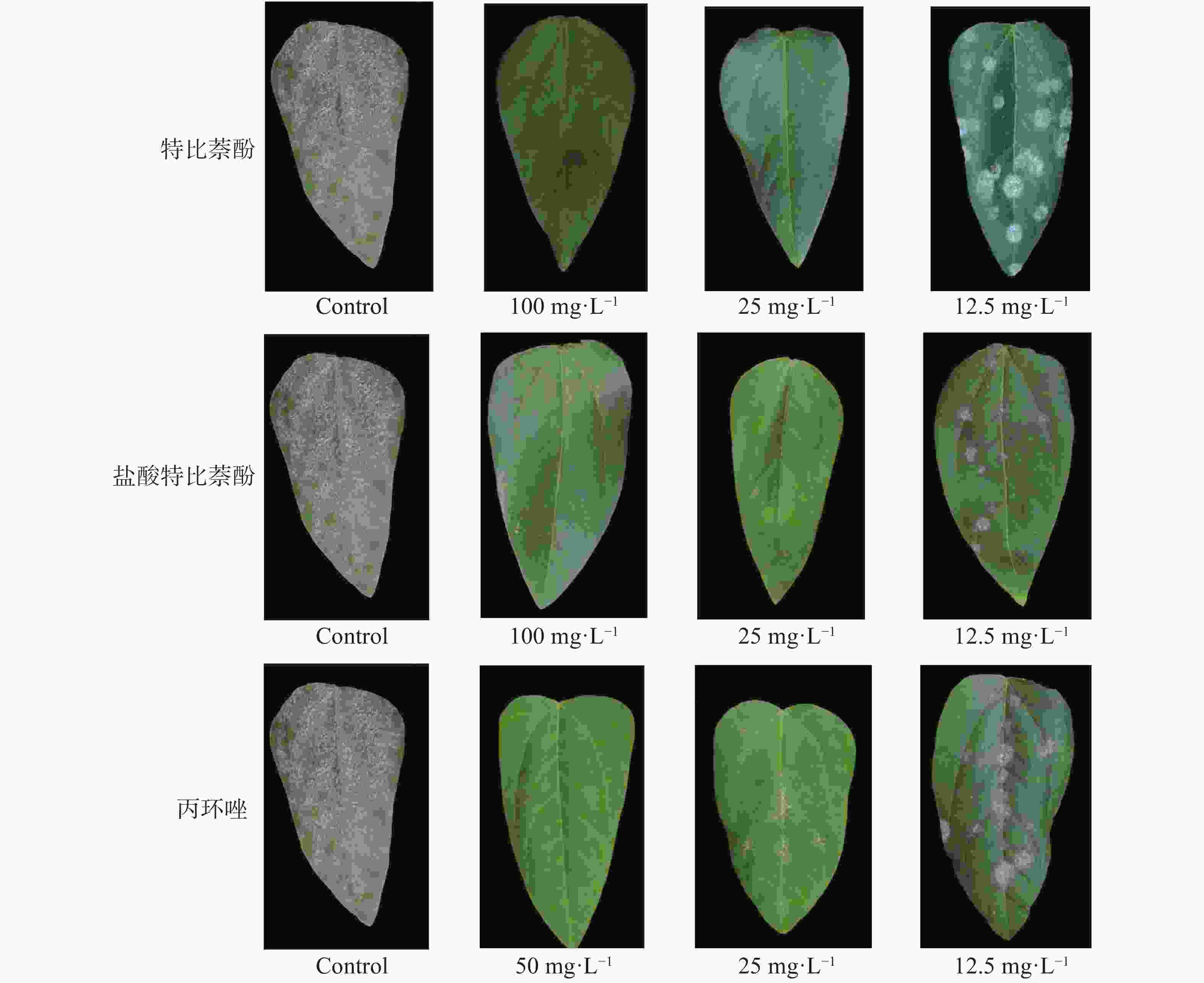
Figure 1. In vivo protective effect of terbinafine and terbinafine hydrochloride microemulsion against Podosphaera xanthii
处理
Treatment浓度/(mg·L−1)
Concentration豇豆白粉病 P. xanthii 发病指数 Disease index 防效/% Control effect 特比萘酚 100 0.00 100.00±0.00a 25 18.43±3.14 80.68±1.41d 12.5 60.16±3.53 36.97±2.69g 盐酸特比萘芬 100 0.00 100.00±0.00a 25 9.14±0.86 90.42±1.43b 12.5 30.41±1.30 68.14±1.04e 丙环唑 50 00.00 100.00±0.00a 25 9.83±2.28 89.70±2.22c 12.5 40.89±2.41 57.16±1.73f 对照 0 95.44±1.33 - Table 3. In vivo protective effect of terbinafine and terbinafine hydrochloride microemulsions against Podosphaera xanthii
采用盆栽喷雾法测定浓度为400、100、25 mg·L−1时,特比萘芬的盐酸特比萘芬溶液对水稻纹枯病、小麦白粉病、大豆锈病和玉米小斑病的防治效果(表4)。由表4可见,特比萘酚和盐酸特比萘酚溶液对4种植物病害均有较好的防效,随着浓度的降低,防治效果逐渐下降,特比萘酚和盐酸特比萘酚溶液对水稻纹枯病菌和小麦白粉病的防效最显著,在400 mg·L−1时,几乎完全抑制了2种真菌病害的侵染,与注册商品杀菌剂嘧菌酯(25 mg·L−1)防效相似;特比萘酚和盐酸特比萘酚溶液对大豆锈病和玉米小斑病的防效较差。采用室内盆栽防效试验测定不用浓度特比萘酚和盐酸特比萘酚溶液对黄瓜靶斑病菌、黄瓜白粉病菌、玉米大斑病菌和番茄灰霉病菌的防治效果(表5)。由表5可见,2种药剂不同浓度对不同的植物病原菌抑制效果不同,特比萘酚和盐酸特比萘酚溶液在浓度为400 mg·L−1时,对黄瓜白粉病和番茄灰霉病的防效与化学杀菌剂乙醚酚(25 mg·L−1)和啶酰菌胺(50 mg·L−1)的防效相似,对黄瓜靶斑病菌和玉米大斑病菌的防效优于化学杀菌剂乙霉威(100 mg·L−1)和咪鲜胺(100 mg·L−1)。
处理
Treatment浓度/(mg·L−1)
Concentration防效/% Control effect 水稻纹枯病菌
R. solani小麦白粉病
B. graminis大豆锈病病菌
P. pachyrhizi王米小斑病菌
B. maydis特比萘酚 25 0.00±0.00f 15.00±0.71f 10.00±1.10e 0.00±0.00f 100 35.00±1.40e 55.00±2.40c 20.00±1.30d 20.00±1.10e 400 90.00±2.60b 100.00±0.00a 70.00±0.70b 75.00±2.30b 盐酸特比萘酚 25 45.00±3.70d 20.00±1.60e 10.00±0.60e 0.00±0.00f 100 60.00±1.50c 40.00±0.80d 30.00±2.10c 35.00±1.70d 400 100.00±0.00a 98.00±2.80b 70.00±2.50b 70.00±1.60c 嘧菌酯 25 100.00±0.00a 100.00±0.00a 100.00±0.00a 100.00±0.00a Table 4. In vivo protective effect of terbinafine and terbinafine hydrochloride solution against four species of phytogenic fungi
处理
Treatment浓度/(mg·L−1)
Concentration防效/% Control effect 黄瓜靶斑病菌
C. cassiicola黄瓜白粉病菌
E. cichoracearum玉米大斑病菌
S. turcica番茄灰霉病菌
B. cinerea特比萘酚 25 25.00±1.20f 15.00±0.60e 0.00±0.00g 65.00±1.00e 100 70.00±1.40c 55.00±1.60b 25.00±1.10d 75.00±3.40d 400 100.00±0.00a 100.00±0.00a 90.00±1.70b 98.00±1.20a 盐酸特比萘酚 25 30.00±1.10e 20.00±1.80d 10.00±2.30f 0.00±0.00g 100 60.00±0.90d 40.00±1.10c 20.00±1.50e 15.00±0.90f 400 100.00±0.00a 98.00±0.80a 95.00±2.20a 80.00±3.10c 乙霉威 100 95.00±3.20b 乙醚酚 25 100.00±0.00a 咪鲜胺 100 85.00±2.00c 啶酰菌胺 50 95.00±1.60b Table 5. In vivo protective effect of terbinafine and terbinafine hydrochloride solution against four species of phytogenic fungi
2.1. 特比萘酚和盐酸特比萘酚对植物病原菌抑菌活性的测定
2.2. 盆栽试验
-
本实验结果表明,特比萘酚和盐酸特比萘芬对植物病原真菌均有良好的抑制作用。在离体条件下,对16种植物病原真菌的EC50均在0.8 mg·L−1以下,其中特比萘酚对6种真菌(山茶灰斑病菌、小麦赤霉病菌、玉蜀黍赤霉病菌、茄链格孢病菌、橡胶炭疽病菌和冬瓜炭疽病菌等)的抑制活性最强,EC50均在0.10 mg·L−1以下;盐酸特比萘酚对4种真菌(山茶灰斑病菌、小麦赤霉病菌、玉蜀黍赤霉病菌和茄链格孢病菌等)的抑制活性最强,EC50均在0.10 mg·L−1以下。盆栽试验中,浓度为100 mg·L−1时,能完全抑制豇豆白粉病的侵染,抑制率均在100%;浓度为400 mg·L−1时,对水稻纹枯病、小麦白粉病、黄瓜靶斑病、黄瓜白粉病和玉米大斑病的抑制效果显著,抑制率均在90%以上,但对番茄灰霉病、大豆锈病和玉米小斑病效果较差,抑制率在70%以上。
特比萘酚和盐酸特比萘芬对皮肤真菌具有高效抗菌作用[14]。特比萘酚和盐酸特比萘芬对抗皮肤癣菌的最低抑菌浓度(MIC)为0.005~0.5 mg·L−1,并且其MIC与最低杀菌浓度(MFC)基本相同;对于杂色曲霉,特比萘芬对杂色曲霉的MIC为0.01~2 mg·L−1,MFC为0.02~4 mg·L−1[15-17]。本实验中特比萘酚和盐酸特比萘芬对植物病原真菌的抑制效果与上述实验结果相似。
三唑类麦角甾醇生物合成抑制剂为农用杀菌剂的优秀代表,因其具有内吸治疗、高效、低毒、杀菌谱广、抗药性风险低等特点,吸引众多农药公司对其进行研究和开发。特比萘酚是丙烯胺类抗真菌药,作用机理是通过抑制真菌的角鲨烯环氧化酶,从而干扰麦角甾醇的生物合成,使真菌细胞内角鲨烯过度堆积和麦角甾醇的合成受阻,最终起到杀菌或抑菌的作用[14]。特比萘酚并不影响细胞色素P450酶系统,因此,并不影响人类激素和相关药物代谢,对人体安全性高[18-19]。以上这些优点对特比萘酚和盐酸特比萘芬在农药安全性方面提供一定的理论支撑。
-
特比萘酚和盐酸特比萘酚对植物真菌病害的抑制效果良好,有的甚至高于现在正在使用的农用商品化杀菌剂嘧菌酯和烯唑醇,且安全性较高,笔者建议拓展其在农作物病害防治上的新用途,实现“老药新用”。







 DownLoad:
DownLoad: