-
烟碱型乙酰胆碱受体(Nicotinic acetylcholine receptors,nAChRs)属于配体门控离子通道,由5个独立的亚基组装而成。在哺乳动物中发现有16种不同的亚基用于nAChRs的构成,分别为α1—α7、α9、α10、β1—β4、δ、ε、γ;鸟类及家禽类动物还含有α8亚基[1]。nAChRs能够传递ACh刺激产生的信号,由于分布广泛,它可介导脑部及其外周的多种生理作用[2-3],并且这些受体结构在许多物种中高度保守,可通过异源表达进行相关研究[4]。虽然nAChRs是研究前景很好的治疗靶点,但由于一些亚型表达困难,相应药物和基础科学的研究进展缓慢,尤其是含有α6亚基的受体,它们在任何重组表达系统中都很难正常表达、形成功能通道[5-6]。这也间接导致α6β4* nAChRs(α6β4或包含其他亚基形成的亚型)在分子水平上与配体相互作用的研究尚不多见。过去有学者认为含α6亚基的nAChRs主要存在于中枢神经系统的儿茶酚胺能神经元中,随着研究深入,研究者们发现α6β4* nAChRs具有可调节人和猴肾上腺嗜铬细胞的胞吐[7-8]、控制小鼠海马去甲肾上腺素的释放等作用[9-10]。目前,α6β4* nAChR被认为是一种治疗神经病理性疼痛的新靶点,且可用于抑制成瘾。已经确定α6β4*亚型的受体在大鼠、小鼠背根神经节(dorsal root ganglia,DRG)中有表达。WIESKOPF等在小鼠上使用表达基因组学鉴定出机械性异常性疼痛与DRG中α6*受体的表达水平有关。通过基因编辑,构建α6*受体功能获得和缺失的突变体,发现基因敲除的小鼠机械性异常性疼痛水平增加,同时与神经性、炎性损伤相关的表现与野生型的受体完全不同,推测是由于在DRG伤害感受器中α6* nAChRs与P2X2/3受体的共表达产生相互作用,抑制疼痛信号的传导,发挥镇痛作用[11-14]。DONVITO等[15]的研究证实,α6β4* nAChRs具有调节THC(∆9-tetrahydrocannabinol,∆9-四氢大麻酚)成瘾后戒断的效果,可作为靶点用于THC戒断药物的开发。以上研究结果为α6β4* nAChRs的药理学研究提供了重要思路,且有助于研究神经病理性疼痛的发病机理。
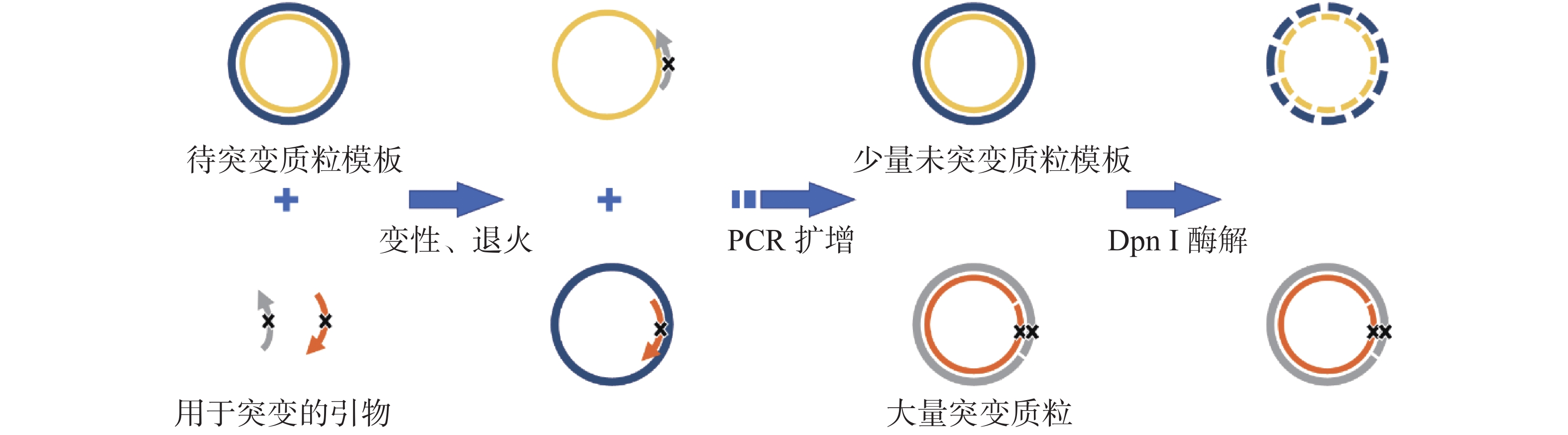
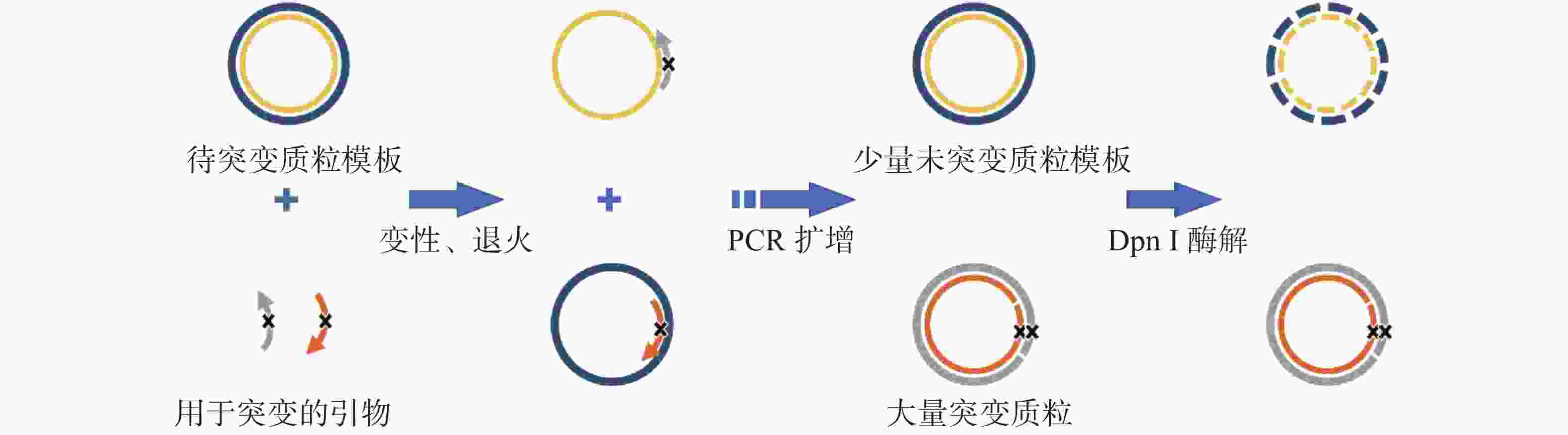
β4亚基在α6β4* nAChRs的功能研究中显示出重要的作用,能够直接影响与配体药物、激动剂的结合活性。通过对比人类和大鼠β4亚基胞外配体结合区序列差异,笔者恰好在形成配体结合口袋的Loop D(54-59)、Loop E(102-118)、Loop F(160-167)附近分别发现52-53,115-116,160-161这3个双差异位点(图1),对于活性影响有较大的可能[16- 17],因此,利用PCR介导的受体定点突变技术,实现一次性将相邻2个位点同时突变,构建了3种双点突变体。将野生型和突变型亚基的DNA通过体外转录的方式得到cRNA,注射入非洲爪蟾卵母细胞内,诱导表达后用双电极电压钳系统检测野生型和突变型nAChRs的表达情况。通过比较野生型和突变型受体对激动剂乙酰胆碱(acetylcholine, ACh)的反应电流值,发现α6/α3β4[S52N,I53V] nAChR在相同浓度ACh刺激下的电流值更大,受体通道的开放程度更高。本研究旨在通过受体结构与功能的研究,找到影响受体敏感度的氨基酸位点,并构建突变体模型,为后续配体与该受体相互作用分子机制的研究打下基础。
HTML
-
雌性非洲爪蟾(Xenopus laevis)购自美国Nasco公司,在实验室饲养1个月以上。饲养用水经过滤、沉淀处理,饲养温度17 ℃。载有大鼠α6/α3、β4 nAChRs亚基基因的质粒来自美国犹他大学。由于α6亚基表达困难,故使用α6/α3嵌合体亚基替代(α6亚基的胞外配体结合域替换α3亚基的对应区域产生的嵌合体,其胞外结合域的结构和功能与α6亚基相同,且对配体的结合活性研究无影响)[18-19],利用该嵌合体构建的α6/α3β4 nAChR能正常表达。
质粒提取试剂盒(FastPure Plasmid Mini Kit)购自南京诺唯赞生物科技有限公司;DNA纯化试剂盒(MiniBEST DNA Fragment Purification Kit Ver. 4.0)、DL 15000 Marker、限制性内切酶Nhe I、Dpn I、Q5超保真聚合酶均购自宝生物工程(大连)有限公司;DNA体外转录试剂盒(mMESSAGE-mMACHINE® T7 Transcription Kit)、RNA 纯化试剂盒(MEGAclearTMTranscription Clean-Up Kit)购自美国Thermo Fisher Scientific公司;DNA marker Ⅳ购自天根生化科技(北京)有限公司;HEPES购自生工生物工程(上海)有限公司;乙酰胆碱(acetylcholine,ACh)、阿托品(Atropine)、胶原蛋白酶 (Collagenase)均购自美国 Sigma-Aldrich 公司;其他生化试剂均为国产分析纯。OR2溶液(NaCl、KCl、MgCl2和 HEPES分别为82.5、2.0、l.0、5 mmol·L−1,pH7.5);ND-96溶液(NaCl、KC1、MgCl2、CaCl2和 HEPES分别为96、2.0、1.0、1.8、5 mmol·L−1,pH7.5)。引物的合成和基因序列的测定由生工生物工程(上海)有限公司完成。
-
超微量分光光度计(Nanodrop 2000,美国Thermo Fisher Scientific公司);PCR仪(Mastercycler X50s,德国Eppendorf);小型水平电泳仪(美国 Bio-Rad);Alpha-2200凝胶成像分析系统(美国 ProteinSimple);Drummond微量注射器(Drummond Scientific,Broomall,PA);KCL-2000A恒温恒湿培养箱(日本EYELA);双电极电压钳放大器AxoClamp 900A,数模转换器Axon Digidata1550B(美国 Molecular Devices)。
-
对比大鼠与人类β4亚基的胞外配体结合域序列,确定3处双突变位点(图1中红色方框圈出的位置)。利用PCR介导的受体定点诱变方法,分别将这3处位点的氨基酸编码序列由大鼠β4亚基替换为人类β4亚基。
使用Primer Premier 5.0软件完成突变位点引物的设计,使正反向引物都携带有突变位点且位于中部,引物长度在25~45 bp之间,保证GC含量大于40%,Tm值大于70 ℃(表1)。
突变位点 Mutant site 突变引物与碱基序列 The sequence of primers (5′→3′) S52N,I53V 正向:CCATTCCTGTTTCAGCCAGACATTGGTGGTCATGATCTGTTCTCGC 反向:GCGAGAACAGATCATGACCACCAATGTCTGGCTGAAACAGGAATGG I115V,Q116L 正向:GGGGGCAGCCACAGGACGCTGCCGTTGG 反向:CCAACGGCAGCGTCCTGTGGCTGCCCCC K160M,S161T 正向:CCATGATGGCCGTGGGCGTCATAAGAACCATGTCAATCTCCG 反向:CGGAGATTGACATGGTTCTTATGACGCCCACGGCCATCATGG Table 1. Primer sequence of β4 subunit mutation
-
将载有大鼠β4亚基DNA序列的质粒作为模板,与诱导突变引物和Q5超保真聚合酶体系按比例混合,采用PCR方法进行定点诱变(图2)。PCR条件如下:50 μL体系,95 ℃预变性120 s;随后95 ℃变性20 s,60 ℃退火10 s,68 ℃延伸阶段3 min,共循环18次;最后68 ℃延伸5 min。PCR反应完成后,在水浴条件下,在PCR产物中加入1 μL Dpn I,37 ℃反应1 h,水解质粒模板。取少量PCR扩增产物在1.0 %琼脂糖凝胶中90 V电压下电泳20 min,观察电泳结果,验证PCR反应成功。取PCR产物3 μL转化DH5α大肠杆菌感受态细胞,将菌液涂布于含有氨苄青霉素的固体平板培养基上,37 ℃下培养14~18 h。每个平板分别挑取5个菌落,转入含有氨苄青霉素的LB液体培养基中,37 ℃、250 r·min−1 培养12~14 h,提质粒后用Nanodrop测定其浓度,并通过1%的琼脂糖凝胶电泳(条件同上)判断其纯度,测序验证插入序列突变情况。
-
选取测序正确的突变体质粒进行酶切线性化反应。200 μL酶切反应体系如下:突变体质粒20 μg(40~60 μL),限制性内切酶Nhe Ⅰ 10 μL,10×M Buffer 20 μL,剩余体积用ddH2O 补齐,37 ℃反应4 h。酶切后使用DNA纯化试剂盒回收线性化产物。回收的线性质粒使用Nanodrop测定其浓度,并通过1%的琼脂糖凝胶电泳判断其纯度。
-
将线性突变体质粒作为模版,使用试剂盒法进行体外转录。20 μL反应体系如下:线性模版2 μg(5~6 μL);2×NTP/CAP 10 μL;10×Rxn Buffer 2 μL;Enzyme Mix 2 μL;剩余体积用无RNA酶的ddH2O 补齐,37 ℃反应 4~6 h。随后在反应液中加入1 μL Dnase,反应30 min,酶解DNA模版。使用RNA纯化试剂盒回收cRNA产物,Nanodrop测定其浓度,并通过1%的琼脂糖凝胶电泳验证。
-
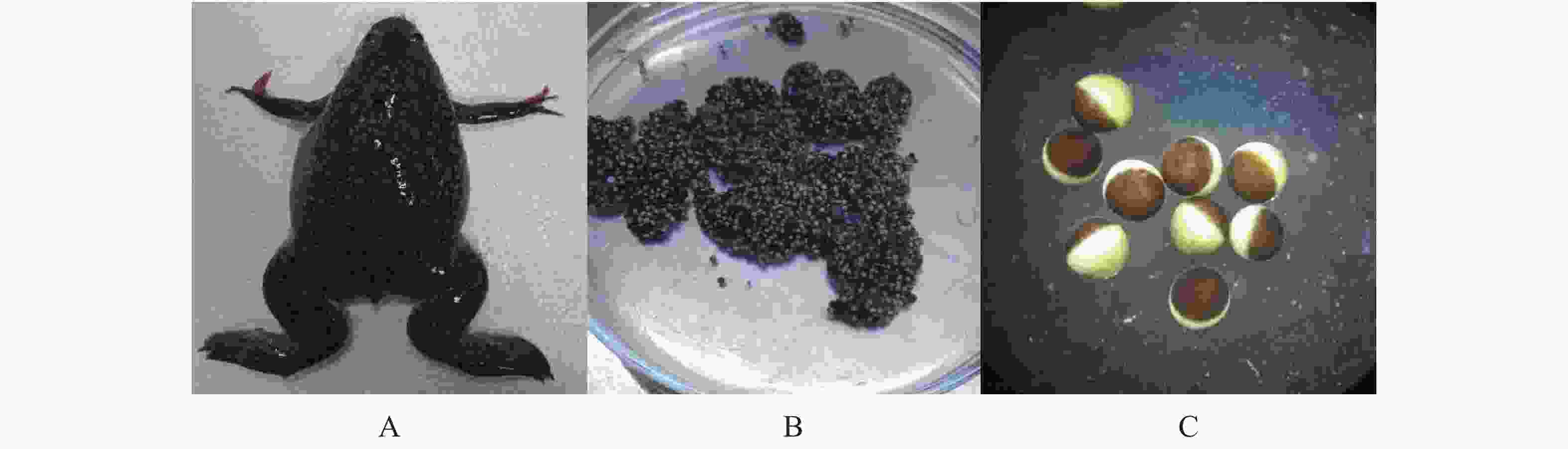
选取状态良好的成熟雌性非洲爪蟾,冰冻麻醉1 h,用手术刀在腹侧剖开小口,取出卵母细胞团块。剪碎团块,使用OR2溶液清洗至澄清。将卵母细胞转移至含有0.5 g·L−1 胶原蛋白酶的OR2溶液中酶解,室温下反应40~50 min,使其完全分离成为互不粘连的单个细胞,再用OR2溶液清洗至少10次后,挑选形态正常饱满的卵母细胞转入含抗ND-96溶液中,在17 ℃、湿度35%的条件下继续培养。
卵母细胞在获取24 h后用于显微注射,实验方法参考熊洋等[20]对α6/α3β4表达研究的优化结果,将野生型或突变型α6/α3与β4 nAChRs亚基的cRNA以1∶1的比例混合,每个亚基的终浓度≥500 ng·μL−1。将混合后的RNA以每个59.8 nL的体积显微注射入非洲爪蟾卵母细胞,在17 ℃、湿度35%条件下继续培养(图3)。
-
显微注射后2~5 d 使用双电极电压钳检测卵母细胞上受体的表达情况。设置钳制电压为−70 mV,灌流速度2~4 mL·min−1,记录ACh刺激细胞产生内向电流的情况。详细过程如下:每个循环总时长60 s,首先给予2 s Ach脉冲刺激,随后使用含有0.1 g·L−1 BSA的ND-96缓冲液灌流冲洗,每个记录程序含3次循环。数据记录软件为pClamp 11.0.3,采样模式为Episodic stimulation,采样频率为Slow 200 Hz。
-
使用不同浓度的ACh作为激动剂(1、10、50、100、250、500 μmol·L−1 和1 mmol·L−1)刺激受体通道开放,检测并记录产生的内向电流值。以1 mmol·L−1 ACh 刺激产生的内向电流作为基准,计算其他浓度的ACh(1~500 μmol·L−1)刺激通道开放的反应率。每组实验数据至少在不同卵母细胞上重复3~6次。所得数据导入GraphPad Prism 6.0 软件使用非线性拟合方程:Response%=100/{1+(EC50/[agonist])nH}。式中Response代表反应率,agonist代表激动剂的内向电流值,nH代表Hill系数,分析拟合并作图。
1.1. 材料与试剂
1.2. 仪器
1.3. 突变体引物设计
1.4. PCR介导的定点突变
1.5. 突变体质粒酶切及回收
1.6. 突变体RNA的制备
1.7. 受体在非洲爪蟾卵母细胞上表达
1.8. 受体功能检测
1.9. 数据统计分析
-
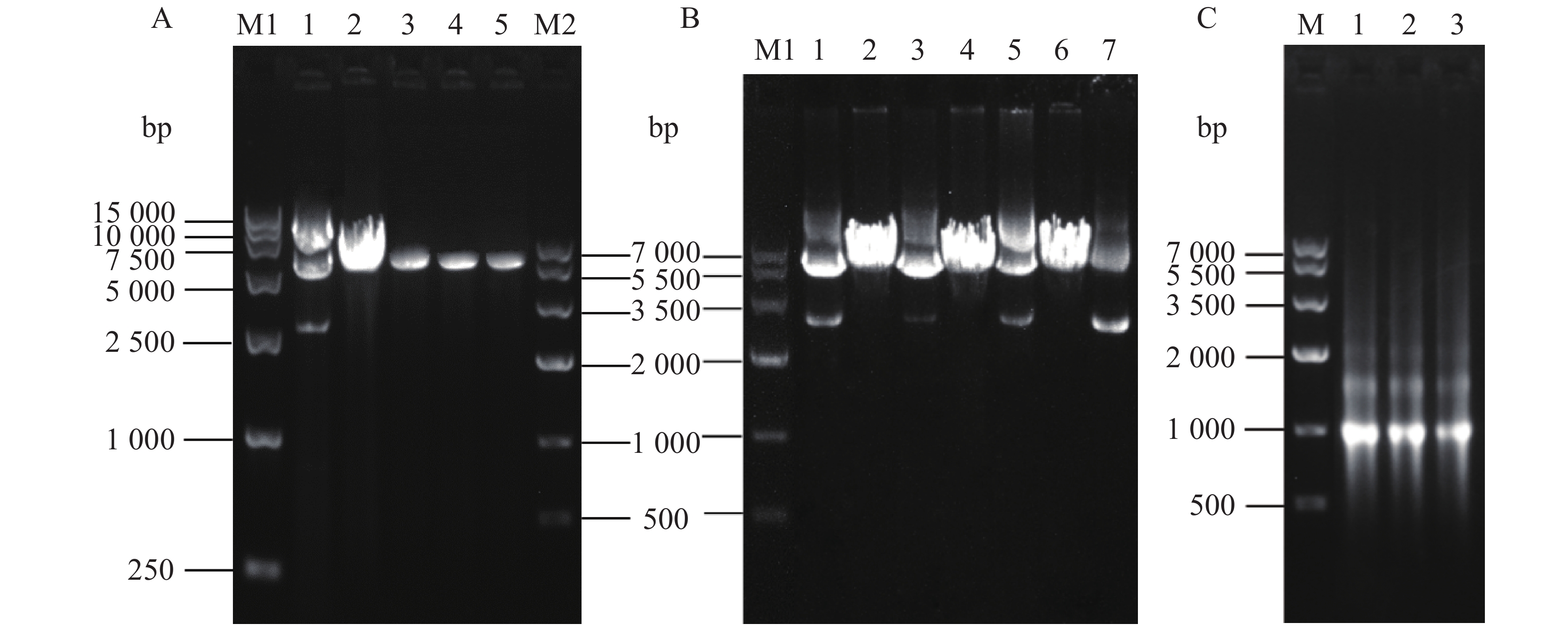
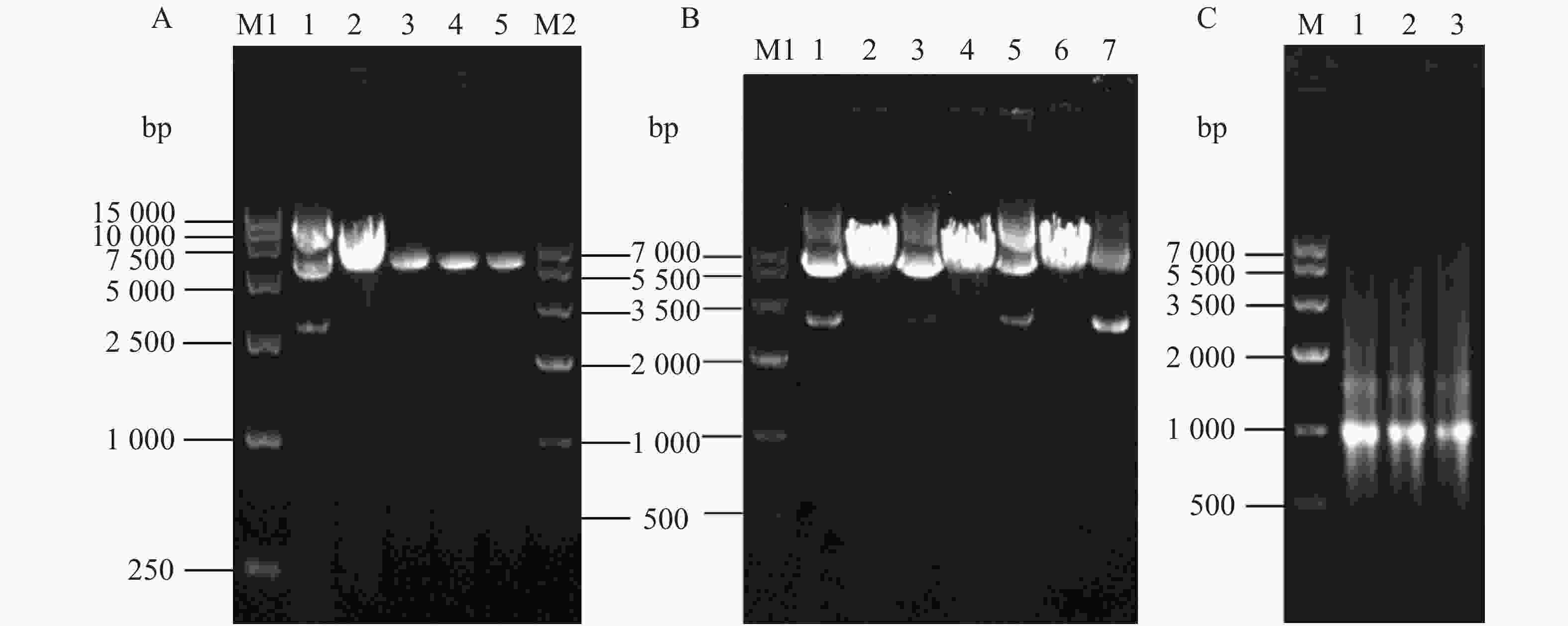
琼脂糖凝胶电泳结果表明,经PCR后,3种突变体基因均有条带产生(图4-A胶孔3、4、5),与线性质粒模板(图4-A胶孔2)的位置一致,可以将PCR产物用于转化实验。
-
使用质粒提取试剂盒提取突变质粒,所得结果经超微量分光光度计测得浓度(表2)。琼脂糖凝胶电泳结果验证质粒纯度良好。插入基因测序结果使用NCBI网站中的BLAST在线序列比对验证,证实3个突变体质粒均构建成功。将测序正确的β4突变体质粒与本体质粒分别进行酶切反应,琼脂糖凝胶电泳验证。环状质粒(图4-B胶孔1、3、5、7)因呈超螺旋结构,在琼脂糖凝胶中空间位阻小,所以移动更快。而线性化的质粒(图4-B胶孔2、4、6)移动较慢。电泳结果中线性化质粒对应泳道在环状质粒对应位置已无条带,证明酶切完全。经超微量分光光度计测得浓度与A260/280值(表2),均在正常范围内,可进行后续实验。
质粒 Plasmid 浓度 /(g·L−1) Concentration A260/280 线性质粒 Linear plasmid 浓度 /(g·L−1) Concentration A260/280 S52N, I53V 0.247 5 1.86 S52N, I53V 0.288 2 1.88 I115V, Q116L 0.240 3 1.86 I115V, Q116L 0.291 1 1.88 K160M, S161T 0.231 5 1.85 K160M, S161T 0.226 5 1.86 Table 2. Mutant plasmid and linear plasmid concentration and A260 /280
-
测定体外转录获得的cRNA浓度(表3),均达到500 mg·µL−1。琼脂糖凝胶结果显示,图4-C中胶孔1、2、3相同高度均有对应的较为清晰明亮的条带,证明体外转录成功,可用于下一步卵母细胞显微注射。
突变位点
Mutant sitecRNA浓度 /(g·L−1)
ConcentrationA260/280 S52N, I53V 0.5915 2.08 I115V, Q116L 0.7097 2.07 K160M, S161T 0.5867 2.08 Table 3. Mutant cRNA concentration and A260/280
-
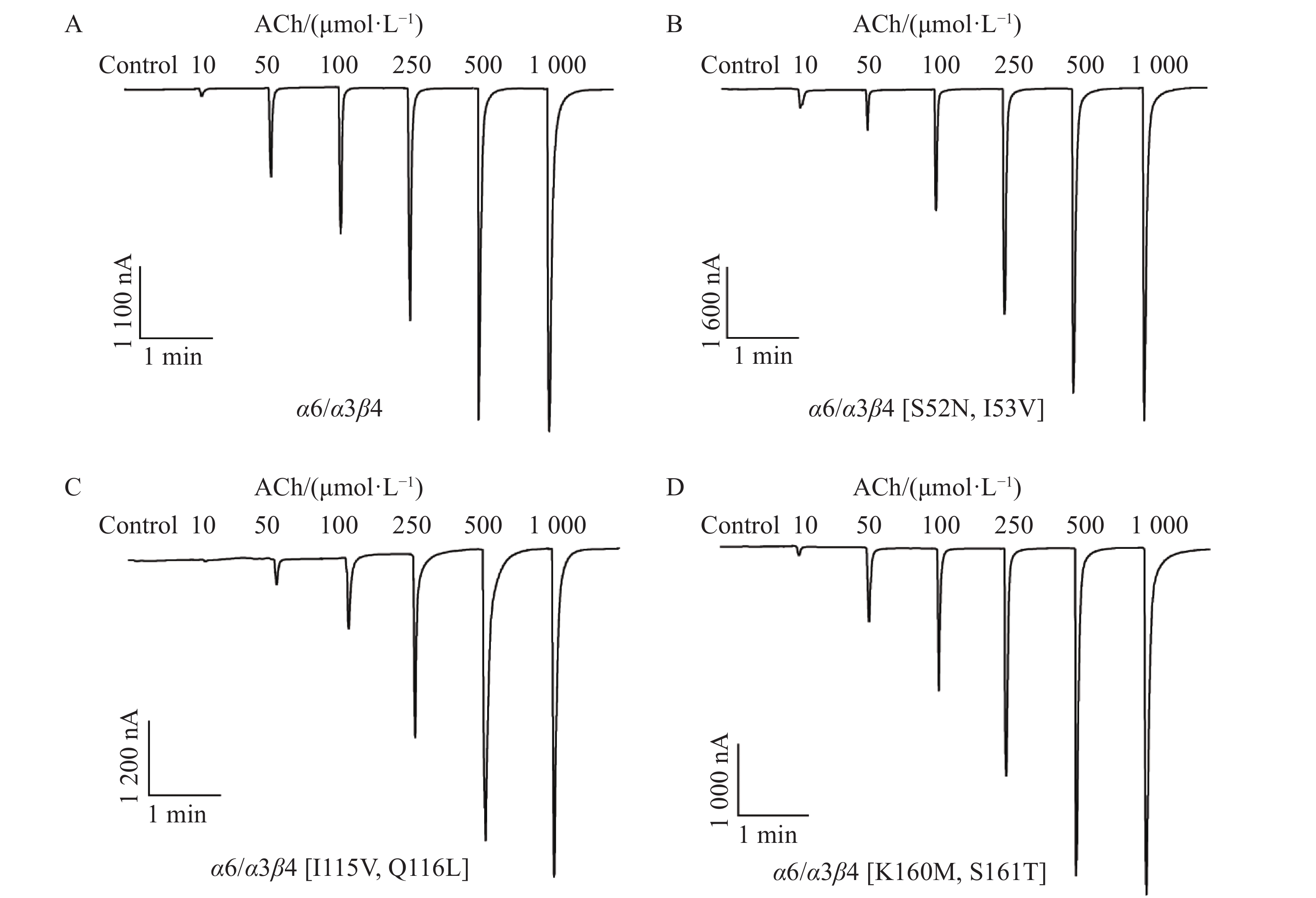
使用双电极电压钳对野生型和3种突变型受体的功能进行检测。α6/α3β4[S52N, I53V]突变型的受体与其他几种相比,表达时间略有提前,在注射后的第3天即达到正常水平。另外2种突变型与野生型的受体表达时间无明显的差异,均在第4天达到正常水平。结果表明,ACh浓度为1 μmol·L−1时均无电流产生,未达到产生内向电流的最小刺激强度。随着ACh浓度的增大,受体接受ACh刺激产生的电流值也随之增大,呈现出先快后慢的变化趋势。对比图5中A、B、C、D的电流轨迹图,突变受体与野生型对ACh的敏感程度相当,可以初步判断,突变并未影响受体的基本结构及功能。当给予相同浓度ACh刺激时,突变型α6/α3β4[S52N, I53V] nAChR相比于野生型和其他的突变型,电流值明显更大,推测是α6/α3β4[S52N, I53V] nAChR离子通道的开放水平更高。

Figure 5. Current traces of wild-type and mutant α6/α3β4 nAChR evoked by different concentrations of ACh
使用Graphpad Prism 6.0软件对测定结果进行分析,绘制浓度−反应率曲线图,并计算受体对ACh刺激的EC50。对比图6中A、B、C图中的曲线,结果表明,野生型与突变型受体的变化趋势相似。野生型α6/α3β4 nAChR 的EC50是突变型α6/α3β4[S52N, I53V] nAChR的2倍(表4),证明52、53位双点突变,对ACh的激动活性有一定的提升,使α6/α3β4 nAChR与ACh结合后离子通道的开放程度增加。
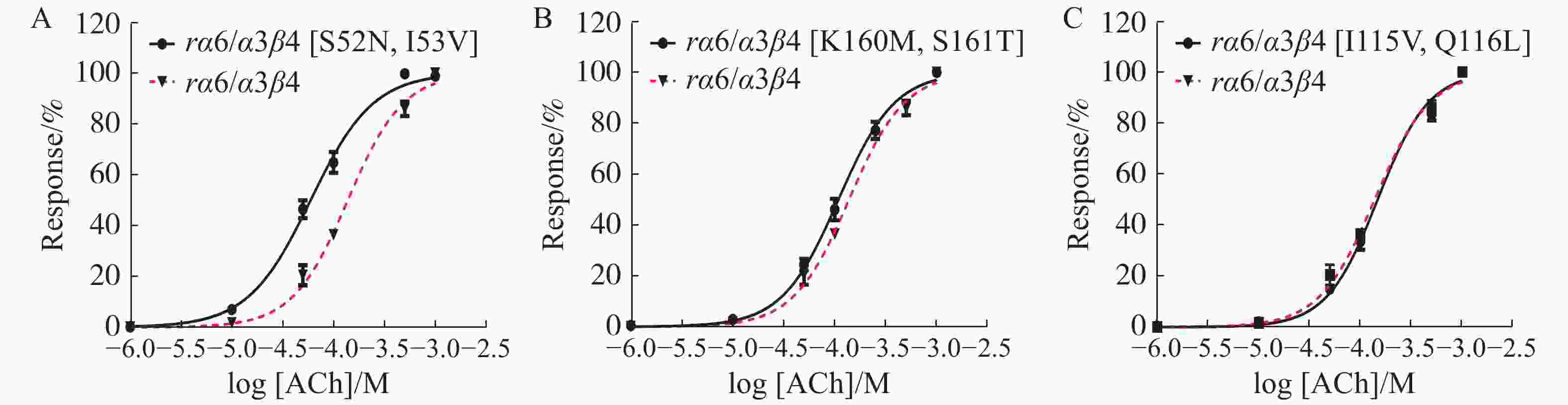
Figure 6. Concentration response curve of wild-type and mutant α6/α3β4 nAChR to the agonist ACh Mean ± SEM, n=3~6.
受体名称 EC50/ (μmol·L−1) (95% CI) 与α6/α3β4的比值 Hill slope (95% CI) α6/α3β4 138.2 (127.1~150.2) 1 1.592 (1.395~1.790) α6/α3β4[S52N, I53V] 59.58 (53.07~66.89) 0.4 1.407 (1.156~1.658) α6/α3β4[I115V, Q116L] 147.8 (134.6~162.4) 1.1 1.727 (1.490~1.974) α6/α3β4[K160M, S161T] 108.8 (127.6~185.8) 0.8 1.567 (1.276~1.858) 注:EC50值、95% CI (95% confidence interval)、Hill slope(nH)等数据来自浓度−反应曲线图;所有数据来源于至少3个不同的非洲爪蟾卵母细胞。
Note: EC50 value, 95% CI (95% confidence interval), Hill slope (nH) and other data are from the concentration response curve; All data were derived from at least three different Xenopus oocytes.Table 4. Median effective concentration (EC50) of wild type and mutant α6/α3β4 nAChRs for ACh stimulation
2.1. PCR诱导的定点突变琼脂糖电泳结果
2.2. 质粒提取与酶切结果
2.3. cRNA的制备
2.4. 野生型及突变型α6β4* nAChR的功能检测
-
α6β4*作为一类特殊的nAChRs受到广泛关注,但含α6亚基nAChRs的异源表达却十分困难。烟碱型乙酰胆碱受体与配体结合的主要结构位于细胞膜外的N-端结合域,通过基因改造,构建α6/α3的嵌合体可以辅助受体正常表达,不影响受体的功能活性。
本研究比较了人类和大鼠的α6和β4两种亚基的胞外N-端结合域的序列,发现人类和大鼠α6亚基的同源性较高,而β4亚基的种属差异性更大。芋螺毒素是一类作用于nAChRs的小分子多肽,可以作为分子探针,研究配体与受体结合的关键位点。HONE等进行了人类(Human)和大鼠(Rat)α6/α3和β4亚基的混合表达实验,构建了Hα6/α3Hβ4、Rα6/α3Rβ4、Hα6/α3Rβ4和Rα6/α3Hβ4这4种受体,并选取3种作用于α6/α3β4 nAChR的芋螺毒素PeIA、PnIA和TxIB作为拮抗剂,分别比较配体对突变受体的阻断作用。结果显示,这3种芋螺毒素对受体的阻断作用具有一致性,由强到弱依次为Hα6/α3Hβ4> Rα6/α3Hβ4> Hα6/α3Rβ4> Rα6/α3Rβ4。该实验从一定程度上说明β4亚基对α6/α3β4 nAChR的配体识别和选择具有重要作用[21]。
本实验利用受体定点突变技术对大鼠β4亚基非保守残基进行受体突变,将其替换人类β4亚基相同位置处的残基,对比序列发现有3处位点均为相邻2个残基的差异。将2个差异位点均设计在突变引物内,经一次突变即得到具有相邻2个残基差异的突变受体,大大缩短了突变体构建的时间,并且为后续大鼠和人类α6/α3β4 nAChR对芋螺毒素活性差异关键位点的筛选,构建了3个双点突变体模型。
在对突变体进行电生理活性检测中,电流值的大小和变化趋势与野生型受体均相似,表明受体基本的结构和功能保持不变。而观察ACh浓度-反应率曲线图,其中1种突变体α6/α3β4[S52N, I53V]相比于野生型,对ACh敏感性更高,EC50值仅为本体的一半。并且在标准浓度(100 μmol·L−1)ACh下,突变体α6/α3β4[S52N, I53V]产生的激发电流值更大。推测可能是由于52位由丝氨酸变为天冬酰胺后更易形成氢键,而53位由异亮氨酸到缬氨酸的改变,导致其空间位阻减小,使得在与ACh结合时,通道的敏感性增加,且开放程度增大。由于在β4亚基上人类和大鼠还存在其他差异位点,因此,α6/α3β4 nAChR对于激动剂ACh和拮抗剂芋螺毒素活性的关键氨基酸位点还有待研究。








 DownLoad:
DownLoad: