-
柱花草(Stylosanthes Sw.)又称巴西苜蓿、热带苜蓿等,柱花草是我国热带、亚热带地区栽培的主要豆科牧草,具有干物质产量高、粗蛋白含量高等特点,被广泛应用到反刍动物饲料中[1-3]。中国南方如广东、广西等省(区),将柱花草与果树间种,柱花草除用作饲草外,还可起到覆盖、保持水土和绿肥作用[4]。中国热带农业科学院自20世纪60年代起从国际热带农业研究中心(Centro International Agriculture Tropicals, CIAT)等地引进柱花草种质,先后培育了‘热研2号’(Stylosanthes guianensis ‘Reyan No.2’)、‘热研5号’(Stylosanthes guianensis ‘Reyan No.5’)等优良柱花草品种13个[5]。近年来,柱花草的根部和叶部病害日益严重,严重影响了柱花草的产量和品质[6-8],因此,开展柱花草的增产促生作用研究具有一定的实际意义。
微生物通过调节生物地球化学循环、有机质重组和矿化的多种酶活性改善土壤条件[9]从而在维持土壤的健康和促进健康土壤的形成中发挥重要作用。近年来,微生物对植物的促生作用逐渐引起科研人员的关注,正在成为应用微生物研究领域的热点。植物根际促生菌(Plant-growth-promoting rhizobacteria,简称PGPR)是指能够促进植物生长、增加作物产量、防治病虫害的有益细菌。根际促生菌对植物生长促进的机制可分为直接和间接2种方式。直接的促生作用是指PGPR能产生一些生长促进物质,如生长激素和铁载体等,供植物利用,促进植物对营养物质的吸收;间接的促生作用是指PGPR通过对病原微生物的生物防治,减轻或抑制有害微生物,从而间接促进植物生长[10-11]。有研究表明,放线菌除具有很好的生防作用外,也能通过产生长素,溶解磷酸盐,产生铁载体等方式促进植物生长[12-13]。本实验室在前期实验中分离得到4株对土传病害具有良好防效的内生放线菌NM2、NM3、NM17和NM24。笔者以柱花草为供试植物,采用皿内测定法和盆栽实验法,研究本实验室在前期实验中分离得到的4株放线菌对柱花草形态指标和生理生化指标的影响,旨在探究4株放线菌对柱花草的促生长作用及柱花草的增产机制。
HTML
-
供试内生放线菌分别为娄彻氏链霉菌(Streptomyces roche,代号NM2、NM3)和密旋链霉菌(Streptomyces pactum,代号NM17、NM24),由海南大学植物保护学院农药研究室保存并提供。
-
按照文献[14]的方法制备高氏1号培养基:可溶性淀粉(20 g),KNO3(1 g),K2HPO4(0.5 g),MgSO4·7H2O(0.5 g),NaCl(0.5 g),FeSO4·7H2O(0.01 g),琼脂(16 g),蒸馏水1 L, pH=7.2~7.4,121 ℃灭菌20 min。分别配制4种供试放线菌的孢子悬浮液(109 cfu·mL−1),并按10%接种量分别接种在高氏1号培养液中,28 ℃,160 r·min−1振荡培养5 d。分别取振荡培养5 d的发酵液300 mL,经8 000 r·min−1离心10 min后,将上清液经0.22 μm滤膜过滤制得发酵液原液。将原液用无菌水稀释成10倍、50倍、100倍的发酵液,与原液一同备用;
-
柱花草种子由中国热带农业科学院品质资源研究所提供。精选均一且颗粒饱满无破损的柱花草种子,用1%高锰酸钾表面消毒,再用无菌水冲洗3次后,用温烫法催芽直到种子露白(备用)。盆栽所用土壤(采自海南大学植物保护学院教学基地)过筛并进行干热灭菌。
-
皿内测定方法在文献[15]的方法上做一定的修改:取10粒称质量后的露白柱花草种子放入直径为9 cm铺有滤纸的培养皿内,沿培养皿边缘每天同一时间分别加入3 mL供试菌株,用无菌水稀释成10倍、100倍的发酵液,在日夜温度[(18±2) ℃~(25±2) ℃]下进行,每天自然光照为10 h,培养4 d。分别以无菌高氏1号液体培养液和无菌水为对照,每个处理重复3次。
-
盆栽实验于2019年11−12月在海南大学植物保护学院实验教学基地进行。温室条件:28 ℃、湿度70%、自然光照。将催芽露白的柱花草种子均匀放置于装满灭菌土壤的盆钵里,再覆盖1层无菌土。出苗后第5天移植于装有1 400 g土的培养钵中,每处理30株。每株放线菌对柱花草促生长实验设3个处理,3个处理为分别淋施发酵液原液、10倍稀释发酵液、50倍稀释发酵液,对照为分别淋施无菌高氏1号液体培养液和无菌水,实验共设12个处理组,2个对照组,每处理3次重复。间苗时尽量使各培养钵内幼苗间隔一致。从拌土种植后连续3次每隔7 d浇灌处理液50 mL,以维持和加强放线菌的作用。
-
皿内测定法实验:待无菌水处理的种子根和茎出现明显区分时,测量幼苗培养前后的质量,计算净增重值、茎长、根长。盆栽实验:第3次浇灌7 d后取样,测量形态指标,包括幼苗鲜质量、幼苗株高;生理生化指标,包括叶绿素总含量[16]、可溶性糖含量(蒽酮法)[17]、可溶性蛋白质含量(考马斯亮蓝法测定)[18]、根系活力强度(TTC法)[19]。
-
采用SPSS 22.0进行数据差异性分析,其中使用单因素方差分析法(ANOVA)分析数据,并使用LSD进行多重比较分析。各项数据均以平均值±标准差(Mean ± SD)表示。采用OriginPro 2018C软件作图。
1.1. 供试菌株
1.2. 制备供试放线菌的孢子悬浮液
1.3. 种子与土壤
1.4. 柱花草皿内测定法实验
1.5. 盆栽实验
1.6. 生物性状测定
1.7. 数据处理
-
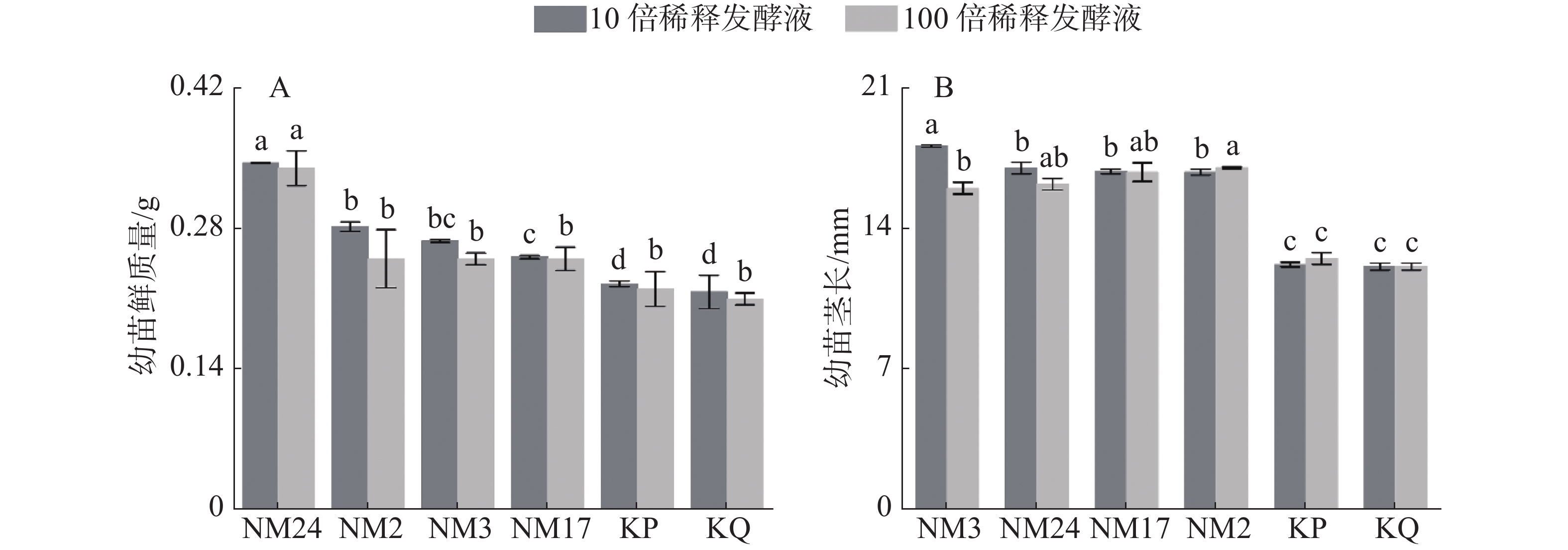
由图1可见,与无菌水对照组(KQ)和无菌高氏1号液体培养液对照组(KP)相比,4株放线菌发酵液在不同稀释浓度下均能促使幼苗鲜质量增加和茎的伸长,其中,放线菌NM24的发酵液在稀释10倍和稀释100倍后均可显著提高幼苗的鲜质量;与KP相比,在稀释10倍条件下,放线菌NM3、NM24、NM17和NM2促进茎的伸长百分比依次为48.34%、39.34%、38.01%和37.70%,稀释100倍条件下则为28.00%、29.60%、34.40%和36.25%;与KQ相比,在稀释10倍条件下,放线菌NM3、NM24、NM17、NM2促进茎的伸长百分比依次为49.56%、40.50%、39.15%和38.84%,稀释100倍条件下则为32.23%、33.88%、38.84%和40.75%,差异显著。
-
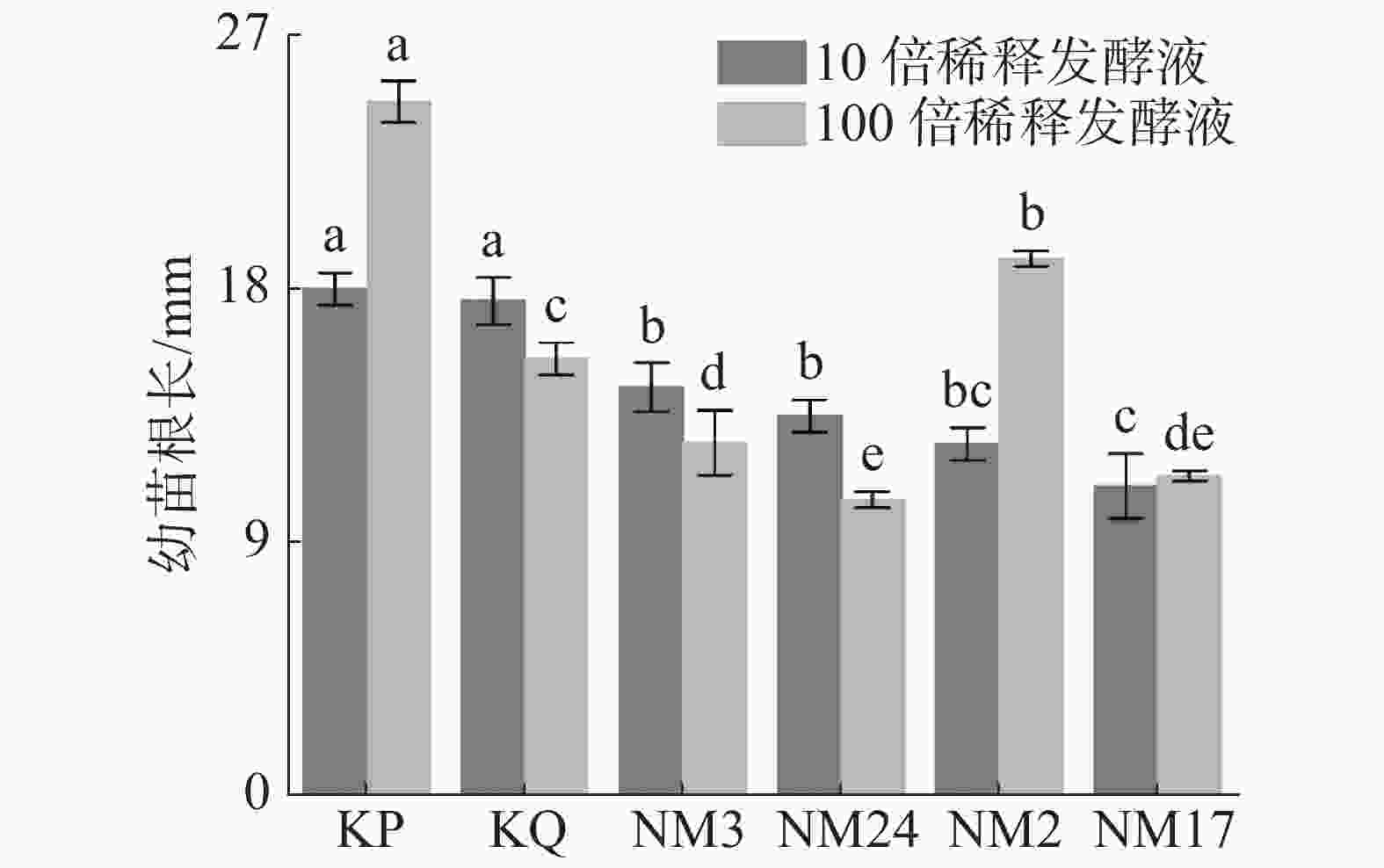
由图2可见,经放线菌发酵液处理后的柱花草幼苗根长的伸长生长与无菌水对照组(KQ)和空白培养液对照组(KP)相比,均受到不同程度的抑制作用,菌株NM2和NM17的抑制随发酵液浓度的降低而减弱。
-
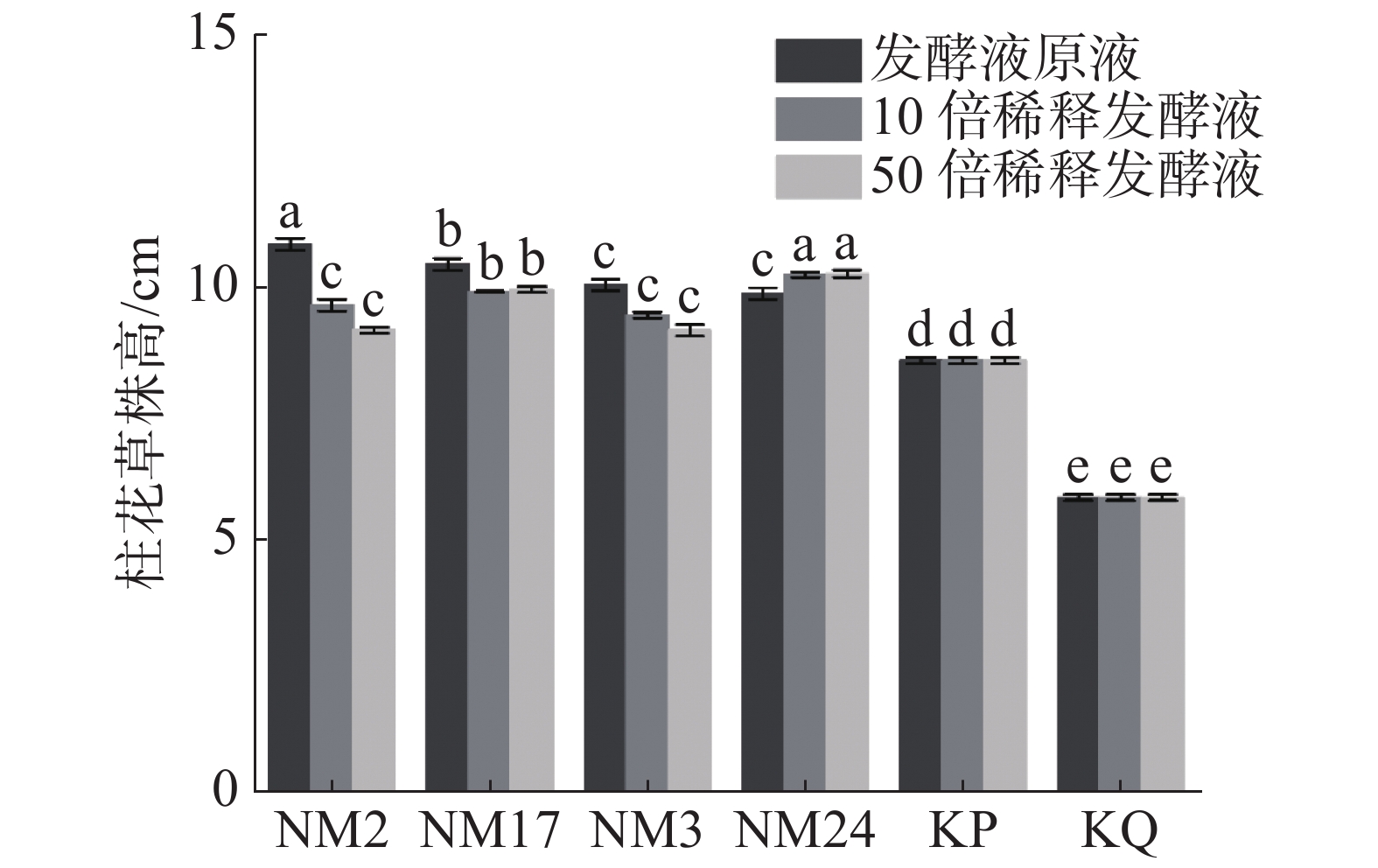
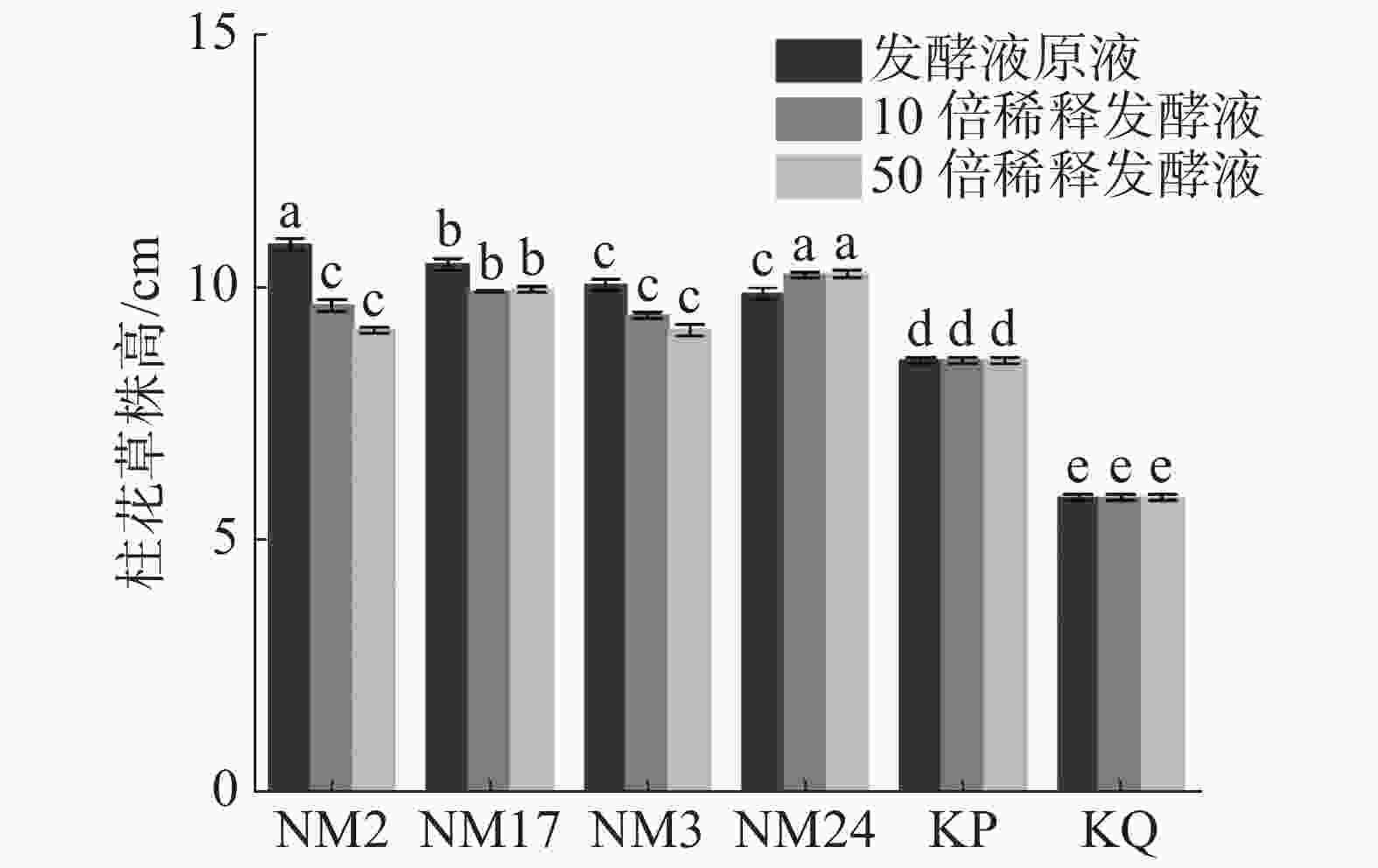
盆栽实验结果(图3)表明,经放线菌发酵液处理后的柱花草幼苗株高,与无菌水对照组(KQ)和培养液对照组(KP)相比有所增加。其中,与对照组(KP、KQ)相比,4株放线菌不同浓度的发酵液对柱花草的促进作用均达到显著水平,其中,放线菌NM2、NM3和NM17随发酵液浓度降低,对柱花草株高的促进作用减弱;放线菌NM24对柱花草株高的促进作用随发酵液浓度降低呈现增加趋势。
-
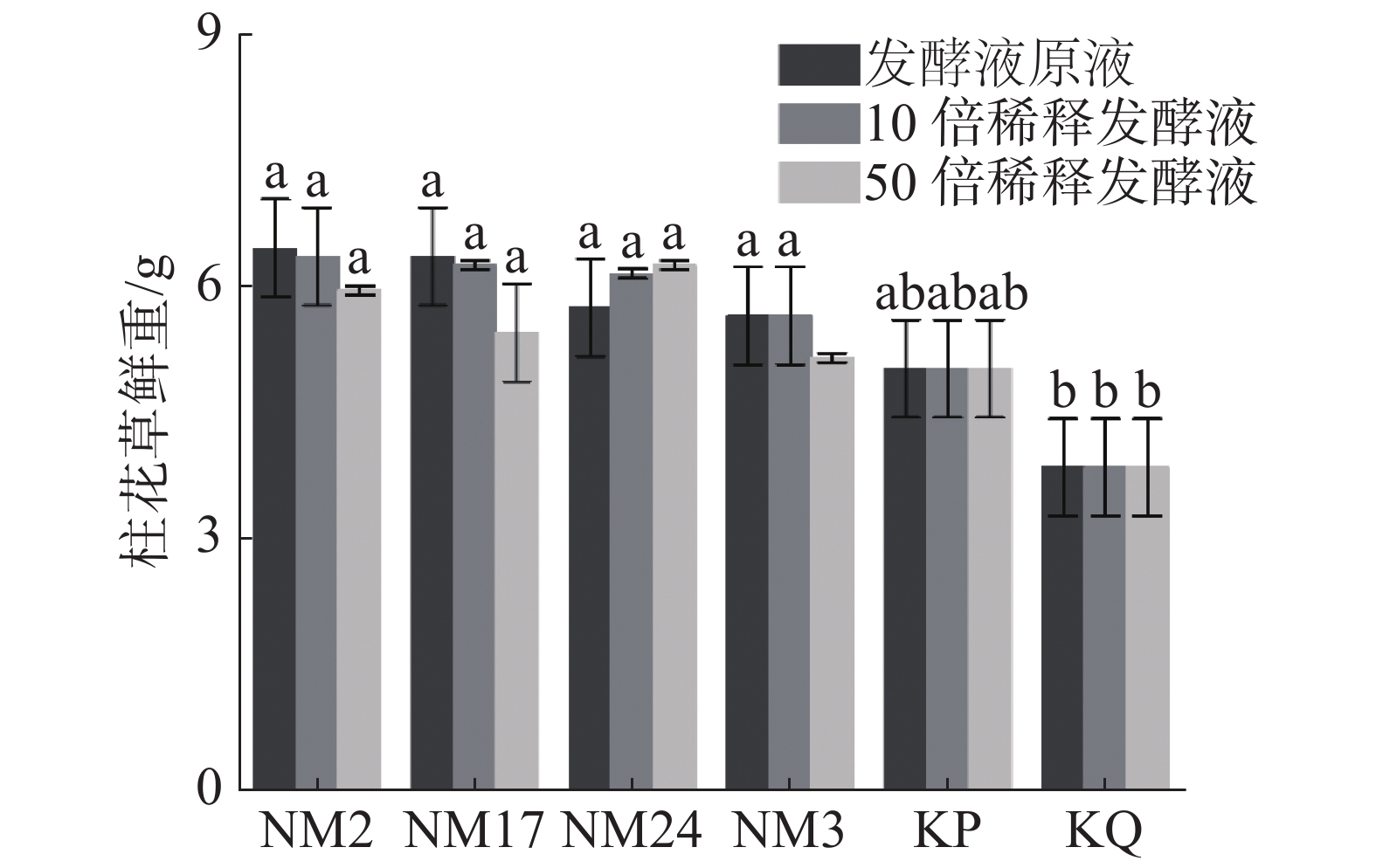
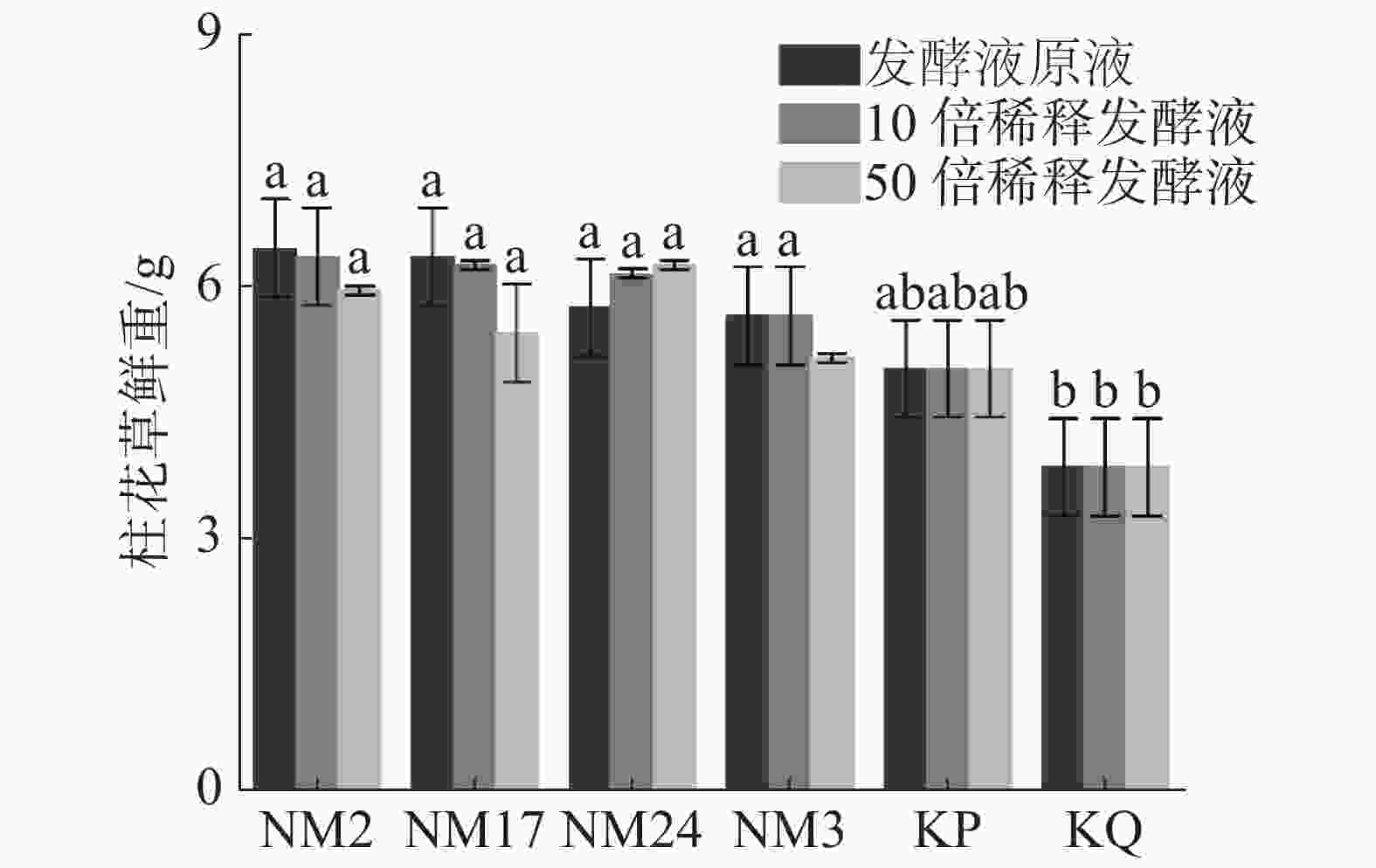
由图4可见,经过放线菌发酵液处理后的柱花草幼苗鲜质量,与无菌水对照组(KQ)和空白培养液对照组(KP)相比有所增加。与无菌水对照组(KQ)相比,4株菌株的发酵液原液、10倍稀释发酵液和50倍稀释发酵液处理都显著增加柱花草幼苗鲜质量。其中,在发酵液原液浓度下,放线菌NM2、NM17、NM24和NM3对柱花草鲜质量增加百分比在发酵液原液浓度下依次为67.53%、64.94%、49.35%和46.75%;在10倍稀释液条件下依次为64.94%、62.34%、59.74%和46.75%;在50倍稀释液条件下依次为54.55%、41.56%、62.34%和33.77%。与培养基对照组相比,差异并不显著,推测可能是培养液中含有一些柱花草生长需要的营养物质对柱花草鲜质量的变化产生了影响。
-
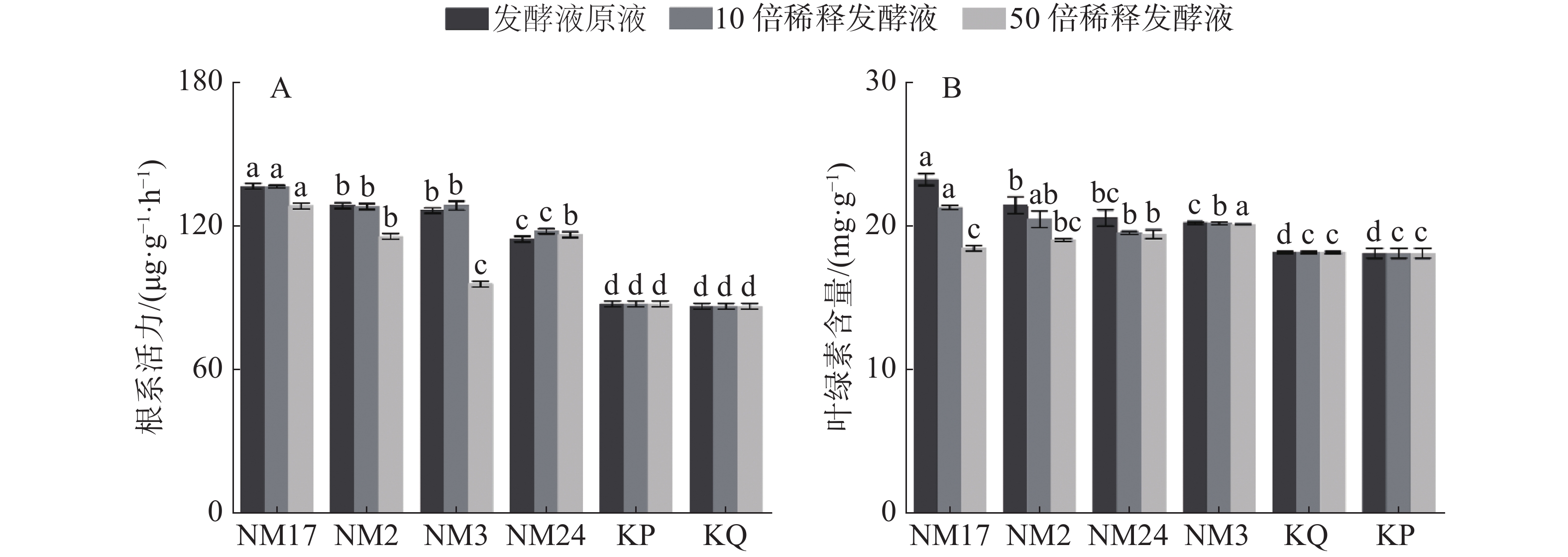
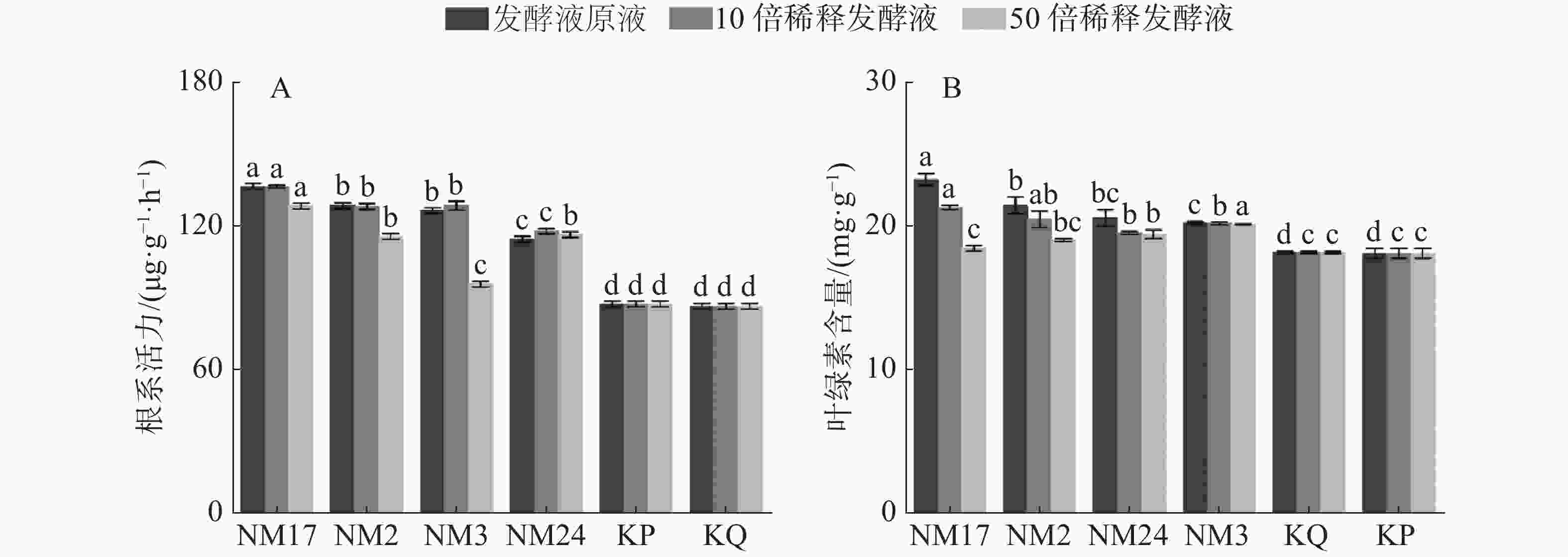
经放线菌发酵液处理后的柱花草幼苗根系活力和叶绿素含量的测定结果(图5)表明,与无菌水对照组(KQ)和空白培养液对照组(KP)相比,4株放线菌发酵液均显著提高了柱花草的根系活力(图5-A),且菌株NM2、NM3和NM17随发酵液浓度降低,根系活力呈现减弱的趋势;在叶绿素含量结果中(图5-B),与无菌水对照组(KQ)和空白培养液对照组(KP)相比,4株放线菌发酵液原液和10倍稀释液都显著增加了柱花草的叶绿素含量,且随着发酵液浓度降低,增加效果减弱。其中,与KQ相比,放线菌NM17、NM2、NM24和NM3对柱花草叶绿素含量增加百分量在发酵液原液浓度下依次为27.84%、18.13%、13.19%和11.36%;在10倍稀释液条件下依次为17.21%、12.64%、7.51%和11.17%;与KP相比,放线菌NM17、NM2、NM24和NM3对柱花草叶绿素含量增加百分量在发酵液原液浓度下依次为28.33%、18.59%、13.62%和11.79%;在10倍稀释液条件下依次为17.67%、13.07%、7.93%和11.60%。
-
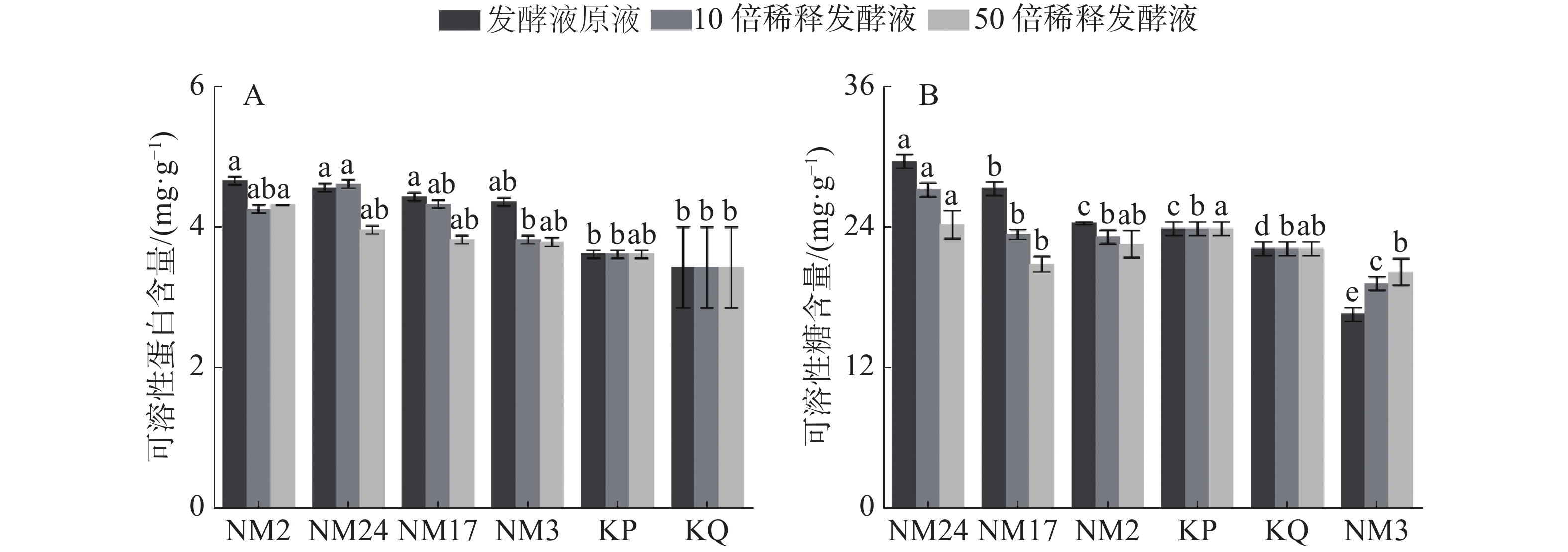
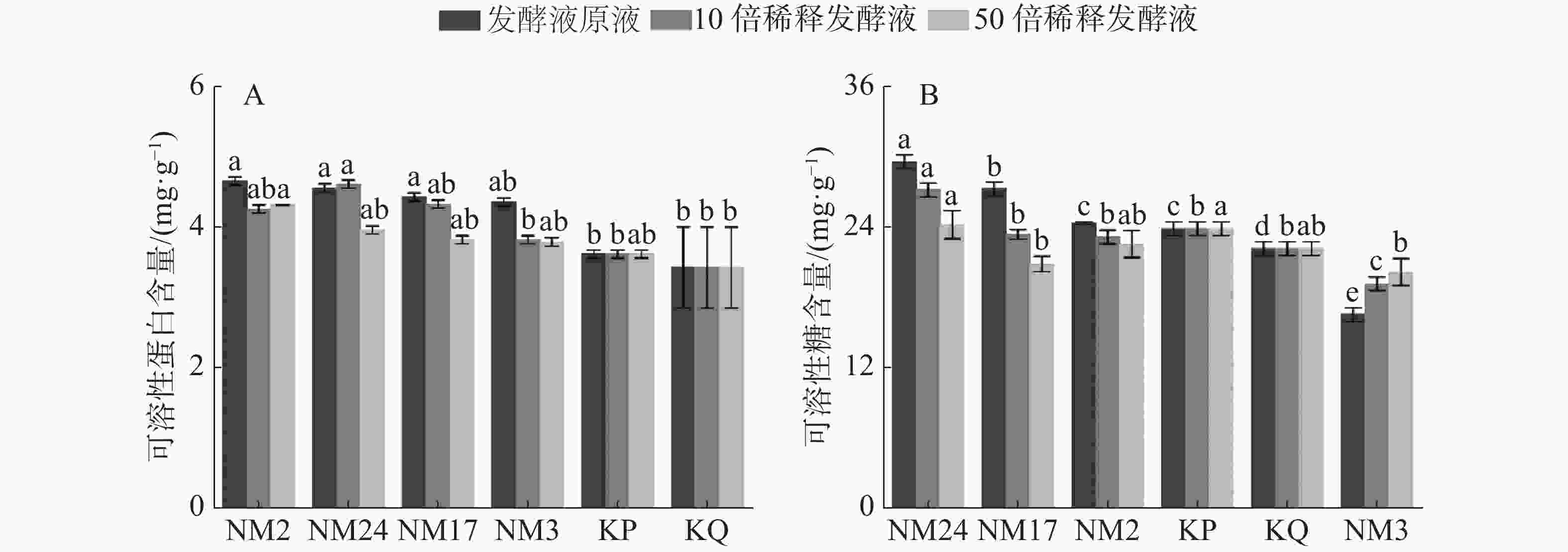
经过放线菌发酵液处理后柱花草幼苗可溶性蛋白和可溶性糖含量的测定结果(图6)表明,与无菌水对照组(KQ)和空白培养液对照组(KP)相比,淋施放线菌不同稀释浓度的发酵液均相应提高了柱花草的可溶性蛋白含量(图6-A),其中,与KQ相比,放线菌NM2、NM24、NM17和NM3对柱花草可溶性蛋白含量增加百分量在发酵液原液条件下依次为36.10%、33.17%、29.36%和27.32%;在10倍稀释液条件下依次为24.39%、34.63%、26.44%和11.51%;在50倍稀释液条件下依次为26.15%、15.61%、11.51%和10.63%;与KP相比,放线菌NM17、NM2、NM24和NM3对柱花草可溶性蛋白含量增加百分量在发酵液原液条件下依次为28.81%、26.04%、22.44%和20.50%;在10倍稀释液条件下依次为17.73%、27.42%、19.67%和5.54%;在50倍稀释液条件下依次为19.39%、9.42%、5.54%和4.71%,且菌株NM2、NM3和NM17随发酵液浓度降低,可溶性蛋白含量呈现降低的趋势。可溶性糖含量结果(图6-B)表明,与无菌水对照组(KQ)相比,淋施菌株NM2、NM17和NM24发酵液原液和10倍稀释液都增加了柱花草的可溶性糖含量,其中,放线菌NM24、NM17和NM2对柱花草可溶性糖含量增加百分量在发酵液原液条件下依次为33.48%、23.08%和9.80%;在10倍稀释液条件下依次为22.62%、5.43%和4.52%。随着发酵液浓度降低,柱花草可溶性糖含量增加效果减弱,且菌株NM24的促进效果与对照相比具有显著差异,但菌株NM3对柱花草可溶性糖含量的增加则起到抑制作用。随着发酵液浓度降低,抑制效果减弱。
2.1. 皿内测定法实验结果分析
2.1.1. 放线菌对皿内柱花草幼苗鲜质量和茎长的影响
2.1.2. 放线菌对柱花草幼苗根长的影响
2.2. 盆栽实验结果分析
2.2.1. 放线菌对柱花草株高的影响
2.2.2. 放线菌对柱花草鲜质量的影响
2.2.3. 放线菌对柱花草根系活力和叶绿素含量的影响
2.2.4. 放线菌对柱花草可溶性蛋白和可溶性糖含量的影响
-
关于放线菌的促生作用已经开展了大量的研究,如王艳等[20]的报道表明,内生放线菌SR-1102不仅能有效防治蔬菜立枯病,同时能使番茄、辣椒产量分别提高10.10%~14.61%、7.67%~13.53%;据李兴昱等[21]报道,放线菌ZZ-9可通过有效促进小麦幼苗的生长来提高小麦植株的抗病性;BAOUNE等[22]分离的17株链霉菌属的内生放线菌,均能够通过产生铁载体、溶解磷酸盐、IAA、固氮等方式促进植物生长。可见,放线菌不仅可作为重要的生防资源,还对植物表现出良好的促生作用[23]。对放线菌的促生作用主要从对植物的形态指标和生理生化指标的影响进行评价。植株根长、茎长、株高和鲜质量是容易观察和测定的直观指标,一般作为形态指标测定内容。植物中叶绿素含量直接影响光合作用强度,对提高植物的产量有一定意义[24-25];可溶性蛋白质可以反映出植物体的代谢强度,它参与新器官的建成,而且有一部分是直接调控各种生化反应的酶[26];可溶性糖既是高等植物的主要光合产物,又是碳水化合物代谢和暂时贮藏的主要形式,在植物碳代谢中占有重要位置[27];根系活力是衡量根系功能的主要指标之一,植物根系是植物营养和水分的吸收器官,根的生长情况和活力水平直接影响地上部的生长和营养状况[28],上述这些指标可以较全面地代表植株的生长健康状况,一般作为生理生化指标测定内容。本研究结果表明,4株放线菌发酵液在不同稀释浓度下都促使幼苗鲜质量的增加和茎的伸长,并且在高浓度下均能提高柱花草叶绿素、可溶性蛋白质的含量。同时除NM3外,其余3株放线菌在高浓度下也能提高柱花草植株可溶性糖的含量。由此可见,供试的放线菌可以显著地增加柱花草形态指标量的变化,也能在高浓度下显著地增强柱花草生理生化指标质的提升,对柱花草具有很好的促生作用,具有提升柱花草产量和品质的潜质。本研究结果表明,利用不同放线菌发酵液对柱花草幼苗进行处理,可显著提高柱花草生理指标和增加干物质积累量。故推测其增产机制可能是放线菌产生的次级代谢产物通过直接促生长作用,促进柱花草地下部根的伸长,吸收更多的水分和养分,从而增加地上部鲜质量,提高幼苗叶绿素含量,促进柱花草光合能力增强,进而增加干物质的积累,最终提高柱花草的品质和产量。
另外,本研究结果还表明,供试的4株放线菌对柱花草不同测定指标活性顺序不同,如在10倍稀释液浓度下,4株放线菌对皿内幼苗鲜质量促进作用的大小依次为NM24>NM2>NM3>NM17,对盆栽幼苗鲜质量促进作用的大小依次为NM2>NM17>NM24>NM3,对叶绿素含量促进作用的大小依次为NM17>NM2>NM3>NM24。可见,每种放线菌产生的次生代谢产物明显存在差异,对不同测定指标起作用的活性物质也不同。因此,在后续研究中有必要进一步开展放线菌的促生活性成分的研究,以便为放线菌次生代谢产物的开发应用奠定基础。






 DownLoad:
DownLoad: