-
微生物天然产物因具有化学和生物活性的多样性,历来是药物先导结构的重要来源[1]。放线菌中的链霉菌是药物先导化合物的主要产生菌[2]。近年来,易于采集和分离培养的链霉菌已被重复地分离研究,导致从普通链霉菌中发现新药物或其先导结构已经越来越困难。解决目前放线菌药物乃至微生物药物研究中出现的这些问题,必须从资源和方法两个方面开拓空间,其中资源是核心。新物种的发现,是获得新化合物的一条重要途径。要获得新的菌种资源和基因资源,必须选择从特殊的生态环境(如海洋、植物内生、沙漠以及极端环境等)中采集样品和采用特殊的分离方法进行分离[3-5]。近年来从特殊的生态环境中发现了大量特有的链霉菌新类群,这些新颖的链霉菌具有合成新颖结构天然产物的巨大潜力,是筛选新抗生素的重要来源[2, 5]。红树林是一类分布于热带和亚热带海陆交界潮间带的木本植物群落,具有丰富的生物多样性,是新颖海洋放线菌菌种分离和新抗生素发现的理想生境[6],据报道,近十年来从红树林生境中发现了8个新属,66个放线菌新种以及从红树林放线菌中发现了包括盐孢菌素(Salinosporamides)在内的84个新颖的化合物[7]。其中,许多化合物展现出抗菌、抗肿瘤、抗病毒、抗纤维化剂以及抗氧化等活性,在新型药物研发和农业生物制剂的研制上具有重要的利用价值[8]。海南岛是我国红树林的主要分布区之一,种类丰富,多达11科16属25种[9]。红树林在海南环岛沿海市县均有分布,其中,东线沿海分布较多,包含了最大的红树林分布区东寨港和清澜港红树林保护区,是国内的热点研究生境[10-12]。西线沿海红树林主要分布于澄迈、临高、儋州、东方等地,红树林面积较小,群落类型相对单一,目前对于该区域红树林放线菌的研究仅有少量报道[13-15]。在同一植物的根、茎、叶部位出菌率总体相差不大,但由于根部直接与土壤接触,外围菌的侵入机会较大,出菌主要以根部居多,其次是植物的茎多于植物的叶[16]。本实验室以海南西线海岸的红树林植物为研究对象,本实验室部分研究人员对红树林植物样品的根及其根际土壤中的放线菌进行分离;笔者以红树林植物样品的茎为研究对象,开展红树林植物茎的共附生放线菌的分离、鉴定及其抗菌活性分析,旨在为发现具有抗菌活性的新菌种以及新抗生素奠定基础。
HTML
-
红树林植物海榄雌(Avicennia marina)、木榄(Bruguiera gymnorrhiza)、秋茄(Kandelia candel)和桐花树(Aegiceras corniculatum)的10份样品采集于海南岛西线海岸,具体采集地点、数量、编号等信息详见表1。样品采集完成后4 h内带回实验室−20 ℃冰箱保存备用。病原细菌:金黄色葡萄球菌、甲氧西林金黄色葡萄球菌(MRSA)、大肠杆菌、无乳链球菌;病原真菌:水稻稻瘟病菌、香蕉枯萎病菌、山药炭疽病菌、木薯根腐病菌均为本实验室保存。分离、发酵培养基配方见表2。
样品编号
Sample code植物学名
Scientific name采集部位
Part of plant for collection分离菌株数
Strains isolated采集地点
Location for collectionMF1 海榄雌(Avicennia marina) 茎 8 110°4′59.36″ E 19°58′48.94″ N MF2 木榄(Bruguiera gymnorrhiza) 茎 10 109°59′42.81″ E 19°54′15.78″ N MF3 秋茄(Kandelia candel) 茎 6 109°53′28.01″ E 19°58′48.67″ N MF4 桐花树(Aegiceras corniculatum) 茎 12 109°50′4.04″ E 19°55′48.63"N MF5 海榄雌(Avicennia marina) 茎 10 109°48′2.08″ E 19°57′35.34″ N MF6 海榄雌(Avicennia marina) 茎 2 109°33′39.7″ E 19°51′49.28"N MF7 秋茄(Kandelia candel) 茎 1 109°17′23.02″ E 19°53′48.56″ N MF8 秋茄(Kandelia candel) 茎 4 109°15′18.61″ E 19°46′9.09″ N MF9 海榄雌(Avicennia marina) 茎 5 109°8′59.46″ E 19°38′23.24″ N MF10 秋茄(Kandelia candel) 茎 5 109°17′34.45″ E 19°43′32.82″ N Table 1. Location, quantity and number of 10 mangrove plant samples
培养基
Medium培养基配方 Formula 分离培养基Ⅰ 甘油6 mL,精氨酸1 g,K2HPO4 1 g, MgSO4·7H2O 0.5 g,琼脂15 g,陈海水1 L,pH7.2~7.4。 分离培养基Ⅱ 可溶性淀粉20 g,KNO3 1 g,K2HPO4·3H2O 0.5 g,MgSO4·7H2O 0.5 g,NaCl 0.5 g,FeSO4·7H2O 0.01 g,琼脂15 g,陈海水1 L,pH7.4~7.6。 分离培养基Ⅲ 葡萄糖1 g,蛋白胨0.5 g,胰胨0.3 g,NaCl 0.5 g,复合维生素3.75 mg(维生素B1、核黄素、烟酸、维生素B6、泛酸钙、肌醇、p-氨基苯甲酸各0.5 mg,生物素0.25 mg),琼脂15 g,陈海水1 L,pH7.2。 分离培养基Ⅳ 可溶性淀粉10 g,干酪素0.3 g,KNO3 2 g,NaCl 2 g,K2HPO4 2 g,MgSO4.7H2O 0.05 g,CaCO3 0.02 g,FeSO4·7H2O 0.01 g,陈海水1 L,琼脂20 g,pH7. 2~7. 4。 发酵培养基Ⅰ 葡萄糖2%,K2HPO4 0.05%,MgSO4·7H2O 0.05%,蛋白胨1%,酵母浸粉1%,牛肉膏0.3%,可溶性淀粉1%,CaCO3 0.2%,自来水50 mL,陈海水50 mL,pH7.0。 发酵培养基Ⅱ 可溶性淀粉1%,酵母浸粉0.4%,蛋白胨0.2%,CaCO3 0.1%,自来水50 mL,陈海水50 mL,pH7.0。 发酵培养基Ⅲ 可溶性淀粉2.5%,黄豆粉1.5%,酵母浸粉0.2%,CaCO3 0.4%,自来水50 mL,陈海水50 mL,pH7.2。 发酵培养基Ⅳ 酵母浸粉0.4%,麦芽浸粉1%,葡萄糖0.4%,自来水50 mL,陈海水50 mL,pH7.3。 发酵培养基Ⅴ 葡萄糖1%,蛋白胨0.5%,酵母浸粉0.2%,甘油1%,可溶性淀粉1%,玉米浸粉0.25%,Na CL 0.1%, CaCO3 0.3%,自来水50 mL,陈海水50 mL,pH7.3。 Table 2. Medium formula for isolation an fermentation of mangrove plant samples
-
将采集的红树林植物样品用自来水清洗干净,剪碎,称取1 g剪碎的样品,用无菌水洗3次,置于无菌的研钵中,加入无菌的石英砂和10 mL无菌水一起研磨成匀浆,匀浆即为100样品悬液,吸取其上清液按体积比1∶10,1∶100,1∶1000的比例稀释,得到10−1,10−2,10−3样品悬液,取样品悬液100 μL分别涂布于分离培养基Ⅰ、分离培养基Ⅱ、分离培养基Ⅲ、分离培养基Ⅳ上,28 ℃,培养15~30 d,挑取单菌落到ISP2培养基上反复纯化。纯化后的菌株分别保存于ISP2斜面和−20 ℃的无菌甘油中。
-
纯化得到的菌株根据平板上的形态特征进行初步排重,选取形态特征差异较大的菌株做16S rRNA序列分析。各菌株基因组DNA提取及16S rRNA序列扩增参照周双清等[17]的方法,即取0.2 mL 10%(W/V)的Chelex-100溶液加入到无菌的离心管中,再从平板上挑取绿豆大小的菌体置于Chelex-100溶液中,在旋涡混合器上振荡4~5 s,至菌株与溶液混合,然后放在沸水浴中10~15 min,冷却至室温之后,10 000 r·min−1离心10 min。取上清作为PCR扩增的模板,PCR引物为27F:5′-AGAGTTTGATCMTGGCTCAG-3′,1492R:5′-TACCTTGTTACGACTT-3′。扩增产物送往生工生物工程有限公司进行测序。所得序列利用EzBioCloud在线比对服务进行同源性比较分析,并确定菌株的种属。
-
选择发酵培养基Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ发酵相关菌株,每种培养基配置200 mL,重复接2瓶,置于28 ℃,180 r·min−1摇床培养7 d。用3倍体积乙酸乙酯萃取发酵液3次,萃取液合并后经减压蒸馏浓缩得粗提物。将粗提物用甲醇配制成1 g·L−1溶液,10 000 r·min−1离心10 min。取10 μL上清液并放在直径6 mm滤纸片上,滤纸片风干后用于抗菌活性测定。采用十字交叉法测定抑菌圈直径,重复3次。
抗细菌活性测定方法:将上述制得的放线菌滤纸片贴在已分别涂布了4种供试细菌的琼脂营养培养基上(菌体密度约1×106 cuf ·mL−1),28 ℃培养1 d。取100 μg·mL−1羧苄青霉素和甲醇各10 μL分别滴加在直径6 mm滤纸片上风干,分别作为阳性对照和阴性对照。将阳性对照和阴性对照滤纸片贴在已分别涂布4种供试细菌的琼脂营养培养基上。
抗真菌活性测定方法:将上述制得的放线菌滤纸片贴在已分别接种了4种供试真菌(用无菌的竹签挑取供试真菌接种于培养基中心)的马铃薯葡萄糖琼脂培养基表面,28 ℃培养5~7 d。取100 μg·mL−1制霉菌素和甲醇各10 μL分别放在直径6 mm滤纸片上风干,分别作为阳性对照和阴性对照。将阳性对照和阴性对照滤纸片贴在已分别接种了4种供试真菌(用无菌的竹签挑取供试真菌接种于培养基中心)的马铃薯葡萄糖琼脂培养基表面,28 ℃培养5~7 d。
-
将菌株HNM0645接种于发酵培养基Ⅲ中,发酵10 L,用500 mL的锥形瓶分装,每瓶200 mL。于28 ℃,180 r·min−1振荡培养7~10 d,向发酵完成的发酵液中加入3倍体积的乙酸乙酯,通过旋转蒸发浓缩至干获得粗浸膏。通过正相硅胶柱、反相硅胶柱并结合半制备HPLC分离得到化合物。通过H-NMR、C-NMR、质谱等确定化合物的结构。
-
采用山药炭疽病原菌测试单体化合物A的抗真菌活性。测定化合物A质量浓度为1000,500,250,125,62.5 μg·mL−1时对山药炭疽病原菌的抑菌率。以化合物A各质量浓度的对数为x,对应的抑制率的机率值为y,利用Excel求出毒力回归方程,计算EC50值。抗病原真菌活性的测定方法:在马铃薯葡萄糖琼脂培养基的中心接种病原真菌,以滴加甲醇的直径6mm灭菌圆形滤纸片为空白对照。在直径6mm灭菌圆形滤纸片上滴加10 μL甲醇,风干后将滤纸片贴在培养基中心右侧约1 cm处;处理组中每个直径6mm灭菌圆形滤纸片加10 μL稀释好浓度的纯品化合物A,风干后将滤纸片贴在培养基中心左侧约1 cm处,27 ℃培养。待空白对照一侧的菌丝即将长满时,分别测量为空白对照一侧的菌落半径R1和样品一侧的菌落半径R2,计算抑菌率。抑菌率(%)=(R1−R2)/R1×100。
抗供试细菌活性的测定方法:取1 g·L−1化合物A、100 μg·mL−1羧苄青霉素和甲醇各10 μL,分别滴在无菌的直径6 mm滤纸片上,待滤纸片风干后,制得处理、阳性对照和阴性对照所用的滤纸片。将制得的处理、阳性对照和阴性对照的滤纸片放置于涂布了供试细菌的琼脂培养基平板上(菌体浓度1×106 cfu·mL−1),置于28 ℃培养箱中培养24 h,观察滤纸片周围是否有抑菌圈产生,并测量抑菌圈的直径大小。
1.1. 样品和分离、发酵培养基
1.2. 放线菌菌株分离
1.3. 放线菌菌株鉴定
1.4. 放线菌抗菌活性分析
1.5. 菌株HNM0645主体化合物分离
1.6. 单体化合物A抗菌活性
-
本研究采用4种分离培养基对采集于海南西线海岸的4种红树林植物的10份样品茎的共附生放线菌进行分离及纯化,共获得63株放线菌(表3)。其中海榄雌分离到25株放线菌,木榄分离到10株放线菌,秋茄分离到16株放线菌,桐花树分离到12株放线菌。通过形态排除重复,选取16株代表性菌株进行16S rRNA序列分析(表4)。结果表明,16株放线菌归属于2个放线菌属(链霉菌属和小单孢菌属),其中,14株菌属于链霉菌属(Streptomyces),2株菌属于小单孢菌属(Micromonospora);链霉菌属菌株HNM0622,HNM0629,HNM0630,HNM0643,HNM0663的16S rRNA序列与标准菌株的相似性较低,均小于98.70%。根据原核生物16S rRNA相似度的分类标准[18],笔者推测这5个菌株可能是潜在的新物种。
样品编号
Sample code植物学名
Scientific name采集部位
Plant part for collection分离菌株数
Strains isolated经纬度
Geological locationMF1 海榄雌 茎 8 110°4′59.36″ E 19°58′48.94″ N MF2 木榄 茎 10 109°59′42.81″ E 19°54′15.78″ N MF3 秋茄 茎 6 109°53′28.01″ E 19°58′48.67″ N MF4 桐花树 茎 12 109°50′4.04″ E 19°55′48.63"N MF5 海榄雌 茎 10 109°48′2.08″ E 19°57′ 35.34″ N MF6 海榄雌 茎 2 109°33′39.7″ E 19°51′49.28"N MF7 秋茄 茎 1 109°17′23.02″ E 19°53′48.56″ N MF8 秋茄 茎 4 109°15′18.61″ E 19°46′9.09″ N MF9 海榄雌 茎 5 109°8′59.46″ E 19°38′23.24″ N MF10 秋茄 茎 5 109°17′34.45″ E 19°43′32.82″ N Table 3. Isolation of actinomycetes from 10 mangrove plant samples
菌株编号
Strain codeGenBank 登录号
GenBank accession number最相似标准菌株
Most similar standard strain相似性/%
Similarity样品来源
Sample sourceHNM0621 MN865197 Streptomyces tunisiensis CN-207(T) 99.36 MF-2 HNM0622 MN865133 Streptomyces sanyensis 219820(T) 98.67 MF-3 HNM0625 MN865134 Streptomyces araujoniae ASBV-1(T) 99.15 MF-9 HNM0627 MN865198 Streptomyces sanyensis 219820(T) 99.16 MF-3 HNM0629 MN865135 Streptomyces amphotericinicus 1H-SSA8(T) 95.14 MF-4 HNM0630 MN865199 Streptomyces araujoniae ASBV-1(T) 98.65 MF-2 HNM0631 MN865200 Streptomyces araujoniae ASBV-1(T) 99.21 MF-4 HNM0634 MN865136 Streptomyces griseoflavus LMG 19344(T) 98.87 MF-8 HNM0643 MN865201 Streptomyces sanyensis 219820(T) 95.07 MF-3 HNM0645 MN865137 Streptomyces wuyuanensis CGMCC 4.7042(T) 99.51 MF-3 HNM0655 MN865138 Streptomyces tunisiensis CN-207(T) 99.12 MF-6 HNM0661 MN865139 Streptomyces harbinensis NEAU-Da3(T) 99.09 MF-5 HNM0663 MN865140 Streptomyces lichenis LCR6-01(T) 98.67 MF-1 HNM0675 MN865141 Micromonospora carbonacea DSM 43168(T) 99.64 MF-1 HNM0678 MN865142 Streptomyces verrucosisporus CPB1-1(T) 99.21 MF-5 HNM0680 MN865143 Micromonospora tulbaghiae DSM 45142(T) 99.49 MF-10 Table 4. 16S rRNA sequence alignment results of 16 representative actinomycetes
-
11株放线菌的发酵粗提物对4种指示细菌显示出不同程度的抑菌作用(表5),占总菌数的17.5%,其中,菌株HNM0645的抗菌活性最好,对4种指示细菌全都表现出良好的抗菌活性。
菌株
Strain发酵培养基
Fermentation
medium样品来源
Sample
source指示菌 Indicator bacteria MRSA Methicillin-resistant
Staphylococcus aureus金黄色葡萄球菌
Staphylococcus
aureus 无乳链球菌
Streptococcus
agalactiae大肠杆菌
Escherichia
coli羧苄青霉素 ++ +++ +++ +++ HNM0621 发酵培养基Ⅰ MF-2 + + + − HNM0624 发酵培养基Ⅳ MF-2 − + − − HNM0629 发酵培养基Ⅱ MF-4 − +++ − − HNM0643 发酵培养基Ⅲ MF-3 ++ +++ − +++ HNM0645 发酵培养基Ⅲ MF-3 ++ +++ +++ ++ HNM0655 发酵培养基Ⅳ MF-6 + − ++ − HNM0661 发酵培养基Ⅳ MF-5 + + + − HNM0663 发酵培养基Ⅲ MF-1 + − − ++ HNM0675 发酵培养基Ⅰ MF-1 − + + − HNM0678 发酵培养基Ⅲ MF-5 ++ ++ ++ − HNM0680 发酵培养基Ⅳ MF-10 ++ ++ + − 注:−,0 < d(抑菌圈直径)< 7 mm;+,7 ≤ d < 12 mm;++,12 ≤ d < 18 mm;+++,18 mm ≤ d。
Note: −, 0 < d (diameter of inhibition zone) < 7 mm; +, 7 ≤ d < 12 mm; ++, 12 ≤ d < 18 mm; +++, 18 mm ≤ d.Table 5. Antibacterial activity of crude fermented extracts from actinomycetes
-
10株放线菌的发酵粗提物对4种指示真菌显示出不同程度的抑菌作用(表6),占总菌数的15.8%,其中,菌株HNM0625,HNM0630,HNM0634,HNM0645的发酵粗提物对4种指示真菌全都表现出良好的抗菌活性;菌株HNM0645的发酵粗提物的抑菌作用最强。
菌株
Strain发酵培养基
Fermentation
medium样品来源
Sample
source指示菌 Indicator bacteria 木薯根腐病菌
Phytophthora palmivora (Cassava root rot)山药炭疽病菌
Colletotrichum gloeosporioides (Yam amthracnose)香蕉枯萎病菌
Fusarium oxysporum f.sp cubense (banana wilt)水稻稻瘟菌
Pyricularia oryzae (rice blast)制霉菌素 +++ +++ +++ +++ HNM0622 发酵培养基Ⅳ MF-3 ++ ++ ++ − HNM0625 发酵培养基Ⅲ MF-9 ++ ++ ++ ++ HNM0627 发酵培养基Ⅲ MF-3 ++ ++ ++ _ HNM0629 发酵培养基Ⅳ MF-4 ++ ++ ++ − HNM0630 发酵培养基Ⅲ MF-2 ++ ++ ++ ++ HNM0631 发酵培养基Ⅳ MF-4 ++ ++ _ ++ HNM0634 发酵培养基Ⅲ MF-8 ++ ++ ++ ++ HNM0643 发酵培养基Ⅲ MF-3 + − + + HNM0645 发酵培养基Ⅲ MF-3 ++ +++ +++ +++ HNM0680 发酵培养基Ⅳ MF-10 ++ ++ + − 注:−,0 < d(抑菌圈直径)<7 mm;+,7 ≤ d < 12 mm;++,12 ≤ d < 18 mm;+++,18 mm ≤ d。
Note: −, 0 < d (diameter of inhibition zone) <7 mm; +, 7 ≤ d < 12 mm; ++, 12 ≤ d<18 mm; +++, 18 mm ≤ d.Table 6. Antifungal activity of fermented crude extracts of actinomycetes
综合抗细菌和抗真菌活性的分析结果,共有16株菌的发酵粗提物具有抗菌活性,占总菌数的25.3%,其中,菌株HNM0645的发酵粗提物对所有指示细菌和指示真菌都具有抗菌活性。
-
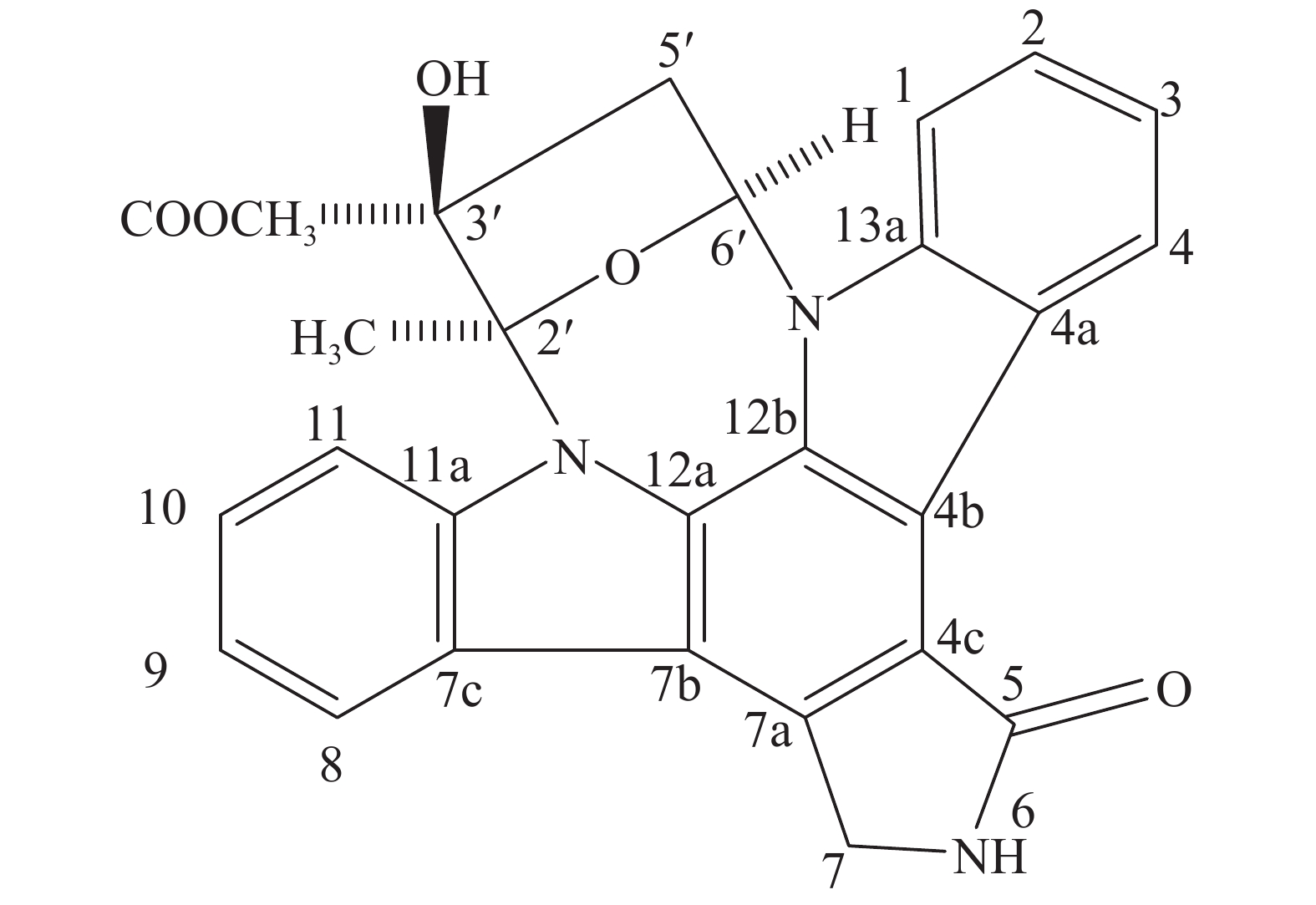
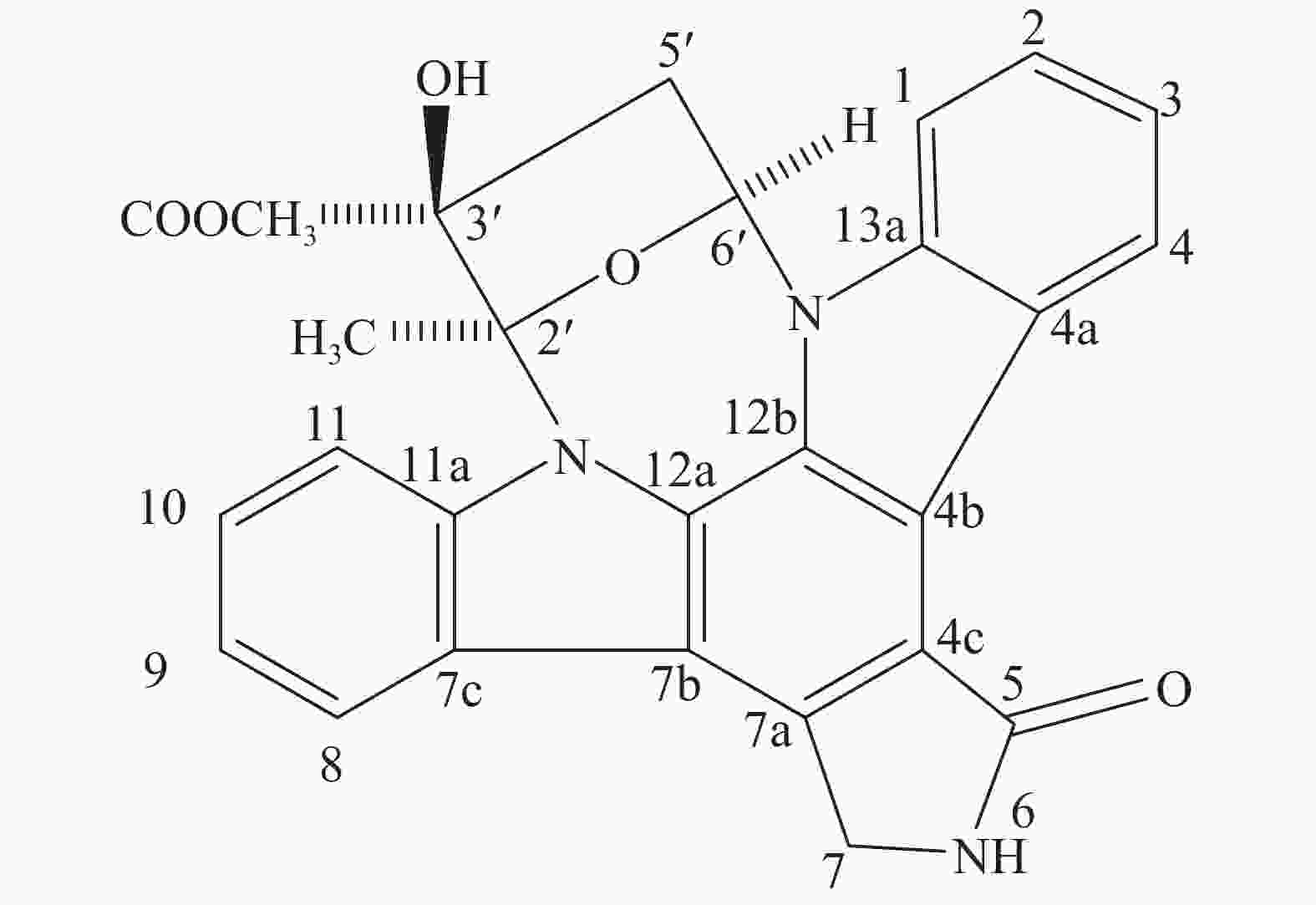
从菌株HNM0645的次级代谢产物中分离获得了1个化合物A(图1):ESI-MS m/z:467 [M-H]+。分子式为C27H21N3O5,通过波谱数据(表7)分析,该化合物与文献[19]报道的基本一致,通过文献[19]的报道可知,菌株Nocardiopsis sp. K-252 (NRRL 15532)发酵获得吲哚咔唑生物碱类化合物,并命名为K-252a。
Position 13C NMR 1H NMR 1 109.2 7.90 (d) 2 125.55 7.49 (br t) 3 119.4 7.29 (br t) 4 125.71 9.24 (d) 4a 122.66 — 4b 115.88 — 4c 119.63 — 5 171.87 — 7 45.57 5.04 (AB) 5.00 7a 133.06 — 7b 114.67 — 7c 124.22 — 8 121.34 8.05 (d) 9 120.55 7.36 (br t) 10 125.18 7.49 (br t) 11 114.89 7.95 (d) 11a 139.96 — 12a 128.41 — 12b 124.01 — 13a 136.89 — 1′ 85.09 7.15 (dd) 2′ 42.6 3.41(dd) 2.04(dd) 3′ 85.02 — 4′ 99.46 — 5′ 22.93 2.16 (s) 6′ 172.98 — COOCH3 52.83 3.94 (s) Table 7. 13C NMR and 1H NMR data of the compounds
-
K-252a具有蛋白激酶C抑制作用,是一种蛋白激酶C抑制剂。目前未见对该化合物抗菌活性的分析报道。化合物A对山药炭疽病原菌的抑菌率见表8。通过Excel求出化合物A对山药炭疽病原菌的毒力回归方程为Y=0.827 9+1.697 8x,相关系数为0.958 9,EC50值为286.61 μg·mL−1,95%置信区间为127.35~645.03。这说明化合物A对山药炭疽病原菌有一定的抑菌活性。而化合物A对4种供试细菌无明显活性。
质量浓度
Mass concentration/
(µg·mL−1)R1/cm R2/cm 抑菌率
Inhibition
rate/%1000 4 1 75 500 4 1.2 70 250 4 1.6 60 125 4 3 25 62.5 4 3.6 10 Table 8. Inhibition rate of compound A at different concentrations against the pathogen of yam anthracnose pathogen
2.1. 放线菌的分离与鉴定
2.2. 放线菌发酵产物的抗菌活性
2.2.1. 抗细菌活性
2.2.2. 抗真菌活性
2.3. 菌株HNM0645次级代谢产物
2.4. 化合物A抗菌活性
-
我国红树林主要分布于海南、广东、广西、福建、台湾、香港、澳门等地区。2000年至今,从海南红树林生境中分离到的放线菌新属有1个,新种26个[20-24],这些菌株主要分离自海南东线海岸红树林环境。海南西线海岸的红树林植物放线菌资源研究相对滞后,目前未见海南西线海岸的红树林植物放线菌新种资源的报道。笔者以海南西线海岸的红树林植物茎为研究对象,从中分离到63株放线菌,并选取16株代表性菌株进行鉴定,发现它们归属于链霉菌属和小单孢菌属,其中,链霉菌属为优势菌属,这与前人的报道一致[25]。笔者从中发现了5株潜在的链霉菌新种,这说明海南西线海岸的红树林环境也蕴藏着种类新颖的放线菌资源。
红树林放线菌资源被报道具有丰富的生物活性(如抗菌、抗肿瘤、蛋白抑制剂,抗衰老等活性)[26],其中,抗菌活性的研究报道相对较多[27-29]。本研究采用4种供试细菌和4种供试真菌对分离菌株的发酵液进行抗菌活性筛选,发现16株菌株对至少1种供试菌具有抗性,抗菌活性比为25.3%,其中8株菌株具有抗MRSA活性,10株菌株具有抗植物丝状病原菌活性,这说明海南西线海岸红树林的放线菌资源不仅抗菌活性比例高,而且在抗耐药菌株活性天然产物和农用抗生素的开发等方面具有潜在的应用前景。从链霉菌属菌株HNM0645的发酵粗提物中分离的化合物A,为已知化合物K-252a,是1种吲哚咔唑生物碱类化合物。根据文献报道,吲哚咔唑生物碱类化合物对真菌和酵母菌具有抑制活性,但对细菌没有显著影响[30]。目前未见到关于化合物K-252a抑菌活性的报道,本实验测试的化合物A对山药炭疽病原菌的EC50为286.61 μg·mL−1,说明化合物A对山药炭疽病原菌有一定的抑菌活性。






 DownLoad:
DownLoad: