-
大黄鱼(Larimichthys crocea)隶属于硬骨鱼纲,鲈形目,石首鱼科,黄鱼属,是我国东南沿海养殖的重要海洋经济鱼类之一[1]。随着大黄鱼养殖规模的不断扩大,大黄鱼病害问题尤其是细菌性疾病已成为制约大黄鱼养殖业健康稳定发展的重要因素之一。据报道,大黄鱼细菌性病原包括多种革兰氏阳性细菌及革兰氏阴性细菌,常见的有鳗弧菌[2]、副溶血弧菌[3]、杀香鱼假单胞菌[4]、丝状诺卡氏菌[5]等。鱼类属于低等脊椎动物,其特异性免疫系统并不完善,其非特异性免疫在疾病防控系统中尤显重要。巨噬细胞是鱼类非特异性免疫系统中的固有免疫细胞,可直接清除、杀伤病原体,同时能够分泌细胞因子,介导并促进炎症反应,启动特异性免疫应答,在免疫调节中发挥重要的作用。提高鱼体免疫能力是解决病原感染的有效措施之一,随着鱼类细胞培养技术的发展,通过体外培养鱼类巨噬细胞来进行相关免疫功能及机制的探索,已成为研究的热点问题。病原相关分子模式(PAMP)是病原微生物表面高度保守的分子结构,如脂多糖(lipopolysaccharide,LPS)、肽聚糖(peptidoglycan,PGN)、脂磷壁酸(lipoteichoic acid,LTA)、胞壁酰二肽(muramyl dipeptide,MDP)等,也是非特异性免疫模式中模式识别受体(PRR)的相应配体,能够激活非特异性免疫信号通路,促进多种炎性介质释放[6]。脂多糖是革兰氏阴性细菌细胞壁外壁的组成成分,是免疫学研究中常用的免疫刺激物,主要作用于宿主细胞膜表面的TLR4[7],同时也能逐级上调TNF-α,IL-6,IL-8等关键性炎症细胞因子的表达[2]。肽聚糖(PGN)存在于革兰氏阳性菌和革兰氏阴性菌的细胞壁中,是TLR2的配体,作用于细胞的Toll样受体通路中[7]。PGN的G-M双糖单位间的β-1,4糖苷键能被溶菌酶水解,使细胞壁出现孔洞,甚至解体,从而杀死细菌[8]。LTA是革兰氏阳性菌细胞壁特殊组份,其抗原性很强,是革兰氏阳性菌的重要表面抗原;LTA具有免疫调节作用能激活巨噬细胞,增强其吞噬以及细胞毒功能[9]。MDP是分枝杆菌细胞骨架中具有免疫佐剂活性的最小结构单位,可以代替弗氏完全佐剂中的整体分枝杆菌,能加强细胞免疫和体液免疫,激活巨噬细胞和T辅助细胞[10]。在本研究中,笔者利用脂多糖(LPS)、肽聚糖(PGN)、脂磷壁酸(LTA)、胞壁酰二肽(MDP)4种能够作用于细胞表面引发免疫效应的病原相关分子模式来刺激离体大黄鱼头肾巨噬细胞,建立免疫刺激模型,并探讨这4种病原相关分子模式对大黄鱼头肾巨噬细胞相关非特异性免疫功能及免疫相关细胞炎症因子表达的影响。本研究结果将有助于了解病原相关分子模式对大黄鱼非特异性免疫应答的影响及其调控机制,对大黄鱼抵御病害具有重要的理论意义。
HTML
-
大黄鱼购买自福建宁德市养殖场,活体运输至海南大学海洋学院 ,暂养7 d后开始实验。暂养结束后,随机选取健康有活力的大黄鱼[平均体质量(89.1 ± 5.7) g]进行头肾巨噬细胞的提取,实验期间,水温保持在(23 ± 1) ℃。
-
percoll购自美国GE Health公司;DMEM和双抗(青霉素/链霉素)均购自美国GIBCO公司;超氧化物歧化酶(superoxide dismutase,SOD),过氧化氢酶(catalase,CAT),溶菌酶(lysozyme,LZM)和BCA蛋白检测试剂盒均购自南京建成生物工程研究所;细菌脂多糖(LPS,Escherichia coli 055:B5),肽聚糖(PGN,Staphylococcus aureus),脂磷壁酸(LTA,S. aureus)和胞壁酰二肽(MDP)均来自美国Sigma公司;佛波醇乙酯(PMA)、氯化硝基四氮唑兰(NBT)和二甲基亚砜(DMSO)均购自中国Solarbio公司;RNA提取试剂盒购自南京诺唯赞生物有限公司;cDNA第一链合成试剂盒和qPCR试剂盒均购自美国Promega公司。
-
操作方法参考文献[11]的方法。选取1条健康大黄鱼,在无菌条件下解剖获得大黄鱼头肾,轻轻研磨使头肾组织通过300目筛孔,得到细胞悬液。将细胞悬液置于26 ℃静置沉降2~3 h,小心取上清,用percoll水平梯度(34%~51%)离心技术分离获得头肾巨噬细胞。用吉姆萨染色法验证提取细胞为巨噬细胞;对提取的细胞进行台盼蓝染色并计数,计算活细胞率。
活细胞率(%)=活细胞总数/(活细胞总数+死细胞总数)×100 。
-
采用氯化硝基四氮唑兰(NBT)法测定头肾巨噬细胞产生的呼吸爆发活性。将新鲜提取的巨噬细胞接种至96孔细胞培养板中,每孔100 μL(细胞密度为2×106个·mL−1),然后分别加入2.5 μL浓度为10 g·L-1的LPS,PGN,LTA,MDP溶液,每组3个平行,对照组加入等量的磷酸盐缓冲液(PBS),共同孵育2 h后去除上清液,然后在每孔中加入100 μL 0.2%NBT,室温孵育1 h。吸去上清液,加入100 μL 100%甲醇,固定3 min,然后去上清,加入100 μL 70%甲醇。去上清液,开口室温凉干,接着加入120 μL 2 mol·L−1 KOH溶液,然后再加入140 μL二甲基亚砜(DMSO),用排枪吹打混匀,以使甲蓝晶体完全溶解,以KOH/DMSO为空白测定630 nm处吸光度。本测定进行3次独立重复实验。
-
将新鲜提取的巨噬细胞接种至6孔细胞培养板中,每孔1 mL(细胞密度为2×106个·mL−1),然后分别加入2.5 μL浓度为10 g·L−1的LPS,PGN,LTA,MDP溶液,每组3个平行,对照组加入等量的PBS,共同孵育2 h检测巨噬细胞SOD,CAT及LZM活性。SOD,CAT和LZM活性检测方法参照相应试剂盒说明书进行检测,蛋白浓度采用BCA法进行测定,每个测定进行3次独立重复实验。
-
参考RNA提取试剂盒说明书提取细胞总RNA,然后用琼脂糖凝胶电泳和Nanodrop检测提取RNA的完整性及浓度,并分装保存至−80 ℃超低温冰箱。以提取的RNA为模板合成cDNA第一链,操作方法参考cDNA第一链合成试剂盒说明书。本研究所用免疫基因的序列信息由NCBI数据库查询获得,然后用Primer5软件设计荧光定量引物(表1),内参基因为β-actin。使用SYBR Green I嵌合荧光法进行实时荧光定量PCR分析。荧光定量PCR总反应体系为10 μL,包括5 μL Eastep® qPCR Master Mix(2×),1 μL cDNA模板,上下游引物各0.5 μL,3.6 μL RNase-free water。反应条件:95 ℃ 2 min,(95 ℃ 15 s,60 ℃ 1 min)× 40个循环。采用2−ΔΔCt法计算基因的相对表达量,将对照组表达量设为1。
引物名称 Primer 引物序列(5′-3′)Primer sequences (5′-3′) IL1β-F/R CAATCTGGCAAGGATCAGC / GGACGGACACAAGGGTACTAA IL8-F/R ACAACAAAAGACGCTGAACGGAC / ATGCAAACATGACATGTGAAGTTCT IL10-F/R CTGGTTCTCTTGTCTTTTTTC / CATAGTTTAGTCTGAGCGTCT TNFα-F/R ATCAGCCTACAGCGAAACAAATC / AGCAGGCATCCTATGGTGAAATA CXCL9-F/R GGATGGGCAAACAGCTAACTCG / CTCTGGTTTCGGCTCTTCTGG MYD88-F/R CAGTATTTGGGGCAGCGTGTA / AAAGCAGGTGTCAGCAGTCAGTAA TLR3-F/R TTTTGACATTAACCAGTGTGTAAAT / TGCGGGTCTGTGGTGTCGTA TLR8-F/R ATGACAGCGAGGCGTTGTTGAT / GACATAGGAGGCGTCCCAGTAAA β-actin-F/R GACCTGACAGACTACCTCATG / AGTTGAAGGTGGTCTCGTGGA Table 1. Primer sequences for real-time PCR
-
实验数据用SPSS(SPSS Statistics 22)进行单因素方差分析(T-test),实验数据均用平均值 ± 标准差(X ± SD)表示。其中P < 0.05表示有显著差异,P < 0.01表示有极显著差异。
1.1. 实验用鱼
1.2. 实验药品
1.3. 巨噬细胞的提取
1.4. 病原相关分子模式对大黄鱼巨噬细胞各项非特异性免疫指标的影响
1.4.1. 呼吸爆发活性测定
1.4.2. 超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和溶菌酶(LZM)的活性测定
1.5. 病原相关分子模式刺激大黄鱼巨噬细胞后免疫基因的表达
1.6. 数据分析
-
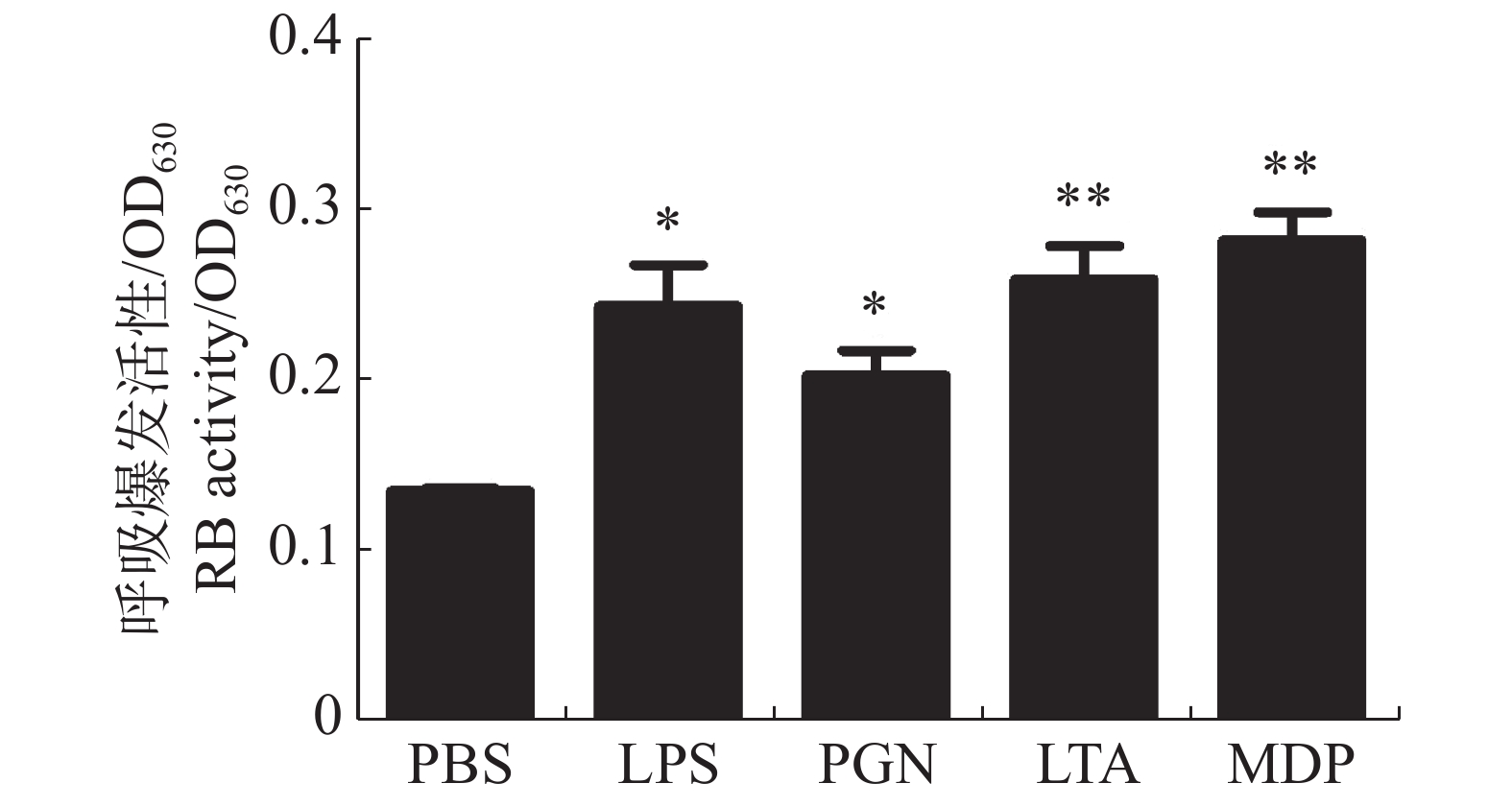
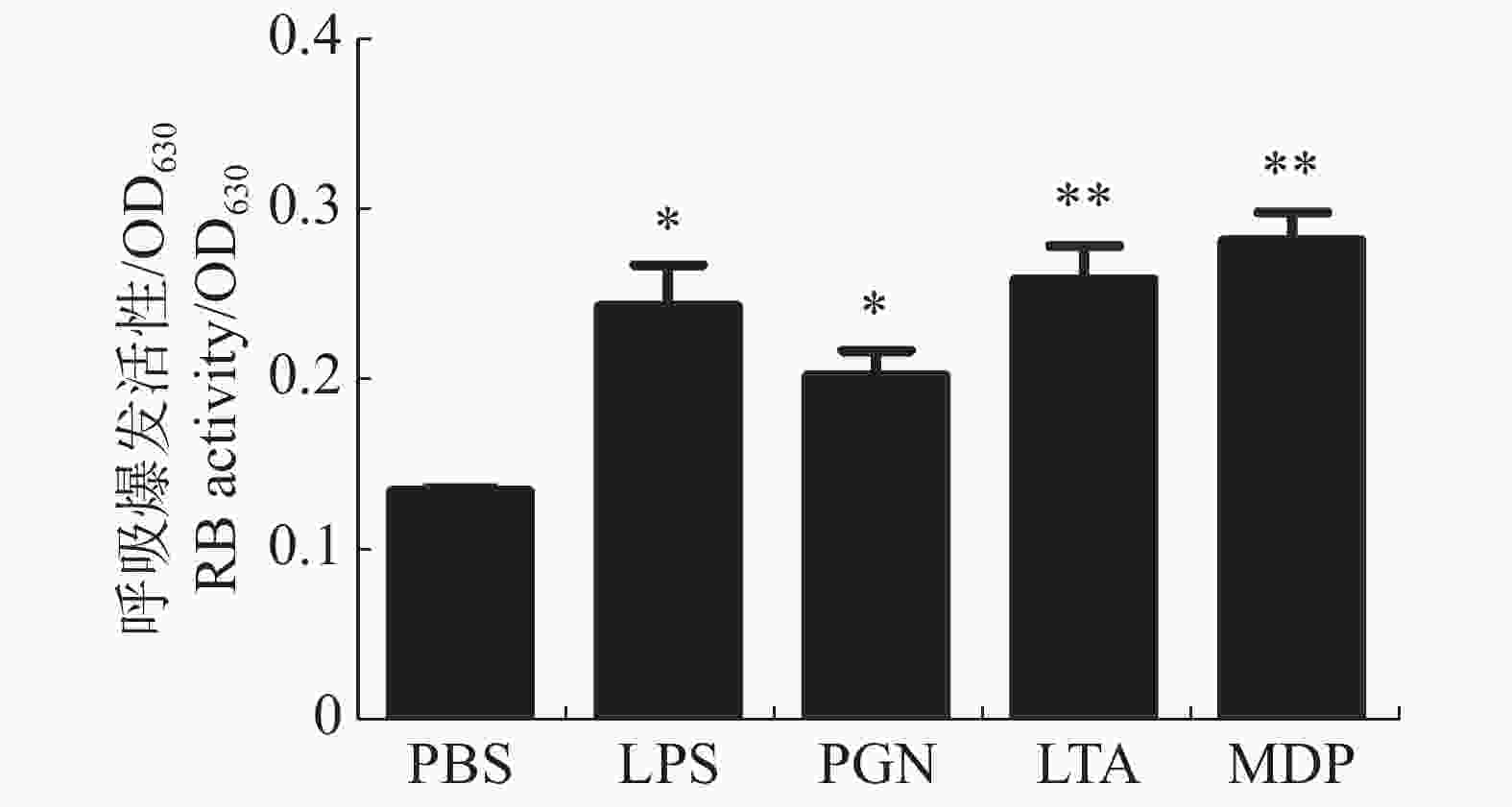
大黄鱼头肾巨噬细胞在病原相关分子模式LPS,PGN,LTA,MDP刺激下呼吸爆发活性的变化结果(图1)表明,与对照组相比,LPS和PGN均显著提高了大黄鱼头肾巨噬细胞呼吸爆发活性(P < 0.05);而在LTA和MDP刺激下,大黄鱼的头肾巨噬细胞呼吸爆发活性极显著升高(P < 0.01),其中,MDP处理组的呼吸爆发活性最高。
-
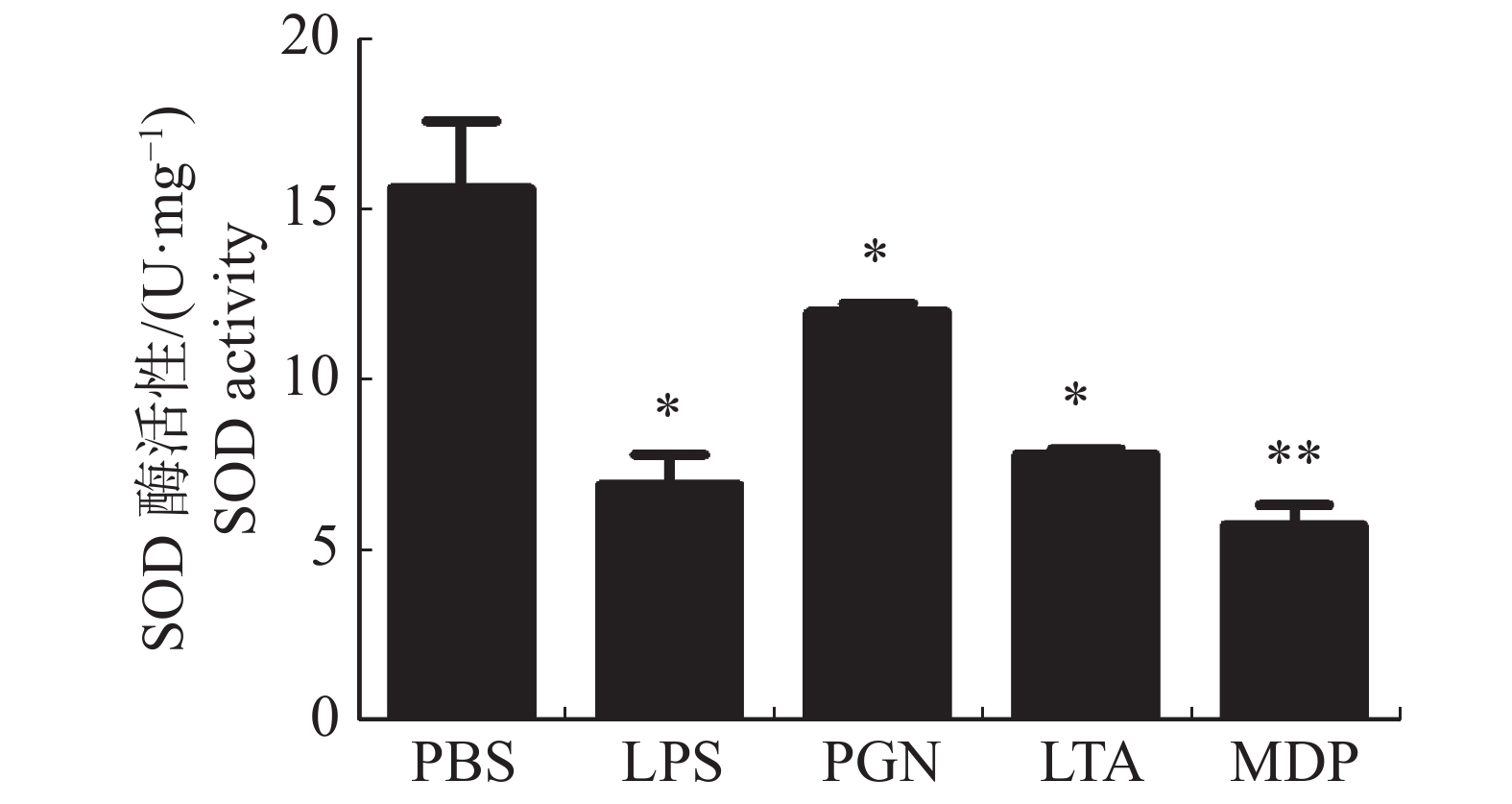
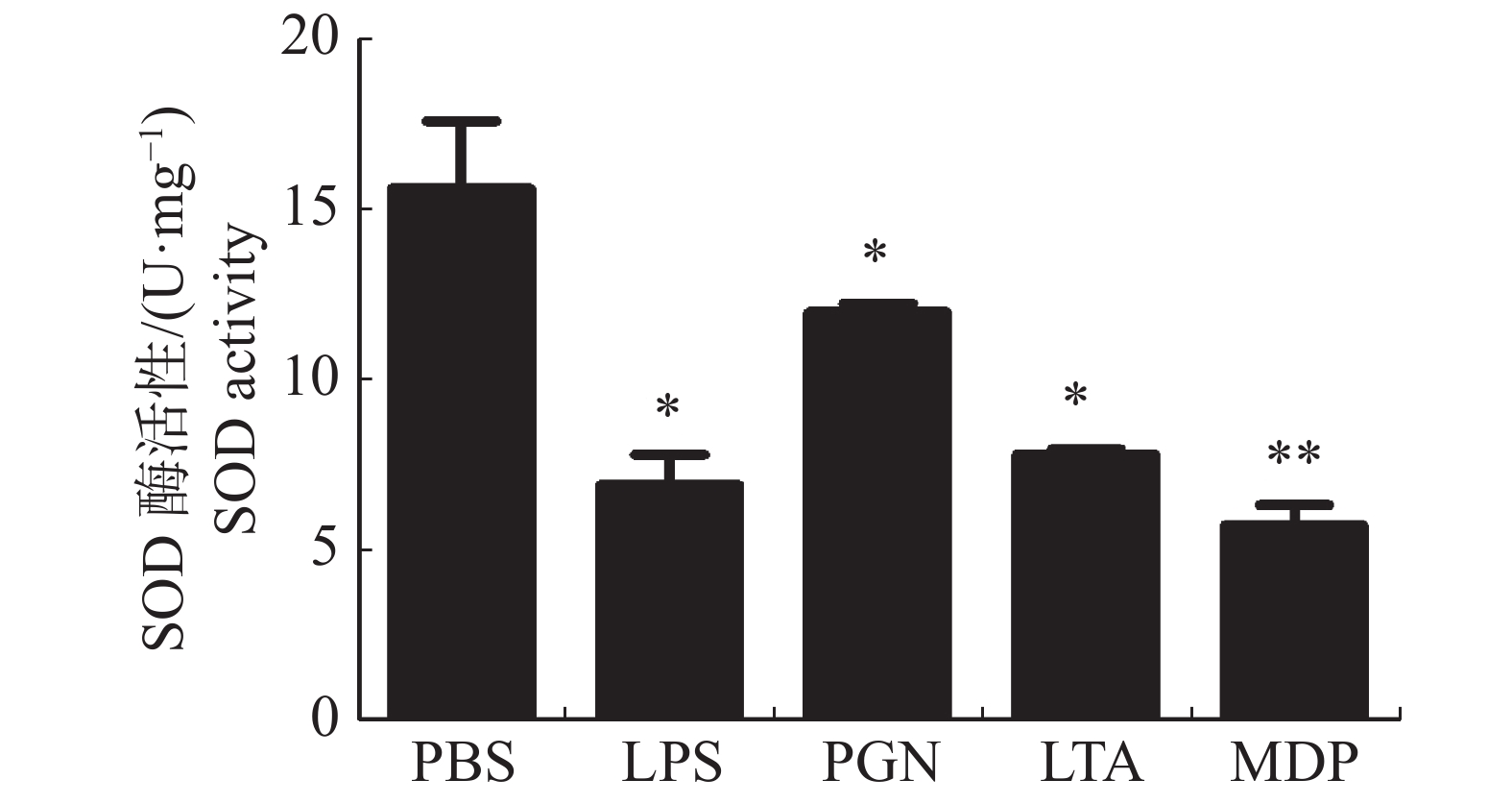
大黄鱼头肾巨噬细胞的SOD活性在LPS,PGN,LTA,MDP刺激下的变化情况(图2)结果显示,与对照组相比,LPS、PGN和LTA处理组的头肾巨噬细胞的SOD活性均显著降低(P < 0.05);MDP处理组极显著降低了大黄鱼头肾巨噬细胞的SOD活性(P < 0.01)。
-
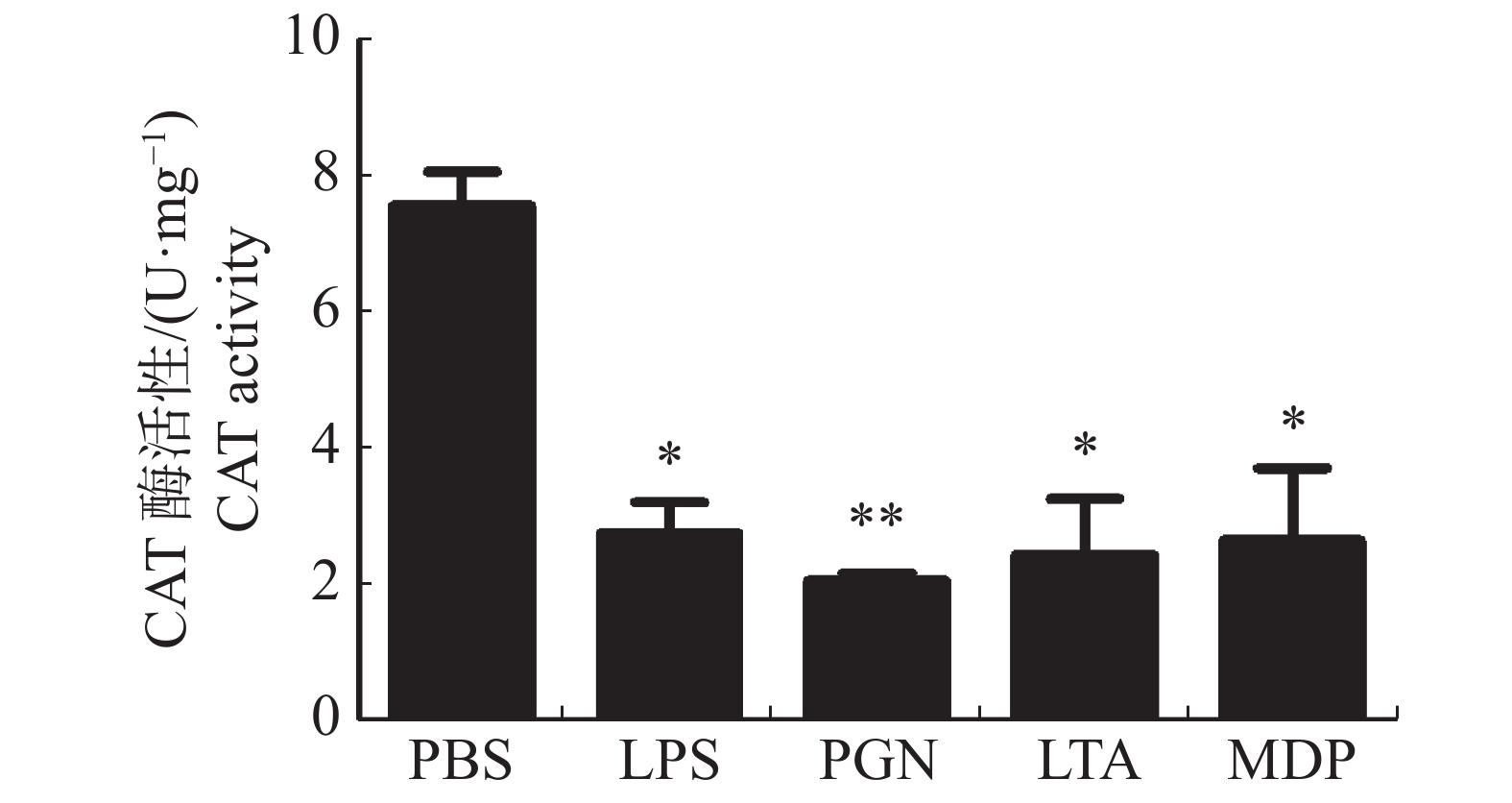
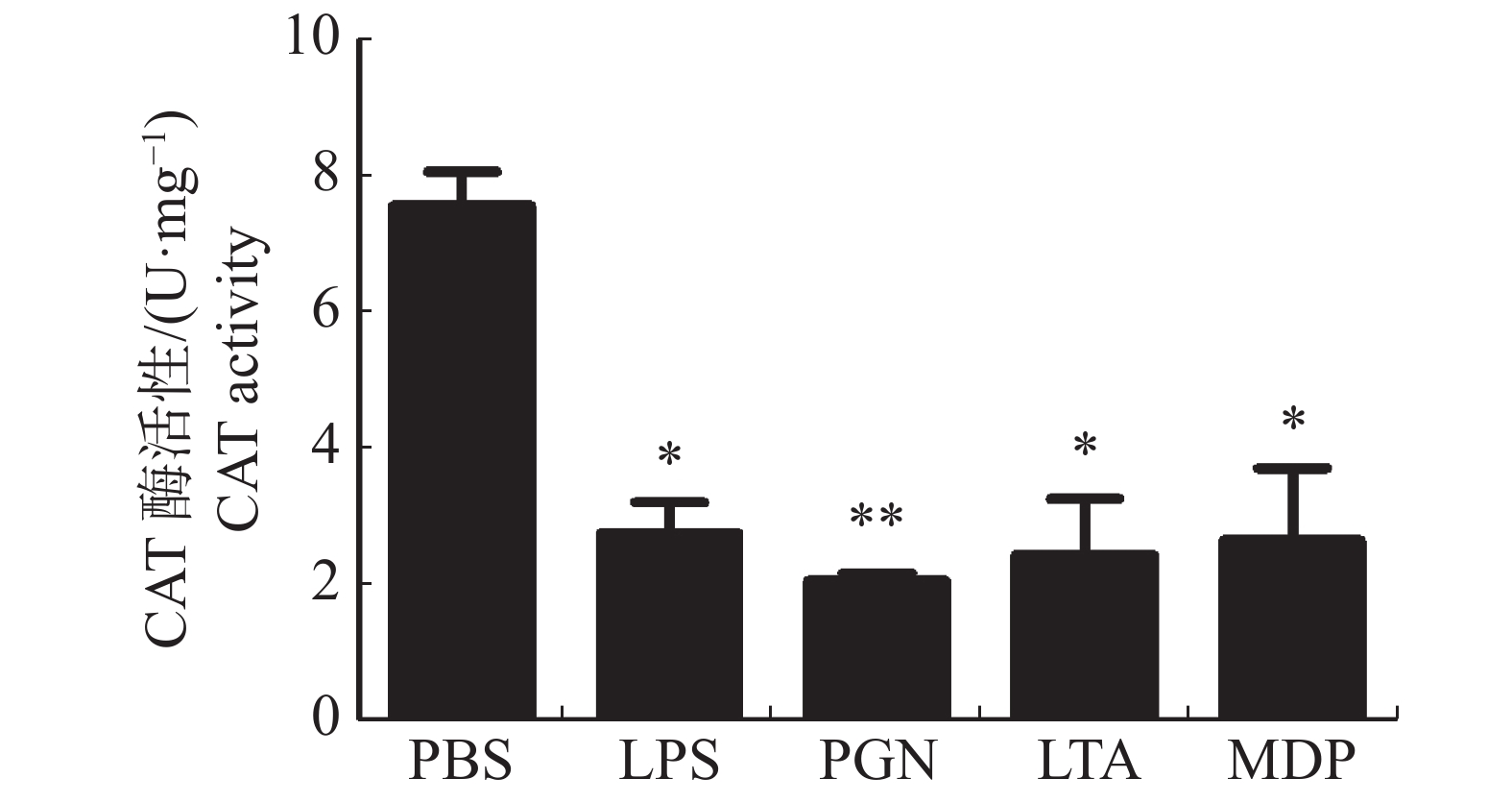
大黄鱼头肾巨噬细胞的CAT活性在LPS,PGN,LTA,MDP刺激下的变化结果(图3)显示,LPS,LTA,MDP处理组均显著降低了大黄鱼头肾巨噬细胞的CAT活性(P < 0.05);PGN处理组极显著降低了大黄鱼头肾巨噬细胞的CAT活性(P < 0.01)。
-
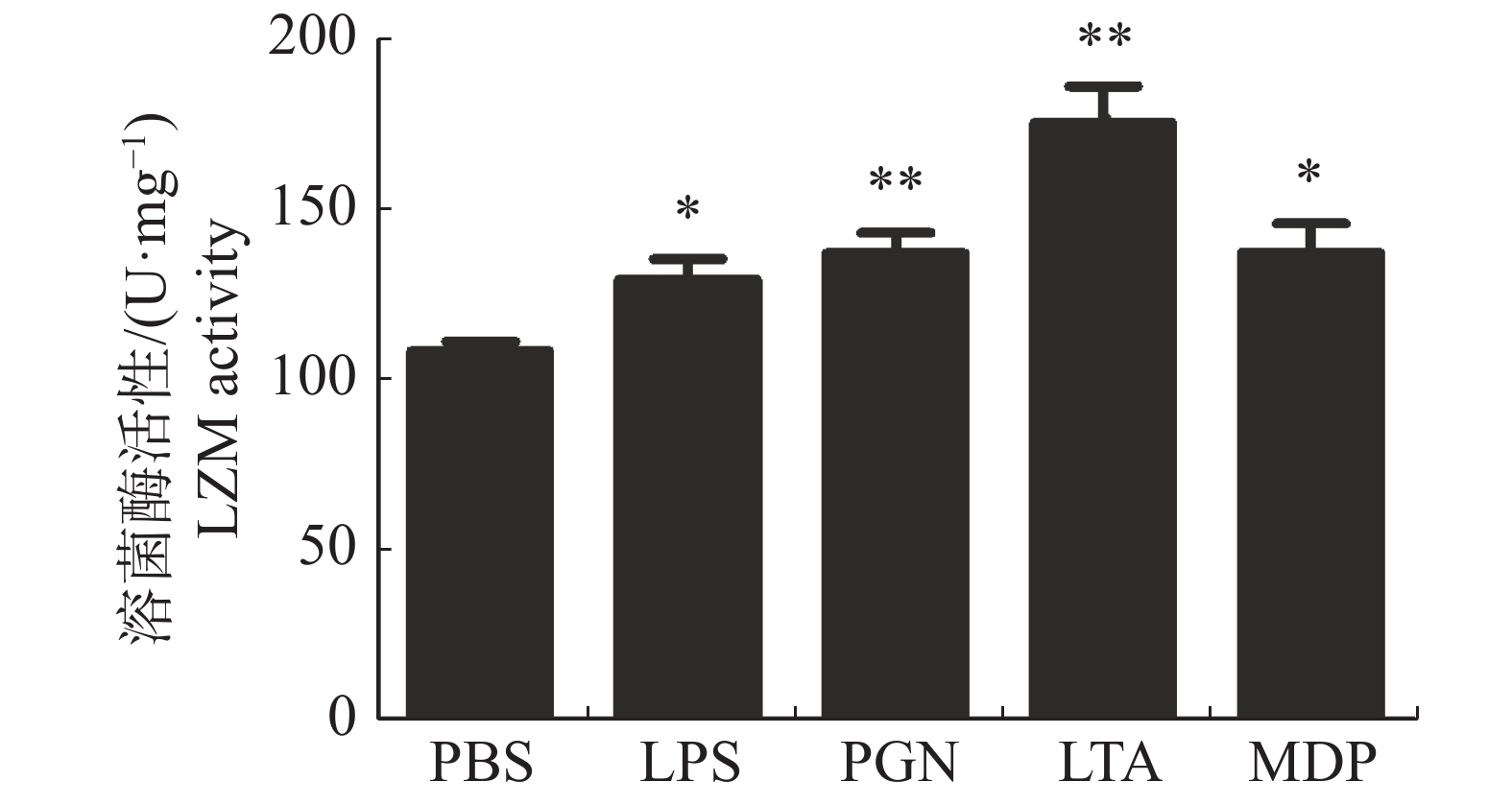
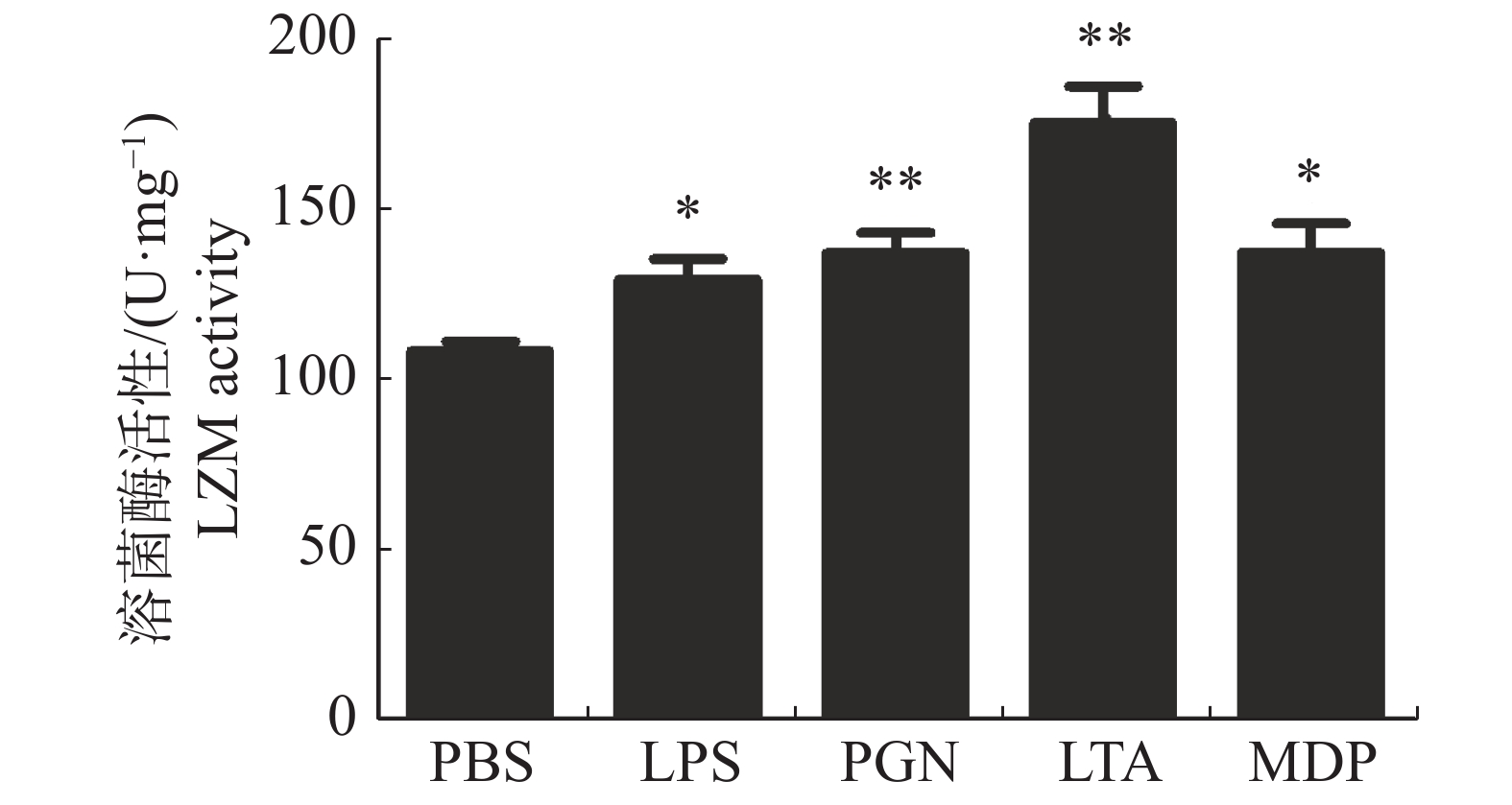
大黄鱼头肾巨噬细胞的LZM活性在病原相关分子模式LPS,PGN,LTA,MDP刺激下的变化结果(图4)显示,LPS和MDP处理组头肾巨噬细胞的LZM活性显著高于对照组(P < 0.05);PGN和LTA处理组头肾巨噬细胞的LZM活性极显著高于对照组(P < 0.01),其中,LTA处理组大黄鱼头肾巨噬细胞的LZM活性最高(图4)。
-
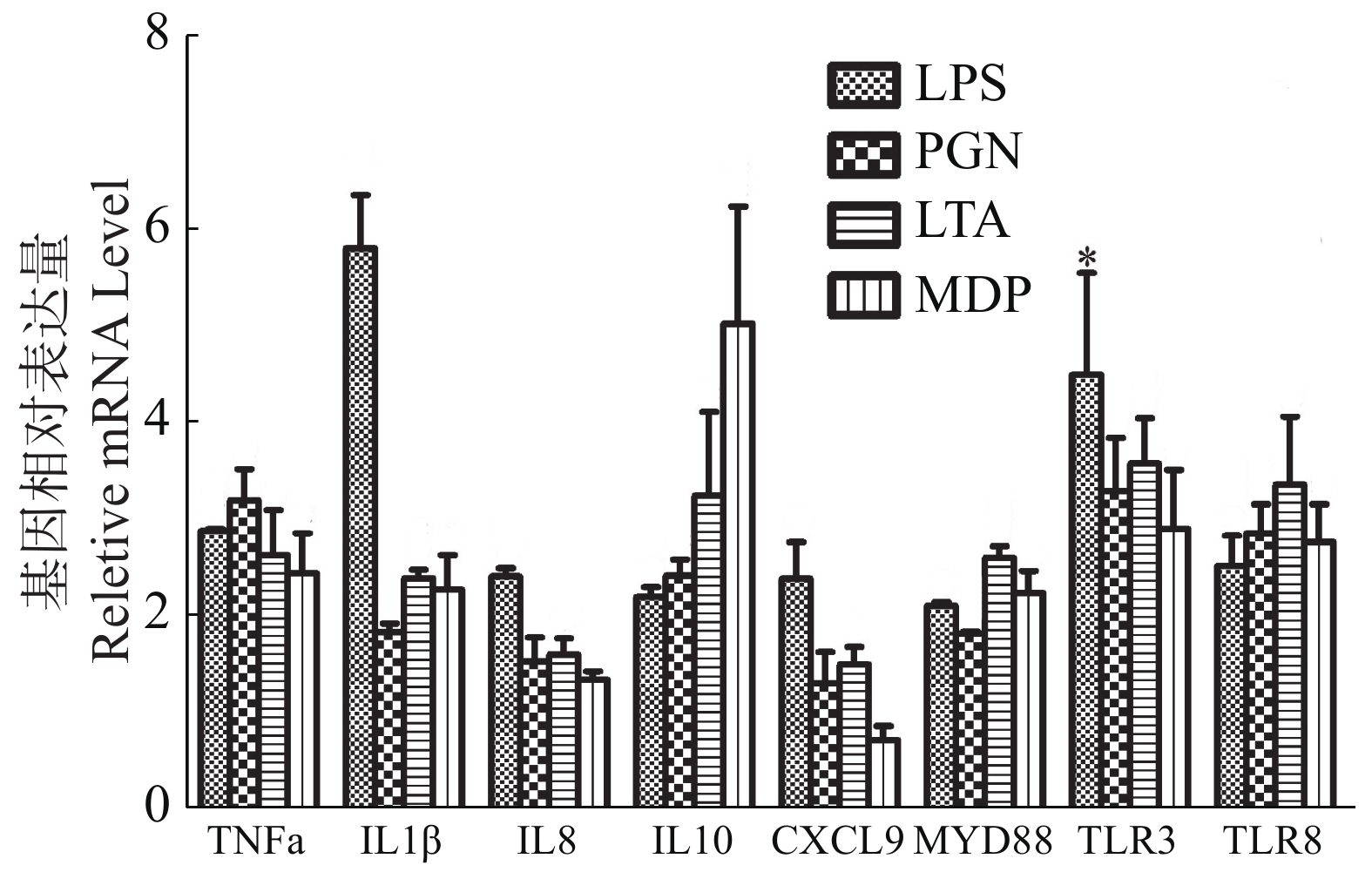
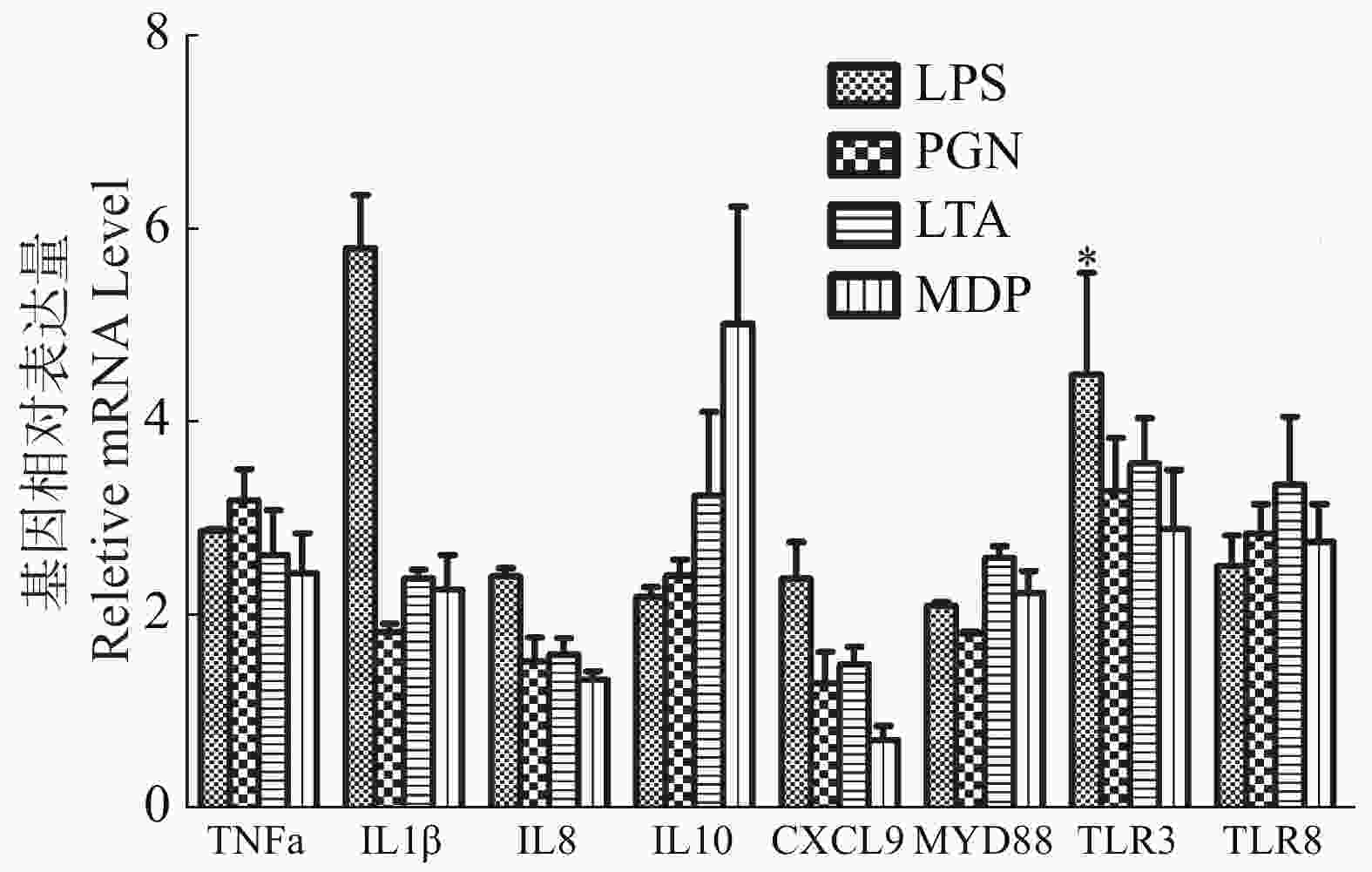
与对照组相比(图5),LPS和LTA处理组头肾巨噬细胞的8种免疫相关细胞炎症因子TNFα,IL1β,IL8,IL10,CXCL9,MYD88,TLR3和TLR8的表达水平均呈显著性上调趋势(P < 0.05);PGN和MDP处理组的TNFα,IL1β,IL10,MYD88,TLR3和TLR8基因表达水平均显著性高于对照组(P < 0.05),而IL8和CXCL9的表达水平虽呈升高趋势,但与对照组差异不显著(P > 0.05)。
2.1. 病原相关分子模式对大黄鱼头肾巨噬细胞呼吸爆发活性的影响
2.2. 病原相关分子模式对大黄鱼头肾巨噬细胞SOD活性的影响
2.3. 病原相关分子模式对大黄鱼头肾巨噬细胞CAT活性的影响
2.4. 病原相关分子模式对大黄鱼头肾巨噬细胞溶菌酶(LZM)活性的影响
2.5. 病原相关分子模式对大黄鱼头肾巨噬细胞中部分免疫相关细胞炎症因子表达的影响
-
大黄鱼属于海洋低等脊椎动物,在抵抗外界病原侵染的过程中,非特异性免疫尤其重要。巨噬细胞是机体重要的非特异性免疫效应细胞,广泛分布于机体不同组织中,当其受到病原体入侵、机体损伤等外界刺激时,会启动防御机制以达到清除杀灭病原体的作用[12]。此外,巨噬细胞能分泌多种活性物质如活性氧(ROS)和细胞因子等来参与机体的免疫应答,同时还能够传递抗原[12]。巨噬细胞还可同时参与机体的非特异性免疫反应和特异性免疫反应,广泛参与免疫系统的调节[13]。本研究利用体外培养的大黄鱼头肾巨噬细胞,分析了在4种病原相关分子模式的刺激下,其非特异性免疫功能和免疫相关细胞炎症因子的表达变化情况。呼吸爆发是指当有病原菌入侵机体时由巨噬细胞发挥吞噬消化作用,现广泛被用作评估机体非特异性免疫系统防御病原体的能力指标[14]。在本研究中,当病原相关分子模式刺激时,大黄鱼头肾巨噬细胞的呼吸爆发活性均显著增强。Solem等[15]的研究结果显示,LPS可导致大西洋鲑的呼吸爆发和吞噬活性显著增强,李庆飞等[16]的研究也发现LPS可以诱导大黄鱼巨噬细胞的呼吸爆发。本实验结果与文献[15-16]研究结果相一致。而PGN[7],LTA[9, 17],MDP[10]也被证明有刺激免疫细胞产生免疫应答及诱导巨噬细胞炎症的作用。黄行许等的研究结果[18]表明,巨噬细胞发生呼吸爆发可产生大量活性氧(ROS),而ROS可以抑制巨噬细胞自身的调亡。通常情况下,机体内氧化与抗氧化维持在一种动态平衡当中,一旦系统平衡被打破,机体就会产生一系列的氧化应激反应,从而对机体造成损伤[12, 19]。生物机体中抗氧化系统包括SOD,CAT和核转录因子红系2相关因子2(nuclear factor-erythroid 2-related factor 2,Nrf2)等抗氧化元件。一旦机体或者细胞产生的ROS被抗氧化系统清除,会同时表现出抗氧化酶活性降低。在本研究中,大黄鱼头肾巨噬细胞的抗氧化酶SOD与CAT活性均显著性降低,可能是由于在病原相关分子模式刺激下ROS产生与抗氧化系统之间的平衡破坏,致使抗氧化酶的分子损伤,故而降低了酶的活性。类似的结果在对中华绒螯蟹的研究中也有发现,在LPS的刺激下中华绒螯蟹的SOD等抗氧化酶活性显著性降低[20]。同样地,Ren G等[21]的研究表明,LPS降低了哲罗鲑肠中抗氧化酶的活性,并增加了炎症细胞因子的表达水平。Jiang W等[22]研究小鼠时发现,LPS可显著降低抗氧化酶SOD、CAT、谷胱甘肽过氧化物酶(GSH-PX)的活性。另外,Zhang T T等[23]在枯草芽孢杆菌中分离的PGN可显著降低鲤鱼肠道上皮细胞SOD和CAT的活性。
溶菌酶是鱼类等水生动物非特异性免疫系统中不可或缺的一种酶。溶菌酶在引发和维持机体防御免疫的过程中起着重要的作用,在机体免疫过程中可以水解致病微生物细胞壁中的肽聚糖而使细胞溶解、破碎直至死亡,还可诱导和调节其他免疫因子的合成与分泌[24]。据文献[25 − 26]报道,活化后的巨噬细胞在吞噬异物的过程中会释放大量溶菌酶、防御素、活性氧等多种免疫活性物质来清除异物。本实验中,在LPS,PGN,LTA,MDP刺激下,大黄鱼头肾巨噬细胞被活化,其溶菌酶活力也显著提高,表明这4种病原相关分子模式均可刺激大黄鱼产生较强的非特异性免疫应答。
大黄鱼主要依赖非特异性免疫系统抵抗病害[3]。在外界环境的刺激下,其体内的免疫机制被迅速激发,产生多种免疫细胞因子。前人的研究发现,LPS刺激后,炎症相关细胞因子(IL1,IL6,IL10和TNFα)均显著性上调[27];Jiang等[22]人发现LPS刺激后鲤鱼肠道细胞的TNFα,IL1β,IL8的mRNA相对表达水平显著提高。Zhang T T等人[23]的研究结果显示,PGN可以通过抑制炎症因子和促进抗炎因子的基因表达来提高鱼体的抗炎能力。Su B C等[17]用LTA处理小鼠巨噬细胞,结果发现LTA提高了IL6和TNFα的水平,证实了LTA是巨噬细胞中炎症相关反应的有效诱导剂。同样地,本研究中,在LPS,PGN,LTA和MDP刺激下,大黄鱼免疫相关细胞炎症因子的表达水平均呈现不同程度的上调,说明大黄鱼头肾巨噬细胞对这4种病原相关分子模式产生了强烈的免疫反应。
本研究利用4种病原相关分子模式LPS,PGN,LTA,MDP刺激大黄鱼头肾巨噬细胞,探究了病原相关分子模式对大黄鱼头肾巨噬细胞非特异性免疫指标和免疫相关细胞炎症因子表达的影响。本研究结果表明,上述4种病原相关分子模式均能显著影响大黄鱼头肾巨噬细胞的呼吸爆发活性,抗氧化酶(SOD,CAT)活性和LAM活性,同时均显著上调了绝大部分免疫相关细胞炎症因子。本研究结果为深入探讨大黄鱼在受到不同病原相关分子模式刺激时产生的免疫机制提供了参考资料。






 DownLoad:
DownLoad: