-
木薯(Manihot esculenta Crantz)属大戟科(Euphorbiaceae)木薯属(Manihot),与马铃薯、甘薯并称为世界三大薯类[1]。木薯从十九世纪初引入中国,广泛种植于我国华南地区,现在已逐步发展到我国华东、华中、西南地区的多个省市[2]。木薯除了是主要的粮食作物,还可以作为经济及能源作物生产动物饲料、淀粉以及酒精等[3-5]。随着木薯产业发展不断壮大,木薯的育种目标不再单纯地只为满足产量和品质上的基本要求,还需提升品种的抗逆性,并且已经有专家发现多倍化可以增加木薯抗逆性[6-7]。木薯由于基因组高度杂合,使得后代出现严重的性状分离,且木薯有12个月的种植周期,这就导致木薯通过传统育种进行育种改良的过程漫长并具有挑战性[8],而多倍体育种可以缩短木薯的育种周期,故被广泛应用于木薯育种工作。多倍体具抗逆性强等优点,可以满足目前抗逆性品种选育的育种目标[9]。前人多通过体细胞染色体加倍获得木薯无性四倍体,关于木薯有性多倍化的报道较少。近年来,有育种专家发现通过2 n配子诱导木薯有性多倍化可以使木薯同源染色体之间发生高频率重组,从而让亲本的优良基因发生间渗,达到优良品种选育的目的[10-11]。关于木薯的有性多倍化研究从2010年才开始,LAI H等[12]观察了木薯大孢子发生、雌配子体发育过程各时期与花序、雌蕊的外部形态的相关性;采用秋水仙素溶液棉浸法对木薯花芽进行诱导,比较分析了诱导后花序、雌花及子房的形态变异,并通过种间杂交得到首例木薯有性四倍体植株。
使用二维电泳(2-DE)和质谱(MS),通常可以在给定的组织或细胞样品中可视化,定量和鉴定成百上千种蛋白质,蛋白质组分析也越来越多地用于功能性植物研究中[13]。蛋白质水平分析有可能为植物对蛋白质的胁迫反应提供广阔的视野[14]。一些报道集中于对植物多倍体的蛋白质组学分析,包括香蕉[15],马铃薯[16],棉花[17],小麦[18-19]等。由于对木薯有性多倍化的研究较少,所以关于木薯有性四倍体抗旱机制的研究报道也相对较少。现有研究多从木薯长势形态及各项生理指标来研究木薯的抗旱性,也有科研人员从基因组的水平研究木薯抗旱性,发现干旱胁迫下木薯出现表达差异的基因,但YIN等[20]的研究结果表明,蛋白组与基因组在逆境条件下,两者的表达趋势并不完全相同。有性多倍化由于起源于配子加倍,其倍性的遗传稳定性理论上要优于组织器官加倍的无性多倍化途径,即避免了混倍嵌合体现象。本研究在本课题组研究木薯有性四倍体后代株系且基本明确其具备遗传稳定性后,将木薯有性四倍体与其母本华南5号作为供试材料,初步观察了供试材料株系在干旱胁迫下长势、叶片形态等生长特性,并通过系统鉴定干旱胁迫下木薯叶片差异表达蛋白、研究与有性四倍体叶片抗旱机制相关的代谢通路,旨在为木薯抗旱性种质资源开发提供科研依据。
HTML
-
本实验以有性四倍体木薯和华南5号(SC5)木薯为供试材料,对照材料为木薯华南5号。中国热带农科院品资所为本实验提供了供试材料的种质资源,本课题组将其种植于海南大学儋州校区农科基地(19°30′N ,109°28′E)培养。木薯有性四倍体通过华南5号(母本)和华南10号(父本)有性杂交产生。
-
本试验于2017年在海南大学儋州校区农学院温室大棚进行。供试材料采用无性系扦插−盆栽营养土方式进行种植培养,选用的花盆规格为高15 cm,口径22 cm,用于扦插的种茎要求长度在15 cm左右。待植株长到45 cm左右,对其中长势一致的木薯进行干旱处理。干旱胁迫处理:设置5,10,15 d干旱时间处理梯度;对照为正常浇水,每处理3次重复。
-
经干旱梯度处理下的供试木薯材料,择其第四片功能叶,叶片除中脉以外部分剪成大小均一的碎叶,对其进行各项生理指标测定。采用硫代巴比妥酸(TBA)比色法测定丙二醛含量,具体操作参照李合生[21]的方法;游离脯氨酸的测定采用磺基水杨酸提取法、茚三酮显色法,具体操作参照《植物生理生化实验原理和技术》[22];采用超氧化物歧化酶活性测定试剂盒测定SOD酶活性。
-
采用苯酚提取法[23]提取木薯叶片全蛋白质,使用Bradford试剂盒对溶解的蛋白质定量,再采用双向电泳[23]对其分离,3次重复。使用Delta2D软件对照华南5号叶片全蛋白质图谱分析确定有性四倍体木薯叶片的差异蛋白质点,筛选并标记出表达量符合平均差异表达量在±2.0以上要求的蛋白质[24]。鉴定蛋白质参照AN F等[13]的操作。
-
本研究对鉴定出的抗旱性相关的差异蛋白质使用String分析软件构建蛋白质互作网络(PPI)[25]。
-
本研究的所有数据均先使用Excel 2013软件处理,后经过SPSS软件对处理后的数据进行统计学分析,本研究图片均采用Adobe Photoshop CC软件处理。
1.1. 研究材料
1.2. 干旱胁迫处理设计
1.3. 测定项目及方法
1.4. 提取、分离及鉴定干旱处理下的木薯叶片全蛋白质
1.5. 构建木薯干旱胁迫下叶片差异蛋白质互作网络
1.6. 数据处理
-
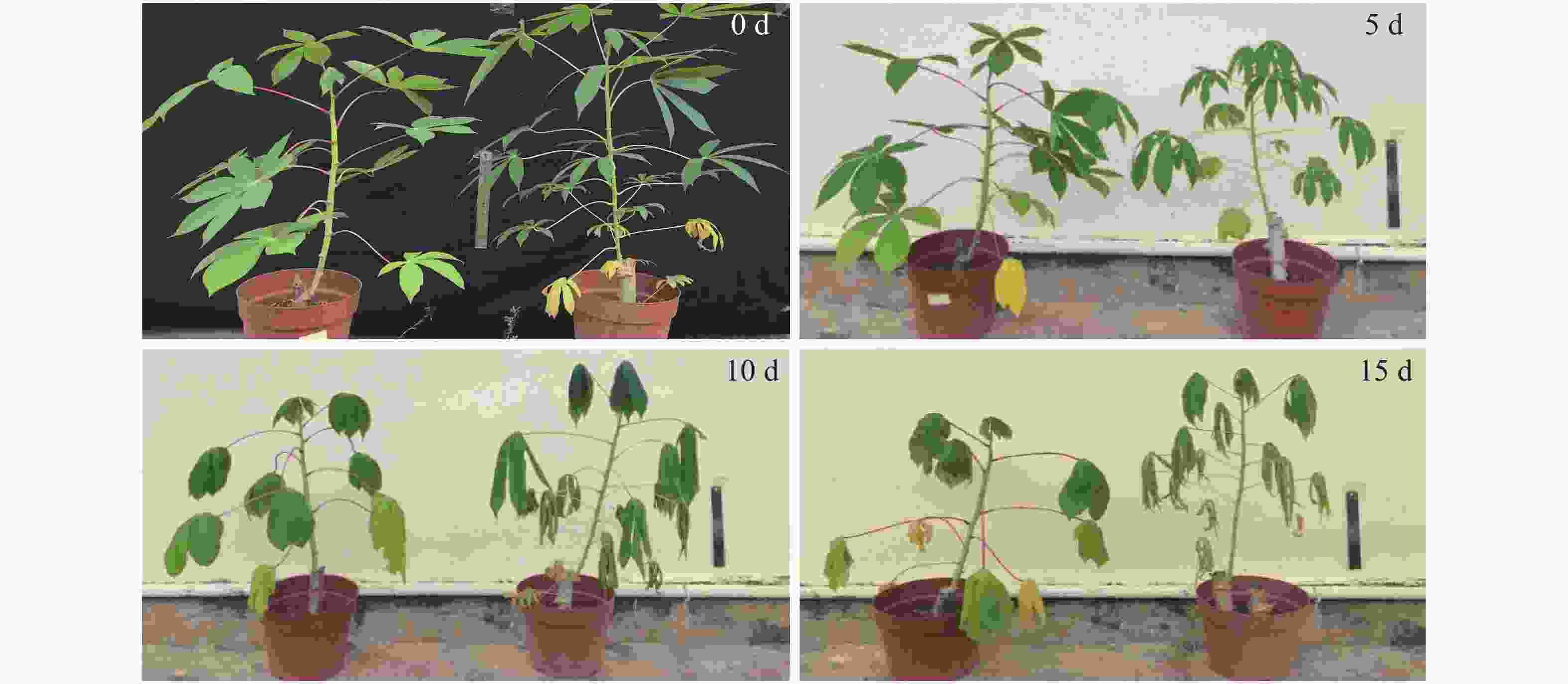
对供试材料在干旱胁迫5、10、15 d时的叶片形态进行拍照,以便于观察不同干旱处理程度下木薯有性四倍体和华南5号叶片的变化。由图1所示,随着干旱胁迫程度的加深,植株生长日渐缓慢甚至趋于停止,叶片也呈现出自下而上干枯脱落的状态。然而在同一干旱处理程度下,有性四倍体植株长势比华南5号好,叶片枯萎较SC5缓慢,能更好地适应干旱胁迫。
-
木薯叶片丙二醛含量在不同干旱处理的变化如图2所示,在干旱协迫下华南5号叶片中丙二醛含量极显著地(P<0.01)高于有性四倍体叶片的。有性四倍体与华南5号叶片中丙二醛含量随着干旱胁迫程度加深均呈上升趋势,华南5号上升趋势更显著。由上可知,有性四倍体的内膜系统比华南5号能够更迅速有效地响应干旱胁迫,作出防御来减轻干旱对植株造成的伤害。
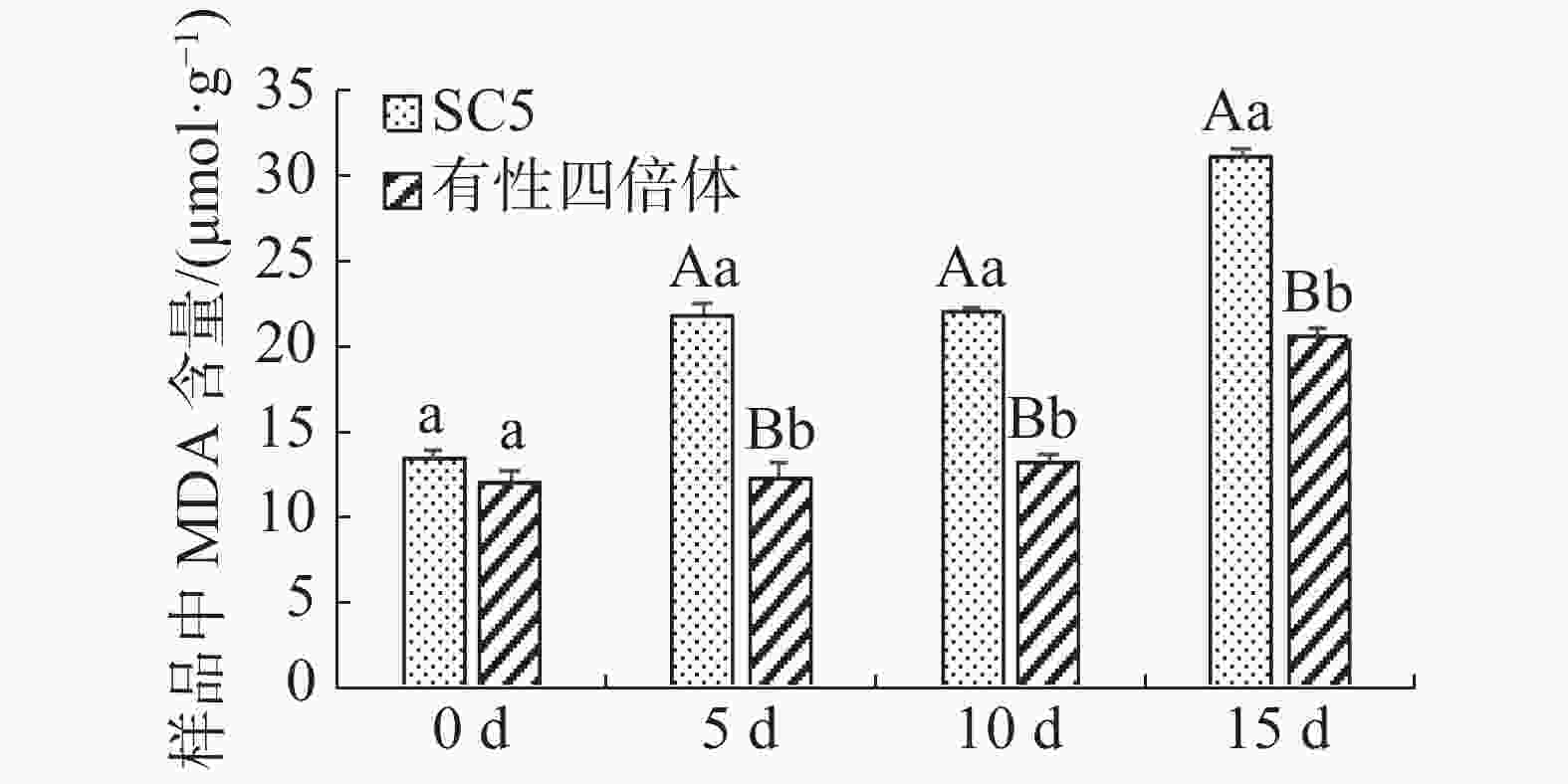
Figure 2. Changes of the leaf content of MDA in cassava sexual tetraploid and SC5 under drought stress
木薯叶片脯氨酸含量在不同干旱处理下的变化如图3所示,经干旱处理后,供试材料叶片中脯氨酸含量均增加,说明叶片中均通过积累脯氨酸来应对外界不良环境,并且有性四倍体叶片中含量增加更显著,随着干旱处理程度加深,华南5号叶片中脯氨酸含量持续积累,有性四倍体叶片中脯氨酸含量呈先上升后下降趋势。因此,推测在干旱处理5~10 d时,有性四倍体比华南5号更能迅速地积累更多的脯氨酸进行渗透调节,有效地响应干旱胁迫;在干旱处理15 d时,有性四倍体已经在前期通过渗透调节适应干旱胁迫,而华南5号因为前期脯氨酸含量积累少不足以较快适应干旱胁迫。
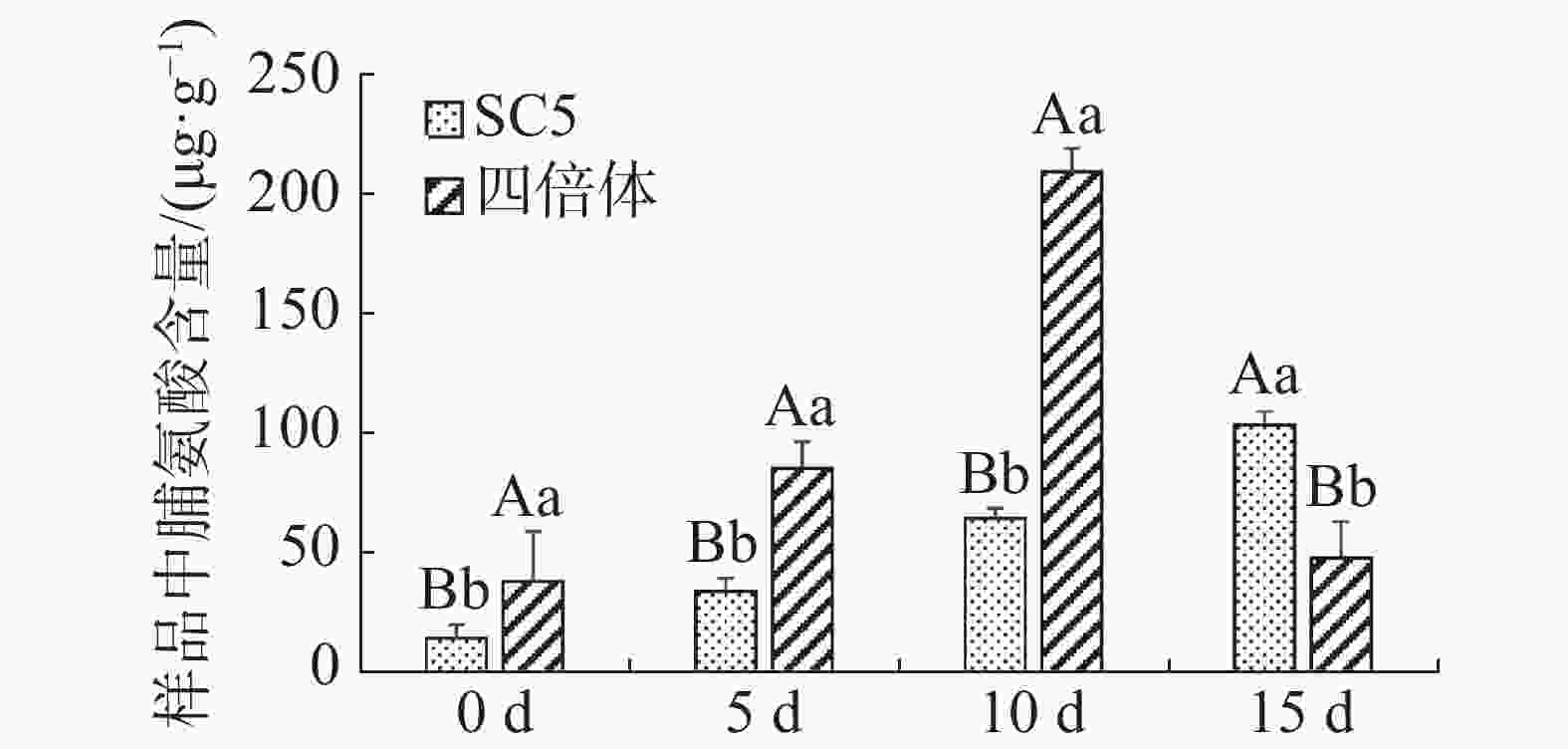
Figure 3. Changes of the leaf content of proline in cassava sexual tetraploid and SC5 under drought stress
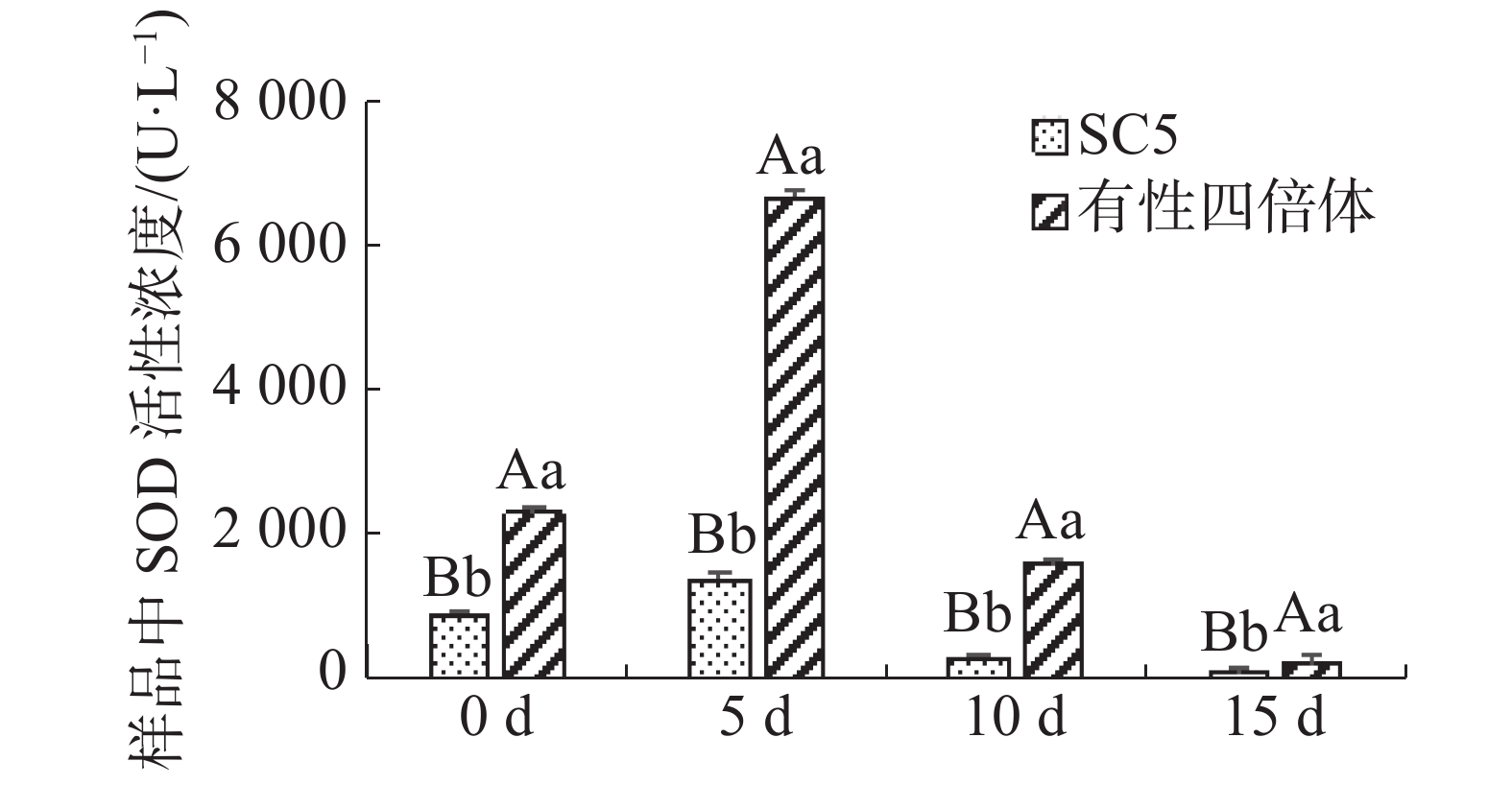
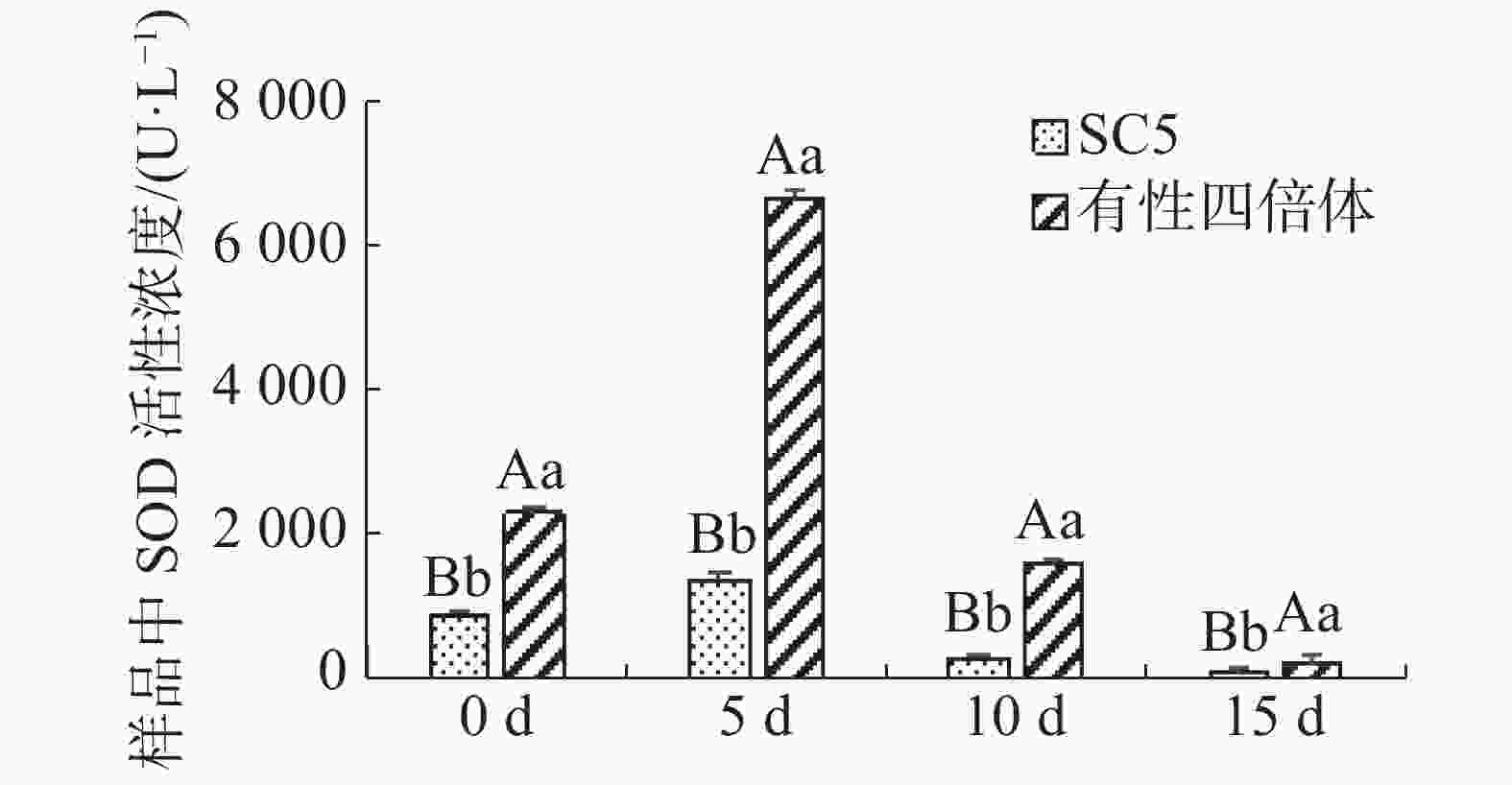
木薯叶片SOD活性在不同干旱处理下的变化如图4所示,在干旱处理下,有性四倍体叶片中SOD活性极显著地高于华南5号( P <0.01),且随着干旱处理时间延长,供试材料叶片中SOD活性均呈先升后降趋势,然而有性四倍体木薯叶片中超氧化物歧化酶活性变化较华南5号木薯的更明显。
-
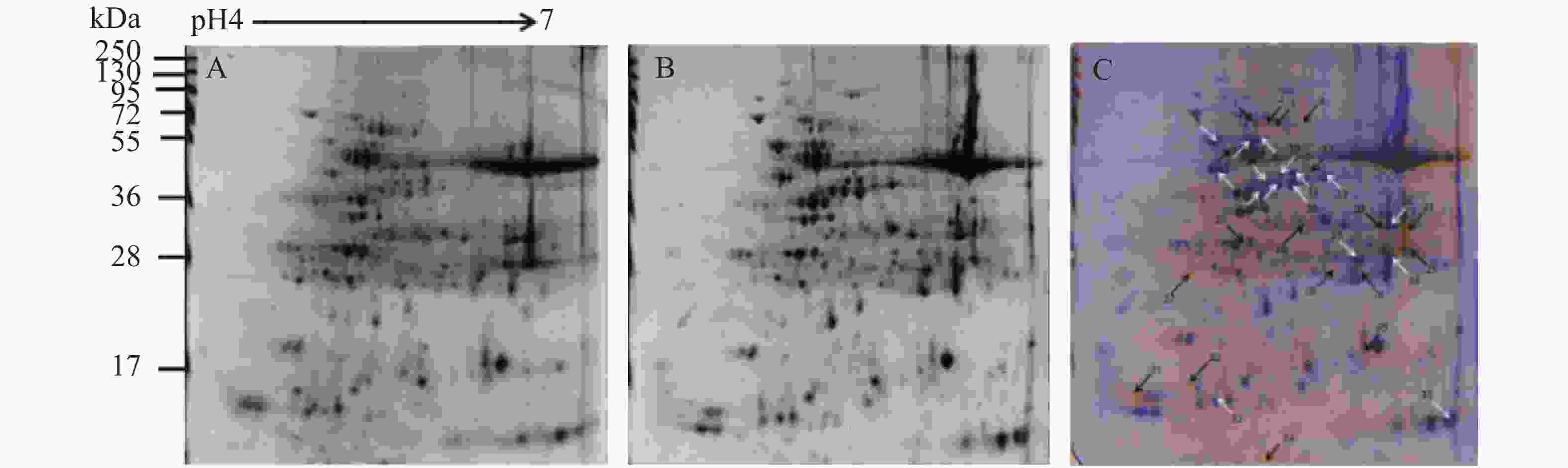
对木薯有性四倍体和华南5号经干旱处理后差异明显植株的叶片全蛋白质进行提取、分离、染色,得到重复性较好的叶片蛋白质双向电泳图谱(图5A和5B)。使用Delta 2D软件对照华南5号叶片全蛋白质图谱进行分析,确定有性四倍体木薯叶片的差异蛋白质点,筛选并标记出34个表达量符合平均差异表达量在2.0倍[24]以上要求的蛋白质点(图5C),包括18个表达上调的蛋白质,16个表达下调的蛋白质。将上述蛋白质比对差异蛋白质点的质谱,再联合NCBI的蛋白质数据库分析,发现有29个与之相符的差异蛋白质,并对其按作用分类,各蛋白质详细相关信息如表1所示。
蛋白作用
类别序号
No.功能
Function序列号
Gi number理论等电点/
分子量
Theoretical
pI/Mw差异量
(均值标准差)
Fold changes
(Mean±SE)Photo-synthesis related proteins 光合作用 (7) 22 Photosystem II oxygen-evolving enhancer protein 1 (psbO) 光系统Ⅱ(PSⅡ)放氧增强蛋白1(psbO) Manes.12G097200.1.p 5.57/35.40 2.451±0.12 (+) 4 Ribulose-bisphosphate carboxylase large chain (rbcL) 核酮糖二磷酸羧化酶大链(rbcL) Manes.S113700.1.p 8.36/37.03 3.993±0.21 (+) 27 Light-harvesting complex Ⅱ chlorophyll a/b binding protein 1 (LHCB1) 捕光复合物Ⅱ叶绿素a / b结合蛋白1(LHCB1) Manes.17G066700.1.p 5.09/28.16 +∞ 29 Oxygen-evolving enhancer protein 2-1, chloroplastic-related
与叶绿体有关的氧增强蛋白2-1Manes.02G089900.1.p 8.76/28.52 2.347±0.28 (+) 34 Ribulose bisphosphate carboxylase small chain 1A, chloroplastic-related 与叶绿体有关的核糖二磷酸羧化酶小链1A Manes.01G011500.1.p 8.82/15.24 64.0±0.10 (+) 9 Ribulose bisphosphate carboxylase/oxygenase activase, chloroplastic 核酮糖二磷酸羧化酶/
氧化酶活化酶, 叶绿体Manes.10G027600.1.p 5.37/52.18 2.0±0.18 (−) Photo-synthesis related proteins 光合作用 (7) 33 RIibulose bisphosphate carboxylase small chain 1A, chloroplastic-related 核酮糖-1,5-二磷酸羧化酶小亚基/核酮糖二磷酸羧化酶 Manes.01G011500.1.p 8.82/15.24 −∞ Carbohydrate and energy metabolism associated proteins 碳水化合物和能量代谢相关蛋白 (12) 2 FtsH extracellular protease familyFtsH
胞外蛋白酶家族Manes.02G089700.1.p 5.33/55.86 +∞ 3 Glycosyl hydrolase
糖基水解酶Manes.07G027700.1.p 5.16/63.06 9.135±0.32 (+) 19 Beta-pyrazolylalanine synthase / Pyrazolylalaninase β-吡唑丙氨酸合酶/吡唑啉丙氨酸酶 Manes.09G157100.1.p 5.53/34.26 2.128±0.28 (+) 28 Glutathione S-transferase TAU 19谷胱甘肽S-转移酶TAU 19 Manes.15G101100.1.p 6.79/25.37 +∞ 26 Triose-phosphate isomerase / Triosephosphate mutase 丙糖磷酸异构酶/磷酸丙糖变位酶 Manes.07G116700.1.p 6.29/27.63 +∞ 11 Monodehydroascorbate reductase
单脱氢异硬脂酸还原酶Manes.09G058800.1.p 5.20/41.18 3.0±0.24 (−) 15 Glutamine synihetase, chloroplastic/mitochondrial
谷氨酰胺合成酶,叶绿体/线粒体Manes.03G186600.1.p 5.50/40.80 2.0±0.29 (−) 17 Succinyl-CoA synthetase beta subunit (LSC2)琥珀酰辅酶A合成酶β亚基(LSC2) Manes.13G037000.1.p 5.45/42.08 5.0±0.43(−) 13 Acyl-Acyl-CARRcarrier-rortein desAturase-related 酰基载体蛋白脱氢酶 Manes.11G128500.1.p 6.05/48.01 3.0±0.25 (−) 18 Carbonic anhydrase 2, chloroplastic-related
与叶绿体相关的碳酸酐酶2Manes.15G167500.1.p 6.44/32.52 2.0±0.23 (−) 23 Phosphoglycolate phosphatase (PGP, PGLP)
磷酸甘油磷酸酯酶(PGP,PGLP)Manes.13G001100.1.p 6.32/32.12 2.0±0.34 (−) 24 Triose-phosphate isomerase / Triosephosphate mutase 丙糖磷酸异构酶/磷酸丙糖变位酶 Manes.02G132800.1.p 6.48/27.60 2.0±0.11 (−) Chaperones proteins
伴侣蛋白 (2)1 Heat shock 70 KDA protein 10, mitochondrial 70 KDA 热激蛋白10,(线粒体70 KDA HSP10) Manes.07G046700.1.p 5.45/71.82 4.604±0.09 (+) 6 Chaperonin 60 subunit beta 1, chloroplastic-related 与叶绿体相关的伴侣蛋白60亚单位1 Manes.15G110300.1.p 5.42/64.74 3.0±0.52 (−) Structure
结构蛋白 (1)14 Actin 肌动蛋白 Manes.12G150500.1.p 5.16/41.90 2.0±0.34 (−) Detoxifying and antioxidant 解毒和抗氧化蛋白 (1) 12 Peroxidase 2 过氧化物酶2 Manes.15G104300.1.p 6.50/37.83 3.184±0.51 (+) DNA/RNA binging proteins DNA/RNA 结合蛋白 (1) 31 Nucleic acid-binding, OB-fold-like protein
核酸结合,ob折叠蛋白Manes.02G024200.1.p 4.41/16.93 3.991±0.13 (+) Inorganic ion transport and metabolism
无机离子转运与
代谢 (3)5 Calcium-activated chloride channel regulator
钙激活氯离子通道调节器Manes.08G075100.1.p 4.72/51.06 6.0±020(−) 8 V-type H+-transporting ATPase subunit B (ATPeV1B, ATP6B) V型H + −
转运ATP酶亚基B (ATPeV1B,ATP6B)Manes.05G143200.1.p 4.62/54.47 5.444±0.05 (+) 32 F-type H+-transporting ATPase subunit d (ATPeF0D, ATP5H, ATP7) F型H + −
转运ATP酶亚基d (ATPeF0D,ATP5H,ATP7)Manes.07G102500.1.p 4.99/16.53 6.863±0.18(+) Defense
保护蛋白 (1)25 Hydroxynitrile lyase / Oxynitrilase
羟基腈裂合酶/腈水解酶Manes.13G092100.1.p 6.42/29.52 2.705±0.06 (+) Function unknown proteins 功能未知蛋白 (1) 10 Polyadenylate-binding protein Manes.15G072700.1.p 5.46/45.14 2.0±0.28 (−) Table 1. Identification of differentially expressed proteins extracted from the leaves of the sexual tetraploid and SC5 after drought stress
-
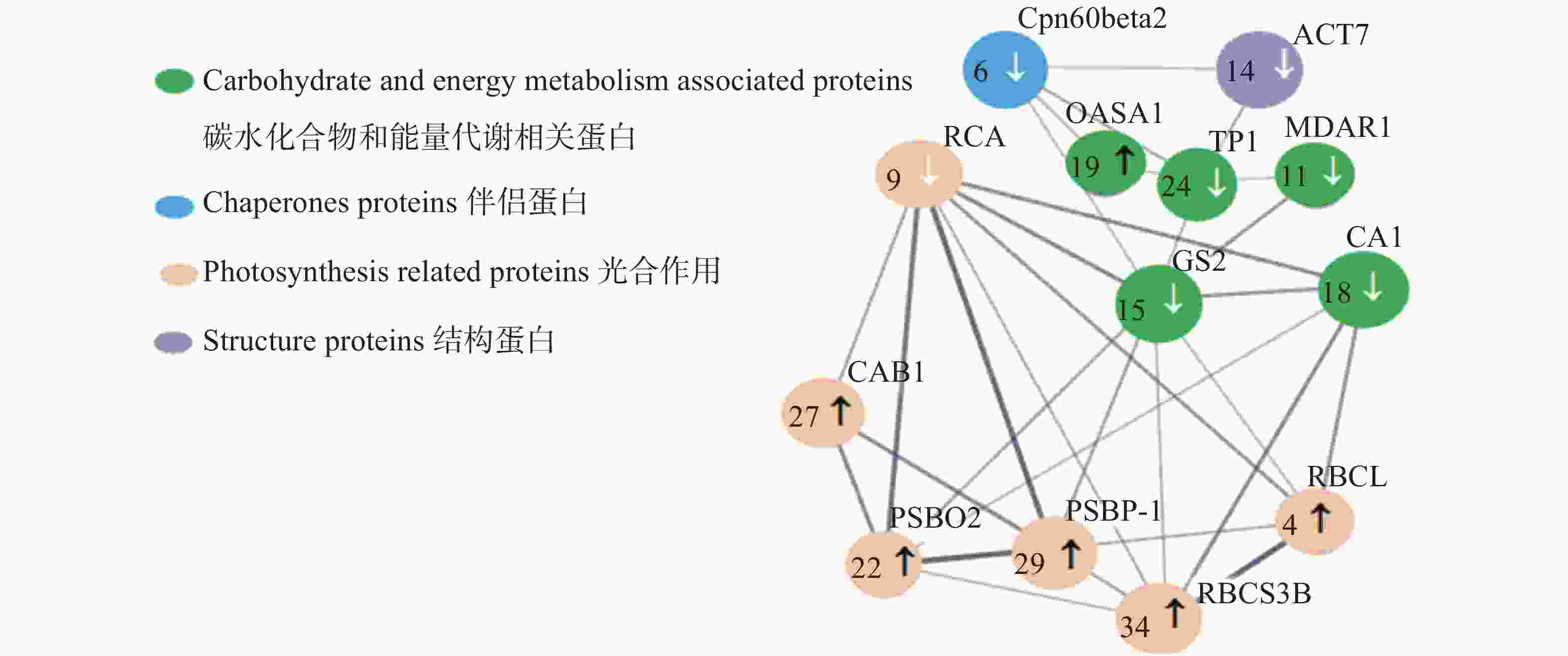
差异蛋白质点互作网络如图6所示,有13个蛋白质节点、31种蛋白质互作关系存在于差异蛋白质互作网络中。各差异表达蛋白质间通过多条通路进行调节,其线条的粗细代表蛋白质相互作用的强弱,其中GS2蛋白质点相互作用较强,且调节通路多达9条;RCA蛋白质点含有7种互作关系;RBCS3B、PSBP-1及PSBO2蛋白质均包括6种互作关系;TPI、CA1和RBCL蛋白质有5种互作关系。
2.1. 不同干旱处理木薯叶片形态的变化
2.2. 不同干旱处理木薯叶片丙二醛含量、游离脯氨酸含量、超氧化物歧化酶活性变化
2.3. 干旱处理下木薯叶片的差异蛋白质点
2.4. 木薯干旱胁迫下叶片差异蛋白质互作调控网络的构建
-
植物多倍体诱导会使其花、果实、叶片等器官增大,且对于逆境的抗性能力也会增强,如小麦[26]、玉米[27]、棉花[28]等植物的多倍体类型均具有比未加倍材料更强的抗逆性。并且,以往的研究表明[7],木薯多倍体植株的解剖学改变,在薄壁组织细胞的密度、压实度和厚度上存在差异,可使四倍体植株具有较高的耐旱性。四倍体中大量的容器群也可比二倍体中较少的容器群保持更多的水分[7, 29]。丙二醛(MDA)含量、脯氨酸含量以及超氧化物歧化酶(SOD)活性是评价植物抗旱性的重要生理代谢变化指标,其中丙二醛(MDA)是脂质过氧化的产物,已作为测量氧化损伤的指标被广泛应用[30-32]。其含量变化间接反映出植物的抗逆性,在相同水分胁迫下MDA含量的增幅差异, 说明品种间确实存在抗旱性差别,丙二醛 (MDA) 含量增幅越少的品种抗旱性越强。本研究结果发现经干旱处理后华南5号叶片中丙二醛增量极显著地高于有性四倍体。植物经干旱处理后,其叶片中通过迅速积累脯氨酸进行渗透调节细胞含水量来提高植物的抗旱性[33-35]。据本研究结果推测:在干旱处理5~10 d时,木薯有性四倍体比华南5号更迅速地积累更多的脯氨酸进行渗透调节,有效地响应干旱胁迫;在干旱处理15 d时,有性四倍体已经在前期通过渗透调节适应干旱胁迫。超氧化物歧化酶(SOD)是维持细胞膜的稳定性的抗氧化酶,较高的SOD活性值能减轻膜脂过氧化对植物造成的伤害[36]。本研究结果显示有性四倍体叶片中SOD活性极显著地高于华南5号。上述生理指标数据都说明木薯有性四倍体的抗旱能力更强。
多倍体诱导对蛋白质组影响被认为是显著的,在干旱逆境过程木薯的蛋白质表达量发生变化以适应干旱环境。本研究基于String数据库构建有性四倍体木薯叶片差异蛋白质互作网络,发现光合作用类蛋白质GS2相互作用较强,且调节通路最多。
在高等植物中核酮糖二磷酸羧化酶是由8个大亚基和8个小亚基组成的,其催化和活化部位都位于大亚基上,而小亚基与活性无关[37]。由于该酶能够调节光合作用的碳同化速率,所以其活性高低是影响植物的净光合产量的直接因素[36, 38-39]。干旱胁迫会使酶活性降低,导致碳同化速率降低,从而影响光合速率,其表达量随干旱程度加深而增加,进而减少干旱胁迫对植物造成的危害[40-42]。PARKER等[43]指出耐旱性向日葵在干旱胁迫下,叶片中Rubisco含量高于正常环境下的含量,这是一种植物对干旱环境的适应性反应,也显示出该植物较强的抗旱能力。本研究结果显示,干旱条件下木薯有性四倍体叶片中Rubisco的表达量上调,因此,推测有性四倍体木薯在干旱条件下能更迅速地表现出适应性反应,以减少干旱环境对木薯造成的危害。
放氧增强蛋白是一种叶绿体蛋白,位于光系统Ⅱ (PSⅡ) 的边缘,与放氧关系最密切[44]。放氧增强蛋白包括放氧增强蛋白1、放氧增强蛋白2、放氧增强蛋白3,其中放氧增强蛋白1、放氧增强蛋白2是影响氧释放活力的重要影响因子[45]。放氧增强蛋白1通过作用于植物光合作用中氧气释放的过程来保证光合系统结构正常。有研究表明放氧增强蛋白是植物遭受逆境胁迫时光合相关蛋白的降解产物[45]。本研究木薯叶片的差异蛋白质结果显示,放氧增强蛋白1在干旱条件下表达量上调。因此,推测有性四倍体木薯在干旱胁迫中对放氧增强蛋白1及其前体诱导程度更容易,诱导量也更多,更能快速有效地维持光合系统的稳定。







 DownLoad:
DownLoad: